Введение
Остеоартрит (ОА) является одним из наиболее распространенных заболеваний суставов, характеризующихся прогрессирующими структурными изменениями и деградацией хряща, болью в суставах и тугоподвижностью, снижением функциональной способности и ухудшением качества жизни пациентов [1]. Распространенность ОА растет, что связано со старением населения и ростом заболеваемости ожирением [2]. Данное заболевание занимает 45–49% в общей структуре всех ревматологических заболеваний в России, им страдают от 7,5% людей в молодом возрасте до 40% в возрасте старше 65 лет [3, 4]. ОА коленного сустава (КС) страдает больше 250 млн человек во всем мире. ОА тазобедренного сустава и КС занимает 11-е место в мире по количеству людей с инвалидностью и 38-е место по наибольшему влиянию на число лет жизни с поправкой на инвалидность (Disability adjusted life years, DALY) [5].
Несмотря на высокую распространенность ОА, серьезным недостатком по-прежнему является заметное отсутствие достижений в области фармакотерапии этого заболевания [6, 7]. Открытые вопросы патофизиологии ОА затрудняют определение надлежащих целей лечения. В настоящее время растет понимание того факта, что патофизиологические механизмы прогрессирования ОА различаются в зависимости от локализации и стадии заболевания [8]. Задача исследователей состоит в том, чтобы идентифицировать маркеры, которые связаны с патофизиологией ОА, что позволит проводить раннюю диагностику заболевания, выделять больных с высоким риском прогрессирования ОА, прогнозировать краткосрочные структурные изменения или эволюцию боли/симптомов, предсказывать эффективность и контролировать эффекты лечения на индивидуальном уровне [9]. Сегодня ученые пытаются решить новую задачу, которая заключается в выявлении и определении фенотипов и ассоциированных с ними эндотипов ОА [10]. Биомаркер предоставляет информацию об эффективности лечения пациентов с ОА, а также определяет эффективность вмешательства до лечения и может быть измерен более 1 раза для оценки краткосрочного изменения, возникающего в результате фармакотерапии.
Тотальное эндопротезирование КС (TЭKС) обеспечивает значительный прогресс в лечении рефрактерной боли в КС при ОА. Увеличение продолжительности жизни, выполнение в более раннем возрасте, хорошие функциональные результаты ТЭКС приводятся в качестве причин, обосновывающих увеличение частоты выполнения подобных операций в РФ и во всем мире [11, 12]. В то же время только 72–86% пациентов удовлетворены купированием болевого синдрома после операции и 70–84% удовлетворены функцией оперированного сустава [13, 14]. Значительное количество пациентов, перенесших ТЭКС, имеют субоптимальные результаты оперативного лечения, связанные с послеоперационной рефрактерной болью, перипротезным остеолизом с асептической нестабильностью протеза, гетеротопической оссификацией и инфицированием, артрофиброзом [15]. Оценка осложнений эндопротезирования в основном клиническая, крайне редко применяются прогностические инструментальные и лабораторные диагностические тесты, которые способствуют раннему выявлению этой подгруппы больных с субоптимальными результатами ТЭКС, а также разработке и внедрению эффективных и безопасных режимов лекарственной профилактики осложнений ТЭКС [16].
В систематическом обзоре биомаркеров для прогнозирования эффективности эндопротезирования обобщены результаты 30 клинических исследований, в которых в качестве наиболее часто изучаемых результатов эндопротезирования, связанных с изменением уровня биомаркеров в сыворотке крови и синовиальной жидкости, были остеолиз с асептической нестабильностью протеза [16]. Авторы различных исследований представили следующие функциональные группы биомаркеров, перспективных для применения в системе фенотипирования и эндотипирования прогноза ТЭКС, оценки эффективности и безопасности новых режимов периоперационной терапии с целью контроля остеолиза с асептической нестабильностью, рефрактерной послеоперационной боли, воспаления: биомаркеры костного метаболизма, метаболизма в хрящевой ткани и коллагена II типа, синовиального и системного воспаления, метаболического синдрома, старения и механического повреждения [17, 18].
Морфологическим субстратом ОА любого фенотипа является прогрессирующее разрушение гиалинового хряща. Применение стероидных и некоторых нестероидных противовоспалительных лекарственных препаратов (НПВП) при ОА сопряжено с их негативным действием на хрящ и развитием самостоятельных и более опасных лекарственных осложнений, что обосновывает необходимость изучения альтернативных подходов как к купированию болевого синдрома в остром периоде заболевания, так и к базисной терапии [19].
В основе лечебного эффекта симптоматических средств замедленного действия (Symptomatic Slow Acting Drugs for Osteoarthritis, SYSADOA) лежит дефицит субстратов для синтеза матрикса гиалинового хряща, который приводит к неэффективности его регенерации, а вид лечения препаратами SYSADOA при ОА является заместительной терапией с субстратной специфичностью [20].
Одним из таких лекарственных средств является хондроитина сульфат (ХС) — сульфатированный гликозаминогликан, который не только играет роль в метаболизме протеогликанов, но и улучшает соотношение анаболических/катаболических процессов во внеклеточном хрящевом матриксе, уменьшает содержание некоторых провоспалительных и катаболических факторов и резорбтивные свойства остеобластов субхондральной кости [21–24]. Помимо способности уменьшать выраженность симптомов ОА аналогично НПВП [25], в клинических исследованиях ХС [25–27] показал уменьшение потери объема хряща на основе количественной магнитно-резонансной томографии (МРТ).
На сегодняшний день не вызывает сомнений эффективность ХС, для которого показаны способность к проникновению в суставные ткани при максимальном из возможных уровней убедительности рекомендаций A и достоверности доказательств 1 в отношении его терапевтического эффекта [28, 29].
Препараты, содержащие ХС, входят в состав базисной терапии ОА и согласно анатомо-терапевтическо-химической классификации относятся к группе М01AX. Нестероидные противовоспалительные препараты другие [29–32]. Биодоступность пероральных форм ХС составляет 13–38% вследствие разрушения молекул ХС в желудочно-кишечном тракте [33]. Внутримышечное введение препарата позволяет увеличить его биодоступность, что существенно увеличивает эффективность терапии и способствует более быстрому развитию симптоматического эффекта — в среднем через 3–4 нед. применения (25–30 инъекций). В РФ представлены стандартизированные парентеральные формы высокоочищенного ХС, эффективность которых доказана в рандомизированных клинических исследованиях [34].
Экспериментальные и клинические подтверждения перспективности использования ХС в периоперационный период свидетельствуют о том, что применение стандартизированных препаратов ХС в подготовке к эндопротезированию суставов и в период послеоперационной реабилитации потенциально может улучшить исходы эндопротезирования [35].
Материал и методы
Проведено открытое проспективное контролируемое рандомизированное исследование, одобренное локальными этическими комитетами ООО «МЦ «Новомедицина» (Ростов-на-Дону), ФГБОУ ВО БГМУ Минздрава России.
Критерии включения в исследование: возраст старше 18 лет; рентгенологически подтвержденный ОА КС III стадии по Kellgren — Lawrence (K–L) и согласно классификационным и диагностическим критериям ОА КС, рекомендованным EULAR в 2010 г.; функциональная недостаточность суставов (ФНС) 2-й степени декомпенсированной формы (общий балл не менее 25 по скрининг-системе); отсутствие любых заболеваний суставов в период до появления ОА КС; выраженный болевой синдром (интенсивность боли при ходьбе соответствует 40 мм и более по ВАШ), функциональный индекс Лекена 8–13 баллов; отсутствие терапии боли на протяжении минимум 60 дней до включения в исследование; информированное согласие на участие в клиническом исследовании; подписанное «Согласие при ознакомлении».
Критерии невключения в исследование: впервые возникшая боль в суставах в течение ближайших 3 нед.; хирургическое лечение в анамнезе; аутоиммунные, онкологические заболевания, болезни крови; наличие грубых и обширных посттравматических рубцов, спаянных с подлежащей костью в области КС; признаки острого тромбофлебита; психические нарушения; умеренные и тяжелые когнитивные нарушения; болезнь Паркинсона; обострения сердечно-сосудистых заболеваний; высокий и очень высокий кардиоваскулярный риск; хроническая болезнь почек (скорость клубочковой фильтрации менее 50 мл/мин/1,73 м2); декомпенсированная стадия сахарного диабета и заболеваний щитовидной железы; печеночная недостаточность; старческая астения; гипергидратация; жалобы на диспепсию; обострение язвенной болезни желудка или двенадцатиперстной кишки за последний год; хронический эрозивный гастрит; COVID-19 в последние 6 мес.; прием пероральных форм ХС и/или глюкозамина, диацереина, неомыляемых соединений авокадо и сои; индивидуальная непереносимость ХС, НПВП; участие в другом клиническом исследовании по препаратам из группы SYSADOA, НПВП, диацереину, неомыляемым соединениям авокадо и сои в течение 60 дней до начала исследования; по административным причинам.
В исследование включено 67 пациентов, из них 43 женщины, в возрасте от 41 года до 73 лет, удовлетворявших критериям включения, находившихся на лечении в клинике травматологии и ортопедии ФГБОУ ВО БГМУ Минздрава России в период с 2020 по 2022 г. На момент включения в исследование все пациенты получали НПВП (целекоксиб, диклофенак, мелоксикам) в стандартной суточной дозе. Все пациенты разделены на контрольную группу (КГ; n=35) и основную группу (ОГ; n=32). Пациенты ОГ в дополнение к НПВП получали парентеральную форму ХС (Хондрогард®, ЗАО «ФармФирма «Сотекс», Россия): первые 3 дня внутримышечно в дозе 100 мг/сут; 4–25 инъекций в последующие дни в дозе 200 мг/сут каждые 48 ч продолжительностью 50 дней за 2 мес. до проведения ТЭКС в дополнение к НПВП.
При включении в клиническое исследование (визит 0), при выписке из стационара (визит 1) и через 3 мес. после ТЭКС (визит 2) оценивали интенсивность боли у пациентов по визуальной аналоговой шкале (ВАШ), индексу WOMAC (Western Ontario and McMaster Universities Arthrose index), шкале KOOS (Knee and Osteoarthritis Outcome Score), а также функциональное состояние КС и активность пациента в повседневной и спортивной жизни (индексы Лекена, WOMAC). На визите 0 на стандартных рентгенограммах КС выявляли рентгенологические признаки ОА III стадии по К–L оперируемого сустава и ОА II стадии контралатерального сустава [36]. МРТ КС выполняли на аппарате Toshiba Medical Systems Excelart Vantage 1,5Т (Япония) на визите 0. Оценку суставного хряща контралатерального сустава проводили по шкале ICRS Международного общества репарации суставного хряща [International Cartilage Regeneration & Joint Preservation Society], которая предусматривает 4 стадии изменения структуры хряща по МР-картине [37]. На визитах 1 и 2 выполняли МРТ с Т2-картированием бедренно-подколенного сегмента хрящевой ткани и вычислением времени Т2-релаксации, которое отражает темпы дегенеративных изменений в хрящевой ткани.
Исследование уровней гиалуроновой кислоты (ГК) (набор реагентов Corgenix Medical Corp., США), ультрачувствительного С-реактивного белка (СРБ) (Abbott Diagnostics Technologies AS, США), концентрации ФНО-α и ИЛ-6 (Cusabio Biotech, США), лептина (DBC Diagnostics Biochem Canada Inc., Канада), адипсина (Hycult Biotech, Нидерланды), N-концевого пропептида коллагена IIα (PIIANP) (Puda Scientific, Китай), C-концевого телопептида коллагена I типа (CTX-1) (Cusabio Biotech, США), остеокальцина (Cusabio Biotech, США), матриксных металлопротеиназ (ММП) 3 и 13 (eBioscience, Австрия), олигомерного матричного белка хряща (COMP) (BioVendor, Германия), склеростина (набор реагентов Biomedica, США), 25-гидроксивитамина D (25(ОН)D3) (Immunodiagnostic Systems, Великобритания) в сыворотке и плазме крови проводили методом иммуноферментного анализа на визитах 0, 1 и 2.
Операцию ТЭКС выполняли на основе данных рентгенометрического анализа по методике C. Ranawat: предоперационное планирование с учетом угла отклонения анатомической и механической оси бедренной кости (от 3 до 9°) [38]. Применяли системы полусвязанной фиксации без сохранения крестообразных связок. Использовали парапателлярный доступ к суставу, релиз мягких тканей, вскрытие канала бедренной кости, резекцию эпифизов бедренной (с внутренней навигацией) и большой берцовой костей (с наружной навигацией) и цементную фиксацию компонентов эндопротеза. При наличии остеофитов проводили краевую моделирующую резекцию надколенника.
Морфологическому анализу были подвергнуты биообразцы субхондральной кости, суставного хряща бедренной и большеберцовой костей, суставной капсулы. Для гистологического исследования биообразцы фиксировали в 10% нейтральном формалине, заливали в парафин. Срезы толщиной 4–5 мкм готовили на микротоме и окрашивали гематоксилином и эозином. Структуру хряща рассматривали под цифровым сканирующим микроскопом 3DHISTECH PANNORAMIC 250 Flash (Carl Zeiss, Германия) с увеличением 125, 250. Количественный анализ морфологических параметров проведен при помощи пакета ImagrJ 1.46. Расчеты выполнены с учетом рекомендаций по стереометрическому анализу. Оценку выраженности синовита выполняли по гистопатологической шкале синовита (General Synovitis Score, GSS) [39].
Безопасность терапии препаратом ХС оценивали по частоте, характеру, выраженности, длительности неблагоприятных побочных реакций и их связи с приемом препаратов по шкалам ВОЗ и Наранжо.
Статистическую обработку данных проводили в среде пакета статистических программ для биомедицинских исследований Statistica 10.0 (StatSoft, Inc., CША), XLSTAT version 2019.3.2 (Addinsoft, США). Рандомизацию в исследовании выполнили методом стратифицированной случайной выборки на основе текущего файла данных пациентов с применением стратифицирующих переменных (возраст, вес, рост, пол, среднее число коморбидных заболеваний, индекс коморбидности Charlson, интенсивность боли по ВАШ, индексу WOMAC, KOOS, функциональная недостаточность по индексам Лекена, WOMAC, продолжительность обострения болевого синдрома в КС, рентгенологическая стадия ОА по K–L). Оценку нормальности распределения количественных данных проводили с применением теста Колмогорова — Смирнова. Межгрупповые различия оценивали с помощью U-теста Манна — Уитни, для сравнения двух относительных показателей, характеризующих частоту определенного признака, применяли точный критерий Фишера (φ). Критерием статистически значимых различий результатов считали величину р<0,05.
Результаты исследования
Клинико-анамнестическая характеристика пациентов представлена в таблице 1. Пациенты двух групп статистически значимо не отличались по всем анализируемым показателям.
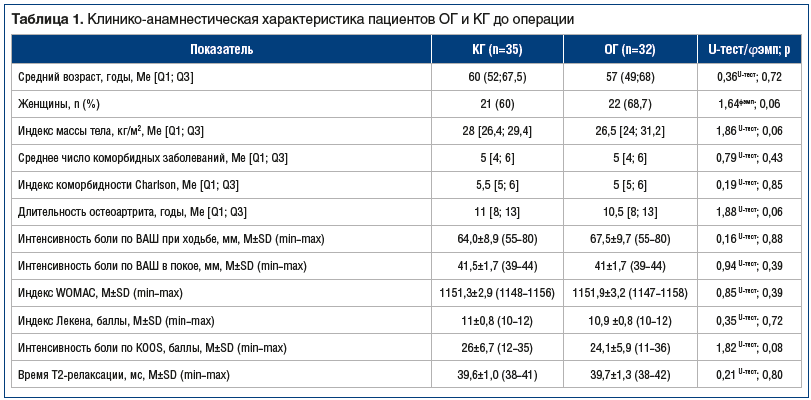
В исследовании показано, что на визите 1 у пациентов ОГ, принимавших до ТЭКС ХС в парентеральной форме, регистрировалось статистически значимое уменьшение интенсивности боли по ВАШ в покое и при ходьбе, по KOOS, индексу WOMAC, а также существенное снижение показателя функциональной недостаточности в оперированном и контралатеральном суставах по индексу Лекена, WOMAC по сравнению с аналогичными показателями шкал в КГ пациентов, принимавших НПВП до операции. Наиболее выраженное снижение интенсивности боли по всем шкалам и улучшение функционального состояния обоих суставов отметили у пациентов ОГ через 3 мес. после проведения ТЭКС (рис. 1).
На визите 1 констатировали статистически значимое увеличение времени Т2-релаксации у пациентов КГ по сравнению с исходным показателем и данным показателем у пациентов ОГ. Через 3 мес. после ТЭКС у пациентов КГ констатировали статистически значимое увеличение скорости Т2-релаксации по сравнению с аналогичным показателем у пациентов ОГ и с показателем Т2-релаксации на визите 1 (табл. 2).

У пациентов КГ при гистологическом анализе гиалинового хряща бедренной (рис. 2 А, В) и большеберцовой (рис. 2 С, D) костей выявлены значительные участки деструкции, преимущественно в поверхностной и глубокой зонах. В хряще бедра под поверхностным слоем, содержащим одиночные клетки, ткань заполнена многочисленными клетками, которые располагались хаотично. Хондроциты имели признаки апоптоза, количество клеток — не более 2. В промежуточной зоне отмечено формирование деформированных остеонов, в глубокой зоне хряща на границе с костью встречались участки с дистрофическими изменениями в виде запустевших лакун. В межклеточном матриксе встречались участки гомогенного, равномерно окрашенного основного вещества, и участки с частично нарушенными тинкториальными свойствами. Отмечено значительное количество капиллярных петель, проникающих в хрящевую ткань со стороны субхондральной кости (см. рис. 2 А, В). Таким образом, структура суставного хряща бедренной кости имела множественные проявления дегенеративных изменений.
У пациентов КГ выявлены значительные зоны оссификации преимущественно в глубокой и промежуточной зонах гиалинового хряща большеберцовой кости с формированием деформированных остеонов (см. рис. 2 С, D). Поверхностная зона хряща большеберцовой кости разрушена, в центре — плотная фиброзная ткань с редкими клетками. Глубже располагался бесструктурный матрикс, в котором встречались редкие клеточные кластеры пролиферирующих клеток. В глубокой зоне отсутствовали типичные колонковые структуры, клетки располагались поодиночке. В этой зоне практически утрачена клеточно-молекулярная структура гиалинового хряща (см. рис. 2 C). Таким образом, в этой зоне КС хрящ представлен плотной фиброзной тканью с редкими клетками и кластерами пролиферирующих фибробластоподобных клеток с остатками структуры гиалинового хряща в глубокой зоне и значительными зонами оссификации.
Морфология гиалинового хряща бедренной (рис. 3 A) и большеберцовой (рис. 3 B) костей пациентов ОГ имела признаки, характерные для его адаптивной перестройки. Под поверхностным слоем располагались округлые клетки, напоминающие малодифференцированные хондроциты. В гомогенном матриксе встречались регенераты из малодифференцированных хондробластов. Глубокая и промежуточная зоны гиалинового хряща интенсивно воспринимала краситель (см. рис. 3 A), особенно вокруг изогенных групп хондроцитов. Количество хондроцитов в лакунах составило 2 и более клеток с четко визуализируемыми базофильными ядрами (см. рис. 3 B). В регенератах и колонкообразных структурах интенсивная окраска свидетельствовала об активном синтезе гликозаминогликанов. В целом на момент выполнения ТЭКС в хряще имелись области с активными регенеративными процессами, а также с недифференцированными клетками.

У пациентов КГ при анализе элементов синовиальной оболочки выявлены признаки выраженного хронического экссудативного воспаления с полнокровием сосудов на уровне посткапилляров и венул, а также формирование участков склерозирования и рубцевания за счет аморфных коллагеновых фибрилл, характерных для рыхлой не-оформленной соединительной ткани на различных этапах ее дифференцировки (рис. 4). Оценка выраженности синовита по шкале GSS составила 7 баллов и соответствовала высокоуровневому синовиту.

Синовиальная мембрана и капсула сустава у пациентов ОГ имели значимо меньше признаков экссудативного воспаления и дегенеративной атрофии по сравнению с пациентами КГ, диаметр посткапиллярных венул составил 30–50 мкм, что сопоставимо со средними физиологическими параметрами (рис. 5). Оценка выраженности синовита по шкале GSS составила 3 балла и соответствовала низкоуровневому синовиту. Следовательно, прием курса ХС в парентеральной форме до выполнения ТЭКС способствовал разрешению морфологических проявлений синовита при ОА КС.
Плотность изогенных групп хондроцитов в глубокой зоне хряща бедренной кости у пациентов ОГ составила 1720±230 ед/мм2, что было достоверно выше, чем у пациентов КГ — 1340±250 ед/мм2 (p<0,05). Аналогичная закономерность показана для суставного хряща мыщелков большеберцовой кости при статистически значимых различиях (p<0,05).
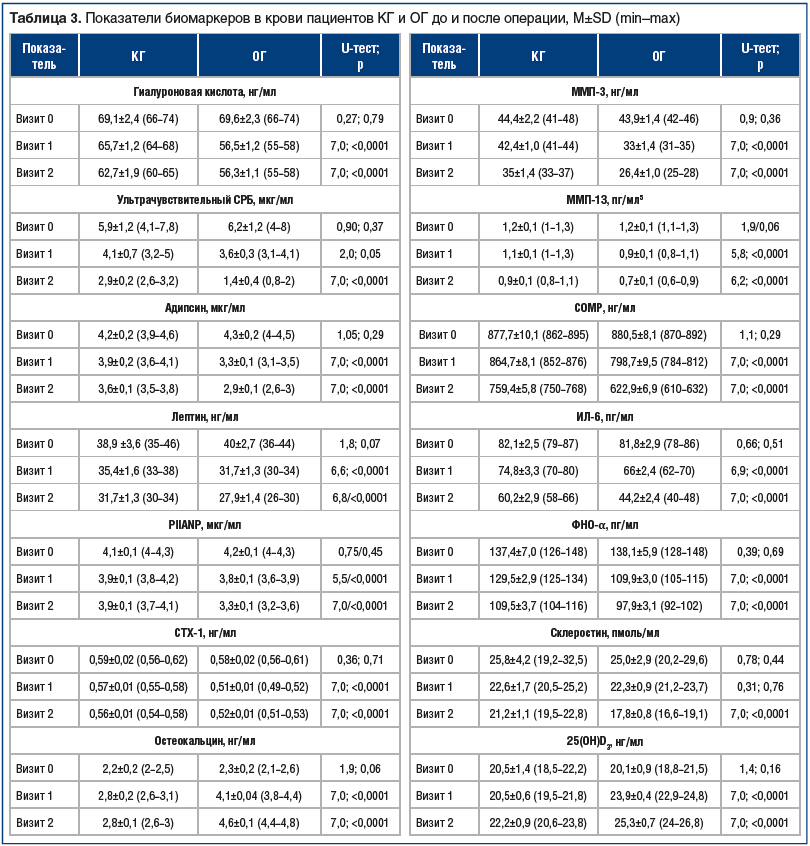
В ходе анализа результатов лабораторных тестов при включении в исследование не выявлено достоверных различий по всем анализируемым показателям (табл. 3). На визите 1 зарегистрировано статистически значимое снижение уровня всех лабораторных показателей крови, за исключением концентраций остеокальцина и 25(ОН)D3, значения которых существенно увеличивались у пациентов ОГ, принимавших ХС в парентеральной форме до ТЭКС, в отличие от динамики аналогичных параметров в КГ, пациенты которой принимали НПВП до ТЭКС. Через 3 мес. после ТЭКС у пациентов ОГ отмечено дальнейшее существенное снижение содержания ультрачувствительного СРБ, ФНО-α, ИЛ-6, лептина, адипсина, PIIANP, ММП-3 и -13, COMP, склеростина при значимом увеличении уровней остеокальцина и 25(ОН)D3 в крови, что свидетельствовало о долгосрочных противовоспалительных и структурно-модифицирующих эффектах ХС (см. табл. 3).
В ходе клинического исследования не зарегистрированы нежелательные явления при приеме парентеральной формы ХС.
Обсуждение
Анализ полученных данных по выраженности боли и ФНС у пациентов с ОА КC III стадии по K–L, перенесших операцию ТЭКС, и ОА контралатерального КС II стадии по K–L с высоким уровнем нагрузки на него в период реабилитации после ТЭКС позволил сделать заключение о различиях в эффективности методов предоперационной фармакотерапии ОА, оказавшей влияние на качество послеоперационного периода. Отмечена высокая эффективность парентеральной формы фармацевтически активной субстанции ХС в составе препарата Хондрогард® при ОА КС по влиянию на болевой синдром (ВАШ, KOOS, индекс WOMAC) и функциональную недостаточность (индексы WOMAC, Лекена) в оперированном и контралатеральном суставах в послеоперационный период и через 3 мес. после выполнения ТЭКС. Отмечены его хорошая переносимость и быстрое наступление эффекта, что согласуется с данными других работ [40, 41].
Выявленное в КГ увеличение протонной плотности (времени Т2-релаксации) контралатерального сустава при выписке из стационара и через 3 мес. после операции свидетельствует о продолжающемся воспалении в хрящевой ткани и дезорганизации хрящевого матрикса в отличие от пациентов ОГ, у которых зафиксированы МР-признаки замедления темпов дегенерации хрящевой ткани.
Полученные нами результаты морфологического анализа гиалинового хряща мыщелков бедренной и большеберцовой костей в ходе ТЭКС у пациентов, принимавших НПВП при включении в исследование, свидетельствуют об увеличении содержания дистрофически измененных хондроцитов: от появления крупных пустот в клетках до деструкции цитоплазмы; в части клеток хряща полностью разрушается цитоплазма и ядро; характерно также увеличение лакунообразных пустот вокруг клеток, часть из которых полностью электронно-прозрачные, другие содержат очень рыхло расположенный зернистый компонент (протеогликаны), и еще реже отдельные тонкие коллагеновые фибриллы. Морфологические изменения хондроцитов в поверхностной, промежуточной и глубокой зонах гиалинового хряща сопровождаются нарушением синтеза коллагена II типа, а также коллагенов III, IX, XI и VI типов, которые регулируют механотрансдукцию хондроцитов и опосредуют биомеханические свойства внеклеточного матрикса. Также показано нарушение синтеза и функции протеогликанов, имеющих одну или несколько цепей гликозаминогликанов, представленных аггреканом, в котором цепи ХС и кератансульфата прикреплены к продолговатой белковой сердцевине [42], версиканом в глубокой зоне хряща, бигликаном и деокрином, содержащими цепи дерматансульфата, фибромодулином и люмиканом, содержащими кератансульфаты [43], а также перлеканом и лубрицином [44, 45]. В результате аггрекан не связывает фибриллы коллагена II типа и не удерживает воду, что способствует нарушению биомеханических характеристик суставного хряща. Обнаруженные нами морфологические признаки хронического экссудативного воспаления высокого уровня в синовиальной оболочке КС пациентов, принимавших НПВП до операции ТЭКС, свидетельствуют о существенном нарушении гомеостаза хряща в связи с изменениями в фенотипе хондроцитов и сопутствующей активацией ферментов, разрушающих матрикс, а также нарушением баланса в экспрессии поверхностных рецепторов к различным цитокинам и ростовым факторам [46].
В исследовании морфологических проявлений механизма действия высокоочищенного ХС в парентеральной форме у пациентов с декомпенсированной формой ОА КС, принимавших ХС за 2 мес. до выполнения ТЭКС, продемонстрировано значимо меньше признаков экссудативного воспаления и дегенеративной атрофии в синовиальной оболочке. Морфология гиалинового хряща бедренной и большеберцовой костей характеризовалась признаками его адаптивной перестройки: появлением в поверхностном слое малодифференцированных хондроцитов, в гомогенном матриксе — регенератов из малодифференцированных хондробластов, увеличением плотности изогенных групп хондроцитов и количества хондроцитов с четко визуализируемыми базофильными ядрами, а также признаками активного синтеза гликозаминогликанов. Морфологические проявления фармакологических эффектов (противовоспалительного и структурно-модифицирующего) ХС на уровне гиалинового хряща и синовиальной оболочки при декомпенсированной форме ОА КС свидетельствуют о молекулярных звеньях его механизма действия, что требует дополнительных доказательств на уровне молекулярной регуляции с участием биомаркеров.
В качестве одной из причин замедления костного обмена при ОА предполагается повышение уровня склеростина [47], что было подтверждено в нашем исследовании. Белок склеростин, продуцируемый и высвобождаемый остеоцитами, играет ключевую роль в механизме торможения остеобластогенеза. Применение парентеральной формы ХС до проведения ТЭКС, сопровождавшееся значимым снижением уровня склеростина в крови пациентов, способствует устранению тормозящего влияния склеростина на Wnt/β-катенин-сигнальную систему, что приводит к снижению концентрации β-катенина в цитоплазме и ядре остеобласта и усилению пролиферации и дифференцировки остеобластов [48]. Нами показано, что снижение уровня склеростина в крови связано с достижением стабильной концентрации в крови маркеров костного ремоделирования: СТХ-1, PIIANP и остеокальцина. Защитный эффект ХС у больных с высокими уровнями CTX-I в крови, отражающими увеличение обмена коллагена I типа в костях, возможно, связан с положительным влиянием ХС на поражение костного мозга при ОА [26] и с активацией механизмов ремоделирования костной ткани у больных ОА в оперированном и контралатеральном КС [22, 24, 49]. Благоприятное влияние предоперационного назначения ХС в парентеральной форме, связанное с нормализацией уровня PIIANP, позволяет предположить увеличение уровня синтеза коллагена II типа в хряще при ОА контралатерального КС, что соответствует данным других авторов [50]. Значимое увеличение уровня остеокальцина в крови пациентов на поздней стадии ОА КС под влиянием ХС в условиях предоперационной медикаментозной подготовки свидетельствует об интенсификации процессов ремоделирования костной ткани, прежде всего контралатерального сустава, с предотвращением дестабилизации хрящевой ткани со стороны субхондральной кости, что согласуется с данными других исследователей [51].
Назначение дополнительного курса терапии ХС пациентам с ОА КС до проведения ТЭКС сопровождалось значимым снижением степени системного воспаления и стабилизацией уровня катаболических факторов в хрящевой ткани — СРБ и ГК, лептина, адипсина, ММР-3, что обусловливает замедление темпов деградации хрящевой ткани в контралатеральном суставе, это соответствует данным других авторов [52]. Существенное уменьшение концентрации цинк-зависимой эндопептидазы ММП-13 в крови, вероятно, приводит к ограничению патологического распада коллагена II типа и аггрекана в хрящевой ткани контралатерального сустава, а также процессов дегенерации в субхондральной кости в обоих КС [53, 54]. Сопряженное уменьшение концентрации ММП-13, синтезируемой макрофагами, фибробластами и хондроцитами, и провоспалительного цитокина ФНО-α лежит в основе ограничения деградации экстрацеллюлярного матрикса в хрящевой ткани, воспалительной фазы в синовиальной оболочке и процесса деградации в субхондральной кости [55, 56].
Выявленное в ходе исследования статистически значимое снижение уровня ИЛ-6 и комплексного биомаркера COMP в крови у пациентов с ОА КС, получавших ХС в парентеральной форме перед проведением ТЭКС, а также последующее уменьшение концентрации этих показателей при выписке из стационара и через 3 мес. после выполнения ТЭКС, соответствуют уменьшению выраженности болевого синдрома в ОГ. Полученные данные совпадают с результатами зарубежных исследований [16].
Заключение
Несмотря на декомпенсированный характер ОА КС, в настоящем исследовании у пациентов были отмечены признаки адаптивной перестройки во всех слоях гиалинового хряща и уменьшение выраженности воспаления в синовиальной оболочке cо снижением явлений деградации в области субхондральной кости после 2-месячного дооперационного курса терапии парентеральной формой ХС. Анализ биомаркеров прогрессирования ОА продемонстрировал, что применение данного курса восстанавливает баланс уровней биомаркеров следующих функциональных групп: костного метаболизма, метаболизма в хрящевой ткани и коллагена II типа, синовиального и системного воспаления, механического повреждения. Это может служить основанием для выработки рекомендаций к применению парентеральной формы ХС с целью контроля осложнений ТЭКС. Таким образом, проведенное исследование позволяет рекомендовать применение парентеральной формы ХС (Хондрогард®, ЗАО «ФармФирма «Сотекс») курсом 25 инъекций за 2 мес. до проведения ТЭКС с целью улучшения как непосредственных, так отдаленных функциональных результатов оперативного вмешательства.












