
Введение
По мере развития научных знаний появляются описания новых нозологических форм, претерпевают изменения старые названия болезней. Наглядно это можно проследить на истории развития остеоартрита (ОА). В 1782 г. У. Геберден впервые описал узелки на суставах кистей, которые теперь названы в его честь, подчеркнув, что они не связаны с подагрой, поскольку раньше все поражения суставов называли «подагрой» [1]. Б. Броуди в 1829 г. отметил, что у пожилых людей часто выявляется «невоспалительная эрозия» в хряще [2]. Используемый сегодня термин «остеоартрит» ввел E. Гаррод в 1890 г. [3].
В 2015 г. было дано новое определение этого заболевания: ОА — заболевание суставов, характеризующееся клеточным стрессом и деградацией экстрацеллюлярного матрикса, возникающими при макро- или микроповреждениях, которые активируют патологические адаптивные восстановительные ответы, включая провоспалительные пути иммунной системы. Изменения, происходящие первоначально на молекулярном уровне, постепенно приводят к анатомическим и физиологическим нарушениям (деградация хряща, костное ремоделирование, образование остеофитов, воспаление и т. д.) и развитию заболевания. В связи с этим ОА рассматривается как органное поражение, т. е. заболевание всего сустава, при котором в процесс вовлекаются хрящ, субхондральная кость, синовиальная оболочка, связки, капсула, мышцы [4]. В России длительное время используется термин «остеоартроз», что подразумевает «дегенеративную», невоспалительную природу этого заболевания. Однако учитывая, что центральную роль в патогенезе играют воспалительные изменения, целесообразно использовать общепризнанное определение «остеоартрит» (osteoarthritis).
ОА является одним из наиболее распространенных заболеваний. По данным ВОЗ (2017 г.), им страдает более 300 млн человек в 195 странах [5]. Хотя формально эта болезнь не несет прямой угрозы жизни больных, она приводит к тяжелым страданиям, значительному снижению качества жизни, временной и стойкой потере трудоспособности, уверенно занимая одно из лидирующих мест в структуре причин инвалидизации населения. Последние данные подтверждают, что ОА способствует прогрессированию коморбидных заболеваний, повышению рисков как общей, так и связанной с кардиоваскулярными катастрофами смертности [6].
Накопление знаний об ОА приводит не только к лучшему пониманию патогенеза этого заболевания, но и к изменениям в подходах к его диагностике и лечению, поэтому предлагаются новые редакции рекомендаций по лечению ОА, подготовленные Международным обществом по изучению остеоартрита (Osteoarthritis Research Society International, OARSI, 2019 г.) [7], Европейским обществом по клиническим и экономическим аспектам остеопороза, остеоартрита и мышечно-скелетных заболеваний (European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases, ESCEO, 2019 г.) [8], Американским колледжем ревматологии (American College of Rheumatology, ACR, 2019 г.) [9], Европейской антиревматической лигой (European League Against Rheumatism, EULAR, 2018 г.) [10]. В 2018 г. EULAR [24] и в 2019 г. ACR [25] были опубликованы рекомендации для ведения больных с ОА суставов кистей.
Остеоартрит суставов кистей
Определение, классификация, распространенность
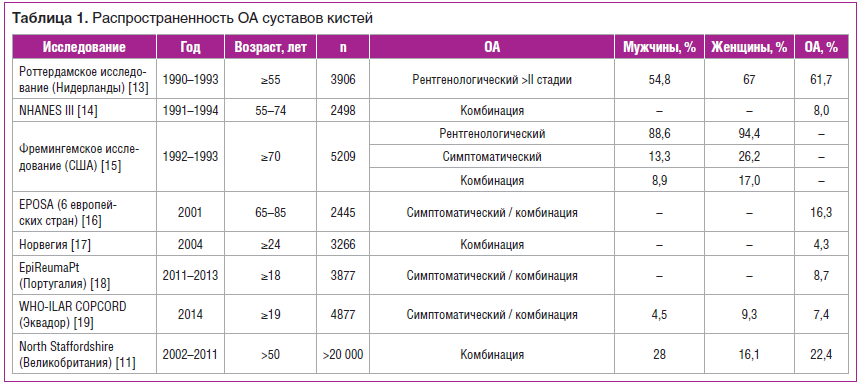
Остеоартрит суставов кистей — одна из самых частых локализаций, занимает 2-е место по распространенности после ОА коленных суставов, чаще выявляется у женщин; чем старше возраст, тем выше вероятность диагностирования ОА кистей (табл. 1). Выделяют следующие формы ОА кистей:
узелковый остеоартрит (УОА), при котором клинически определяются узелки в проекции эпифизов фаланг, формирующих дистальные межфаланговые суставы (ДМФС) кистей, — узелки Гебердена, проксимальные межфаланговые суставы (ПМФС) — узелки Бушара;
эрозивный ОА (ЭОА);
ОА суставов основания большого пальца;
генерализованную форму ОА кистей.
По данным недавно опубликованного крупномасштабного английского исследования (2020 г.), эрозивный ОА рентгенологически выявляется в 2% случаев (с превалированием в женской когорте [3,3%, 95% ДИ 2,0–4,5%] по сравнению с мужской [0,6%, 95% ДИ 0–1,2%]), УОА — в 10,7% (у женщин — в 14,8%, у мужчин — в 6%), генерализованная форма ОА кистей — в 5,2% (у женщин — в 7,6%, у мужчин — в 2,6%) и ОА суставов основания большого пальца — в 15,8% (у женщин — в 20,1%, у мужчин — в 11%) [11]. Эрозивный ОА является наиболее сложным фенотипом заболевания как для диагностики, так и для курации пациентов, имеет более тяжелое течение и сопровождается значительными функциональными нарушениями [12].
Диагностика остеоартрита кистей
Диагноз ОА мелких суставов кистей, согласно классификационным критериям ACR, основывается только на оценке клинических проявлений [4]. Так, обязательными критериями являются: боль и/или скованность в кистях на протяжении большинства дней предыдущего месяца; костные разрастания в области двух и более суставов из 10 оцениваемых (учитываются 2–3 ДМФС, 2–3 ПМФС и запястно-пястные суставы I пальцев); припухание менее чем 3 пястно-фаланговых суставов (ПЯФ); а также деформация хотя бы одного из 10 вышеуказанных суставов или костные разрастания, включающие 2 и более ДМФС.
Рентгенологическое исследование необходимо только для дифференциальной диагностики и выявления эрозивной формы ОА, для чего проводят обзорную рентгенографию обеих кистей в прямой проекции на одной пленке [20, 21].
На сегодняшний день классификационные критерии играют центральную роль в диагностике ОА, т. к. имеют очень высокую чувствительность и специфичность — соответственно 92% и 98%. Несмотря на это, они не позволяют решить все диагностические проблемы, возникающие в реальной клинической практике.
В 2010 г. группой экспертов EULAR [22] были сформулированы 10 рекомендаций по диагностике ОА суставов кисти для практикующих врачей. Эти диагностические критерии учитывают многие аспекты, связанные с заболеванием:
Факторами риска ОА суставов кистей являются женский пол, возраст старше 40 лет, менопауза, семейный анамнез, избыточная масса тела, высокая минеральная плотность кости (МПК), увеличение мышечной силы предплечья, гипермобильность суставов, предшествующее повреждение кисти, повышенная профессиональная нагрузка на суставы кистей. Уровень доказательности — Ib–IIb, сила рекомендации — 69% (95% ДИ 54–84%).
Типичными симптомами ОА суставов кистей являются боль при движении и незначительная утренняя скованность или тугоподвижность в одном или нескольких суставах в любое время суток; симптомы обычно имеют интермиттирующее течение и возникают в ДМФС, ПМФС, ПЯФ I, II и III пальцев. При наличии этих классических признаков у лиц старше 40 лет с уверенностью может быть установлен клинический диагноз «ОА суставов кисти». Уровень доказательности — IIb, сила рекомендации — 85% (95% ДИ 77–92%).
Типичные клинические признаки ОА суставов кистей — узелки Гебердена и Бушара или костные разрастания с деформацией, т. е. с латеральной девиацией межфаланговых суставов, подвывихом и аддукцией (приведением) основания I пальца кисти или без деформации с вовлечением характерных суставов — ДМФС, ПМФС, основания I пальца кисти и ПЯФ I, II и III пальцев. Уровень доказательности — Ib–IV, сила рекомендации — 80% (95% ДИ 69–90%).
Функциональная недостаточность суставов при ОА кистей может быть такой же тяжелой, как и при ревматоидном артрите. Функция суставов должна тщательно оцениваться и контролироваться с помощью валидированных критериев или методик. Уровень доказательности — IIb, сила рекомендации — 57% (95% ДИ 42–73%).
У больных с множественным вовлечением суставов кистей повышается риск развития ОА коленных, тазобедренных и других суставов (генерализованный ОА), что необходимо учитывать в диагностическом процессе. Уровень доказательности – IIa–IIb, сила рекомендации – 77% (95% ДИ 62–92%).
Определены подгруппы пациентов с множественными факторами риска, ассоциациями и исходами, требующими различных подходов, в т. ч. с ОА межфаланговых суставов (с узелками и без них), ОА основания I пальца кисти и ЭОА. Уровень доказательности — IIa–IIb, сила рекомендации — 68% (95% ДИ 56–79%).
Эрозивное поражение развивается в межфаланговых суставах и характеризуется следующими рентгенологическими изменениями: субхондральные эрозии, подвывихи и костные анкилозы. Начало заболевания, как правило, острое, сопровождается выраженной болью и функциональной недостаточностью суставов, симптомами воспаления (скованность, отек мягких тканей, покраснение, парестезии), небольшим повышением уровня CРБ и неблагоприятным прогнозом по сравнению с неэрозивным ОА. Уровень доказательности — IIa–IIb, сила рекомендации — 87% (95% ДИ 81–93%).
Дифференциальная диагностика ОА кистей обычно проводится с псориатическим артритом (при котором могут поражаться ДМФС или отмечается осевое поражение суставов), ревматоидным артритом (преимущественное вовлечение в процесс ПЯФ, ПМФС и лучезапястных суставов), подагрой (возможно сочетание с ОА), гемохроматозом (особенно при поражении ПЯФ и лучезапястных суставов). Уровень доказательности – Ib–IIb, сила рекомендации – 81% (95% ДИ 73–89%).
Обзорная рентгенография обеих кистей в прямой проекции на одной пленке является «золотым стандартом» диагностики ОА. Типичные признаки: сужение суставной щели, наличие остеофитов, субхондральный склероз и субхондральные кисты. Эрозивный ОА характеризуется также субхондральными эрозиями. Дополнительные инструментальные исследования показаны редко. Уровень доказательности – Ib–IIb, сила рекомендации – 87% (95% ДИ 81–93%).
Лабораторное исследование крови для диагностики OA кистей не требуется, но может использоваться для подтверждения или исключения сопутствующих заболеваний. При наличии выраженных воспалительных симптомов и признаков, особенно при поражении нетипичных для ОА суставов, необходимо исследование крови для исключения воспалительных артритов. Уровень доказательности — Ib–IIb, сила рекомендации — 78% (95% ДИ 63–92%).
Подходы к ведению пациентов с остеоартритом кистей
В конце 2018 г. были опубликованы рекомендации по ОА, разработанные Международной группой экспертов из Канады, Франции, России, Марокко, Португалии и Бельгии, предназначенные преимущественно для врачей первичного звена здравоохранения, включающие в себя упрощенные критерии диагностики, пути оказания медицинской помощи и «красные флажки» — ситуации, требующие направления к специалисту [23]. Основное внимание было уделено трем основным локализациям заболевания: коленные, тазобедренные суставы и суставы кистей (рис. 1). Алгоритм был создан для того, чтобы при наличии определенных симптомов или знаков врач первичного звена направил пациента к специалисту. При отсутствии так называемых «красных флажков» курацию может осуществлять врач общей практики.
![Рис. 1. Алгоритм ведения пациентов с остеоартритом суставов кисти [23] Рис. 1. Алгоритм ведения пациентов с остеоартритом суставов кисти [23]](/upload/medialibrary/918/2-2.png)
Терапия ОА суставов кисти — одна из актуальных и обсуждаемых тем, подтверждением этого служат недавно вышедшие рекомендации EULAR 2018 г. [24] и ACR 2019 г. [25] по лечению ОА этой локализации. Согласно современным принципам лечение пациентов с ОА суставов кистей должно включать комбинацию фармакологических и нефармакологических методов и направлено не только на уменьшение боли и улучшение функционального состояния суставов, качества жизни больных, но и на предотвращение/замедление прогрессирования заболевания.
Рекомендации EULAR 2018 г. удобны в использовании и включают всего 10 основных положений:
Необходимо внедрение образовательных программ, направленных на обучение эргономическим методикам и использованию вспомогательных приспособлений, а также на увеличение физической активности. Уровень доказательности — Ib, уровень убедительности рекомендаций — А, уровень согласованности — 9,3 (1.1).
Каждому пациенту следует назначать упражнения для улучшения функциональной способности и увеличения мышечной силы в кистях, что способствует снижению интенсивности боли в них. 1a; A; 9,1 (1.6).
Для уменьшения боли в ЗПС при ОА показано длительное ношение ортезов. 1b; A; 9,3 (1.0).
Локальная терапия предпочтительнее системной в связи с меньшим риском развития нежелательных явлений. Среди лекарственных препаратов для локальной фармакотерапии НПВП для местного использования являются препаратами выбора. 1b; A; 8,6 (1,8).
Симптоматические препараты быстрого действия, особенно НПВП, следует назначать для облегчения симптомов заболевания в течение ограниченного времени («по требованию»). 1a; A; 9,4 (0,9).
Хондроитин сульфат (ХС) может использоваться у пациентов с ОА суставов кистей для облегчения боли и улучшения функции. 1b; A; 7,3 (2,7).
Внутрисуставные инъекции глюкокортикоидов не рекомендованы при ОА суставов кистей, однако допустимо инъекционное введение ГК в межфаланговые суставы при наличии синовиита. 1a–1b; A; 7,9 (2,4).
Пациентам с ОА суставов кистей не показаны генно-инженерные биологические препараты или базисные противовоспалительные препараты. 1a; A; 8,8 (1,8).
К хирургическим методам лечения у пациентов с деформациями суставов кистей следует прибегать лишь при неэффективности консервативной терапии. Трапецэктомия рекомендована при ОА I ЗПС, а артродез/артропластика — при ОА межфаланговых суставов. 5; D; 9,4 (1,4).
Пациенты с ОА суставов кистей подлежат длительному наблюдению. 5; D; 9,5 (1,7).
Буквально через 1,5 года после рекомендаций EULAR были опубликованы обновленные американские рекомендации по лечению ОА, где представлен дифференцированный подход к лечению ОА в зависимости от локализации поражения. Данные рекомендации были созданы с учетом последних высококачественных систематических обзоров и метаанализов, на основании чего были сделаны рекомендации в пользу или против применяемых методов лечения. Так, при ОА кистей из нефармакологических методов (табл. 2) настоятельно рекомендованы: образовательные программы для пациентов, лечебная физкультура (упражнения для кистей) и ношение ортеза для ЗПС. Условные рекомендации касаются когнитивно-поведенческой терапии (КПТ); использования кинезиотейпирования для ЗПС и ортезов на другие суставы кистей; иглоукалывания (по данным ряда исследований, этот метод обладает эффективным анальгетическим эффектом); термических воздействий (локальное применение тепла или холода), а также применения парафина как дополнительного метода тепловой терапии.
![Таблица 2. Нефармакологические методы лечения остеоартрита суставов кистей (рекомендации ACR, 2019) [9] Таблица 2. Нефармакологические методы лечения остеоартрита суставов кистей (рекомендации ACR, 2019) [9]](/upload/medialibrary/96f/2-3.png)
Из фармакологических препаратов (табл. 3) строго рекомендовано только пероральное применение НПВП; условно рекомендованы: применение ХС; НПВП для локального пользования; внутрисуставные инъекции глюкокортикоидов; ацетаминофен; дулоксетин (возможно использование как отдельно, так и в сочетании с НПВП); трамадол (назначается пациентам с противопоказаниями к применению НПВП, при неэффективности других методов лечения и отсутствии доступных хирургических вариантов). Авторы также поясняют, что использование ацетаминофена в качестве монотерапии может быть неэффективно. Его назначение возможно при наличии противопоказаний к НПВП и должно быть лимитировано минимально эффективной дозой, не превышающей 3 г/сут. При использовании ацетаминофена необходим регулярный мониторинг гепатотоксичности.
![Таблица 3. Медикаментозные методы лечения остеоартрита суставов кистей (рекомендации ACR, 2019) [9] Таблица 3. Медикаментозные методы лечения остеоартрита суставов кистей (рекомендации ACR, 2019) [9]](/upload/medialibrary/d24/2-4.png)
Либо настоятельно, либо условно не рекомендованы для лечения ОА суставов кисти следующие лекарственные средства и методики: локальное использование капсаицина (условно рекомендован, только для ОА коленных суставов), внутрисуставное введение гиалуроновой кислоты, опиоиды (кроме трамадола), колхицин, рыбий жир, бисфосфонаты, гидроксихлорохин, метотрексат и биологическая терапия (ингибиторы ФНО и антагонисты рецептора интерлейкина-1).
Роль хондроитина сульфата в терапии остеоартрита суставов кисти
В последних рекомендациях EULAR и ACR применение ХС рекомендовано для лечения пациентов с ОА суставов кисти. Это мнение основано на доказательной базе по ХС. Так, в рандомизированном двойном слепом плацебо-контролируемом клиническом исследовании C. Gabay et al. [26] приняли участие 162 пациента с ОА суставов кисти. Больные получали ХС 800 мг (80 пациентов) либо плацебо (82 пациента) 1 раз в сутки в течение 6 мес. Более выраженное снижение боли и улучшение функции в суставах кистей было отмечено у пациентов из основной группы по сравнению с данными показателями в группе плацебо (р=0,016 и 0,008 соответственно). Статистически значимое уменьшение скованности тоже отмечалось только в группе пациентов, принимавших ХС. Структурно-модифицирующий эффект ХС продемонстрирован в длительном 3-летнем исследовании G. Verbruggen et al. [27] при включении 119 пациентов с ОА (34 больных принимали ХС в дозе 1200 мг/сут, 85 — плацебо). Рентгенография межфаланговых суставов проводилась в начале исследования и каждый год наблюдения для оценки прогрессирования заболевания. За 3-летний период в основной группе выявлено статистически значимое снижение риска прогрессирования ОА суставов кистей и замедление риска развития ЭОА по сравнению с группой контроля. Эти данные были подтверждены в работе G. Rovetta et al. на основании 2-летнего лечения 24 больных с ЭОА: ХС в дозе 800 мг/сут + напроксен 500 мг/сут (n=12) против монотерапии препаратом напроксен 500 мг/сут (n=12). Результаты исследования тоже подтвердили, что ХС положительно влияет на симптомы ОА суставов кистей и замедляет прогрессирование заболевания (при контрольном обследовании через 2 года наблюдения, p<0,05) [28].
Согласно российским Федеральным клиническим рекомендациям (2016 г.) при установлении диагноза первичного ОА любой локализации требуется обязательное применение симптоматических препаратов замедленного действия. Эксперты ESCEO [8, 29] в 2019 г. отнесли cимптоматические препараты замедленного действия (Symptomatic Slow Acting Drugs for Osteoarthritis, SYSADOA) к базисной терапии, указывая, что всем пациентам с ОА коленных суставов необходимо на длительный срок назначать высококачественный ХС и/или кристаллический глюкозамин сульфат (ГС). Действительно, препараты из этой группы обладают не только обезболивающим и противовоспалительным эффектом, но и способны замедлять прогрессирование заболевания. В последнем систематическом обзоре (2018 г.) [30] продемонстрировано, что размер эффекта для ХС (оценка структурно-модифицирующего действия) при лечении пациентов с ОА различной локализации равен 0,2.
Одним из препаратов, который в течение нескольких десятилетий применяется для лечения ОА в странах Европы и в России, является Структум (Pierre Fabre Medicament, France). Его эффективность была доказана в серии двойных слепыхрандомизированных клинических испытаний. В 2012 г. швейцарскими исследователями был опубликован метаанализ (включены только рандомизированные плацебо-контролируемые исследования), подтвердивший симптоматический эффект препарата. Кроме того, было показано, что при назначении данного препарата значительно чаще, чем при использовании плацебо, у большего количества пациентов достигался ответ на терапию по критерию OMERACT-OARSI (ОР=1,2, 95% ДИ 1,06–1,36, p=0,003) [31]. В двойном слепом плацебо-контролируемом исследовании J.J. Railhac et al. (2012 г.) на фоне применения препарата Структум продемонстрирована меньшая потеря объема хрящевой ткани по сравнению с таковой на фоне применения плацебо при МРТ-оценке через 48 нед. от начала терапии [32].
В России изучалось применение ХС (Структум) для лечения ОА коленных суставов в течение 9 мес. (6 мес. лечения и 3 мес. наблюдения для оценки последействия препарата). При приеме ХС в суточной дозе 1000 мг отмечалось уменьшение боли и потребности в НПВП, улучшалось функциональное состоянии суставов и качество жизни пациентов, а также сохранение эффекта последействия как минимум в течение 3 мес. после окончания курса терапии [33]. В другом открытом рандомизированном многоцентровом 6-месячном исследовании при участии 555 пациентов (192 — основная группа и 363 — контрольная) из 11 городов РФ оценивались эффективность и безопасность препарата ХС у пациентов с ОА не только коленных, но и тазобедренных суставов. Все больные в течение периода наблюдения получали либо НПВП (контрольная группа), либо НПВП плюс ХС (основная группа) — в первые 3 нед. по 1,5 г и далее по 1,0 г/сут до 6 мес. [34]. Результаты тоже продемонстрировали значимое снижение боли, индекса Лекена у пациентов, получавших ХС, по сравнению с контрольной группой, вне зависимости от локализации процесса (р<0,05). Положительный результат терапии в основной группе позволил существенно снизить дозу НПВП, кратность их приема, а у части пациентов — отказаться от их использования. Продолжением данной работы явилось изучение в течение 12 мес. длительности последействия препарата, его влияния на течение ОA и сопутствующих заболеваний, оцениваемое в 9 центрах. Так, через 1 год после завершения приема ХС суммарный функциональный индекс Лекена, показатели боли по ВАШ и суточная потребность в НПВП оказались ниже первоначальных значений. Частота обострений заболеваний ЖКТ, артериальной гипертензии и ишемической болезни сердца у пациентов, принимавших препарат, оказалась ниже, чем у больных из группы контроля. Авторами также был подтвержден продолжительный эффект последействия: в среднем 4,6 мес. при ОА коленных суставов и 4,1 мес. при ОА тазобедренных суставов [35].
Заключение
Таким образом, применение ХС у больных с ОА (в т. ч. при ОА кистей) способствует существенному уменьшению выраженности болевого синдрома, замедлению прогрессирования, улучшению функционального состояния суставов и течения коморбидных заболеваний, снижению потребности в НПВП. Во всех исследованиях отмечен хороший профиль безопасности препарата: в имеющихся работах, выполненных как зарубежными авторами, так и отечественными исследователями, показана очень низкая частота нежелательных реакций.
Благодарность
Авторы и редакция благодарят компанию «ООО «Пьер Фабр» за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации












