–Т 1894 –≥. E. Devic –Є –µ–≥–Њ —Г—З–µ–љ–Є–Ї F. Gault –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –≤—Л–і–µ–ї–Є—В—М –Ю–Ь –≤ –Њ—В–і–µ–ї—М–љ—Г—О –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —Д–Њ—А–Љ—Г, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –Њ—З–∞–≥–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Љ–Є–µ–ї–Є–љ–∞ –Ј–∞—В—А–∞–≥–Є–≤–∞–ї–Є –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –Њ–њ—В–Є—З–µ—Б–Ї–Є–є –љ–µ—А–≤ –Є —Б–њ–Є–љ–љ–Њ–є –Љ–Њ–Ј–≥ (–њ–Њ–њ–µ—А–µ—З–љ—Л–є –Љ–Є–µ–ї–Є—В –љ–∞ —Г—А–Њ–≤–љ–µ –≥—А—Г–і–љ—Л—Е, —А–µ–ґ–µ вАФ —И–µ–є–љ—Л—Е —Б–µ–≥–Љ–µ–љ—В–Њ–≤) [2]. –Т 2004 –≥. V. Lennon et al. –±—Л–ї–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–∞—П –њ—А–Є—А–Њ–і–∞ –±–Њ–ї–µ–Ј–љ–Є –њ—Г—В–µ–Љ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Л—Е –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї NMO-IgG (neuromyelitis optica вАФ Immunoglobulin G). –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ю–Ь вАФ –µ–і–Є–љ—Б—В–≤–µ–љ–љ–Њ–µ –і–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А—Г—О—Й–µ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –≤—Л—П–≤–ї–µ–љ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –±–Є–Њ–Љ–∞—А–Ї–µ—А. –Т –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–µ–ґ–Є—В —Б–µ–ї–µ–Ї—В–Є–≤–љ–∞—П —Б–≤—П–Ј—М NMO-IgG —Б –∞–Ї–≤–∞–њ–Њ—А–Є–љ–Њ–Љ-4, –Њ–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –±–µ–ї–Ї–Њ–≤ –≤–Њ–і–љ—Л—Е –Ї–∞–љ–∞–ї–Њ–≤ –¶–Э–°, –ї–Њ–Ї–∞–ї–Є–Ј—Г—О—Й–Є—Е—Б—П –≤ –љ–Њ–ґ–Ї–∞—Е –∞—Б—В—А–Њ—Ж–Є—В–Њ–≤, –Њ–±—А–∞–Ј—Г—О—Й–Є—Е –≥–µ–Љ–∞—В–Њ—Н–љ—Ж–µ—Д–∞–ї–Є—З–µ—Б–Ї–Є–є –±–∞—А—М–µ—А (–У–≠–С). –Э–∞–Є–±–Њ–ї—М—И–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –∞–Ї–≤–∞–њ–Њ—А–Є–љ–∞-4 –≤ –¶–Э–° –Њ—В–Љ–µ—З–µ–љ–∞ –≤ —Б–µ—А–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б–µ, –њ–µ—А–Є–≤–µ–љ—В—А–Є–Ї—Г–ї—П—А–љ—Л—Е –Њ–±–ї–∞—Б—В—П—Е. –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є, –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Б–Є—Б—В–µ–Љ—Л –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞, –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ (–Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–Њ–≤ –Ш–Ы-17, –Ш–Ы-8, –≥—А–∞–љ—Г–ї–Њ—Ж–Є—В–∞—А–љ–Њ–≥–Њ –Ї–Њ–ї–Њ–љ–Є–µ—Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–≥–Њ —Д–∞–Ї—В–Њ—А–∞). –Э–∞—А—Г—И–µ–љ–Є–µ –Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —В—А–∞–љ—Б–њ–Њ—А—В–∞ –≤–Њ–і—Л, –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–µ –У–≠–С –Є –∞–Ї—В–Є–≤–љ–∞—П –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є—П –њ–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–≥–Њ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ –љ–µ–є—В—А–Њ—Д–Є–ї–∞–Љ–Є –Є —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї–∞–Љ–Є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —А–∞–Ј–≤–Є—В–Є—О –і–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–∞—Ж–Є–Є, —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –≥–Є–њ–µ—А–њ–ї–∞–Ј–Є–Є —Б –≥–Є–∞–ї–Є–љ–Є–Ј–∞—Ж–Є–µ–є —Б—В–µ–љ–Њ–Ї –Ї–∞–њ–Є–ї–ї—П—А–Њ–≤, –љ–µ–Ї—А–Њ–Ј—Г –Њ–ї–Є–≥–Њ–і–µ–љ–і—А–Њ—Ж–Є—В–Њ–≤ –Є –љ–µ–є—А–Њ–љ–Њ–≤ –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –њ–Њ–ї–Њ—Б—В–µ–є –Ї–∞–Ї –≤ –±–µ–ї–Њ–Љ, —В–∞–Ї –Є –≤ —Б–µ—А–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (—А–Є—Б. 1). –Ю–њ–Є—Б–∞–љ–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —Б–њ–Є–љ–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –Љ–Њ–≥—Г—В –љ–∞–њ–Њ–Љ–Є–љ–∞—В—М –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ, –њ—А–Њ—В–µ–Ї–∞—О—Й–µ–µ –њ–Њ —В–Є–њ—Г –≤–∞—Б–Ї—Г–ї–Є—В–∞ [3].

–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–Њ—З–µ—В–∞–љ–Є–µ–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–≤ –Њ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–µ–≤—А–Є—В–∞ –Є –њ—А–Њ–і–Њ–ї—М–љ–Њ-–њ–Њ–њ–µ—А–µ—З–љ–Њ–≥–Њ –Љ–Є–µ–ї–Є—В–∞ (—В–∞–±–ї. 1). –Ґ–Є–њ–Є—З–љ—Л–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –Љ–Є–µ–ї–Є—В–∞ –≤—Л—Б—В—Г–њ–∞—О—В –Љ—Л—И–µ—З–љ–∞—П —Б–ї–∞–±–Њ—Б—В—М, —Б–њ–∞—Б—В–Є—З–љ–Њ—Б—В—М, –і–Є—Б–Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є—П, –∞—В–∞–Ї—Б–Є—П, —Б–Є–Љ–њ—В–Њ–Љ –Ы–µ—А–Љ–Є—В—В–∞ (–Њ—Й—Г—Й–µ–љ–Є–µ —Г–і–∞—А–∞ —В–Њ–Ї–Њ–Љ –њ—А–Є —Б–≥–Є–±–∞–љ–Є–Є —И–µ–Є), –Ј–∞–і–µ—А–ґ–Ї–∞ –Љ–Њ—З–Є, –≤–µ–≥–µ—В–∞—В–Є–≤–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П, –≤–Њ–Ј–Љ–Њ–ґ–љ—Л —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞ –љ–Є–ґ–µ —Г—А–Њ–≤–љ—П –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞. –Я–Њ—А–∞–ґ–µ–љ–Є—П –Ј—А–Є—В–µ–ї—М–љ—Л—Е –љ–µ—А–≤–Њ–≤ –Є —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –≤–Њ–Ј–љ–Є–Ї–∞—О—В –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ, –љ–Њ —З–∞—Й–µ вАФ —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –Љ–Њ–ґ–µ—В —Б–Њ—Б—В–∞–≤–ї—П—В—М –Љ–µ—Б—П—Ж—Л, –≥–Њ–і—Л –Є –і–∞–ґ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П. –°–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ –љ–∞—А–∞—Б—В–∞–µ—В –≤ —В–µ—З–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –і–љ–µ–є, –∞ —А–µ–≥—А–µ—Б—Б–Є—А—Г–µ—В –љ–µ–і–µ–ї—П–Љ–Є –Є –Љ–µ—Б—П—Ж–∞–Љ–Є, –Ј–∞—З–∞—Б—В—Г—О —Б —Б–Њ—Е—А–∞–љ–µ–љ–Є–µ–Љ –Њ—Б—В–∞—В–Њ—З–љ–Њ–≥–Њ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–Њ–њ—Г—Б–Ї–∞–µ—В—Б—П, —З—В–Њ –Ю–Ь –Љ–Њ–ґ–µ—В –Є–Љ–µ—В—М –Ї–∞–Ї –Љ–Њ–љ–Њ—Д–∞–Ј–љ—Л–є, —В–∞–Ї –Є —А–µ–Љ–Є—В—В–Є—А—Г—О—Й–Є–є —В–Є–њ —В–µ—З–µ–љ–Є—П [4].

–Ф–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–µ–≤—А–Є—В–∞ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –Њ–њ—В–Є—З–µ—Б–Ї–∞—П –Ї–Њ–≥–µ—А–µ–љ—В–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –Є—Б—В–Њ–љ—З–µ–љ–Є–µ —А–µ—В–Є–љ–∞–ї—М–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ), –≤—Л–Ј–≤–∞–љ–љ—Л–µ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—Л (–Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–Њ –і–∞–љ–љ—Л–Љ –Ј—А–Є—В–µ–ї—М–љ—Л—Е –≤—Л–Ј–≤–∞–љ–љ—Л—Е –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–≤ –≤–њ–ї–Њ—В—М –і–Њ –њ–Њ–ї–љ–Њ–≥–Њ –Њ—В—Б—Г—В—Б—В–≤–Є—П –Њ—В–≤–µ—В–∞), –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П (–Ь–†–Ґ) (–≤ –Њ—Б—В—А—Г—О —Д–∞–Ј—Г –Љ–Њ–ґ–µ—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –Њ—В–µ—З–љ–Њ—Б—В—М –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞ –Є –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Є–Љ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞).
–Ь–†–Ґ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–∞—П –≤ –Њ—Б—В—А—Г—О —Д–∞–Ј—Г –Љ–Є–µ–ї–Є—В–∞, –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –Њ–±—И–Є—А–љ—Л–є –љ–µ–њ—А–µ—А—Л–≤–љ—Л–є –Њ—З–∞–≥ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –Ї–Њ—В–Њ—А—Л–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ—П–µ—В—Б—П –њ–Њ –і–ї–Є–љ–љ–Є–Ї—Г –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 3 –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ—Л—Е —Б–µ–≥–Љ–µ–љ—В–∞, –Њ–і–љ–∞–Ї–Њ –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Њ—З–∞–≥–∞ –Є–ї–Є –Ї–Њ—А–Њ—В–Ї–Є–µ –Њ—З–∞–≥–Є (–Љ–µ–љ–µ–µ 2 —Б–µ–≥–Љ–µ–љ—В–Њ–≤) –Љ–Њ–≥—Г—В –Њ–њ—А–µ–і–µ–ї—П—В—М—Б—П –≤ –њ–µ—А–Є–Њ–і—Л —А–µ–Љ–Є—Б—Б–Є–є –Є–ї–Є –≤ –Њ—В–і–∞–ї–µ–љ–љ—Л–µ –њ–µ—А–Є–Њ–і—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ї–Њ–≥–і–∞ —Д–Њ—А–Љ–Є—А—Г–µ—В—Б—П –∞—В—А–Њ—Д–Є—П —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞.
–Я—А–Є –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –љ–∞ –љ–∞—З–∞–ї—М–љ—Л—Е —Б—В–∞–і–Є—П—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–∞—П –Ї–∞—А—В–Є–љ–∞ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г 55вАУ84% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ь, –Њ–і–љ–∞–Ї–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –Њ—З–∞–≥–Њ–≤ –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ –њ—А–Є —А–∞–Ј–≤–Є—В–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—А–Є—Б. 2) [5]. –¶–µ—А–µ–±—А–∞–ї—М–љ—Л–µ –Њ—З–∞–≥–Є –њ–Њ —Б–≤–Њ–µ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–Љ–µ—О—В –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –Ї —В–µ–Љ —Г—З–∞—Б—В–Ї–∞–Љ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –≥–і–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Є–Љ–Љ—Г–љ–Њ—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї –∞–Ї–≤–∞–њ–Њ—А–Є–љ—Г-4 (–≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б, —Б—В–≤–Њ–ї –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, III –Є IV –ґ–µ–ї—Г–і–Њ—З–Ї–Є) [6].
![–†–Є—Б. 2. –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ (A-D) –Є —Б–њ–Є–љ–љ–Њ–≥–Њ (E, F) –Љ–Њ–Ј–≥–∞: A, B, E вАФ –Њ—Б—В—А–∞—П —Д–∞–Ј–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П; C, D, F вАФ —А–µ–Љ–Є—Б—Б–Є—П [5] –†–Є—Б. 2. –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ (A-D) –Є —Б–њ–Є–љ–љ–Њ–≥–Њ (E, F) –Љ–Њ–Ј–≥–∞: A, B, E вАФ –Њ—Б—В—А–∞—П —Д–∞–Ј–∞ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П; C, D, F вАФ —А–µ–Љ–Є—Б—Б–Є—П [5]](/upload/medialibrary/5cf/103-3.png)
–Ъ–ї—О—З–µ–≤—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —П–≤–ї—П–µ—В—Б—П –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–µ —Б–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞ вАФ –∞–љ—В–Є—В–µ–ї –Ї –∞–Ї–≤–∞–њ–Њ—А–Є–љ—Г-4 (NMO-IgG), —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М 75%, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М 85вАУ99%. –£—А–Њ–≤–µ–љ—М –∞–љ—В–Є—В–µ–ї –Ї –∞–Ї–≤–∞–њ–Њ—А–Є–љ—Г-4 –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Б–љ–Є–ґ–∞–µ—В—Б—П –њ—А–Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –Њ—Б—В–∞–µ—В—Б—П –љ–Є–Ј–Ї–Є–Љ –≤ —В–µ—З–µ–љ–Є–µ —А–µ–Љ–Є—Б—Б–Є–Є. –Я–Њ–Ї–∞–Ј–∞–љ–∞ –Ї–Њ—А—А–µ–ї—П—Ж–Є—П —В–Є—В—А–∞ –∞–љ—В–Є—В–µ–ї —Б —В—П–ґ–µ—Б—В—М—О –Ј—А–Є—В–µ–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є [3].
–Я—А–Њ–≥–љ–Њ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–µ—А—М–µ–Ј–љ—Л–є, –≤–њ–ї–Њ—В—М –і–Њ –Є–љ–≤–∞–ї–Є–і–Є–Ј–∞—Ж–Є–Є –Є –ї–µ—В–∞–ї—М–љ–Њ–≥–Њ –Є—Б—Е–Њ–і–∞. –Я—А–Є —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ—Л—Е —А–µ–Љ–Є—Б—Б–Є–є, –њ—П—В–Є–ї–µ—В–љ—П—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –њ—А–Є –Ю–Ь –њ–Њ–≤—Л—И–∞–µ—В—Б—П —Б 68 –і–Њ 91%.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–≥–Њ —Б—В–∞–љ–і–∞—А—В–∞ –ї–µ—З–µ–љ–Є—П —Б–Є–љ–і—А–Њ–Љ–∞ –Ф–µ–≤–Є–Ї–∞ –љ–µ—В. –Ю–і–љ–Є–Љ –Є–Ј –≤–∞—А–Є–∞–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —З–∞—Б—В–Є—З–љ–Њ –±–ї–Њ–Ї–Є—А—Г—О—Й–Є—Е –Т-–Ї–ї–µ—В–Ї–Є, —В–∞–Ї–Є—Е –Ї–∞–Ї —А–Є—В—Г–Ї—Б–Є–Љ–∞–±. –Ф–ї—П –ї–µ—З–µ–љ–Є—П –∞—В–∞–Ї–Є –Љ–Є–µ–ї–Є—В–∞ –Є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–µ–≤—А–Є—В–∞ –њ—А–Є–Љ–µ–љ—П—О—В –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤. –Э–∞—А—П–і—Г —Б —Н—В–Є–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–є –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–µ–є —В–µ—А–∞–њ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Ь —Д–Њ—А–Љ–∞–ї—М–љ–Њ –љ–µ –Є–Ј—Г—З–µ–љ–∞. –Ґ–µ—А–∞–њ–Є–µ–є –≤—Л–±–Њ—А–∞ —Б—З–Є—В–∞—О—В –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—О –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ –Є –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ–∞ [7].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ
–Я—А–Є–≤–Њ–і–Є–Љ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –±–Њ–ї—М–љ–Њ–є –Њ–њ—В–Є–Ї–Њ–љ–µ–≤—А–Њ–Љ–Є–µ–ї–Є—В–Њ–Љ –Ф–µ–≤–Є–Ї–∞, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–Љ —Б –°–Ъ–Т (—Б–Љ. —А–Є—Б. 3).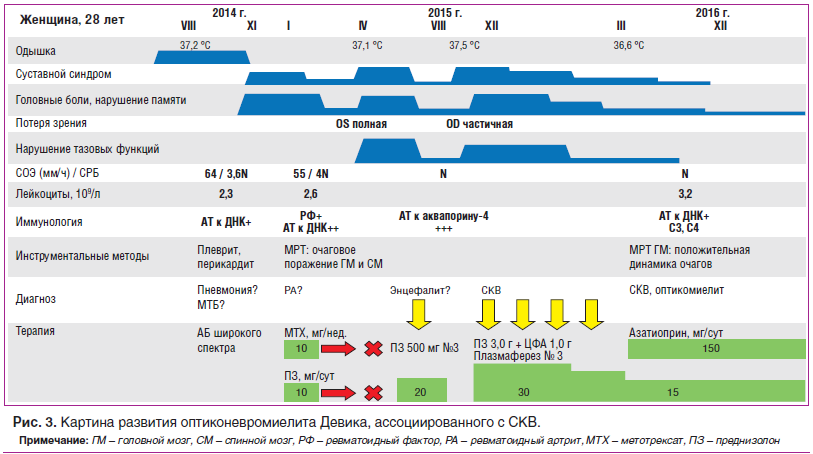
–С–Њ–ї—М–љ–∞—П –Ъ., 28 –ї–µ—В, –і–Њ–Љ–Њ—Е–Њ–Ј—П–є–Ї–∞.
–Т —В–µ—З–µ–љ–Є–µ 2013вАУ2014 –≥–≥. –≤ —Б–≤—П–Ј–Є —Б —Н–њ–Є–Ј–Њ–і–∞–Љ–Є —Б—Г–±—Д–µ–±—А–Є–ї–Є—В–µ—В–∞, –Њ–і—Л—И–Ї–Њ–є, –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–Є–Љ–Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –љ–Є–ґ–љ–µ–і–Њ–ї–µ–≤–Њ–є –Є–љ—Д–Є–ї—М—В—А–∞—Ж–Є–Є —Б–ї–µ–≤–∞, —Г—Б—В–Њ–є—З–Є–≤—Л–Љ–Є –Ї –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞, –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –Є –њ–Њ–ї—Г—З–∞–ї–∞ –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ—Г—О —Е–Є–Љ–Є–Њ—В–µ—А–∞–њ–Є—О –≤ –њ—А–Њ—В–Є–≤–Њ—В—Г–±–µ—А–Ї—Г–ї–µ–Ј–љ–Њ–Љ –і–Є—Б–њ–∞–љ—Б–µ—А–µ –•–∞–±–∞—А–Њ–≤—Б–Ї–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ–ї–Є–Љ–µ—А–∞–Ј–љ–Њ-—Ж–µ–њ–љ–Њ–є —А–µ–∞–Ї—Ж–Є–Є, –±—А–Њ–љ—Е–Њ-–∞–ї—М–≤–µ–Њ–ї—П—А–љ–Њ–≥–Њ –ї–∞–≤–∞–ґ–∞ –Є –Ї–Њ–ґ–љ—Л—Е —В—Г–±–µ—А–Ї—Г–ї–Є–љ–Њ–≤—Л—Е –њ—А–Њ–± (–і–Є–∞—Б–Ї–Є–љ-—В–µ—Б—В) –±—Л–ї–Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–Љ–Є –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П. –Т –∞–≤–≥—Г—Б—В–µ 2014 –≥. вАФ –ї–µ–≤–Њ—Б—В–Њ—А–Њ–љ–љ–Є–є –њ–ї–µ–≤—А–Є—В, –њ–µ—А–Є–Ї–∞—А–і–Є—В, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П –і–Њ 2,3√Ч109/–ї, –њ–Њ–≤—Л—И–µ–љ–Є–µ –Љ–∞—А–Ї–µ—А–Њ–≤ –Њ—Б—В—А–Њ—Д–∞–Ј–Њ–≤–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (—Б–Ї–Њ—А–Њ—Б—В—М –Њ—Б–µ–і–∞–љ–Є—П —Н—А–Є—В—А–Њ—Ж–Є—В–Њ–≤ (–°–Ю–≠) 52вАУ64 –Љ–Љ/—З, —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –°-—А–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ (–°–†–С) 3,5N), –≤–њ–µ—А–≤—Л–µ –≤—Л—П–≤–ї–µ–љ—Л –∞–љ—В–Є—В–µ–ї–∞ –Ї –љ–∞—В–Є–≤–љ–Њ–є –Ф–Э–Ъ. –Т –љ–Њ—П–±—А–µ 2014 –≥. –≤–Њ–Ј–љ–Є–Ї–ї–Є –ґ–∞–ї–Њ–±—Л –љ–∞ –≥–Њ–ї–Њ–≤–љ—Л–µ –±–Њ–ї–Є, –±–Њ–ї–Є –њ—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є –Є –і–≤–Є–ґ–µ–љ–Є–Є, –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В–Є –≤ —И–µ–є–љ–Њ–Љ –Њ—В–і–µ–ї–µ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, –±–Њ–ї–Є –≤ –≤–µ—А—Е–љ–µ–Љ –њ–ї–µ—З–µ–≤–Њ–Љ –њ–Њ—П—Б–µ, –∞—А—В—А–Є—В—Л –Љ–µ–ї–Ї–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Ї–Є—Б—В–µ–є —А—Г–Ї. –Т —П–љ–≤–∞—А–µ 2015 –≥. –њ—А–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є: —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є —Д–∞–Ї—В–Њ—А (–†–§)+, –∞–љ—В–Є—В–µ–ї–∞ –Ї –љ–∞—В–Є–≤–љ–Њ–є –Ф–Э–Ъ 10N, –ї–µ–є–Ї–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—П 2,6√Ч109/–ї, –°–Ю–≠ 55 –Љ–Љ/—З, –°–†–С 4N. –°–Њ—Б—В–Њ—П–љ–Є–µ —А–∞—Б—Ж–µ–љ–µ–љ–Њ –Ї–∞–Ї —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–є –∞—А—В—А–Є—В, –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –њ—Г–ї—М—Б-—В–µ—А–∞–њ–Є—П –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–∞–Љ–Є, –і–∞–ї–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ 10 –Љ–≥/—Б—Г—В, –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В 10 –Љ–≥/–љ–µ–і. —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ. –Т —Д–µ–≤—А–∞–ї–µ 2015 –≥. —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –њ—А–µ–Ї—А–∞—В–Є–ї–∞ –њ—А–Є–µ–Љ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ –Є –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В–∞, –љ–∞ —Д–Њ–љ–µ —З–µ–≥–Њ –Њ—В–Љ–µ—В–Є–ї–∞ –≤–љ–µ–Ј–∞–њ–љ–Њ–µ –≤—Л–њ–∞–і–µ–љ–Є–µ –љ–Є–ґ–љ–µ–є –њ–Њ–ї–Њ–≤–Є–љ—Л –њ–Њ–ї—П –Ј—А–µ–љ–Є—П, –∞ –Ј–∞—В–µ–Љ –њ–Њ–ї–љ—Г—О –њ–Њ—В–µ—А—О –Ј—А–µ–љ–Є—П –љ–∞ –ї–µ–≤—Л–є –≥–ї–∞–Ј. –Т –Љ–∞—А—В–µ 2015 –≥. –њ—А–Є –Ь–†–Ґ-–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ.
–Т –∞–њ—А–µ–ї–µ 2015 –≥. –±—Л–ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ ¬Ђ—Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П –љ–µ—П—Б–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є¬ї. –Ю–±—К–µ–Ї—В–Є–≤–љ–Њ: —Б–Њ–Ј–љ–∞–љ–Є–µ –љ–∞—А—Г—И–µ–љ–Њ –і–Њ —Б—В–µ–њ–µ–љ–Є –Ј–∞—В–Њ—А–Љ–Њ–ґ–µ–љ–љ–Њ—Б—В–Є, —А–Є–≥–Є–і–љ–Њ—Б—В—М –Ј–∞—В—Л–ї–Њ—З–љ—Л—Е –Љ—Л—И—Ж, –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є–Њ–љ–љ—Л–µ –њ—А–Њ–±—Л –љ–µ –≤—Л–њ–Њ–ї–љ—П–µ—В, –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є —В–∞–Ј–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤ (–Ј–∞–і–µ—А–ґ–Ї–∞ –Љ–Њ—З–Є). –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞: –≤ –±–µ–ї–Њ–Љ –≤–µ—Й–µ—Б—В–≤–µ –ї–Њ–±–љ—Л—Е, —В–µ–Љ–µ–љ–љ—Л—Е, –≤–Є—Б–Њ—З–љ—Л—Е –і–Њ–ї–µ–є –≤—Л—П–≤–ї–µ–љ—Л –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ –Њ—З–∞–≥–Є –Є–Ј–Љ–µ–љ–µ–љ–љ–Њ–≥–Њ –Ь–†-—Б–Є–≥–љ–∞–ї–∞ (–≥–Є–њ–µ—А–Є–љ—В–µ–љ—Б–Є–≤–љ—Л–µ –≤ —А–µ–ґ–Є–Љ–µ –Ґ2 –Є FLAIR, –Є–Ј–Њ- –Є –≥–Є–њ–Њ–Є–љ—В–µ–љ—Б–Є–≤–љ—Л–µ –≤ —А–µ–ґ–Є–Љ–µ –Ґ1), –њ–Њ–ї–Є–≥–Њ–љ–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л —Б –љ–µ—З–µ—В–Ї–Є–Љ–Є –Є –љ–µ—А–Њ–≤–љ—Л–Љ–Є –Ї–Њ–љ—В—Г—А–∞–Љ–Є, —Б–ї–Є–≤–љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞, —А–∞–Ј–Љ–µ—А–∞–Љ–Є –Њ—В 0,3 –і–Њ 3,0 —Б–Љ. –Я—А–Є –њ–Њ—Б—В–Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є: 2 —Б—Г–њ—А–∞—В–µ–љ—В–Њ—А–Є–∞–ї—М–љ—Л—Е –Њ—З–∞–≥–∞ (–≤ –ї–µ–≤–Њ–є –ї–Њ–±–љ–Њ–є –і–Њ–ї–µ), –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ –љ–∞–Ї–∞–њ–ї–Є–≤–∞—О—Й–Є—Е –Ї–Њ–љ—В—А–∞—Б—В –≤ –≤–Є–і–µ –љ–µ–±–Њ–ї—М—И–Є—Е –Њ—З–∞–≥–Њ–≤ –љ–∞ –њ–µ—А–Є—Д–µ—А–Є–Є. –Ь–†–Ґ —И–µ–є–љ–Њ–≥–Њ, –њ–Њ—П—Б–љ–Є—З–љ–Њ–≥–Њ –Њ—В–і–µ–ї–Њ–≤ —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞: –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ –Є–љ—В—А–∞–Љ–µ–і—Г–ї–ї—П—А–љ—Л–µ –Ј–Њ–љ—Л –≥–Є–њ–µ—А–Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ –њ—А–Њ—В—П–ґ–µ–љ–љ–Њ—Б—В—М—О 5вАУ13 –Љ–Љ. –Р–љ–∞–ї–Є–Ј –ї–Є–Ї–≤–Њ—А–∞: —Ж–Є—В–Њ–Ј 12/–Љ–Љ3 (–љ–µ–є—В—А–Њ—Д–Є–ї—Л 5, –ї–Є–Љ—Д–Њ—Ж–Є—В—Л 7), –≥–ї—О–Ї–Њ–Ј–∞ 2,8 –Љ–Љ–Њ–ї—М/–ї, –Њ–±—Й–Є–є –±–µ–ї–Њ–Ї 0,8 –≥/–ї. –Т –ї–µ–є–Ї–Њ—Ж–Є—В–∞—А–љ–Њ–є —Д–Њ—А–Љ—Г–ї–µ: –ї–µ–є–Ї–Њ–њ–µ–љ–Є—П, –ї–Є–Љ—Д–Њ–њ–µ–љ–Є—П, –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–Ј. –Р–љ—В–Є—В–µ–ї–∞ –Ї –≤–Є—А—Г—Б—Г –≠–њ—И—В–µ–є–љ–∞ вАФ –С–∞—А—А IgM, –∞–љ—В–Є—В–µ–ї–∞ –Ї Herpes simplex IgM, –∞–љ—В–Є—В–µ–ї–∞ –Ї –Ї–∞—А–і–Є–Њ–ї–Є–њ–Є–љ–∞–Љ –љ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л. –Я—А–Њ–≤–µ–і–µ–љ–∞ –њ—Г–ї—М—Б-—В–µ—А–∞–њ–Є—П –Љ–µ—В–Є–ї–њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–Њ–Љ, –і–∞–ї–µ–µ –љ–∞–Ј–љ–∞—З–µ–љ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ –≤ –і–Њ–Ј–µ 20 –Љ–≥/—Б—Г—В —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –≤ –≤–Є–і–µ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –њ–∞–Љ—П—В–Є, —Д—Г–љ–Ї—Ж–Є–Є —В–∞–Ј–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤. –Т –∞–≤–≥—Г—Б—В–µ 2015 –≥. –љ–∞ —Д–Њ–љ–µ –Њ—В–Љ–µ–љ—Л –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–Њ–≤ –Њ—В–Љ–µ—В–Є–ї–∞ —Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Б—В—А–Њ—В—Л –Ј—А–µ–љ–Є—П —Б–њ—А–∞–≤–∞, —Б–љ–Є–ґ–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, –≥–Њ–ї–Њ–≤–љ—Л–µ –±–Њ–ї–Є, –≤–Њ–Ј–љ–Є–Ї–ї–Є –∞—А—В—А–Є—В—Л –Љ–µ–ї–Ї–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Ї–Є—Б—В–µ–є —А—Г–Ї. –Ю—Б–Љ–Њ—В—А –Њ–Ї—Г–ї–Є—Б—В–∞: –њ–Њ–ї–љ–∞—П –∞—В—А–Њ—Д–Є—П –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞ —Б–ї–µ–≤–∞, –љ–Є—Б—Е–Њ–і—П—Й–∞—П —З–∞—Б—В–Є—З–љ–∞—П –∞—В—А–Њ—Д–Є—П —Б–њ—А–∞–≤–∞, –Љ–Є–Њ–њ–Є—П —Б—А–µ–і–љ–µ–є —Б—В–µ–њ–µ–љ–Є. –Р–љ—В–Є—В–µ–ї–∞ –Ї –∞–Ї–≤–∞–њ–Њ—А–Є–љ—Г-4 (NMO) –≤—Л—П–≤–ї–µ–љ—Л –≤ –≤—Л—Б–Њ–Ї–Њ–Љ —В–Є—В—А–µ 1:320 (N<1:10). –Т–њ–µ—А–≤—Л–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є, –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–µ–≥–Њ –Њ–њ—В–Є–Ї–Њ–Љ–Є–µ–ї–Є—В–∞. –Т–Њ–Ј–Њ–±–љ–Њ–≤–ї–µ–љ–∞ –∞–Ї—В–Є–≤–љ–∞—П –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П: –≤—Л–њ–Њ–ї–љ–µ–љ–Њ 3 —Б–µ–∞–љ—Б–∞ –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞, –њ—А–Њ–≤–µ–і–µ–љ–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П –њ—Г–ї—М—Б-—В–µ—А–∞–њ–Є—П –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–∞–Љ–Є –Є —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–Њ–Љ (–њ–Њ 1000 –Љ–≥/–Љ–µ—Б.), –љ–∞–Ј–љ–∞—З–µ–љ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ –≤ –і–Њ–Ј–µ 30 –Љ–≥/—Б—Г—В. –Т –і–µ–Ї–∞–±—А–µ 2015 –≥. –њ–Њ –і–∞–љ–љ—Л–Љ –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ —Б –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–Љ —Г—Б–Є–ї–µ–љ–Є–µ–Љ –Њ—В–Љ–µ—З–µ–љ–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –Њ—З–∞–≥–Њ–≤–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –љ–∞ —Д–Њ–љ–µ –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –° –Љ–∞—А—В–∞ 2016 –≥. –њ–µ—А–µ–≤–µ–і–µ–љ–∞ –љ–∞ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–µ –ї–µ—З–µ–љ–Є–µ, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і –±—Л–ї –Ј–∞–Љ–µ–љ–µ–љ –љ–∞ –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ –≤ –і–Њ–Ј–µ 150 –Љ–≥/—Б—Г—В, –і–Њ–Ј–∞ –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Б–љ–Є–ґ–µ–љ–∞ –і–Њ 15 –Љ–≥/—Б—Г—В. –Т –і–µ–Ї–∞–±—А–µ 2016 –≥. –≤–њ–µ—А–≤—Л–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –≤ –Ї–ї–Є–љ–Є–Ї—Г –Є–Љ. –Х.–Ь. –Ґ–∞—А–µ–µ–≤–∞. –£—З–Є—В—Л–≤–∞—П –Ї–ї–Є–љ–Є–Ї–Њ-–∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –Њ –њ–Њ–ї–Є—Б–µ—А–Њ–Ј–Є—В–∞—Е, –∞—А—В—А–Є—В–∞—Е –Љ–µ–ї–Ї–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Ї–Є—Б—В–µ–є —А—Г–Ї, –і–µ–Љ–Є–µ–ї–Є–љ–Є–Ј–Є—А—Г—О—Й–µ–Љ –Њ—З–∞–≥–Њ–≤–Њ–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–Є —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –ї–µ–є–Ї–Њ–њ–µ–љ–Є—О, –≥–Є–њ–Њ–Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–µ–Љ–Є—О, –≤—Л—П–≤–ї–µ–љ–Є–µ –∞–љ—В–Є—В–µ–ї –Ї –љ–∞—В–Є–≤–љ–Њ–є –Ф–Э–Ъ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —В–Є—В—А–∞—Е, –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О –і–Є–љ–∞–Љ–Ї—Г —Б–Њ—Б—В–Њ—П–љ–Є—П –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –і–Є–∞–≥–љ–Њ–Ј —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є —Б–Њ–Љ–љ–µ–љ–Є–є –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В (SLE SLICC 4 –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є 2 –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ї—А–Є—В–µ—А–Є—П). –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –і–∞–љ–љ–Њ–≥–Њ —Б–ї—Г—З–∞—П —П–≤–ї—П–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ –і–≤—Г—Б—В–Њ—А–Њ–љ–љ–µ–≥–Њ –Њ–њ—В–Є–Ї–Њ–љ–µ–≤—А–Њ–Љ–Є–µ–ї–Є—В–∞, NMO-IgG-–∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ, –Њ—Б–ї–Њ–ґ–љ–Є–≤—И–µ–≥–Њ—Б—П –њ–Њ–ї–љ–Њ–є –њ–Њ—В–µ—А–µ–є –Ј—А–µ–љ–Є—П —Б–ї–µ–≤–∞. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–∞–љ–љ—Л—Е –Ј–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ, –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —В–µ—Б—В—Л –≤ –љ–Њ—А–Љ–µ. –Т–≤–Є–і—Г –љ–∞–ї–Є—З–Є—П –Є–љ–≤–∞–ї–Є–і–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ –Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ –ґ–Є–Ј–љ–µ—Г–≥—А–Њ–ґ–∞—О—Й–µ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –¶–Э–° —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ—Л: –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ–Њ–Љ –≤ –њ—А–µ–ґ–љ–µ–є –і–Њ–Ј–µ вАФ 150 –Љ–≥/—Б—Г—В, –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ –Љ–µ–і–ї–µ–љ–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–∞ –њ–Њ 1,25 –Љ–≥/–Љ–µ—Б. –і–Њ 10 –Љ–≥/—Б—Г—В, –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–є –Ь–†-–Ї–Њ–љ—В—А–Њ–ї—М –Њ—З–∞–≥–Њ–≤—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Є —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –љ–∞–±–ї—О–і–µ–љ–Є–µ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞, –љ–µ–≤—А–Њ–ї–Њ–≥–∞, –Њ–Ї—Г–ї–Є—Б—В–∞. –Т–≤–Є–і—Г —А–µ–Љ–Є—В—В–Є—А—Г—О—Й–µ–≥–Њ —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б—В—А–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–∞ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–∞—П –Њ—В–Љ–µ–љ–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В —А–µ–і–Ї–Є–є –≤–∞—А–Є–∞–љ—В –њ–Њ—А–∞–ґ–µ–љ–Є—П –¶–Э–° –њ—А–Є —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–µ. –Ю—Б—В–∞–µ—В—Б—П –Њ—В–Ї—А—Л—В—Л–Љ –≤–Њ–њ—А–Њ—Б, —Б–ї–µ–і—Г–µ—В –ї–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М —А–∞–Ј–≤–Є—В–Є–µ –Ю–Ь –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–є –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л –Є–ї–Є –Ї–∞–Ї –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤ –љ–∞—И–µ–Љ —Б–ї—Г—З–∞–µ —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є. –° –Њ–і–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л, –љ–∞–ї–Є—З–Є–µ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є—В–µ–ї (NMO-IgG) –Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–µ —Г—Е—Г–і—И–µ–љ–Є–µ —В–µ—З–µ–љ–Є—П –Ю–Ь –≤–љ–µ –Ї–Њ–љ—В–µ–Ї—Б—В–∞ —Б–Є—Б—В–µ–Љ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —П–≤–ї—П—О—В—Б—П –∞—А–≥—Г–Љ–µ–љ—В–∞–Љ–Є –≤ –њ–Њ–ї—М–Ј—Г –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ—Б—В–Є —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–љ—В—А–Њ–ї—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ю–Ь, —Б–Њ–≤–њ–∞–і–µ–љ–Є–µ –њ–µ—А–Є–Њ–і–Њ–≤ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Ю–Ь —Б —Б–Є—Б—В–µ–Љ–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є, –Њ–і–љ–Њ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –Ю–Ь –Є –°–Ъ–Т –њ–Њ–Ј–≤–Њ–ї—П—О—В —В—А–∞–Ї—В–Њ–≤–∞—В—М –Ю–Ь —Г –љ–∞—И–µ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є –Ї–∞–Ї –≤—В–Њ—А–Є—З–љ—Л–є. –Т–∞–ґ–љ–Њ, —З—В–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —В–Є—В—А–∞ NMO-IgG –њ–Њ–Љ–Њ–≥–∞–µ—В –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–Ј–љ–Є. –Ґ–∞–Ї, —Г—А–Њ–≤–µ–љ—М –∞–љ—В–Є—В–µ–ї –Ї –∞–Ї–≤–∞–њ–Њ—А–Є–љ—Г-4 —Б–љ–Є–ґ–∞–µ—В—Б—П –Є –Њ—Б—В–∞–µ—В—Б—П –љ–Є–Ј–Ї–Є–Љ –≤ —В–µ—З–µ–љ–Є–µ —А–µ–Љ–Є—Б—Б–Є–Є. –•–Њ—А–Њ—И–Є–є –Њ—В–≤–µ—В –љ–∞ –ї–µ—З–µ–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —А–∞—Б—Б—З–Є—В—Л–≤–∞—В—М –љ–∞ –і–ї–Є—В–µ–ї—М–љ—Л–є –Ї–Њ–љ—В—А–Њ–ї—М –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є.












