–Т–≤–µ–і–µ–љ–Є–µ
–Я–Њ–і–∞–≥—А–∞ вАФ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞—О—Й–∞—П—Б—П —Д–Њ—А–Љ–∞ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–∞—П –Њ—В–ї–Њ–ґ–µ–љ–Є–µ–Љ –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Љ–Њ–љ–Њ—Г—А–∞—В–∞ –љ–∞—В—А–Є—П (–Ь–£–Э) [1]. –Ч–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –њ–Њ–і–∞–≥—А–Њ–є –±—Л—Б—В—А–Њ —А–∞—Б—В–µ—В –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ. –Я–Њ –і–∞–љ–љ—Л–Љ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–Њ–і–∞–≥—А—Л —Б—А–µ–і–Є –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 0,05% –і–Њ 3% –≤ —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ–∞—Е –Љ–Є—А–∞, –≤ –Х–≤—А–Њ–њ–µ –Њ–љ–∞ –і–Њ—Б—В–Є–≥–∞–µ—В –њ—А–Є–Љ–µ—А–љ–Њ 2% [2, 3]. –≠—В–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ —Б—В—А–∞–і–∞—О—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Љ—Г–ґ—З–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ 40 –ї–µ—В –Є —Б—В–∞—А—И–µ, –ґ–µ–љ—Й–Є–љ—Л –±–Њ–ї–µ—О—В —А–µ–ґ–µ. –Ю–і–љ–∞–Ї–Њ, –µ—Б–ї–Є —А–∞–љ—М—И–µ –њ–Є–Ї –њ–Њ–і–∞–≥—А—Л —Г –ґ–µ–љ—Й–Є–љ –њ—А–Є—Е–Њ–і–Є–ї—Б—П –љ–∞ –≤–Њ–Ј—А–∞—Б—В 60 –ї–µ—В –Є —Б—В–∞—А—И–µ, —В–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ–љ —Б–Љ–µ—Б—В–Є–ї—Б—П –≤ —Б—В–Њ—А–Њ–љ—Г –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –≤—Б–µ —З–∞—Й–µ —А–µ–≥–Є—Б—В—А–Є—А—Г—О—В —Г –ґ–µ–љ—Й–Є–љ —Б —А–∞–љ–љ–Є–Љ –Ї–ї–Є–Љ–∞–Ї—Б–Њ–Љ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 27вАУ29 –ї–µ—В. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є —Б–≤—П–Ј—Л–≤–∞—О—В —Б —А–Њ—Б—В–Њ–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Њ–ґ–Є—А–µ–љ–Є—П –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Э–µ–ї—М–Ј—П –љ–µ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Г –Љ–Њ–ї–Њ–і—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–Њ–Є—Е –њ–Њ–ї–Њ–≤ –њ–Њ–і–∞–≥—А–∞ –Њ—В–ї–Є—З–∞–µ—В—Б—П –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ, —З—В–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П —З–∞—Б—В—Л–Љ–Є –Є –і–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П–Љ–Є –Є –њ—А–Є—Б–Њ–µ–і–Є–љ–µ–љ–Є–µ–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є [4]. –°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –њ–Њ–і–∞–≥—А—Л –≤ –њ–µ—А–µ—Б—З–µ—В–µ –љ–∞ –≤—Б–µ—Е –ґ–Є—В–µ–ї–µ–є –†–Њ—Б—Б–Є–Є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 18 –ї–µ—В –Є —Б—В–∞—А—И–µ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 0,3% [5].
–Ф–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –і–ї–Є—В–µ–ї—М–љ–∞—П —Б—В–Њ–є–Ї–∞—П –≥–Є–њ–µ—А—Г—А–Є–Ї–µ–Љ–Є—П (–У–£), –Љ–Њ–≥—Г—В –њ—А–Є–≤–µ—Б—В–Є –Ї –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—О –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —П–≤–љ–Њ–є –њ–Њ–і–∞–≥—А—Л. –Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ–µ—А–µ—Е–Њ–і–Є—В –≤ –і–ї–Є—В–µ–ї—М–љ—Г—О —А–µ–Љ–Є—Б—Б–Є—О –њ—А–Є –њ—А–∞–≤–Є–ї—М–љ–Њ–Љ –Є –њ–Њ–ґ–Є–Ј–љ–µ–љ–љ–Њ–Љ –ї–µ—З–µ–љ–Є–Є. –С–µ–Ј –∞–і–µ–Ї–≤–∞—В–љ–Њ–є –ґ–µ —В–µ—А–∞–њ–Є–Є –њ–Њ–і–∞–≥—А–∞ –њ–µ—А–µ—Е–Њ–і–Є—В –≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О —Д–Њ—А–Љ—Г —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –њ—А–Є—Б—В—Г–њ–∞–Љ–Є –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В—А–Є—В–∞ [6, 7]. –Я—А–Њ–±–ї–µ–Љ—Л –њ–∞—Ж–Є–µ–љ—В–∞ —Б –њ–Њ–і–∞–≥—А–Њ–є –љ–µ –Є—Б—З–µ—А–њ—Л–≤–∞—О—В—Б—П –њ—А–Є—Б—В—Г–њ–∞–Љ–Є –Ї—А–∞–є–љ–µ –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞, –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –њ–Њ–і–∞–≥—А–Њ–є, –У–£ –Є —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –≤–Ї–ї—О—З–∞—П —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –±–Њ–ї–µ–Ј–љ—М –њ–Њ—З–µ–Ї (–•–С–Я), –Љ–Њ—З–µ–Ї–∞–Љ–µ–љ–љ—Г—О –±–Њ–ї–µ–Ј–љ—М (–Ь–Ъ–С), —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–є —Б–Є–љ–і—А–Њ–Љ, –і–Є—Б–ї–Є–њ–Є–і–µ–Љ–Є—О, –∞—А—В–µ—А–Є–∞–ї—М–љ—Г—О –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—О –Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–°–°–Ч) [8вАУ10]. –І—В–Њ–±—Л –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Б—Г—Б—В–∞–≤–љ—Л–µ –Є –≤–љ–µ—Б—Г—Б—В–∞–≤–љ—Л–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –њ–Њ–і–∞–≥—А—Л, –≤–∞–ґ–љ–Њ –і–Њ–±–Є—В—М—Б—П –њ—Г—В–µ–Љ —В–Є—В—А–Њ–≤–∞–љ–Є—П —Г—А–∞—В—Б–љ–Є–ґ–∞—О—Й–µ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ –Є –љ–∞ —Н—В–Є—Е –Ј–љ–∞—З–µ–љ–Є—П—Е –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М –µ–≥–Њ [11вАУ14]. –Ф–∞–ї–µ–µ –±—Г–і—Г—В —А–∞—Б—Б–Љ–Њ—В—А–µ–љ—Л –њ—А–Њ–±–µ–ї—Л –≤ –ї–µ—З–µ–љ–Є–Є –њ–Њ–і–∞–≥—А—Л –Є –У–£, –Њ–±—Б—Г–ґ–і–µ–љ—Л —Б—В—А–∞—В–µ–≥–Є–Є –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ —Б –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ–Љ —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –£–°–Ґ, —З—В–Њ –≤ –Є—В–Њ–≥–µ –Њ–±–µ—Б–њ–µ—З–Є—В –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–є –Є—Б—Е–Њ–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–°—В—А–∞—В–µ–≥–Є–Є –ї–µ—З–µ–љ–Є—П –У–£ –њ—А–Є –Њ—Б—В—А–Њ–є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ–і–∞–≥—А–µ
–¶–µ–ї—М—О –і–Њ–ї–≥–Њ—Б—А–Њ—З–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–µ–µ —А–∞—Б—В–≤–Њ—А–µ–љ–Є—О –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э, —Г–Љ–µ–љ—М—И–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є –∞—А—В—А–Є—В–∞, —Г—Б—В—А–∞–љ–µ–љ–Є–µ —В–Њ—Д—Г—Б–Њ–≤ –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Б—Г—Б—В–∞–≤–Њ–≤ –Є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤.. –Ь–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л–µ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞ [11вАУ14] –∞–Ї—В–Є–≤–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –£–°–Ґ –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ь–Ъ (—В–∞–±–ї. 1).
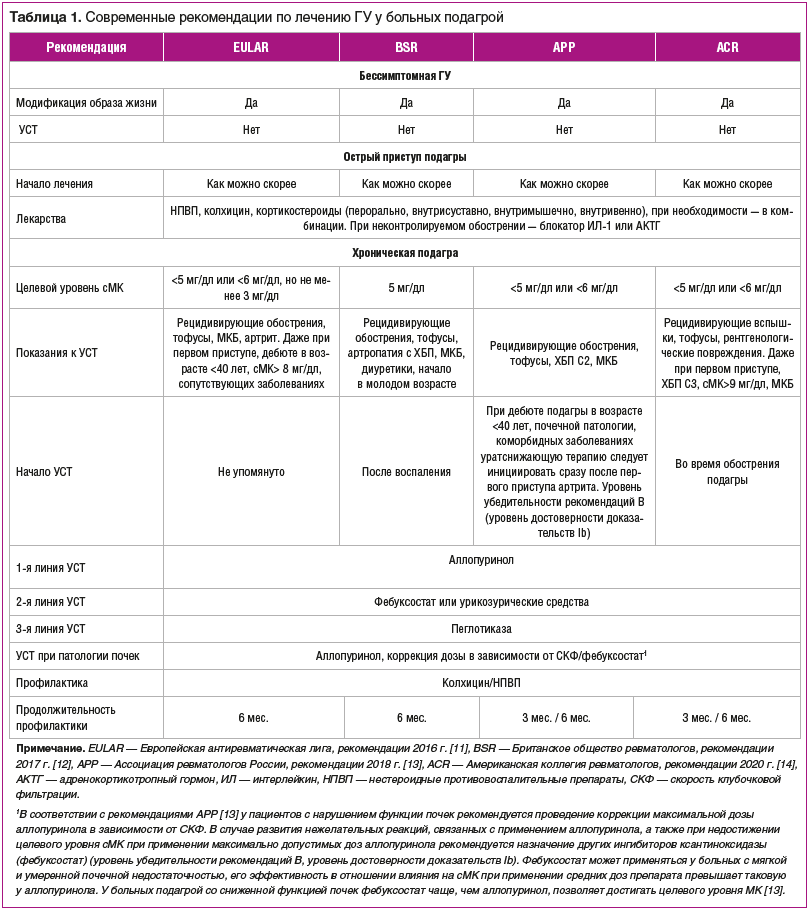
–Я–Њ–Ї–∞–Ј–∞–љ–Є—П –і–ї—П –£–°–Ґ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –≤ —А–∞–Ј–љ—Л—Е —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞—Е, –Є —Б–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ ACR 2020 –≥. [14]. –£–°–Ґ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –њ—А–Є —Б–ї–µ–і—Г—О—Й–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є—П—Е:
—З–∞—Б—В—Л–µ –њ—А–Є—Б—В—Г–њ—Л –њ–Њ–і–∞–≥—А—Л (2 –Є–ї–Є –±–Њ–ї–µ–µ –њ—А–Є—Б—В—Г–њ–Њ–≤ –њ–Њ–і–∞–≥—А—Л –≤ –≥–Њ–і);
–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л–µ —В–Њ—Д—Г—Б—Л;
–Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ —Б—Г—Б—В–∞–≤–Њ–≤ –њ—А–Є –њ–Њ–і–∞–≥—А–µ;
—Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–є —Г—А–∞—В–љ—Л–є –љ–µ—Д—А–Њ–ї–Є—В–Є–∞–Ј;
—Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–∞—П –•–С–Я (—Б—В–∞–і–Є–Є –°2вАУ–°5).
–°—В—А–∞—В–µ–≥–Є—П ¬Ђ–ї–µ—З–µ–љ–Є–µ –і–Њ —Ж–µ–ї–Є¬ї вАФ –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Ь–Ъ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ <6 –Љ–≥/–і–ї (360 –Љ–Ї–Љ–Њ–ї—М/–ї) —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–ї—П –≤—Б–µ—Е –≤—Л—И–µ—Г–њ–Њ–Љ—П–љ—Г—В—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –і–ї—П —В–µ—Е, —Г –Ї–Њ–≥–Њ –љ–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —В–Њ—Д—Г—Б–Њ–≤ –Є–ї–Є —Н—А–Њ–Ј–Є–≤–љ–Њ–є –∞—А—В—А–Њ–њ–∞—В–Є–Є.. –£—А–Њ–≤–µ–љ—М —Б–Ь–Ъ <5 –Љ–≥/–і–ї
(300 –Љ–Ї–Љ–Њ–ї—М/–ї) —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ–і–∞–≥—А—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –±–Њ–ї–µ–µ —В—П–ґ–µ–ї–Њ–є –Є–ї–Є –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є –µ–µ —Д–Њ—А–Љ–Њ–є. –†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ ACR —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Г—А–Њ–≤–µ–љ—М —Б–Ь–Ъ –Ї–∞–ґ–і—Л–µ 2вАУ5 –љ–µ–і. –≤–Њ –≤—А–µ–Љ—П –њ–Њ–≤—Л—И–µ–љ–Є—П –і–Њ–Ј—Л –£–°–Ґ –і–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Є –љ–µ —А–µ–ґ–µ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ –≥–Њ–і –њ–Њ—Б–ї–µ —Н—В–Њ–≥–Њ (—З–∞—Й–µ, –µ—Б–ї–Є —Б–Є–Љ–њ—В–Њ–Љ—Л –њ–Њ–і–∞–≥—А—Л –Њ—Б—В–∞—О—В—Б—П –∞–Ї—В–Є–≤–љ—Л–Љ–Є) [14]. –°–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Є–Љ –ґ–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –љ–µ —Б–ї–µ–і—Г–µ—В –љ–∞–Ј–љ–∞—З–∞—В—М –£–°–Ґ –њ—А–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –У–£, –њ–∞—Ж–Є–µ–љ—В–∞–Љ –±–µ–Ј —В–Њ—Д—Г—Б–Њ–≤ –Є–ї–Є —Б —А–µ–і–Ї–Є–Љ–Є –≤—Б–њ—Л—И–Ї–∞–Љ–Є –њ–Њ–і–∞–≥—А—Л (–Љ–µ–љ—М—И–µ 2 —А–∞–Ј –≤ –≥–Њ–і). –Ъ–∞–ґ–і—Л–є –±–Њ–ї—М–љ–Њ–є –і–Њ–ї–ґ–µ–љ –њ–Њ–ї—Г—З–Є—В—М –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—О –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є, –Њ –љ–∞–ї–Є—З–Є–Є —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ—Л—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –і–Є–µ—В–Њ—В–µ—А–∞–њ–Є–Є [14].
–£—А–∞—В—Б–љ–Є–ґ–∞—О—Й–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л, –і–Њ—Б—В—Г–њ–љ—Л–µ –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є, вАФ —Н—В–Њ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї –Є —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В, –Є–љ–≥–Є–±–Є—А—Г—О—Й–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —Б–Ь–Ъ. –Р–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї, –∞–љ–∞–ї–Њ–≥ –њ—Г—А–Є–љ–∞ –Є –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –Ї–Њ–љ–Ї—Г—А–µ–љ—В–љ—Л–є –Є–љ–≥–Є–±–Є—В–Њ—А –Ї—Б–∞–љ—В–Є–љ–Њ–Ї—Б–Є–і–∞–Ј—Л (–Ъ–Ю), —П–≤–ї—П–µ—В—Б—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є –£–°–Ґ. –†–µ–Ї–Њ–Љ–µ–љ–і—Г–µ–Љ–∞—П –љ–∞—З–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 100вАУ150 –Љ–≥/—Б—Г—В —Б —В–Є—В—А–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ –Љ–µ—А–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Ї–∞–ґ–і—Л–µ 2вАУ5 –љ–µ–і. –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Г—А–∞—В–Њ–≤ <6,0 –Љ–≥/–і–ї (360 –Љ–Ї–Љ–Њ–ї—М/–ї), –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –і–Њ–Ј–Є—А–Њ–≤–Ї–∞ вАФ 800 –Љ–≥/—Б—Г—В. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–Њ–Ј–∞ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ 100вАУ300 –Љ–≥/—Б—Г—В –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –љ–∞–Ј–љ–∞—З–∞–µ–Љ–∞—П, –љ–Њ –Њ–љ–∞ —З–∞—Й–µ –≤—Б–µ–≥–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞ –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–µ–є –њ–Њ—З–µ–Ї [14]. –Ч–∞–Љ–µ—В–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї—Г—О –љ–µ—Д—А–Њ–њ–∞—В–Є—О –њ—А–µ–њ–∞—А–∞—В –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В. –Ф–Њ–Ј–∞ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П, –Є—Б—Е–Њ–і—П –Є–Ј –Ј–љ–∞—З–µ–љ–Є–є –Ї–ї–Є—А–µ–љ—Б–∞ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞: –µ—Б–ї–Є –Њ–љ –±–Њ–ї–µ–µ 60 –Љ–ї/–Љ–Є–љ, —Б—Г—В–Њ—З–љ–∞—П –і–Њ–Ј–∞ –Љ–Њ–ґ–µ—В —Б–Њ—Б—В–∞–≤–ї—П—В—М 200 –Љ–≥, –Љ–µ–љ–µ–µ 40 –Љ–ї/–Љ–Є–љ вАФ –љ–µ –і–Њ–ї–ґ–љ–∞ –њ—А–µ–≤—Л—И–∞—В—М 100 –Љ–≥, –љ–Є–ґ–µ 10 –Љ–ї/–Љ–Є–љ вАФ 100 –Љ–≥ 1 —А–∞–Ј –≤ 3 –і–љ—П. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є—Е –і–Њ–Ј –Љ–Њ–ґ–µ—В —Г—Б—Г–≥—Г–±–Є—В—М —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –њ–Њ—З–µ—З–љ—Г—О –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М.. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —В–µ–Љ, —З—В–Њ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї –±–ї–Њ–Ї–Є—А—Г–µ—В –њ—Г—А–Є–љ–Њ–≤—Л–є —А–∞—Б–њ–∞–і –і–Њ –Ї—Б–∞–љ—В–Є–љ–∞, —Г—А–Њ–≤–µ–љ—М –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –≤ –Ї—А–Њ–≤–Є –Є –≤ –Љ–Њ—З–µ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ. –Ъ—Б–∞–љ—В–Є–љ–µ–Љ–Є—П –Є –Ї—Б–∞–љ—В–Є–љ—Г—А–Є—П –љ–µ–≥–∞—В–Є–≤–љ–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ –њ–Њ—З–Ї–Є..
–§–µ–±—Г–Ї—Б–Њ—Б—В–∞—В —П–≤–ї—П–µ—В—Б—П –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –Ъ–Ю, –Њ—В–ї–Є—З–љ—Л–Љ –Њ—В –Љ–Њ—З–µ–≤–Њ–≥–Њ –∞–љ–∞–ї–Њ–≥–∞, –Є –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ 2-–є –ї–Є–љ–Є–Є –£–°–Ґ. –Т —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П—Е —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В –љ–µ –Є–љ–≥–Є–±–Є—А—Г–µ—В –і—А—Г–≥–Є–µ —Д–µ—А–Љ–µ–љ—В—Л, —Г—З–∞—Б—В–≤—Г—О—Й–Є–µ –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –њ—Г—А–Є–љ–Њ–≤ –Є–ї–Є –њ–Є—А–Є–Љ–Є–і–Є–љ–Њ–≤. –Я—А–Є–µ–Љ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј—Л —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–∞ 80 –Є–ї–Є 120 –Љ–≥ (1 —В–∞–±–ї–µ—В–Ї–∞ 1 —А/—Б—Г—В) –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б–Ь–Ъ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–Њ–Љ –≤ –і–Њ–Ј–µ 300 –Љ–≥/—Б—Г—В [15]. –Э–∞–ї–Є—З–Є–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –љ–∞ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї –љ–µ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –њ—А–Є–µ–Љ—Г —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–∞. –Ю–љ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞—Б—Б–Љ–Њ—В—А–µ–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ 1-–є –ї–Є–љ–Є–Є –£–°–Ґ –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –њ–Њ—З–µ–Ї, —В–∞–Ї –Ї–∞–Ї –Є–Љ–µ–µ—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –Њ—В—Б—Г—В—Б—В–≤–Є—О –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –≤ —В–Є—В—А–∞—Ж–Є–Є –Є –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –і–Њ–Ј—Л –Њ—В —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї, –Њ–њ—В–Є–Љ–∞–ї–µ–љ –њ–Њ –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є.. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О —Б–µ—А–і—Ж–∞ –Є–ї–Є —Б–µ—А–і–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ. –°–°–Ч —А–∞–Ј–≤–Є–≤–∞—О—В—Б—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —П–≤–љ–Њ–є –њ–Њ–і–∞–≥—А–Њ–є. –•–Њ—В–µ–ї–Њ—Б—М –±—Л –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б —В—П–ґ–µ–ї—Л–Љ –°–°–Ч (–љ–µ–і–∞–≤–љ–Є–є –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П —Б–µ—А–і–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞) –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–∞ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Њ, –Њ–і–љ–∞–Ї–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–°–Ч –±–Њ–ї–µ–µ –ї–µ–≥–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –µ—Й–µ –≤—Л—И–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П —Б–Ь–Ъ, –∞ –Ј–љ–∞—З–Є—В (—З—В–Њ —Б–Њ–≥–ї–∞—Б—Г–µ—В—Б—П —Б —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ–Є FDA), –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М –њ—А–Є–Ј–љ–∞–Ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —Г—Е—Г–і—И–µ–љ–Є—П CC–Ч, –љ–Њ –љ–µ–ї—М–Ј—П –Њ—В–Љ–µ–љ—П—В—М —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В.. –Р —Б —Г—З–µ—В–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є —Г–і–Њ–±—Б—В–≤–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –µ–≥–Њ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –Ї–∞–Ї –њ—А–µ–њ–∞—А–∞—В –≤—Л–±–Њ—А–∞, –Ї–Њ—В–Њ—А—Л–є –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Љ–Њ–ґ–µ—В –≤–љ–µ—Б—В–Є —Б–µ—А—М–µ–Ј–љ—Л–є –≤–Ї–ї–∞–і –≤ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є—Б–Ї–Њ–≤ –Ї–∞—В–∞—Б—В—А–Њ—Д –Є —Б–Љ–µ—А—В–Є –Њ—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –њ—А–Є—З–Є–љ вАФ –≤–µ–і—М –Є–Љ–µ–љ–љ–Њ –Њ—В —Н—В–Њ–≥–Њ –њ–Њ–≥–Є–±–∞—О—В –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–∞–≥—А–Њ–є.. –Ф–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —А–µ–Љ–Є—Б—Б–Є–µ–є, –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –£–°–Ґ (–љ–∞–њ—А–Є–Љ–µ—А, –±–µ–Ј –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Б—Г—Б—В–∞–≤–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –≤ —В–µ—З–µ–љ–Є–µ вЙ•1 –≥–Њ–і–∞ –Є –±–µ–Ј —В–Њ—Д—Г—Б–Њ–≤), –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –£–°–Ґ –Є–ї–Є —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ–Ј—Л –њ—А–Є–Љ–µ–љ—П–µ–Љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ [14]. –Т –†–§ —Б 2018 –≥.. –і–Њ—Б—В—Г–њ–µ–љ –њ–µ—А–≤—Л–є –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–є –њ—А–µ–њ–∞—А–∞—В —Б –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ –≤–µ—Й–µ—Б—В–≤–Њ–Љ —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В вАФ –Р–Ј—Г—А–Є–Ї—Б¬Ѓ, –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–љ—Л–є –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —В—А–µ–±–Њ–≤–∞–љ–Є—П–Љ–Є –Я—А–∞–≤–Є–ї –љ–∞–і–ї–µ–ґ–∞—Й–µ–є –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–µ–љ–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є (GMP –†–§) [16, 17].
–Я—А–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є–ї–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б—В–Њ–Є—В –њ–Њ–і—Г–Љ–∞—В—М –Њ–± –Є–Ј–Љ–µ–љ–µ–љ–Є–Є —Б—В—А–∞—В–µ–≥–Є–Є –£–°–Ґ. –£—А–Є–Ї–Њ–Ј—Г—А–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ—А–Є–Љ–µ–љ—П—В—М –Њ—В–і–µ–ї—М–љ–Њ –Њ—В –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞/—Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–∞ –Є–ї–Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –љ–Є–Љ–Є —В–µ–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ъ–Ю –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –і–Њ—Б—В–Є—З—М —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ (<6 –Љ–≥/–і–ї), –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Г—О –њ–µ—А–µ–љ–Њ—Б–Є–Љ—Г—О –Є–ї–Є —Г–Ї–∞–Ј–∞–љ–љ—Г—О –і–Њ–Ј–Є—А–Њ–≤–Ї—Г [14]. –Ю–і–љ–∞–Ї–Њ –≤ –†–Њ—Б—Б–Є–Є, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –і–∞–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –љ–µ–і–Њ—Б—В—Г–њ–љ—Л –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О.
–Т –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ 3-–є –ї–Є–љ–Є–Є —В–µ—А–∞–њ–Є–Є –≤—Л—Б—В—Г–њ–∞–µ—В –њ–µ–≥–ї–Њ—В–Є–Ї–∞–Ј–∞.. –Я—А–µ–њ–∞—А–∞—В –њ–Њ–Ї–∞–Ј–∞–љ –≤ —Б–ї—Г—З–∞—П—Е, –µ—Б–ї–Є –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –Ъ–Ю, —Г—А–Є–Ї–Њ–Ј—Г—А–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є –і—А—Г–≥–Є–Љ–Є –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞–Љ–Є –љ–µ —Г–і–∞–ї–Њ—Б—М –і–Њ—Б—В–Є—З—М —Ж–µ–ї–µ–≤—Л—Е –Ј–љ–∞—З–µ–љ–Є–є —Б–Ь–Ъ, –∞ —В–∞–Ї–ґ–µ –µ—Б–ї–Є —З–∞—Б—В–Њ—В–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –њ–Њ–і–∞–≥—А—Л –≤ –≥–Њ–і –њ—А–µ–≤—Л—И–∞–µ—В 2 –≤—Б–њ—Л—И–Ї–Є –Є–ї–Є –Є–Љ–µ—О—В—Б—П –љ–µ—А–∞–Ј—А–µ—И–Є–Љ—Л–µ –њ–Њ–і–Ї–Њ–ґ–љ—Л–µ —В–Њ—Д—Г—Б—Л [14].
–Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –і–ї—П –ї–µ—З–µ–љ–Є—П –њ—А–Є—Б—В—Г–њ–∞ –Њ—Б—В—А–Њ–≥–Њ –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В—А–Є—В–∞ —П–≤–ї—П—О—В—Б—П –Э–Я–Т–Я, –Ї–Њ–ї—Е–Є—Ж–Є–љ –Є –Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л (–њ–µ—А–Њ—А–∞–ї—М–љ–Њ, –≤–љ—Г—В—А–Є—Б—Г—Б—В–∞–≤–љ–Њ, –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ, –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ). –Я—А–Є –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Њ–±–Њ—Б—В—А–µ–љ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ –Ш–Ы-1 –Є–ї–Є –Р–Ъ–Ґ–У [14].
–Я—А–Њ–±–µ–ї—Л –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є
–£—А–∞—В—Б–љ–Є–ґ–∞—О—Й–∞—П —В–µ—А–∞–њ–Є—П —З–∞—Б—В–Њ –њ–ї–Њ—Е–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П, –∞ —Б—В—А–∞—В–µ–≥–Є—П ¬Ђ–ї–µ—З–µ–љ–Є–µ –і–Њ —Ж–µ–ї–Є¬ї —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ –љ–µ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –≤–µ–і–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е –њ–Њ–і–∞–≥—А–Њ–є. –Ь–Њ–ґ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Д–∞–Ї—В–Њ—А–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–Є—Е —Н—В—Г –њ—А–Њ–±–ї–µ–Љ—Г.
–Э–µ—Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –њ–Њ –ї–µ—З–µ–љ–Є—О –њ–Њ–і–∞–≥—А—Л
–Я—А–Є–≤–µ–і–µ–љ–љ—Л–µ –≤—Л—И–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В —Ж–µ–ї–µ–≤—Г—О —Б—В—А–∞—В–µ–≥–Є—О –ї–µ—З–µ–љ–Є—П –У–£. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ J. Sautner –Є T. Sautner –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤ —Г—З—А–µ–ґ–і–µ–љ–Є—П—Е –њ–µ—А–≤–Є—З–љ–Њ–є –Љ–µ–і–Є–Ї–Њ-—Б–∞–љ–Є—В–∞—А–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є, –≥–і–µ –ї–µ—З–∞—В—Б—П –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –±–Њ–ї—М–љ—Л—Е –њ–Њ–і–∞–≥—А–Њ–є, —Г—А–Њ–≤–µ–љ—М —Б–Ь–Ъ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П –µ–ґ–µ–≥–Њ–і–љ–Њ —В–Њ–ї—М–Ї–Њ —Г —З–µ—В–≤–µ—А—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [18]. –Ф—А—Г–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Љ–µ–љ–µ–µ 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ—Б—В–Є–≥–ї–Є —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –Є–ї–Є –Є–Ј–±–∞–≤–Є–ї–Є—Б—М –Њ—В –Њ–±–Њ—Б—В—А–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ 12 –Љ–µ—Б. [19, 20]. –Т —Ж–µ–ї–Њ–Љ –≤—А–∞—З–Є –≤ —Г—З—А–µ–ґ–і–µ–љ–Є—П—Е –њ–µ—А–≤–Є—З–љ–Њ–є –Љ–µ–і–Є–Ї–Њ-—Б–∞–љ–Є—В–∞—А–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є –љ–µ —Б–Њ–±–ї—О–і–∞—О—В –љ–∞—Г—З–љ–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ—Г –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –£–°–Ґ [17].
–Э–µ–њ–Њ—Б—В–Њ—П–љ–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Г—А–∞—В—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞—П –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–∞)
D. Hill-McManus et al. [21] —Г—Б—В–∞–љ–Њ–≤–Є–ї–Є, —З—В–Њ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–µ—А—Л–≤ –≤ –њ—А–Є–µ–Љ–µ –Є –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞–ї–Њ –њ–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П –£–°–Ґ, —В. –µ. –±—Л–ї –Њ–і–љ–Њ–Ї—А–∞—В–љ—Л–є –Є—Е –Њ—В–њ—Г—Б–Ї —В–Њ–ї—М–Ї–Њ –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–є –≤—Л–њ–Є—Б–Ї–µ —А–µ—Ж–µ–њ—В–∞. –Я–ї–Њ—Е–Њ–µ —Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–µ–ґ–Є–Љ–∞ –ї–µ—З–µ–љ–Є—П —В–∞–Ї–ґ–µ —Б–≤—П–Ј–∞–љ–Њ —Б –љ–µ–Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ —Б–Ь–Ъ. –С–Њ–ї—М–љ—Л–µ –њ–Њ–і–∞–≥—А–Њ–є –љ–µ–Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ —Б–Њ–Њ–±—Й–∞–ї–Є –Њ –≤—Б–њ—Л—И–Ї–∞—Е –±–Њ–ї–µ–Ј–љ–Є. –І–∞—Б—В—Л–µ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –Є –њ—А–Є—Б—В—Г–њ—Л –∞—А—В—А–Є—В–∞ —Б–љ–Є–ґ–∞—О—В –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є. –Ю–±–Њ—Б—В—А–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞—О—В—Б—П, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ—А–Є–µ–Љ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞, —З—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є, –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ –њ–Њ–і–Њ–±—А–∞–љ–љ–Њ–є –і–Њ–Ј–µ –њ—А–µ–њ–∞—А–∞—В–∞ (–Њ—В—Б—Г—В—Б—В–≤–Є–µ —В–Є—В—А–Њ–≤–∞–љ–Є—П), —Н—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –Ј–љ–∞–љ–Є–Є –њ—А–Є–љ—Ж–Є–њ–Њ–≤ –ї–µ—З–µ–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є –Є –љ–µ–Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –£–°–Ґ –Є–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–∞ –Њ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П—Е –љ–µ–њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ –Є –љ–µ—А–µ–≥—Г–ї—П—А–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П (–Ї–Њ–≥–і–∞ –њ–∞—Ж–Є–µ–љ—В—Л —Б–∞–Љ–Є –≤–Љ–µ—И–Є–≤–∞—О—В—Б—П –Є –Љ–µ–љ—П—О—В —Б—Е–µ–Љ—Г –њ—А–Є–µ–Љ–∞ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞) [22].
–§–∞–Ї—В–Њ—А—Л –≤—А–∞—З–∞
–Я–Њ–Љ–Є–Љ–Њ –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–∞ –ї–µ—З–µ–љ–Є—О, –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Є–≤–љ–Њ—Б—В—М –£–°–Ґ –≤–ї–Є—П–µ—В –Є –≤—А–∞—З–µ–±–љ—Л–є —Д–∞–Ї—В–Њ—А. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –≤ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е –≤—Г–Ј–∞—Е –њ—А–Њ–≤–Њ–і–Є—В—Б—П –љ–µ—Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–∞—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–∞ –њ–Њ –ї–µ—З–µ–љ–Є—О –њ–Њ–і–∞–≥—А—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤—А–∞—З–Є –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –љ–µ –≤—Б–µ–≥–і–∞ –њ—А–∞–≤–Є–ї—М–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—О—В –≤–∞–ґ–љ–Њ—Б—В—М —Б–Ї—А—Л—В—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –Њ—А–≥–∞–љ–Њ–≤ –њ—А–Є –њ–Њ–і–∞–≥—А–µ (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б—Г—Б—В–∞–≤–Њ–≤), —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —В–Њ–Љ—Г, —З—В–Њ –≤—А–∞—З —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В –њ–Њ–і–∞–≥—А—Г –Њ—В–і–µ–ї—М–љ–Њ –Њ—В —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є–ї–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –°—В—А–µ–Љ–ї–µ–љ–Є–µ –Ї –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є—О –Ї—А–Є—Б—В–∞–ї–ї–Њ–≤ –Ь–£–Э —Г –≤—А–∞—З–µ–є –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј–∞—В—М—Б—П –љ–µ—А–µ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –Є–Ј-–Ј–∞ —З—А–µ–Ј–Љ–µ—А–љ–Њ–є –Ј–∞–≥—А—Г–ґ–µ–љ–љ–Њ—Б—В–Є –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є—П –Њ–њ—Л—В–∞ (–Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Є –њ–Њ—А–∞–ґ–µ–љ–Є–Є –љ–µ–±–Њ–ї—М—И–Є—Е —Б—Г—Б—В–∞–≤–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї –њ–µ—А–≤—Л–є –њ–ї—О—Б–љ–µ–≤–Њ–є —Д–∞–ї–∞–љ–≥–Њ–≤—Л–є). –Ь–µ–ґ–і—Г —В–µ–Љ –≤—А–∞—З –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –і–Њ–ї–ґ–µ–љ –њ—А–∞–≤–Є–ї—М–љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М –∞–љ–∞–Љ–љ–µ–Ј, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П (–њ—А–Є –Њ—Б—В—А–Њ–Љ –њ—А–Є—Б—В—Г–њ–µ –њ–Њ–і–∞–≥—А—Л), –і–∞–љ–љ—Л–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Є —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —З—В–Њ–±—Л —Б–≤–Њ–µ–≤—А–µ–Љ–µ–љ–љ–Њ –Ј–∞–њ–Њ–і–Њ–Ј—А–Є—В—М –њ–Њ–і–∞–≥—А—Г –Є –љ–∞–њ—А–∞–≤–Є—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –Ї —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥—Г.. –Ф–∞–ґ–µ –Ї–Њ–≥–і–∞ –£–°–Ґ –Є–љ–Є—Ж–Є–Є—А–Њ–≤–∞–љ–∞, –Њ–љ–∞ —З–∞—Б—В–Њ –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –≤ —Д–Є–Ї—Б–Є—А–Њ–≤–∞–љ–љ–Њ–є –і–Њ–Ј–µ, –Ї–Њ—В–Њ—А–∞—П –љ–µ —В–Є—В—А—Г–µ—В—Б—П –і–Њ–ї–ґ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –і–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞—О—В –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ [23, 24].
–Я—Г—В–Є –њ–Њ–≤—Л—И–µ–љ–Є—П –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—О –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –њ—А–Є—Б—В—Г–њ–Њ–≤ –њ–Њ–і–∞–≥—А—Л –њ—А–Є –£–°–Ґ
–Ш–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–± –Њ–ґ–Є–і–∞–µ–Љ–Њ–Љ —Г—З–∞—Й–µ–љ–Є–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є –≤ –љ–∞—З–∞–ї–µ –£–°–Ґ –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є—Е —А–∞–Ј–≤–Є—В–Є—П –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –њ—А–Є–µ–Љ–∞ –Ї–Њ–ї—Е–Є—Ж–Є–љ–∞ –Љ–Њ–≥—Г—В —Г–ї—Г—З—И–Є—В—М –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є—О.. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ–ї—Е–Є—Ж–Є–љ–∞ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Б –љ–∞—З–∞–ї–Њ–Љ –£–°–Ґ –њ–Њ–Ї–∞–Ј–∞–ї–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –≤ –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є –µ—Й–µ –љ–∞—З–Є–љ–∞—П —Б 1960-—Е
–≥–Њ–і–Њ–≤ [25, 26].
–Т —В—А–µ—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, —Б—А–∞–≤–љ–Є–≤–∞–≤—И–Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–∞ –Є –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ (APEX [27], FACT [28] –Є CONFIRMS [29]), –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –Ї–Њ–ї—Е–Є—Ж–Є–љ –Є–ї–Є –љ–Є–Ј–Ї–Є–µ –і–Њ–Ј—Л –Э–Я–Т–Я. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е APEX –Є FACT, –≤ –Ї–Њ—В–Њ—А—Л—Е –њ–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ—Л –і–ї—П –њ–Њ–ї—Г—З–µ–љ–Є—П —А–∞–Ј–љ—Л—Е –і–Њ–Ј –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ –Є —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–∞, –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –њ—А–Є–љ–Є–Љ–∞—В—М –ї–Є–±–Њ –Ї–Њ–ї—Е–Є—Ж–Є–љ 0,6 –Љ–≥ 1 —А/—Б—Г—В, –ї–Є–±–Њ –љ–∞–њ—А–Њ–Ї—Б–µ–љ 250 –Љ–≥ 2 —А/—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–Є–Њ–і–∞ –≤—Л–Љ—Л–≤–∞–љ–Є—П –Є –њ–µ—А–≤—Л—Е 8 –љ–µ–і. –£–°–Ґ –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ—А–Є –њ–Њ–і–∞–≥—А–µ. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CONFIRMS –њ–∞—Ж–Є–µ–љ—В—Л –њ—А–Њ–і–Њ–ї–ґ–∞–ї–Є –њ–Њ–ї—Г—З–∞—В—М –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –Я—А–Є —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –њ–Њ–≤—В–Њ—А–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є FACT, APEX –Є CONFIRMS –≤—Л—П–≤–Є–ї–Њ—Б—М, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є —А–µ–Ј–Ї–Њ –≤–Њ–Ј—А–Њ—Б–ї–∞ –і–Њ 40% –Ї –Ї–Њ–љ—Ж—Г 8-–є –љ–µ–і–µ–ї–Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е FACT –Є APEX, –Ї–Њ–≥–і–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –±—Л–ї–∞ –њ—А–µ–Ї—А–∞—Й–µ–љ–∞. –Ю–і–љ–∞–Ї–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є CONFIRMS —З–∞—Б—В–Њ—В–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –±—Л–ї–∞ –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ –љ–Є–Ј–Ї–Њ–є (3вАУ5%) –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 6 –Љ–µ—Б. –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є..
–Э–∞ –Ї–∞—Д–µ–і—А–µ —Д–∞–Ї—Г–ї—М—В–µ—В—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –§–У–Р–Ю–£ –Т–Ю –†–Э–Ш–Ь–£ –Є–Љ. –Э.–Ш. –Я–Є—А–Њ–≥–Њ–≤–∞ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Ї–Њ–≥–Њ—А—В–љ–Њ–µ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, —Ж–µ–ї—М—О –Ї–Њ—В–Њ—А–Њ–≥–Њ –±—Л–ї–∞ –Њ—Ж–µ–љ–Ї–∞ 12-–љ–µ–і–µ–ї—М–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —Б–Њ—З–µ—В–∞–љ–љ–Њ–є –£–°–Ґ –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–Њ–Љ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –і–Њ–Ј—Л –і–Њ 300 –Љ–≥/—Б—Г—В –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ 7,5 –Љ–≥/—Б—Г—В. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —Б–і–µ–ї–∞–љ—Л –≤—Л–≤–Њ–і—Л –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П –Љ–Њ–ґ–µ—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –њ—А–Є—Б—В—Г–њ—Л –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В—А–Є—В–∞ –Є —Г–ї—Г—З—И–Є—В—М –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е –њ–Њ–і–∞–≥—А–Њ–є [30].
–Т–µ–і–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–∞–≥—А–Њ–є –Є —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є
–Р—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї—П –Є –Њ–ґ–Є—А–µ–љ–Є–µ —П–≤–ї—П—О—В—Б—П —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–і–∞–≥—А—Л [31]. –Я–∞—Ж–Є–µ–љ—В—Л —Б –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ —З–∞—Б—В–Њ —Б—В—А–∞–і–∞—О—В –•–С–Я, –љ–Њ –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –њ–Њ—З–µ–Ї –Љ–Њ–ґ–µ—В –љ–∞—Б—В—Г–њ–Є—В—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б ¬Ђ–Є–Ј–Њ–ї–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є¬ї –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є (–Є–Ј —З–Є—Б–ї–∞ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е) –≤ —В–µ—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є, –∞ –њ—А–Є —Б–Њ—З–µ—В–∞–љ–Є–Є —Н—В–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є вАФ –≥–Њ—А–∞–Ј–і–Њ –±—Л—Б—В—А–µ–µ [32, 33].
–Э–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –•–С–Я –≤–ї–Є—П–µ—В –љ–∞ –≤—Л–±–Њ—А –£–°–Ґ,
–∞ –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –њ—А–µ–њ–∞—А–∞—В—Л –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ—А–Є—Б—В—Г–њ–Њ–≤ –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В—А–Є—В–∞ –Є –њ–Њ–≤—Л—И–∞—В—М –і–Њ–Ј—Г –∞–ї–ї–Њ–њ—Г—А–Є–љ–Њ–ї–∞ (–њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Д–µ–±—Г–Ї—Б–Њ—Б—В–∞—В–∞ —Н—В–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ) [34, 35]. –°–љ–Є–ґ–µ–љ–Є–µ —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –•–С–Я —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ–і–∞–≥—А–Њ–є –Ј–∞–≤–Є—Б–Є—В –Њ—В —Г—Б–њ–µ—Е–∞ –£–°–Ґ –њ—А–Є —Г—Б–ї–Њ–≤–Є–Є –µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П [36]. –Я—А–Є —Н—В–Њ–Љ –љ–µ —Б—В–Њ–Є—В –Ј–∞–±—Л–≤–∞—В—М, —З—В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –њ–Њ–і–∞–≥—А—Л —Г –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В —В–∞–Ї–Њ–≤–Њ–є —Г –ї—О–і–µ–є —Б—А–µ–і–љ–µ–≥–Њ –Є –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –ї–∞—В–µ–љ—В–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ —Б –љ–µ–±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Њ—Б—В—А—Л—Е —Б—Г—Б—В–∞–≤–љ—Л—Е –∞—В–∞–Ї, –љ–Њ –љ–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є —В—А–µ–±—Г–µ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є —В–µ—А–∞–њ–Є–Є [37]. –Т—А–∞—З–∞–Љ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ —Б–ї–µ–і—Г–µ—В –≤–љ–Є–Љ–∞—В–µ–ї—М–љ–Њ —Б–ї–µ–і–Є—В—М –Ј–∞ –ї–µ—З–µ–љ–Є–µ–Љ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є, –і–Є–∞–±–µ—В–∞, –≥–Є–њ–µ—А–ї–Є–њ–Є–і–µ–Љ–Є–Є –Є –Њ–ґ–Є—А–µ–љ–Є—П —Г —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [38].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–і–∞–≥—А–∞ вАФ —Н—В–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –∞—А—В—А–Є—В, —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –Љ—Г—З–Є—В–µ–ї—М–љ–Њ–є –±–Њ–ї—М—О, –љ–Є–Ј–Ї–Є–Љ –Ї–∞—З–µ—Б—В–≤–Њ–Љ –ґ–Є–Ј–љ–Є –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ–Є –Ј–∞—В—А–∞—В–∞–Љ–Є –љ–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ –Њ–±—Б–ї—Г–ґ–Є–≤–∞–љ–Є–µ. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–∞–ї–Є—З–Є–µ —З–µ—В–Ї–Є—Е —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤ –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤ –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–Њ–і–∞–≥—А—Л, –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —З–∞—Б—В–Њ –љ–µ –і–Њ—Б—В–Є–≥–∞—О—В—Б—П.. –Я—А–Є—З–Є–љ—Л —Н—В–Њ–≥–Њ –Љ–љ–Њ–≥–Њ—Д–∞–Ї—В–Њ—А–љ—Л–µ –Є –≤–Ї–ї—О—З–∞—О—В –≤ —Б–µ–±—П –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Њ–±—Г—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є—Е –≤–µ–і–µ–љ–Є–µ, –љ–µ—Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–µ–ґ–Є–Љ–∞ –£–°–Ґ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є–Ј-–Ј–∞ —Г—З–∞—Й–µ–љ–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є–є –њ–Њ–і–∞–≥—А—Л –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –њ—А–Є–µ–Љ–∞ –£–°–Ґ (–Њ –Ї–Њ—В–Њ—А–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–∞ –љ–µ—А–µ–і–Ї–Њ –љ–µ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—О—В), –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–∞—Е –ї–µ–Ї–∞—А—Б—В–≤, –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–µ –Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ –њ–Њ–≤–Њ–і—Г –±–Њ–ї–µ–Ј–љ–Є –Є –њ—А–Є–µ–Љ–∞ –ї–µ–Ї–∞—А—Б—В–≤, —Г–≤–ї–µ—З–µ–љ–Є–µ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –і–Њ–±–∞–≤–Ї–∞–Љ–Є —Б –љ–µ–і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –∞ —В–∞–Ї–ґ–µ –љ–µ—Е–≤–∞—В–Ї–∞ –≤—А–µ–Љ–µ–љ–Є –і–ї—П –Њ–±—Г—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤.. –Э–∞—З–∞–ї–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞ —Д–Њ–љ–µ –£–°–Ґ, –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–µ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ —Ж–µ–ї–µ–≤–Њ–≥–Њ —Г—А–Њ–≤–љ—П —Б–Ь–Ъ –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –њ—А–Є—Б—В—Г–њ—Л –њ–Њ–і–∞–≥—А–Є—З–µ—Б–Ї–Њ–≥–Њ –∞—А—В—А–Є—В–∞ –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –†–µ–≥—Г–ї—П—А–љ–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–Љ–Њ–ґ–µ—В –≤—А–∞—З–∞–Љ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –њ—А–Є–љ—П—В—М –∞–і–µ–Ї–≤–∞—В–љ–Њ–µ, –њ—А–∞–≤–Є–ї—М–љ–Њ–µ —А–µ—И–µ–љ–Є–µ –њ–Њ –њ–Њ–≤–Њ–і—Г –ї–µ—З–µ–љ–Є—П –њ–Њ–і–∞–≥—А—Л –Є –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є.
–С–ї–∞–≥–Њ–і–∞—А–љ–Њ—Б—В—М
–Р–≤—В–Њ—А—Л –Є —А–µ–і–∞–Ї—Ж–Є—П –±–ї–∞–≥–Њ–і–∞—А—П—В –Р–Ю ¬Ђ–Р–Ы–Ш–£–Ь¬ї –Ј–∞ –њ—А–µ–і–Њ—Б—В–∞–≤–ї–µ–љ–Є–µ –њ–Њ–ї–љ—Л—Е —В–µ–Ї—Б—В–Њ–≤ –Є–љ–Њ—Б—В—А–∞–љ–љ—Л—Е —Б—В–∞—В–µ–є, —В—А–µ–±–Њ–≤–∞–≤—И–Є—Е—Б—П –і–ї—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є –і–∞–љ–љ–Њ–є –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є.












