Введение
Внедрение генно-инженерных биологических препаратов (ГИБП) в практику лечения ревматоидного артрита (РА) позволило значительно улучшить результаты у пациентов, не отвечавших на традиционную базисную терапию. Однако применение этих лекарственных средств связано со значительным возрастанием расходов на лечение. К настоящему времени сроки действия патентов на большинство ГИБП, используемых в ревматологии, истекли, что позволяет воспроизводить эти важные лекарственные средства. Появление воспроизведенных препаратов на рынке, как показывает опыт, приводит к значительному снижению расходов на лечение [1].
Однако воспроизведение ГИБП имеет ряд существенных особенностей. Воспроизведенный низкомолекулярный препарат (дженерик) точно повторяет химическую структуру оригинала. Для белковых молекул, каковыми являются ГИБП, совпадение аминокислотной последовательности не гарантирует сходство трехмерной структуры белка, определяющей его фармакологические свойства. Поэтому при воспроизведении ГИБП от биосимиляра требуется не только доказательство сходства ключевых химических и физико-химических характеристик, но и подтверждение терапевтической эквивалентности. Для этого (в отличие от дженериков) предполагаемые биосимиляры изучаются в значительных по объему рандомизированных клинических исследованиях (РКИ) III фазы [1].
Первый биосимиляр для лечения РА (инфликсимаб) был одобрен Европейским агентством лекарственных средств (European Medicines Agency, EMA) в 2013 г. [2]. С этого момента число биоаналогов ГИБП стало быстро возрастать, и в настоящее время они играют значительную роль в лечении ревматических заболеваний.
Препарат ритуксимаб, представляющий собой химерное моноклональное антитело к поверхностной молекуле CD20 B-лимфоцитов, был зарегистрирован EMA для лечения РА в 2006 г. В 2017 г. в Российской Федерации для лечения РА и АНЦА-ассоциированного системного васкулита был зарегистрирован первый российский биоаналог препарата Ацеллбия®. Полный цикл разработки препарата, а также его производство осуществляются на территории Российской Федерации компанией BIOCAD. Масштабное 48-недельное исследование III фазы BIORA не выявило различий в клинической эффективности и безопасности биоаналога Ацеллбия® и препарата-оригинатора Мабтера®, выявило отсутствие влияния переключения с одного препарата на другой на параметры эффективности, безопасности и иммуногенности [3]. Тем не менее с учетом биологической природы препаратов наличие таких различий возможно. Поэтому накопление сравнительных данных, особенно в условиях реальной практики, представляет большой интерес.
Цель исследования: оценить эффективность и безопасность переключения с препарата Мабтера® (оригинальный препарат ритуксимаба) на его биоаналог (Ацеллбия®) у пациентов с РА в условиях реальной клинической практики.
Материал и методы
Произведен анализ данных из Московского единого регистра артритов (МЕРА). В регистре наблюдаются пациенты, получающие ГИБП или таргетные синтетические противовоспалительные препараты в счет бюджетных средств, проживающие в г. Москве и давшие информированное согласие на участие в исследовании.
Для анализа отобраны следующие пациенты:
соответствующие критериям РА Американской ревматологической ассоциации (American Rheumatism Association, ARA) 1987 г. или Американского колледжа ревматологии / Европейской лиги против ревматизма (American College of Rheumatology / European League Against Rheumatism, ACR/EULAR) 2010 г.;
получившие хотя бы один курс лечения оригинальным препаратом ритуксимаба и впоследствии переключенные на лечение биоаналогом;
совершившие хотя бы один визит на фоне лечения оригинальным препаратом ритуксимаба не менее чем через 6 мес. после его начала;
совершившие хотя бы один визит на фоне лечения биоаналогом не менее чем через 6 мес. после его начала.
Ритуксимаб вводился в виде одной или двух (с интервалом в 2 нед.) инфузий с разовой дозой 500–1000 мг и внутривенной премедикацией метилпреднизолоном (100–250 мг).
Оценка эффективности препаратов осуществлялась по данным последнего завершенного визита на фоне лечения соответствующим препаратом. На каждом визите пациенты с помощью анкеты опрашивались обо всех клинически значимых событиях, произошедших с момента предшествовавшего визита. Данные о нежелательных явлениях (НЯ) анализировались за весь период применения соответствующего препарата. Из анализа исключены сообщения об острых респираторных заболеваниях.
В ходе визитов всем больным проводилось стандартное обследование, включавшее в том числе определение числа припухших суставов и числа болезненных суставов (ЧБС), исследование скорости оседания эритроцитов, С-реактивного белка. Эффективность лечения оценивалась по композитному индексу DAS28 и показателям опросников HAQ-DI (Health Assessment Questionnaire disability index), RAPID-3 (Routine Assessment of Patient Index Data 3).
Пациенты с пропущенными данными исключались из анализа. Для обработки данных была использована программа IBM SPSS Statistic 22 (2013). Для оценки значимости различий в количественных показателях до и после переключения использовался Т-критерий для связанных выборок. Оценка значимости динамики качественных показателей проведена с помощью точного критерия Фишера. Значимость изменения дозы препарата оценивалась с помощью метода непараметрической корреляции Пирсона.
Результаты
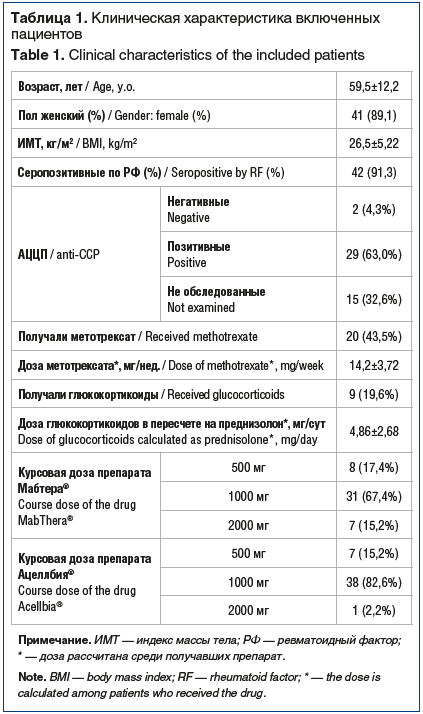
В исследование было включено 46 амбулаторных пациентов, которым в начале лечения назначался оригинальный препарат ритуксимаба, а затем пациенты были переключены на биоаналог. Средняя длительность терапии на оригинальном препарате ритуксимаба до переключения составила 36,8±26,8 мес. Средний период наблюдения пациентов на терапии биоаналогом — 12,2±6,18 мес. Объем наблюдения на лечении оригинальным препаратом ритуксимаба и биоаналогом составил 141 и 46 пациенто-лет соответственно (общий объем — 187 пациенто-лет). У 20 пациентов (43,5%) ранее отмечалась неэффективность или непереносимость других ГИБП. Доля пациентов, получавших сопутствующую терапию глюкокортикоидами, составила 19,6% (9 пациентов), 43,5% (20 пациентов) получали метотрексат в различных дозировках. Клиническая характеристика пациентов приведена в таблице 1. Доза ритуксимаба в процессе лечения изменялась: она снижалась в случае устойчивого достижения низкой активности заболевания или ремиссии и могла увеличиваться в случае повышения уровня активности заболевания выше целевого в процессе лечения. В таблице 1 приведены дозы ритуксимаба на момент последнего завершенного визита, на котором оценивалась клиническая эффективность лечения. Выявлено статистически значимое снижение дозы ритуксимаба после переключения (p=0,002).
При оценке динамики показателей DAS28, HAQ-DI и RAPID3 установлено, что переключение с оригинального препарата ритуксимаба на биоаналог не сопровождалось снижением эффективности лечения (табл. 2). Более того, численно средние значения указанных индексов активности и функциональной способности были несколько меньше на фоне продолжающейся терапии биоаналогом. Однако достоверных различий зарегистрировано не было. Отмечено статистически значимое увеличение числа пациентов с низкой активностью заболевания (DAS28 <3,2) и ремиссией (DAS28 <2,6). Доля лиц с низкой активностью болезни после переключения возросла с 39,1% до 52,2%, а процент больных в ремиссии — с 17,4% до 23,9% (см. табл. 2). Увеличение частоты положительного ответа на проводимое лечение, очевидно, связано с длительностью использования ритуксимаба в целом, а не с переключением с одного препарата на другой.

Ни у одного пациента биоаналог не был отменен по причине недостаточной эффективности.
Краткое описание наблюдавшихся НЯ приведено в таблице 3. В период применения оригинального препарата ритуксимаба у анализируемых пациентов было зарегистрировано 13 НЯ (встречаемость — 9,22 на 100 пациенто-лет) у 5 пациентов (10,9%), из которых 2 были расценены как серьезные. За время лечения биоаналогом было отмечено 5 НЯ (10,9 на 100 пациенто-лет) у 4 пациентов (8,7%), ни одно из них не было расценено как серьезное. Не было зарегистрировано значимых инфузионных реакций, НЯ, потребовавших прекращения лечения, и летальных исходов.

Обсуждение
В настоящем исследовании на основании анализа данных из регистра пациентов с РА было продемонстрировано сохранение клинического эффекта после переключения больных с терапии оригинальным препаратом ритуксимаба на биоаналог. Показатели активности заболевания и функциональной способности по крайней мере не ухудшились после переключения.
Более того, возросли доли пациентов, достигших низкой активности заболевания и ремиссии по критерию DAS28. Такая динамика не может рассматриваться как превосходство биоаналога над оригинальным препаратом ритуксимаба. Следует иметь в виду, что во всех случаях биоаналог применялся после оригинального препарата. В различных когортах отмечались снижение активности заболевания и возрастание доли пациентов, достигающих целевой активности по мере наблюдения [3]. Такие изменения наблюдались ранее и по регистру МЕРА в целом [4].
Для оценки безопасности препарата исследования реальной практики являются наиболее ценным источником. С одной стороны, они, как правило, более длительные и вследствие этого могут иметь больший объем наблюдения и могут обнаруживать осложнения, частота которых возрастает при длительном лечении. Так, в нашем исследовании общий объем наблюдения — 187 пациенто-лет (в РКИ III фазы BIORA он составил около 148 пациенто-лет) [5]. С другой стороны, в РКИ, как правило, действуют строгие критерии отбора, исключающие пациентов с повышенным риском НЯ. Поэтому профиль безопасности в реальной практике может несколько отличаться от такового в РКИ. Проведенный анализ безопасности не выявил существенных различий между препаратами исследования. Общая встречаемость НЯ практически была сопоставима.
Заключение
Суммируя данные проведенного анализа, можно констатировать, что наблюдаемые в условиях реальной клинической практики результаты переключения пациентов с РА с оригинального препарата ритуксимаба на биоаналог Ацеллбия® не дают оснований подвергать сомнению их терапевтическую эквивалентность.
Благодарность
Авторы и редакция благодарят компанию БИОКАД, ЗАО (Россия) за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Acknowledgement
The authors and Editorial Board are grateful to Biocad CJSC (Russia) for providing full-text foreign articles required to write the review.
Сведения об автораХ:
Жиляев Евгений Валерьевич — д.м.н., профессор, профессор кафедры ревматологии ФГБОУ ДПО РМАНПО Минздрава России; 125993, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1.; ведущий научный сотрудник НИЛ ревматических болезней ФГАУО ВО РНИМУ
им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; главный врач АО «ЕМЦ»; 129090, Россия, г. Москва, ул. Щепкина, д. 35; ORCID iD 0000-0002-9443-1164.
Кольцова Екатерина Николаевна — заведующая организационно-методическим отделом по ревматологии, ГБУ «НИИОЗММ ДЗМ»; 115088, Россия, г. Москва, ул. Шарикоподшипниковская, д. 9; ORCID iD 0000-0002-5202-4878.
Шмидт Евгения Исаковна — к.м.н., заведующая ревматологическим отделением, ГКБ № 1 им. Н.И. Пирогова; 119049, Россия, г. Москва, Ленинский просп., д. 8; ORCID iD 0000-0001-8814-9704.
Лыткина Каринэ Арнольдовна — к.м.н., заведующая ревматологическим отделением, ГБУЗ «ГКБ № 4 ДЗМ»; 115093, Россия, г. Москва, ул. Павловская, д. 25; ORCID iD 0000-0001-9647-7492.
Лукина Галина Викторовна — д.м.н., профессор, заведующая научно-исследовательским отделом ревматологии, руководитель Московского городского ревматологического центра ГБУЗ МКНЦ имени А.С. Логинова ДЗМ; 111123, Россия, г. Москва, шоссе Энтузиастов, д. 86, стр. 6; ведущий научный сотрудник лаборатории изучения коморбидных инфекций и мониторинга безопасности лекарственной терапииФГБНУ НИИР им. В.А. Насоновой; 115522, Россия, г. Москва, Каширское шоссе, д. 34А; ORCID iD 0000-0001-7958-5926.
Контактная информация: Жиляев Евгений Валерьевич, e-mail: zhilyayevev@mail.ru. Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 20.08.2020, поступила после рецензирования 04.09.2020, принята в печать 11.09.2020.
About the authors:
Eugenii V. Zhilyaev — Dr. of Sci. (Med.), Professor, Professor of the Department of Rheumatology, Russian Medical Academy of Continuous Professional Education: 2/1, bldg. 1, Barrikadnaya str., Moscow, 125993 Russian Federation; Leading Researcher of the Research Laboratory of Rheumatological Diseases, Pirogov Russian National Research Medical University: 1 Ostrovityanova str., Moscow, 117997, Russian Federation; Chief Medical Officer, European Medical Center: 35 Schepkina str., Moscow, 129090, Russian Federation; ORCID iD 0000-0002-9443-1164.
Ekaterina N. Koltsova — Head of the Organizational and Methodological Department of Rheumatology, Research Institute for Healthcare and Medical Management of Moscow Healthcare Department: 9, Sharikopodshipnikovskaya str., Moscow, 115088, Russian Federation; ORCID iD 0000-0002-5202-4878.
Evgeniya I. Shmidt — Cand. of Sci. (Med.), Head of the Department of Rheumatology, City Clinical Hospital No. 1 named after N.I. Pirogov: 8, Leninskii prospect, Moscow, 119049, Russian Federation; ORCID iD 0000-0001-8814-9704.
Karine A. Lytkina — Cand. of Sci. (Med.), Head of the Department of Rheumatology, City Clinical Hospital No.4 of Moscow Healthcare Department: 25, Pavlovskaya str., Moscow, 115093, Russian Federation; ORCID iD 0000-0001-9647-7492.
Galina V. Lukina — Dr. of Sci. (Med.), Professor, Head of the Research Department of Rheumatology, Head of the Moscow City Rheumatology Center, Loginov Moscow Clinical Scientific Center: 86, bldg. 6, Entusiastov road, Moscow, 111123, Russian Federation; Leading Researcher of the Laboratory for the Study of Comorbid Infections and Monitoring the Safety of Medical Therapy, Research Institute of Rheumatology named after V.A. Nasonova: 34A, Kashirskoe road, Moscow, 115522, Russian Federation; ORCID iD 0000-0001-7958-5926.
Contact information: Eugenii V. Zhilyaev, e-mail: zhilyayevev@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 20.08.2020, revised 04.09.20, accepted 11.09.20.












