–°—А–µ–і–Є —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е –Є–Љ–Љ—Г–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ —А–∞–Ј–≤–Є—В–Є—П –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Є–Ј—Г—З–µ–љ–Є–µ –і–µ—Д–µ–Ї—В–Њ–≤ –Т––Ї–ї–µ—В–Њ—З–љ–Њ–є —А–µ–≥—Г–ї—П—Ж–Є–Є –≤—Л–Ј—Л–≤–∞–µ—В –Њ—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —А–∞–Ј—А–∞–±–Њ—В–Ї–Є –љ–Њ–≤—Л—Е –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –њ–Њ–і—Е–Њ–і–Њ–≤ –Ї –ї–µ—З–µ–љ–Є—О [1]. –Э–∞–њ–Њ–Љ–љ–Є–Љ, —З—В–Њ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В—Л – –Ї–ї–µ—В–Ї–Є –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, —Г—З–∞—Б—В–≤—Г—О—Й–Є–µ –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –∞–і–∞–њ—В–Є–≤–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞, –Њ–±—А–∞–Ј—Г—О—В—Б—П –Є–Ј –≥–µ–Љ–Њ–њ–Њ—Н—В–Є—З–µ—Б–Ї–Є—Е –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –≤ –Ї–Њ—Б—В–љ–Њ–Љ –Љ–Њ–Ј–≥–µ –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–є –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞, —Г—З–∞—Б—В–≤—Г—О—В –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ –∞–љ—В–Є–≥–µ–љ–∞–Љ (–∞—Г—В–Њ–∞–љ—В–Є–≥–µ–љ–∞–Љ). –Ф–µ—Д–µ–Ї—В –Т––Ї–ї–µ—В–Њ—З–љ–Њ–є —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–Є–љ—В–µ–Ј—Г –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї, –Ї–Њ—В–Њ—А—Л–µ, –∞–Ї—В–Є–≤–Є—А—Г—П —Н—Д—Д–µ–Ї—В–Њ—А–љ—Л–µ –Ј–≤–µ–љ—М—П –Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞, –Є–љ–і—Г—Ж–Є—А—Г—О—В —А–∞–Ј–≤–Є—В–Є–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –і–µ—Б—В—А—Г–Ї—Ж–Є–Є —В–Ї–∞–љ–µ–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞. –Ю–і–љ–∞–Ї–Њ –Ј–љ–∞—З–µ–љ–Є–µ –Т––Ї–ї–µ—В–Њ–Ї –≤ —А–∞–Ј–≤–Є—В–Є–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –љ–µ –Є—Б—З–µ—А–њ—Л–≤–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ —Б–Є–љ—В–µ–Ј–Њ–Љ «–њ–∞—В–Њ–≥–µ–љ–љ—Л—Е» –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї. –£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞—А—Г—И–µ–љ–Є–µ –Т––Ї–ї–µ—В–Њ—З–љ–Њ–є –Ї–Њ–—Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є–≥—А–∞–µ—В —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Є –Љ–Њ–ґ–µ—В —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П –љ–∞ —Б–∞–Љ—Л—Е —А–∞–љ–љ–Є—Е —Б—В–∞–і–Є—П—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –і–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–∞–љ–Є—Д–µ—Б—В–∞—Ж–Є–Є –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [2]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ–Њ –і–∞–љ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –Т––Ї–ї–µ—В–Њ—З–љ—Л—Е –љ–µ—Е–Њ–і–ґ—Б–Ї–Є–љ—Б–Ї–Є—Е –ї–Є–Љ—Д–Њ–Љ [3]. –Т—Б–µ —Н—В–Њ –≤–Љ–µ—Б—В–µ –≤–Ј—П—В–Њ–µ –і–µ–ї–∞–µ—В –Т––Ї–ї–µ—В–Ї–Є –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л–Љ–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ–Є «–Љ–Є—И–µ–љ—П–Љ–Є» –њ—А–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е [4–7].
–Я–µ—А–≤—Л–Љ –Є –њ–Њ–Ї–∞ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –∞–љ—В–Є––Т––Ї–ї–µ—В–Њ—З–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ, —А–∞–Ј—А–µ—И–µ–љ–љ—Л–Љ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, —П–≤–ї—П–µ—В—Б—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–± (Rituximab, –Ь–∞–±–Ґ–µ—А–∞ «–§. –•–Њ—Д—Д–Љ–∞–љ––Ы—П –†–Њ—И –Ы—В–і.») – —Е–Є–Љ–µ—А–љ—Л–µ –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л–µ –∞–љ—В–Є—В–µ–ї–∞ –Ї CD20 –∞–љ—В–Є–≥–µ–љ—Г –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ [8]. –Я—А–µ–њ–∞—А–∞—В –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ –Љ–µ–і–Є—Ж–Є–љ–µ —Б 1997 –≥–Њ–і–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –Т––Ї–ї–µ—В–Њ—З–љ—Л—Е –љ–µ—Е–Њ–і–ґ—Б–Ї–Є–љ—Б–Ї–Є—Е –ї–Є–Љ—Д–Њ–Љ, –∞ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л – —И–Є—А–Њ–Ї–Њ–≥–Њ –Ї—А—Г–≥–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [9].
–Т—Л–±–Њ—А CD20 –Љ–Њ–ї–µ–Ї—Г–ї—Л –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–Є—И–µ–љ–Є –і–ї—П –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї —Б–≤—П–Ј–∞–љ —Б –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Т––Ї–ї–µ—В–Њ–Ї, –Ї–Њ—В–Њ—А—Л–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –Њ—В —Б—В–≤–Њ–ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Ї–ї–µ—В–Ї–Є –њ—А–Њ—Е–Њ–і—П—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е —Б—В–∞–і–Є–є, –і–ї—П –Ї–∞–ґ–і–Њ–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —Е–∞—А–∞–Ї—В–µ—А–љ–∞ —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –Љ–µ–Љ–±—А–∞–љ–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї (—А–Є—Б. 1). –≠–Ї—Б–њ—А–µ—Б—Б–Є—П CD20 –љ–∞–±–ї—О–і–∞–µ—В—Б—П –љ–∞ –Љ–µ–Љ–±—А–∞–љ–µ «—А–∞–љ–љ–Є—Е» –Є –Ј—А–µ–ї—Л—Е –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤, –љ–Њ –љ–µ —Б—В–≤–Њ–ї–Њ–≤—Л—Е, «—А–∞–љ–љ–Є—Е» –њ—А–µ––Т, –і–µ–љ–і—А–Є—В–љ—Л—Е –Є –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї. –Я–Њ—Н—В–Њ–Љ—Г –Є—Е –Є—Б—В–Њ—Й–µ–љ–Є–µ –љ–µ –Њ—В–Љ–µ–љ—П–µ—В —А–µ–≥–µ–љ–µ—А–∞—Ж–Є—О –њ—Г–ї–∞ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є –љ–µ –≤–ї–Є—П–µ—В –љ–∞ —Б–Є–љ—В–µ–Ј –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–Њ–≤ –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, CD20 –љ–µ –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞–µ—В—Б—П —Б –Љ–µ–Љ–±—А–∞–љ—Л –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –≤ –Ї—А–Њ–≤—П–љ–Њ–µ —А—Г—Б–ї–Њ –Є –њ–Њ—Н—В–Њ–Љ—Г –љ–µ –±–ї–Њ–Ї–Є—А—Г–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Б –Т––Ї–ї–µ—В–Ї–∞–Љ–Є, —З—В–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є. –Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Н–ї–Є–Љ–Є–љ–Є—А–Њ–≤–∞—В—М –Т––Ї–ї–µ—В–Ї–Є —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –Ј–∞ —Б—З–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –Є –∞–љ—В–Є—В–µ–ї–Њ––Ј–∞–≤–Є—Б–Є–Љ–Њ–є –Ї–ї–µ—В–Њ—З–љ–Њ–є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–љ–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ –Є–љ–і—Г–Ї—Ж–Є–Є –∞–њ–Њ–њ—В–Њ–Ј–∞ [10]. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –Є—Б—В–Њ—Й–µ–љ–Є–µ –Т––Ї–ї–µ—В–Њ–Ї –Љ–Њ–ґ–µ—В –Њ–Ї–∞–Ј—Л–≤–∞—В—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Њ—Б–љ–Њ–≤–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л —А–∞–Ј–≤–Є—В–Є—П –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ –Є –Є–Љ–µ–µ—В —Б–µ—А—М–µ–Ј–љ–Њ–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ:
• –Њ—Б–ї–∞–±–ї–µ–љ–Є–µ –∞–љ—В–Є–≥–µ–љ––њ—А–µ–Ј–µ–љ—В–Є—А—Г—О—Й–µ–є —Д—Г–љ–Ї—Ж–Є–Є –Т––Ї–ї–µ—В–Њ–Ї –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Є–љ–і—Г–Ї—Ж–Є–Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є —Б–Є–љ—В–µ–Ј–∞ —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ CD4+ –Ґ––Ї–ї–µ—В–Ї–∞–Љ–Є;
• –і–µ—Б—В—А—Г–Ї—Ж–Є—П –∞–±–µ—А—А–∞–љ—В–љ—Л—Е —А–Њ—Б—В–Ї–Њ–≤—Л—Е —Ж–µ–љ—В—А–Њ–≤, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –∞—Г—В–Њ–∞–љ—В–Є–≥–µ–љ–—Б–њ–µ—Ж–Є—Д–Є—З–љ—Л—Е –Т––Ї–ї–µ—В–Њ–Ї –њ–∞–Љ—П—В–Є, –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї –Є —Б–Є–љ—В–µ–Ј–∞ –∞–љ—В–Є—В–µ–ї;
• –Є—Б—В–Њ—Й–µ–љ–Є–µ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ї–ї–µ—В–Њ–Ї, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –њ–Њ–і–∞–≤–ї–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –∞–љ—В–Є—В–µ–ї –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є–Љ–Љ—Г–љ–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤;
• –Љ–Њ–і—Г–ї—П—Ж–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –і—А—Г–≥–Є—Е –∞—Г—В–Њ—А–µ–∞–Ї—В–Є–≤–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –Ј–∞ —Б—З–µ—В –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –Ґ––Ї–ї–µ—В–Њ–Ї;
• –∞–Ї—В–Є–≤–∞—Ж–Є—П –Ґ–—А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї (CD4+ CD25+).
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є –њ—Г—В–µ–Љ –Є—Б—В–Њ—Й–µ–љ–Є—П (–Є/–Є–ї–Є –Љ–Њ–і—Г–ї—П—Ж–Є–Є —Д—Г–љ–Ї—Ж–Є–Є) –Т––Ї–ї–µ—В–Њ–Ї –і–Њ–Ї–∞–Ј–∞–љ–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Ю–± —Н—В–Њ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –≤—Л—Б–Њ–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–Љ –Є —В—П–ґ–µ–ї–Њ–Љ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–Љ —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є – —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ (–†–Р), —З—В–Њ –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ф–µ—В–∞–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –†–Р –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –≤ –њ—А–µ–і—Л–і—Г—Й–Є—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П—Е [7,11,12].
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Њ—З–µ–љ—М –±—Л—Б—В—А–Њ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –і–ї—П –ї–µ—З–µ–љ–Є—П –і—А—Г–≥–Є—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞ [13–15]. –°–ї–µ–і—Г–µ—В –Њ—Б–Њ–±–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —А–Є—В—Г–Ї—Б–Є–Љ–∞–± –љ–∞–Ј–љ–∞—З–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Њ—З–µ–љ—М —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –±–Њ–ї–µ–Ј–љ–µ–є, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ–Њ–є –Є —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ—Г –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ—Г, —Н–Ї—Б—В—А–∞–Ї–Њ—А–њ–Њ—А–∞–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–∞–Љ –Њ—З–Є—Й–µ–љ–Є—П –Ї—А–Њ–≤–Є, –љ–µ—А–µ–і–Ї–Њ –њ–Њ –ґ–Є–Ј–љ–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ.
–°–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞
–°–Є—Б—В–µ–Љ–љ–∞—П –Ї—А–∞—Б–љ–∞—П –≤–Њ–ї—З–∞–љ–Ї–∞ (–°–Ъ–Т) – –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–µ —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –≤ –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ї–Њ—В–Њ—А–Њ–≥–Њ –ї–µ–ґ–∞—В –і–µ—Д–µ–Ї—В—Л –Є–Љ–Љ—Г–љ–Њ—А–µ–≥—Г–ї—П—Ж–Є–Є, –њ—А–Є–≤–Њ–і—П—Й–Є–µ –Ї –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–є –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є–Є –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї –Ї –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞–Љ —Б–Њ–±—Б—В–≤–µ–љ–љ—Л—Е —В–Ї–∞–љ–µ–є –Є —А–∞–Ј–≤–Є—В–Є—О —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Ј–∞—В—А–∞–≥–Є–≤–∞—О—Й–µ–≥–Њ –Љ–љ–Њ–≥–Є–µ –Њ—А–≥–∞–љ—Л –Є —Б–Є—Б—В–µ–Љ—Л. –Я—А–Є —Н—В–Њ–Љ –Т––ї–Є–Љ—Д–Њ—Ж–Є—В—Л –Є–≥—А–∞—О—В –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ —А–∞–Ј–≤–Є—В–Є–Є –Є–Љ–Љ—Г–љ–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –њ—А–Є —Н—В–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–Є [16].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –±–Њ–ї–µ–µ —З–µ–Љ —Г 100 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ъ–Т, –Ї–∞–Ї –≤–Ј—А–Њ—Б–ї—Л—Е, —В–∞–Ї –Є –і–µ—В–µ–є, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А—Л—Е —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л –≤ –Њ–±–Ј–Њ—А–µ [17]. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б–і–µ–ї–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –Њ—Б–љ–Њ–≤–љ—Л–µ –≤—Л–≤–Њ–і—Л:
• –Т —Ж–µ–ї–Њ–Љ –ї–µ—З–µ–љ–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –±–Њ–ї–µ–µ —З–µ–Љ —Г 80% –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
• –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ —Г –±–Њ–ї—М–љ—Л—Е –°–Ъ–Т —Б –∞–Ї—В–Є–≤–љ—Л–Љ–Є –≤–љ–µ–њ–Њ—З–µ—З–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –±–Њ–ї–µ–Ј–љ–Є (—Б–µ—А–Њ–Ј–Є—В, –њ–Њ–ї–Є–∞—А—В—А–Є—В, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–Њ–ґ–Є, —Б—В–Њ–Љ–∞—В–Є—В, –ї–Є—Е–Њ—А–∞–і–Ї–∞, –∞–љ–µ–Љ–Є—П), —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ –≤–Њ–ї—З–∞–љ–Њ—З–љ—Л–Љ –љ–µ—Д—А–Є—В–Њ–Љ (III–IV –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —В–Є–њ –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Т–Ю–Ч).
• –†–Є—В—Г–Ї—Б–Є–Љ–∞–± –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –≤—Л–±–Њ—А–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б «–Ї—А–Є—В–Є—З–µ—Б–Ї–Є–Љ» —В–µ—З–µ–љ–Є–µ–Љ –°–Ъ–Т, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–Љ —В—П–ґ–µ–ї—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –¶–Э–° (–Ї–Њ–Љ–∞—В–Њ–Ј–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ, —Б—Г–і–Њ—А–Њ–≥–Є, –њ—Б–Є—Е–Њ–Ј), –∞ —В–∞–Ї–ґ–µ –Љ—Г–ї—М—В–Є–Њ—А–≥–∞–љ–љ—Л–Љ —В—А–Њ–Љ–±–Њ–Ј–Њ–Љ, —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є–Љ –∞–љ—В–Є—Д–Њ—Б—Д–Њ–ї–Є–њ–Є–і–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ.
• –Я—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ї—Г—А—Б–Њ–≤ —В–µ—А–∞–њ–Є–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –≤ —Б–ї—Г—З–∞–µ —А–∞–Ј–≤–Є—В–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є—П.
–°–Є–љ–і—А–Њ–Љ –®–µ–≥—А–µ–љ–∞
–°–Є–љ–і—А–Њ–Љ –®–µ–≥—А–µ–љ–∞ (–°–®) – —Б–Є—Б—В–µ–Љ–љ–Њ–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –њ–Њ—А–∞–ґ–∞—О—Й–µ–µ —Н–Ї–Ј–Њ–Ї—А–Є–љ–љ—Л–µ –ґ–µ–ї–µ–Ј—Л –Є –њ—А–Њ—П–≤–ї—П—О—Й–µ–µ—Б—П –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є —Б—Г—Е–Њ—Б—В—М—О —А—В–∞ –Є –≥–ї–∞–Ј, —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–Є —Б–ї—О–љ–љ—Л—Е –Є —Б–ї–µ–Ј–љ—Л—Е –ґ–µ–ї–µ–Ј [18]. –°–® –≤–µ—Б—М–Љ–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є, –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Б —З–∞—Б—В–Њ—В–Њ–є 0,6%–3,3% –Є–ї–Є 4 –љ–Њ–≤—Л—Е —Б–ї—Г—З–∞—П –љ–∞ 100000 –љ–∞—Б–µ–ї–µ–љ–Є—П –≤ –≥–Њ–і. –°–® —З–∞—Й–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Г –ґ–µ–љ—Й–Є–љ —Б—А–µ–і–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –ґ–µ–љ—Й–Є–љ –Ї –Љ—Г–ґ—З–Є–љ–∞–Љ –Ї–Њ–ї–µ–±–ї–µ—В—Б—П –Њ—В 14:1 –і–Њ 24:1. –Т—Л–і–µ–ї—П—О—В –њ–µ—А–≤–Є—З–љ—Л–є —Б–Є–љ–і—А–Њ–Љ (–±–Њ–ї–µ–Ј–љ—М) –®–µ–≥—А–µ–љ–∞ –Є –≤—В–Њ—А–Є—З–љ—Л–є –°–®, —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–є—Б—П —Г –±–Њ–ї—М–љ—Л—Е –†–Р –Є –і—А—Г–≥–Є–Љ–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ–Є —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Є –љ–µ—А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є.
–°–® – –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —В—П–ґ–µ–ї–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–µ—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ —Н–Ї—Б—В—А–∞–≥–ї–∞–љ–і—Г–ї—П—А–љ—Л—Е (—Б–Є—Б—В–µ–Љ–љ—Л—Е) –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Є –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –ї–Є–Љ—Д–Њ–Љ, —З—В–Њ –Њ—В—А–∞–ґ–∞–µ—В —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Г—О —А–Њ–ї—М –Т––Ї–ї–µ—В–Њ—З–љ–Њ–є –≥–Є–њ–µ—А—А–µ–∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –≤ –Є–Љ–Љ—Г–љ–Њ–њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –±–Њ–ї–µ–Ј–љ–Є [3]. –Я–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –њ–µ—А–≤–Є—З–љ—Л–є –°–® –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Г–љ–Є–Ї–∞–ї—М–љ—Г—О –Љ–Њ–і–µ–ї—М –і–ї—П –Є–Ј—Г—З–µ–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –њ–Њ–ї–Є–Ї–ї–Њ–љ–∞–ї—М–љ–Њ–є –Т––Ї–ї–µ—В–Њ—З–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –≤ –Њ–ї–Є–≥–Њ– (–Љ–Њ–љ–Њ–) –Ї–ї–Њ–љ–∞–ї—М–љ—Г—О –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Т––Ї–ї–µ—В–Њ–Ї, –њ—А–Є–≤–Њ–і—П—Й—Г—О, –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ —Б—З–µ—В–µ, –Ї —А–∞–Ј–≤–Є—В–Є—О –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Т––Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–Љ—Д–Њ–њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –°–® –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–∞ –Є —Б–≤–Њ–і–Є—В—Б—П –Ї —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О —Б—Г—Е–Њ–≥–Њ –Ї–µ—А–∞—В–Њ–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є—В–∞ –Є –Ї—Б–µ—А–Њ—Б—В–Њ–Љ–Є–Є –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –У–Ъ –Є —Ж–Є—В–Њ—Б—В–∞—В–Є–Ї–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї—Л–Љ–Є —Б–Є—Б—В–µ–Љ–љ—Л–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –±–Њ–ї–µ–Ј–љ–Є. –Я–Њ–њ—Л—В–Ї–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Э–Ю–a –і–∞–ї–Є –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ—Л. –Ф–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –°–®, —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.
–Т–ї–Є—П–љ–Є–µ –ї–µ—З–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –љ–∞ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б—Г—Е–Њ–≥–Њ –Ї–µ—А–∞—В–Њ–Ї–Њ–љ—К—О–љ–Ї—В–Є–≤–Є—В–∞ –Є –Ї—Б–µ—А–Њ—Б—В–Њ–Љ–Є–Є –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Њ—Б—М –≤ 3–—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е. –Я–Њ –і–∞–љ–љ—Л–Љ J.E. Gottenberg –Є —Б–Њ–∞–≤—В. [20], —Г 3 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ, –∞ —Г 2 – —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є. –°—Е–Њ–і–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–µ–љ—Л J. Pijpe –Є —Б–Њ–∞–≤—В. [21]. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П R. Seror –Є —Б–Њ–∞–≤—В. [22] –љ–µ –≤—Л—П–≤–Є–ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –ї–µ—З–µ–љ–Є—П –љ–∞ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б—Г—Е–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є V. Davauchelle–Pensec –Є —Б–Њ–∞–≤—В. [23] —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В–∞–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ї–∞–Ї —Б–ї–∞–±–Њ—Б—В—М, —Б—Г—Е–Њ—Б—В—М –≤–Њ —А—В—Г, –њ–Њ—А–∞–ґ–µ–љ–Є–µ —Б—Г—Б—В–∞–≤–Њ–≤, –Њ–±—Й–µ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ (SF–36), —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –ї–µ–≥–Ї–Є—Е (1 –њ–∞—Ж–Є–µ–љ—В).
–Ю—Б–Њ–±–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Њ—В–Љ–µ—З–µ–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–Є—Б—В–µ–Љ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я–Њ –і–∞–љ–љ—Л–Љ J.E. Gottenberg –Є —Б–Њ–∞–≤—В. [20], —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–∞—П –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ —Г 5 –Є–Ј 6 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–Ј–Є—В—М –і–Њ–Ј—Г –У–Ъ. R. Seror –Є —Б–Њ–∞–≤—В. [22] –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–Є—Б—В–µ–Љ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є —Г 9 –Є–Ј 11 –±–Њ–ї—М–љ—Л—Е.
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –Љ–∞—В–µ—А–Є–∞–ї—Л, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–® –Є –ї–Є–Љ—Д–Њ–Љ–∞–Љ–Є. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є J.E. Gottenberg –Є —Б–Њ–∞–≤—В. [209] –њ–Њ–ї–љ–∞—П —А–µ–Љ–Є—Б—Б–Є—П –Њ—В–Љ–µ—З–µ–љ–∞ —Г 1 –њ–∞—Ж–Є–µ–љ—В–∞, –∞ –њ–Њ –і–∞–љ–љ—Л–Љ J. Pijpe –Є —Б–Њ–∞–≤—В. [21], –њ–Њ–ї–љ–∞—П —А–µ–Љ–Є—Б—Б–Є—П –і–Њ—Б—В–Є–≥–љ—Г—В–∞ —Г 3, –∞ —З–∞—Б—В–Є—З–љ–∞—П – —Г 2–—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ —В–Њ–ї—М–Ї–Њ —Г 1 –±–Њ–ї—М–љ–Њ–≥–Њ. –Я–Њ –і–∞–љ–љ—Л–Љ R. Seror –Є —Б–Њ–∞–≤—В. [22], —А–∞–Ј–≤–Є—В–Є–µ —А–µ–Љ–Є—Б—Б–Є–Є –Є–Љ–µ–ї–Њ –Љ–µ—Б—В–Њ —Г 4 –Є–Ј 5 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –ї–Є–Љ—Д–Њ–Љ–Њ–є. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –∞–і—К—О–≤–∞–љ—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ—А–Є –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е –Т––Ї–ї–µ—В–Њ—З–љ—Л—Е –ї–Є–Љ—Д–Њ–Љ–∞—Е. M. Vougarelis –Є —Б–Њ–∞–≤—В. [24] –њ—А–µ–і—Б—В–∞–≤–Є–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ –і–ї–Є—В–µ–ї—М–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є –і–Є—Д—Д—Г–Ј–љ–Њ–є –Т––Ї–ї–µ—В–Њ—З–љ–Њ–є –ї–Є–Љ—Д–Њ–Љ—Л —Г 6 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–µ—А–≤–Є—З–љ—Л–Љ –°–®, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Г—О —В–µ—А–∞–њ–Є—О —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–Њ–Љ, –і–Њ–Ї—Б–Њ—А—Г–±–Є—Ж–Є–љ–Њ–Љ, –≤–Є–љ–Ї—А–Є—Б—В–Є–љ–Њ–Љ, –њ—А–µ–і–љ–Є–Ј–Њ–ї–Њ–љ–Њ–Љ (CHOP) –Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ. –Т —Ж–µ–ї–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –±—Л–ї–∞ –≤—Л—И–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ —Б—А–∞–≤–љ–µ–љ–Є–є, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —В–Њ–ї—М–Ї–Њ —Ж–Є—В–Њ—В–Њ–Ї—Б–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О –±–µ–Ј —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞.
–Ш–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ
–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Љ–Є–Њ–њ–∞—В–Є–Є (–Ш–Т–Ь)
–Ш–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Љ–Є–Њ–њ–∞—В–Є–Є (–Ш–Т–Ь) – –≥—А—Г–њ–њ–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В –≤—Б—В—А–µ—З–∞—В—М—Б—П –Ї–∞–Ї –≤ –≤–Є–і–µ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Л—Е –љ–Њ–Ј–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ, —В–∞–Ї –Є –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е [25]. –Э–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –Ш–Т–Ь —П–≤–ї—П—О—В—Б—П –њ–Њ–ї–Є–Љ–Є–Њ–Ј–Є—В (–Я–Ь) –Є –і–µ—А–Љ–∞—В–Њ–Љ–Є–Њ–Ј–Є—В (–Ф–Ь). –Т –Њ—Б–љ–Њ–≤–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ш–Т–Ь –ї–µ–ґ–Є—В –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Љ—Л—И—Ж, –Ї–Њ—В–Њ—А–Њ–µ –Є–Љ–µ–µ—В —Б–≤–Њ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ—А–Є –Я–Ь –Є –Ф–Ь. –Я—А–Є –Я–Ь –≤ –Ї–ї–µ—В–Њ—З–љ–Њ–Љ –Є–љ—Д–Є–ї—М—В—А–∞—В–µ –њ—А–µ–Њ–±–ї–∞–і–∞—О—В CD 8+ –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В—Л –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Є, –∞ –њ—А–Є –Ф–Ь – CD 4+ –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В—Л. –†–∞–Ј–≤–Є—В–Є–µ –Ш–Т–Ь –Љ–Њ–ґ–µ—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П —Б–Є–љ—В–µ–Ј–Њ–Љ —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–Є–ї–Є –љ–∞–Ј–≤–∞–љ–Є–µ –Љ–Є–Њ–Ј–Є—В–—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е. –Ы–µ—З–µ–љ–Є–µ –Я–Ь/–Ф–Ь –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ—Б—В–∞–µ—В—Б—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є–Љ –Є –Њ–±—Л—З–љ–Њ —Б–Њ—Б—В–Њ–Є—В –Є–Ј —Б–Њ—З–µ—В–∞–љ–Є—П –У–Ъ –Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Њ–і–љ–∞–Ї–Њ —Г –Љ–љ–Њ–≥–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –ї–µ—З–µ–љ–Є–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ. –Я–Њ—Н—В–Њ–Љ—Г –Њ–њ—Л—В –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –Ш–Т–Ь –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В –љ–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–є –Є–љ—В–µ—А–µ—Б (—В–∞–±–ї. 2).
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —В–∞–±–ї–Є—Ж—Л, –ї–µ—З–µ–љ–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –±—Л–ї–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е, —З—В–Њ –њ—А–Њ—П–≤–ї—П–ї–Њ—Б—М –≤ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є (–Є–ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–Є) –Љ—Л—И–µ—З–љ–Њ–є —Б–Є–ї—Л –Є —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ъ–§–Ъ. –£ –±–Њ–ї—М–љ—Л—Е —Б –Ф–Ь –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –Њ—В–Љ–µ—З–µ–љ–Њ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–Њ–ґ–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞–љ—В–Є—Б–Є—Б—В–µ—В–∞–Ј–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Њ—В–Љ–µ—З–µ–љ–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Ї–Є—Е.
C–Є—Б—В–µ–Љ–љ—Л–µ –≤–∞—Б–Ї—Г–ї–Є—В—Л
–°–Є—Б—В–µ–Љ–љ—Л–µ –≤–∞—Б–Ї—Г–ї–Є—В—Л, –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—Й–Є–µ—Б—П —Б —Б–Є–љ—В–µ–Ј–Њ–Љ –∞–љ—В–Є–љ–µ–є—В—А–Њ—Д–Є–ї—М–љ—Л—Е —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –∞–љ—В–Є—В–µ–ї (–Р–Э–¶–Р), – –≥—А—Г–њ–њ–∞ —Б–Є—Б—В–µ–Љ–љ—Л—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є—Е—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–∞—Б–Ї—Г–ї–Є—В–Њ–Љ –Љ–µ–ї–Ї–Є—Е —Б–Њ—Б—Г–і–Њ–≤ –Є —Б–Є–љ—В–µ–Ј–Њ–Љ –Р–Э–¶–Р [32]. –Т—Л–і–µ–ї—П—О—В 2 –Њ—Б–љ–Њ–≤–љ—Л–µ —Д–Њ—А–Љ—Л —Н—В–Є—Е –≤–∞—Б–Ї—Г–ї–Є—В–Њ–≤: –≥—А–∞–љ—Г–ї–µ–Љ–∞—В–Њ–Ј –Т–µ–≥–µ–љ–µ—А–∞ (–У–Т), –і–ї—П –Ї–Њ—В–Њ—А–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≥—А–∞–љ—Г–ї–µ–Љ –Є –і–µ—Б—В—А—Г–Ї—В–Є–≤–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≤–µ—А—Е–љ–Є—Е –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є, –Є –Љ–Є–Ї—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є–є –њ–Њ–ї–Є–∞–љ–≥–Є–Є—В (–Ь–Я–Р), –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ —Н—В–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ –љ–∞–±–ї—О–і–∞—О—В—Б—П.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –Р–Э–¶–Р––∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е –≤–∞—Б–Ї—Г–ї–Є—В–∞—Е —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є –Њ–њ—А–∞–≤–і–∞–љ–Њ –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤–∞–ґ–љ–Њ–є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —А–Њ–ї—М—О –Р–Э–¶–Р (–∞–љ—В–Є—В–µ–ї–∞ –Ї –њ—А–Њ—В–µ–Є–љ–∞–Ј–µ 3 –Є –∞–љ—В–Є—В–µ–ї–∞ –Ї –Љ–Є–µ–ї–Њ–њ–µ—А–Њ–Ї—Б–Є–і–∞–Ј–µ) –≤ —А–∞–Ј–≤–Є—В–Є–Є —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П —Б–Њ—Б—Г–і–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Т––Ї–ї–µ—В–Ї–Є —Г—З–∞—Б—В–≤—Г—О—В –≤ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –≥—А–∞–љ—Г–ї–µ–Љ –њ—А–Є –У–Т, –∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Є—Е —Г—А–Њ–≤–љ—П –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
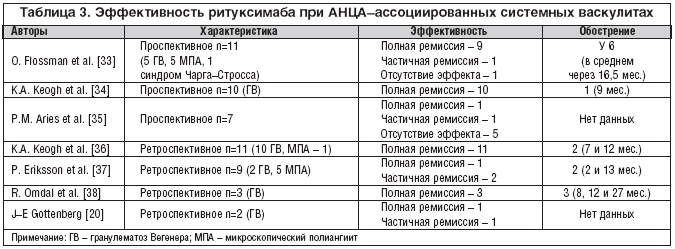
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–Њ –Њ—З–µ–љ—М –±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –У–Т –Є –Ь–Я–Р (—В–∞–±–ї. 3).
–Т —Ж–µ–ї–Њ–Љ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —Н—Д—Д–µ–Ї—В –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –±–Њ–ї–µ–Ј–љ–Є –Њ—В–Љ–µ—З–µ–љ –±–Њ–ї–µ–µ —З–µ–Љ —Г 90% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я—А–Є —Н—В–Њ–Љ –±–Њ–ї–µ–µ —З–µ–Љ —Г 80% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–∞ –і–Њ—Б—В–Є–≥–љ—Г—В–∞ –њ–Њ–ї–љ–∞—П —А–µ–Љ–Є—Б—Б–Є—П, –∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Е–Њ—А–Њ—И–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–ї–Њ—Б—М –њ–Њ–≤—В–Њ—А–љ—Л–Љ–Є –Ї—Г—А—Б–∞–Љ–Є —В–µ—А–∞–њ–Є–Є (–≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 9–12 –Љ–µ—Б.). –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–µ–є —Г—А–Њ–≤–љ—П –Т––Ї–ї–µ—В–Њ–Ї –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —В–Є—В—А–Њ–≤ –Р–Э–¶–Р. –Ю–і–љ–∞–Ї–Њ —Г –Љ–љ–Њ–≥–Є—Е –±–Њ–ї—М–љ—Л—Е —А–µ–Љ–Є—Б—Б–Є—П —Б–Њ—Е—А–∞–љ—П–ї–∞—Б—М –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–Є –ї–µ—З–µ–љ–Є—П –Є–ї–Є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –љ–µ–±–Њ–ї—М—И–Є—Е –і–Њ–Ј –У–Ъ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —Г—А–Њ–≤–љ—П –Т––Ї–ї–µ—В–Њ–Ї –Є —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —В–Є—В—А–Њ–≤ –Р–Э–¶–Р. –°–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –У–Т, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є —А–µ—В—А–Њ––Њ—А–±–Є—В–∞–ї—М–љ–∞—П –≥—А–∞–љ—Г–ї–µ–Љ–∞, –Љ–µ–љ–µ–µ «—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–∞» –Ї —А–Є—В—Г–Ї—Б–Є–Љ–∞–±—Г, —З–µ–Љ –≥—А–∞–љ—Г–ї–µ–Љ–∞—В–Њ–Ј–љ–Њ–µ –њ–Њ—А–∞–ґ–µ–љ–Є–µ –ї–µ–≥–Ї–Є—Е. –£ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–Є—В—Г–Ї—Б–Є–Љ–∞–± –љ–∞–Ј–љ–∞—З–∞–ї–Є –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є, –≤–Ї–ї—О—З–∞—П —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і, –Љ–µ—В–Њ—В—А–µ–Ї—Б–∞—В, –∞–Ј–∞—В–Є–Њ–њ—А–Є–љ –Є –Љ–Є–Ї–Њ—Д–µ–љ–Њ–ї–∞—В–∞ –Љ–Њ—Д–µ—В–Є–ї, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –і—А—Г–≥–Є—Е – –≤ –≤–Є–і–µ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —В–Њ–ї—М–Ї–Њ —Б –У–Ъ. –°–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ, —З—В–Њ –њ–Њ–ї–љ—Л–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —Н—Д—Д–µ–Ї—В –љ–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Ї –Ї–Њ–љ—Ж—Г —В—А–µ—В—М–µ–≥–Њ –Љ–µ—Б—П—Ж–∞, —З—В–Њ –і–Є–Ї—В—Г–µ—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л—Е —Б—Е–µ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ъ—А–Є–Њ–≥–ї–Њ–±—Г–ї–Є–љ–µ–Љ–Є—З–µ—Б–Ї–Є–є –≤–∞—Б–Ї—Г–ї–Є—В
–°–Љ–µ—И–∞–љ–љ–∞—П –Ї—А–Є–Њ–≥–ї–Њ–±—Г–ї–Є–љ–µ–Љ–Є—П (–°–Ъ) – —Б–Є—Б—В–µ–Љ–љ—Л–є –≤–∞—Б–Ї—Г–ї–Є—В, —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–µ–є –Ї–ї–Њ–љ–Њ–≤ –Т––Ї–ї–µ—В–Њ–Ї, —Б–Є–љ—В–µ–Ј–Є—А—Г—О—Й–Є—Е «–њ–∞—В–Њ–≥–µ–љ–љ—Л–є» IgM, –Њ–±–ї–∞–і–∞—О—Й–Є–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ (–†–§) [32]. –°–Ъ –≤–µ–і–µ—В –Ї —А–∞–Ј–≤–Є—В–Є—О —И–Є—А–Њ–Ї–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А—Л—Е –≤–∞—А—М–Є—А—Г–µ—В –Њ—В —Г–Љ–µ—А–µ–љ–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Њ–ґ–љ–Њ–≥–Њ –≤–∞—Б–Ї—Г–ї–Є—В–∞ –њ–Њ —В–Є–њ—Г –њ—Г—А–њ—Г—А—Л, –∞—А—В—А–∞–ї–≥–Є–є –Є –∞—Б—В–µ–љ–Є–Є (—Б–Є–љ–і—А–Њ–Љ –°–Ъ) –і–Њ —В—П–ґ–µ–ї—Л—Е –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є –Є –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –і–Њ–Ї–∞–Ј–∞–љ–∞ —А–Њ–ї—М –≤–Є—А—Г—Б–∞ –≥–µ–њ–∞—В–Є—В–∞ –° (–Т–У–°) –≤ —А–∞–Ј–≤–Є—В–Є–Є –°–Ъ, –Ї–Њ—В–Њ—А—Л–є –≤—Л—П–≤–ї—П–µ—В—Б—П —Г 60–90% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ —Г 36–55% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–љ—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Т–У–°, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Ї—А–Є–Њ–≥–ї–Њ–±—Г–ї–Є–љ–µ–Љ–Є—П. –Я—А–Є —Н—В–Њ–Љ —Г 15–20% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–Ъ, –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б –Т–У–°, —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —В—П–ґ–µ–ї—Л—Е –≤–∞—Б–Ї—Г–ї–Є—В, –Ї–Њ—В–Њ—А—Л–є –≤ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Љ–Њ–ґ–µ—В –њ—А–Є–≤–µ—Б—В–Є –Ї –ї–µ—В–∞–ї—М–љ–Њ–Љ—Г –Є—Б—Е–Њ–і—Г —Г 15–20% —Б –Ъ–Т, —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –Т–У–°, –Є —Г 50% —Б –Х–°–Ъ.
–Ы–µ—З–µ–љ–Є–µ –°–Ъ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —А–∞–Ј—А–∞–±–Њ—В–∞–љ–Њ. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Д–µ–Ї—Ж–Є–µ–є –Т–У–° –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Є–љ—В–µ—А—Д–µ—А–Њ–љ–Њ–Љ (–Ш–§–Э)–a –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Є —З–∞—Б—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –Њ–±–Њ—Б—В—А–µ–љ–Є–є. –С–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –Ш–§–Э–a –Є —А–Є–±–∞–≤–Є—А–Є–љ–Њ–Љ, –љ–∞ —Д–Њ–љ–µ –Ї–Њ—В–Њ—А–Њ–є –њ–Њ—З—В–Є —Г 80% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —А–µ–Љ–Є—Б—Б–Є—П, –Њ–і–љ–∞–Ї–Њ —Г –љ–µ–Ї–Њ—В–Њ—А—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ—О—В –Љ–µ—Б—В–Њ —В—П–ґ–µ–ї—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –У–Ъ, —Ж–Є–Ї–ї–Њ—Д–Њ—Б—Д–∞–Љ–Є–і–∞ –Є –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –Ї –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —В–∞–Ї–ґ–µ –Є–Љ–µ–µ—В –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —В—П–ґ–µ–ї—Л–Љ–Є –њ–Њ–±–Њ—З–љ—Л–Љ–Є —Н—Д—Д–µ–Ї—В–∞–Љ–Є.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–∞ —Б–µ—А–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–≤—Б–µ–≥–Њ 57 –њ–∞—Ж–Є–µ–љ—В–Њ–≤), –Ї–Њ—В–Њ—А—Л–µ —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л –≤ –Њ–±–Ј–Њ—А–µ P. Cocoub –Є —Б–Њ–∞–≤—В. [39], —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є—Е –Њ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –Ъ–Т (—В–∞–±–ї. 4).
–£ –і–≤—Г—Е —В—А–µ—В–µ–є –±–Њ–ї—М–љ—Л—Е –±—Л–ї –Ъ–Т, —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –Є–љ—Д–µ–Ї—Ж–Є–µ–є –Т–У–С, –∞ —Г –Њ—Б—В–∞–ї—М–љ—Л—Е – –µ—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ–∞—П —Б–Љ–µ—И–∞–љ–љ–∞—П –Ї—А–Є–Њ–≥–ї–Њ–±—Г–ї–Є–љ–µ–Љ–Є—П (–Х–°–Ъ). –Ю—Б–љ–Њ–≤–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –Ъ–Т –±—Л–ї–Є –њ–Њ—А–∞–ґ–µ–љ–Є–µ –Ї–Њ–ґ–Є (84%), –∞—А—В—А–∞–ї–≥–Є–Є (61,4%), –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П (54,4%), –≥–ї–Њ–Љ–µ—А—Г–ї–Њ–љ–µ—Д—А–Є—В (31,6%), –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —А–µ—Д—А–∞–Ї—В–µ—А–љ—Л —Г –њ—А–Њ—В–Є–≤–Њ–≤–Є—А—Г—Б–љ–Њ–є (–±–Њ–ї–µ–µ —З–µ–Љ —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –±–Њ–ї—М–љ—Л—Е) –Є –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –Њ—Б—В–∞–ї—М–љ—Л—Е. –Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —В–∞–±–ї–Є—Ж—Л 4, —А–Є—В—Г–Ї—Б–Є–Љ–∞–± –±—Л–ї —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б–љ–Њ–≤–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ъ–Т, –њ—А–Є—З–µ–Љ —Г 80–93% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —А–∞–Ј–≤–Є–ї–∞—Б—М –њ–Њ–ї–љ–∞—П (–Є–ї–Є —З–∞—Б—В–Є—З–љ–∞—П) —А–µ–Љ–Є—Б—Б–Є—П. –Ю–і–љ–∞–Ї–Њ —Г 39% –±–Њ–ї—М–љ—Л—Е —А–∞–Ј–≤–Є–ї–Њ—Б—М –Њ–±–Њ—Б—В—А–µ–љ–Є–µ –≤ —Б—А–µ–і–љ–µ–Љ —З–µ—А–µ–Ј 6,7 –Љ–µ—Б. –њ–Њ—Б–ї–µ –њ–Њ—Б–ї–µ–і–љ–µ–є –Є–љ—Д—Г–Ј–Є–Є. –Я—А–Є —Н—В–Њ–Љ —Г 8 –Є–Ј 14 —Г–і–∞–ї–Њ—Б—М –і–Њ—Б—В–Є–≥–љ—Г—В—М —А–µ–Љ–Є—Б—Б–Є–Є –љ–∞ —Д–Њ–љ–µ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ —А–Є—В—Г–Ї—Б–Є–Љ–∞–± –±—Л–ї –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –Ї–∞–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Х–°–Ъ, —В–∞–Ї –Є —Б –Ъ–Т, —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –Т–У–°.
–Ш–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П
—В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—З–µ—Б–Ї–∞—П –њ—Г—А–њ—Г—А–∞
–Ш–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–∞—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є—З–µ—Б–Ї–∞—П –њ—Г—А–њ—Г—А–∞ (–Ш–Ґ–Я) – —З–∞—Б—В–Њ–µ –≥–µ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, —Б–≤—П–Ј–∞–љ–љ–Њ–µ —Б —Б–Є–љ—В–µ–Ј–Њ–Љ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –∞–љ—В–Є—В–µ–ї, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–µ—Б—П —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–њ–µ–љ–Є–µ–є –Є —А–Є—Б–Ї–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–Њ 19 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–≤—Б–µ–≥–Њ 313 –њ–∞—Ж–Є–µ–љ—В–Њ–≤), –≤ –Ї–Њ—В–Њ—А—Л—Е –Є–Ј—Г—З–∞–ї–∞—Б—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞, –Є 29 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (306 –њ–∞—Ж–Є–µ–љ—В–Њ–≤), –њ–Њ—Б–≤—П—Й–µ–љ–љ—Л—Е –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А—Л—Е –Њ–±–Њ–±—Й–µ–љ—Л –≤ –љ–µ–і–∞–≤–љ–Њ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–Љ —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –Њ–±–Ј–Њ—А–µ [40]. –Я—А–Њ–≤–µ–і–µ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ (62,5%) –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ (—В–∞–±–ї. 5).
–Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —Н—Д—Д–µ–Ї—В–∞ –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 10,5 –Љ–µ—Б. –£ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М —Б—В–∞–љ–і–∞—А—В–љ–∞—П —Б—Е–µ–Љ–∞ –ї–µ—З–µ–љ–Є—П, —Б–Њ—Б—В–Њ—П—Й–∞—П –Є–Ј 4 –µ–ґ–µ–љ–µ–і–µ–ї—М–љ—Л—Е –Є–љ—Д—Г–Ј–Є–є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –і–Њ–Ј–µ 375 –Љ–≥/–Љ2. –Я—А–Є–Љ–µ—А–љ–Њ —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ —Б–њ–ї–µ–љ—Н–Ї—В–Њ–Љ–Є—П, –Ї–Њ—В–Њ—А–∞—П –±—Л–ї–∞ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–∞.
–Я—Г–Ј—Л—А—З–∞—В–Ї–∞
–Я—Г–Ј—Л—А—З–∞—В–Ї–∞ – –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ —Б–Љ–µ—А—В–µ–ї—М–љ–Њ–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –њ—А–Њ—П–≤–ї—П—О—Й–µ–µ—Б—П —В—П–ґ–µ–ї—Л–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Ї–Њ–ґ–Є –Є —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–µ–Ї [41]. –Т –Њ—Б–љ–Њ–≤–µ —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –ї–µ–ґ–Є—В —Б–Є–љ—В–µ–Ј –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї, —А–µ–∞–≥–Є—А—Г—О—Й–Є—Е —Б –і–µ—Б–Љ–Њ–≥–ї–µ–Є–љ–Њ–Љ 1 –Є 3 –Є –Љ–Њ–ї–µ–Ї—Г–ї–∞–Љ–Є –∞–і–≥–µ–Ј–Є–Є —Н–њ–Є–і–µ—А–Љ–Є—Б–∞, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–Є–Љ–Є —Б—Ж–µ–њ–ї–µ–љ–Є–µ –Љ–µ–ґ–і—Г –Ї–µ—А–∞—В–Є–љ–Њ—Ж–Є—В–∞–Љ–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –≤ –Ї–Њ–ґ–µ –Є —Б–ї–Є–Ј–Є—Б—В—Л—Е [42]. –Э–µ–і–∞–≤–љ–Њ –њ–Њ—П–≤–Є–ї–Є—Б—М —Б–Њ–Њ–±—Й–µ–љ–Є—П –Њ–± —Г—Б–њ–µ—И–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї–Њ–є –њ—Г–Ј—Л—А—З–∞—В–Ї–Њ–є, —А–µ—Д—А–∞–Ї—В–µ—А–љ–Њ–є –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞—О—Й–µ–є –≤—Л—Б–Њ–Ї–Є–µ –і–Њ–Ј—Л –У–Ъ, —Ж–Є—В–Њ—Б—В–∞—В–Є–Ї–Њ–≤, –њ–ї–∞–Ј–Љ–∞—Д–µ—А–µ–Ј –Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–є –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ [43]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є P. Joly –Є —Б–Њ–∞–≤—В. [44], –≤ –Ї–Њ—В–Њ—А–Њ–µ –≤–Њ—И–µ–ї 21 –њ–∞—Ж–Є–µ–љ—В, –ї–µ—З–µ–љ–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ (375 –Љ–≥/–Ї–≥ –≤ —В–µ—З–µ–љ–Є–µ 4 –љ–µ–і–µ–ї—М) –њ—А–Є–≤–µ–ї–Њ –Ї –њ–Њ–ї–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є —Г 18 (86%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —А–µ–Љ–Є—Б—Б–Є–Є —Б–Њ—Б—В–∞–≤–Є–ї–∞ –≤ —Б—А–µ–і–љ–µ–Љ 35 –Љ–µ—Б—П—Ж–µ–≤, –њ—А–Є—З–µ–Љ —Г 8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Г–і–∞–ї–Њ—Б—М –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ–љ–Є—В—М –У–Ъ, –∞ —Г –Њ—Б—В–∞–ї—М–љ—Л—Е – —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–Ј–Є—В—М –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й—Г—О –і–Њ–Ј—Г –њ—А–µ–њ–∞—А–∞—В–∞. –°—Е–Њ–і–љ—Л–µ –і–∞–љ–љ—Л–µ —А–∞–љ–µ–µ –њ–Њ–ї—Г—З–µ–љ—Л –і—А—Г–≥–Є–Љ–Є –∞–≤—В–Њ—А–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–Њ–±—Й–∞—О—В –Њ –њ–Њ–ї–љ–Њ–є —А–µ–Љ–Є—Б—Б–Є–Є —Г 9 –Є–Ј 11 –±–Њ–ї—М–љ—Л—Е —Б —Д–∞—В–∞–ї—М–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Њ–і–љ–∞–Ї–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ —А–µ–Љ–Є—Б—Б–Є–Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞–ї–Њ—Б—М –Є–љ—Д—Г–Ј–Є—П–Љ–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –Є–Љ–Љ—Г–љ–Њ–≥–ї–Њ–±—Г–ї–Є–љ–∞ [45].
–Ч–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ—З–µ–Ї
–Ъ–∞–Ї —Г–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, —А–Є—В—Г–Ї—Б–Є–Љ–∞–± –Ј–∞—А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї —Б–µ–±—П –Ї–∞–Ї —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –і–ї—П –ї–µ—З–µ–љ–Є—П –≤–Њ–ї—З–∞–љ–Њ—З–љ–Њ–≥–Њ –љ–µ—Д—А–Є—В–∞. –Я–Њ—Н—В–Њ–Љ—Г –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –Њ—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –њ—А–Є –і—А—Г–≥–Є—Е —Д–Њ—А–Љ–∞—Е –њ–Њ—З–µ—З–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–Ь–µ–Љ–±—А–∞–љ–Њ–Ј–љ–∞—П –љ–µ—Д—А–Њ–њ–∞—В–Є—П (–Ь–Э) – –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–∞—П –њ—А–Є—З–Є–љ–∞ (20%) –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ (–Ш–Э–°) [46]. –Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ —З—В–Њ —Г —В—А–µ—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Љ–Њ–≥—Г—В —А–∞–Ј–≤–Є–≤–∞—В—М—Б—П —Б–њ–Њ–љ—В–∞–љ–љ—Л–µ —А–µ–Љ–Є—Б—Б–Є–Є, –њ–Њ—З—В–Є –≤ 40% —Б–ї—Г—З–∞–µ–≤ –њ—А–Њ—Ж–µ—Б—Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г–µ—В, –њ—А–Є–≤–Њ–і—П –Ї —А–∞–Ј–≤–Є—В–Є—О —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В –њ–Њ—Б–ї–µ –љ–∞—З–∞–ї–∞ –±–Њ–ї–µ–Ј–љ–Є, –і–∞–ґ–µ –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –њ—А–Њ–≤–Њ–і–Є–Љ—Г—О –Є–Љ–Љ—Г–љ–Њ—Б—Г–њ—А–µ—Б—Б–Є–≤–љ—Г—О —В–µ—А–∞–њ–Є—О [47,48].
–•–∞—А–∞–Ї—В–µ—А–љ–Њ–є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–Њ—З–µ–Ї –њ—А–Є –Ь–Э —П–≤–ї—П–µ—В—Б—П –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –Є–Љ–Љ—Г–љ–љ—Л—Е –і–µ–њ–Њ–Ј–Є—В–Њ–≤ –љ–∞ –≤–љ–µ—И–љ–µ–є —Б—В–Њ—А–Њ–љ–µ –±–∞–Ј–∞–ї—М–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л –Ї–ї—Г–±–Њ—З–Ї–Њ–≤ –њ–Њ—З–µ–Ї. –Ш–Љ–Љ—Г–љ–љ—Л–µ –і–µ–њ–Њ–Ј–Є—В—Л —Б–Њ—Б—В–Њ—П—В –Є–Ј IgG (—З–∞—Б—В–Њ IgG4), –Љ–µ–Љ–±—А–∞–љ–Њ––∞—В–∞–Ї—Г—О—Й–µ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ –Ї–Њ–Љ–њ–ї–µ–Љ–µ–љ—В–∞ (C5b–C9), –∞ —В–∞–Ї–ґ–µ –њ–ї–Њ—Е–Њ –Њ—Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–љ–љ—Л—Е –±–µ–ї–Ї–Њ–≤—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї, –Ї–Њ—В–Њ—А—Л–µ, –Ї–∞–Ї –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В, –Љ–Њ–≥—Г—В –≤—Л—Б—В—Г–њ–∞—В—М –≤ —А–Њ–ї–Є –∞—Г—В–Њ–∞–љ—В–Є–≥–µ–љ–Њ–≤. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ь–Э –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ–Њ–є —Д–Њ—А–Љ–Њ–є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —А–∞–Ј–≤–Є—В–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ —Б–≤—П–Ј–∞–љ–Њ —Б —Б–Є–љ—В–µ–Ј–Њ–Љ «–љ–µ—Д—А–Є—В–Њ–≥–µ–љ–љ—Л—Е» –∞—Г—В–Њ–∞–љ—В–Є—В–µ–ї. –Т –њ—А–Њ—Ж–µ—Б—Б–µ –Є–Ј—Г—З–µ–љ–Є—П —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ–Њ–є –Љ–Њ–і–µ–ї–Є –Ь–Э, –•–µ–є–Љ–∞–љ–Њ–≤—Б–Ї–Њ–≥–Њ –љ–µ—Д—А–Є—В–∞, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –Њ–і–љ–Є–Љ –Є–Ј –≤–µ—А–Њ—П—В–љ—Л—Е –∞—Г—В–Њ–∞–љ—В–Є–≥–µ–љ–Њ–≤ —П–≤–ї—П–µ—В—Б—П –Љ–µ–Љ–±—А–∞–љ–љ—Л–є –±–µ–ї–Њ–Ї –њ–Њ–і–Њ—Ж–Є—В–Њ–≤ –њ–Њ—З–Ї–Є, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–ї—Г—З–Є–ї –љ–∞–Ј–≤–∞–љ–Є–µ –Љ–µ–≥–∞–ї–Є–љ. –Х–≥–Њ –∞–љ–∞–ї–Њ–≥–Њ–Љ –њ—А–Є –Ь–Э —Г —З–µ–ї–Њ–≤–µ–Ї–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М –љ–µ–є—В—А–∞–ї—М–љ–∞—П —Н–љ–і–Њ–њ–µ–њ—В–Є–і–∞–Ј–∞ – —Д–µ—А–Љ–µ–љ—В, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–Є–є –љ–∞ –Љ–µ–Љ–±—А–∞–љ–µ –њ–Њ–і–Њ—Ж–Є—В–Њ–≤ –Є –і—А—Г–≥–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ–Њ—З–µ—З–љ–Њ–є —В–Ї–∞–љ–Є [49].
–Я–Њ –і–∞–љ–љ—Л–Љ P. Ruggenenti –Є —Б–Њ–∞–≤—В. [50], –ї–µ—З–µ–љ–Є–µ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ—В–µ–Є–љ—Г—А–Є–Є, —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–Њ–≥–Њ –∞–ї—М–±—Г–Љ–Є–љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Э–°, —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ –Ї –і–ї–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є –∞–љ–≥–Є–Њ—В–µ–љ–Ј–Є–љ–њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞ (–Р–Я–§). –Ю—В–Љ–µ—З–µ–љ–∞ —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О —В–µ—А–∞–њ–Є–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–Њ–Љ –Є —В—П–ґ–µ—Б—В—М—О –Є–љ—В–µ—А—Б—В–Є—Ж–Є–∞–ї—М–љ–Њ–≥–Њ —Д–Є–±—А–Њ–Ј–∞ –Є –∞—В—А–Њ—Д–Є–Є –Ї–∞–љ–∞–ї—М—Ж–µ–≤, –њ–Њ –і–∞–љ–љ—Л–Љ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –і–Є–љ–∞–Љ–Є–Ї–µ [51].
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤—Л—Б–Њ–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ —Г –і–µ—В–µ–є —Б —Б—В–µ—А–Њ–Є–і—А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л–Љ –љ–µ—Д—А–Њ—В–Є—З–µ—Б–Ї–Є–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ [52] –Є –Њ—З–∞–≥–Њ–≤—Л–Љ —Б–µ–≥–Љ–µ–љ—В–∞—А–љ—Л–Љ –≥–ї–Њ–Љ–µ—А—Г–ї–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ, –љ–µ—А–µ–і–Ї–Њ —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–Љ—Б—П –њ–Њ—Б–ї–µ –њ–µ—А–µ—Б–∞–і–Ї–Є –њ–Њ—З–Ї–Є [53]. –≠—В–Є –і–∞–љ–љ—Л–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –≤ –љ–µ—Д—А–Њ–ї–Њ–≥–Є–Є –Є —В—А–∞–љ—Б–њ–ї–∞–љ—В–Њ–ї–Њ–≥–Є–Є [54].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —А–Є—В—Г–Ї—Б–Є–Љ–∞–± —П–≤–ї—П–µ—В—Б—П —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –і–ї—П –ї–µ—З–µ–љ–Є—П –†–Р –Є –і—А—Г–≥–Є—Е —В—П–ґ–µ–ї—Л—Е –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Х–≥–Њ –≤–љ–µ–і—А–µ–љ–Є–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –њ–Њ –њ—А–∞–≤—Г –Љ–Њ–ґ–љ–Њ —Б—З–Є—В–∞—В—М –Ї—А—Г–њ–љ—Л–Љ –і–Њ—Б—В–Є–ґ–µ–љ–Є–µ–Љ –Љ–µ–і–Є—Ж–Є–љ—Л –љ–∞—З–∞–ї–∞ XXI –≤–µ–Ї–∞, –Ї–Њ—В–Њ—А–Њ–µ –Є–Љ–µ–µ—В –љ–µ —В–Њ–ї—М–Ї–Њ –≤–∞–ґ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ, –љ–Њ –Є —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞—Б—И–Є—Д—А–Њ–≤–Ї–µ —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Ј–≤–µ–љ—М–µ–≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞.
–§–∞–Ї—В–Є—З–µ—Б–Ї–Є —А–Є—В—Г–Ї—Б–Є–Љ–∞–± —П–≤–ї—П–µ—В—Б—П —А–Њ–і–Њ–љ–∞—З–∞–ї—М–љ–Є–Ї–Њ–Љ –љ–Њ–≤–Њ–≥–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П –≤ –ї–µ—З–µ–љ–Є–Є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –ї–µ–ґ–Є—В –Љ–Њ–і—Г–ї—П—Ж–Є—П –Т––Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Ј–≤–µ–љ–∞ –Є–Љ–Љ—Г–љ–Є—В–µ—В–∞.
–Ю–і–љ–∞–Ї–Њ –Є–Ј—Г—З–µ–љ–Є–µ –Љ–µ—Б—В–∞ —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ —В–Њ–ї—М–Ї–Њ –љ–∞—З–Є–љ–∞–µ—В—Б—П. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г, –Ї–∞–Ї —Г–ґ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ—А–µ–њ–∞—А–∞—В –љ–∞–Ј–љ–∞—З–∞–ї–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Њ—З–µ–љ—М —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –±–Њ–ї–µ–Ј–љ–µ–є, –љ–µ—А–µ–і–Ї–Њ –њ–Њ –ґ–Є–Ј–љ–µ–љ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ, –љ–µ—Г–і–Є–≤–Є—В–µ–ї—М–љ–Њ, —З—В–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є (–Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ –†–Р) –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ, —Е–Њ—В—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –≤—Л—И–µ –Њ–њ—В–Є–Љ–Є—Б—В–Є—З–µ—Б–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Б–љ–Њ–≤—Л–≤–∞—О—В—Б—П –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –љ–∞ –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Њ—В–Ї—А—Л—В—Л—Е «–њ–Є–ї–Њ—В–љ—Л—Е» –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–ї–Є —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Є—Б—Е–Њ–і–Њ–≤ —В–µ—А–∞–њ–Є–Є –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –≥—А—Г–њ–њ–∞—Е –±–Њ–ї—М–љ—Л—Е, –Њ–љ–Є —Б–Њ–Ј–і–∞—О—В —Е–Њ—А–Њ—И–Є–µ –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –і–ї—П –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–≥–Њ –≤–љ–µ–і—А–µ–љ–Є—П —А–Є—В—Г–Ї—Б–Є–Љ–∞–±–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Є –і–Њ–ї–ґ–љ—Л —Б—В–Є–Љ—Г–ї–Є—А–Њ–≤–∞—В—М –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є—О —И–Є—А–Њ–Ї–Њ–Љ–∞—Б—И—В–∞–±–љ—Л—Е –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б–њ—Л—В–∞–љ–Є–є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л—Е –і–ї—П —А–∞—Б—И–Є—А–µ–љ–Є—П –Њ—Д–Є—Ж–Є–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О.





–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Browning JL. B cell move to centre stage: novel opportunities for autoimmune disease treatment. Nature Rev. 2006; 5: 564–576
2. Bizzaro N, Tozzoli R, Shoenfeld Y. Are we at stage to predict autoimmune rheumatic diseases? Arthritis Rheum 2007; 56: 1736–1744
3. Hansen A, Lipsky PE, Dorner T. B cell lymphoproliferation in chronic inflammatory rheumatic diseases. Nature Clin Pracr Rheumatol 2007; 3: 561–
4. Edwards JCW, Cambridge G. Rheumatoid arthritis: the predictable effect of small immune complexes in which antibody is also antigen. Br J Rheumatol. 1998; 37:126–130.
5. Youinou P, Jamin C, Saraux A. B–cell: a logical target for treatment of rheumatoid arthritis. Clin Exp Rheumatol 2007; 25: 318–328
6. Driver CB, Ishimori M, Weisman WH. The B cell in systemic lupus erythematosus: a rational target for more effective therapy. Ann Rheum Dis 2007; August 24 on line
7. Edwards JCW, Cambridge G, Leandro MJ. B cell depletion therapy in rheumatic disease Best Pract Res Clin Rheumatol 2006; 20: 915–928
8. Reff ME, Carner K, Chambers KS, et al. Depletion of B cells in vivo by a chimeric mouse human antibody to CD20. Blood. 1994; 83:435–445.
9. Boye J, Elter T, Engert A. An overview of the current clinical use of the anti–CD20 monoclonal antibody rituximab. Ann Oncol 2003; 14: 520–535–Х–Х–Х–Х
10. Johnson P, Glennie M. The mechanism of action of rituximab in the elimination of tumor cells. Semin Oncol 2003 (Supp 2); 30:3–8.
11. –Э–∞—Б–Њ–љ–Њ–≤ –Х–Ы. –Я–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Ї –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–∞–Љ (—А–Є—В—Г–Ї—Б–Є–Љ–∞–±) –њ—А–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–Љ –∞—А—В—А–Є—В–µ. –Ъ–ї–Є–љ. –§–∞—А–Љ–∞–Ї–Њ–ї. —В–µ—А–∞–њ–Є—П 2006; 1–5:55–58
12. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –Э–Њ–≤—Л–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П —В–µ—А–∞–њ–Є–Є —А–µ–≤–Љ–∞—В–Њ–Є–і–љ–Њ–≥–Њ –∞—А—В—А–Є—В–∞: –њ–µ—А—Б–њ–µ–Ї—В–Є–≤—Л –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–Њ–љ–Њ–Ї–ї–Њ–љ–∞–ї—М–љ—Л—Е –∞–љ—В–Є—В–µ–ї –Ї –Т––ї–Є–Љ—Д–Њ—Ж–Є—В–∞–Љ (—А–Є—В—Г–Ї—Б–Є–Љ–∞–±). –†–Ь–Ц 2006; 25: 1778–1782
13. –°–Њ–ї–Њ–≤—М–µ–≤ –°.–Ъ., –Ъ–Њ—В–Њ–≤—Б–Ї–∞—П –Ь.–Р., –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –†–Є—В—Г–Ї—Б–Є–Љ–∞–± –≤ –ї–µ—З–µ–љ–Є–Є —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є. –†–Ь–Ц 2005; 13: 1731–1735
14. Nielsen CH, Fassi DE, Hasselbalch HC, et al. B cell depletion with rituximab in the treatment of autoimmune disrases. Expert Opin Biol Ther 2007; 7: 1061–1078
15. Schmidt E, Hunzelman N, Zillikens D, et al. Rituximab in refractory autoimmune diseases Clin Exp Dermatol 2006; 31: 503–508
16. Lipsky PE. Systemic lupus erythematosus: an autoimmune disease of B cell hyperactivity. Nat Immunol. 2001; 2:764–766.
17. –°–Њ–ї–Њ–≤—М–µ–≤ –°–Ъ, –Ґ–Њ—А–≥–∞—И–Є–љ–∞ –Р, –Р—Б–µ–µ–≤–∞ –Х, –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –†–Є—В—Г–Ї—Б–Є–Љ–∞–±. –Р–љ—В–Є––Т––Ї–ї–µ—В–Њ—З–љ–∞—П —В–µ—А–∞–њ–Є—П —Б–Є—Б—В–µ–Љ–љ–Њ–є –Ї—А–∞—Б–љ–Њ–є –≤–Њ–ї—З–∞–љ–Ї–Є. –У–£ –Ш–љ—Б—В–Є—В—Г—В —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є –†–Р–Ь–Э, –Ь–Њ—Б–Ї–≤–∞, 2007, 20 —Б—В—А.
18. Moutsopoulos HM, Chused TM, Mann DL, et al. Sjogrens`s syndrome (sicca syndrome): current issues. Ann Intern Med 1980; 92: 212–226
19. Ramos–Casals M, Brito–Zeron P. Emerging biological therapy in primary Sjogren`s syndrome. Rheumatology 2007, June 22, on line.
20. Gottenberg J–E, Guillevin L, Lambotte O, et al. Tolerance and short term efficacy of rituximab in 43 patients with systemic autoimmune disease. Ann Rheum Dis 2005;64: 913–920.
21. Pijpe J, van Imhoff GW, Spijkervet FK, et al. Rituximab treatment in patients with primary Sjogren`s syndrome: an open–label phase II study. Arthritis Rheum 2005; 64: 913–920
22. Seror R, Sorbet C, Guilleven L, et al. Tolerance and efficacy of rituximab and changed in serum biomarkers in patients with systemic complications of primary Sjogren`s syndrome. Ann Rheum Dis 2006; Sept 1 on lime
23. Davauchelle–Pensec V, Pennec Y, Morvan J, et al. Improvement of Sjogren`s syndrome after two infusions of rituximab (Anti–CD20). Arthritis Care Res 2007; 57: 310–317
24. Voulgarelis M, Giannouli S, Anagnostou D, Tzioufas AG, Combined therapy with rituximab plus cyclophosphamide/doxorubicin/vincristin/prednisolon (CHOP) for Sjogren`s syndrome associated B–cell aggressive B cell aggressive non–Hodgkin`s lymphoma. Rheumatology (Oxford) 2004; 43: 1050–1053
25. Dalakas MC, Hohlfeld R. Polymyositis and dermatomyositis. Lancet 2003; 362: 971–982.
26. Levin T.D. Rituximab in the treatment of dermatomyositis. Arthritis Rheum 2005; 52: 601–607.
27. Noss EH, Hausner–Sypek DL, Weinblatt ME. Rituximab as the therapy for refractory polymyositis and dermatomyositis. J Rheumatol 2006; 33: 1021–1026.
28. Lambotte O, R Kotb, G Maigne et al. Efficacy of Rituximab in refractory polymyositis.J Rheumatology 2005;32:1369–70.
29. Brulhart L, Waldburger J–M, Gabay C. Rituximab in the treatment of antisynthetase syndrom. Ann Rheum Dis 2006; 65: 974–975
30. Cooper MA, Willingham DL, Brown DE, et al. Rituximab for the treatment of juvenile dermatomyositis. Arthritis Rheum 2007; 56: 3107–3111
31. Mok CC, Ho LY, To CH. Rituximab for refractory polymyositis: an open–label prospective study. J Rheumatol 2007; 34: 1864–1868
32. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы., –С–∞—А–∞–љ–Њ–≤ –Р.–Р., –®–Є–ї–Ї–Є–љ–∞ –Э.–Я. –Т–∞—Б–Ї—Г–ї–Є—В—Л –Є –≤–∞—Б–Ї—Г–ї–Њ–њ–∞—В–Є–Є. –ѓ—А–Њ—Б–ї–∞–≤–ї—М. –Ш–Ј–і–∞—В–µ–ї—М—Б—В–≤–Њ «–Т–Њ–ї–≥–∞», 1999., 612 —Б—В—А.
33. Flossman O, Jones RB, Jayne DRW, Luqmani RA. Should rituximab be used to treat antineutrophil cytoplasmic antibody associated vasculitis? Ann Rheum Dis 2006;15 June on line.
34. Keogh KA, Ytterberg SR, Fervenza FC, Carlson KA, Schroeder DR, Specks U. Rituximab for refractory Wegener’s granulomatosis: report of a prospective, open–label pilot trial. Am J Respir Crit Care Med 2006;173:180–7
35. Aries PM, Hellmich B, Voswinkel J, Both M, Nolle B, Holl–Ulrich K, et al. Lack of efficacy of rituximab in Wegener’s granulomatosis with refractory granulomatous manifestations. Ann Rheum Dis 2006;65:853–8.
36. Keogh KA, Wylam ME, Stone JH, Specks U. Induction of remission by B lymphocyte depletion in eleven patients with refractory antineutrophil cytoplasmic antibody–associated vasculitis. Arthritis Rheum 2005;52:262–8
37. Eriksson P. Nine patients with anti–neutrophil cytoplasmic antibody–positive vasculitis successfully treated with rituximab. J Intern Med 2005;257:540–8.
38. Omdal R, Wildhagen K, Hansen T, Gunnarsson R, Kristoffersen G. Anti–CD20 therapy of treatment–resistant Wegener’s granulomatosis: favourable but temporary response. Scand J Rheumatol 2005;34:229–32
39. Cocoub P, Delluc A, Saadoun D, et al. Anti–CD20 monoclonal antibody (rituximab) treatment for cryoglobulinemia vasculitis? Where do we stand? Ann Rheum Dis 2007; 20 June on line.
40. Arnold DA, Dentali F, Crowther MA, et al. Systemic review: efficacy and safety of rituximab for adults with idiopathic thrombocytopenic purpura. Ann Intern Med 2007; 146: 25–33
41. Anhalt GJ, Diaz LA. Research advances in pemphigus. JAMA 2001; 285:652–654
42. Kottke MD, Delva E, Kowalczyk. The desmosome; cell science lessons from human diseases. J Cell Sci 2006; 119: 797–806
43. Schmidt E, Hunzelman N, Zillikens D, et al. Rituximab in refractory autoimmune bullous diseases. Clin Exp Dermatol 2006; 31: 503–508
44. Joly P, Mouquet H, Roujeau J–C, et al. A single cycle of rituximab for the treatment of severe pemphigus. New Engl J Med 2007; 357: 545–552
45. Ahmed AR, Spigelman Z, Cavacini LA, Posner MR. Treatment of pemphigus vulgaris with rituximab and intravenous immune globulin. New Engl J Med 2006; 355: 1772–1779
46. Glassoks RJ. Diagnosis and natural course of membranous nephropathy. Semin Nephrol 2003; 23: 324–332.
47. Glassock RJ. The treatment of idiopathic membranous nephropathy; a dilemma or a conundrum? Am J Kidney Dis 2004; 44: 562–566
48. Perna A, Schieppati A, Zamora J, et al. Immunosupressive treatment for idiopathic membranous nephropathy: a systemic review. Am J Kidney Dis 2004; 44: 385–401
49. Ronco P, Debiec H. Molecular dissection of target antigens and nephritogenic antibodies in membranous nephropathy; towards epitope–driven therapies. J Am Soc Nephrol 2006; 17: 1772–1774
50. Ruggenenti P, Chiurchiu C, Brusegan V, et al. Rituximab in idiopathic membranous nephropathy; a one–year prospective study. J Amer Soc Nephrol 2003;14:1851–1857
51. Ruggenenti P, Chiurchiu C, Abbate M, et al. Rituximab for idiopathic membranous nephropathy; who can benefit? Clin J Am Soc Nephrol 2006; 1: 738–748
52. Bagga A, Sinha A, Moudgil A. Rituximab in patients with steroid–resistant nephrotic syndrome. New Engl J Med 2007; 356: 2751–2752
53. Pescovitz MD, Book BK, Sidner RA. Resolution of recurrent focal segmental glomerulosclerosis proteinuria after rituximab treatment. N Engl J Med 2006; 35: 1961–1963
54. Salama AD, Pusey CD. Rituximab in renal disease and transplantation Nature Clin Pract Nephrol 2005; 2: 221–230.












