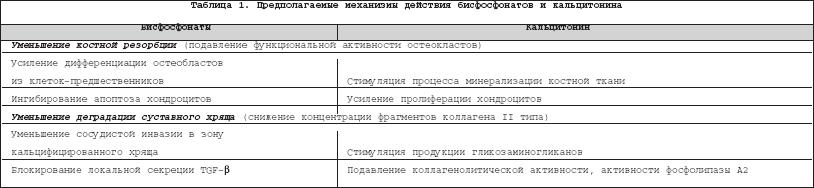
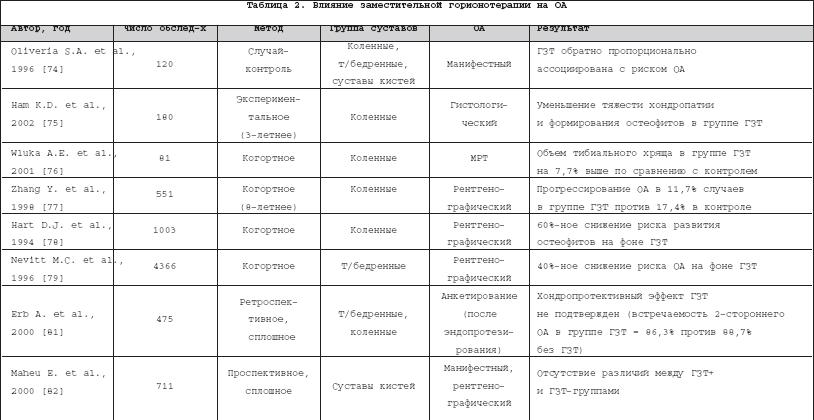
Интерес к изучению субхондральной кости, в том числе ее минеральной плотности (МПКТ), возник благодаря появлению новых сведений о патогенезе остеоартроза (ОА), когда стало ясно, что данное заболевание проявляется не только потерей суставного хряща, но и изменениями в костной ткани. В последние годы появилась теория о том, что происходящие в субхондральной кости изменения, возможно, являются первичными и способны инициировать деградацию хряща [1–4]. Одна из гипотез, объясняющих этот процесс, заключается в способности субхондральной кости продуцировать большое количество провоспалительных цитокинов и факторов роста, которые могут проникать в вышележащий хрящ (вследствие образования микротрещин хряща и сосудистой инвазии в зону кальцифицированного хряща) и вовлекаться в деградацию хрящевой ткани [5]. Вышеописанные процессы являются cледствием нарушения ремоделирования субхондральной кости, сдвигающегося в сторону усиления костной резорбции на ранних стадиях ОА и повышения костеобразования в дальнейшем. Регуляция ремоделирования костной ткани осуществляется как на системном, так и на локальном уровнях. Системное воздействие оказывают ряд остеотропных гормонов, к которым относятся паратиреоидный гормон (ПТГ), кальцитонин (КТ), соматотропный гормон (СТГ), тиреоидные и половые гормоны. Основными кальциотропными гормонами являются КТ и ПТГ, их секреция ассоциирована с разнонаправленными изменениями концентрации кальция в крови: повышением концентрации – для КТ и снижением – для ПТГ. КТ ингибирует активность остеокластов и, следовательно, костную резорбцию и стимулирует минерализацию костной ткани, точнее, ускоряет ее начало [6]. Основными клетками–мишенями ПТГ являются остеобласты: под действием этого гормона увеличивается их образование из клеток–предшественников и возрастает функциональная активность. Подобный эффект наблюдается в случае интермиттирующего поступления ПТГ, тогда как постоянное повышение его концентрации в крови приводит к стимуляции активности остеокластов и усилению костной резорбции [7], что подтверждено в экспериментальных исследованиях [8,9]. Помимо влияния на остеобласты и остеокласты, в исследованиях in vitro показано, что ПТГ способен усиливать пролиферацию хондроцитов в пластинке роста, а также оказывать дозозависимое стимулирующее действие на синтез коллагена и протеогликанов. Кроме того, ПТГ оказывает двухфазный эффект на активность костной щелочной фосфатазы: первоначальная стимуляция этого фермента сменяется в дальнейшем подавлением его активности. Это явление характерно для низких концентраций ПТГ, в то время как высокие его концентрации оказывают только ингибирующее действие [6]. Кроме ПТГ, пролиферацию и дифференцировку остеобластов и хондроцитов стимулирует СТГ, активность зрелых клеток контролируется тиреоидными и половыми гормонами, а на клеточном уровне – многочисленными цитокинами и факторами роста, многие из которых продуцируются остеобластами. Так, инсулиноподобный фактор роста–1 (IGF–1), трансформирующий фактор роста– ? (TGF– ? ) и факторы роста фибробластов стимулируют дифференцировку остеобластов из клеток–предшественников [10,11] и усиливают костеобразование. Интерлейкины (IL) –1,6,11 и фактор некроза опухоли– ? (ФНО– ? ) способствуют созреванию и активации остеокластов и повышению костной резорбции; IL–4,10,13, антагонисты рецептора IL–1 и интерферон– ? оказывают противоположный эффект [12,13]. Ряд цитокинов и факторов роста, помимо участия в ремоделировании кости, способны вызывать деградацию хряща: TGF– ? – через стимуляцию активности металлопротеиназ, IGF–1 – активатора плазминогена, IL–1,6 способны напрямую вызывать деструктивные изменения в хрящевом матриксе. Рядом клинических исследований подтверждено, что при ОА наблюдается увеличение скорости обеих составляющих ремоделирования костной ткани – и резорбции, и костеобразования [14–16]. Преобладание какого–либо процесса зависит от стадии заболевания, и, кроме того, скорость костного обмена замедляется с возрастом. Костная ткань при ОА имеет ряд особенностей. В ней определяется повышенное содержание коллагена I типа, IGF–1, TGF– ? , низкая минерализация и сходный с нормальной костной тканью уровень cross–linкs [17,18]. Ответ остеобластов на ПТГ–стимуляцию при ОА снижен примерно на 50% по сравнению с нормой [19], что может быть обусловлено IGF–1–индуцированным снижением количества ПТГ–рецепторов [20]. Следствием подобного нарушения системной регуляции при ОА может быть повышение уровня щелочной фосфатазы и остеокальцина, продуцируемых остеобластами [17,18], хотя данные изменения обнаружены и в исследованиях in vitro (на изолированной культуре остеобластов, лишенных системного влияния), что является подтверждением нарушения метаболизма в самих остеобластах [19]. Снижение МПКТ субхондральных участков кости на ранних стадиях ОА отмечалось как в экспериментальных моделях [21,22], так и у больных с гонартрозом: Karvonen R.L. с соавт. в 1998 г. установили достоверное уменьшение значений МПКТ в субхондральных участках бедренной и большеберцовой костей у женщин с начальными стадиями ОА коленных суставов [23]. Дальнейший процесс костеобразования и утолщения субхондральной кости не всегда сопровождается повышением ее минерализации [15,19,24,25]. Это объясняется изменениями, возникающими в клеточном метаболизме, в частности: • повышением активности остеобластов, которое приводит к увеличению объема остеоидного матрикса со сниженным содержанием минеральных веществ [19]; • нарушением регуляции синтеза протеинов, т.е. синтезом коллагена, неспособного к минерализации. Данная особенность обусловлена изменением соотношения ? 1– и ? 2–цепей в составе коллагена I типа (2,4:1 в нормальной кости и от 4:1 до 17:1 – при ОА) [26]; повышение содержания ? 1 и снижение ? 2, по сведениям Misof K. с соавт., вызывает 50%–ное снижение прочности кости и снижение минерализации компактно лежащих коллагеновых волокон [26,27]. Увеличение объема остеоида при ОА подтверждено исследованием микроструктуры субхондральной кости тибиального плато; он составил 54,1±10,6% против 37,8±8,1% в контроле, р <0,01 [28]. Многочисленные исследования на животных моделях ОА и образцах субхондральной кости и суставного хряща больных, подвергшихся эндопротезированию, подтверждают, что наибольшая степень деградации хряща наблюдается при большей выраженности и глубине изменений в архитектонике субхондральной кости [28]; кроме того, отмечено, что изменения в субхондральной кости предшествуют поражению хряща [4,19,29,30]. Нарушение структуры и изменение МПКТ субхондральной кости могут, по–видимому, способствовать прогрессии ОА. В ряде исследований было показано, что изменения в сцинтиграфической картине (отражающие повышение обмена субхондральной кости) служат предиктором последующих рентгенологических изменений [31,32], и, наоборот, ни у одного из больных с нормальными исходными сцинтиграфическими показателями (обследовались больные с гонартрозом в течение 5 лет) прогрессирования не было [33]. В работе Bruyere O. с соавт. [34], в которой проводилась рентгенологическая оценка ширины суставной щели у 56 пациентов с гонартрозом с интервалом в год, установлена достоверная связь между МПКТ субхондральной кости и прогрессированием ОА: больные с исходно низкими значениями МПКТ (<0,73 г/см 2 ) демонстрировали менее заметное сужение суставной щели через год наблюдения по сравнению с теми, у кого исходные значения МПКТ превышали 0,96 г/см 2 . Таким образом, значения МПКТ субхондральных участков большеберцовой кости рассматриваются в качестве предиктора прогрессирования ОА. Кроме субхондральной кости, большая роль в патогенезе ОА принадлежит зоне кальцифицированного хряща, активация которой может приводить к сосудистой инвазии и кальцификации неминерализированного хряща. В кальцификации хрящевой ткани большое значение отводится апоптозным хондроцитам, имеющим связанные с мембраной везикулы с гидроксиапатитными кристаллами. Процесс отложения минералов напрямую связан с активностью щелочной фосфатазы [6]. Часть авторов склонна считать именно эту зону хряща ответственной за прогрессирование ОА, так как кроме непосредственного вмешательства в хрящевой метаболизм, она является «проводником» для цитокинов и факторов роста, проникающих в хрящ из субхондральной кости [4,35,36]. Осознание роли субхондральной кости в развитии ОА привело к поиску новых путей терапии этого заболевания, в частности, разработке препаратов, точкой приложения которых являлась бы не только хрящевая, но и костная ткань. В последнее десятилетие стало появляться все больше сведений по вопросу применения противоостеопоротических препаратов для лечения ОА, что связано с возможностью вмешательства в метаболизм субхондральной кости, а также наличием у этих препаратов хондропротективных свойств. В первую очередь это касается бисфосфонатов [37–39] и кальцитонина [40]. Среди механизмов действияданных препаратов при ОА обсуждаются следующие (табл. 1). Для бисфосфонатов (БФ): • Потенциальное подавление активности остеокластов, а также регулирование их взаимодействия с остеобластами [41] и усиление дифференциации остеобластов [42]. Предполагается, что действие азотсодержащих БФ (алендронат, ризедронат) опосредовано через сигнальные протеины, ответственные за функцию остеокластов и предупреждение их апоптоза, в то время как не содержащие азот БФ имеют несколько другие механизмы действия, например, образование в остеокластах цитотоксических метаболитов (негидролизуемых аналогов АТФ) [43]. Прогресс в изучении механизмов действия БФ достигнут за последние 4 года. Еще в 1998 г. Rodan G.A. с соавт. [44] писали о том, что действие БФ изучено лишь на клеточном уровне. Позднее (2000–2004 г.) этими же авторами представлена молекулярная модель действия этих препаратов [45,46]. Суть ее заключается в способности азотсодержащих БФ ингибировать энзим, участвующий в биосинтезе холестерола. Таким образом, они вмешиваются в процесс прикрепления изопреноидных липидов к регуляторным белкам (ГТФ–азам), что вызывает инактивацию остеокластов. • Прямое или опосредованное (через первичную супрессию костного обмена) действие на хрящ и уменьшение его деградации [37]. • Влияние на апоптоз. В исследовании in vitro при инкубации бычьих хондроцитов с дексаметазоном и бисфосфонатами установлено, что последние способны ингибировать дексаметазон–индуцированные апоптоз, а также замедление роста хондроцитов и их способности к пролиферации [47–49]. • Потенциальное уменьшение сосудистой инвазии в зону кальцифицированного хряща [50]. • Блокирование локального высвобождения TGF– ? , возможно через ингибирование экспрессии металлопротеиназы–13 в хряще и металлопротеиназы–9 в субхондральной кости при ОА [50]. Для кальцитонина (КТ) (Миакальцик): • Уменьшение костной резорбции [51]. • Усиление пролиферации хондроцитов и продукции гликозаминогликанов [52,53]. • In vitro КТ снижает (дозозависимым образом) коллагенолитическую активность и активность фосфолипазы А2 [54]. Кроме того, добавление КТ к культуре хондроцитов стимулирует процесс минерализации костной ткани [6]. Хондропротективныйэффект противоостеопоротических препаратов подтверждается анализом уровня продуктов деградации хряща и маркеров костной резорбции в сыворотке крови и моче. Известно, что концентрация фрагментов коллагена II типа, свойственного главным образом хрящу, повышена у больных с ОА по сравнению со здоровым контролем [55], и более того, эта концентрация коррелирует с площадью поверхности сустава [56]. Для определения уровня деградации коллагена I и II типов используется метод иммуноанализа ELISA, основанный на применениии моноклональных антител, специфичных для эпитопов коллагена [55]. Этим же методом может быть определен и уровень гиалуроновой кислоты и кератансульфата [57], которые обсуждаются в качестве маркеров прогрессирования ОА [58,59]. Кроме того, пациентам с прогрессирующим течением гонартроза свойственно повышение экскреции с мочой маркеров костной резорбции (N– и С–концевой телопептиды коллагена I типа, пиридинолин и дезоксипиридинолин) [60]. Проведено множество исследований на животных моделях ОА, которые демонстрируют хондропротективный эффект БФ и КТ. В частности, в экспериментальных моделях ОА у кроликов отмечена регенерация поверхности суставного хряща и замедление формирования остеофитов в группе животных, получающих KT [19,61]. В исследовании Manicourt D–H с соавт. [51] на модели ОА у собак (после рассечения передней крестообразной связки) отмечено повышение уровня гиалуроната и кератансульфата в крови, а также пиридолина и деоксипиридинолина в моче уже на ранней стадии заболевания. Применение KT вызывало значительное снижение уровня этих маркеров и тяжести поражений, причем улучшение вышеуказанных параметров находилось в прямой зависимости от длительности лечения. В аналогичном по дизайну исследовании Behets C. с соавт., проведенном в 2004 г. [62], при интраназальном назначении КТ отмечено значительное уменьшение степени дегенеративных изменений в хряще и отсутствие различий в МПКТ субхондральной кости между оперированными и неоперированными животными. Положительные результаты получены и в экпериментальных работах с использованием БФ. Введение золедроновой кислоты кроликам, деградация хряща у которых вызывалась внутрисуставной инъекцией химопапаина, приводило к уменьшению степени хондропатии и снижению экскреции с мочой маркеров костной резорбции [63]. В исследовании Hayami T. с соавт., выполненном в США в 2004 г., на модели ОА у крыс с рассечением передней крестообразной связки подтвержден хондропротективный эффект алендроната, а также его модулирующее действие на субхондральную кость: снижение резорбции на ранних стадиях (через 2 недели после операции) и предотвращение последующего повышения костеобразования (начиная с 10–й недели после операции). Помимо этого, отмечено уменьшение инвазии новообразованных сосудов в зону кальцифицированного хряща и дозозависимое ингибирование роста остеофитов [50]. 6–недельное применение ризедроната у кроликов с рассечением передней крестообразной связки также вызывало повышение МПКТ субхондральной кости (МПКТ в дистальных отделах бедренной кости после операции была на 18% ниже, чем у 10–летних неоперированных животных, взятых в качестве контроля, в то время как у получающих ризедронат – только на 5%) [64]. В 2002 г. Lehmann H.J. с соавт. [37] проведено рандомизированное плацебо–контролируемое исследование по использованию алендроната и ибандроната у постменопаузальных женщин. Анализ результатов показал, что у женщин с ОА бисфосфонаты вызывали достоверное снижение концентрации продуктов деградации коллагена I типа в крови и II типа в моче. Однако отмечено, что для протективного действия на хрящ необходимы несколько более высокие дозы БФ, чем для подавления потери костной массы. Косвенным подтверждением этому может служить тот факт, что уменьшение деградации суставного хряща на фоне приема БФ (также как влияние на формирование остеофитов и сосудистую инвазию) отмечено не во всех экспериментальных работах [65]. Важным моментом в действии КТ (в большей степени) и БФ является их способность оказывать анальгетический эффект . Возможными механизмами действия КТ (Миакальцика) являются как прямое центральное действие (ингибирование функции нейронов и их ответа на болевые раздражители; воздействие на специфические рецепторы в участках головного мозга, ответственныхза восприятие боли), так и периферическое (подавление синтеза простагландинов и тромбоксана, а также возможное действие через ? –эндорфинную систему) [66,67]. БФ также свойственно анальгетическое действие [68,69]. Так, внутрисуставное введение клодроната пациентам с вторичным синовитом коленных суставов сопровождалось статистически значимым уменьшением боли в покое и при движении (оцениваемое по ВАШ), причем это уменьшение коррелировало со снижением концентрации простагландина Е2 [70] Таким образом, КТ и БФ являются перспективными препаратами для лечения не только остеопороза, но и ОА. Возможно, не менее перспективным направлением в терапии ОА окажется применение препаратов женских половых гормонов . Влияние гормонозаместительной терапии (ГЗТ) на риск возникновения и течение ОА остается не до конца изученным, сведения о действии этих препаратов на хрящ, в том числе на хрящ различных суставов, иногда разнонаправлены (табл. 2). В настоящее время доказано наличие в хряще эстрогеновых рецепторов, а также способность эстрогенов стимулировать синтез протеогликанов и IGF–связанного протеина–2 хондроцитами, оказывая прямое хондропротективное действие на хрящевую ткань [71]. Кроме того, эффект эстрогенов связан с воздействием на костную ткань, а именно торможением продукции IL1,6, TGF– ? и лизосомных ферментов остеокластов и активацией синтеза проколлагена I типа [72,73]. Существует довольно большое число исследований (как экспериментальных, так и эпидемиологических проспективных наблюдений), подтверждающих гипотезу о том, что длительная (в течение 3–5 лет) гормонозаместительная терапия (ГЗТ) снижает риск развития ОА [74] и замедляет его прогрессию (степень хондропатии, формирование остеофитов и сужение суставной щели) [75–77]. В длительном 8–летнем исследовании, в которое вошли 551 женщина в возрасте 63–91 года, оценивалась рентгенологическая стадия гонартроза (от 0 до 4 по Kellgren–Lawrence). Выявлены статистически значимые различия в прогрессировании заболевания между пациентами, принимающими эстрогены, и контролем: увеличение стадии гонартроза на 1 ступень отмечено у 17,4%, на 2–3 ступени – у 5,8% пациентов, не принимающих эстрогены; в то время как в группе ГЗТ прогрессирование гонартроза выявлено только в 11,7% случаев и максимум на 1 стадию [77]. В работе Hart D.J. с соавт. [78] 4–летний прием эстрогенов сопровождался 60%–ным снижением риска развития остеофитов в коленных суставах. По данным Nevitt M.C. и Spector T.D. [79,80], проведение ГЗТ в течение 8–10 лет приводило к снижению риска развития коксартроза и гонартроза, хотя и недостоверно. Однако в ряде исследований не удалось подтвердить хондропротективный эффект ГЗТ ни при ОА т/бедренных и коленных суставов [81], ни при узелковой форме ОА [81,82]. Более того, в одной из работ описывается наличие ассоциации между приемом эстрогенов (в течение года) и возникновением ОА т/бедренных суставов и суставов кистей по сравнению с контролем (4,1% vs 1,1% и 15,8% vs 13,5% соответственно) [83]. Кроме самих эстрогенов, идет изучение препаратов, воздействующих на эстрогеновые рецепторы. В костной ткани они действуют в качестве агонистов гормонов, снижая секрецию IL–6 [84] и стимулируя синтез TGF– ? [85]. Таким образом, расширение наших знаний о патогенезе ОА, роли субхондральной кости, открывает новые возможности в лечении этого заболевания в плане использования противоостеопоротических препаратов. Вместе с тем полученные предварительные результаты по применению таких средств диктуют необходимость проведения дальнейших исследований по изучению механизмов действия рассматриваемых препаратов и выработке оптимальных схем их применения.
Литература
1. Hilal G, Martel–Pelletier J, Pelletier JP, et al. Abnormal regulation
of urokinase plasminogen activator by insulin–like grows factor
1 in human osteoarthritic subchondral osteoblasts. Arthritis
Rheum 1999;42:2112–2
2. Westacott CI, Webb GR, Warnock MG, et al. Alteration of cartilage
metabolism by cells from osteoarthritic bone. Arthritis Rheum
1997;40:1282–91
3. Westacott CI, Webb GR, Elson CJ. Cells from osteoarthritic bone
produse enzymes which degrade cartilage. Trans Orthop Res Soc
1998;23:919
4. Burr DB, Schaffler MB. The involvement of subchondral mineralized
tissues in osteoarthrosis: quantitative microscopic evidence.
Microsc Res Tech 1997;37(4):343–57
5. Lajeunesse D, Massicotte F, Pelletier JP, Martel–Pelletier J.
Subchondral bone sclerosis in osteoarthritis: not Just an innocent
bystander. Mod Rheumatol 2003;13:7–14
6. Ishikawa Y, Wu LNY, Genge BR, et al. Effects of calcitonin and
parathyroid hormone on calcification of primary cultures of chicken
growth plate chondrocytes. J Bone Miner Res 1997;12(3):356
7. Kronenberg HM. Parathyroid hormone: mechanism of action. In: Favus
MJ (eds). Primer on the metabolic bone disease and disorders of mineral
metabolism. Raven Press, New York, NY, USA, American Society
for Bone and Mineral Research 2nd ED, 1993, 58–60
8. Tam CS, Heersche JNM, Murray TM, Parsons JA. Parathyroid hormone
stimulates the bone apposition rate independently of its resorptive
action: differential effect of intermittent and continuous administration.
Endocrinology 1982;110:505–12 [abstract]
9. Hock JM, Gera I. Effect of continuous and intermittent administration
and inhibition of resorption on the anabolic response of bone
to parathyroid hormone. J Bone Miner Res 1992;7:65–72 [abstract]
10. Bonewald LF, Dalls SL. Role of activated and latent transforming
growth factor in bone formation. J Cell Biochem 1994;55:350–7
11. Canalis E. Skeletal growth factors. In: Marcus R, Feldman D,
Kelsey J eds. Osteoporosis. Academic Press, San Diego, 1996:261–79
12. Manolagos SC, Jilka RL. Bone marrow, cytokines, and bone remodeling
– emerging insights into the pathophysiology of osteoporosis.
N Engl J Med 1995;332:305–11
13. Udagawa N, Horwood NJ, Elliott J, et al. Interleukin–18 (interferon–[
gamma]–inducing factor) is produced by osteoblasts and acts
via granulocyte/macrophage colony–stimulating factor and not via
interferon–[gamma] to inhibit osteoclast formation. J Exp Med
1997;185:1005–12
14. Seibel MJ, Duncan A, Robins SP. Urinary hydroxy–pyridinium
crosslinks provide indices of cartilage and bone involvement in
arthritic diseases. J Rheumatol 1989;16:964–70.
15. Li B, Marshall D, Roe M, Aspden RM. The electron microscope
appearance of the subchondral bone plate in the human femoral head
in osteoarthritis and osteoporosis. J Anat 1999;195(Pt 1):101–10
16. Sowers M, Zobel D, Weissfeld L, et al. Progression of
osteoarthritis of the hand and metacarpal bone loss. A twenty–year
follow up of incident cases. Arthritis Rheum 1991;34:36–42.
17. Mansell JP, Tarlton JF, Bailey AJ. Biochemical evidence for
altered subchondral bone collagen metabolism in osteoarthritis of
the hip. Br J Rheumatol 1997;36:16–19.
18. Gevers G, Dequeker J. Collagen and non–collagenous protein content
(osteocalcin, sialoprotein, proteoglycan) in the iliac crest
bone and serum osteocalcin in women with and without hand
osteoarthritis. Coll Relat Res 1987;7:435–42
19. Lajeunesse D. The role of bone in treatment of osteoarthritis.
Osteoarthritis Cartilage 2004;12 Sappl A:S34–8
20. Hilal G, Massicotte F, Martel–Pelletier J, et al. Endogenous
prostaglandin E2and insulin–like growth factor 1 can modulate the
levels of parathyroid hormone receptor in human osteoarthritic
osteoblasts. J Bone Miner Res 2001;16:713–21
21. Messner K, Fahlgren A, Ross I, Andersson B. Simultaneous changes
in bone mineral dencity and articular cartilage in a rabbit meniscetomy
model of knee oateoarthrosis. Osteoarthritis Cartilage
2000;8:197–206
22. Pastoureau PC, Chomel AC, Bonnet J. Evidence of early subchondral
bone scanges in the menisectomized guinea pig: a densitometric
study using dual X–ray absorptijmetry subregional analysis.
Osteoarthritis Cartilage 1999;7:466–73
23. Karvonen RL, Miller PR, Nelson DA, et al. Periarticular osteoporosis
in osteoarthritis of the knee. J Rheumatol. 1998
Nov;25(11):2187–94.
24. Hunter DJ, Spector TD. The role of bone metabolism in
osteoarthritis. Curr Rheumatol Rep 2003;5(1):15–9
25. Li B, Aspden RM. Composition and mechanical properties of cancellous
bone from the femoral head of patients with osteoporosis or
osteoarthritis. J Bone Miner Res 1997;12:641–51
26. Bailey AJ, Sims TJ, Knott L. Phenotypic expression of osteoblast
collagen in osteoarthritic bone: production of type I homotrimer. Int
J Biochem Cell Biol 2002;34:176–82
27. Misof K, Landis WJ, Klaushofer K, et al. Cjllagen from the osteogenesis
imperfecta mouse model (oim) shows redused resistance
against tensile stress. J Clin Invest 1997;100:40–5
28. Bobinac D, Spanjol J, Zoricic S, Maric I. Changes in articular
cartilage and subchondral bone histomorphometry in osteoarthritic
knee joints in humans. Bone 2003;32(3):284–90














