Анемия и хроническая сердечная недостаточность
Большинство проблем, связанных с диагностикой, лечением и реабилитацией пожилых больных хронической сердечной недостаточностью (ХСН), по-прежнему приходится решать врачу-терапевту и врачу общей практики. ХСН на сегодняшний день вполне возможно рассматривать как заболевание пожилого возраста, поскольку в течение последних двух десятилетий существенно изменился «фенотип» больных ХСН: увеличилось число больных старшего возраста, число больных с сохраненной и промежуточной фракцией выброса левого желудочка (ФВЛЖ), количество сопутствующих заболеваний и принимаемых лекарственных препаратов [1, 2].
Сопутствующие заболевания могут взаимно провоцировать прогрессирование друг друга, включая декомпенсацию сердечной деятельности, приводя к госпитализациям или летальному исходу. Среди сопутствующих заболеваний особый интерес представляют анемия и железодефицитное состояние (дефицит железа).
Анемия — это патологическое состояние, которое характеризуется абсолютным снижением концентрации гемоглобина и количества эритроцитов в единице объема крови за счет их уменьшения в организме. Эксперты ВОЗ (2001) рекомендуют использовать значения гемоглобина 13,0 г/дл и ниже у мужчин и 12,0 г/дл и ниже у женщин в качестве диагностических критериев анемии, осложнившей течение ХСН.
Дефицит железа (сидеропения, гипосидероз) — это состояние здоровья, при котором доступное количество железа в организме недостаточно для удовлетворения его потребностей, и может наблюдаться как на фоне анемии, так и без нее [3].
Железодефицитная анемия (ЖДА) представляет собой клинико-гематологический синдром, возникающий при развитии дефицита железа вследствие патологических (или физиологических) процессов, и характеризуется снижением концентрации гемоглобина в сочетании с клиническими признаками сидеропении: трофические нарушения кожи (шелушение, трещины кожных покровов), изменение слизистых оболочек, повышенная ломкость ногтей, выпадение волос, гипотрофический глоссит, гастрит, энтерит, сидеропеническая дисфагия.
Анемия выявляется приблизительно у 30% амбулаторных пациентов со стабильным течением ХСН и у 50% пациентов, получающих лечение в госпитальных условиях, независимо от характера ФВЛЖ. В отличие от популяции пациентов с ХСН, анемия регистрируется у 10% всего населения, и ее частота нарастает с возрастом, достигая 20% у лиц 85 лет и старше [4]. По сравнению с пациентами с ХСН без анемии пациенты с ХСН и анемией обычно старше, среди них чаще встречаются женщины, лица с хронической болезнью почек (ХБП), сахарным диабетом, отечным синдромом, у них более тяжелое течение заболевания, более низкий функциональный статус и уровень артериального давления, более высокая частота назначения диуретиков и более высокий уровень нейрогуморальной, провоспалительной цитокиновой активности и неблагоприятных исходов заболевания [5].
Результаты крупного исследования RED-HF trial (Reduction of Events With Darbepoetin Alfa in Heart Failure) показали, что сама по себе анемия, возможно, не является предиктором летального исхода у больных ХСН, но выступает маркером тяжелого течения сердечной недостаточности [6]. Анемия даже легкого течения при ХСН ассоциируется с ухудшением клинического состояния, снижением функциональной активности, адаптивными гемодинамическими изменениями, усугубляющими процессы ремоделирования левого желудочка (ЛЖ), почечной дисфункцией и госпитализациями [7, 8].
При выявлении у пациента пожилого возраста с ХСН анемии перед врачом, особенно в первичном звене, встает ряд вопросов:
Какова причина анемии?
Каков минимум диагностических мероприятий, требуемых для выявления характера анемии?
Как правильно назначить лечение?
Согласно общепринятой точке зрения анемия у пожилых больных не связана с возрастными изменениями кроветворной системы, а является в большинстве случаев проявлением сопутствующих заболеваний, которые чаще встречаются в более старшем возрасте (ХБП, неопластические процессы, нарушение питания, в основном за счет снижения употребления продуктов, содержащих железо), а другие могут быть не связаны с инволютивными изменениями (эрозивно-язвенные поражения желудочно-кишечного тракта (ЖКТ), прием аспирина, антикоагулянтов, хронические воспалительные заболевания, сердечная кахексия, обусловленная компенсаторной гиподинамией и неполноценным питанием, уменьшение всасывания железа в ЖКТ из-за застоя слизистой и др.).
Патогенетические основы коморбидности
Патогенез анемического синдрома в пожилом возрасте при ХСН является мультифакторным, включающим дефицит железа, фолиевой кислоты, витамина В12 и другие факторы (рис. 1) [9].
![Рис. 1. Патогенетические механизмы анемии при ХСН (адаптировано из [9]). Рис. 1. Патогенетические механизмы анемии при ХСН (адаптировано из [9]).](/upload/medialibrary/724/44-1.png)
Практически у каждого 3-го пациента пожилого возраста анемия развивается без очевидной причины (гипопролиферативная анемия на фоне низкой активности эритропоэтина) [4].
Регуляция эритропоэза является сложным и комплексным процессом c участием разных представителей цитокинов. Для окончательной дифференцировки эритроидных клеток необходим эритропоэтин — гликопротеид, первичный медиатор нормальной физиологической реакции на гипоксию, стимулирующий митоз и являющийся гормоном дифференцировки, который способствует образованию эритроцитов из стволовых клеток. Эритропоэтин вырабатывается преимущественно в почках (в основном в перитубулярных интерстициальных фибробластах коры и внешней области мозгового слоя) и в меньшей степени (до 15%) — в печени (гепатоцитами и фибробластоподобными клетками печени — Ito-клетками).
ХСН способствует гипоперфузии почек, перераспределению кровотока в них, вазоконстрикции, что приводит к нарушению функции почек практически у каждого 2-го пациента пожилого возраста [10]. Анемия, развивающаяся у больных с ХСН и патологией почек, определяется дефицитом эндогенной продукции эритропоэтина вследствие необратимого уменьшения количества клубочков почек или их относительной ишемии из-за снижения сердечного выброса. По мере снижения функциональной активности почек структуры, продуцирующие эритропоэтин, замещаются фиброзной тканью и утрачивают гормонпродуцирующие свойства. В результате гипоперфузии почек нарастает ишемия эндотелиоцитов перитубулярных капилляров и фибробластов, локализующихся в тубулоинтерстиции, и уменьшается продукция эритропоэтина. Помимо этого, протеинурия при ХСН усиливает потерю эритропоэтина, трансферрина, ионизированного железа с мочой и может приводить к развитию железодефицитного состояния.
Подавление костномозговой функции с формированием анемии при ХСН может реализоваться и через воспалительные реакции, т. к. при данном заболевании увеличивается уровень и активность провоспалительных цитокинов, в частности ФНО-α и ИЛ-6. Повышение цитокинов ассоциируется с угнетением пролиферации и дифференцировки эритроидных клеток-предшественников, с неадекватной гипоксией, выработкой эндогенного эритропоэтина и повышением синтеза гепсидина. Последний высвобождается в печени в ответ на воспаление и подавляет абсорбцию железа в тонком кишечнике и выход железа из ретикулоэндотелиальной макрофагальной системы вследствие снижения активности ферропортина, что приводит к неэффективному эритропоэзу.
Показано, что низкий уровень гепсидина, наряду с нормальными значениями показателей воспалительного ответа и отсутствием связи между ними, а также отсутствием корреляции между уровнем гепсидина и концентрацией гемоглобина, свидетельствует о том, что гепсидин не играет роли в развитии анемии у больных старшего возраста с ХСН и ЖДА. И наоборот, высокие уровни гепсидина, показателей воспаления, положительные корреляции между ними и отрицательная корреляция между уровнем гепсидина и концентрацией гемоглобина указывают на воспаление как причину повышения уровня гепсидина, который обусловливает развитие анемии при ХСН в пожилом и старческом возрасте [11].
Возможной причиной развития анемии при ХСН является применение ингибиторов ренин-ангиотензин-альдостероновой системы, в частности иАПФ и АРА, особенно в высоких дозах, что замедляет выработку эритропоэтина в почках и снижает его активность в костном мозге. К примеру, обсуждается роль ингибитора гематопоэза N-ацетил-серил-аспартил-лизил-пролина (AсSDKP), который разрушается под действием АПФ, роль уменьшения циркулирующего ангиотензина II — митогенного фактора для предшественников эритропоэтина [12, 13].
Сахарный диабет также играет немаловажную роль в развитии анемии, т. к. в процессе гликозилирования на ранних этапах повреждаются продуцирующие эритропоэтин клетки в почках [14].
У большинства пациентов с ХСН, помимо истинной анемии, может встречаться и гемодилюционная анемия, при которой снижение гемоглобина и гематокрита становится результатом повышенного объема плазмы [15]. Сниженный кровоток в почках и усиленная канальцевая реабсорбция натрия при ХСН способствуют увеличению объема плазмы, который обычно повышен даже при отсутствии застойных явлений. Еще в 2003 г. А. Androne et al. [16] показали неблагоприятный прогноз у пациентов с ХСН и гемодилюцией в отличие от пациентов с истинной анемией, и возможным объяснением этого факта выдвинули перегрузку объемом, приводящую к дилатации ЛЖ, увеличению длины саркомеров и перерастяжению миофибрилл, что в итоге приводит к эксцентрической гипертрофии миокарда — независимого предиктора неблагоприятного исхода. На сегодняшний день существует мнение, что гемодилюция предшествует клиническим проявлениям накопления жидкости и играет немаловажную роль в развитии анемии при ХСН. Помимо этого у пациентов со стабильной ХСН и низкой ФВЛЖ при оптимальной медикаментозной терапии объем плазмы в целом нормальный, но неоднородно распределенный, а встречаемость анемии при ХСН гораздо выше, чем когда ее оценивают только по уровню гемоглобина (поскольку методы измерения внеклеточного объема жидкости не всегда доступны, особенно в рутинной клинической практике) [17].
При ХСН дефицит железа рассматривается как сопутствующая патология и встречается у 37–61% пациентов [18]. Данные исследования NHANES III свидетельствуют о наличии дефицита железа у 61,3% из 574 взрослых пациентов с ХСН (уровень ферритина менее 100 или 100–199 при уровне трансферрина <20%) [19]. Согласно E. Jankowska et al. дефицит железа имел место у 37% из 546 пациентов с ХСН (включая 32% пациентов без анемии) [20].
Результаты проспективного обсервационного регистра PReP registry (Prävalenz des Eisenmangels bei Patienten mit Herzinsuffizienz) с участием амбулаторных пациентов с ХСН и ФВЛЖ ≤45% из Германии показали встречаемость дефицита железа у 42,5% пациентов (до включения в регистр никто из пациентов не знал о наличии этого состояния у них), анемии — у 18,9% (4,8% пациентов знали о наличии у них анемии). Средний возраст пациентов составил 69,0±10,6 года, среди них было 25,3% женщин, ФВЛЖ отмечена у 35,3±7,2%. Дефицит железа ассоциировался с женским полом, более низкой массой тела и низким уровнем гемоглобина, более высоким функциональным классом (ФК) ХСН и высоким уровнем натрийуретического пептида (при всех показателях p<0,05) [21].
Железо играет центральную роль в поглощении, транспорте, хранении и метаболизме кислорода, эритропоэзе и клеточном иммунном ответе. Регуляция баланса железа, определяемого комбинацией абсорбции алиментарного железа, использования и его выведения, необходима для поддержания основных клеточных функций, особенно в клетках с высокими энергетическими потребностями — скелетных миоцитах и кардиомиоцитах [22, 23]. Дефицит железа может приводить к дисфункции митохондрий, нарушению активности ферментов, активации апоптоза, нарушению синтеза и функции белков. Последствия дефицита железа выражаются в ремоделировании тканей организма, в снижении работоспособности и изменении когнитивно-эмоциональной cферы.
Дефицит железа как на фоне анемии, так и независимо от нее может ухудшать течение самой ХСН и заболеваний, лежащих в ее основе, значительно снижать качество жизни, физическую активность и увеличивать риск летального исхода [24, 25]. К тому же дефицит железа повышает вероятность госпитализаций пациентов с ХСН [26].
Представленные выше данные свидетельствуют о дефиците железа как одной из ведущих причин развития анемии у лиц пожилого возраста, в частности с ХСН, что приводит к необходимости дальнейшего изучения проблемы, включая взаимосвязь норэпинефрина и статуса железа. Активация симпатической нервной системы, которая влечет за собой повышение уровня норэпинефрина, является одной из терапевтических мишеней при ХСН из-за оказываемого ею неблагоприятного влияния на прогноз заболевания, особенно у лиц с ХСН и низкой ФВЛЖ. В этом контексте в эксперименте было показано, что норэпинефрин приводит к истощению внутриклеточного железа [27], что побудило рассматривать роль симпатической активации в дисрегуляции гомеостаза железа и стало посылом к изучению ассоциации между симпатической активностью и статусом железа. В наблюдательном проспективном одноцентровом когортном исследовании DAMOCLES (Definition of the neuro-hormonal activation, myocardial function, genomic expression and clinical outcomes in heart failure patients) приняли участие 742 пациента с ХСН (из них 56% мужчин) со средним возрастом 72 года, средней ФВЛЖ 44%, медианой N-терминального мозгового натрийуретического пептида (NT-proBNP) 1547 пг/мл. У 45% пациентов ХСН соответствовала III–IV ФК, медиана норэпинефрина — 523 (351–730) пг/мл, 515 (69%) пациентов имели дефицит железа [28]. Уровень норэпинефрина у пациентов с низким уровнем железа был выше, чем у лиц с нормальным уровнем железа (528 [505–551]
и 482 пг/мл [448–518] соответственно, p=0,038); а у пациентов с нарушенным транспортом железа выше, чем у пациентов с нормальным транспортом железа (537 [511–566] и 482 пг/мл [452–513] соответственно, p=0,012) (табл. 1 и 2).
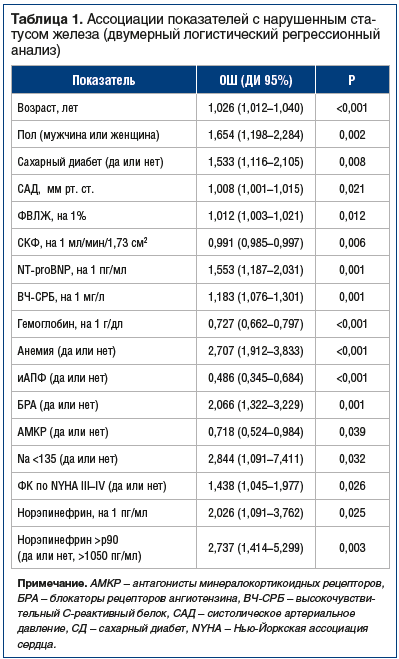

P. Moliner et al. полагают, что дефицит железа возможно рассматривать не только в качестве одного из сопутствую-щих состояний, но и как ключевой элемент в патофизиологической последовательности изменений, способствующий развитию и прогрессированию ХСН [28].
Дефицит железа может быть абсолютным, когда общее количество железа в организме снижается, или функциональным, когда общее количество железа в организме нормальное или повышенное, но достаточное количество железа не поступает из депо (происходит неравномерное распределение железа). При абсолютном дефиците железа снижаются и общие запасы железа, и запасы функционального железа, тогда как при функциональном дефиците железа снижается лишь пул функционального железа. Оба состояния могут возникать независимо друг от друга или сосуществовать у отдельного пациента.
Абсолютный дефицит железа при сердечной недостаточности может быть вызван снижением потребления железа из-за анорексии, кахексии, нарушенного всасывания железа в результате отека слизистой кишечника, а также индуцированным гепсидином подавлением активности переносчиков железа (например, ферропортина). Другие причины абсолютного дефицита железа включают желудочно-кишечные кровотечения, связанные с использованием аспирина, антиагрегантов или антикоагулянтов или вызванные сопутствующими заболеваниями, такими как злокачественные новообразования ЖКТ или мочеполовой системы.
Функциональный дефицит железа при ХСН вызван механизмами, аналогичными тем, которые ответственны за анемию хронического заболевания или воспаления, обусловленных повышением уровня воспалительных цитокинов, включая ИЛ-1, ИЛ-6, ИЛ-18 и ФНО-α, которые, в свою очередь (особенно ИЛ-6), повышают уровень гепсидина в печени. Пролиферация эритробластов напрямую ингибируется повышенными уровнями гепсидина, что еще более ухудшает синтез гемоглобина (рис. 2) [9].

Принципы дифференциальной диагностики
Ранними проявлениями ХСН в пожилом возрасте могут быть утомляемость, слабость, тяжесть в ногах, часто проявляющиеся во время повседневной физической нагрузки и не всегда ассоциирующиеся с выраженностью одышки и отечного синдрома. Пациенты могут жаловаться на головокружение, пресинкопальные и синкопальные состояния, раздражительность, нарушение сна. Как правило, эти симптомы малоспецифичны, поскольку могут присутствовать и при других заболеваниях, в частности при анемии. Клиническая картина анемического синдрома включает в себя 3 субъективных симптома: усталость, одышку и сердцебиение. При осмотре пациента с ХСН следует обращать внимание не только на эти симптомы, являющиеся неотъемлемой частью клинической картины сердечной недостаточности, но и помнить об анемическом синдроме и не игнорировать роль гемодилюции, особенно у лиц пожилого возраста.
Затруднения в дифференциальной диагностике ХСН возникают, как правило, вследствие мультиморбидности. У пожилых больных с анемией также нередко приходится исключать или подтверждать наличие ХСН. Диагностическими критериями в этом случае является совокупность анамнестических данных (в частности, ишемическая болезнь сердца, инфаркт миокарда), клинических симптомов и признаков (смещение верхушечного толчка влево, повышенная ЧСС), данных объективных методов исследования. С учетом атипичности клинических проявлений и малосимптомности заболевания в пожилом возрасте большое значение приобретает контроль уровня натрийуретического пептида.
При постановке диагноза ЖДА решающее значение имеют данные комплекса лабораторных исследований — подтверждение факта анемии и дефицита железа. Анализ крови характеризуется наличием признаков гипохромной микроцитарной анемии со снижением концентрации гемоглобина и цветового показателя. Гипохромия — уменьшение средней концентрации Hb в эритроцитах (<24 пг), микроцитоз — уменьшение размеров эритроцитов (<75 нм). В мазках крови преобладают небольшие по размеру гипохромные эритроциты, аннулоциты (эритроциты в виде колец с отсутствием Hb в центре), отмечаются пойкилоцитоз и анизоцитоз. В пользу дефицита железа свидетельствуют уровень сывороточного железа <12,5 мкмоль/л, ферритина сыворотки <30 мкг/л, сатурация трансферрина <17%) [29].
При анемии, развившейся на фоне кровопотери, непосредственно после кровотечения отмечается повышение количества ретикулоцитов. Количество лейкоцитов имеет тенденцию к снижению, но лейкоцитарная формула не меняется. Количество тромбоцитов обычно нормальное, с тенденцией к увеличению при кровотечении. Наблюдается снижение уровня сывороточного железа и повышение общей железосвязывающей способности плазмы крови. Около 33% всего количества трансферрина сыворотки связано с железом (показатель насыщения трансферрина железом). Остальное количество трансферрина остается свободным и характеризует скрытую железосвязывающую способность сыворотки крови. При дефиците железа снижается уровень трансферрина до 10–20 мг/л, но при этом увеличивается скрытая железосвязывающая способность плазмы.
На сегодняшний день эксперты рекомендуют проводить скрининг дефицита железа у всех пациентов, независимо от уровня гемоглобина, с впервые поставленным диагнозом ХСН (класс рекомендаций I, уровень доказанности С), а также при наличии уже существующей ХСН с клиническими проявлениями. Лабораторные параметры обмена железа рекомендовано определять хотя бы однократно в год (табл. 3) [1, 29].

Таким образом, дефицит железа у пациентов с ХСН диагностируется при снижении уровня ферритина <100 мкг/л или при уровне ферритина 100–299 мкг/л при условии, что сатурация трансферрина <20%.
Следует отметить, что ферритин не обладает диагностической ценностью, поскольку достаточно изменчив, является белком острой фазы, а его увеличение, которое наблюдается при ХСН и других воспалительных заболеваниях, не всегда отражает высокие уровни запаса железа, что следует принимать во внимание. К тому же показано, что именно низкий уровень сатурации трансферрина, а не ферритина ассоциируется с высоким риском летальности [30]. Кроме этого, у пациентов с уровнем сатурации трансферрина 20,1% не наблюдалось улучшения выживаемости при приеме железосодержащих препаратов [31].
Насыщение трансферрина железом является биологическим маркером доставки железа клеткам. Трансферрин — это специфический транспортный белок плазмы
крови, который обеспечивает доставку железа к клеткам через рецепторы трансферрина. Поскольку концентрация трансферрина зависит от многих факторов, в практике его в изолированном виде не используют для определения дефицита железа в организме. Степень насыщения трансферрина железом (СНТЖ) рассчитывается методом деления сывороточной концентрации железа на сывороточную концентрацию трансферрина и отражает то количество железа, которое доступно для эритробластов и других клеток, нуждающихся в нем. СНТЖ не зависит от степени воспаления в организме, а его уровень менее 20% свидетельствует о недостаточном эритропоэзе [32].
Авторы последних исследований полагают, что лечение ЖДА само по себе может быть благоприятно, но сохраняется ряд пробелов в вопросах понимания, когда, как и насколько длительно необходимо лечить текущую анемию или железодефицитное состояние при ХСН, а также понимания механизмов, лежащих в основе лечебных эффектов.
Основные принципы лечения ЖДА, в т. ч. у лиц пожилого возраста с ХСН
Установить причину кровопотери и провести лечение основного заболевания.
Нельзя только одной диетой вылечить ЖДА!
Возместить дефицит железа без железосодержащих лекарственных средств невозможно!
Терапию препаратами железа необходимо проводить длительно.
Терапия ЖДА не должна прекращаться после нормализации уровня гемоглобина и количества эритроцитов.
Гемотрансфузии при ЖДА должны проводиться строго по жизненным показаниям.
Парентеральное назначение препаратов показано только при определенных обстоятельствах.
Целью лечения ЖДА при ХСН является достижение уровня Hb ≥120 г/л за счет перорального или парентерального введения необходимого количества железа.
Терапевтические возможности в отношении улучшения функциональной способности человека очень ограничены, и целевое выявление нарушений, препятствующих транспортировке кислорода и/или его использованию, может достичь функциональных преимуществ. Эти гипотезы были подтверждены во всех 5 рандомизированных контролируемых исследованиях по изучению парентерального введения железа с участием пациентов с ХСН.
К примеру, исследование FAIR-HF (The Ferinject Assessment in Patients with Iron Deficiency and Chronic Heart Failure) продемонстрировало улучшение самочувствия, функциональной и физической работоспособности пациентов с ХСН и дефицитом железа (средний возраст 67 лет, ФВЛЖ <40%) при применении карбоксимальтозата железа [33]. Результаты многоцентрового, двойного слепого плацебо-контролируемого рандомизированного исследования CONFIRM-HF (Ferric CarboxymaltOse evaluatioN on perFormance in patients with IRon deficiency in coMbination with chronic Heart Failure) с участием 304 амбулаторных пациентов с клинически выраженной ХСН, ФВЛЖ ≤45%, повышенным уровнем НУП и дефицитом железа (ферритин <100 нг/мл или 100–300 нг/мл при уровне сатурации трансферрина <20%) также подтвердили положительное действие парентерального введения железа на функциональный статус, выраженность клинических симптомов и качество жизни пациентов [34]. Рандомизированное контролируемое исследование EFFECT-HF (Effect of Ferric Carboxymaltose on Exercise Capacity in Patients With Iron Deficiency and Chronic Heart Failure) с участием 172 пациентов с ХСН и железодефицитом показало увеличение VO2 max у пациентов, которым парентерально вводился препарат железа, по сравнению с группой контроля [35].
Результаты исследования FAIR-HF2 (Intravenous Iron in Patients With Systolic Heart Failure and Iron Deficiency to Improve Morbidity & Mortality) с участием пациентов с систолической дисфункцией ЛЖ и дефицитом железа ожидаются в 2020 г. [36].
Благоприятный эффект препаратов железа, оказываемый на пациентов с ХСН, подтвержден и в метаанализе, проведенном в 2018 г. S. Anker et al., согласно которому парентеральное введение железа способствовало снижению частоты повторных госпитализаций в связи с декомпенсацией ХСН (ОШ 0,53; 95% ДИ 0,33–0,86; р=0,011) и повторных госпитализаций по сердечно-сосудистым причинам (ОШ 0,60; 95% ДИ 0,41–0,88; р=0,009) [31].
Вышепредставленные данные позволяют рассматривать терапию железосодержащими препаратами как полезное дополнение к общепринятому медикаментозному лечению пациентов с ХСН.
Имеющаяся на сегодняшний день доказательная база по лечению пациентов пожилого и старческого возраста с ХСН и анемией не позволяет однозначно рассматривать вышепредставленные подходы как целесообразные и безопасные. К тому же нет данных об эффективности и безопасности терапии препаратами железа у пациентов с ХСН с сохраненной и промежуточной ФВЛЖ, большинство из которых и являются лицами старшего возраста.
В связи с этим эксперты Общества специалистов по сердечной недостаточности акцентируют внимание на необходимости выявления и коррекции причин, приводящих к развитию железодефицита у пациентов с ХСН (алиментарные нарушения, желудочно-кишечные кровотечения, прием нежелательных лекарственных препаратов и др.).
Пероральные железосодержащие средства могут быть препаратами выбора при ЖДА в комплексном лечении пациентов c ХСН вследствие их достаточно высокой эффективности и низкой стоимости. Лекарственные препараты железа могут быть в виде ионизированного (Fe2+) в составе органических или неорганических солей (фумарат, лактат, сульфат, хлорид) и неионного — в составе комплексов, содержащих окисное железо (Fe3+), — протеин-сукцинилат, полимальтозат или сахарозный комплекс. Препараты ионизированного железа используются только перорально, препараты комплексов окисного железа — парентерально.
Эффективность лечения пациентов с ЖДА определяется суточной дозой и формой элементарного железа, входящего в состав лекарственного препарата. При этом темп нарастания уровня гемоглобина зависит от выраженности анемического синдрома. Выбор между препаратами железа — Fe2+ или Fe3+ — определяется в первую очередь клинической целью: быстрое достижение эффекта (предпочтение отдается препарату Fe2+) или хорошая переносимость на фоне длительного приема (предпочтение отдается препарату Fe3+).
Железа (III) гидроксид полимальтозат показан для лечения латентного железодефицита и ЖДА. Этот препарат имеет несколько лекарственных форм, в частности форму жевательных таблеток, содержащих 400 мг железополимальтозного комплекса (100 мг элементарного железа), что позволяет пациенту принимать препарат по 1 таблетке 2 р./день с хорошим клиническим эффектом. Данное действие препарата обусловлено, во‑первых, структурой комплекса, которая имеет железо (III) гидроксидное ядро и углеводную оболочку, что напоминает белок запаса железа — ферритин, и, во‑вторых, контролируемой диссоциацией ионов железа из этого лекарственного комплекса. Помимо вышесказанного, полимальтозная оболочка обеспечивает стабильность и растворимость комплекса в достаточно широком диапазоне pH, что и определяет его терапевтическую эффективность и хорошую переносимость с последующим улучшением клинического состояния и качества жизни, что важно в старшем возрасте, особенно при невозможности устранения основной причины заболевания.
Адекватный ответ на терапию железосодержащими препаратами включает [37, 38]:
увеличение количества ретикулоцитов через 7 дней;
увеличение уровня гемоглобина на ≈2 г/дл через 1–2 нед. после начала приема препаратов железа;
нормализацию содержания гемоглобина через 6–8 нед.
Следует обращать внимание на динамику эритроцитарных индексов, нормализация которых отражает адекватность терапии: средний объем эритроцита, среднее содержание гемоглобина в эритроците, среднюю концентрацию гемоглобина в эритроците. Анализы периферической крови проводят 1 раз в 1–2 нед. в начале лечения, а затем 1 раз в 2–4 нед.
Поскольку не вполне корректно расценивать любое снижение гемоглобина ниже нормы у больных ХСН как анемию, то у большинства больных ХСН, помимо истинной анемии, может быть диагностирована и гемодилюция [39, 40], лечение которой должно фокусироваться на коррекции дозы диуретиков. Очевидно, что стратегия лечения возрастной категории пациентов, помимо патогенетической терапии анемии, предусматривает воздействие на нейрогуморальную активацию — применение ингибиторов АПФ и блокаторов рецепторов к ангиотензину II, антагонистов минералокортикоидных рецепторов, бета-адреноблокаторов, а также петлевых диуретиков. Поскольку в развитии отечного синдрома задействованы сложные нейрогуморальные механизмы, бездумная дегидратация вызывает побочные эффекты и рикошетную задержку жидкости, что может приводить к необоснованной терапии.
Блокирование гепсидина может быть эффективной терапевтической стратегией, особенно в отношении функционального железодефицита. Как перспективные меры могут рассматриваться прямая блокада экспрессии гепсидина с помощью анти-гепсидин-1-олигорибонуклеотида (lexaptepid), подавление активности гепсидина с помощью препаратов человеческих антител к гепсидину, блокирование передачи сигнала с гепсидина с помощью низкомолекулярного ингибитора (LDN-193189) или неантикоагулянтные гепарины. Спиронолактон, обычно используемый в качестве основного лекарственного средства у пациентов с сердечной недостаточностью, подавляет экспрессию гепсидина у мышей [41, 42].
Заключение
Таким образом, анемия и дефицит железа являются часто встречающимися сопутствующими ХСН состояниями у лиц пожилого возраста. Дефицит железа как на фоне анемии, так и независимо от анемии может ухудшать течение ХСН и заболеваний, лежащих в основе ее развития, снижать качество жизни, физическую активность пациентов и увеличивать риск неблагоприятных событий. Принципиально важным является скрининг дефицита железа у всех пациентов с ХСН, особенно при впервые возникшей, а при постановке диагноза ЖДА решающее значение имеют данные лабораторных исследований — подтверждение факта анемии и дефицита железа. На сегодняшний день однозначных рекомендаций по лечению пациентов пожилого и старческого возраста с ХСН и анемией не существует. В связи с этим необходимо выявлять и корректировать причины дефицита железа у пациентов с ХСН, воздействовать на нейрогуморальную активацию и разумно подходить к лечению отечного синдрома. Требуется тесное сотрудничество нефрологов, кардиологов, терапевтов для эффективной коррекции терапии ХСН и анемии в соответствии с современными достижениями и требованиями. Только в условиях активного регулярного врачебного наблюдения возможно улучшить качество и увеличить продолжительность жизни больным ХСН.












