В патогенезе рецидивирующего цистита имеют значение как механизмы врожденного иммунитета слизистых оболочек, так и общая иммунокомпетентность организма. Уротелий, выстилающий нижние отделы мочевыводящих путей, является одним из важнейших факторов резистентности за счет значительной фагоцитарной активности, а также способности к синтезу и секреции специфических мукополисахаридов, образующих защитный слой [3,7]. Слизистая оболочка мочевого пузыря обладает бактериостатическими свойствами, антиадгезивным действием, вырабатывает секреторный IgA и ингибиторы роста бактерий. Имеют значение также физико–химические защитные свойства мочи (низкое значение рН, высокая концентрация мочевины) и нормальная уродинамика [3]. В случае несостоятельности врожденного иммунитета слизистых оболочек мочевых путей и проникновения микроорганизма внутрь клетки нарушение целостности слизистой актуализирует общие иммунные процессы [7,8]. Наиболее ранним и основным системным ответом на повреждение стенки мочевого пузыря является острое воспаление. При этом отмечаются вазодилатация, повышение проницаемости сосудистой стенки, хемотаксис лейкоцитов в первичный очаг и запуск каскада биохимических реакций с участием цитокинов: гистамина, кининов, факторов системы комплемента, оксида азота, протеазы и т.д. [8]. Исследования показали, что параллельно тяжести воспалительного процесса в мочевом пузыре повышается способность уротелия вырабатывать провоспалительные цитокины (IL–1, IL–6), а синтез противовоспалительных цитокинов (IL–4, TGF, ИФНγ), соответственно, снижается по сравнению с функциями здоровых клеток [9]. Важная роль в патогенезе цистита принадлежит тучным клеткам, усиленно мигрирующим в очаг воспаления и продуцирующим фактор некроза опухоли альфа (TNF), замыкая таким образом circulus vitiosus между повреждением эпителия и высвобождением провоспалительных цитокинов. Этот процесс признан одним из ведущих иммуногистохимических механизмов, обусловливающих хроническое рецидивирующее течение цистита [8]. В целом, поражению более глубоких слоев стенки мочевого пузыря и переходу острого процесса в хронический во многом способствует латентная дисфункция иммунной системы [6,10].
Диагноз хронического цистита, как правило, не представляет особых сложностей из–за характерной клинической картины. Основными симптомами, свидетельствующими о наличии воспаления мочевого пузыря, являются признаки дизурии: учащенное мочеиспускание, сопровождающееся дискомфортом, болью, жжением; частые позывы к мочеиспусканию, никтурия, чувство неполного опорожнения мочевого пузыря. Синдром интоксикации, как правило, выражен умеренно или слабо и имеет общую тенденцию к уменьшению интенсивности с каждым последующим рецидивом [3,11].
Лабораторная диагностика хронического цистита, наряду с рутинными методами обследования, такими как общий анализ мочи, клинический анализ крови, бактериологический анализ мочи, может включать уродинамические исследования, УЗИ мочевого пузыря и почек, определение возбудителей инфекций, передаваемых половым путем (ПЦР), рентгенологическую диагностику, морфологические методы (проведение цистоскопии с биопсией). Для исключения сопутствующих заболеваний у женщин необходим гинекологический осмотр, а также обязательный осмотр пациентки урологом на гинекологическом кресле.
Современные стандарты лечения рецидивирующего цистита предусматривают назначение антибактериального препарата, в первую очередь – фосфомицина трометамола и нитрофуранов [11,22]. По результатам культурального исследования мочи возможно курсовое назначение фторхинолонов. Комплекс терапевтических мероприятий также должен быть направлен на устранение признаков воспаления и интоксикации с помощью симптоматических лекарственных средств: фитопрепаратов, пробиотиков, может включать заместительную эстрогенотерапию, вакцинотерапию. Несмотря на целесообразность антибактериальной терапии, особенно явную при купировании первичного эпизода цистита, назначение антибиотиков при последующих рецидивах заболевания имеет существенные ограничения. В первую очередь это связано с селекцией резистентных штаммов микроорганизмов [6,12]. Таким образом, одной из приоритетных задач терапии хронического цистита является медицина предупредительная: предотвращение или минимизация риска возникновения обострений. В последнее время, с учетом знаний о патогенезе и механизмах рецидивирования цистита, все большее значение приобретают иммунотропные средства, позволяющие купировать реинфекционный процесс на ранних стадиях за счет модуляции иммунного ответа организма.
Особое место среди иммунокорректоров занимают препараты на основе рекомбинантного человеческого интерферона альфа (рчИФНα). Интерфероны – естественные цитокины, участвующие в реализации противоинфекционного ответа и обладающие рядом биологических свойств, актуальных в клинической практике. Ведущая роль среди различных классов ИФН принадлежит интерферонам альфа (α), позволяющим обеспечить иммуномодулирующее, противовирусное, противомикробное, противовоспалительное действия и таким образом усилить способность организма противостоять факторам патогенности различных возбудителей [15,16]. К безусловным преимуществам применения интерферонов в лечебных целях относятся их модулирующее действие (способность улучшать несостоятельные функции иммунной системы, не влияя на нормальные показатели), широкий спектр терапевтических эффектов, а также подтвержденная безопасность.
Одним из перспективных препаратов рчИФНα является разработанный российской фармацевтической компанией ЗАО «БИОКАД» препарат Генферон®. Генферон® выпускается в виде суппозиториев ректальных и вагинальных и обладает улучшенным составом: 500 000 МЕ или 1 000 000 МЕ рчИФНα–2b, антиоксидант таурин и местный анестетик бензокаин. Серосодержащая аминокислота таурин способна потенцировать биологическое действие интерферона, а также обладает собственными эффектами: противовоспалительным, мембрано– и гепатопротекторным, репаративным, регенерирующим. Эффективность и безопасность Генферона® в составе комплексной терапии герпетических инфекций, хронической урогенитальной патологии, респираторных вирусных инфекций подтверждены в многочисленных клинических исследованиях [17–21]. Препарат разрешен к применению у женщин на протяжении второго и третьего триместров беременности, что является дополнительным свидетельством минимального риска развития нежелательных явлений при использовании Генферона®.
В целях уточнения эффектов назначения интерферонов при инфекциях мочевыводящих путей было проведено двойное слепое рандомизированное плацебо–контролируемое сравнительное исследование эффективности применения препарата Генферон® в составе комбинированной терапии хронического цистита бактериальной этиологии.
Материалы и методы
Исследование было проведено на базе 6 клинических центров. Всего в исследование было включено 86 пациенток, 6 из которых на протяжении исследования выбыли по различным причинам, не связанным с приемом исследуемого препарата. Таким образом, в целях анализа эффективности производилась статистическая обработка данных на основании результатов 80 участниц; анализ безопасности был проведен у всех пациенток, получивших хотя бы одно введение препарата (86 человек).
В исследование включались больные с верифицированным диагнозом хронического цистита и длительностью заболевания более 1 года, не применявшие в течение последнего месяца каких–либо иммуномодуляторов или антибактериальных препаратов. Критериями постановки диагноза хронического рецидивирующего цистита служили следующие параметры: наличие двух и более обострений в анамнезе за последние 6 мес. или свыше трех обострений за последний год; обострение заболевания (с учетом клинических и/или лабораторных признаков); изменение общего анализа мочи (лейкоцитурия, бактериурия, гематурия); бактериурия при проведении бактериологического исследования мочи.
Участницы, прошедшие все процедуры скринингового обследования и соответствующие критериям включения в исследование, рандомизировались в 2 группы по 40 человек: основная группа получала норфлоксацин в дозе 400 мг х 2 р./сут. per os в течение 7 дней в сочетании с препаратом Генферон® по 1 000 000 МЕ х 2 р./сут. ректально в течение 10 дней (параллельно стандартной терапии); затем Генферон® через день по 1 суппозиторию в течение 40 дней, группа сравнения – норфлоксацин в дозе 400 мг х 2 р./сут. per os в течение 7 дней в сочетании с плацебо х 2 р./сут. ректально в течение 10 дней (параллельно стандартной терапии), затем плацебо через день по 1 суппозиторию в течение 40 дней. В случае выявленной устойчивости возбудителя к норфлоксацину предусматривалось назначение другого антибактериального препарата на усмотрение исследователя.
Оценка ответа на терапию проводилась через 10, 50, 90 и 180 дней после начала лечения по следующим критериям: достижение ремиссии (клинической, лабораторной), частота возникновения рецидивов заболевания. На протяжении исследования осуществлялись 6 визитов: скрининг–визит, визит для повторной проверки соответствия критериям включения/исключения, выдачи препарата и дневника пациента, 2 визита для предварительной оценки эффективности и комплаентности, а также 2 визита для оценки отдаленной эффективности терапии. В периоды между визитами пациентки заполняли дневник мочеиспускания и дневник пациента, где оценивали выраженность симптомов хронического цистита. Визиты включали в себя регистрацию жалоб, объективный осмотр, проведение общего и бактериологического анализов мочи, регистрацию рецидивов цистита, оценку безопасности.
Для анализа полученных данных применялись методы описательной статистики, параметрического и непараметрического сравнительного анализа. Если признак имел нормальное распределение данных, то меры центральной тенденции и рассеяния представлялись в формате среднее (среднеквадратичное отклонение), если признак имел распределение данных, отличное от нормального, то меры центральной тенденции и рассеяния представлялись как медиана [интерквартильный размах].
Результаты
Демографическая и клиническая
характеристика исследуемой популяции
В исследование было включено в общей сложности 86 человек. В связи с досрочным завершением участия в исследовании 6 из них были заменены. В итоге анализ эффективности препарата был произведен на основании результатов 80 больных, анализ безопасности – с учетом данных всех больных, получивших хотя бы одно введение препарата (86 человек). Все субъекты исследования были представлены женщинами, медиана возраста составила 27,5 лет (минимальный возраст – 18 лет, максимальный – 57 лет). Пациентки были рандомизированы в основную группу, получавшую Генферон®, и в группу сравнения, получавшую плацебо, по 40 человек. Средний возраст пациенток в группе Генферона® составил 28,5 [25–39] лет, в группе плацебо – 27 [23–31] лет (р>0,05).
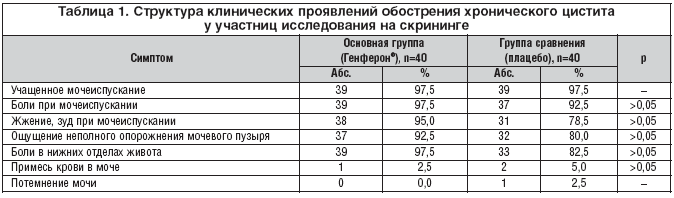
В структуре клинических проявлений обострения хронического цистита на скрининговом визите, проанализированных по данным жалоб и дневников пациента, преобладали симптомы дизурии (учащенное мочеиспускание, сопровождающееся резями, болями, дискомфортом, зудом; ощущение неполного опорожнения мочевого пузыря; частые позывы к мочеиспусканию; выделение мочи малыми порциями), ноющие или тянущие боли в нижних отделах живота. Данные клинические признаки встречались примерно с одинаковой частотой в обеих группах (табл. 1).
Частота купирования отдельных симптомов
заболевания
Сроки купирования симптомов обострения хронического цистита оценивались в совокупности: на основании жалоб, предъявляемых участницами на визитах, записей в дневнике пациента, который заполнялся исследуемыми женщинами самостоятельно, а также данных лабораторных исследований. Оценка проводилась по следующим клиническим критериям: выраженность боли в нижних отделах живота (в баллах), при мочеиспускании (в баллах), выраженность жжения во время мочеиспускания (в баллах), выраженность учащения мочеиспускания (в баллах), наличие неудержимых позывов к мочеиспусканию (в баллах), частота эпизодов недержания мочи (количество), чувство неполного опорожнения мочевого пузыря (в баллах).
Полученные результаты показали сходную динамику купирования основных проявлений обострения хронического цистита в обеих группах. В среднем, симптомы купировались у большинства пациенток с 7–8 дня комплексной терапии, включавшей антибактериальный препарат. В группе пациенток, получавших Генферон®, отмечалась тенденция к более эффективному купированию выраженности болей в нижних отделах живота, при мочеиспускании, ощущения неполного опорожнения мочевого пузыря, однако без статистически достоверных различий.
Для интегральной оценки тяжести клинических проявлений и динамики их обратного развития в процессе терапии было использовано значение итогового балла, представляющего собой сумму баллов по всем анализируемым клиническим признакам.
Средняя величина итогового балла до начала лечения в группах составила 16,5 [14,3–15,0] балла в основной группе и 15,0 [11,8–17,3] баллов в группе плацебо (p>0,05). В процессе проведения терапии была отмечена тенденция к большей скорости снижения итогового балла в основной группе, чем в группе плацебо: к 4–му дню итоговый балл снизился на 10 баллов в основной группе, на 7,5 баллов – в группе сравнения и составил соответственно 6,5 [5,0–11,0] и 7,5 [3,8–10,3] балла (p>0,05). К 10–му дню терапии медиана итогового балла составила 0 [0–1] в обеих группах, сохраняясь в течение всего периода наблюдения.
Динамика лабораторных показателей
Общий анализ мочи. Обработку данных общего анализа мочи проводили у всех пациенток на скрининге, визите 2 (день 11–й), визите 3 (день 51–й), визите 4 (день 90–й), визите 5 (день 180–й). На скрининге изменения общего анализа мочи отмечались у всех 80 пациенток. Лейкоцитурия была наиболее часто встречающимся лабораторным симптомом, что в целом характерно для обострения хронического цистита. В основной группе лейкоцитурия была выявлена у 40 (100%) пациенток, из них у 6 (15,0%) человек лейкоциты покрывали все поле зрения; в группе сравнения – у 39 пациенток (97,5%), из них у 5 (12,5%) лейкоциты покрывали все поле зрения. У 1 пациентки группы плацебо лейкоцитов при микроскопии осадка мочи обнаружено не было, но присутствовали другие косвенные признаки воспаления (большое количество плоского эпителия и бактериурия), а также выраженная клиническая симптоматика цистита. Медиана количества лейкоцитов в осадке мочи в основной группе составила 100 [60–170], в группе сравнения – 90 [35–150]. Статистически значимых различий между группами по данным параметрам выявлено не было.
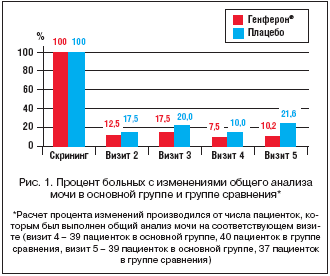
При исследовании частоты регистрации патологических изменений в общем анализе мочи в динамике было выявлено, что число пациенток с лабораторными признаками воспаления мочевого пузыря (лейкоцитурия, эритроцитурия, бактериурия) на визите 5 составило 4 (10,2%) участницы в группе, получавшей Генферон®, и 8 (21,6%) участниц в группе плацебо, p>0,05 (рис. 1).
Бактериологический анализ мочи. В рамках исследования бактериологический анализ мочи на патогенную микрофлору производился на скрининге и на визитах 2–5. Рост патогенной микрофлоры при бактериологическом исследовании мочи на скрининге отмечался у 39 (97,5%) пациенток основной группы и у 33 (82,5%) пациенток группы сравнения (p>0,05). В структуре возбудителей, выявленных на скрининге, преобладала E. coli (72% в основной группе, 67% – в группе сравнения), также выявлялись Proteus spp. (13 и 9% соответственно), Enterococcus spp. (2 и 6% соответственно), Enterobacter spp. (2 и 3% соответственно), Staphylococci epidermidis et saprophyticus (2 и 3% соответственно). Микст–инфицирование отмечалось в 8% случаев в основной группе и в 12% – в группе плацебо; ассоциации микроорганизмов были представлены E. coli, Enterococcus spp., Citrobacter freundii, Streptococcus agalactiae, Enterobacter spp., Кlebsiella spp., Pseudomonas aeruginosa. Третья степень бактериурии отмечалась у 100% пациенток основной группы и у 97,0% пациенток группы плацебо.
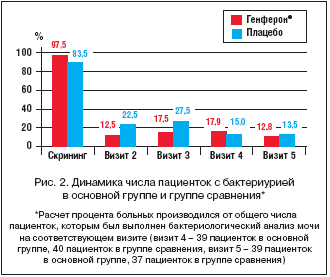
На визитах 2–5 у подавляющего большинства пациенток роста патогенной микрофлоры при посеве мочи не выявлено. Сравнительный анализ частоты обнаружения роста патогенной микрофлоры при посеве мочи показал, что в группе Генферона® по сравнению с группой плацебо бактериурия имела тенденцию к более быстрому купированию, однако без статистически достоверных различий (рис. 2).
Рецидивы хронического цистита
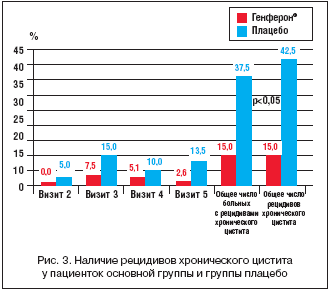
На визитах 2–5 исследователем оценивалось наличие у больных рецидивов хронического цистита. Учитывались клинические данные (признаки дизурии), изменения в общем анализе мочи, наличие и степень бактериурии. На протяжении периодов активной терапии и наблюдения общее число пациенток с отмеченными рецидивами заболевания составило 6 (15,0%) человек в группе, получавшей Генферон®, и 15 (37,5%) больных группы сравнения (p=0,024, ТКФ), при этом у 2 пациенток группы плацебо рецидивы регистрировались 2 раза на протяжении периода наблюдения. Соответственно, кумулятивное число рецидивов составило 17 (42,5%) эпизодов в группе плацебо и 6 (15,0%) эпизодов в группе Генферона® (p=0,014, ТКФ).
На визите 2 рецидивы хронического цистита были отмечены у 2 пациенток группы плацебо, в основной группе рецидивов заболевания не было. На визите 3 рецидивы наблюдались у 3 (7,5%) больных основной группы и у 6 (15%) больных группы сравнения, на визите 4 – у 2 (5,1%) и 4 (10,0%) больных соответственно, на визите 5 – у 1 (2,6%) пациентки основной группы и у 5 (13,5%) пациенток группы плацебо. На визитах 4 и 5 процент пациентов с рецидивами рассчитывался от общего числа больных в данной группе, прошедших процедуры соответствующего визита (визит 4 – 39 пациенток в основной группе, 40 пациенток в группе сравнения; визит 5 – 39 и 37 пациенток соответственно) (рис. 3).
Анализ безопасности
У всех больных, которым было осуществлено хотя бы одно введение исследуемого препарата (86 человек), проводился тщательный анализ безопасности.
В процессе проведения исследования (на протяжении 180 дней) нежелательные явления были зафиксированы у 3 пациенток основной группы и у 2 пациенток группы плацебо. В основной группе все нежелательные явления (ОРВИ – у 2 пациенток, транзиторная кандидурия – у 1 пациентки) имели легкую степень выраженности, не потребовали изменений режима/дозы назначения исследуемого препарата и завершились выздоровлением без последствий. Связь описанных состояний с исследуемым препаратом во всех случаях была расценена исследователями как маловероятная. В группе плацебо было зафиксировано 2 нежелательных явления, заключавшихся в обострении артроза коленных суставов, имевших среднюю степень выраженности, не повлиявших на режим и дозу назначения исследуемой терапии. Данные состояния также завершились выздоровлением без последствий и имели маловероятную связь с исследуемой терапией.
Таким образом, на основании полученных данных можно сделать вывод о хорошей переносимости исследуемого препарата.
Обсуждение
В двойное слепое рандомизированное плацебо–контролируемое сравнительное исследование эффективности применения препарата Генферон® в составе комбинированной терапии хронического цистита бактериальной этиологии было включено 86 пациенток на базе 6 исследовательских центров. Оценка эффективности препарата производилась на основании данных 80 пациенток, завершивших участие в соответствии с процедурами протокола, анализ безопасности осуществлялся у всех 86 больных, получивших хотя бы одно введение суппозиториев Генферон®/плацебо.
Клинические признаки хронического цистита были представлены симптомами дизурии (учащенное мочеиспускание, сопровождающееся болями, жжением, дискомфортом), болями в нижних отделах живота, ощущением неполного опорожнения мочевого пузыря, примесью крови в моче. Этиологическая структура заболевания в обеих группах была сходной и показывала преобладание среди возбудителей E. coli.
Анализ частоты регистрации и купирования отдельных симптомов в период проведения антибактериальной терапии и стихания обострения по данным дневников пациента показал сходную динамику купирования анализируемых локальных симптомов воспаления мочевого пузыря (боли в нижних отделах живота, боль и жжение при мочеиспускании, учащение мочеиспускания, наличие неудержимых позывов к мочеиспусканию, частота эпизодов мочеиспускания, ощущение неполного опорожнения мочевого пузыря), что говорит об эффективности назначенного курса антибактериальной терапии.
При анализе количества рецидивов хронического цистита у участниц исследования на протяжении периода наблюдения было выявлено, что в группе плацебо повторные обострения после проведенного курса антибактериальной терапии развивались у 37,5% больных, что соответствует данным литературных источников, свидетельствующих о том, что в течение первых 6 мес. после стандартной терапии около 30% пациенток переносят рецидив цистита [3,4]. Обострения хронического цистита у пациенток, получавших Генферон®, регистрировались значительно реже, чем в группе плацебо: общее число больных, перенесших рецидив хронического цистита на протяжении исследования, в основной группе составило 6 (15,0%) человек. Между числом больных с обострением хронического цистита в исследуемых группах были выявлены статистически достоверные различия (p=0,024, ТКФ). Анализ кумулятивной частоты обострений показал, что в группе плацебо рецидивы возникали в 17 (42,5%) случаях, тогда как в основной группе – в 6 (15,0%) случаях (p=0,014, ТКФ). Таким образом, в исследовании было показано достоверное преимущество применения препарата Генферон® в качестве средства противорецидивного лечения хронического бактериального цистита.
Анализ безопасности показал хорошую переносимость исследуемого препарата даже при длительном (суммарно – в течение 50 дней) применении.
В целом, результаты исследования позволяют сделать заключение о высокой безопасности и эффективности препарата Генферон®, назначаемого на фоне адекватной антибактериальной терапии хронического цистита. Генферон® воздействует на воспалительный процесс в мочевом пузыре в 2–х направлениях: за счет активной иммуномодуляции интерферона α и, вследствие этого, его опосредованного антибактериального эффекта. С учетом механизмов действия Генферона® патогенетически обоснованным является его назначение по схеме, использующейся в настоящем исследовании: по 1 суппозиторию 1 000 000 МЕ ректально 2 р./сут. в течение 10 дней, затем через день по 1 суппозиторию 1 000 000 МЕ в течение 40 дней. В период обострения, когда возбудитель активно размножается в клетках уротелия, применение препарата вместе с антибиотиком позволяет добиться наиболее полной элиминации возбудителя и снизить риск его персистенции. В последующем поддерживающий курс интерферонотерапии обеспечивает способность организма более адекватно реагировать на повторное проникновение патогена как на уровне местных защитных процессов, так и в результате системного иммунного ответа. Таким образом, применение Генферона® в качестве компонента лечения хронического рецидивирующего бактериального цистита в комплексе с антибактериальной терапией позволяет добиться не только эффективного купирования клинических и лабораторных симптомов обострения, но и достоверного снижения количества рецидивов цистита в дальнейшем.
Выводы
На основании данных, полученных при проведении двойного слепого рандомизированного плацебо–контролируемого сравнительного исследования эффективности применения препарата Генферон® в составе комбинированной терапии хронического цистита бактериальной этиологии, были сделаны следующие выводы:
1. Генферон® характеризуется хорошей переносимостью и безопасностью при его использовании в терапии хронического цистита, в том числе при длительном (суммарно – в течение 50 дней) применении.
2. Генферон® в составе комплексной терапии хронического рецидивирующего цистита бактериальной этиологии (в сочетании с антибактериальным курсом) позволяет добиться эффективного купирования клинических и лабораторных признаков обострения воспаления мочевого пузыря, а также достоверно снизить частоту возникновения рецидивов заболевания.
3. Генферон® может быть рекомендован для широкого применения в лечении хронических рецидивирующих циститов бактериальной этиологии: при обострении – в дозе 1 000 000 МЕ ректально 2 р./сут. в течение 10 дней в сочетании со стандартным курсом антибактериальной терапии, затем – по 1 суппозиторию 1 000 000 МЕ ректально через день в течение 40 дней с целью профилактики рецидивов.
Литература
1. Локшин К.Л. Современные представления о диагностике и лечении неосложненного острого цистита // РМЖ.– 2006. – № 12. – С. 55–56.
2. Лопаткин Н.А., Деревянко И.И. Программа антибактериальной терапии острого цистита и пиелонефрита у взрослых // Инфекции и антимикроб. терапия. – 1999. – № 2. – С. 81–87.
3. Стрельцова О.С., Крупин В.Н. Хронический цистит: новое в диагностике и лечении // Лечащий врач. – 2008. – №.7. – С.18–24.
4. Лоран О.Б., Синякова Л.А., Косова И.В. Лечение и профилактика хронического рецидивирующего цистита у женщин // Consilium medicum. – 2004. – № 7(6). – С. 31–35.
5. Рафальский В.В., Страчунский Л.С., Кречикова О.И., Эйдельштейн И.А. и др. Резистентность возбудителей амбулаторных инфекций мочевыводящих путей по данным многоцентровых микробиологических исследований UTIAP–I и UTIAP–II // Урология. – 2004. – № 2. – С. 13–17.
6. Minardi D., d’Anzeo G., Cantoro D. et al. Urinary tract infections in women: etiology and treatment options // Intern. J. General Med. 2011. № 4. Р. 333–334.
7. Birder L.A., Hanna–Mitchell А.Т., Mayer E., Buffington Ch. A. Cystitis, Comorbid Disorders and Associated Epithelial Dysfunction // Neurourol Urodyn. 2011 . Vol. 30(5). Р. 668–672.
8. Grover S., Srivastava A., Lee R. et al. Role of inflammation in bladder function and interstitial cystitis // Ther. Adv. Urol. 2011. № 3(1) Р. 19–33.
9. Hang L., Wullt B., Shen Z. et al. Cytokine repertoire of epithelial cells lining the human urinary tract // J. Urol. 1998. № 159(6). Р. 2185–2192.
10. Persu C., Cauni V., Gutue S. et al. From interstitial cystitis to chronic pelvic pain// J. Med. and Life. 2010. Vol. 3, № 2. Р.167–174.
11. Скрябин Г.Н., Александров В.П., Кореньков Д.Г., Назаров Т.Н. Циститы (учебное пособие). – СПб, 2006. – 127 с.
12. Gupta K., Hooton T.M., Naber K.G. et al. International Clinical Practice Guidelines for the Treatment of Acute Uncomplicated Cystitis and Pyelonephritis in Women: A 2010 Update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases // Clin. Infect. Diseases. 2011. № 52(5). Р. 103–120.
13. Рафальский В.В., Довгань Е.В. Фторхинолоны в лечении инфекций мочевыводящих путей: роль антибиотикорезистентности // РМЖ.– 2011. – № 11. – С. 34–37.
14. Grabe M., Bjerklund–Johansen T., Botto H. et al. Guidelines on urological infections. 2010: European Association of Urology.
15. Нестерова И.В. Препараты интерферона альфа в клинической практике // Рос. аллергол. журнал. – 2010. – № 2. – С. 43–52.
16. Ершов Н.И. Система интерферона в норме и патологии. – М.: Медицина, 1998. – 173 c.
17. Репин И.В., Хлынова С.А., Черняева Е.В. Роль иммунотропной терапии в лечении хронических урогенитальных инфекций у женщин. Опыт клинического применения препаратов интерферона // Эффективная фармакотерапия в акушерстве и гинекологии. – 2010. – № 3.
18. Камалов А.А., Ефремов Е.А., Дорофеев С.Д. и др. Клинико–иммунологические аспекты хронического бактериального простатита на фоне проведения иммуномодулирующей терапии // Эффективная фармакотерапия в урологии. – 2007. – № 3.
19. Горелов А.В., Феклисова Л.В., Плоскирева А.А. и др. Комплексная терапия вирусной диареи у детей – первые результаты открытого сравнительного рандомизированного клинического исследования препаратов интерферона // Педиатрическая фармакология. – 2011. – Т. 8, № 4. – C.106–114.
20. Уджуху В.Ю., Короткий Н.Г., Борисов И.В., Казакова М.А. Комплекс Ацикловир – Генферон® в терапии генитального герпеса // Вопросы дерматологии, косметологии, клинической микологии и ИППП. – 2005.
21. Кузьмина Н.В., Романюк Ф.П. Новые препараты в иммунотропной терапии ОРВИ у детей // Consilium Medicum. Педиатрия. – 2011. – № 1.
22. Российские национальные рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов» – М., 2012. – 64с.












