История открытия центров
мочеиспукания головного мозга
Первые работы, посвященные изучению механизмов регуляции мочеиспускания, появляются в 1900 и 1914 годах. Их авторы Guyon и Barrington F.D.F. показали в опытах на кошках роль спинномозговых центров и подчревного нерва в регуляции мочеиспускания. Барингтона не удовлетворили результаты исследования, и в 1925 году появляется его работа, посвященная открытию центра мочеиспускания, расположенного у кошек в области Варолиевого моста. Barrington F.D.F. станет первым хирургом–физиологом, который поймет важность ассоциации между «центрами мочеиспускания» головного мозга и функционированием нижних мочевых путей (НМП) [6]. Его известная статья 1925 г. под названием «Эффекты от повреждения заднего и среднего мозга на мочеиспускание кошки», многократно цитированная, по мнению F.I. MacDonald, явилась одной из наиболее значимых работ по изучению головного мозга в XX веке. Основные выводы работы заключались в следующем:
1. Разрушение маленькой части мозга, расположенного вентрально к внутреннему краю верхних ножек мозжечка от уровня середины моторного ядра пятого нерва сзади и конечных отделов заднего мозга впереди приводит к полной задержке мочи при двустороннем поражении и не вызывает нарушения мочеиспускания при одностороннем поражении.
2. Разрушение среднего мозга, от вентральной половины задних отделов, минуя конец акведука, до ядра пятого нерва сопровождается при двустороннем повреждении постоянной потерей желания к мочеиспусканию и дефекации (исчезновение характерных поведенческих реакций у кошки, связанных с ритуалом мочеиспускания), но не нарушает работу этих функций.
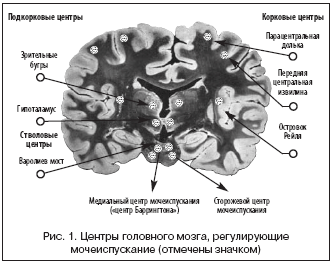
3. При более обширном поражении отмечается увеличение частоты мочеиспускания и дефекации. Первая из этих областей впоследствии была названа «ядром Баррингтона», «pontine micturition center» (PMC), «М» регион (от лат. medial), или медиальный центр мочеиспускания (МЦМ) [20,27]. Как выяснили Blok B.F. и Holstege G. (1997), нейроны «ядра Баррингтона» связаны прямыми синаптическими сообщениями с сакральными парасимпатическим преганглионарными нейронами и нейронами задних комиссур на сакральном уровне (спинальные представительства тазового нерва) [7]. По мнению Blok B.F. еt al. (1998), первые нейроны возбуждают мочевой пузырь (через тазовые ганглии), в то время как последние, как полагают авторы, оказывают тормозное действие на мотонейроны, регулирующие наружный сфинктер уретры [11]. В результате этих связей, по современным представлениям, стволовой центр мочеиспускания координирует синергию мочевого пузыря и сфинктера уретры. Roppolo J.R. и соавт. (1985) выяснили, что афферентные импульсы по чувствительным волокнам, идущим от ванилоидных рецепторов слизистой мочевого пузыря, минуя стволовой центр мочеиспускания, поднимаются до паравентрикулярных ядер, где происходит первичная их обработка (рис. 1). Сходные данные получены в работах Liu R.P.C. (1983), Blok B.F. и Holstege G. (1994, 1995) [9,10,26,31]. Подобная картина регуляции мочеиспускания была описана на кошках и приматах. Изучение центров мочеиспускания у человека впервые стало возможно с появлением методов прижизненной нейровизуализации, в частности, позитронно–эмиссионной томографии. В работах, руководимых Blok B.F. (1997, 1998), показано, что при мочеиспускании в головном мозге человека увеличивается кровоток в области dorsomedial pontine tegmentum, близкого к четвертому желудочку, и это, как предположили авторы, было местоположением МЦМ у человека [7,12]. Исследования Torrens M. (1987), Shefchyk S.J. (2001), Morrison J. еt al. (2005) и de Groat W.C. (2006) показали сходные области расположения «ядра Баррингтона» у крыс, собак, морских свинок, свиней и человека [19,28,33,34]. Эти авторы, используя современные нейрофизиологические и уродинамические методики, выделили дополнительный регион в пределах рострального участка заднебокового отдела Варолиевого моста, отвечающий за сокращение наружного сфинктера мочеиспускательного канала, который был назван «L–регион» (от лат. lateral) или сторожевой центр мочеиспускания (СЦМ). СЦМ содержит нейроны, влияющие на мотонейроны ядра Онуфа–Онуфриевича (спинальное представительство соматического срамного нерва) (рис. 1, 2).
Holstege G. еt al. (1979, 1986) показали связь СЦМ с тораколюмбальными симпатическими преганглионарными нейронами [22,23]. Двусторонние повреждения СЦМ у кошек приводили к развитию гиперрефлексии и ургентному недержанию мочи. Описанная еще Barrington F.D.F. (1925) картина «высокого тонуса мочевого пузыря и спастического состояния сфинктера» позже получила название «детрузорно–сфинктерной диссинергии» (ДСД). Современные концепции механизмов формирования стрессового недержания мочи (недержании мочи при повышении внутрибрюшного давления на фоне глубокого дыхания, кашле, чихании, смехе или сексуальной деятельности), по мнению Griffiths D.J. (2002), также связывают с поражением СЦМ [21]. Сходные данные представлены в работе Минатуллаева Ш.А. (2008) у больных с вертебрально–базиллярной недостаточностью [2].
Другими важными «центрами мочеиспускания» являются ядра, расположенные в области лобных и височных долей и гипоталамуса (рис. 1). Центры лобной коры отвечают за анализ постоянно поступающих через паравентрикулярное ядро гипоталамуса афферентных импульсов из наполняющегося мочой мочевого пузыря. Большинство этих импульсов суммируются и в результате осознаются человеком, как позыв на мочеиспускание при наполнении мочевого пузыря до 250–300 мл. За этим следуют поведенческие реакции, связанные с поиском удобной для мочеиспускания территории (вероятно, за это отвечают базальные ганглии). Поиск удобного места для мочеиспускания программируется социальными нормами поведения. Изменение мочевого поведения, снятия табу, может косвенно свидетельствовать о нарушении скоординированной работы лобных и подкорковых центров мочеиспускания (это относится и к ограничению больными питьевого режима). Подобные расстройства мочеиспускания наблюдаются при выраженных когнитивных нарушениях и могут отражать динамику изменения ядра личности [2].
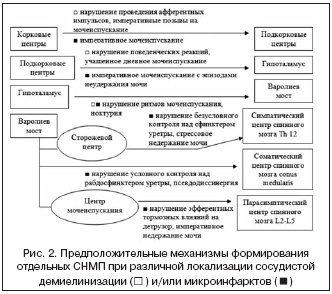
В иерархическом подчинении находятся подкорковые ганглии, связанные с гипоталамическими центрами, регулирующими суточный ритм мочеиспускания. По данным МРТ наличие бокового и подкоркового лейкоареоза с развитием микроинфарктов может приводить к появлению дизурических расстройств и смещению биологических ритмов в сторону ночных мочеиспусканий (при нормальном или уреженном дневном мочеиспускании) [3]. В частности, сосудистое поражение ствола головного мозга при дисциркуляторной энцефалопатии (ДЭ) носит, как правило, характер микроинфарктов и может затрагивать МЦМ, описанный Barrington F.J.F. в 1925 г., и парные СЦМ, регулирующие сокращение детрузора и удержание мочи. В МЦМ происходит суммация и перераспределение восходящих спинальных импульсов с мочевого пузыря. Оба этих парных центра работают синхронно и антагонистично. При активации МЦМ, имеющего влияние на парасимпатические центры спинного мозга, происходит сокращение мочевого пузыря, а при активации сторожевого центра, связанного с симпатическими центрами спинного мозга (и, по–видимому, соматическими), происходит сокращение непроизвольного сфинктера уретры.
Таким образом, работы Barrington F.J.F. остаются узловыми в современном понимании центрального контроля над мочеиспусканием у человека и животных.
Заболевания головного мозга,
приводящие к расстройствам
акта мочеиспускания
Нарушения акта мочеиспускания являются частым осложнением заболеваний головного мозга, что объясняется высокой концентрацией корковых, подкорковых и стволовых центров, регулирующих сократительную активность мочевого пузыря и уретры, а также «мочевое поведение». Поражение одного или нескольких центров мочеиспускания, проводящих нервных волокон между центрами, дисбаланс нейромедиаторных систем – все это может стать самостоятельной причиной дискоординированной работы детрузора и сфинктеров уретры. Кроме того, прием ряда лекарственных средств, применяемых в неврологической практике, может самостоятельно изменять сократительную активность НМП. Характер течения (прогредиентное или ремиттирующее) и развития (острое или хроническое) также отражается на динамике развития дисфункций НМП. Стоит также упомянуть такое грозное ятрогенное осложнение нейрогенных нарушений мочеиспускания, как катетер–ассоциированная инфекция НМП, сопровождающая катетеризацию мочевого пузыря при острой и хронической задержке мочи.
Инсульт – поражение центров
мочеиспускания головного мозга
Наиболее часто встречающейся формой нарушения акта мочеиспускания, наблюдающейся у больных, перенесших инсульт, является императивное недержание мочи, в значительной степени снижающее качество жизни и социальную адаптацию, а по данным ряда авторов, являющееся предиктором смертности больных и суицидальных попыток [24].
Острая и хроническая задержка мочи, а также катетер–ассоциированная инфекция, связанная с интермиттирующим или постоянным дренированием НМП, могут приводить к развитию хронических очагов инфекции и септических осложнений в острый и последующие периоды НМК.
Частота встречаемости урологических осложнений НМК варьирует в зависимости от фазы нарушения мозгового кровообращения, пола и возраста больных, характера поражения головного мозга (ишемический или геморрагический), локализации очага поражения (рис. 2) и тактики ведения больных и, по данным Langhorne P. et al. (2000) и Brittain K. R. et al. (1998), составляет от 24 до 87% [13,24].
Нарушения акта мочеиспускания проявляются симптомами нижних мочевых путей (СНМП). Для оценки СНМП используют шкалы: IPSS, LISS, Madsen – Iversen, индекс Боярского. До настоящего времени нет единого мнения о том, какую диагностическую шкалу–вопросник можно было бы применять для оценки СНМП у неврологических больных (в том числе перенесших инсульт). В урологии широкое распространение получило деление СНМП на обструктивные и ирритативные, предложенное P. Abrams (1988) [4].
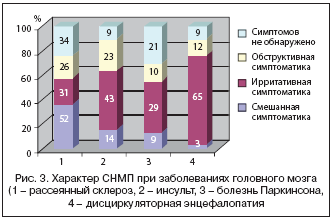
К обструктивным симптомам относят: вялую струю мочи, ощущение неполного опорожнения мочевого пузыря, прерывистое мочеиспускание и необходимость натуживаться для начала мочеиспускания. К ирритативным симптомам относят: учащенное мочеиспускание (более 8 раз/сут.), императивные позывы и недержание мочи, а также ноктурию. В наших исследованиях было показано, что у 91% больных, перенесших инсульт, отмечаются СНМП, из них ирритативная симптоматика отмечалась у 44%, обструктивная симптоматика – у 23%, смешанная симптоматика – у 14% больных (рис. 3).
По мнению Lee A.H. et al. (2003), на частоту встречаемости императивного недержания мочи влияет и характер инсульта. При субарахноидальном кровоизлиянии (n=322) авторы отметили недержание мочи у 3,1%, при внутримозговом кровоизлиянии (n=807) – 5,2%, при ишемическим инсульте (n=4681) – 6,7%, а при транзиторных ишемических атаках (n=1974) – 2,0% [25]. Daviet J.C. et al. (2004), отмечают, что на период 2–х суток СНМП наблюдаются у 40% больных, на 15–е сутки – у 32%, а на 90–е сутки лишь у 19%, то есть в два раза реже, чем в начале заболевания [14]. Doshi V.S. et al. (2003) указывают, что нарушения акта мочеиспускания наряду с инфекцией НМП и депрессией чаще встречается у женщин, перенесших инсульт, по сравнению с мужчинами [17]. Devroe D. et al. (2003) указывают на то, что такие сопутствующие осложнения НМК, как сахарный диабет 2 типа в стадии декомпенсации, геморрагический характер инсульта, кома и недержание мочи могут стать причиной летального исхода [15].
Хроническая задержка мочи характеризуется наличием в мочевом пузыре остаточной мочи. Удобным, достоверным и малоинвазивным методом определения остаточной мочи является ультразвуковое исследование объема мочевого пузыря после мочеиспускания. Исследование 123 больных, перенесших инсульт, показали наличие остаточной мочи более 50 мл у 34 больных: из них 18 исследование проводилось в первые 3 мес. после инсульта, 16 больным в более отдаленном периоде. По данным Daviet J.C. et al. (2004), наличие остаточной мочи более 150 мл (в норме остаточной мочи не определяется) в первые сутки после инсульта отмечается у 36% больных, а на 90–й день только у 19%. При выявлении остаточной мочи на 90–й день после инсульта случаи смерти больных учащаются с 16 до 22% [14]. Dromerick A.W. et al. (2003) выявили наличие остаточной мочи более 150 мл у 28 из 101 пациента [16].
Важно отметить, что невозможность самостоятельного мочеиспускания в острый период инсульта может быть обусловлена также вынужденным положением (лежа на спине), наличием других больных в палате и непривычной больничной обстановкой. Создание комфортных условий для мочеиспускания для этой категории больных позволяет избегать неоправданных катетеризаций мочевого пузыря. Использование весов при взвешивании памперсов и перкуторное определение наполнения мочевого пузыря позволяет максимально сократить использование уретрального катетера для определения диуреза, а следовательно сводит к минимуму риск развития инфекционных осложнений.
Nitti V.W. еt al. (1996) указывают в своей работе на необходимость проведения комплексного уродинамического исследования (КУДИ) больным, перенесшим инсульт, имеющим СНМП [29]. При проведении КУДИ у 34 больных были выявлены 3 уродинамических варианта (формы) нарушения акта мочеиспускания: нейрогенная детрузорная гиперактивность (НДГ) – у 17 (50%), нарушение сократительной способности – у 13 больных (38%) и нарушение произвольного расслабления поперечно–полосатого сфинктера уретры у 4 (12%) больных.
При сравнении данных шкалы IPSS с показателями МРТ головного мозга C. Fowler et al. (1992) выявили корреляцию между наличием нарушений акта мочеиспускания и локализацией повреждений головного мозга в лобной и височной областях, гипоталамусе и области Варолиевого моста, что совпадает с другими данными [18].
Дисциркуляторная энцефалопатия – ишемическое поражение центров мочеиспускания и их проводников
в головном мозге
Нарушение мочеиспускания является весьма распространенным осложнением ДЭ и у 9% больных отмечается на ранних стадиях заболевания. По мнению Sakakibara R. и соавт. (1999), еще до появления нейровизуализационных признаков заболевания (лейкоареоза) частота встречаемости нейрогенной детрузорной гиперактивности (НДГ) (20%) преобладает над двигательными (16%) и когнитивными (10%) нарушениями. Автор предлагает исследовать СНМП, как одни из ранних маркеров ДЭ у лиц пожилого возраста. По мере нарастания явлений лейкоареоза отмечается и увеличение частоты встречаемости СНМП. Максимальное значение этого показателя отмечено при распространенном лейкоареозе (передний, средний и задний) и достигает 93%. В то же время нарастает когнитивный и двигательный дефицит [30].
Обращает на себя внимание, что в поздние стадии заболевания отмечается наиболее тяжелая степень расстройств мочеиспускания, частота которых на всех стадиях выше по сравнению с нарушениями психических и двигательных функций. При распределении отдельных симптомов можно выявить относительно раннее появление ночных мочеиспусканий (ноктурии) и более позднее присоединение императивного недержания мочи. Изолированный симптом ноктурии можно расценить, как следствие нарушения суточных ритмов, в то время как ночные мочеиспускания в составе синдрома гиперактивного мочевого пузыря (ГМП) – проявление поллакиурии.
В исследовании Griffiths D.J. и соавт. (2002) [21] показана роль асимметричности поражения корковых представительств на характер расстройств мочеиспускания у больных ДЭ. При поражении правых передних отделов лобной коры отмечалось преобладание императивного недержания мочи со снижением чувствительности мочевого пузыря, а при поражении левого полушария указанные нарушения отмечались реже.
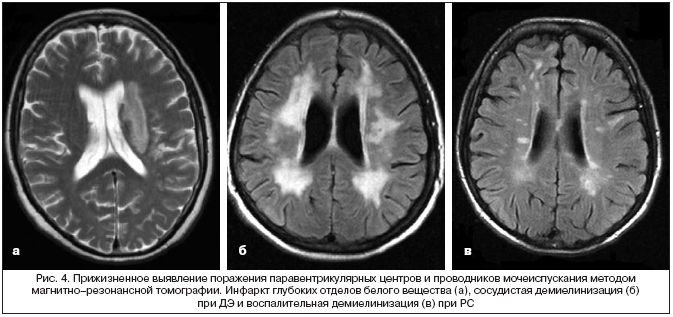
Таким образом, существует некая топическая семиотика нейрогенных нарушений мочеиспускания при ДЭ и инсульте. Наблюдая за характером СНМП, можно предположить уровень поражения головного мозга, а оценивая динамику их развития – клинический вариант ДЭ. Для подтверждения предположительного повреждения головного мозга целесообразно проводить магнитно–резонансную томографию (рис. 4).
Раннее развитие СНМП при относительно сохранных когнитивных и двигательных функциях, характерное для некоторых случаев ДЭ, может служить одним из критериев при дифференциальной диагностике различных деменций (в частности, Альцгеймеровского типа, когда указанные расстройства появляются при выраженном когнитивном дефиците).
При проведении КУДИ больным ДЭ Минатуллаев Ш.А. (2008) выявил НДГ (моторная форма) у 60%, ГМП без детрузорной гиперактивности (сенсорная форма) у 25%. Сфинктерные нарушения были выявлены у 15% больных и проявлялись стрессовым недержанием мочи (9%) и нарушением произвольного расслабления поперечно–полосатого сфинктера уретры (6%). При распределении видов уродинамических нарушений по формам ДЭ автор выявляет следующие закономерности: у больных с вертебрально–базиллярной недостаточностью чаще отмечались сфинктерные нарушения, у больных мультиинфарктной гипертонической энцефалопатией и субкортикальной артериосклеротической энцефалопатией отмечалось повышение моторики мочевого пузыря, а у больных со смешанной формой ДЭ – повышение чувствительности мочевого пузыря [2].
При сопоставлении нейровизуализационных признаков ДЭ с уродинамическими формами нарушения мочеиспускания нами были выявлены следующие корреляции: 1) НДГ (моторная форма) выявлена у больных с передним и задним лейкоареозом, лакунарными инфарктами в паравентрикулярной и преоптической областях, а также в области варолиева моста; 2) сенсорные расстройства мочеиспускания отмечены у больных с передним лейкоареозом; 3) сфинктерные нарушения выявлены у больных с лакунарными инфарктами в области Варолиева моста.
Рассеянный склероз – сочетанное поражение нервных проводников между центрами мочеиспускания головного и спинного мозга
По данным различных авторов, частота встречаемости нарушений мочеиспускания составляет от 24 до 96% случаев РС [3]. Использование шкалы I–PSS позволило нам выявить СНМП у 253 из 325 больных (78%). Ирритативная симптоматика, включая императивные позывы на мочеиспускание, ноктурию и императивное недержание мочи, была выявлена у 48 (19%) больных. Обструктивная симптоматика, включая затрудненное начало акта мочеиспускания, тонкую струю мочи и ощущение неполного опорожнения мочевого пузыря отмечено у 93 (37%) больных. Смешанная симптоматика, включая различное сочетание симптомов, выявлена у 112 (44%) больных РС. Нарушения акта мочеиспускания у 191 (75%) больного РС клинически проявлялись в первые 5 лет заболевания, причем у 18 из них СНМП были отмечены в дебюте заболевания, а у 5 из этих больных СНМП были в течение первых 3 лет единственным проявлением неврологического заболевания, и только выполнение МРТ головного мозга и нейрофизиологического исследования позволило установить диагноз РС (рис. 4). При сопоставлении данных, полученных при МРТ головного мозга, с клиническими проявлениями нарушения акта мочеиспускания у больных РС (n=112) были отмечены следующие достоверные корреляции: 1) наличие бляшек РС в мозолистом теле сочеталось с ирритативной симптоматикой, 2) поражение мозжечка – с нарушением произвольного расслабления мышц тазового дна, 3) поражение ствола мозга сопровождалось обструктивной и смешанной симптоматикой, 4) наличие бляшек РС в шейном отделе спинного мозга сочеталось с детрузорно–сфинктерной диссинергией (ДСД). Полученные данные можно объяснить дискоординацией между работой расположенных в соответствующих отделах головного и спинного мозга центров, регулирующих нормальный акт мочеиспускания, в частности, стволовых и подкорковых прессорных центров, контролирующих сократительную активность детрузора, а также мозжечковых центров, регулирующих сократительную активность произвольного компонента сфинктера уретры (рис. 3). У 105 больных РС (32%) при УЗИ отмечалась остаточная моча в объеме более 50 мл. При этом 27 больных, которые имели остаточную мочу по данным УЗИ, не ощущали ее наличия. В то же время у 18 больных с жалобой на ощущение неполного опорожнения мочевого пузыря не отмечалось наличия остаточной мочи. Данные КУДИ представлены в таблице 1.
Как видно из таблицы 1, КУДИ выявило все известные виды нарушения акта мочеиспускания, каждый из которых имел характерные уродинамические признаки. Анализ жалоб больных и сопоставление их с результатами КУДИ показали, что различные типы нарушения функции НМП могут сопровождаться сходной клинической картиной. НДГ и ГМП без детрузорной гиперактивности сопровождаются выраженной ирритативной симптоматикой. Поэтому на основании симптомов учащенного дневного и ночного мочеиспускания, а также ургентного недержания мочи могут быть заподозрены указанные формы нарушения функции НМП. Учитывая отсутствие жалоб, характерных для нарушения опорожнения мочевого пузыря у этих больных, а также возможность точного определения остаточной мочи при помощи УЗИ, имеются все основания отказаться в таких случаях от проведения КУДИ.
В свою очередь, у больных с нарушением произвольного расслабления поперечно–полосатого сфинктера уретры и у больных со снижением сократительной способности детрузора, выявленных по данным комплексного уродинамического обследования, отмечена обструктивная симптоматика, включая все обструктивные симптомы. Анализ этих симптомов не выявил специфических проявлений, позволяющих отметить разницу между этими двумя формами. Следовательно, у больных с обструктивными симптомами только КУДИ позволяет определить тип нарушения функции НМП и на основании этого выбрать соответствующий вид лечения.
У больных с ДСД и НДГ в сочетании со сниженной сократительной способностью детрузора отмечаются жалобы, характерные как для ирритативного, так и для обструктивного типа нарушения функции НМП. Это обстоятельство доказывает невозможность точного определения этих форм нарушения функции НМП на основании жалоб и клинической картины нарушения акта мочеиспускания и подчеркивает необходимость выполнения КУДИ.
Необходимость проведения специализированного урологического диагностического комплекса мероприятий по выявлению нарушений акта мочеиспускания у больных с заболеваниями головного мозга с последующим определением лечебной тактики диктует обязательное участие уролога в обследовании неврологических больных.
Болезнь Паркинсона –
нарушение мочеиспускания,
как проявление дефицита
дофамина и парасимпатикотонии
В отличие от нарушений мочеиспускания, причиной которых было ишемическое поражение центров мочеиспускания и/или демиелинизирующее повреждение их проводников (сосудистого генеза при ДЭ или воспалительного при РС), дисфункции НМП при болезни Паркинсона возникают вследствие недостаточности дофамина, обусловленной гибелью популяции пигментированных дофаминергических нейронов плотной части черной субстанции и других дофаминсодержащих ядер ствола головного мозга. Yoshimura N. еt al. (2003) показали в своих исследованиях роль D1/D5 рецепторов в регуляции мочеиспускания. Стимуляция этих подтипов дофаминовых рецепторов способствует подавлению детрузорной гиперактивности, в то время как стимуляция куинпиролом (quinpirole), агонистом D2/D3/D4 подтипов дофаминовых рецепторов приводила к уменьшению накопительной функции мочевого пузыря. Стимуляция веществом PD128907, селективным агонистом D3 подтипа рецепторов, не приводила к изменениям функций мочевого пузыря. Дефицит возбуждения D1/D5–рецепторов – не единственная возможная причина развития НДГ и других нарушений мочеиспускания при БП [35]. На более поздних стадиях заболевания к 5–8 году заболевания появляется парасимпатикотония, проявлениями которой, помимо НДГ (в норме сокращения детрузора происходят за счет активации парасимпатического центра мочеиспускания, расположенного в conus medularis), являются сиалорея, спастический запор и др. Следовательно, можно предположить, что в основе сходного клинического и уродинамического феномена в разные периоды заболевания лежат различные механизмы, их формирующие. Это, в свою очередь, может объяснить неэффективность фармакотерапии этих расстройств при применении антихолинергических средств на ранних стадиях заболевания и стимуляторов D1/D5–рецепторов на поздних стадиях заболевания. Появление расстройств мочеиспускания при БП на поздних стадиях заболевания может быть объяснено относительной сохранностью лобных, подкорковых и спинальных центров мочеиспускания, нейромедиаторами которых являются ацетилхолин, норадреналин, гамма–аминомасляная кислота, серотонин, субстанция Р и гистамин.
Soler J.M. (2004) указывает на сфинктерные расстройства при БП, которые, по его наблюдениям, отмечаются в 30–90% случаев [32]. По нашим наблюдениям, (рис. 3) нарушения мочеиспускания отмечаются у 48% больных, среди которых были пациенты с акинетико–ригидной и ригидно–дрожательной формами заболевания. Из них у 29% преобладают ирритативные СНМП и при КУДИ выявляется НДГ, у 10% отмечается нарушение сократительной способности детрузора и у 9% наблюдается смешанная симптоматика, обусловленная в отдельных случаях доброкачественной гиперплазией простаты. Мазуренко Д.А. (2005) в своей работе подтвердил мнение Araki I. (2000), что высокий риск осложнений от оперативного лечения доброкачественной гиперплазии простаты у пациентов с БП обусловлен нейрогенным, а не органическим происхождением СНМП у этой категории больных [1,5].
Лекарственная терапия нарушений мочеиспускания при заболеваниях головного мозга
Фармакотерапия является наиболее эффективным методом лечения функциональных расстройств мочеиспускания. Приоритетной группой лекарственных средств, применяемых для лечения НДГ при заболеваниях головного мозга, являются антихолинергические средства. Эти средства с разной степенью органной специфичности и избирательности в отношении разных подтипов блокируют мускариновые (М)–холинорецепторы мочевого пузыря (табл. 2). Основными задачами этого вида лечения являются снижение сократительной активности детрузора и увеличение функциональной емкости мочевого пузыря, что клинически выражается в урежении мочеиспусканий и снижении выраженности императивных позывов, а при наличии ургентного недержания мочи – ликвидации последнего.
Устойчивый терапевтический эффект от применения препаратов этой группы создает условия для их длительного применения. Также на фоне приема толтеродина тартрата у больных отмечалось купирование явлений анального недержания у больных РС, а при применении троспиума хлорида у больных, перенесших инсульт, отмечалась нормализация работы кишечника вследствие уменьшения явлений спастического запора, а у пациентов с БП уменьшаются явления сиалореи. При приеме антихолинергических средств у 5–54% больных отмечается сухость слизистых, наименее выраженная у троспиума хлорида.
Реже отмечаются такие центральные эффекты, как галлюцинации, атонический запор, тахиаритмия, обострение закрытоугольной глаукомы и появление остаточной мочи. При появлении побочных эффектов возможно уменьшение суточной дозы препарата или отмена средства. Важно отметить, что при БП не рекомендуется прием антихолинергических средств, проникающих через ГЭБ, из–за возможного потенцирования противопаркинсонической терапии.
В комплексной терапии нарушений функций НМП у пациентов со спастичностью мышц тазового дна используется ботулинический токсин, оказывающий влияние на ГАМК–ергическую регуляцию мочеиспускания.
По нашим наблюдениям, препараты этой группы наиболее эффективны у больных с псевдодиссинергией и у отдельных больных со снижением тонуса детрузора. a1–адреноблокаторы (доксазозина мезилат, альфузозин, теразозин и тамсулозин) способствует облегчению начала акта мочеиспускания у больных с ДСД.
У больных со сниженной сократительной способностью детрузора используют антихолинэстеразные средства, способные с разной степенью обратимости ингибировать фермент ацетилхолинэстеразу (дистигмина бромид и пиридостигмина бромид). Терапевтический эффект развивается на 2–3–и сутки приема и выражается в учащении мочеиспускания, исчезновении остаточной мочи, усилении ощущения позыва на мочеиспускание и облегчении начала мочеиспускания.
Применение симптоматических средств, влияющих на акт мочеиспускания, является необходимым дополнением к патогенетической терапии заболеваний головного мозга.
Характер «положительных» и «отрицательных» побочных эффектов от нейрофармакологических средств позволяет проследить некоторые параллели между процессами, происходящими при нейрогенных дисфункциях различных тазовых органов (кишечник, мочевой пузырь и половые органы) и сделать предположения не только об общности их иннервации, но и об их функциональном единстве.


Литература
1. Мазуренко Д.А. Дифференциальная диагностика и лечение расстройств мочеиспускания у больных болезнью Паркинсона. Дис. …канд. мед. наук — М., 2005. — 105 с.
2. Минатуллаев Ш.А. хронические сосудистые заболевания головного мозга и функциональные нарушения мочеиспускания. : Автореф. дис. …канд. мед. наук. М., 2008. 25 с.
3. Шварц П.Г. Нарушения акта мочеиспускания у больных рассеянным склерозом ремиттирующего течения. : Автореф. дис. …канд. мед. наук. М., 2004. 22 с.
4. Abrams P.H., Blaivas J.G., Stanton S.L., Anderson J.T. Standartization of terminology of lower urinary tract function. // Neurourol. Urodyn. — 1988. — Vol. 7 — P. 403–428.
5. Araki I. Kitahara M. at al., Voiding dysfunction and Parkinson’s disease: urodynamic abnormalities and urinary symptoms. : J Urol 2000 Nov;164(5):1640–3.
6. Barrington FJF The effect of lesions of the hind– and mid–brain on micturition in the cat. Q J Exp Physiol. 1925. 15, 81–102. Elsevier. 1992.
7. Blok BF & Holstege G. Ultrastructural evidence for a direct pathway fromthe pontine micturition center to the parasympathetic preganglionic motoneurons of the bladder of the cat. Neurosci Lett. 1997. 222, 195–198.
8. Blok BF, Sturms LM & Holstege G. A PET study on cortical and subcortical control of pelvic floor musculature in women. J Comp Neurol. 1997. 389, 535–544.
9. Blok BF,DeWeerdH&Holstege G. Ultrastructural evidence for a paucity of projections from the lumbosacral cord to the pontine micturition center or M–region in the cat: a new concept for the organization of the micturition reflex with the periaqueductal gray as central relay. J Comp Neurol. 1995. 359, 300–309.
10. Blok BF & Holstege G. Direct projections from the periaqueductal gray to the pontine micturition center (M–region). An anterograde and retrograde tracing study in the cat. Neurosci Lett. 1994. 166, 93–96.
11. Blok BF, Sturms LM & Holstege G. Brain activation during micturition in women. Brain. 1998. 121 (Pt 11), 2033–2042.
12. Blok BF, van Maarseveen JT & Holstege G. Electrical stimulation of the sacral dorsal gray commissure evokes relaxation of the external urethral sphincter in the cat. Neurosci Lett. 1998. 249, 68–70.
13. Brittain K.R. et al. // Stroke 1998. Vol. 29; 2: 524–528.
14. Daviet J.C. et al. // Ann Readapt Med. 2004. Oct 47(8). P. 531.
15. Devroey D et al. // Cerebrovasc Dis. 2003. № 16(3). Р. 272.
16. Dromerick A.W. et al. // Arch Phys Med Rehabil. 2003. № 84(9). Р. 1369.
17. Doshi V.S. et al. // Singapore Med J. 2003. vol. 44(12). Р. 643.
18. Fowler C.J, Frohman E.M. Neurologic bladder bowel and sexual dysfunction.
19. De GroatWC. Integrative control of the lower urinary tract: preclinical perspective. Br J Pharmacol. 2006. 147 Suppl 2, S25–S40.
20. De GroatWC. Nervous control of the urinary bladder of the cat. Brain Res. 1975. 87, 201–211.
21, Griffiths DJ. The pontine micturition centres. Scand J Urol Nephrol. 2002. Suppl 210, 21–26.
22. Holstege G, Griffiths D, deWall H & Dalm E. Anatomical and physiological observations on supraspinal control of bladder and urethral sphincter muscles in cats. J Comp Neurol.1986. 250, 449–461.
23. Holstege G, Kuypers HG & Boer RC. Anatomical evidence for direct brain stem projections to the somatic motoneuronal cell groups and autonomic preganglionic cell groups in cat spinal cord. Brain Res. 1979. 171, 329–333.
24. Langhorne et al. // Stroke. 2000. Vol. 31. 6. Р. 1223.
25. Lee A.H. et al. // MJA 2003. № 179 (6) Р. 289.
26. Liu RPC. Laminar origins of spinal projection neurons to the periaqueductal gray of the rat. Brain Res. 1983. 264, 118–122.
27. Loewy AD, Saper CB & Baker RP. Descending projections from the pontine micturition center. Brain Res. 1979. 172, 533–538.
28. Morrison J, Fowler C, Birder L, Craggs M, de Groat W, Downie J,Drake M & Thor K Neural control of the bladder. InIncontinence, ed. Abrams P, Cardozo L, Khoury S & Wein A, 2005. pp. 363–422. Health Publications Ltd, Paris.
29. Nitti V.W. et al. // J Urol. 1996. № 155(1). Р. 263.
30. Sakakibira R. et al. // Int. Urogynecol J Pelvic floor Dysfunct. 1999. № 10(3).Р. 192.
31. Roppolo JR, Nadelhaft I & de GroatWC. The organization of pudendal motoneurons and primary afferent projections in the spinal cord of the rhesus monkey revealed by horseradish peroxidase. J Comp Neurol. 1985. 234, 475–488.
32. Soler JM, Le Portz B Bladder sphincter disorders in Parkinson’s disease Ann Urol (Paris). 2004 Dec;38 Suppl 2:S57–61.
33. Shefchyk SJ. Sacral spinal interneurones and the control of urinary bladder and urethral striated sphincter muscle function. J Physiol. 2001. 533, 57–63.
34. TorrensM&Morrison JFB. The Physiology of the Lower Urinary Tract. Springer–Verlag, 1987. London.
35. Yoshimura N, Kuno S, at al., Dopaminergic mechanisms underlying bladder hyperactivity in rats with a unilateral 6–hydroxydopamine (6–OHDA) lesion of the nigrostriatal pathway.Br J Pharmacol. 2003 Aug;139(8):1425–32.












