–Т–≤–µ–і–µ–љ–Є–µ
–Ш–љ—Д–µ–Ї—Ж–Є–Є –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є (–Ш–Ь–Я) —П–≤–ї—П—О—В—Б—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–Љ–Є –µ–ґ–µ–≥–Њ–і–љ–Њ —Б—В—А–∞–і–∞—О—В –Њ–Ї–Њ–ї–Њ 11% –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ —Б—В–∞—А—И–µ 18 –ї–µ—В [1]. –£ –ґ–µ–љ—Й–Є–љ –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Б—В—А–µ—З–∞–µ—В—Б—П –Њ—Б—В—А—Л–є —Ж–Є—Б—В–Є—В вАФ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П, —Б –ї–µ–≥–Ї–Є–Љ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ; —Г –Љ—Г–ґ—З–Є–љ –і–∞–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞. –†–µ—Ж–Є–і–Є–≤–љ–Њ–µ —В–µ—З–µ–љ–Є–µ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–≥–Њ –Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П –њ—А–Є—З–Є–љ—П–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є —Г—Й–µ—А–± –Ј–і–Њ—А–Њ–≤—М—О, —Б–љ–Є–ґ–∞–µ—В –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –≤–ї–µ—З–µ—В –±–Њ–ї—М—И–Є–µ —А–∞—Б—Е–Њ–і—Л —Б–Є—Б—В–µ–Љ—Л –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –Њ–±—Й–Є–µ —А–∞—Б—Е–Њ–і—Л –љ–∞ –ї–µ—З–µ–љ–Є–µ –Ш–Ь–Я —Г –ґ–µ–љ—Й–Є–љ –≤ –°–®–Р –≤ 2000 –≥. —Б–Њ—Б—В–∞–≤–Є–ї–Є –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ 2,47 –Љ–ї—А–і –і–Њ–ї–ї–∞—А–Њ–≤ [2]. –Ф–ї–Є—В–µ–ї—М–љ—Л–є –Є–ї–Є –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –њ—А–Є–µ–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –љ–∞–њ—А–Є–Љ–µ—А —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ш–Ь–Я, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є–≤–љ–Њ–Љ—Г —А–Њ—Б—В—Г —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є —А–∞–Ј–≤–Є—В–Є—О –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є—О –Ї–Њ–Љ–њ–ї–∞–µ–љ—В–љ–Њ—Б—В–Є.
–Э–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤ –Љ–Њ—З–µ–≤–Њ–Љ –њ—Г–Ј—Л—А–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Ї–∞–Ї —Б–њ–Њ—А–∞–і–Є—З–µ—Б–Ї–Є–є, —В–∞–Ї –Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–є —Г –љ–µ–±–µ—А–µ–Љ–µ–љ–љ—Л—Е –ґ–µ–љ—Й–Є–љ –Є –≤ –њ—А–µ–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ, –±–µ–Ј –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є—Е –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –љ–Є–ґ–љ–Є—Е –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є (–Э–Ь–Я) –Є –±–µ–Ј –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Б–Њ—Б—В–Њ—П–љ–Є–є.
–Ю—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤ –Љ–Њ—З–µ–≤–Њ–Љ –њ—Г–Ј—Л—А–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ —Г –Љ—Г–ґ—З–Є–љ, —Г –±–µ—А–µ–Љ–µ–љ–љ—Л—Е, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Э–Ь–Я, —Б –љ–∞–ї–Є—З–Є–µ–Љ –Ї–∞—В–µ—В–µ—А–Њ–≤ –≤ –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В—П—Е, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ, –Є–Љ–Љ—Г–љ–Њ–Ї–Њ–Љ–њ—А–Њ–Љ–µ—В–Є—А—Г—О—Й–Є–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ–Њ—З–µ–Ї.
–†–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –≤ –Љ–Њ—З–µ–≤–Њ–Љ –њ—Г–Ј—Л—А–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Ї–∞–Ї –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–є, —В–∞–Ї –Є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–є [3]. –Ъ—А–Є—В–µ—А–Є—П–Љ–Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –Љ–Њ—З–µ–≤–Њ–Љ –њ—Г–Ј—Л—А–µ —П–≤–ї—П–µ—В—Б—П —З–∞—Б—В–Њ—В–∞ –љ–µ –Љ–µ–љ–µ–µ —В—А–µ—Е —А–µ—Ж–Є–і–Є–≤–Њ–≤ –≤ –≥–Њ–і –Є–ї–Є –і–≤—Г—Е вАФ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 6 –Љ–µ—Б.
–≠—В–Є–Њ–ї–Њ–≥–Є—П
–Т–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–Љ –Њ—Б—В—А–Њ–≥–Њ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–≥–Њ —Ж–Є—Б—В–Є—В–∞ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ (–Њ–Ї–Њ–ї–Њ 80вАУ90%) —П–≤–ї—П–µ—В—Б—П Escherichia coli –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ вАФ –і—А—Г–≥–Є–µ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–Є –Љ–Њ—З–µ–≤–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є: Staphylococcus saprophyticus, Klebsiella sp—А., Proteus spp. –Є –і—А. [4].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –Љ–Є—А–µ —Б —Ж–µ–ї—М—О –Љ–Њ–љ–Є—В–Њ—А–Є–љ–≥–∞ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Ш–Ь–Я –Є –Є—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є —А–µ–≥—Г–ї—П—А–љ–Њ –њ—А–Њ–≤–Њ–і—П—В—Б—П –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ъ—А—Г–њ–љ–µ–є—И–µ–µ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ ECOвАУSENS —Б —Г—З–∞—Б—В–Є–µ–Љ 4734 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј 252 –Ї–ї–Є–љ–Є–Ї 16 —Б—В—А–∞–љ –Х–≤—А–Њ–њ—Л –Є –Ъ–∞–љ–∞–і—Л, –Ј–∞–Ї–Њ–љ—З–Є–≤—И–µ–µ—Б—П –≤ 2003 –≥., –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –≤—Л—П–≤–Є—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В–Є: —Г 77,7% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Ш–Ь–Я –±—Л–ї–Є –≤—Л–Ј–≤–∞–љ—Л E. coli, —Г 5,2% вАФ Proteus mirabilis, —Г 2,8% вАФ Klebsiella spp., —Г 3,9% вАФ –і—А—Г–≥–Є–Љ–Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П–Љ–Є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae, —Г 4,6% вАФ S. saprophyticus –Є —Г 5,8% вАФ –њ—А–Њ—З–Є–Љ–Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–∞–Љ–Є. –Э–µ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ—Л –Ї –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ—Г –Њ–Ї–∞–Ј–∞–ї–Є—Б—М 29,8% –≤—Л–і–µ–ї–µ–љ–љ—Л—Е —И—В–∞–Љ–Љ–Њ–≤ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –Ї —Б—Г–ї—М—Д–∞–Љ–µ—В–Њ–Ї—Б–∞–Ј–Њ–ї—Г вАФ 29,1% –Є –Ї —В—А–Є–Љ–µ—В–Њ–њ—А–Є–Љ—Г вАФ 14,8%. –£—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М —И—В–∞–Љ–Љ–Њ–≤ E. coli –Ї —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г, –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ–∞ –Є –Ї–ї–∞–≤—Г–ї–∞–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ—Г, –≥–µ–љ—В–∞–Љ–Є—Ж–Є–љ—Г –Є —Д–Њ—Б—Д–Њ–Љ–Є—Ж–Є–љ–∞ —В—А–Њ–Љ–µ—В–∞–Љ–Њ–ї—Г –±—Л–ї–∞ –Њ—В–Љ–µ—З–µ–љ–∞ –Љ–µ–љ–µ–µ —З–µ–Љ —Г 3% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [5].
–Т –†–Њ—Б—Б–Є–Є –њ–Њ–і —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–Љ –њ—А–Њ—Д–µ—Б—Б–Њ—А–∞ –Ы.C. –°—В—А–∞—З—Г–љ—Б–Ї–Њ–≥–Њ –±—Л–ї–Є –њ—А–Њ–≤–µ–і–µ–љ—Л –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: UTIAP I (1998вАУ1999 –≥–≥.), UTIAP II (2000вАУ2001 –≥–≥.) –Є UTIAP III (2004вАУ2005 –≥–≥.). –Т —Е–Њ–і–µ —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –†–Њ—Б—Б–Є–Є –Њ—Б—В—А—Л–є —Ж–Є—Б—В–Є—В –≤ 85,9% –љ–∞–±–ї—О–і–µ–љ–Є–є –≤—Л–Ј—Л–≤–∞–ї–∞ E. coli, –≤ 6% вАФ Klebsiella spp., –≤ 1,8% вАФ Proteus spp., –≤ 1,6% вАФ S. saprophyticus, –≤ 1,2% вАФ Pseudomonas aeruginosa –Є –і—А. –®—В–∞–Љ–Љ—Л E. coli, —Г—Б—В–Њ–є—З–Є–≤—Л–µ –Ї –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ—Г, –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –≤ 22,7вАУ44% —Б–ї—Г—З–∞–µ–≤, –Ї –Ї–Њ-—В—А–Є–Љ–Њ–Ї—Б–∞–Ј–Њ–ї—Г вАФ –≤ 16,2вАУ26,9%, –Ї –љ–Є—В—А–Њ–Ї—Б–Њ–ї–Є–љ—Г вАФ –≤ 6,8вАУ7,9% –љ–∞–±–ї—О–і–µ–љ–Є–є. –£—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М —И—В–∞–Љ–Љ–Њ–≤ E. coli –Ї –љ–Њ—А—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г, —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г –Є –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ—Г –±—Л–ї–∞ –Њ—В–Љ–µ—З–µ–љ–∞ –Љ–µ–љ–µ–µ —З–µ–Љ —Г 3% –±–Њ–ї—М–љ—Л—Е –Њ—Б—В—А—Л–Љ —Ж–Є—Б—В–Є—В–Њ–Љ [6, 7].
–Ь–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ ¬Ђ–Ф–Р–†–Ь–Ш–°-2011¬ї –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Б—А–µ–і–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Ш–Ь–Я –і–Њ–ї—П –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї–µ–є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae —Б–Њ—Б—В–∞–≤–Є–ї–∞ 83,5%. –Я—А–Є —Н—В–Њ–Љ E. coli –≤—Л—П–≤–ї—П–ї–∞—Б—М —Г 63,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т —Ж–µ–ї–Њ–Љ —З–∞—Б—В–Њ—В–∞ –≤—Л–і–µ–ї–µ–љ–Є—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Ј–љ–∞—З–Є–Љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ–Є –Є –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ–Є –Ш–Ь–Я [8]. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є ¬Ђ–Ф–Р–†–Ь–Ш–°-2018¬ї –≤—Л—П–≤–ї—П–µ–Љ–Њ—Б—В—М E. coli –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–µ–є —Б–Њ—Б—В–∞–≤–Є–ї–∞ 74,6%, –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–є вАФ 67,2%, Klebsiella pneumoniae вАФ 9,6% –Є 12,7%; P. mirabilis вАФ 3% –Є 4,6%; Enterococcus faecalis вАФ 5% –Є 6,3%; Staphylococcus sp—А. вАФ 2,3% –Є 1,2% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; –і–Њ–ї—П P. aeruginosa, –Ї–Њ—В–Њ—А–∞—П –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л—Е –Ш–Ь–Я, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 1,7%. –Ч–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М —И—В–∞–Љ–Љ–Њ–≤ E. coli –Ї –∞–Љ–њ–Є—Ж–Є–ї–ї–Є–љ—Г (57,7%), –∞–Љ–Њ–Ї—Б–Є—Ж–Є–ї–ї–Є–љ—Г/–Ї–ї–∞–≤—Г–ї–∞–љ–∞—В—Г (43%) –Є —В—А–Є–Љ–µ—В–Њ–њ—А–Є–Љ—Г/—Б—Г–ї—М—Д–∞–Љ–µ—В–Њ–Ї—Б–∞–Ј–Њ–ї—Г (36,9%), —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї —Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ—Г (60,6%), –Ї–Њ—В–Њ—А–∞—П –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–Є–ґ–µ, —З–µ–Љ 7 –ї–µ—В –љ–∞–Ј–∞–і (79,9%). –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ—А–µ–і—Л–і—Г—Й–Є–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ, –њ–Њ –і–∞–љ–љ—Л–Љ ¬Ђ–Ф–Р–†–Ь–Ш–°-18¬ї, —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –≤—Л—А–Њ—Б–ї–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, –њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е ќ≤-–ї–∞–Ї—В–∞–Љ–∞–Ј—Л —А–∞—Б—И–Є—А–µ–љ–љ–Њ–≥–Њ —Б–њ–µ–Ї—В—А–∞, вАФ —Б 8,5% –і–Њ 27% [8].
–Я–∞—В–Њ–≥–µ–љ–µ–Ј –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞
–Ю—Б—В—А—Л–є —Ж–Є—Б—В–Є—В, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —П–≤–ї—П–µ—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –≤–Њ—Б—Е–Њ–і—П—Й–µ–є –Є–љ—Д–µ–Ї—Ж–Є–Є (—А–Є—Б. 1).

–Ъ–∞–Ї —Г–ґ–µ –±—Л–ї–Њ —Б–Ї–∞–Ј–∞–љ–Њ –≤—Л—И–µ, —Ж–Є—Б—В–Є—В —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г –ґ–µ–љ—Й–Є–љ, —З—В–Њ –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М –∞–љ–∞—В–Њ–Љ–Њ-—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –Є—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Ъ —В–∞–Ї–Њ–≤—Л–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї–Њ—А–Њ—В–Ї–∞—П –Є —И–Є—А–Њ–Ї–∞—П —Г—А–µ—В—А–∞, –µ–µ –±–ї–Є–Ј–Њ—Б—В—М –Ї –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ —А–µ–Ј–µ—А–≤—Г–∞—А–∞–Љ –Є–љ—Д–µ–Ї—Ж–Є–Є (–Ј–∞–і–љ–µ–њ—А–Њ—Е–Њ–і–љ–Њ–µ –Њ—В–≤–µ—А—Б—В–Є–µ, –≤–ї–∞–≥–∞–ї–Є—Й–µ), –∞ —В–∞–Ї–ґ–µ —З–∞—Б—В—Л–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є–µ –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤–Њ –≤–ї–∞–≥–∞–ї–Є—Й–µ, –≤ –њ—А–µ–і–і–≤–µ—А–Є–Є –≤–ї–∞–≥–∞–ї–Є—Й–∞, –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –њ–Њ–ґ–Є–ї—Л—Е –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ, –љ–µ–і–µ—А–ґ–∞–љ–Є–µ –Љ–Њ—З–Є, –њ—А–Њ–ї–∞–њ—Б —В–∞–Ј–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤) [9].
–С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–µ—Ж–Є–і–Є–≤–Њ–≤ –≤–Њ–Ј–љ–Є–Ї–∞–µ—В –≤ –њ–µ—А–≤—Л–µ 3 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Є–Ј–ї–µ—З–µ–љ–Є—П –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–µ–≥–Њ —Н–њ–Є–Ј–Њ–і–∞. –Т —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ —Н–њ–Є–Ј–Њ–і–∞ –Ш–Ь–Я —Г 27% –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Е–Њ—В—П –±—Л –Њ–і–Є–љ –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–є —А–µ—Ж–Є–і–Є–≤, –∞ —Г 2,7% вАФ –љ–µ –Љ–µ–љ–µ–µ –і–≤—Г—Е —А–µ—Ж–Є–і–Є–≤–Њ–≤ [10].
–Ъ —Д–∞–Ї—В–Њ—А–∞–Љ —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є –Ш–Ь–Я —Г –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ –Є –ґ–µ–љ—Й–Є–љ –≤ –њ–µ—А–Є–Њ–і –њ—А–µ–Љ–µ–љ–Њ–њ–∞—Г–Ј—Л –Њ—В–љ–Њ—Б—П—В [4]:
–Ї—Г–ї—М—В—Г—А—Г –њ–Њ–ї–Њ–≤–Њ–є –ґ–Є–Ј–љ–Є;
–Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б–њ–µ—А–Љ–Є—Ж–Є–і–Њ–≤;
—Б–Љ–µ–љ—Г –њ–Њ–ї–Њ–≤–Њ–≥–Њ –њ–∞—А—В–љ–µ—А–∞;
–љ–∞–ї–Є—З–Є–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –Ш–Ь–Я —Г –Љ–∞—В–µ—А–Є;
–∞–љ–∞–Љ–љ–µ–Ј –Ш–Ь–Я –≤ –і–µ—В—Б—В–≤–µ;
—Б–µ–Ї—А–µ—В–Њ—А–љ—Л–є —Б—В–∞—В—Г—Б –∞–љ—В–Є–≥–µ–љ–∞ –≥—А—Г–њ–њ—Л –Ї—А–Њ–≤–Є.
–£ –ґ–µ–љ—Й–Є–љ –≤ –њ–µ—А–Є–Њ–і –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј—Л —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Ш–Ь–Я —П–≤–ї—П—О—В—Б—П [4]:
–∞–љ–∞–Љ–љ–µ–Ј –Ш–Ь–Я –і–Њ –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л;
–љ–µ–і–µ—А–ґ–∞–љ–Є–µ –Љ–Њ—З–Є, —Ж–Є—Б—В–Њ—Ж–µ–ї–µ;
–∞—В—А–Њ—Д–Є—П —Б–ї–Є–Ј–Є—Б—В—Л—Е –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤—Л—Е –њ—Г—В–µ–є, –і–µ—Д–Є—Ж–Є—В —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤;
–Њ—Б—В–∞—В–Њ—З–љ–∞—П –Љ–Њ—З–∞;
–Ї–∞—В–µ—В–µ—А–Є–Ј–∞—Ж–Є—П –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П;
—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П, –і–µ–Љ–µ–љ—Ж–Є—П, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞.
–Ъ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –Љ–Њ—З–µ–≤–Њ–Љ –њ—Г–Ј—Л—А–µ –Њ—В–љ–Њ—Б—П—В—Б—П: –±–Њ–ї—М –≤–љ–Є–Ј—Г –ґ–Є–≤–Њ—В–∞; —А–µ–Ј–Є –Є –ґ–ґ–µ–љ–Є–µ –њ—А–Є –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є–Є; —З–∞—Б—В–Њ–µ –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є–µ –Љ–∞–ї—Л–Љ–Є –њ–Њ—А—Ж–Є—П–Љ–Є; –њ—А–Є–Љ–µ—Б—М –≥–љ–Њ—П –≤ –Љ–Њ—З–µ, –≥–µ–Љ–∞—В—Г—А–Є—П, —Б—Г–±—Д–µ–±—А–Є–ї—М–љ–∞—П —В–µ–Љ–њ–µ—А–∞—В—Г—А–∞ —В–µ–ї–∞.
–Ф–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞
–Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –µ–≤—А–Њ–њ–µ–є—Б–Ї–Є–Љ–Є –Є —А–Њ—Б—Б–Є–є—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –і–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ –Њ—Б—В—А–Њ–≥–Њ —Б–њ–Њ—А–∞–і–Є—З–µ—Б–Ї–Њ–≥–Њ —Ж–Є—Б—В–Є—В–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Є–µ –Њ–±—Й–µ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –Љ–Њ—З–Є, —Е–Њ—В—П –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –ї–µ—З–µ–љ–Є—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ [3, 4]. –Ъ—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—З–Є —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –њ—А–Є –≤–њ–µ—А–≤—Л–µ –≤–Њ–Ј–љ–Є–Ї—И–µ–Љ –Њ—Б—В—А–Њ–Љ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —Ж–Є—Б—В–Є—В–µ –љ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ. –Ы–µ—З–µ–љ–Є–µ, –њ–Њ–Љ–Є–Љ–Њ —Г—А–Њ–ї–Њ–≥–∞, –Љ–Њ–≥—Г—В –њ—А–Њ–≤–Њ–і–Є—В—М –≤—А–∞—З –Њ–±—Й–µ–є –њ—А–∞–Ї—В–Є–Ї–Є –Є —В–µ—А–∞–њ–µ–≤—В.
–Ъ–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є—П —Г—А–Њ–ї–Њ–≥–∞ –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—З–Є –љ–∞ –њ—А–µ–і–Љ–µ—В –≤—Л—П–≤–ї–µ–љ–Є—П –њ–∞—В–Њ–≥–µ–љ–љ–Њ–≥–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П —П–≤–ї—П—О—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ–Є –њ—А–Є –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ, —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–Љ —Ж–Є—Б—В–Є—В–µ –Є–ї–Є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—З–Є –і–Њ–ї–ґ–љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М—Б—П –і–Њ –љ–∞—З–∞–ї–∞ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –Њ–±–љ–Њ–≤–ї–µ–љ–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ш–Ь–Я, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Л–µ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є–Љ –Њ–±—Й–µ—Б—В–≤–Њ–Љ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є (Guidelines IDSA), –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –≤ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є —Г—А–Њ–ї–Њ–≥–Њ–≤ (–ХAU, 2019) [4].

–Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Њ—Б—В—А—Л–є —Б–њ–Њ—А–∞–і–Є—З–µ—Б–Ї–Є–є —Ж–Є—Б—В–Є—В –ї–µ–≥–Ї–Њ –Ї—Г–њ–Є—А—Г–µ—В—Б—П –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —А–∞—Б—В–Є—В–µ–ї—М–љ—Л–Љ–Є –і–Є—Г—А–µ—В–Є–Ї–∞–Љ–Є –Є–ї–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–Љ–Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є. –Я—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є —В–∞–Ї—В–Є–Ї–Є –ї–µ—З–µ–љ–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л—Е –Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Э–Ь–Я –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М –њ—А–Є—З–Є–љ—Г –Є—Е —А–∞–Ј–≤–Є—В–Є—П –Є –њ—А–Њ–≤–µ—Б—В–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–∞. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, —Г –ґ–µ–љ—Й–Є–љ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П —Г—А–Њ–≥–µ–љ–Є—В–∞–ї—М–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ —З–∞—Б—В–Њ —П–≤–ї—П–µ—В—Б—П –і–µ—Д–Є—Ж–Є—В —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤, –≤–µ–і—Г—Й–Є–є –Ї –∞—В—А–Њ—Д–Є–Є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤, —Б–љ–Є–ґ–µ–љ–Є—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –ї–∞–Ї—В–Њ–±–∞–Ї—В–µ—А–Є–є –≤–Њ –≤–ї–∞–≥–∞–ї–Є—Й–µ, –њ–Њ–≤—Л—И–µ–љ–Є—О –Ј–љ–∞—З–µ–љ–Є–є —А–Э –≤–∞–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ —Б–µ–Ї—А–µ—В–∞. –≠—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ —Д–∞–Ї—Г–ї—М—В–∞—В–Є–≤–љ–Њ-–∞–љ–∞—Н—А–Њ–±–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, —А–∞–Ј–≤–Є—В–Є–µ –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Ї –Ш–Ь–Я [11]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–Љ–љ–Є—В—М, —З—В–Њ –Њ—Б—В—А—Л–є —Ж–Є—Б—В–Є—В –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ —Б –≤—Г–ї—М–≤–Њ–≤–∞–≥–Є–љ–Є—В–Њ–Љ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ—А–Є—А–Њ–і—Л –Є –Є–љ—Д–µ–Ї—Ж–Є—П–Љ–Є, –њ–µ—А–µ–і–∞—О—Й–Є–Љ–Є—Б—П –њ–Њ–ї–Њ–≤—Л–Љ –њ—Г—В–µ–Љ (–Ш–Я–Я–Я). –Ю–±–Є–ї—М–љ—Л–µ –≥–љ–Њ–є–љ—Л–µ –≤—Л–і–µ–ї–µ–љ–Є—П –Є–Ј —Г—А–µ—В—А—Л –Є–ї–Є –≤–ї–∞–≥–∞–ї–Є—Й–∞, –ґ–ґ–µ–љ–Є–µ –њ—А–Є –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є–Є, –љ–µ–њ—А–Є—П—В–љ—Л–є –Ј–∞–њ–∞—Е, –Ј—Г–і, –і–Є—Б–њ–∞—А–µ—Г–љ–Є—П, –і–Є–Ј—Г—А–Є—П, –≥–Є–њ–µ—А–µ–Љ–Є—П –њ–Њ–ї–Њ–≤—Л—Е –≥—Г–±, –њ—А–µ–і–і–≤–µ—А–Є—П –≤–ї–∞–≥–∞–ї–Є—Й–∞, –±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ—Б—В—М –њ—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є, –≥–љ–Њ–є–љ—Л–є —Ж–µ—А–≤–Є—Ж–Є—В –Є–ї–Є –±–∞—А—В–Њ–ї–Є–љ–Є—В вАФ –≤—Б–µ —Н—В–Њ —Б–Є–Љ–њ—В–Њ–Љ—Л –Є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–µ —Д–∞–Ї—В–Њ—А—Л –і–ї—П –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Њ—Б—В—А–Њ–≥–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –Э–Ь–Я. –І–∞—Б—В—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є –≤—Г–ї—М–≤–Њ–≤–∞–≥–Є–љ–Є—В–∞ —Б–ї—Г–ґ–∞—В —В–∞–Ї–ґ–µ –≥—А–Є–±–Ї–Њ–≤–∞—П –Є–љ—Д–µ–Ї—Ж–Є—П (–Ї–∞–љ–і–Є–і–Њ–Ј) –Є –≥–µ–љ–Є—В–∞–ї—М–љ—Л–є –≥–µ—А–њ–µ—Б. –Т—Л—П–≤–ї–µ–љ–Є–µ –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –≤—Л—И–µ —Б–Њ—Б—В–Њ—П–љ–Є–є —В—А–µ–±—Г–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Г –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–∞. –£–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –і–Њ–≤–Њ–ї—М–љ–Њ —И–Є—А–Њ–Ї–Њ –Ї–∞–Ї —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Њ–±—К–µ–Љ–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –Є –Ї–∞–Љ–љ–µ–є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П [12].
–Я–µ—А–µ–і –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ:
—Б–Њ–±—А–∞—В—М –∞–љ–∞–Љ–љ–µ–Ј;
–њ—А–Њ–≤–µ—Б—В–Є —Д–Є–Ј–Є–Ї–∞–ї—М–љ—Л–є –Њ—Б–Љ–Њ—В—А, –≤–Ї–ї—О—З–∞—П –Њ—Б–Љ–Њ—В—А –љ–∞ –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Ї—А–µ—Б–ї–µ;
–њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≤–µ—Б—В–Є –Ј–∞–±–Њ—А –±–Є–Њ–Љ–∞—В–µ—А–Є–∞–ї–∞ –Є–Ј –≤–ї–∞–≥–∞–ї–Є—Й–∞ –љ–∞ –Ш–Я–Я–Я, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Г—О —Д–ї–Њ—А—Г;
–≤—Л–њ–Њ–ї–љ–Є—В—М —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ—З–µ–Ї –Є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П –і–Њ –Є –њ–Њ—Б–ї–µ –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є—П;
–Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—З–Є вАФ –Њ–±—Й–Є–є –∞–љ–∞–ї–Є–Ј –Љ–Њ—З–Є —Б –њ–Њ–і—Б—З–µ—В–Њ–Љ —Д–Њ—А–Љ–µ–љ–љ—Л—Е —Н–ї–µ–Љ–µ–љ—В–Њ–≤, –Љ–Є–Ї—А–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ–Њ—Б–µ–≤ –Љ–Њ—З–Є —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Є –µ–≥–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ.
–Ы–µ—З–µ–љ–Є–µ
–†–Њ—Б—В —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Ш–Ь–Я –≤ –Љ–Є—А–µ –њ—А–Є–≤–µ–ї –Ї –Ї–∞—А–і–Є–љ–∞–ї—М–љ—Л–Љ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П–Љ –Є –Ј–∞–њ—А–µ—В—Г –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А—П–і–∞ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (–Р–С–Я). –Ґ–∞–Ї, –Ъ–Њ–Љ–Є—В–µ—В –њ–Њ –Њ—Ж–µ–љ–Ї–µ —А–Є—Б–Ї–∞ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Д–∞—А–Љ–∞–Ї–Њ–љ–∞–і–Ј–Њ—А–∞ –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –∞–≥–µ–љ—В—Б—В–≤–∞ (PRAC EMA), –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–∞—П –∞–і–Љ–Є–љ–Є—Б—В—А–∞—Ж–Є—П –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –Ј–∞ –њ–Є—Й–µ–≤—Л–Љ–Є –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–∞–Љ–Є (FDA), –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–µ –Њ–±—Й–µ—Б—В–≤–Њ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є (Guidelines IDSA) –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–ї–Є –≤ 2019 –≥. –љ–Њ–≤—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—О –Ш–Ь–Я, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П [3].
–¶–µ–ї—М –ї–µ—З–µ–љ–Є—П –Њ—Б—В—А–Њ–≥–Њ –Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–≥–Њ —Ж–Є—Б—В–Є—В–∞: –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Н—А–∞–і–Є–Ї–∞—Ж–Є—П –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П, –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤.
–Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Њ–є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б–Њ–±–ї—О–і–∞—В—М: —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї—Г—О –і–Њ–Ј—Г; –Ї—А–∞—В–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞; –њ—Г—В–Є –≤–≤–µ–і–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞; —Г—З–Є—В—Л–≤–∞—В—М –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –Є —Д–∞—А–Љ–∞–Ї–Њ–і–Є–љ–∞–Љ–Є–Ї–Є –њ—А–µ–њ–∞—А–∞—В–∞, —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –≤ —А–µ–≥–Є–Њ–љ–µ, —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ; –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л; —Б–Њ—З–µ—В–∞–љ–Є–µ —Б –і—А—Г–≥–Є–Љ–Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є.
–Я—А–Є –Њ—Б—В—А–Њ–Љ –љ–µ–Њ—Б–ї–Њ–ґ–љ–µ–љ–љ–Њ–Љ —Ж–Є—Б—В–Є—В–µ –ї–µ—З–µ–љ–Є–µ –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї–Є, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є EAU. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ—Л –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–µ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Њ—Б—В—А–Њ–≥–Њ —Ж–Є—Б—В–Є—В–∞ вАФ E. coli: —Д–Њ—Б—Д–Њ–Љ–Є—Ж–Є–љ (—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М вАФ 98,4%), —Д—Г—А–∞–Ј–Є–і–Є–љ (95,7%), –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ (94,1%) –Є –њ–µ—А–Њ—А–∞–ї—М–љ—Л–µ —Ж–µ—Д–∞–ї–Њ—Б–њ–Њ—А–Є–љ—Л (—Ж–µ—Д–∞–і—А–Њ–Ї—Б–Є–ї) (—В–∞–±–ї. 2).
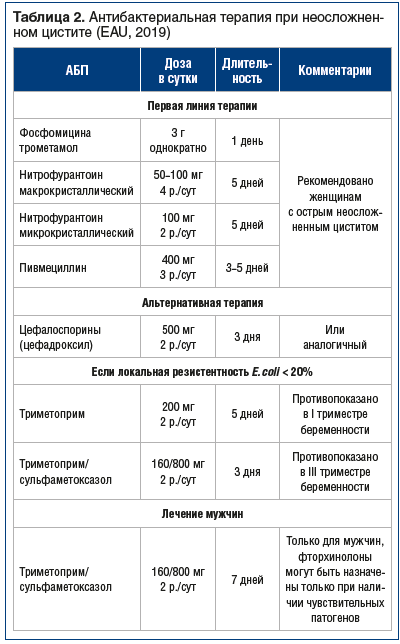
–Я–∞—Ж–Є–µ–љ—В–∞–Љ, —Г –Ї–Њ—В–Њ—А—Л—Е —Б–Є–Љ–њ—В–Њ–Љ—Л –љ–µ –Ї—Г–њ–Є—А–Њ–≤–∞–ї–Є—Б—М –Є–ї–Є –њ–Њ–≤—В–Њ—А–Є–ї–Є—Б—М –≤ —В–µ—З–µ–љ–Є–µ 2 –љ–µ–і. –њ–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –ї–µ—З–µ–љ–Є—П, –њ–Њ–Ї–∞–Ј–∞–љ—Л –њ–Њ–ї–љ–Њ–µ —Г—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –Ї—Г–ї—М—В—Г—А–∞–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ—З–Є —Б –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Ї –Р–С–Я. –Ы–µ—З–µ–љ–Є–µ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–є –Ш–Ь–Я –Ї—А–∞–є–љ–µ —Б–ї–Њ–ґ–љ–Њ –Є —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞–ї–Є—З–Є–µ–Љ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –±–Є–Њ–њ–ї–µ–љ–Њ–Ї, –≤ –Ї–Њ—В–Њ—А—Л—Е —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ—Л —Б–Ї–Њ–њ–ї–µ–љ–Є—П –њ–∞—В–Њ–≥–µ–љ–љ—Л—Е –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –і–Њ–ї–ґ–љ–∞ —Б–Њ—Б—В–∞–≤–ї—П—В—М –љ–µ –Љ–µ–љ–µ–µ 7 –і–љ–µ–є —Б —Г—З–µ—В–Њ–Љ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї—П –Ї –Р–С–Я.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –Љ–Њ—З–µ–≤–Њ–Љ –њ—Г–Ј—Л—А–µ –≤–Ї–ї—О—З–∞–µ—В —Б–ї–µ–і—Г—О—Й–Є–µ –Љ–µ—А—Л:
–њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –њ–µ—А–µ–Њ—Е–ї–∞–ґ–і–µ–љ–Є—П;
–њ–Є—В—М–µ–≤–Њ–є —А–µ–ґ–Є–Љ вАФ 2,5 –ї –ґ–Є–і–Ї–Њ—Б—В–Є;
—Б–Њ–±–ї—О–і–µ–љ–Є–µ –њ—А–∞–≤–Є–ї –ї–Є—З–љ–Њ–є –≥–Є–≥–Є–µ–љ—Л –Є —Б–µ–Ї—Б—Г–∞–ї—М–љ–Њ–є –ґ–Є–Ј–љ–Є;
–ї–µ—З–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є;
—А–µ–≥—Г–ї—П—А–љ–Њ–µ –Њ–њ–Њ—А–Њ–ґ–љ–µ–љ–Є–µ –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П –≤ —В–µ—З–µ–љ–Є–µ –і–љ—П, –∞ —В–∞–Ї–ґ–µ –і–Њ –Є –њ–Њ—Б–ї–µ –њ–Њ–ї–Њ–≤–Њ–≥–Њ –∞–Ї—В–∞;
–і–Є–µ—В–Њ—В–µ—А–∞–њ–Є—О.
–Я—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Ш–Ь–Я –љ–∞–њ—А–∞–≤–ї–µ–љ–∞ –љ–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є –Є –њ–Є—В—М–µ–≤–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞, —Г—Б—В—А–∞–љ–µ–љ–Є–µ —Г—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Є –Ї–Њ—А—А–µ–Ї—Ж–Є—О —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. EAU –Є –†–Њ—Б—Б–Є–є—Б–Ї–Є–Љ –Њ–±—Й–µ—Б—В–≤–Њ–Љ —Г—А–Њ–ї–Њ–≥–Њ–≤ –Р–С–Я —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –љ–∞–Ј–љ–∞—З–∞—В—М –≤ —Б–ї—Г—З–∞–µ –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ–≤–µ–і–µ–љ—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є –Љ–µ—А –љ–µ–∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ —А–µ–Ї–Њ–Љ–µ–љ–і—Г—О—В—Б—П –њ–Њ—Б–ї–µ –њ–Њ–ї–Њ–≤–Њ–≥–Њ –Ї–Њ–љ—В–∞–Ї—В–∞ [13].
–Я–Њ—Б—В–Ї–Њ–Є—В–∞–ї—М–љ–∞—П –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–∞—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –і–Њ–ї–ґ–љ–∞ –њ—А–Є–Љ–µ–љ—П—В—М—Б—П —В–Њ–ї—М–Ї–Њ –њ–Њ—Б–ї–µ –Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ–Є—П —Г—А–Њ–ї–Њ–≥–Њ–Љ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї—Г—А—Б–∞ –њ–Њ–≤–µ–і–µ–љ—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –і—А—Г–≥–Є–µ –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л. –†–µ–ґ–Є–Љ—Л –≤–Ї–ї—О—З–∞—О—В –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ 50 –Љ–≥ –Є–ї–Є 100 –Љ–≥ 1 —А./—Б—Г—В, —Д–Њ—Б—Д–Њ–Љ–Є—Ж–Є–љ–∞ —В—А–Њ–Љ–µ—В–∞–Љ–Њ–ї 3 –≥ –Ї–∞–ґ–і—Л–µ 10 –і–љ–µ–є, –∞ –≤–Њ –≤—А–µ–Љ—П –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В–Є вАФ —Ж–µ—Д–∞–ї–µ–Ї—Б–Є–љ 125 –Є–ї–Є 250 –Љ–≥ –Є–ї–Є —Ж–µ—Д–∞–Ї–ї–Њ—А 250 –Љ–≥ 1 —А./—Б—Г—В.
–° —Ж–µ–ї—М—О –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ш–Ь–Я —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Т –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –Љ–µ—Б—В–љ–∞—П —В–µ—А–∞–њ–Є—П —Н—Б—В—А–Њ–≥–µ–љ–∞–Љ–Є. –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є –Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–µ–є —Г—А–Њ–ї–Њ–≥–Њ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –Љ–љ–Њ–≥–Њ —А–∞–Ј–ї–Є—З–љ—Л—Е —А–∞—Б—В–Є—В–µ–ї—М–љ—Л—Е, –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ вАФ —Н—В–Њ –ї–Є–Њ—Д–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–є –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–є –ї–Є–Ј–∞—В 18 —И—В–∞–Љ–Љ–Њ–≤ E. coli, –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–Є –≥–Є–∞–ї—Г—А–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є —Е–Њ–љ–і—А–Њ–Є—В–Є–љ–∞ —Б—Г–ї—М—Д–∞—В–∞ –≤ –Љ–Њ—З–µ–≤–Њ–є –њ—Г–Ј—Л—А—М –і–ї—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –≥–ї–Є–Ї–Њ–Ј–∞–Љ–Є–љ–≥–ї–Є–Ї–∞–љ–Њ–≤–Њ–≥–Њ —Б–ї–Њ—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П, –њ—А–µ–њ–∞—А–∞—В—Л, —Б–Њ–і–µ—А–ґ–∞—Й–Є–µ –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ—Л, D-–Љ–∞–љ–љ–Њ–Ј—Г, –њ—А–Њ–±–Є–Њ—В–Є–Ї–Є, –≤–Є—В–∞–Љ–Є–љ D3, –і–µ—Д–Є—Ж–Є—В, –Ї–Њ—В–Њ—А–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–µ–љ –і–ї—П —А–µ–≥–Є–Њ–љ–Њ–≤ —Б –Ї–Њ—А–Њ—В–Ї–Є–Љ —Б–≤–µ—В–Њ–≤—Л–Љ –і–љ–µ–Љ, –Є –і—А. –Ь–µ—В–∞–∞–љ–∞–ї–Є–Ј –њ–Њ –љ–µ–∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Ш–Ь–Я –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –њ–µ—А–Њ—А–∞–ї—М–љ—Л–є –њ—А–Є–µ–Љ –ї–Є–Њ—Д–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ –ї–Є–Ј–∞—В–∞ 18 —И—В–∞–Љ–Љ–Њ–≤ E. coli, –њ—А–Њ–∞–љ—В–Є—Ж–Є–∞–љ–Є–і–Є–љ–Њ–≤ –Є –≤–∞–≥–Є–љ–∞–ї—М–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї –±–µ–Ј—А–µ—Ж–Є–і–Є–≤–љ—Л–є –њ–µ—А–Є–Њ–і –Ш–Ь–Я [14].
–§—Г–љ–Ї—Ж–Є–Є –≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–љ–Њ–≥–Њ–Њ–±—А–∞–Ј–љ—Л вАФ —Н—В–Њ –Ї–Њ–љ—В—А–Њ–ї—М –Ї–∞–ї—М—Ж–Є–є-—Д–Њ—Б—Д–Њ—А–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞, –≤–ї–Є—П–љ–Є–µ –љ–∞ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –≤–Ї–ї—О—З–∞—О—Й–Є–µ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г, –∞–њ–Њ–њ—В–Њ–Ј, –Ї–ї–µ—В–Њ—З–љ—Л–є —А–Њ—Б—В, –љ–µ—А–≤–љ–Њ-–Љ—Л—И–µ—З–љ—Г—О –њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В—М, –Є–Љ–Љ—Г–љ–Є—В–µ—В, —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≥–µ–љ–Њ–≤ –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –Ї–∞–Ї –Ј–∞—Й–Є—В–љ—Г—О —А–µ–∞–Ї—Ж–Є—О –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ [15].
–Т–њ–µ—А–≤—Л–µ –љ–∞ —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ —Ж–Є—Б—В–Є—В–Њ–Љ —Г –ґ–µ–љ—Й–Є–љ –≤ –њ—А–µ–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ –Є –і–µ—Д–Є—Ж–Є—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D —Г–Ї–∞–Ј–∞–ї–Є W. Nseir et al. [16]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –≤ –Э–Є–і–µ—А–ї–∞–љ–і–∞—Е van der Starre et al. [17], –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –≤–Ј—А–Њ—Б–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ь–Я –Є–Љ–µ–ї—Б—П –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D –Є –µ–≥–Њ —Г—А–Њ–≤–µ–љ—М –±—Л–ї –љ–Є–ґ–µ —Г —А–µ—Б–њ–Њ–љ–і–µ–љ—В–Њ–≤, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ. S. Javadi Nia et al. [18] –≤ –њ–µ—А–µ–Ї—А–µ—Б—В–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—А–∞–≤–љ–Є–ї–Є —Г—А–Њ–≤–µ–љ—М –≤–Є—В–∞–Љ–Є–љ–∞ D —Г 25 –і–µ—В–µ–є —Б –Ш–Ь–Я –Є 40 –Ј–і–Њ—А–Њ–≤—Л—Е. –£—А–Њ–≤–µ–љ—М –≤–Є—В–∞–Љ–Є–љ–∞ D –±—Л–ї –љ–Є–ґ–µ —Г –і–µ—В–µ–є —Б –Ш–Ь–Я, —З–µ–Љ –≤ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–є –≥—А—Г–њ–њ–µ, –љ–Њ —А–∞–Ј–љ–Є—Ж–∞ –љ–µ –±—Л–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ–є. –Р–≤—В–Њ—А—Л –њ—А–Є—И–ї–Є –Ї –≤—Л–≤–Њ–і—Г, —З—В–Њ –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D –Љ–Њ–ґ–µ—В –Є–≥—А–∞—В—М —А–Њ–ї—М –≤ –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –і–µ—В–µ–є –Ї –Ш–Ь–Я, –љ–Њ –і–ї—П –±–Њ–ї–µ–µ —В–Њ—З–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —Е–Њ—А–Њ—И–Њ —Б–њ–ї–∞–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –±–Њ–ї—М—И–Є—Е –Ї–Њ–≥–Њ—А—В–∞—Е.
M. Tekin et al. [19] –≤ –Њ–±—Б–µ—А–≤–∞—Ж–Є–Њ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—А–∞–≤–љ–Є–≤–∞–ї–Є —Г—А–Њ–≤–µ–љ—М –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ —Г –і–µ—В–µ–є —Б –Є –±–µ–Ј –Ш–Ь–Я –Є –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —З–∞—Б—В–Њ—В–∞ –њ–Њ—П–≤–ї–µ–љ–Є—П –Ш–Ь–Я —Г –і–µ—В–µ–є —Б —Г—А–Њ–≤–љ–µ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–Є–ґ–µ 20 –љ–≥/–Љ–ї –≤ 3,5 —А–∞–Ј–∞ –≤—Л—И–µ, —З–µ–Љ —Г –і–µ—В–µ–є —Б –љ–Њ—А–Љ–∞–ї—М–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D.
–Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П in vitro –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Н–њ–Є—В–µ–ї–Є–є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П —Г –ґ–µ–љ—Й–Є–љ, –њ—А–Њ—Е–Њ–і–Є–≤—И–Є—Е –ї–µ—З–µ–љ–Є–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D3, –Њ–±–ї–∞–і–∞–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –≤—Л—А–∞–±–∞—В—Л–≤–∞—В—М –±–Њ–ї—М—И–µ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Ї–∞—В–µ–ї–Є—Ж–Є–і–Є–љ–∞ –Є ќ≤-–і–µ—Д–µ–љ–Ј–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —П–≤–ї—П—О—В—Б—П –∞–љ—В–Є–Љ–Є–Ї—А–Њ–±–љ—Л–Љ–Є –њ–µ–њ—В–Є–і–∞–Љ–Є –Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В –Ј–∞—Й–Є—В–љ–Њ–µ –Є–Љ–Љ—Г–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ, –њ—А–µ–і–Њ—В–≤—А–∞—Й–∞—П —А–∞–Ј–≤–Є—В–Є–µ –Ш–Ь–Я [20, 21].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ—Б—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D3 –≤ –ї–µ—З–µ–љ–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Э–Ь–Я. –С–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Ш–Ь–Я –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —Б–Њ—З–µ—В–∞–љ–Є—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –Ї–∞–ґ–і—Л–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–Ї–∞–Ј–∞–ї –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М.
D-–Љ–∞–љ–љ–Њ–Ј–∞ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є —Б–∞—Е–∞—А, –≤—Л–њ–Њ–ї–љ—П—О—Й–Є–є –≤–∞–ґ–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞, –≤ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –≥–ї–Є–Ї–Њ–Ј–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –±–µ–ї–Ї–Њ–≤ –њ—А–Њ—В–µ–Њ–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞, –∞ —В–∞–Ї–ґ–µ –њ–Њ–і–і–µ—А–ґ–Ї–Є —Д—Г–љ–Ї—Ж–Є–Є –Є–Љ–Љ—Г–љ–љ–Њ–є, —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є, –Љ–Њ—З–µ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л –Њ—А–≥–∞–љ–Є–Ј–Љ–∞. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П, —П–≤–ї—П—П—Б—М –њ—А–Є—А–Њ–і–љ—Л–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –∞–≥–µ–љ—В–Њ–Љ, D-–Љ–∞–љ–љ–Њ–Ј–∞ –њ—А–µ–њ—П—В—Б—В–≤—Г–µ—В –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –∞–і–≥–µ–Ј–Є–Є –Ї –Ї–ї–µ—В–Ї–∞–Љ —Н–њ–Є—В–µ–ї–Є—П –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є –Њ—Б–љ–Њ–≤–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, —В–∞–Ї–Є—Е –Ї–∞–Ї E. coli, Klebsiella spp., P. aeruginosa –Є –і—А. –≠–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В—Л in vitro –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є, —З—В–Њ D-–Љ–∞–љ–љ–Њ–Ј–∞ —Б–≤—П–Ј—Л–≤–∞–µ—В—Б—П —Б —Д–Є–Љ–±—А–Є—П–Љ–Є —В–Є–њ–∞ I —Н–љ—В–µ—А–Њ–±–∞–Ї—В–µ—А–Є–є, –њ—А–µ–њ—П—В—Б—В–≤—Г—П –Є—Е –∞–і–≥–µ–Ј–Є–Є –Ї –Ї–ї–µ—В–Ї–∞–Љ —Н–њ–Є—В–µ–ї–Є—П –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є, –∞ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є –±–∞–Ї—В–µ—А–Є—Г—А–Є–Є –±—Л–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є in vivo –љ–∞ –Љ–Њ–і–µ–ї—П—Е –ґ–Є–≤–Њ—В–љ—Л—Е [22вАУ26].
–Т —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤–ї–Є—П–љ–Є–µ —А–µ–≥—Г–ї—П—А–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ–Њ—А–Њ—И–Ї–∞ D-–Љ–∞–љ–љ–Њ–Ј—Л –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 2000 –Љ–≥ –љ–∞ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ –≤ 4 —А–∞–Ј–∞ —З–∞—Б—В–Њ—В—Л —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Ш–Ь–Я –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ–Њ–Љ [27]. –Я–Њ—Б–ї–µ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ–є –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ—В–µ—А–∞–њ–Є–Є –Њ—Б—В—А–Њ–≥–Њ —Ж–Є—Б—В–Є—В–∞ 308 –ґ–µ–љ—Й–Є–љ —Б —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є–Љ–Є –Ш–Ь–Я –±—Л–ї–Є —Б–ї—Г—З–∞–є–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –њ–Њ —В—А–µ–Љ –≥—А—Г–њ–њ–∞–Љ –Є –≤–Ї–ї—О—З–µ–љ—Л –≤ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Я–µ—А–≤–∞—П –≥—А—Г–њ–њ–∞ (n=103) –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–ї—Г—З–∞–ї–∞ 2000 –Љ–≥ –њ–Њ—А–Њ—И–Ї–∞ D-–Љ–∞–љ–љ–Њ–Ј—Л –≤ 200 –Љ–ї –≤–Њ–і—Л –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б., –≤—В–Њ—А–∞—П –≥—А—Г–њ–њ–∞ (n=103) вАФ 50 –Љ–≥ –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ–∞ –µ–ґ–µ–і–љ–µ–≤–љ–Њ, –∞ —В—А–µ—В—М—П –≥—А—Г–њ–њ–∞ (n=102) –љ–µ –њ–Њ–ї—Г—З–∞–ї–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –І–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–∞ –Ш–Ь–Я –≤ –≥—А—Г–њ–њ–µ –њ—А–Є–µ–Љ–∞ D-–Љ–∞–љ–љ–Њ–Ј—Л —Б–Њ—Б—В–∞–≤–Є–ї–∞ 14,6%, –≤ –≥—А—Г–њ–њ–µ –њ—А–Є–µ–Љ–∞ –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ–∞ вАФ 20,4%, –≤ –≥—А—Г–њ–њ–µ –±–µ–Ј –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П вАФ 60,8% (—А–Є—Б. 2). –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –±–µ–Ј—А–µ—Ж–Є–і–Є–≤–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –≤ –≥—А—Г–њ–њ–∞—Е –љ–Є—В—А–Њ—Д—Г—А–∞–љ—В–Њ–Є–љ–∞ –Є –±–µ–Ј –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї–∞ 24 –Є 28 –і–љ–µ–є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –∞ –≤ –≥—А—Г–њ–њ–µ D-–Љ–∞–љ–љ–Њ–Ј—Л —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М –і–Њ 43 –і–љ–µ–є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М D-–Љ–∞–љ–љ–Њ–Ј—Г –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ш–Ь–Я [27].
–•–Њ—В–µ–ї–Њ—Б—М –±—Л –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ D-–Љ–∞–љ–љ–Њ–Ј–∞ 2000 –Љ–≥ –≤—Л–Ј—Л–≤–∞–µ—В –Є–љ—В–µ—А–µ—Б —Г –µ–≤—А–Њ–њ–µ–є—Б–Ї–Њ–≥–Њ —Г—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–Њ–±—Й–µ—Б—В–≤–∞ –Є, –Ї–∞–Ї –Њ—В–Љ–µ—З–µ–љ–Њ –≤—Л—И–µ, –±—Л–ї–∞ —Г–њ–Њ–Љ—П–љ—Г—В–∞ –≤ –њ–Њ—Б–ї–µ–і–љ–Є—Е —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞—Е –Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –Ї–∞–Ї –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –≤–µ—Й–µ—Б—В–≤–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Ш–Ь–Я.
–°–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї–ї—О–Ї–≤—Л (Vaccinium macrocarpon, –і–Є–Ї–∞—П —Б–µ–≤–µ—А–Њ–∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–∞—П –≥–Њ–ї—Г–±–Є–Ї–∞) –Є–љ–≥–Є–±–Є—А–Њ–≤–∞—В—М –∞–і–≥–µ–Ј–Є—О E. coli –Ї —Н–њ–Є—В–µ–ї–Є—О –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є –≤–њ–µ—А–≤—Л–µ –±—Л–ї–∞ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≤ 1984 –≥. –≤ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ A.E. Sobota [28]. –≠—В–Њ –і–µ–є—Б—В–≤–Є–µ —Б–≤—П–Ј–∞–љ–Њ —Б –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ–Љ —В–∞–љ–Є–љ–Њ–≤ (–њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ–Њ–≤ –Є –∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ–Њ–≤), –Ї–Њ—В–Њ—А—Л–µ –Њ–±–ї–∞–і–∞—О—В –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, –Є–љ–≥–Є–±–Є—А—Г—О—В —Б–Є–љ—В–µ–Ј —Д–Є–Љ–±—А–Є–є E. coli –Є —Б–љ–Є–ґ–∞—О—В –≤—Л–±—А–Њ—Б –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Њ–Ї–∞–Ј—Л–≤–∞—П –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–µ –і–µ–є—Б—В–≤–Є–µ, —В–µ–Љ —Б–∞–Љ—Л–Љ —Г–ї—Г—З—И–∞—П —В—А–Њ—Д–Є–Ї—Г —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —Г—А–µ—В—А—Л –Є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П [29вАУ32].
–Т 2004 –≥. –≤ –ґ—Г—А–љ–∞–ї–µ –Ъ–Њ–Ї—А–µ–є–љ–Њ–≤—Б–Ї–Њ–є –±–Є–±–ї–Є–Њ—В–µ–Ї–Є –±—Л–ї –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ –Њ–±–Ј–Њ—А –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —А–Њ–ї—М –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ–Њ–≤ –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Ш–Ь–Я [33].
–Ю–њ–Є—А–∞—П—Б—М –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е J. Avorn et al. [34] –Є T. Kontiokari et al. [35] –≤ 2004 –≥., –§—А–∞–љ—Ж—Г–Ј—Б–Ї–Њ–µ –∞–≥–µ–љ—В—Б—В–≤–Њ –њ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–Њ–і—Г–Ї—В–Њ–≤ –њ–Є—В–∞–љ–Є—П (Afssa-Agence fran√Іaise de s√©curit√© sanitaire des aliments) –Њ–њ—А–µ–і–µ–ї–Є–ї–Њ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї—Г—О –і–Њ–Ј–Є—А–Њ–≤–Ї—Г –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ–∞ вАФ 36 –Љ–≥.
–Ф–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ш–Ь–Я —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–µ–µ –≤—Б–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –≤–µ—Й–µ—Б—В–≤, –Њ–±–ї–∞–і–∞—О—Й–Є–µ –Є–Љ–Љ—Г–љ–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, —Г–ї—Г—З—И–∞—О—Й–Є–µ —В—А–Њ—Д–Є–Ї—Г —Б–ї–Є–Ј–Є—Б—В–Њ–є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П –Є –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –±–∞–Ї—В–µ—А–Є—Ж–Є–і–љ–Њ–µ –Є –±–∞–Ї—В–µ—А–Є–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ–∞—П –і–Њ–±–∞–≤–Ї–∞ –£—А–Њ–љ–µ–Ї—Б—В (–Ю–Ю–Ю ¬Ђ–Э–Я–Ю –Я–µ—В—А–Њ–≤–∞–Ї—Б –§–∞—А–Љ¬ї, –†–Њ—Б—Б–Є—П) —Б–Њ–і–µ—А–ґ–Є—В D-–Љ–∞–љ–љ–Њ–Ј—Г 2000 –Љ–≥, –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ—Л 36 –Љ–≥ (–Є–ї–Є 500 –Љ–≥ –±—А–µ–љ–і–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—В–∞ —Н–Ї—Б—В—А–∞–Ї—В–∞ –Ї–ї—О–Ї–≤—Л Cran-Max), –≤–Є—В–∞–Љ–Є–љ D3 1 –Љ–Ї–≥. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М 1 —Б–∞—И–µ 1 —А./—Б—Г—В, –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ —А–∞—Б—В–≤–Њ—А–Є–≤ –≤ —Б—В–∞–Ї–∞–љ–µ –≤–Њ–і—Л (100 –Љ–ї) –Ї–Њ–Љ–љ–∞—В–љ–Њ–є —В–µ–Љ–њ–µ—А–∞—В—Г—А—Л. –Ф–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞, —Б–Њ–≥–ї–∞—Б–љ–Њ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –Є –Њ–њ—Л—В—Г –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –і—А—Г–≥–Є—Е —Б—В—А–∞–љ–∞—Е, —Б–Њ—Б—В–∞–≤–ї—П–µ—В 7 –і–љ–µ–є. –Ґ–∞–Ї–Њ–є –Ї–Њ—А–Њ—В–Ї–Є–є –Ї—Г—А—Б –њ—А–Є–µ–Љ–∞ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ –≤—Л—И–µ—Г–Ї–∞–Ј–∞–љ–љ—Л–Љ —Б–Њ—Б—В–∞–≤–Њ–Љ –≤ –њ—А–∞–≤–Є–ї—М–љ—Л—Е –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –і–Њ–Ј–Є—А–Њ–≤–Ї–∞—Е –Є –µ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ—Л–Љ –і–µ–є—Б—В–≤–Є–µ–Љ. –Ш–Љ–µ—П –≤ —Б–Њ—Б—В–∞–≤–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Г—О —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Г—О –і–Њ–Ј–Є—А–Њ–≤–Ї—Г –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ–Њ–≤ (36 –Љ–≥), –£—А–Њ–љ–µ–Ї—Б—В –Њ—В–ї–Є—З–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О —Н–Ї—Б—В—А–∞–Ї—В–∞ –Ї–ї—О–Ї–≤—Л –Ј–∞ —Б—З–µ—В –Ј–∞–њ–∞—В–µ–љ—В–Њ–≤–∞–љ–љ–Њ–є —Д–Њ—А–Љ—Г–ї—Л –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—П: –ї–Є–≥–љ–Є–љ-—Ж–µ–ї–ї—О–ї–Њ–Ј–љ—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Ј–∞—Й–Є—Й–∞—О—В –∞–Ї—В–Є–≤–љ—Л–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л –Ї–ї—О–Ї–≤—Л –Њ—В –і–µ–≥—А–∞–і–∞—Ж–Є–Є –≤ —В–Њ–љ–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –і–µ–є—Б—В–≤—Г—П –Ї–∞–Ї –µ—Б—В–µ—Б—В–≤–µ–љ–љ–∞—П —Б–Є—Б—В–µ–Љ–∞ –і–Њ—Б—В–∞–≤–Ї–Є.
–Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є –∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, D-–Љ–∞–љ–љ–Њ–Ј—Л, –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ–∞ –Є –≤–Є—В–∞–Љ–Є–љ–∞ D3, –њ–Њ–і—В–≤–µ—А–і–Є–ї–Њ —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –Њ—В–ї–Є—З–љ—Л–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –≤ —А–∞–Љ–Ї–∞—Е –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –њ–Њ–Ї–∞–Ј–∞–ї–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —А–µ—Ж–Є–і–Є–≤–Њ–≤ —Ж–Є—Б—В–Є—В–∞ –≤ 4 —А–∞–Ј–∞ [36]. –Т –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 45 –і–љ–µ–є –њ—А–Є–љ—П–ї–Њ —Г—З–∞—Б—В–Є–µ 120 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –Є–Љ–µ–≤—И–Є—Е –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –±–Њ–ї–µ–µ 6 —Н–њ–Є–Ј–Њ–і–Њ–≤ –Ш–Ь–Я –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 12 –Љ–µ—Б., —А–∞–Ј–≤–Є–≤–∞–≤—И–Є—Е—Б—П –њ–Њ—Б–ї–µ –њ–Њ–ї–Њ–≤–Њ–≥–Њ –Ї–Њ–љ—В–∞–Ї—В–∞. –Я–∞—Ж–Є–µ–љ—В–Њ–Ї —Б–ї—Г—З–∞–є–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–Є–ї–Є –≤ —В—А–Є –≥—А—Г–њ–њ—Л. –Т —В–µ—З–µ–љ–Є–µ 6 —З –њ–Њ—Б–ї–µ –њ–Њ–ї–Њ–≤–Њ–≥–Њ –∞–Ї—В–∞ –Ї–∞–ґ–і–Њ–є –њ–∞—Ж–Є–µ–љ—В–Ї–µ 1-–є –≥—А—Г–њ–њ—Л —В—А–µ–±–Њ–≤–∞–ї–Њ—Б—М –њ—А–Є–љ—П—В—М 1 –Ї–∞–њ—Б—Г–ї—Г —Б –њ–Њ—А–Њ—И–Ї–Њ–Љ –Ї–ї—О–Ї–≤—Л, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Љ–µ—В–Њ–і–Є–Ї–Њ–є Bioshield (Cran-Max); –њ–∞—Ж–Є–µ–љ—В–Ї–∞–Љ 2-–є –≥—А—Г–њ–њ—Л вАФ 1 –Ї–∞–њ—Б—Г–ї—Г —Б—Г—Е–Њ–≥–Њ —Н–Ї—Б—В—А–∞–Ї—В–∞ –Ї–ї—О–Ї–≤—Л —Б —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –њ—А–Њ–∞–љ—В–Њ—Ж–Є–∞–љ–Є–і–Є–љ–Њ–≤ –Р –≤ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ 36 –Љ–≥; 3-–є –≥—А—Г–њ–њ—Л вАФ 1 –Ї–∞–њ—Б—Г–ї—Г –њ–ї–∞—Ж–µ–±–Њ (–Љ–∞–≥–љ–Є—П —Б—В–µ–∞—А–∞—В –Є –Ї—А–∞—Б–љ—Л–є –Њ–Ї—Б–Є–і –ґ–µ–ї–µ–Ј–∞). –Т —В–µ—З–µ–љ–Є–µ –њ–µ—А–Є–Њ–і–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ 1-–є –≥—А—Г–њ–њ–µ —А–µ—Ж–Є–і–Є–≤ –Ш–Ь–Я –љ–∞–±–ї—О–і–∞–ї–Є —Г 10,8% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –≤–Њ 2-–є –Є 3-–є вАФ —Г 18,9% –Є 43,2% –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [36].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я—А–Њ–±–ї–µ–Љ–∞ –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –Э–Ь–Я –Њ—Б—В–∞–µ—В—Б—П –∞–Ї—В—Г–∞–ї—М–љ–Њ–є –≤ —Б–≤—П–Ј–Є —Б –±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Є —А–Њ—Б—В–Њ–Љ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є, –∞ —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –њ–Њ–ї–Є—В–Є–Ї–Є –≤ –Љ–Є—А–µ. –Ф–ї—П –њ–Њ–≤—Л—И–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Њ—Б—В—А–Њ–≥–Њ –Є —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–≥–Њ —Ж–Є—Б—В–Є—В–∞ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–є –∞–Ї—В–Є–≤–љ—Л—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤, –Є–Љ–µ—О—Й–Є—Е –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї—Г—О –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ—Б—В—М, —В–∞–Ї–Є—Е –Ї–∞–Ї –£—А–Њ–љ–µ–Ї—Б—В.
–С–ї–∞–≥–Њ–і–∞—А–љ–Њ—Б—В—М
–†–µ–і–∞–Ї—Ж–Є—П –±–ї–∞–≥–Њ–і–∞—А–Є—В –Ю–Ю–Ю ¬Ђ–Э–Я–Ю –Я–µ—В—А–Њ–≤–∞–Ї—Б –§–∞—А–Љ¬ї –Ј–∞ –њ–Њ–Љ–Њ—Й—М –≤ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Љ–µ–ґ–і—Г –∞–≤—В–Њ—А–∞–Љ–Є –љ–∞—Б—В–Њ—П—Й–µ–є –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є.












