–Т–≤–µ–і–µ–љ–Є–µ
–Ф–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–∞—П –≥–Є–њ–µ—А–њ–ї–∞–Ј–Є—П –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–Ф–У–Я–Ц) —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –Є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ –Ј–љ–∞—З–Є–Љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —Г –Љ—Г–ґ—З–Є–љ —Б—В–∞—А—И–µ 45 –ї–µ—В [1вАУ3].
–Я–Њ—Б–ї–µ–і–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –і–µ—Б—П—В–Є–ї–µ—В–Є–є –Њ–Ј–љ–∞–Љ–µ–љ–Њ–≤–∞–ї–Є—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Њ–≥—А–µ—Б—Б–Њ–Љ –≤ –ї–µ—З–µ–љ–Є–Є –Ф–У–Я–Ц. –≠—В–Њ–Љ—Г —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ –њ–Њ—П–≤–ї–µ–љ–Є–µ –≤—Л—Б–Њ–Ї–Њ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤. –Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ 15 –ї–µ—В —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Њ–њ–µ—А–Є—А—Г–µ–Љ—Л—Е –њ–Њ –њ–Њ–≤–Њ–і—Г –Ф–У–Я–Ц, —Г–Љ–µ–љ—М—И–Є–ї–Њ—Б—М –≤ –Х–≤—А–Њ–њ–µ –љ–∞ 60%, –∞ –≤ –°–®–Р –љ–∞ 30% [4вАУ8]. –Ю–і–љ–∞–Ї–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —И–Є—А–Њ–Ї–Є–є –∞—А—Б–µ–љ–∞–ї —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤, –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –і–∞–ї–µ–Ї–Њ –љ–µ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ—Е–Њ–і–Є—В —Г—Б–њ–µ—И–љ–Њ, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –Њ–Ї–Њ–ї–Њ 30% –Љ—Г–ґ—З–Є–љ, –і–Њ–ґ–Є–≤–∞—О—Й–Є—Е –і–Њ 80 –ї–µ—В, –њ–µ—А–µ–љ–Њ—Б—П—В –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ –њ–Њ –њ–Њ–≤–Њ–і—Г –Ф–У–Я–Ц [1, 2].
–Ю–і–љ–Њ–є –Є–Ј –њ—А–Є—З–Є–љ –±–µ–Ј—Г—Б–њ–µ—И–љ–Њ—Б—В–Є –Ї–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –љ–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є, —Б–∞–Љ–Њ–є —З–∞—Б—В–Њ–є –Є–Ј –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Б—В–∞—В–Є—В (–•–Я). –Ф–∞–љ–љ–Њ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї —З–Є—Б–ї—Г —З–∞—Б—В–Њ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–Є—Е –Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ–ї–Њ—Е–Њ –њ–Њ–і–і–∞–µ—В—Б—П –ї–µ—З–µ–љ–Є—О. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Б—В–Є—В—Г—В–∞ –Ј–і–Њ—А–Њ–≤—М—П –°–®–Р –±–Њ–ї–µ–µ 25% –Љ—Г–ґ—З–Є–љ —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є –Њ—А–≥–∞–љ–Њ–≤ –Љ–Њ—З–µ–≤—Л–і–µ–ї–Є—В–µ–ї—М–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є–Љ–µ—О—В —Б–Є–Љ–њ—В–Њ–Љ—Л –њ—А–Њ—Б—В–∞—В–Є—В–∞, —З—В–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 9% –≤—Б–µ–є –Љ—Г–ґ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є [9вАУ11]. –Ф–∞–љ–љ—Л–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —Г –Љ—Г–ґ—З–Є–љ —Б –Ф–У–Я–Ц, –≤ 96,7% —Б–ї—Г—З–∞–µ–≤ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –љ–∞–ї–Є—З–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≤ —В–Ї–∞–љ—П—Е –њ—А–Њ—Б—В–∞—В—Л [12]. –°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Г 57,2% –Љ—Г–ґ—З–Є–љ —Б –•–Я –Є–Љ–µ–ї–∞—Б—М –Ф–У–Я–Ц, –∞ —Г 38,7% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–У–Я–Ц –±—Л–ї –≤—Л—П–≤–ї–µ–љ –•–Я [13, 14].
–Ч–љ–∞—З–Є–Љ–Њ—Б—В—М –Ф–У–Я–Ц –Є –•–Я –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –Є—Е —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О, –љ–Њ –Є —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –љ–Є–Љ–Є –Ј–∞–Љ–µ—В–љ—Л–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–ї–µ–і—Г–µ—В –њ–Њ–Љ–љ–Є—В—М –Њ –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–µ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, —В–∞–Ї–Є—Е –Ї–∞–Ї –Њ—Б—В—А–∞—П –Ј–∞–і–µ—А–ґ–Ї–∞ –Љ–Њ—З–Є, –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≤–µ—А—Е–љ–Є—Е –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є, —Н—А–µ–Ї—В–Є–ї—М–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П [15, 16].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ф–У–Я–Ц —П–≤–ї—П–µ—В—Б—П —В—А–∞–љ—Б—Г—А–µ—В—А–∞–ї—М–љ–∞—П —А–µ–Ј–µ–Ї—Ж–Є—П (–Ґ–£–†) –њ—А–Њ—Б—В–∞—В—Л [1вАУ3]. –Ь–µ—В–Њ–і —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ –≤ 80% —Б–ї—Г—З–∞–µ–≤ –Є –Є–Љ–µ–µ—В –љ–∞–Є–±–Њ–ї—М—И—Г—О –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Г—О –±–∞–Ј—Г. –Ю–і–љ–∞–Ї–Њ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ —Б–≤–Њ–Є –і–Њ—Б—В–Њ–Є–љ—Б—В–≤–∞, –і–∞–љ–љ–∞—П –Њ–њ–µ—А–∞—Ж–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –і–Њ–≤–Њ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л–Љ–Є –і–ї—П –Ј–і–Њ—А–Њ–≤—М—П –њ–∞—Ж–Є–µ–љ—В–∞ —П–≤–ї—П—О—В—Б—П –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–µ (2,9%), —В–∞–Љ–њ–Њ–љ–∞–і–∞ –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П (4,9%), –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ–Њ-–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (4,1%), —Б—В—А–Є–Ї—В—Г—А–∞ —Г—А–µ—В—А—Л (5вАУ7%), —Б–Ї–ї–µ—А–Њ–Ј —И–µ–є–Ї–Є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П (2вАУ4%) [17вАУ21].
–£—З–Є—В—Л–≤–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є–Ј–≤–µ—Б—В–љ—Л—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ –ї–µ—З–µ–љ–Є—П –њ—А–Є –•–Я –Є –Ф–У–Я–Ц, –≤—Б–µ –±–Њ–ї—М—И–µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ –Љ–µ–і–Є—Ж–Є–љ–µ, –Є –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –≤ —Г—А–Њ–ї–Њ–≥–Є–Є, –љ–∞—Е–Њ–і—П—В –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–µ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л —Б –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ –і–µ–є—Б—В–≤–Є—П [22вАУ25].
–Т –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Б –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л–Љ–Є —Б—А–µ–і—Б—В–≤–∞–Љ–Є –њ—А–Є–Љ–µ–љ—П—О—В —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—Ж–µ–і—Г—А—Л: –Љ–∞–≥–љ–Є—В–Њ—В–µ—А–∞–њ–Є—О, —Н–ї–µ–Ї—В—А–Њ—Д–Њ—А–µ–Ј, –ї–∞–Ј–µ—А–Њ—В–µ—А–∞–њ–Є—О –Є –і—А. –Ю–і–Є–љ –Є–Ј –≤–∞—А–Є–∞–љ—В–Њ–≤ —В–∞–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ ¬Ђ–£—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–∞—П —Б–Є—Б—В–µ–Љ–∞ –°–Ь–Р–†–Ґ-–Я–†–Ю–°–Ґ¬ї. –Р–њ–њ–∞—А–∞—В ¬Ђ–°–Ь–Р–†–Ґ-–Я–†–Ю–°–Ґ¬ї –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Є–ї–Є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П—Е –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –≤–Є–і—Л —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–Є–Є: –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ—Г—О –ґ–µ–ї–µ–Ј—Г –Є –Њ—А–≥–∞–љ—Л –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ –Є–љ—Д—А–∞–Ї—А–∞—Б–љ—Л–Љ –Є–Ј–ї—Г—З–µ–љ–Є–µ–Љ –і–ї–Є–љ–Њ–є –≤–Њ–ї–љ—Л 940¬±10 –љ–Љ; –∞–њ–њ–∞—А–∞—В–љ—Л–є –Љ–∞—Б—Б–∞–ґ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л; –Љ–∞–≥–љ–Є—В–Њ—В–µ—А–∞–њ–Є—О –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –Њ—А–≥–∞–љ–Њ–≤ –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞; —В–µ—А–Љ–Њ—В–µ—А–∞–њ–Є—О –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –Њ—А–≥–∞–љ–Њ–≤ –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞ [22, 23].
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≤—Б–µ –њ—А–Њ—Ж–µ—Б—Б—Л –≤ –ґ–Є–≤–Њ–є –њ—А–Є—А–Њ–і–µ, –∞ –Ј–љ–∞—З–Є—В, –Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ —З–µ–ї–Њ–≤–µ–Ї–∞, –њ–Њ–і—З–Є–љ–µ–љ—Л –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–Љ —А–Є—В–Љ–∞–Љ [24]. –Т —А–∞–Ј–ї–Є—З–љ—Л–µ —Д–∞–Ј—Л —А–Є—В–Љ–∞ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ, –љ–∞—Е–Њ–і–Є—В—Б—П –љ–∞ —А–∞–Ј–љ—Л—Е —Г—А–Њ–≤–љ—П—Е. –Я–µ—А—Б–Њ–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г—З–µ—В–Њ–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Є—Е –±–Є–Њ—А–Є—В–Љ–Њ–≤ вАФ —Е—А–Њ–љ–Њ—В–µ—А–∞–њ–Є—П вАФ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Љ–µ—В–Њ–Љ –Є–Ј—Г—З–µ–љ–Є—П –≤–Њ –Љ–љ–Њ–≥–Є—Е –Њ—В—А–∞—Б–ї—П—Е –Љ–µ–і–Є—Ж–Є–љ—Л, –≤ —В. —З. –≤ —Г—А–Њ–ї–Њ–≥–Є–Є, –Є —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ –ї–µ—З–µ–љ–Є–Є —А—П–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є [25]. –°—Г—Й–љ–Њ—Б—В—М —Е—А–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –≤—А–µ–Љ–µ–љ–Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П (–∞–Ї—А–Њ—Д–∞–Ј—Л) —Е—А–Њ–љ–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ –Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –ї–µ—З–µ–±–љ—Л—Е –њ—А–Њ—Ж–µ–і—Г—А –Є–Љ–µ–љ–љ–Њ –≤ —Н—В–Њ –≤—А–µ–Љ—П. –Я—А–Є–Љ–µ–љ—П—П —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –≤ –њ–µ—А–Є–Њ–і—Л –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –≤—Б–µ—Е –Ј–∞—Й–Є—В–љ—Л—Е –Є —А–µ–њ–∞—А–∞—В–Є–≤–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –Љ—Л –Є–Љ–µ–µ–Љ –≤—Б–µ –Њ—Б–љ–Њ–≤–∞–љ–Є—П –Њ–ґ–Є–і–∞—В—М –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –ї–µ—З–µ–±–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –њ—А–Њ–≤–Њ–і–Є–Љ—Л—Е –њ—А–Њ—Ж–µ–і—Г—А [23вАУ25].
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ—Ж–µ–љ–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Ф–У–Я–Ц –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –•–Я —Б —Г—З–µ—В–Њ–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е —Е—А–Њ–љ–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Ю–±—Б–ї–µ–і–Њ–≤–∞–љ–Њ 60 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ф–У–Я–Ц, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –і–ї—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П (–Ґ–£–†) –њ—А–Њ—Б—В–∞—В—Л, —Г –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї –≤—Л—П–≤–ї–µ–љ –•–Я –Ї–∞—В–µ–≥–Њ—А–Є–Є II (–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–є) —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –Є–љ—Б—В–Є—В—Г—В–∞ –Ј–і–Њ—А–Њ–≤—М—П –°–®–Р (1995).–°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–Њ—Б—В–∞–≤–Є–ї 60,5¬±5,5 –≥–Њ–і–∞. –Я—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –•–Я –Є –Ф–У–Я–Ц –≤–∞—А—М–Є—А–Њ–≤–∞–ї–∞ –Њ—В 5 –і–Њ 10 –ї–µ—В, —Б–Њ—Б—В–∞–≤–Є–≤ –≤ —Б—А–µ–і–љ–µ–Љ 7,5¬±2,3 –≥–Њ–і–∞.
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П: —Б—Г–Љ–Љ–∞—А–љ—Л–є –±–∞–ї–ї I-PSS –±–Њ–ї–µ–µ 20, –Њ–±—К–µ–Љ –Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Љ–Њ—З–Є (V–Њ–Љ) –љ–µ –±–Њ–ї–µ–µ 100 –Љ–ї, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є—П (Qmax) вЙ§14 –Љ–ї/—Б, –Њ–±—К–µ–Љ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (V–њ–ґ) –љ–µ –±–Њ–ї–µ–µ 80 —Б–Љ3, —Г—А–Њ–≤–µ–љ—М –њ—А–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ—В–Є–≥–µ–љ–∞ –љ–µ –±–Њ–ї–µ–µ 2 –љ–≥/–Љ–ї, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –Є–љ—Д–µ–Ї—Ж–Є–є, –њ–µ—А–µ–і–∞–≤–∞–µ–Љ—Л—Е –њ–Њ–ї–Њ–≤—Л–Љ –њ—Г—В–µ–Љ, –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (–Љ–Є–Ї—А–Њ–±–љ–Њ–µ —З–Є—Б–ї–Њ >104 –Ъ–Ю–Х/–Љ–ї).
–Ъ—А–Є—В–µ—А–Є–Є –љ–µ–≤–Ї–ї—О—З–µ–љ–Є—П: –Ї–∞–Љ–љ–Є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П –Є –Љ–Њ—З–µ—В–Њ—З–љ–Є–Ї–Њ–≤, –≥–µ–Љ–∞—В—Г—А–Є—П, –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ –љ–∞ —А–∞–Ї –њ—А–Њ—Б—В–∞—В—Л –Є–ї–Є –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П, –∞–ї–ї–µ—А–≥–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –љ–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л, –Њ–њ–µ—А–∞—В–Є–≤–љ—Л–µ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ –љ–∞ –Њ—А–≥–∞–љ–∞—Е –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞, –Є–љ—Д–µ–Ї—Ж–Є–Є –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є, –љ–µ–є—А–Њ–≥–µ–љ–љ–∞—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є—П –Љ–Њ—З–µ–≤–Њ–≥–Њ –њ—Г–Ј—Л—А—П, –≤—А–Њ–ґ–і–µ–љ–љ—Л–µ –∞–љ–Њ–Љ–∞–ї–Є–Є —А–∞–Ј–≤–Є—В–Є—П –Љ–Њ—З–µ–њ–Њ–ї–Њ–≤–Њ–є —Б–Є—Б—В–µ–Љ—Л, –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є —В—П–ґ–µ–ї—Л–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –≥–Є–њ–Њ–≥–Њ–љ–∞–і–Є–Ј–Љ.
–Ь–µ—В–Њ–і–Њ–Љ —Б–ї—Г—З–∞–є–љ–Њ–є –≤—Л–±–Њ—А–Ї–Є –њ–∞—Ж–Є–µ–љ—В—Л –±—Л–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –≤ 2 –≥—А—Г–њ–њ—Л –њ–Њ 30 —З–µ–ї–Њ–≤–µ–Ї.
–Т –≥—А—Г–њ–њ—Г —Б—А–∞–≤–љ–µ–љ–Є—П (–У–°) –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л –±–Њ–ї—М–љ—Л–µ, –Ї–Њ—В–Њ—А—Л–Љ –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —Б—В–∞–љ–і–∞—А—В–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Є–Ј –≥—А—Г–њ–њ—Л ќ±-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤ (—В–∞–Љ—Б—Г–ї–Њ–Ј–Є–љ 0,4 –Љ–≥ 1 —А/—Б—Г—В) –Є —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤ (–ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ 500 –Љ–≥ 1 —А/—Б—Г—В –≤ —В–µ—З–µ–љ–Є–µ 28 –і–љ–µ–є). –Я—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є –Ї–Њ—А—А–µ–Ї—Ж–Є—О —В–µ—А–∞–њ–Є–Є –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤ [1вАУ3].
–Т –Њ—Б–љ–Њ–≤–љ—Г—О –≥—А—Г–њ–њ—Г (–Ю–У) –≤–Њ—И–ї–Є –њ–∞—Ж–Є–µ–љ—В—Л, –њ–Њ–ї—Г—З–∞–≤—И–Є–µ —Б—В–∞–љ–і–∞—А—В–љ—Г—О —В–µ—А–∞–њ–Є—О –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Б–µ–∞–љ—Б–∞–Љ–Є —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–Є–Є –∞–њ–њ–∞—А–∞—В–Њ–Љ ¬Ђ–°–Ь–Р–†–Ґ-–Я–†–Ю–°–Ґ¬ї, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –≤ –∞–Ї—А–Њ—Д–∞–Ј—Г —Е—А–Њ–љ–Њ—А–Є—В–Љ–∞. –†–µ–≥–Є—Б—В—А–∞—Ж–Є—О —Е—А–Њ–љ–Њ—А–Є—В–Љ–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ–Љ–њ—М—О—В–µ—А–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ ¬Ђ–Ф–Є–љ–∞–Љ–Є–Ї–∞¬ї –µ–ґ–µ–і–љ–µ–≤–љ–Њ –≤ 08:00, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –Њ–њ—А–µ–і–µ–ї—П–ї–Њ—Б—М –≤—А–µ–Љ—П, —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–µ–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–Љ—Г –њ–Є–Ї—Г —Е—А–Њ–љ–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–∞–Ї—А–Њ—Д–∞–Ј–∞ —Е—А–Њ–љ–Њ—А–Є—В–Љ–∞).
–Ю—Ж–µ–љ–Ї—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ—А–Є –Њ–±—А–∞—Й–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–≤–Є–Ј–Є—В 1), —З–µ—А–µ–Ј 2 –љ–µ–і. (–≤–Є–Ј–Є—В 2) –Є —З–µ—А–µ–Ј 4 –љ–µ–і. (–≤–Є–Ј–Є—В 3). –Ю—Ж–µ–љ–Є–≤–∞–ї–Є —З–∞—Б—В–Њ—В—Г –Љ–Є–Ї—Ж–Є–є, –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –љ–Њ—З–љ—Л—Е –Љ–Њ—З–µ–Є—Б–њ—Г—Б–Ї–∞–љ–Є–є (–љ–Њ–Ї—В—Г—А–Є—П), —Б—А–µ–і–љ–Є–є –±–∞–ї–ї –њ–Њ —И–Ї–∞–ї–∞–Љ I-PSS, QoL, NIH-CPSI, Qmax, V–њ–ґ –Є V–Њ–Љ, –≤—Л–њ–Њ–ї–љ—П–ї–Є –±–∞–Ї—В–µ—А–Є–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –Є –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б–µ–Ї—А–µ—В–∞
–њ—А–Њ—Б—В–∞—В—Л.
–Я–Њ—Б–ї–µ –Њ–Ї–Њ–љ—З–∞–љ–Є—П –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Ґ–£–† –њ—А–Њ—Б—В–∞—В—Л, –њ–Њ—Б–ї–µ —З–µ–≥–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–Њ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤ —А–µ–Ј–µ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–Ї–∞–љ–Є –њ—А–Њ—Б—В–∞—В—Л.
–Я–µ—А–Є–Њ–і –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б —Ж–µ–ї—М—О –∞–љ–∞–ї–Є–Ј–∞ –Њ—В–і–∞–ї–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї 6 –Љ–µ—Б., –≤ —В–µ—З–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–Њ—Б—В—А–∞—П –Ј–∞–і–µ—А–ґ–Ї–∞ –Љ–Њ—З–Є, –ї–µ–є–Ї–Њ—Ж–Є—В—Г—А–Є—П, –≥–µ–Љ–∞—В—Г—А–Є—П, –±–∞–Ї—В–µ—А–Є—Г—А–Є—П) —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї—Г—О –Њ–±—А–∞–±–Њ—В–Ї—Г —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–≥—А–∞–Љ–Љ—Л MSExel 11.0 –Є–Ј —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –њ–∞–Ї–µ—В–∞ MS Office 2013, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ–≥—А–∞–Љ–Љ–љ–Њ–≥–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П IBM SPSS Statistics 21.0. –Я—А–Є –њ—А–Њ–≤–µ—А–Ї–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –≥–Є–њ–Њ—В–µ–Ј –њ—А–Є–Љ–µ–љ—П–ї–Є –Ї—А–Є—В–µ—А–Є–є t-test C—В—М—О–і–µ–љ—В–∞ –Є –Ї—А–Є—В–µ—А–Є–є ѕЗ2. –Я—А–Є –Њ—Ж–µ–љ–Ї–µ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –≤—Л—П–≤–ї–µ–љ–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г —Б—А–µ–і–љ–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –≤—Л–±–Њ—А–Њ–Ї –Њ–њ—А–µ–і–µ–ї—П–ї–Є –Ј–љ–∞—З–µ–љ–Є–µ —А, –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М —Б–њ—А–∞–≤–µ–і–ї–Є–≤–Њ—Б—В–Є –љ—Г–ї–µ–≤–Њ–є –≥–Є–њ–Њ—В–µ–Ј—Л –±—Л–ї–∞ –њ—А–Є–љ—П—В–∞ —А–∞–≤–љ–Њ–є 5% (—А<0,05).
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
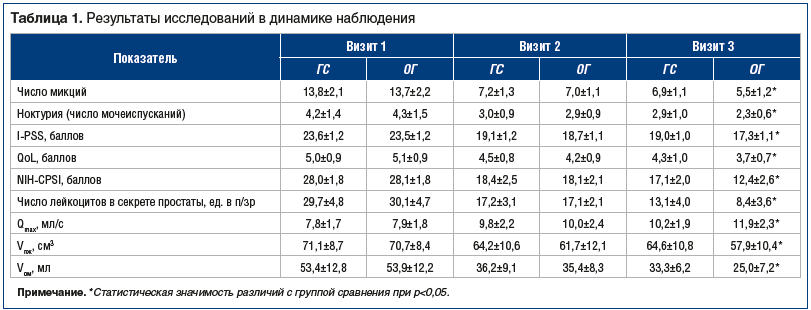
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –Ј–∞ 4 –љ–µ–і. —В–µ—А–∞–њ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.
–Я—А–Є –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б–µ–Ї—А–µ—В–∞ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –љ–∞ –≤–Є–Ј–Є—В–µ 1 –њ–Њ–ї—Г—З–µ–љ—Л —Б–ї–µ–і—Г—О—Й–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л: –Є–Ј 30 (100%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –У–° –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–ї–∞—Б—М E. coli вАФ —Г 16 (53,3%) —З–µ–ї–Њ–≤–µ–Ї, E. faecalis –Њ–±–љ–∞—А—Г–ґ–µ–љ —Г 10 (33,3%), S. epidermidis вАФ —Г 3 (10%), S. aureus вАФ —Г 1 (3,3%) —З–µ–ї–Њ–≤–µ–Ї–∞. –Т –Ю–У —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л: E. coli –≤—Л—П–≤–ї–µ–љ–∞ —Г 17 (56,7%) —З–µ–ї–Њ–≤–µ–Ї, E. faecalis вАФ —Г 8 (26,7%), S. epidermidis вАФ —Г 5 (16,7%).
–Э–∞ –≤–Є–Ј–Є—В–µ 2 –≤ –У–° –±–∞–Ї—В–µ—А–Є–Є –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –≤ 11 (36,7%) –њ–Њ—Б–µ–≤–∞—Е: E. coli вАФ –≤ 6 (20%), E. faecalis вАФ –≤ 3 (10%), S. epidermidis вАФ –≤ 1 (3,3%). –Т –Ю–У –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л –±—Л–ї–Є –≤—Л–і–µ–ї–µ–љ—Л –≤ –њ–Њ—Б–µ–≤–∞—Е 10 (33,3%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤: E. coli вАФ —Г 7 (23,3%) –Є–Ј –љ–Є—Е, E. faecalis вАФ —Г 2 (6,7%), S. epidermidis вАФ —Г 1 (3,3%). –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ (p>0,05).
–Э–∞ –≤–Є–Ј–Є—В–µ 3 –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–µ–Ї—А–µ—В–∞ –њ—А–Њ—Б—В–∞—В—Л –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ —А–Њ—Б—В–∞ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤.
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –њ–Њ—Б–ї–µ –Ґ–£–† –њ—А–Њ—Б—В–∞—В—Л –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–µ–Ј–µ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д—А–∞–≥–Љ–µ–љ—В–Њ–≤ –њ—А–Њ—Б—В–∞—В—Л –≤ –У–° —Г 5 (16,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї –≤—Л—П–≤–ї–µ–љ —А–Њ—Б—В –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤: E. coli вАФ –≤ 4 (13,3%) —Б–ї—Г—З–∞—П—Е, E. faecalis вАФ –≤ 1 (3,3%) —Б–ї—Г—З–∞–µ. –Т –Ю–У –≤ 1 (3,3%) –Њ–±—А–∞–Ј—Ж–µ –±—Л–ї –Њ–±–љ–∞—А—Г–ґ–µ–љ —А–Њ—Б—В E. coli. –Т—Л—П–≤–ї–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є (p<0,05).
–Т —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –≤ –У–° –Њ—Б—В—А–∞—П –Ј–∞–і–µ—А–ґ–Ї–∞ –Љ–Њ—З–Є –≤—Л—П–≤–ї–µ–љ–∞ —Г 2 (6,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –ї–µ–є–Ї–Њ—Ж–Є—В—Г—А–Є—П вАФ —Г 18 (60%), –≥–µ–Љ–∞—В—Г—А–Є—П вАФ —Г 5 (16,7%), –±–∞–Ї—В–µ—А–Є—Г—А–Є—П вАФ —Г 14 (46,7%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Т –Ю–У –Њ—Б—В—А–∞—П –Ј–∞–і–µ—А–ґ–Ї–∞ –Љ–Њ—З–Є –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –≤ 1 (3,3%) —Б–ї—Г—З–∞–µ, –ї–µ–є–Ї–Њ—Ж–Є—В—Г—А–Є—П вАФ –≤ 10 (33,3%), –≥–µ–Љ–∞—В—Г—А–Є—П вАФ –≤ 2 (6,7%), –±–∞–Ї—В–µ—А–Є—Г—А–Є—П вАФ –≤ 7 (23,3%) —Б–ї—Г—З–∞—П—Е. –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ (p<0,05) —А–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –Ї–∞—Б–∞–ї–Є—Б—М —З–∞—Б—В–Њ—В—Л –≤—Л—П–≤–ї–µ–љ–Є—П –ї–µ–є–Ї–Њ—Ж–Є—В—Г—А–Є–Є, –≥–µ–Љ–∞—В—Г—А–Є–Є –Є –±–∞–Ї—В–µ—А–Є—Г—А–Є–Є.
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я–Њ –і–∞–љ–љ—Л–Љ —А–∞–Ј–ї–Є—З–љ—Л—Е –Є—Б—В–Њ—З–љ–Є–Ї–Њ–≤, —З–∞—Б—В–Њ—В–∞ –њ—А–Њ—Б—В–∞—В–Є—В–∞ –њ—А–Є –Ф–У–Я–Ц –≤–∞—А—М–Є—А—Г–µ—В –Њ—В 50% –і–Њ 100% [9вАУ12]. –°–Њ—З–µ—В–∞–љ–Є–µ –Ф–У–Я–Ц —Б –•–Я –≤—Л–Ј—Л–≤–∞–µ—В –Љ–љ–Њ–≥–Њ –≤–Њ–њ—А–Њ—Б–Њ–≤ –њ—А–Є –≤—Л–±–Њ—А–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є —В–∞–Ї—В–Є–Ї–Є –ї–µ—З–µ–љ–Є—П. –Я—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ –Є—А—А–Є—В–∞—В–Є–≤–љ–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є, –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—В–Њ–є–Ї–Њ–≥–Њ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Њ—В –њ—А–Є–µ–Љ–∞ ќ±-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, —З–∞—Б—В—Л–µ –Њ–±–Њ—Б—В—А–µ–љ–Є—П –•–Я –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –њ–Њ–Є—Б–Ї–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –≤ –ї–µ—З–µ–љ–Є–Є —В–∞–Ї–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–Ъ –њ—А–Є—З–Є–љ–∞–Љ –Ї–Њ–Љ–Њ—А–±–Є–і–љ–Њ—Б—В–Є –Ф–У–Я–Ц –Є –•–Я –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є–Є –Є –≤–µ–љ–Њ–Ј–љ—Л–є —Б—В–∞–Ј, –Ј–∞—Б—В–Њ–є–љ—Л–µ —П–≤–ї–µ–љ–Є—П –≤ –њ—А–Њ—Б—В–∞—В–µ –Є —Б–і–∞–≤–ї–µ–љ–Є–µ –њ—А–Њ—В–Њ–Ї–Њ–≤ –∞—Ж–Є–љ—Г—Б–Њ–≤. –Э–µ–Ї–Њ—В–Њ—А—Л–µ –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є, –±–µ—Б–Ї–Њ–љ—В—А–Њ–ї—М–љ–∞—П –Є/–Є–ї–Є –љ–µ—А–µ–≥—Г–ї—П—А–љ–∞—П –њ–Њ–ї–Њ–≤–∞—П –ґ–Є–Ј–љ—М, —Б–Є–і—П—З–Є–є, –њ–∞—Б—Б–Є–≤–љ—Л–є –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є –Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –Є–љ—В–Њ–Ї—Б–Є–Ї–∞—Ж–Є—П —В–∞–Ї–ґ–µ –Љ–Њ–≥—Г—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї –Ј–∞—Б—В–Њ–є–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–∞–Љ –≤ –Љ–∞–ї–Њ–Љ —В–∞–Ј—Г –Є —Б—В–∞—В—М –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–≤–Є—В–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —В–Ї–∞–љ–Є –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Є –њ—А–Є—З–Є–љ–Њ–є –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є [26].
–° —Г—З–µ—В–Њ–Љ –≤—Л—И–µ—Б–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–Љ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Љ–µ—В–Њ–і–Њ–≤ —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —В–Ї–∞–љ—М –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, —Г–ї—Г—З—И–∞—О—Й–Є—Е –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О –Є –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е —Г–Љ–µ–љ—М—И–Є—В—М –Ј–∞—Б—В–Њ–є–љ—Л–µ —П–≤–ї–µ–љ–Є—П –≤ –њ—А–Њ—Б—В–∞—В–µ.
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б —Н—В–Њ–є —Ж–µ–ї—М—О –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –∞–њ–њ–∞—А–∞—В ¬Ђ–°–Р–Ь–†–Ґ-–Я–†–Ю–°–Ґ¬ї, –Ї–Њ—В–Њ—А—Л–є –Њ–±–ї–∞–і–∞–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є–Љ–Є –≤–Є–і–∞–Љ–Є —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П: –Є–љ—Д—А–∞–Ї—А–∞—Б–љ—Л–Љ –Є–Ј–ї—Г—З–µ–љ–Є–µ–Љ –і–ї–Є–љ–Њ–є –≤–Њ–ї–љ—Л 930вАУ950 –љ–Љ —Б —З–∞—Б—В–Њ—В–Њ–є –Є–Љ–њ—Г–ї—М—Б–Њ–≤ –Њ—В 1 –У—Ж –і–Њ 99 –У—Ж, —Б—А–µ–і–љ–µ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О –Є–Ј–ї—Г—З–µ–љ–Є—П 1,05 –Т—В/—Б–Љ2, –љ–Є–Ј–Ї–Њ—З–∞—Б—В–Њ—В–љ–Њ–є –≤–Є–±—А–∞—Ж–Є–µ–є —Б —З–∞—Б—В–Њ—В–Њ–є –Њ—В 2 –У—Ж –і–Њ 170 –У—Ж –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –∞–Љ–њ–ї–Є—В—Г–і–Њ–є –љ–µ –±–Њ–ї–µ–µ 2 –Љ–Љ –Є –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ –Є–ї–Є –љ–Є–Ј–Ї–Њ—З–∞—Б—В–Њ—В–љ—Л–Љ –њ–µ—А–µ–Љ–µ–љ–љ—Л–Љ –Љ–∞–≥–љ–Є—В–љ—Л–Љ –њ–Њ–ї–µ–Љ –љ–∞–њ—А—П–ґ–µ–љ–љ–Њ—Б—В—М—О 10¬±3 –Љ–Ґ–ї —Б —З–∞—Б—В–Њ—В–Њ–є –Њ—В 1 –У—Ж –і–Њ 99 –У—Ж, –≤–µ–ї–Є—З–Є–љ–Њ–є –Љ–∞–≥–љ–Є—В–љ–Њ–є –Є–љ–і—Г–Ї—Ж–Є–Є –і–Њ 3 –Љ–Ґ–ї. –£–Ї–∞–Ј–∞–љ–љ—Л–µ –≤–Є–і—Л –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –њ–Њ–Ј–≤–Њ–ї—П—О—В —Г–ї—Г—З—И–Є—В—М –Љ–Є–Ї—А–Њ—Ж–Є—А–Ї—Г–ї—П—Ж–Є—О, —Г–Љ–µ–љ—М—И–Є—В—М –Ј–∞—Б—В–Њ–є–љ—Л–µ —П–≤–ї–µ–љ–Є—П –≤ –њ—А–Њ—Б—В–∞—В–µ –Є —Б–і–∞–≤–ї–µ–љ–Є–µ –њ—А–Њ—В–Њ–Ї–Њ–≤ –∞—Ж–Є–љ—Г—Б–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Г—Б–Є–ї–Є—В—М –ї–Њ–Ї–∞–ї—М–љ—Л–є –Є–Љ–Љ—Г–љ–Є—В–µ—В [22, 23].
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–Њ–≥–ї–∞—Б–љ–Њ —А—П–і—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є –њ–Њ–і–±–Њ—А –≤—А–µ–Љ–µ–љ–Є –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ–і—Г—А —Б —Г—З–µ—В–Њ–Љ —Е—А–Њ–љ–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–Є—В–Љ–Њ–≤ –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞ —В–∞–Ї–ґ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–≤—Л—Б–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є [23вАУ25].
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –љ–∞–Љ–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–Њ–≥–ї–∞—Б—Г—О—В—Б—П —Б –і–∞–љ–љ—Л–Љ–Є, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ–Є –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ. –Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Б—В–∞–љ–і–∞—А—В–љ—Г—О —В–µ—А–∞–њ–Є—О –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Б–µ–∞–љ—Б–∞–Љ–Є —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–Є–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–њ–њ–∞—А–∞—В–∞ ¬Ђ–°–Ь–Р–†–Ґ-–Я–†–Ю–°–Ґ¬ї –≤ –∞–Ї—А–Њ—Д–∞–Ј—Г —Е—А–Њ–љ–Њ—А–Є—В–Љ–∞, –Ї –Ї–Њ–љ—Ж—Г 4-–є –љ–µ–і–µ–ї–Є —В–µ—А–∞–њ–Є–Є –±—Л–ї–Є –≤—Л—П–≤–ї–µ–љ—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П (p<0,05) –њ–Њ –≤—Б–µ–Љ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ, –≤ —В. —З. –Љ–µ–љ—М—И–∞—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–Є–ґ–љ–Є—Е –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є, –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–є —Б—А–µ–і–љ–Є–є –±–∞–ї–ї –њ–Њ —И–Ї–∞–ї–∞–Љ I-PSS, QOL, NIH-CPSI, –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б–Ї–Њ—А–Њ—Б—В—М –њ–Њ—В–Њ–Ї–∞ –Љ–Њ—З–Є, –Љ–µ–љ—М—И–Є–є —А–∞–Ј–Љ–µ—А –њ—А–Њ—Б—В–∞—В—Л –Є –Љ–µ–љ—М—И–Є–є –Њ–±—К–µ–Љ –Њ—Б—В–∞—В–Њ—З–љ–Њ–є –Љ–Њ—З–Є.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–µ–Ї—А–µ—В–∞ –њ—А–Њ—Б—В–∞—В—Л –Ј–љ–∞—З–Є–Љ–Њ –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –≤ –і–≤—Г—Е –≥—А—Г–њ–њ–∞—Е, –Њ–і–љ–∞–Ї–Њ –і–∞–љ–љ—Л–µ –њ–Њ—Б–µ–≤–Њ–≤ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—В–µ—А–Є–∞–ї–∞ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —Н–ї–Є–Љ–Є–љ–∞—Ж–Є–Є –Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л—Е –≤–Њ–Ј–±—Г–і–Є—В–µ–ї–µ–є –≤ –Ю–У. –Э–∞ –љ–∞—И –≤–Ј–≥–ї—П–і, —Н—В–Њ –Њ–±—К—П—Б–љ—П–µ—В—Б—П —В–µ–Љ, —З—В–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ –Є–Ј–Љ–µ–љ–µ–љ–љ—Л–є —Б–µ–Ї—А–µ—В –њ—А–Њ—Б—В–∞—В—Л, —В–∞–Ї –ґ–µ –Ї–∞–Ї –Є –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ—Л, –≤—Л–Ј—Л–≤–∞—О—Й–Є–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –Љ–Њ–≥—Г—В –љ–∞—Е–Њ–і–Є—В—М—Б—П –≤ —Б–Њ—Б—В–∞–≤–µ –±–Є–Њ–њ–ї–µ–љ–Њ–Ї –љ–∞ —Б—В–µ–љ–Ї–∞—Е –њ—А–Њ—В–Њ–Ї–Њ–≤ –ґ–µ–ї–µ–Ј—Л –Є–ї–Є –≤ –Њ–±—В—Г—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –∞—Ж–Є–љ—Г—Б–∞—Е [27вАУ30]. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–µ —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–Њ–≤—Л—Б–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–µ—А—Б–Њ–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–∞—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–∞—П —В–µ—А–∞–њ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –Ф–У–Я–Ц –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –•–Я —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Д–Є–Ј–Є–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –∞–њ–њ–∞—А–∞—В–Њ–Љ ¬Ђ–°–Ь–Р–†–Ґ-–Я–†–Ю–°–Ґ¬ї —Б —Г—З–µ—В–Њ–Љ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е —Е—А–Њ–љ–Њ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г–Љ–µ–љ—М—И–Є—В—М –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–Є–ґ–љ–Є—Е –Љ–Њ—З–µ–≤—Л–≤–Њ–і—П—Й–Є—Е –њ—Г—В–µ–є –Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –≤ –њ—А–Њ—Б—В–∞—В–µ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –∞–љ—В–Є–±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –Њ —З–µ–Љ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –±–∞–Ї—В–µ—А–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –∞ —В–∞–Ї–ґ–µ —Г–ї—Г—З—И–∞–µ—В —А–µ–Ј—Г–ї—М—В–∞—В—Л —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–∞–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є, –њ–Њ–Ј–≤–Њ–ї—П—П —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –њ–Њ—Б–ї–µ –Ґ–£–† –њ—А–Њ—Б—В–∞—В—Л. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –і–ї—П –±–Њ–ї–µ–µ –≥–ї—Г–±–Њ–Ї–Њ–≥–Њ –њ–Њ–љ–Є–Љ–∞–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, –ї–µ–ґ–∞—Й–Є—Е –≤ –Њ—Б–љ–Њ–≤–µ –і–∞–љ–љ–Њ–≥–Њ —Б–њ–Њ—Б–Њ–±–∞ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є, —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –і–µ—В–∞–ї—М–љ–Њ–≥–Њ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Њ–±—А–∞–Ј—Ж–Њ–≤.












