Большинство исследователей считают, что прием 40–80 г чистого этанола в день на протяжении 10–12 лет приводит к высокому риску развития алкогольной болезни печени (АБП). У женщин опасная доза этанола меньше, чем у мужчин, и составляет 20 г/сут. Кроме этого, женщины более чувствительны к токсическому действию этанола, чем мужчины, у них чаще на фоне алкогольного гепатита развивается цирроз печени. Доказано, что ежедневное употребление небольших доз этанола более опасно, чем периодический прием высоких доз, когда печень имеет возможность регенерировать.
В структуре АБП выделяют стеатоз печени, острый и хронический алкогольный гепатит, цирроз печени, которые могут встречаться как изолированно, так и в сочетании друг с другом.
Для алкогольных поражений печени характерно «стертое» течение заболевания, за медицинской помощью пациенты обращаются при появлении асцита, желтухи и других симптомов заболевания.
Суждение об алкогольной природе болезни строится на основании ряда диагностических признаков:
1. Указание на злоупотребление алкоголя или наличие признаков хронического злоупотребления алкоголем.
2. Быстрое улучшение клинических признаков заболевания при абстиненции.
3. Значительная гепатомегалия.
4. Превалирующее повышение уровня АСТ и γ–ГТ в сыворотке крови.
Лечение пациентов с АПБ должно быть индивидуальным и комплексным с учетом тяжести состояния и потенциального риска развития осложнений.
Т.к. курс лечения АБП длительный и дорогостоящий, то необходим поиск эффективных и доступных гепатопротекторов.
На базе гастроэнтерологического отделения Воронежской областной клинической больницы №1 – главный врач д.м.н., профессор, заслуженный врач РФ В.Н. Эктов – проведено открытое клиническое исследование эффективности и безопасности препарата Гептор (S–аденозин–L–метионин), производитель ОАО «Верофарм», Россия.
Гептор – препарат адеметионина, который представляет собой природное вещество, эндогенно синтезируемое из метионина и аденозина. Адеметионин участвует в трех жизненно важных биохимических реакциях: трансметилирования, транссульфурирования и аминопропилирования и таким образом играет важнейшую роль в комплексе метаболических процессов. При формировании АБП первой мишенью действия этанола и его токсических метаболитов являются клеточные мембраны гепатоцитов. Мембраны, помимо выполнения структурной функции, участвуют в процессах молекулярного транспорта, деления и дифференцировки клеток, стимулируют активность различных ферментных систем. Адеметионин, являясь донором метильной группы, принимает участие в синтезе фосфатилхолина – основного структурного компонента клеточной мембраны. Кроме того, адеметионин оказывает антиоксидантное, детоксицирующее действие, ускоряет регенерацию печеночной ткани, замедляет развитие фиброза, а также обладает антинейротоксическим действием. Помимо этого адеметионин играет ключевую роль в метаболизме нуклеиновых кислот и полиаминов и является предшественником глутатиона. Эти процессы практически всегда страдают при заболеваниях печени и требуют введения экзогенного адеметионина. Проведенные клинические исследования показали повышение выживаемости больных компенсированным и субкомпенсированным алкогольным циррозом печени (классы А и В по Чайлд–Пью) при применении адеметионина: двухлетняя выживаемость составила 90% по сравнению с пациентами, получавшими плацебо [1]. Несколько позднее в исследовании Mato J.M. и соавт. (1999) было продемонстрировано, что применение адеметионина в дозе 1200 мг/сут. у больных с компенсированным и субкомпенсированным циррозом печени приводит к уменьшению летальности и потребности в трансплантации печени с 29 до 12% по сравнению с группой плацебо [2]. Более поздние работы свидетельствуют о том, что экзогенно вводимый адеметионин принимает непосредственное участие в процессах роста, регенерации и гибели гепатоцитов – с другой [3].
Таким образом, выбор препарата был обусловлен наличием достаточного количества клинических исследований, подтверждающих эффективность адеметионина при лечении алкогольной болезни печени, с одной стороны, и доступной ценой Гептора на российском рынке лекарственных препаратов.
В исследование были включены 40 больных циррозом печени (ЦП) класса «А» по Чайлд–Пью, находившихся на стационарном или амбулаторном лечении в гастроэнтерологических отделениях ГУЗ ВОКБ №1, в ЛПУ г. Воронежа.
Критерии включения в исследование:
• мужчины и женщины в возрасте от 30 до 65 лет;
• данные анамнеза – употребление опасных доз этанола (>40 г/сут. чистого этанола для мужчин и >20 г/сут. для женщин);
• длительность употребления этанолсодержащих напитков – 8–10 лет;
• согласие пациентов на участие в исследовании.
В исследование не включались пациенты:
• с наличием цирроза печени другой этиологии, наличием цирроза печени классов В и С по Чайлд–Пью.
• с наличием тяжелой сопутствующей патологии (сердечно–сосудистой, заболеваний легких, злокачественных опухолей);
• не способные к абстиненции во время проведения клинического исследования.
Материалы
и методы исследования
Исследуемую группу составили 32 (80%) мужчины и 8 (20%) женщин; средний возраст 47,3±2 года, которым в результате комплексного обследования был поставлен диагноз цирроза печени (класс А по диагностическим критериям Чайлд–Пью).
С целью постановки диагноза и оценки эффективности и безопасности применения препарата проводились:
• анкетирование (анкета ПАС) для выявления хронической алкогольной интоксикации;
• оценка изменения биохимических показателей сыворотки крови; активности трансаминаз, ЩФ, ГГТП, билирубина, общего белка и белковых фракций, протромбина, показателей липидного спектра: холестерина, триглицеридов;
• ультразвуковое исследование (определение размеров печени и селезенки, диаметр внутрипеченочных желчных протоков, общего желчного протока, воротной вены);
• доплеровское ультразвуковое исследование (определение скорости и направления кровотока);
• эзофагогастродуоденоскопия (определение наличия варикозно расширенных вен пищевода);
• определение маркеров вирусных гепатитов.
Всем пациентам исследуемой группы был назначен адеметионин (Гептор) перорально в дозе 800 мг/сут.
Эффективность лечения определялась по следующим параметрам:
• улучшение субъективного самочувствия больных;
• купирование основных клинических проявлений цирроза печени;
• достоверное улучшение лабораторных показателей: синдрома цитолиза, синдрома холестаза;
• положительная динамика печени по данным УЗИ.
Оценка безопасности лечения проводилась на основе субъективной переносимости пациентами препарата Гептор и данных лабораторных методов исследования (ОАК, ОАМ, б/х показатели крови).
Клинические симптомы, лабораторные данные (ОАК, ОАМ, АлАТ, АсАТ, ЩФ, ГГТП, общий белок, билирубин) оценивались в начале лечения, на 14–й и 28–й день терапии; уровень альбуминов, ПТИ, холестерина, триглицеридов – в начале и на 28–й день лечения Гептором.
Следует отметить, что у 31 пациента (77,5%) были выявлены признаки хронического панкреатита с нарушением внешнесекреторной функции; у 9 (22,5%) при эндоскопическом исследовании выявлен эрозивный, не ассоциированный с H. pylori гастрит. Для лечения сопутствующих заболеваний пациентам соответственно были назначены ферментные препараты без желчных кислот (Креон 25 тыс. ЕД на 1 прием пищи), ингибиторы протонного насоса в дозе 40 мг/сут. При проведении психометрических тестов у всех больных выявлена энцефалопатия 0–1, в связи с чем больным назначен препарат лактулозы в дозе 20–30 мл (доза подбиралась индивидуально).
Результаты
По результатам проведенного анкетирования (ПАС) 28 пациентов (70%) дали положительные ответы на 18 вопросов и 12 пациентов (30%) дали положительные ответы на 15 вопросов, что позволило предположить высокую вероятность систематического употребления алкоголя, которое способствовало формированию у пациентов АБП и ЦП (рис. 1).
В клинической картине ЦП преобладали астено–вегетативный и диспепсический синдромы (табл. 1).
При первичном обследовании слабость, снижение работоспособности, быстрая утомляемость, чувство тяжести в правом подреберье, отрыжка, тошнота, метеоризм выявлялись у всех больных, включенных в исследование.
Через 2 недели от начала лечения была выявлена следующая динамика показателей астено–вегетативного и диспепсического синдромов: слабость была купирована у 15 пациентов (37,5%), снижение работоспособности – у 18 (45%), быстрая утомляемость – у 12 (30%), чувство тяжести в правом подреберье – у 18 (45%), отрыжка – у 17 (72,5%), тошнота – у 16 (40%), метеоризм – у 13 (32,5%). При исследовании пациентов по окончании 4–недельного курса лечения оказалось, что клинические проявления астено–вегетативного синдрома в среднем купированы у 87,5% пациентов: слабость была купирована у 36 пациентов (90%), снижение работоспособности – у 34 (85%), быстрая утомляемость – у 35 (87,5%). Клинические проявления диспепсического синдрома в среднем купированы у 95% пациентов: чувство тяжести в правом подреберье – у 38 (95%), отрыжка – у 37 (92,5%), тошнота – у всех исследованных пациентов, метеоризм – у 37 (92,5%).
На фоне терапии препаратом Гептор значительно уменьшились проявления астеновегетативного и диспептического синдромов, наблюдавшиеся у больных АБП на стадии цирроза печени (класс А по критериям Чайлд–Пью).
Динамика лабораторных данных
Результаты общего анализа крови и мочи не отличались от нормальных показателей как до, так и после курса лечения.
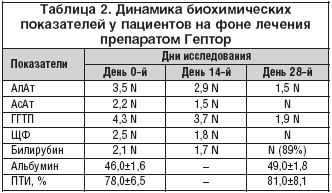
При обследовании больных ЦП до начала лечения у всех больных выявлено: повышение уровня АлАТ (в среднем до 3,5 N), АсАТ (в среднем до 2,2 N), повышение уровня билирубина (в среднем до 2,1 N) (табл. 2).
Динамику биохимических показателей оценивали на 14–й и 28–й дни, показатели белково–синтетической функции печени – на 28–й день лечения.
Показатели цитолиза снизились у всех пациентов уже на 14–й день лечения и практически нормализовались к 28–му дню терапии. АлАТ к 14–му дню снизился в среднем до 2,9 N (на 17%), к 28–му дню – до 1,5 N (на 53%); АсАТ у всех пациентов снизился по сравнению с исходным до 1,5 N (на 32%) к 14–му дню и к 28–му дню не превышал нормальных показателей. Отмечалась также и положительная динамика изменения концентрации билирубина: к 14–му дню уровень билирубина снизился до 1,7 N (на 19%), к 28–му дню был в пределах нормы у 89%, у 11% пациентов билирубин был повышен до 1,2 N. Таким образом, за 28 дней лечения больных ЦП произошла регрессия цитолитического синдрома у большинства пациентов.
До начала терапии у включенных в исследование пациентов было установлено повышение уровня маркеров холестаза: ЩФ (в среднем до 2,5 N) и ГГТП (в среднем до 4,3 N). На фоне лечения препаратом Гептор отмечалась положительная динамика:
• уменьшение уровня ЩФ к 14–му дню исследования до 1,8 N (на 28%), достижение нормальных показателей к 28–му дню;
• уменьшение уровня ГГТП к 14–му дню исследования до 3,7 N (на 14%), к 28–му дню – до 1,9 N (на 56%).
Как видно из представленных в таблице 2 данных, к 28–му дню исследования в исследуемой группе больных было выявлено повышение уровня альбумина на 6,5% и уровня ПТИ до нормальных значений.
Исходный уровень холестерина у исследуемой группы пациентов составил в среднем 1,7 N, уровень триглицеридов – 1,5 N. В результате проведенного лечения уровень холестерина к 28 дню снизился до нормальных показателей у 83% больных, уровень триглицеридов к 28–му дню достиг нормальных показателей у всех пациентов.
Выводы
В ходе исследования эффективности и безопасности применения препарата Гептор у пациентов с алкогольной болезнью печени на стадии цирроза (класс А по Чайлд–Пью) было установлено, что применение препарата Гептор в течение 28 дней приводит к:
• уменьшению выраженности симптомов астеновегетативного и диспепсического синдромов,
• улучшению показателей белково–синтетической функции печени,
• уменьшению выраженности нарушений липидного обмена,
• положительной динамике биохимических показателей (ЩФ, ГГТП, АлАт, АсАт, билирубина),
• субъективному улучшение самочувствия пациентов.
Проведенный курс лечения выявил хорошую переносимость препарата пациентами.
Таким образом, проведенное исследование показало эффективность и безопасность применения препарата Гептор у пациентов с алкогольной болезнью печени на стадии цирроза класса А по Чайлд–Пью.


Литература
1. Mato J.M., Camara J., Ortiz P. et al. S–adenosylmethionine in the treatment of alcoholic cirrhosis: results from a multicentric placebo–controlled, randomized double–blind clinical trial // Hepatology, 1997. – Vol. 26. – P. 251A.
2. Mato J.M., Camara J., Fernandez de Paz J. et al. S–adenosylmethionine in alcoholic liver cirrhosis: a randomized, placebo–controlled, double–blind, multicenter clinical trial // Hepatology. – 1999. – Vol. 30. – P. 1081–1089.
3. Mato J.M., Shelly C.Lu Role of S–Adenosyl–L–Methionine in liver health and injury // Hepatology. – 2007. – Vol. 45. – P. 1306–1312.








.gif)



