
–Т–≤–µ–і–µ–љ–Є–µ
–Э–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П (–Э–≠–Э) –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є –≥—А—Г–њ–њ—Г –≥–µ—В–µ—А–Њ–≥–µ–љ–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є, –Ї–Њ—В–Њ—А—Л–µ –≤–Њ–Ј–љ–Є–Ї–∞—О—В –Є–Ј –і–Є—Б—Б–µ–Љ–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є –Ї–ї–µ—В–Њ—З–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Є–Ј –Њ—А–≥–∞–љ–Њ–≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–Я–Ц). –Ъ–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г—О—В—Б—П –Э–≠–Э –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є–µ–є –Є—Е –Ї–ї–µ—В–Њ–Ї –Є –Є–љ–і–µ–Ї—Б–Њ–Љ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є (–Ъi-67) –Ї–∞–Ї –≤—Л—Б–Њ–Ї–Њ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–Є (–Э–≠–Ю), –≤–Ї–ї—О—З–∞—П G1 (–Ъi-67вЙ§2), G2 (–Ъi-67 3вАУ20%) –Є —Е–Њ—А–Њ—И–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є G3 (–Ъi-67>20%), –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—П –±–Њ–ї–µ–µ –±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –њ–Њ–≤–µ–і–µ–љ–Є–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–Њ—Е–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–Љ–Є G3 –Є –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–Љ–Є –Ї–∞—А—Ж–Є–љ–Њ–Љ–∞–Љ–Є (–Э–≠–Ъ, –Љ–µ–ї–Ї–Њ- –Є –Ї—А—Г–њ–љ–Њ–Ї–ї–µ—В–Њ—З–љ—Л–µ). –†–µ–ґ–µ –≤—Б—В—А–µ—З–∞—О—В—Б—П –Њ–њ—Г—Е–Њ–ї–Є –±—А–Њ–љ—Е–Њ–ї–µ–≥–Њ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ (20вАУ25%), –Ї–Њ—В–Њ—А—Л–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г—О—В—Б—П –Ї–∞–Ї —В–Є–њ–Є—З–љ—Л–µ –Є –∞—В–Є–њ–Є—З–љ—Л–µ –Ї–∞—А—Ж–Є–љ–Њ–Є–і–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–Є. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Э–≠–Э –љ–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А—Г—О—В, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –Љ–µ–љ—М—И–Є–љ—Б—В–≤–∞ –љ–∞–±–ї—О–і–∞—О—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –≥–Є–њ–µ—А—Б–µ–Ї—А–µ—Ж–Є–µ–є –±–Є–Њ–∞–Ї—В–Є–≤–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є [1]. –Я–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Є–µ –Э–≠–Э (–Я–∞–љ–Э–≠–Э) —П–≤–ї—П—О—В—Б—П —А–µ–і–Ї–Є–Љ–Є –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є, –њ—А–Њ—П–≤–ї—П—О—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є–Є –≥–Њ—А–Љ–Њ–љ–Њ–≤. –Э–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –Я–∞–љ–Э–≠–Ю —П–≤–ї—П–µ—В—Б—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–∞—П –Є–Ј ќ≤-–Ї–ї–µ—В–Њ–Ї –Я–Ц –Є –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞—О—Й–∞—П —А–∞–Ј–≤–Є—В–Є–µ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–Љ–њ—В–Њ–Љ–Њ–Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —З–∞—Б—В–Њ—В–∞ –љ–Њ–≤—Л—Е —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –љ–µ —Г–≤–µ–ї–Є—З–Є–ї–∞—Б—М, —Б–Њ—Б—В–∞–≤–ї—П—П 1вАУ3 —Б–ї—Г—З–∞—П –љ–∞ 1 –Љ–ї–љ —З–µ–ї–Њ–≤–µ–Ї –≤ –≥–Њ–і –≤ –ї—О–±–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ [2]. –Ю—Б–љ–Њ–≤–љ–Њ–є –њ–Є–Ї —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –њ—А–Є—Е–Њ–і–Є—В—Б—П –љ–∞ –њ—П—В–Њ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ –ґ–Є–Ј–љ–Є, –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М —Г –ґ–µ–љ—Й–Є–љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ, —З–µ–Љ —Г –Љ—Г–ґ—З–Є–љ [2, 3]. –Т 85вАУ90% —Б–ї—Г—З–∞–µ–≤ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–Њ–ї–Є—В–∞—А–љ—Л–µ –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–Є, –≤ 10вАУ15% –≤—Л—П–≤–ї—П—О—В—Б—П –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–Є, –Љ–µ–љ–µ–µ 6% –Њ–њ—Г—Е–Њ–ї–µ–є –Њ–Ї–∞–Ј—Л–≤–∞—О—В—Б—П –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є [4]. –Ь–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л–µ —Б–Є–љ—Е—А–Њ–љ–љ—Л–µ –Є–ї–Є –Љ–µ—В–∞—Е—А–Њ–љ–љ—Л–µ –Я–∞–љ–Э–≠–Ю/–Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л –Љ–Њ–≥—Г—В –≤–Њ–Ј–љ–Є–Ї–∞—В—М –њ—А–Є –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ–Њ–є —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–є –љ–µ–Њ–њ–ї–∞–Ј–Є–Є —В–Є–њ–∞ 1 (M–≠–Э-1). –Я—А–∞–Ї—В–Є—З–µ—Б–Ї–Є 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ь–≠–Э-1 –Є–Љ–µ—О—В –Я–∞–љ–Э–≠–Ю [2].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ
–Т –Њ—Б–љ–Њ–≤–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –ї–µ–ґ–Є—В –∞–≤—В–Њ–љ–Њ–Љ–љ–∞—П –≥–Є–њ–µ—А–њ—А–Њ–і—Г–Ї—Ж–Є—П –Є–љ—Б—Г–ї–Є–љ–∞, –њ—А–Њ–≤–Њ—Ж–Є—А—Г–µ–Љ–∞—П –≥–Њ–ї–Њ–і–∞–љ–Є–µ–Љ –Є–ї–Є —Д–Є–Ј–Є—З–µ—Б–Ї–Є–Љ–Є —Г–њ—А–∞–ґ–љ–µ–љ–Є—П–Љ–Є. –Э–µ –њ–Њ–і—З–Є–љ—П—П—Б—М —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–Љ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј –≥–ї—О–Ї–Њ–Ј—Л, –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л –њ—А–Є–≤–Њ–і—П—В –Ї —А–∞–Ј–≤–Є—В–Є—О –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є, –≤ –Њ—В–≤–µ—В –љ–∞ –Ї–Њ—В–Њ—А—Г—О –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤—Л–±—А–Њ—Б –Ї–Њ–љ—В—А–Є–љ—Б—Г–ї—П—А–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –≤—Л–Ј—Л–≤–∞—О—Й–Є—Е —Е–∞—А–∞–Ї—В–µ—А–љ—Г—О —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї—Г. –Ю—В–ї–Є—З–Є—В–µ–ї—М–љ—Л–Љ–Є —З–µ—А—В–∞–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ —П–≤–ї—П—О—В—Б—П –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –Є –љ–µ–є—А–Њ–≥–ї–Є–Ї–Њ–њ–µ–љ–Є—З–µ—Б–Ї–Є–µ –≤—Б–ї–µ–і—Б—В–≤–Є–µ —Б–љ–Є–ґ–µ–љ–Є—П –≤ –Ї—А–Њ–≤–Є —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л вАФ –Њ—Б–љ–Њ–≤–љ–Њ–≥–Њ —Н–љ–µ—А–≥–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—Г–±—Б—В—А–∞—В–∞ –і–ї—П –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ (—В–∞–±–ї. 1) [2].
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –Ю—В–ї–Є—З–Є—В–µ–ї—М–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є [2] –Ґ–∞–±–ї–Є—Ж–∞ 1. –Ю—В–ї–Є—З–Є—В–µ–ї—М–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є [2]](/upload/medialibrary/c25/25-1.png)
–Т–∞–ґ–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—П–≤–ї–µ–љ–Є–µ–Љ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л —Б—З–Є—В–∞–µ—В—Б—П —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–≤–њ–ї–Њ—В—М –і–Њ —А–∞–Ј–≤–Є—В–Є—П –Љ–Њ—А–±–Є–і–љ–Њ–≥–Њ –Њ–ґ–Є—А–µ–љ–Є—П) –≤—Б–ї–µ–і—Б—В–≤–Є–µ –≤—Л–љ—Г–ґ–і–µ–љ–љ–Њ–≥–Њ —З–∞—Б—В–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –і–ї—П —Г—Б—В—А–∞–љ–µ–љ–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є [5].
–Я–µ—А–≤—Л–Љ —И–∞–≥–Њ–Љ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л —П–≤–ї—П–µ—В—Б—П –≤—Л—П–≤–ї–µ–љ–Є–µ –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–љ—Г—В—М —Б–њ–Њ–љ—В–∞–љ–љ–Њ, –љ–Њ —З–∞—Й–µ —В—А–µ–±—Г–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –њ—А–Њ–±—Л —Б –≥–Њ–ї–Њ–і–∞–љ–Є–µ–Љ. ¬Ђ–Ч–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–±–∞ —Б —В—А–µ—Е–і–љ–µ–≤–љ—Л–Љ –≥–Њ–ї–Њ–і–∞–љ–Є–µ–Љ, —Ж–µ–ї—М –Ї–Њ—В–Њ—А–Њ–≥–Њ вАФ –њ—А–Њ–≤–Њ–Ї–∞—Ж–Є—П –њ–∞—В–Њ–≥–љ–Њ–Љ–Њ–љ–Є—З–љ–Њ–є –і–ї—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л —В—А–Є–∞–і—Л –£–Є–њ–њ–ї–∞ [2]:
-
–≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –њ—А–Є—Б—В—Г–њ–Њ–≤ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –љ–∞—В–Њ—Й–∞–Ї;
-
–њ–∞–і–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –≤ –Ї—А–Њ–≤–Є –љ–Є–ґ–µ 3,0 –Љ–Љ–Њ–ї—М/–ї –≤–Њ –≤—А–µ–Љ—П –њ—А–Є—Б—В—Г–њ–∞;
-
–Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ –њ—А–Є—Б—В—Г–њ–∞ –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –≤–≤–µ–і–µ–љ–Є–µ–Љ –≥–ї—О–Ї–Њ–Ј—Л.
–С–Њ–ї–µ–µ 95% —Б–ї—Г—З–∞–µ–≤ –Љ–Њ–ґ–љ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞—В—М –љ–∞ –Њ—Б–љ–Њ–≤–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —Н—В–Њ–≥–Њ –њ—А–Њ—Б—В–Њ–≥–Њ —В–µ—Б—В–∞. –Т–Њ –≤—А–µ–Љ—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ–±—Л –њ–∞—Ж–Є–µ–љ—В –љ–∞—Е–Њ–і–Є—В—Б—П –њ–Њ–і –њ—А–Є—Б—В–∞–ї—М–љ—Л–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ –њ–µ—А—Б–Њ–љ–∞–ї–∞. –Э–∞—З–∞–ї–Њ –≥–Њ–ї–Њ–і–∞–љ–Є—П вАФ —Н—В–Њ –≤—А–µ–Љ—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –њ–Є—Й–Є. –Т–Њ –≤—А–µ–Љ—П –≥–Њ–ї–Њ–і–∞–љ–Є—П —Б–ї–µ–і—Г–µ—В –њ—А–µ–Ї—А–∞—В–Є—В—М –њ—А–Є–µ–Љ –≤—Б–µ—Е –≤—В–Њ—А–Њ—Б—В–µ–њ–µ–љ–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤. –Т –љ–∞—З–∞–ї–µ –≥–Њ–ї–Њ–і–∞–љ–Є—П –±–µ—А—Г—В—Б—П –Њ–±—А–∞–Ј—Ж—Л –Ї—А–Њ–≤–Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л, –Є–љ—Б—Г–ї–Є–љ–∞, –°-–њ–µ–њ—В–Є–і–∞ [6]. –Т —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ—А–Њ–±—Л –Є—Б–Ї–ї—О—З–∞–µ—В—Б—П –ї—О–±–Њ–є –њ—А–Є–µ–Љ –њ–Є—Й–Є, –Є –Ї–∞–ґ–і—Л–µ 6 —З –њ—А–Њ–≤–Њ–і–Є—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є. –Ъ–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –≤ –њ–ї–∞–Ј–Љ–µ –њ–∞–і–∞–µ—В –љ–Є–ґ–µ —Г—А–Њ–≤–љ—П 3,3 –Љ–Љ–Њ–ї—М/–ї (60 –Љ–≥/–і–ї), –Њ–±—А–∞–Ј—Ж—Л —Б–ї–µ–і—Г–µ—В –±—А–∞—В—М –Ї–∞–ґ–і—Л–µ 1вАУ2 —З –њ–Њ–і —В—Й–∞—В–µ–ї—М–љ—Л–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ. –У–Њ–ї–Њ–і–∞–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –і–Њ —В–µ—Е –њ–Њ—А, –њ–Њ–Ї–∞ —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –≤ –њ–ї–∞–Ј–Љ–µ –љ–µ —Г–њ–∞–і–µ—В –љ–Є–ґ–µ 2,5 –Љ–Љ–Њ–ї—М/–ї (—Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –≤ –њ–ї–∞–Ј–Љ–µ –Љ–µ–љ–µ–µ 3,0 –Љ–Љ–Њ–ї—М/–ї —П–≤–ї—П–µ—В—Б—П –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ–Њ–є –Ї–Њ–љ–µ—З–љ–Њ–є —В–Њ—З–Ї–Њ–є, –µ—Б–ї–Є —А–∞–љ–µ–µ –±—Л–ї–∞ –Ј–∞–і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ–∞ —В—А–Є–∞–і–∞ –£–Є–њ–њ–ї–∞) –Є –љ–µ –њ—А–Њ—П–≤—П—В—Б—П —Б–Є–Љ–њ—В–Њ–Љ—Л –љ–µ–є—А–Њ–≥–ї—О–Ї–Њ–њ–µ–љ–Є–Є [6].
–Я—А–Є –≥–ї–Є–Ї–µ–Љ–Є–Є –Љ–µ–љ–µ–µ 3,0 –Љ–Љ–Њ–ї—М/–ї –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –Ј–∞–±–Њ—А –≤–µ–љ–Њ–Ј–љ–Њ–є –Ї—А–Њ–≤–Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Є–љ—Б—Г–ї–Є–љ–∞, –њ—А–Њ–Є–љ—Б—Г–ї–Є–љ–∞ –Є –°-–њ–µ–њ—В–Є–і–∞. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –∞–±—Б–Њ–ї—О—В–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Є–љ—Б—Г–ї–Є–љ–∞ –њ–Њ–≤—Л—И–µ–љ –љ–µ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞–Љ–Є, –љ–µ–Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л–є –Є–ї–Є –љ–µ–њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Є–љ—Б—Г–ї–Є–љ–∞ –љ–µ –Є—Б–Ї–ї—О—З–∞–µ—В –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Г. –Ч–љ–∞—З–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞, —А–∞–≤–љ—Л–µ –Є–ї–Є –њ—А–µ–≤—Л—И–∞—О—Й–Є–µ 3 –Љ–Ї–Х–і/–Љ–ї –њ—А–Є —Г—А–Њ–≤–љ–µ –≥–ї—О–Ї–Њ–Ј—Л –≤ –Ї—А–Њ–≤–Є –Љ–µ–љ–µ–µ 3 –Љ–Љ–Њ–ї—М/–ї, —Б –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –≤ –њ–Њ–ї—М–Ј—Г –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –њ—А–µ–і–њ–Њ—З–Є—В–∞—О—В –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–∞—В—М—Б—П –љ–∞ –±–Њ–ї–µ–µ —Б—В—А–Њ–≥–Є–µ –њ—А–µ–і–µ–ї—М–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ 2,2 –Љ–Љ–Њ–ї—М/–ї –Є–ї–Є –Љ–µ–љ–µ–µ –і–ї—П –њ–Њ–≤—Л—И–µ–љ–Є—П –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є. –Ш–Ј-–Ј–∞ –њ–Њ—В–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є –њ—А–Њ–Є–љ—Б—Г–ї–Є–љ–∞, –Ї–Њ—В–Њ—А–∞—П –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П —Б –њ–Њ–Љ–Њ—Й—М—О –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –∞–љ–∞–ї–Є–Ј–Њ–≤ –љ–∞ –Є–љ—Б—Г–ї–Є–љ, –Њ–±—Л—З–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П —В–∞–Ї–ґ–µ –Є–Ј–Љ–µ—А—П—В—М —Г—А–Њ–≤–љ–Є –њ—А–Њ–Є–љ—Б—Г–ї–Є–љ–∞ –Є/–Є–ї–Є –°-–њ–µ–њ—В–Є–і–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ —Г—А–Њ–≤–µ–љ—М –Є–љ—Б—Г–ї–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є –љ–Є–Ј–Ї–Є–є –Є–ї–Є –љ–µ–Њ–њ—А–µ–і–µ–ї—П–µ–Љ—Л–є [1]. –†–µ–Ј—Г–ї—М—В–∞—В –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤, –∞ —В–∞–Ї–ґ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≤ –Ї—А–Њ–≤–Є –њ–µ—А–Њ—А–∞–ї—М–љ—Л—Е —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ—Г—О –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї—Г –Љ–µ–ґ–і—Г —Н–љ–і–Њ–≥–µ–љ–љ—Л–Љ –Є —Н–Ї–Ј–Њ–≥–µ–љ–љ—Л–Љ –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–Є–Ј–Љ–Њ–Љ (—В–∞–±–ї. 2).
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є (—Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л <3,0 –Љ–Љ–Њ–ї—М/–ї) –њ–Њ—Б–ї–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≥–Њ–ї–Њ–і–∞–љ–Є—П [6] –Ґ–∞–±–ї–Є—Ж–∞ 2. –Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є (—Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л <3,0 –Љ–Љ–Њ–ї—М/–ї) –њ–Њ—Б–ї–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≥–Њ–ї–Њ–і–∞–љ–Є—П [6]](/upload/medialibrary/52e/25-2.png)
–Я—А–Є–Љ–µ—А–љ–Њ —Г 75% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞–Љ–Є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—П –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –њ–Њ—Б–ї–µ 24-—З–∞—Б–Њ–≤–Њ–≥–Њ –≥–Њ–ї–Њ–і–∞–љ–Є—П, —Г 90вАУ94% вАФ —З–µ—А–µ–Ј 48 —З. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Н–Ї—Б–њ–µ—А—В—Л —Г—В–≤–µ—А–ґ–і–∞—О—В, —З—В–Њ –њ—А–Њ–і–ї–µ–љ–Є–µ –≥–Њ–ї–Њ–і–∞–љ–Є—П –і–Њ 72 —З —Б–≤–Њ–і–Є—В –Ї –Љ–Є–љ–Є–Љ—Г–Љ—Г –Њ—И–Є–±–Њ—З–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –Є –Љ–∞–Ї—Б–Є–Љ–Є–Ј–Є—А—Г–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л [6].
–Т–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ
–Я—А–Є –љ–∞–ї–Є—З–Є–Є —Н–љ–і–Њ–≥–µ–љ–љ–Њ–є –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–µ–Љ–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –њ—А–Њ–≤–Њ–і—П—В—Б—П –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А—Г—О—Й–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Г—Б–њ–µ—И–љ–Њ –≤—Л—П–≤–ї—П—О—Й–Є–µ –њ—А–Є–Љ–µ—А–љ–Њ 75% –Є–љ—Б—Г–ї–Є–љ–Њ–Љ. –Р–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–∞—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є–љ—Б—Г–ї–Є–љ–Њ–Љ —В–∞–Ї–ґ–µ –≤–∞–ґ–љ–∞ –і–ї—П –≤—Л–±–Њ—А–∞ –Љ–µ–ґ–і—Г –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–є, —А–Њ–±–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є –Њ—В–Ї—А—Л—В–Њ–є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–є –Њ–њ–µ—А–∞—Ж–Є–µ–є, –∞ —В–∞–Ї–ґ–µ –і–ї—П –≤—Л–±–Њ—А–∞ –Љ–µ–ґ–і—Г —Н–љ—Г–Ї–ї–µ–∞—Ж–Є–µ–є –Є–ї–Є —З–∞—Б—В–Є—З–љ–Њ–є –њ–∞–љ–Ї—А–µ–∞—В—Н–Ї—В–Њ–Љ–Є–µ–є [2]. –Я—А–Њ—Ж–µ–і—Г—А—Л –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Љ–Њ–≥—Г—В –≤–Ї–ї—О—З–∞—В—М —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ –Љ–µ—В–Њ–і—Л: –Ї–Њ–Љ–њ—М—О—В–µ—А–љ—Г—О —В–Њ–Љ–Њ–≥—А–∞—Д–Є—О (–Ъ–Ґ), –Љ–∞–≥–љ–Є—В–љ–Њ-—А–µ–Ј–Њ–љ–∞–љ—Б–љ—Г—О —В–Њ–Љ–Њ–≥—А–∞—Д–Є—О (–Ь–†–Ґ), —В—А–∞–љ—Б–∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–µ –Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ (–£–Ч–Ш), –∞ —В–∞–Ї–ґ–µ –Љ–µ—В–Њ–і—Л –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є.
–Ь–µ—В–Њ–і—Л, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –Њ–њ—Г—Е–Њ–ї–µ–є –≤ –Я–Ц, –≤–Ї–ї—О—З–∞—О—В —В—А–µ—Е—Д–∞–Ј–љ—Г—О –Ъ–Ґ –Є –Ь–†–Ґ, –∞ —В–∞–Ї–ґ–µ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–µ –£–Ч–Ш [2]. –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ъ–Ґ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ–±–Њ–ї—М—И–Є–µ (0,5вАУ2 —Б–Љ) –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –≥–Є–њ–µ—А–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –љ–∞ —А–∞–љ–љ–Є—Е –Є –њ–Њ–Ј–і–љ–Є—Е –њ–Њ—Б—В–Ї–Њ–љ—В—А–∞—Б—В–љ—Л—Е –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П—Е, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –љ–µ—Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А—Г—О—Й–Є–µ –Я–∞–љ–Э–≠–Э, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –±–Њ–ї—М—И–Є–µ –њ–Њ —А–∞–Ј–Љ–µ—А—Г, –Љ–Њ–≥—Г—В –±—Л—В—М –Ї–Є—Б—В–Њ–Ј–љ—Л–Љ–Є –Є–ї–Є –і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞—В—М –љ–µ–Ї—А–Њ—В–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П. –Ь–µ—В–∞—Б—В–∞–Ј—Л –≤ –њ–µ—З–µ–љ—М –њ—А–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞—Е –Љ–Њ–≥—Г—В —Б–Њ—З–µ—В–∞—В—М—Б—П —Б –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —Б—В–µ–∞—В–Њ–Ј–∞ –њ–µ—З–µ–љ–Є. –Ь–†–Ґ —Б –±–Њ–ї—М—И–µ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –≤—Л—П–≤–ї—П–µ—В –љ–µ–±–Њ–ї—М—И–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є–Ј-–Ј–∞ –ї—Г—З—И–µ–≥–Њ –Ї–Њ–љ—В—А–∞—Б—В–∞ –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є, –Њ–і–љ–∞–Ї–Њ —Н—В–Њ —А–∞–Ј–ї–Є—З–Є–µ —З–∞—Б—В–Њ –љ–µ —Б—З–Є—В–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ –Є–Ј-–Ј–∞ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –Ь–†–Ґ. –Ґ–Є–њ–Є—З–љ—Л–µ –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–Є –њ—А–Њ—П–≤–ї—П—О—В—Б—П –≤ –≤–Є–і–µ —В–µ–Љ–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –љ–∞ –Ґ1-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е –Ь–†-–Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П—Е –Є –≤ –≤–Є–і–µ —П—А–Ї–Є—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –љ–∞ –Ґ2-–≤–Ј–≤–µ—И–µ–љ–љ—Л—Е –Ь–†-–Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П—Е. –Т –Њ—Б—В–∞–ї—М–љ–Њ–Љ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–µ —Г—Б–Є–ї–µ–љ–Є–µ –Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є —З–∞—Б—В–Њ —Б—Е–Њ–ґ–Є —Б –Ъ–Ґ (—В–∞–±–ї. 3).
![–Ґ–∞–±–ї–Є—Ж–∞ 3. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ, % [2] –Ґ–∞–±–ї–Є—Ж–∞ 3. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ, % [2]](/upload/medialibrary/87c/25-3.png)
–Ю—В–Ї—А—Л—В–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л—Е –Љ–Є—И–µ–љ–µ–є –Є–Ј-–Ј–∞ —Б–≤–µ—А—Е—Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –њ–µ–њ—В–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –Э–≠–Ю –њ—А–Є–≤–µ–ї–Њ –Ї —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ —А–∞–і–Є–Њ–љ—Г–Ї–ї–Є–і–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Я–∞–љ–Э–≠–Э. –†–µ—Ж–µ–њ—В–Њ—А –≥–ї—О–Ї–∞–≥–Њ–љ–Њ–њ–Њ–і–Њ–±–љ–Њ–≥–Њ –њ–µ–њ—В–Є–і–∞-1 (—А–У–Я–Я-1) –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В—Б—П –љ–∞ ќ≤-–Ї–ї–µ—В–Ї–∞—Е –Я–Ц –Є –њ–Њ—Н—В–Њ–Љ—Г —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –Љ–Є—И–µ–љ—М—О –і–ї—П –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ, –Ї–Њ—В–Њ—А—Л–µ —Б–ї–Њ–ґ–љ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞—В—М –Є–Ј-–Ј–∞ –Є—Е –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ —А–∞–Ј–Љ–µ—А–∞ –Є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–є –±–ї–Є–Ј–Њ—Б—В–Є –Ї –њ–Њ—З–Ї–∞–Љ. –Ш–љ—Б—Г–ї–Є–љ–Њ–Љ–∞ –Њ–±—Л—З–љ–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ—В –Љ–∞–ї–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–Њ–Љ–∞—В–Њ—Б—В–∞—В–Є–љ–∞ (—А–°–°–Ґ), —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В–µ –≤—Л—П–≤–ї–µ–љ–Є—П –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —А–°–°–Ґ-–≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є. –Ю–і–љ–∞–Ї–Њ —А–У–Я–Я-1 —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г—О—В—Б—П —Б –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –Є –≤—Л—Б–Њ–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В—М—О –≤ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞—Е [7]. –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –і–Њ–±—А–Њ–Ї–∞—З–µ—Б-—В–≤–µ–љ–љ—Л—Е –Є–љ—Б—Г–ї–Є–љ–Њ–Љ, –≤ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е —З–∞—Б—В–Њ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –У–Я–Я-1 [8]. –С—Л–ї–Є —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л –У–Я–Я-1-–њ–Њ–і–Њ–±–љ—Л–µ —А–∞–і–Є–Њ–ї–Є–≥–∞–љ–і—Л, —Б–Њ—Е—А–∞–љ—П—О—Й–Є–µ –≤—Л—Б–Њ–Ї—Г—О –∞—Д—Д–Є–љ–љ–Њ—Б—В—М –Ї —А–У–Я–Я-1. –Ю–і–Є–љ –Є–Ј —В–∞–Ї–Є—Е —А–∞–і–Є–Њ–ї–Є–≥–∞–љ–і–Њ–≤ вАФ —Н–Ї—Б–µ–љ–і–Є–љ-4. –Я—А–Њ—Ж–µ–і—Г—А–∞ 68Ga-DOTA-exendin-4 –Я–≠–Ґ/–Ъ–Ґ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Н–Ї—Б–µ–љ–і–Є–љ–∞-4, –љ–∞—Ж–µ–ї–µ–љ–љ–Њ–≥–Њ –љ–∞ —А–У–Я–Я-1, –≤–µ—А–Њ—П—В–љ–Њ, —Б—В–∞–љ–µ—В –Љ–µ—В–Њ–і–Њ–Љ –≤—Л–±–Њ—А–∞ –њ—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Г, –љ–µ –≤—Л—П–≤–ї–µ–љ–љ—Г—О –њ—А–Є –Њ–±—Л—З–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –Љ–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–Њ—А–∞–ґ–µ–љ–Є–є –Я–Ц —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ь–≠–Э-1. –С–ї–∞–≥–Њ–і–∞—А—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–Љ—Г –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤—Г, –Ј–∞–Ї–ї—О—З–∞—О—Й–µ–Љ—Г—Б—П –≤ –±–Њ–ї–µ–µ –Ї–Њ—А–Њ—В–Ї–Њ–Љ –≤—А–µ–Љ–µ–љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –Љ–µ–љ—М—И–µ–є –ї—Г—З–µ–≤–Њ–є –љ–∞–≥—А—Г–Ј–Ї–µ, –Я–≠–Ґ/–Ъ–Ґ 68Ga-DOTA-exendin-4 –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–µ—В–Њ–і–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≤—Л–±–Њ—А–∞ –њ—А–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є–Є –љ–∞ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Г –Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–Љ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Њ–±—Л—З–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є–Ј–±–µ–ґ–∞—В—М –≥—А–Њ–Љ–Њ–Ј–і–Ї–Њ–є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ–є –≤–љ—Г—В—А–Є–∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –Ї–∞–ї—М—Ж–Є–µ–Љ —Б –Ј–∞–±–Њ—А–Њ–Љ –њ—А–Њ–± –≤–µ–љ–Њ–Ј–љ–Њ–є –Ї—А–Њ–≤–Є [7].
–Я—А–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є—П —А–У–Я–Я-1 –Њ–≥—А–∞–љ–Є—З–µ–љ–∞, –љ–Њ —З–∞—Б—В–Њ —Б–Њ—Е—А–∞–љ—П–µ—В—Б—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–Њ–Љ–∞—В–Њ—Б—В–∞—В–Є–љ–∞, —З—В–Њ –і–µ–ї–∞–µ—В –Є—Е —В–∞–Ї–ґ–µ –њ—А–Є–≥–Њ–і–љ—Л–Љ–Є –і–ї—П –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є —Б –њ–Њ–Љ–Њ—Й—М—О 68Ga-SSTR-–Я–≠–Ґ/–Ъ–Ґ. –≠–Ї—Б–њ—А–µ—Б—Б–Є—А—Г—О—В—Б—П —А–°–°–Ґ –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Е–Њ—А–Њ—И–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є, –њ—А–Є —Н—В–Њ–Љ –њ–ї–Њ—В–љ–Њ—Б—В—М —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —Б–љ–Є–ґ–∞–µ—В—Б—П –≤ –њ–ї–Њ—Е–Њ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П—Е. –Ф–Њ–ї–≥–Њ–µ –≤—А–µ–Љ—П —А–°–°–Ґ –њ–Њ–і—В–Є–њ–∞ 2 –±—Л–ї –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –Њ–±—К–µ–Ї—В–Њ–Љ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Є —В–µ—А–∞–њ–Є–Є, –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –њ—А–Є–Њ–±—А–µ–ї–Є –њ–Њ–і—В–Є–њ—Л 3 –Є 5. –Т–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –Њ–њ—Г—Е–Њ–ї–µ–є —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Њ–і–љ–Њ—Д–Њ—В–Њ–љ–љ–Њ–є —Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є –Ъ–Ґ (–Ю–§–≠–Ъ–Ґ)/–Ъ–Ґ —Б –Њ–Ї—В—А–µ–Њ—Б–Ї–∞–љ–Њ–Љ (–љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –Љ–љ–Њ–≥–Є—Е –њ—А–µ–ґ–љ–Є—Е –ї–µ—В вАФ ¬Ђ–Ј–Њ–ї–Њ—В–Њ–є —Б—В–∞–љ–і–∞—А—В¬ї –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є —А–°–°–Ґ), –Я–≠–Ґ/–Ъ–Ґ —Б –≥–∞–ї–ї–Є–µ–Љ (68Gallium-SSTR-–Я–≠–Ґ –љ–∞ –Њ—Б–љ–Њ–≤–µ 68Ga-DOTATOC (–∞—Д—Д–Є–љ–љ–Њ—Б—В—М –Ї —А–°–°–Ґ –њ–Њ–і—В–Є–њ–Њ–≤ 2, 3, 5), 68Ga-NOC (–∞—Д—Д–Є–љ–љ–Њ—Б—В—М –Ї —А–°–°–Ґ –њ–Њ–і—В–Є–њ–Њ–≤ 2, 3, 5) –Є 68Ga-DOTATAT–Х (–∞—Д—Д–Є–љ–љ–Њ—Б—В—М –Ї —А–°–°–Ґ –њ–Њ–і—В–Є–њ–∞ 2)); –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Б—В–∞–і–Є–Є –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л —З–∞—Б—В–Њ –љ–µ–±–Њ–ї—М—И–Є–µ –Є –Њ–±—Л—З–љ–Њ –Є–Љ–µ—О—В –љ–Є–Ј–Ї—Г—О —Н–Ї—Б–њ—А–µ—Б—Б–Є—О —А–°–°–Ґ, –њ—А–∞–≤–Є–ї—М–љ–∞—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П –љ–µ –≤—Б–µ–≥–і–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ 68Ga-SSTR-–Я–≠–Ґ/–Ъ–Ґ [7]. –Р–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є —А–°–°–Ґ —П–≤–ї—П—О—В—Б—П –Я–≠–Ґ —Б 18F-—Д—В–Њ—А–і–µ–Ј–Њ–Ї—Б–Є–≥–ї—О–Ї–Њ–Ј–Њ–є (–њ–Њ–Ї–∞–Ј–∞–љ–∞ –≤—Л—Б–Њ–Ї–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ –Є—Б—Е–Њ–і–Њ–Љ), –Я–≠–Ґ —Б F-18 —Д—В–Њ—А–і–Є–≥–Є–і—А–Њ–Ї—Б–Є—Д–µ–љ–Є–ї–∞–ї–∞–љ–Є–љ–Њ–Љ (18F-–Ф–Ю–†–Р, –Њ–њ–Є—Б–∞–љ–∞ —А–Њ–ї—М –≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–Є–Ј–Љ–∞, —П–≤–ї—П–µ—В—Б—П –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–Љ –Я–≠–Ґ-–Є–љ–і–Є–Ї–∞—В–Њ—А–Њ–Љ –і–ї—П —Б—В—А–∞–љ, –≥–і–µ –љ–µ–і–Њ—Б—В—Г–њ–љ–∞ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П 68Ga-SSTR) (—В–∞–±–ї. 3).
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П 68Ga-exendin-4 –Я–≠–Ґ/–Ъ–Ґ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —В–Њ–ї—М–Ї–Њ –≤ —А–∞–Љ–Ї–∞—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –і–Њ—Б—В—Г–њ–љ–∞ –ї–Є—И—М –≤ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Ж–µ–љ—В—А–∞—Е, –Њ–і–љ–∞–Ї–Њ –Љ–љ–Њ–≥–Њ–Њ–±–µ—Й–∞—О—Й–Є–µ –і–∞–љ–љ—Л–µ –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –љ–µ–±–Њ–ї—М—И–Є—Е —А–У–Я–Я-1-–њ–Њ–Ј–Є—В–Є–≤–љ—Л—Е –Є–љ—Б—Г–ї–Є–љ–Њ–Љ, –≤–µ—А–Њ—П—В–љ–Њ, –њ—А–Є–≤–µ–і—Г—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Я–Њ –Љ–љ–µ–љ–Є—О –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–≥–Њ –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–∞ —Н–Ї—Б–њ–µ—А—В–Њ–≤ –њ–Њ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Є —В–µ—А–∞–љ–Њ—Б—В–Є–Ї–µ –Э–≠–Э, 68Ga-exendin-4 –Я–≠–Ґ/–Ъ–Ґ —Б—В–∞–љ–µ—В –Љ–µ—В–Њ–і–Њ–Љ –њ–µ—А–≤–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л. –Я—А–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–µ —Б–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є —А–°–°–Ґ (—А–У–Я–Я-1-–љ–µ–≥–∞—В–Є–≤–љ–∞—П, –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–∞—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞) 68Gallium-DOTA-SSA —В–∞–Ї–ґ–µ —П–≤–ї—П–µ—В—Б—П –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ –Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ, –Ї–Њ–≥–і–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ 18F-DOPA –Я–≠–Ґ –Љ–Њ–ґ–µ—В –±—Л—В—М –Ј–∞—В—А—Г–і–љ–µ–љ–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –±–Є–Њ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –≤ –Я–Ц [1].
–У–Є—Б—В–Њ–њ–∞—В–Њ–ї–Њ–≥–Є—П –Э–≠–Ю
–Я–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Є–µ –Э–≠–Ю –Є–Љ–µ—О—В –≤—Л—А–∞–ґ–µ–љ–љ—Г—О –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Г—О –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г, –Ї–Њ—В–Њ—А–∞—П –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –Є –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є —Б–Є–љ–∞–њ—В–Њ—Д–Є–Ј–Є–љ–∞ вАФ –Љ–∞—А–Ї–µ—А–∞ –Љ–µ–ї–Ї–Є—Е –≤–µ–Ј–Є–Ї—Г–ї, –∞ —В–∞–Ї–ґ–µ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Е—А–Њ–Љ–Њ–≥—А–∞–љ–Є–љ–∞ –Р вАФ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–≥–Њ –љ–µ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞, —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –њ–ї–Њ—В–љ—Л–Љ–Є —Б–µ–Ї—А–µ—В–Њ—А–љ—Л–Љ–Є –≥—А–∞–љ—Г–ї–∞–Љ–Є [2, 5, 13]. –≠–Ї—Б–њ—А–µ—Б—Б–Є—П —Е—А–Њ–Љ–Њ–≥—А–∞–љ–Є–љ–∞ –Р –Љ–Њ–ґ–µ—В –≤–∞—А—М–Є—А–Њ–≤–∞—В—М –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Њ–≤–∞—В—М –≤ –љ–Є–Ј–Ї–Њ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л—Е —Д–Њ—А–Љ–∞—Е, –њ—А–Є —Н—В–Њ–Љ –љ–∞–ї–Є—З–Є–µ —Б–Є–љ–∞–њ—В–Њ—Д–Є–Ј–Є–љ–∞ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –і–ї—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞ –Э–≠–Ю. –Ф–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–є –њ—А–Є—А–Њ–і—Л –Э–≠–Ю –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–µ –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–µ –љ–∞ –Ї–µ—А–∞—В–Є–љ—Л, –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –њ—А–Є –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є–Є –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї –њ–∞–љ—Ж–Є—В–Њ–Ї–µ—А–∞—В–Є–љ—Г (AE1/AE3) –Є –∞–љ—В–Є—В–µ–ї–∞–Љ–Є –Ї –љ–Є–Ј–Ї–Њ–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–Љ —Ж–Є—В–Њ–Ї–µ—А–∞—В–Є–љ–∞–Љ (–°–Ъ8, –°–Ъ18, –°–Р–Ь 5.2) [5]. –Ю–Ї—А–∞—И–Є–≤–∞–љ–Є–µ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ –љ–µ –≤—Б–µ–≥–і–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞—Е –Є –Њ–±—Л—З–љ–Њ –љ–µ —П–≤–ї—П–µ—В—Б—П –Њ–±—П–Ј–∞—В–µ–ї—М–љ—Л–Љ —В—А–µ–±–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ—Б–ї–µ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –і–Є–∞–≥–љ–Њ–Ј–∞ [2].
–Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Э–≠–Ю
–Т –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Э–≠–Ю –≤–≤–µ–і–µ–љ–∞ –≥—А–∞–і–∞—Ж–Є—П (G1, G2 –Є G3) —Б—В–µ–њ–µ–љ–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Є—Е –Њ–њ—Г—Е–Њ–ї–µ–є, –Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –љ–∞ –Њ—Ж–µ–љ–Ї–∞—Е —Б—В–µ–њ–µ–љ–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є (–Љ–Є—В–Њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞) –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—В–Є–≤–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ–њ—Г—Е–Њ–ї–Є, –Ї–Њ—В–Њ—А—Г—О –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Њ–Ї—А–∞—И–Є–≤–∞–љ–Є—П –љ–∞ –Љ–∞—А–Ї–µ—А –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є Ki-67 (—В–∞–±–ї. 4) [5].
![–Ґ–∞–±–ї–Є—Ж–∞ 4. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Є –≥—А–∞–і–∞—Ж–Є—П –Я–∞–љ–Э–≠–Э (–Т–Ю–Ч, 2017 –≥.) [5] –Ґ–∞–±–ї–Є—Ж–∞ 4. –Ъ–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Є –≥—А–∞–і–∞—Ж–Є—П –Я–∞–љ–Э–≠–Э (–Т–Ю–Ч, 2017 –≥.) [5]](/upload/medialibrary/900/25-4.png)
–Ф–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–µ–Ј —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ —Б–њ–µ–Ї—В—А –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Б–Њ—Б—В–Њ—П–љ–Є–є –і–ї—П –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –і–Њ–≤–Њ–ї—М–љ–Њ —И–Є—А–Њ–Ї. –°—А–µ–і–Є –њ—А–Є—З–Є–љ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є —Г –≤–Ј—А–Њ—Б–ї—Л—Е –≤—Л–і–µ–ї—П—О—В (–њ–Њ [6]):
-
–њ—А–Є–µ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ (—Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й–Є–µ —Б—А–µ–і—Б—В–≤–∞, –≥–ї—О–Ї–∞–≥–Њ–љ (–≤–Њ –≤—А–µ–Љ—П —Н–љ–і–Њ—Б–Ї–Њ–њ–Є–Є), –Є–љ–і–∞–Љ–µ—В–∞—Ж–Є–љ, —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ—Л, —Б—Г–ї—М—Д–Њ–љ–Є–ї–∞–Љ–Є–і—Л, —Б–∞–ї–Є—Ж–Є–ї–∞—В—Л, –Є–Р–Я–§, –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л ќ≤-–∞–і—А–µ–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, –Є–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ 1 –Є –і—А.);
-
–∞–ї–Ї–Њ–≥–Њ–ї—М;
-
–њ–µ—З–µ–љ–Њ—З–љ—Г—О, –њ–Њ—З–µ—З–љ—Г—О –Є–ї–Є —Б–µ—А–і–µ—З–љ—Г—О –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М;
-
—Б–µ–њ—Б–Є—Б, —В—А–∞–≤–Љ—Г, –Њ–ґ–Њ–≥–Є;
-
–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ;
-
–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л–є –і–µ—Д–Є—Ж–Є—В (–Ї–Њ—А—В–Є–Ј–Њ–ї, –≥–ї—О–Ї–∞–≥–Њ–љ, –∞–і—А–µ–љ–∞–ї–Є–љ);
-
–Њ–њ—Г—Е–Њ–ї–Є –љ–µ–Њ—Б—В—А–Њ–≤–Ї–Њ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї (–Њ–њ—Г—Е–Њ–ї–Є, —Б–µ–Ї—А–µ—В–Є-—А—Г—О—Й–Є–µ –Є–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ—Л–є —Д–∞–Ї—В–Њ—А —А–Њ—Б—В–∞ 2);
-
–Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Г (–Њ–њ—Г—Е–Њ–ї–Є, —Б–µ–Ї—А–µ—В–Є—А—Г—О—Й–Є–µ –Є–љ—Б—Г–ї–Є–љ);
-
–њ–∞–љ–Ї—А–µ–∞—В–Њ–≥–µ–љ–љ—Г—О –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—О, –љ–µ —Б–≤—П–Ј–∞–љ–љ—Г—О —Б –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–Њ–є (–љ–µ–Ј–Є–і–Є–Њ–±–ї–∞—Б—В–Њ–Ј);
-
–Њ–њ–µ—А–∞—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —И—Г–љ—В–Є—А–Њ–≤–∞–љ–Є—П;
-
–∞–љ—В–Є—В–µ–ї–∞ –Ї –Є–љ—Б—Г–ї–Є–љ—Г –Є–ї–Є –∞–љ—В–Є—В–µ–ї–∞ –Ї —А–µ—Ж–µ–њ—В–Њ—А—Г –Є–љ—Б—Г–ї–Є–љ–∞ (–±–Њ–ї–µ–Ј–љ—М –•–Є—А–∞—В–∞, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї–∞ –Є–ї–Є ќ±-–ї–Є–њ–Њ–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л);
-
—Б–ї—Г—З–∞–є–љ–Њ —Б–Ї—А—Л—В—Г—О –Є–ї–Є –њ—А–µ–і–љ–∞–Љ–µ—А–µ–љ–љ—Г—О –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—О;
-
–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П (–Љ—Г—В–∞—Ж–Є—П –≤ –≥–µ–љ–µ ABCC8).
–Я—А–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—О, —Б–≤—П–Ј–∞–љ–љ—Г—О —Б –њ—А–Є–µ–Љ–Њ–Љ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е —Б—А–µ–і—Б—В–≤, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–Є—Е —Б–µ–Ї—А–µ—Ж–Є—О –Є–љ—Б—Г–ї–Є–љ–∞, вАФ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е —Б—Г–ї—М—Д–Њ–љ–Є–ї–Љ–Њ—З–µ–≤–Є–љ—Л, –Љ–µ–≥–ї–Є—В–Є–љ–Є–і–Њ–≤ –Є–ї–Є –≤–≤–µ–і–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–∞, –∞ —В–∞–Ї–ґ–µ –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ —Б–ї—Г—З–∞–Є –њ—А–Є –њ—А–Є–µ–Љ–µ –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е ќ≤-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –Р–Я–§, —Д—В–Њ—А—Е–Є–љ–Њ–ї–Њ–љ–Њ–≤—Л—Е –∞–љ—В–Є–±–Є–Њ—В–Є–Ї–Њ–≤ (—Ж–Є–њ—А–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞, –ї–µ–≤–Њ—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞, –Љ–Њ–Ї—Б–Є—Д–ї–Њ–Ї—Б–∞—Ж–Є–љ–∞) –Є –њ—А–Њ—В–Є–≤–Њ–≥—А–Є–±–Ї–Њ–≤–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –њ–µ–љ—В–∞–Љ–Є–і–Є–љ–∞ [6, 8, 9]. –†–Є—Б–Ї –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –њ–Њ–≤—Л—И–∞–µ—В—Б—П –њ—А–Є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–µ—З–µ–љ–Є, —Б–µ–њ—Б–Є—Б–µ, —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞—Е –њ–Є—Й–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П, —Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–Є –∞–ї–Ї–Њ–≥–Њ–ї—П –Є –љ–∞—А–Ї–Њ—В–Є–Ї–Њ–≤, –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–є –±–∞—А–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є [6, 11]. –Ґ–∞–Ї–ґ–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–∞—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Б –Є–љ—Б—Г–ї–Є–љ–Њ–≤—Л–Љ –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, –і–ї—П –Ї–Њ—В–Њ—А–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –љ–∞–ї–Є—З–Є–µ –∞–љ—В–Є—В–µ–ї –Ї –Є–љ—Б—Г–ї–Є–љ—Г –Є/–Є–ї–Є –њ—А–Њ–Є–љ—Б—Г–ї–Є–љ—Г, –Є–ї–Є —А–µ—Ж–µ–њ—В–Њ—А—Г –Є–љ—Б—Г–ї–Є–љ–∞ —Г –ї–Є—Ж, —А–∞–љ–µ–µ –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —Н–Ї–Ј–Њ–≥–µ–љ–љ—Л–є –Є–љ—Б—Г–ї–Є–љ [6, 12]. –Т–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —Б—Г–ї—М—Д–≥–Є–і—А–Є–ї—М–љ—Г—О –≥—А—Г–њ–њ—Г, —В–∞–Ї–Є—Е –Ї–∞–Ї –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї –Є–ї–Є ќ±-–ї–Є–њ–Њ–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞, –Ї–Њ—В–Њ—А–∞—П —В–∞–Ї–ґ–µ —Б–Њ–і–µ—А–ґ–Є—В —Б–µ—А—Г, –Љ–Њ–ґ–µ—В –≤—Л–Ј–≤–∞—В—М –Є–љ—Б—Г–ї–Є–љ–Њ–≤—Л–є –∞—Г—В–Њ–Є–Љ–Љ—Г–љ–љ—Л–є —Б–Є–љ–і—А–Њ–Љ. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ —Б—Г–ї—М—Д–≥–Є–і—А–Є–ї—М–љ–∞—П –≥—А—Г–њ–њ–∞ —А–∞–Ј—А—Г—И–∞–µ—В –і–Є—Б—Г–ї—М—Д–Є–і–љ—Г—О —Б–≤—П–Ј—М –Є–љ—Б—Г–ї–Є–љ–∞, —Г–≤–µ–ї–Є—З–Є–≤–∞—П –µ–µ –Є–Љ–Љ—Г–љ–Њ–≥–µ–љ–љ–Њ—Б—В—М [6].
–Ы–µ—З–µ–љ–Є–µ –Є–љ—Б—Г–ї–Є–љ–Њ–Љ
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ —А–∞–і–Є–Ї–∞–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ –Я–Ц —П–≤–ї—П–µ—В—Б—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є–є, –∞ –Є–Љ–µ–љ–љ–Њ —Н–љ—Г–Ї–ї–µ–∞—Ж–Є—П –Њ–њ—Г—Е–Њ–ї–Є –Є–ї–Є —А–µ–Ј–µ–Ї—Ж–Є—П —З–∞—Б—В–Є –ґ–µ–ї–µ–Ј—Л, –њ–Њ—Н—В–Њ–Љ—Г –≤–∞–ґ–љ–∞ —В–Њ—З–љ–∞—П –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є—П –Њ–њ—Г—Е–Њ–ї–Є –і–Њ –Є–ї–Є –≤–Њ –≤—А–µ–Љ—П –Њ–њ–µ—А–∞—Ж–Є–Є. –Ю–њ–µ—А–∞—Ж–Є—П –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –њ–Њ–ї–љ–Њ–µ –Є–Ј–ї–µ—З–µ–љ–Є–µ. –Ю–і–љ–∞–Ї–Њ —Н—В–Њ –і–Њ–ї–ґ–љ–Њ –≤—Л–њ–Њ–ї–љ—П—В—М—Б—П —В–Њ–ї—М–Ї–Њ —В–Њ–≥–і–∞, –Ї–Њ–≥–і–∞ –і–Є–∞–≥–љ–Њ–Ј —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ, –Є —В–Њ–ї—М–Ї–Њ —Е–Є—А—Г—А–≥–Њ–Љ, –Ї–Њ—В–Њ—А—Л–є –Є–Љ–µ–µ—В –Њ–њ—Л—В –≤ —Е–Є—А—Г—А–≥–Є–Є –Я–Ц. –Ш–љ—Б—Г–ї–Є–љ–Њ–Љ—Л –Њ–±—Л—З–љ–Њ —Г–і–∞–ї—П—О—В—Б—П –њ—Г—В–µ–Љ —Н–љ—Г–Ї–ї–µ–∞—Ж–Є–Є –Њ–њ—Г—Е–Њ–ї–Є, —А–µ–і–Ї–Њ –Њ–њ—Г—Е–Њ–ї–Є –≤ –≥–Њ–ї–Њ–≤–Ї–µ –Я–Ц —В—А–µ–±—Г—О—В –њ–∞–љ–Ї—А–µ–∞—В–Њ–і—Г–Њ–і–µ–љ—Н–Ї—В–Њ–Љ–Є–Є. –Ф–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –ї–∞–њ–∞—А–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–∞—П –Є–ї–Є —А–Њ–±–Њ—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–∞—П —Н–љ—Г–Ї–ї–µ–∞—Ж–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л –≤–Њ–Ј–Љ–Њ–ґ–љ–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –µ—Б–ї–Є –њ–Њ—А–∞–ґ–µ–љ–Є–µ –≤–Є–Ј—Г–∞–ї–Є–Ј–Є—А—Г–µ—В—Б—П –і–Њ –Њ–њ–µ—А–∞—Ж–Є–Є –љ–∞ –Ъ–Ґ –Є–ї–Є –£–Ч–Ш [1, 11]. –Ъ–Њ–≥–і–∞ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—О –Љ–Њ–ґ–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —В–Њ–ї—М–Ї–Њ —Б –њ–Њ–Љ–Њ—Й—М—О –і–Є–µ—В—Л –Є–ї–Є –љ–µ–±–Њ–ї—М—И–Є—Е, —Е–Њ—А–Њ—И–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ—Л—Е –і–Њ–Ј –і–Є–∞–Ј–Њ–Ї—Б–Є–і–∞, –Є/–Є–ї–Є –Ї–Њ–≥–і–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ј–і–Њ—А–Њ–≤—М—П –њ–∞—Ж–Є–µ–љ—В–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞, –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Њ —В–Њ–ї—М–Ї–Њ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ. –Ъ–Њ–љ—Б–µ—А–≤–∞—В–Є–≤–љ–∞—П —В–∞–Ї—В–Є–Ї–∞ –њ—А–Є –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є–љ—Б—Г–ї–Є–љ–∞–Љ–∞—Е –≤–Ї–ї—О—З–∞–µ—В –≤ —Б–µ–±—П –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —А–∞—Ж–Є–Њ–љ–∞ –њ–Є—В–∞–љ–Є—П —Б –≤–Ї–ї—О—З–µ–љ–Є–µ–Љ –ї–µ–≥–Ї–Є—Е —Г–≥–ї–µ–≤–Њ–і–Њ–≤ –Є–ї–Є –љ–µ—А–∞—Д–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л—Е —Г–≥–ї–µ–≤–Њ–і–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –і–∞—О—В —В–∞–Ї —З–∞—Б—В–Њ, –Ї–∞–Ї —В—А–µ–±—Г–µ—В—Б—П –і–ї—П –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є—П –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є. –Э–µ—А–µ–і–Ї–Њ –њ–∞—Ж–Є–µ–љ—В—Л –Љ–Њ–≥—Г—В –Є–Ј–±–µ–ґ–∞—В—М —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –≤ —В–µ—З–µ–љ–Є–µ —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–µ—А–Є–Њ–і–Њ–≤ –≤—А–µ–Љ–µ–љ–Є, —Б–Њ–Ї—А–∞—Й–∞—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —З–∞—Б–Њ–≤ –Љ–µ–ґ–і—Г –њ—А–Є–µ–Љ–∞–Љ–Є –њ–Є—Й–Є. –Ф–ї—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П –њ–µ—А–µ–і —Б–љ–Њ–Љ (–≤ 23:00); –і–ї—П –і—А—Г–≥–Є—Е –љ–µ–Њ–±—Е–Њ–і–Є–Љ –њ–µ—А–µ–Ї—Г—Б –≤ —Б–µ—А–µ–і–Є–љ–µ —Г—В—А–∞, –≤ —Б–µ—А–µ–і–Є–љ–µ –і–љ—П –Є/–Є–ї–Є –љ–Њ—З—М—О –≤ 3:00. –Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л –±–Њ–ї–µ–µ –Љ–µ–і–ї–µ–љ–љ–Њ —Г—Б–≤–∞–Є–≤–∞–µ–Љ—Л–µ —Д–Њ—А–Љ—Л —Г–≥–ї–µ–≤–Њ–і–Њ–≤ (–љ–∞–њ—А–Є–Љ–µ—А, –Ї—А–∞—Е–Љ–∞–ї—Л, —Е–ї–µ–±, –Ї–∞—А—В–Њ—Д–µ–ї—М, —А–Є—Б). –Т–Њ –≤—А–µ–Љ—П —Н–њ–Є–Ј–Њ–і–Њ–≤ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –і–ї—П –Є—Е –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –ї–µ–≥–Ї–Њ—Г—Б–≤–Њ—П–µ–Љ—Л–µ —Г–≥–ї–µ–≤–Њ–і—Л –±—Л—Б—В—А–Њ (–љ–∞–њ—А–Є–Љ–µ—А, —Д—А—Г–Ї—В–Њ–≤—Л–µ —Б–Њ–Ї–Є —Б –і–Њ–±–∞–≤–ї–µ–љ–Є–µ–Љ –≥–ї—О–Ї–Њ–Ј—Л –Є–ї–Є —Б–∞—Е–∞—А–Њ–Ј—Л) [1].
–Ю—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Є –њ—А–Њ–≥–љ–Њ–Ј
–Ю—Б–ї–Њ–ґ–љ–µ–љ–Є—П, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–Њ–є, –≤–Ї–ї—О—З–∞—О—В —Б—В–Њ–є–Ї—Г—О –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—О, –≤—Л–Ј—Л–≤–∞—О—Й—Г—О –љ–∞—А—Г—И–µ–љ–Є—П –њ–Њ–≤—Б–µ–і–љ–µ–≤–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–µ –љ–µ–є—А–Њ–Ї–Њ–≥–љ–Є—В–Є–≤–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Є —Б–Љ–µ—А—В—М. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–Њ–є 10-–ї–µ—В–љ—П—П –≤—Л–ґ–Є–≤–∞–µ-–Љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–ї—П–µ—В 88% –њ–Њ—Б–ї–µ —Г—Б–њ–µ—И–љ–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Г–і–∞–ї–µ–љ–Є—П, 87,5% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј–ї–µ—З–Є–≤–∞—О—В—Б—П (–±–µ–Ј —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –љ–µ –Љ–µ–љ–µ–µ 6 –Љ–µ—Б.) –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є. –Я–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–Љ –і–∞–љ–љ—Л–Љ, 10-–ї–µ—В–љ—П—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М –њ—А–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞—Е —Б–Њ—Б—В–∞–≤–ї—П–µ—В 29% –њ–Њ—Б–ї–µ —Г—Б–њ–µ—И–љ–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Я–∞—Ж–Є–µ–љ—В—Л —Б —Б–Є–љ–і—А–Њ–Љ–Њ–Љ M–≠–Э-1 –Є–ї–Є —Б–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б-—В–≤–µ–љ–љ—Л–Љ–Є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞–Љ–Є –Є–Љ–µ—О—В –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї—Г—О —З–∞—Б—В–Њ—В—Г –љ–µ—Г–і–∞—З–љ—Л—Е –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є –Є–ї–Є —А–µ—Ж–Є–і–Є–≤–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –І–∞—Б—В–Њ—В–∞ —А–µ—Ж–Є–і–Є–≤–Њ–≤ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б M–≠–Э-1 —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 21% –≤ —В–µ—З–µ–љ–Є–µ 10 –Є 20 –ї–µ—В, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±–µ–Ј M–≠–Э-1 —Б–Њ–Њ–±—Й–∞–µ—В—Б—П –Њ 5% —А–µ—Ж–Є–і–Є–≤–Њ–≤ –≤ —В–µ—З–µ–љ–Є–µ 10 –ї–µ—В –Є 7% —А–µ—Ж–Є–і–Є–≤–Њ–≤ вАФ –≤ —В–µ—З–µ–љ–Є–µ 20 –ї–µ—В [13].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ
–Я–∞—Ж–Є–µ–љ—В–Ї–∞ –Э., 73 –≥–Њ–і–∞, –њ–Њ—Б—В—Г–њ–Є–ї–∞ –≤ –§–У–С–£–Ч –Ч–°–Ь–¶ –§–Ь–С–Р –†–Њ—Б—Б–Є–Є (–≥. –Ю–Љ—Б–Ї) —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ —Б–ї–∞–±–Њ—Б—В—М, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, —Н–њ–Є–Ј–Њ–і—Л –њ–Њ—В–µ—А–Є —Б–Њ–Ј–љ–∞–љ–Є—П, —Б–Њ–љ–ї–Є–≤–Њ—Б—В—М.
–°—З–Є—В–∞–µ—В —Б–µ–±—П –±–Њ–ї—М–љ–Њ–є —Б –Є—О–љ—П 2022 –≥., –Ї–Њ–≥–і–∞ –љ–∞ —Д–Њ–љ–µ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П —Б—В–∞–ї–∞ –Њ—В–Љ–µ—З–∞—В—М —Н–њ–Є–Ј–Њ–і—Л –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –Њ–±—Й–µ–є —Б–ї–∞–±–Њ—Б—В–Є, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є—П, –њ–Њ—П–≤–ї–µ–љ–Є–µ –Ї–Њ—В–Њ—А—Л—Е –Њ–±—К—П—Б–љ—П–ї–∞ –њ—А–Њ–њ—Г—Б–Ї–Њ–Љ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є (–њ—А–Є–Љ–µ—А–љ–Њ 6-—З–∞—Б–Њ–≤–Њ–µ –≥–Њ–ї–Њ–і–∞–љ–Є–µ), –∞ –њ–Њ–ї–љ–Њ–µ —Г—Б—В—А–∞–љ–µ–љ–Є–µ —Б–≤—П–Ј—Л–≤–∞–ї–∞ —Б –њ—А–Є–µ–Љ–Њ–Љ –њ–Є—Й–Є. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –≤ —В–µ—З–µ–љ–Є–µ 1вАУ1,5 –Љ–µ—Б. –њ–∞—Ж–Є–µ–љ—В–Ї–∞ —Г–≤–µ–ї–Є—З–Є–ї–∞ –Ї—А–∞—В–љ–Њ—Б—В—М –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –і–Њ 5вАУ6 —А–∞–Ј –і–µ–љ—М, –љ–∞ —Д–Њ–љ–µ —З–µ–≥–Њ –Њ—В–Љ–µ—В–Є–ї–∞ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞. –Т –Є—О–ї–µ 2022 –≥. –≤–њ–µ—А–≤—Л–µ –њ—А–Є –њ—А–Њ–њ—Г—Б–Ї–µ –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є –≤ –Њ–±–µ–і –≤–Њ–Ј–љ–Є–Ї —Н–њ–Є–Ј–Њ–і —А–µ–Ј–Ї–Њ–є —Б–ї–∞–±–Њ—Б—В–Є, –љ–∞—А—Г—И–µ–љ–Є—П –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є–Є –і–≤–Є–ґ–µ–љ–Є–є –Є –њ–Њ—В–µ—А–Є —Б–Њ–Ј–љ–∞–љ–Є—П. –°–Њ —Б–ї–Њ–≤ –њ–∞—Ж–Є–µ–љ—В–Ї–Є, –Њ—З–љ—Г–ї–∞—Б—М –≥–ї—Г–±–Њ–Ї–Є–Љ –≤–µ—З–µ—А–Њ–Љ, —А–∞—Б—Ж–µ–љ–Є–≤ –≤—А–µ–Љ—П —Б—Г—В–Њ–Ї –Ї–∞–Ї —А–∞–љ–љ–µ–µ —Г—В—А–Њ. –Т —Б–≤—П–Ј–Є —Б —Г–Ї–∞–Ј–∞–љ–љ—Л–Љ–Є –ґ–∞–ї–Њ–±–∞–Љ–Є –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –Њ–±—А–∞—В–Є–ї–∞—Б—М –Ј–∞ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й—М—О –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ, –±—Л–ї–∞ –Ї–Њ–љ—Б—Г–ї—М—В–Є—А–Њ–≤–∞–љ–∞ –љ–µ–≤—А–Њ–ї–Њ–≥–Њ–Љ, –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–∞ (–≤–Ї–ї—О—З–∞—П –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞). –Т–≤–Є–і—Г –Њ—В—Б—Г—В—Б—В–≤–Є—П –і–∞–љ–љ—Л—Е –Ј–∞ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –њ–∞—В–Њ–ї–Њ–≥–Є—О –±—Л–ї–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –љ–∞–±–ї—О–і–µ–љ–Є–µ –Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Г —В–µ—А–∞–њ–µ–≤—В–∞, —З–µ–Љ –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –њ—А–µ–љ–µ–±—А–µ–≥–ї–∞. –І–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –љ–µ–і–µ–ї—М –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –±—Л–ї–∞ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ –±—А–Є–≥–∞–і–Њ–є —Б–Ї–Њ—А–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є, –≤—Л–Ј–≤–∞–љ–љ–Њ–є —Б–Њ—Б–µ–і—П–Љ–Є –њ–Њ –њ–Њ–і—К–µ–Ј–і—Г, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –њ–∞—Ж–Є–µ–љ—В–Ї—Г —Б—В–Њ—П—Й–µ–є –љ–∞ —Г–ї–Є—Ж–µ –±–Њ—Б–Є–Ї–Њ–Љ, –љ–µ –Њ—А–Є–µ–љ—В–Є—А—Г—О—Й–µ–є—Б—П –≤ –Љ–µ—Б—В–µ –њ—А–µ–±—Л–≤–∞–љ–Є—П –Є –њ–ї–Њ—Е–Њ –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–µ–є –Ї–Њ–љ—В–∞–Ї—В. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –і–Њ–Ї—Г–Љ–µ–љ—В–∞—Ж–Є–Є, –±—Л–ї–∞ –≤–њ–µ—А–≤—Л–µ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є—П —Б —Г—А–Њ–≤–љ–µ–Љ –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є <1,1 –Љ–Љ–Њ–ї—М/–ї. –Я–Њ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –≤ —Б—В–∞—Ж–Є–Њ–љ–∞—А–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –Ї–Њ–ї–µ–±–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л –Њ—В 1,7 –і–Њ 6,6 –Љ–Љ–Њ–ї—М/–ї. –С—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –Ь–°–Ъ–Ґ –Њ—А–≥–∞–љ–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є, –≤—Л—П–≤–ї–µ–љ–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —В–µ–ї–∞ –Я–Ц. –Ю—В –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –Њ—В–Ї–∞–Ј–∞–ї–∞—Б—М –Є –±—Л–ї–∞ –≤—Л–њ–Є—Б–∞–љ–∞ —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є —Б–Њ–±–ї—О–і–µ–љ–Є—П –і—А–Њ–±–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞ –њ–Є—В–∞–љ–Є—П –Є —А–∞–Ј—К—П—Б–љ–µ–љ–Є—П–Љ–Є —Б–њ–Њ—Б–Њ–±–Њ–≤ –≤—Л—П–≤–ї–µ–љ–Є—П –Є –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –Э. –њ–µ—А–Є–Њ–і–Є—З–µ—Б–Ї–Є –Њ—В–Љ–µ—З–∞–ї–∞ —Н–њ–Є–Ј–Њ–і—Л –ї–µ–≥–Ї–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–љ—Л—Е –≤–µ—А–Њ—П—В–љ—Л—Е –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –Ї—Г–њ–Є—А–Њ–≤–∞–ї–∞ –њ—А–Є–µ–Љ–Њ–Љ —Г–≥–ї–µ–≤–Њ–і–Њ–≤, —Г—А–Њ–≤–µ–љ—М –≥–ї–Є–Ї–µ–Љ–Є–Є –њ—А–Є —Н—В–Њ–Љ –љ–µ –Њ–њ—А–µ–і–µ–ї—П–ї–∞. –І–µ—А–µ–Ј 1 –Љ–µ—Б. –њ–∞—Ж–Є–µ–љ—В–Ї–∞ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ –Њ–±—А–∞—В–Є–ї–∞—Б—М –і–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –њ–ї–∞–љ–Њ–≤–Њ–≥–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б-–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≤ –§–У–С–£–Ч –Ч–°–Ь–¶ –§–Ь–С–Р –†–Њ—Б—Б–Є–Є.
–Ш–Ј –∞–љ–∞–Љ–љ–µ–Ј–∞ –ґ–Є–Ј–љ–Є: –Њ—В—П–≥–Њ—Й–µ–љ–љ–∞—П –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ–Њ—Б—В—М –њ–Њ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ (—Г –Њ—В—Ж–∞ –Є –і–µ–і–∞ –њ–Њ –ї–Є–љ–Є–Є –Њ—В—Ж–∞ вАФ —А–∞–Ї –ґ–µ–ї—Г–і–Ї–∞), —А–∞–љ–љ–Є–є –Ї–ї–Є–Љ–∞–Ї—Б (–≤ 39 –ї–µ—В), –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П (–≤ —В–µ—З–µ–љ–Є–µ 20 –ї–µ—В; –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ (–Р–Ф) 160/100 –Љ–Љ —А—В. —Б—В., –∞–і–∞–њ—В–Є—А–Њ–≤–∞–љ–љ–Њ–µ –Р–Ф 130/80 –Љ–Љ —А—В. —Б—В.; –њ–Њ—Б—В–Њ—П–љ–љ—Л–є –њ—А–Є–µ–Љ –≤ —В–µ—З–µ–љ–Є–µ 3 –ї–µ—В –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є: –Є–љ–і–∞–њ–∞–Љ–Є–і 1,5 –Љ–≥, —В–Њ—А–∞—Б–µ–Љ–Є–і 5 –Љ–≥, –±–Є—Б–Њ–њ—А–Њ–ї–Њ–ї 5 –Љ–≥, –ї–Њ–Ј–∞—А—В–∞–љ 100 –Љ–≥/—Б—Г—В. –Я—А–Є —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–Љ –Њ—Б–Љ–Њ—В—А–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є —А–∞—Б—Ж–µ–љ–µ–љ–Њ –Ї–∞–Ї —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ–Њ–µ, —Б–Њ–Ј–љ–∞–љ–Є–µ —П—Б–љ–Њ–µ, –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ–µ. –Ш–Ј –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞: –Є–Ј–±—Л—В–Њ—З–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ, —А–Њ—Б—В 154 —Б–Љ, –Љ–∞—Б—Б–∞ —В–µ–ї–∞ 106,3 –Ї–≥ (–Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ 46,2 –Ї–≥/–Љ2), –Ї–Њ–ґ–љ—Л–µ –њ–Њ–Ї—А–Њ–≤—Л —Г–Љ–µ—А–µ–љ–љ–Њ–є –≤–ї–∞–ґ–љ–Њ—Б—В–Є, –≥–Є–њ–µ—А–њ–Є–≥–Љ–µ–љ—В–∞—Ж–Є—П –Ї–Њ–ґ–Є –≤ –Њ–±–ї–∞—Б—В–Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л—Е —Б–Ї–ї–∞–і–Њ–Ї (—З–µ—А–љ—Л–є –∞–Ї–∞–љ—В–Њ–Ј), –ї–Є–њ–Њ–Љ–∞ –≤ –Њ–±–ї–∞—Б—В–Є –≤–µ—А—Е–љ–µ–є —В—А–µ—В–Є —Б–њ–Є–љ—Л –Њ–Ї–Њ–ї–Њ 10 —Б–Љ –≤ –і–Є–∞–Љ–µ—В—А–µ; –Р–Ф 120/80 –Љ–Љ —А—В. —Б—В.; –ґ–Є–≤–Њ—В –њ—А–∞–≤–Є–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л, —Г–≤–µ–ї–Є—З–µ–љ –Ј–∞ —Б—З–µ—В –њ–Њ–і–Ї–Њ–ґ–љ–Њ-–ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є, –Њ—В–µ–Ї–Њ–≤ –љ–µ—В. –Я—А–Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤ –Њ–±—Й–µ–Љ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є, –Њ–±—Й–µ–Љ –∞–љ–∞–ї–Є–Ј–µ –Љ–Њ—З–Є, –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –Ї—А–Њ–≤–Є, –Ї–Њ–∞–≥—Г–ї–Њ–≥—А–∞–Љ–Љ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–є –Њ—В –љ–Њ—А–Љ—Л –љ–µ –≤—Л—П–≤–ї–µ–љ–Њ. –Я—А–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –≥–ї–Є–Ї–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П (–≥–ї—О–Ї–Њ–Ј–∞ –њ–ї–∞–Ј–Љ—Л –Ї–∞–њ–Є–ї–ї—П—А–љ–Њ–є –Ї—А–Њ–≤–Є) –≤—Л—П–≤–ї—П–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –љ–Є–Ј–Ї–Њ–љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –≥–ї–Є–Ї–µ–Љ–Є–Є, —Н–њ–Є–Ј–Њ–і –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–є –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є (—В–∞–±–ї. 5).

–Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ь–°–Ъ–Ґ –Њ—А–≥–∞–љ–Њ–≤ –±—А—О—И–љ–Њ–є –њ–Њ–ї–Њ—Б—В–Є —Б –≤–љ—Г—В—А–Є–≤–µ–љ–љ—Л–Љ –±–Њ–ї—О—Б–љ—Л–Љ —Г—Б–Є–ї–µ–љ–Є–µ–Љ (—Г–ї—М—В—А–∞–≤–Є—Б—В 370вАУ100 –Љ–ї) –≤ –Ј–∞–і–љ–µ–≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–∞—Е —В–µ–ї–∞ –Я–Ц –≤—Л—П–≤–ї–µ–љ–Њ –Њ—З–∞–≥–Њ–≤–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —Б –і–Њ–≤–Њ–ї—М–љ–Њ —З–µ—В–Ї–Є–Љ–Є —А–Њ–≤–љ—Л–Љ–Є –Ї–Њ–љ—В—Г—А–∞–Љ–Є, –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—Б—В—Г–њ–∞—О—Й–µ–µ –Ј–∞ –љ–∞—А—Г–ґ–љ—Л–є –Ї–Њ–љ—В—Г—А –ґ–µ–ї–µ–Ј—Л, –љ–µ –≤—Л–Ј—Л–≤–∞—О—Й–µ–µ –Њ–±—Б—В—А—Г–Ї—Ж–Є—О –≤–Є—А—Б—Г–љ–≥–Њ–≤–∞ –њ—А–Њ—В–Њ–Ї–∞, –њ—А–Є–Љ–µ—А–љ—Л–Љ–Є —А–∞–Ј–Љ–µ—А–∞–Љ–Є –і–Њ 23,5√Ч20√Ч20 –Љ–Љ. –Ю–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –Є–Ј–Њ–і–µ–љ—Б–љ–Њ –њ–∞—А–µ–љ—Е–Є–Љ–µ –ґ–µ–ї–µ–Ј—Л –≤ –љ–∞—В–Є–≤–љ—Г—О —Д–∞–Ј—Г (–і–Њ 35 –µ–і–Є–љ–Є—Ж –•–∞—Г–љ—Б—Д–Є–ї–і–∞ (HU)), –Њ–і–љ–Њ—А–Њ–і–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л, –њ—А–Є –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–Љ —Г—Б–Є–ї–µ–љ–Є–Є —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ –љ–∞–Ї–∞–њ–ї–Є–≤–∞–ї–Њ –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–є –њ—А–µ–њ–∞—А–∞—В —Б –њ–Є–Ї–Њ–Љ –Ї–Њ–љ—В—А–∞—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤ –∞—А—В–µ—А–Є–∞–ї—М–љ—Г—О —Д–∞–Ј—Г (–і–Њ 132вАУ140 HU); –≤ –њ–Њ—А—В–∞–ї—М–љ—Г—О —Д–∞–Ј—Г –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –≤—Л–≥–ї—П–і–µ–ї–Њ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≥–Є–њ–µ—А–і–µ–љ—Б–љ—Л–Љ (110вАУ116 HU); –≤ –Њ—В—Б—А–Њ—З–µ–љ–љ—Г—О —Д–∞–Ј—Г –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞–ї–Њ—Б—М. –Я–µ—А–Є—Д–Њ–Ї–∞–ї—М–љ–Њ —В–Ї–∞–љ—М –Я–Ц –љ–µ –Є–Ј–Љ–µ–љ–µ–љ–∞, –њ–∞—А–∞–њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–∞—П –Ї–ї–µ—В—З–∞—В–Ї–∞ –љ–µ –Є–љ—Д–Є–ї—М—В—А–Є—А–Њ–≤–∞–љ–∞ (—А–Є—Б. 1).

–° —Г—З–µ—В–Њ–Љ –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е –Ї–ї–Є–љ–Є–Ї–Њ-–ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –і–∞–љ–љ—Л—Е –±—Л–ї–∞ –њ—А–Њ–≤–µ–і–µ–љ–∞ –њ—А–Њ–±–∞ —Б –≥–Њ–ї–Њ–і–∞–љ–Є–µ–Љ, –≤–Њ –≤—А–µ–Љ—П –Ї–Њ—В–Њ—А–Њ–є —Г –њ–∞—Ж–Є–µ–љ—В–Ї–Є –њ—А–Њ—П–≤–Є–ї–∞—Б—М —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є (—А–µ–Ј–Ї–∞—П —Б–ї–∞–±–Њ—Б—В—М, –њ–Њ—В–ї–Є–≤–Њ—Б—В—М, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, –љ–∞—А—Г—И–µ–љ–Є–µ —Б–Њ–Ј–љ–∞–љ–Є—П) –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 3 —З –њ—А–Њ–±—Л, —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л —Б–љ–Є–Ј–Є–ї—Б—П –і–Њ 2,5 –Љ–Љ–Њ–ї—М/–ї. –†–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—Ж–µ–љ–Ї–Є —Г—А–Њ–≤–љ—П –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Ї—А–Њ–≤–Є –≤–Њ –≤—А–µ–Љ—П –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є: –Є–љ—Б—Г–ї–Є–љ 406 –Љ–Х–і/–Љ–ї (–љ–Њ—А–Љ–∞ 2,3вАУ28,4 –Љ–Х–і/–Љ–ї), –°-–њ–µ–њ—В–Є–і 17,1 –љ–≥/–Љ–ї (–љ–Њ—А–Љ–∞ 0,78вАУ5,19 –љ–≥/–Љ–ї), –°–Р 19вАУ9 2,0 –Ь–Х/–Љ–ї (–љ–Њ—А–Љ–∞ 0вАУ37 –Ь–Х/–Љ–ї), –њ—А–Њ–Є–љ—Б—Г–ї–Є–љ 147,6 –њ–Љ–Њ–ї—М/–Љ–ї (–љ–Њ—А–Љ–∞ 0,7вАУ4,3 –њ–Љ–Њ–ї—М/–Љ–ї).
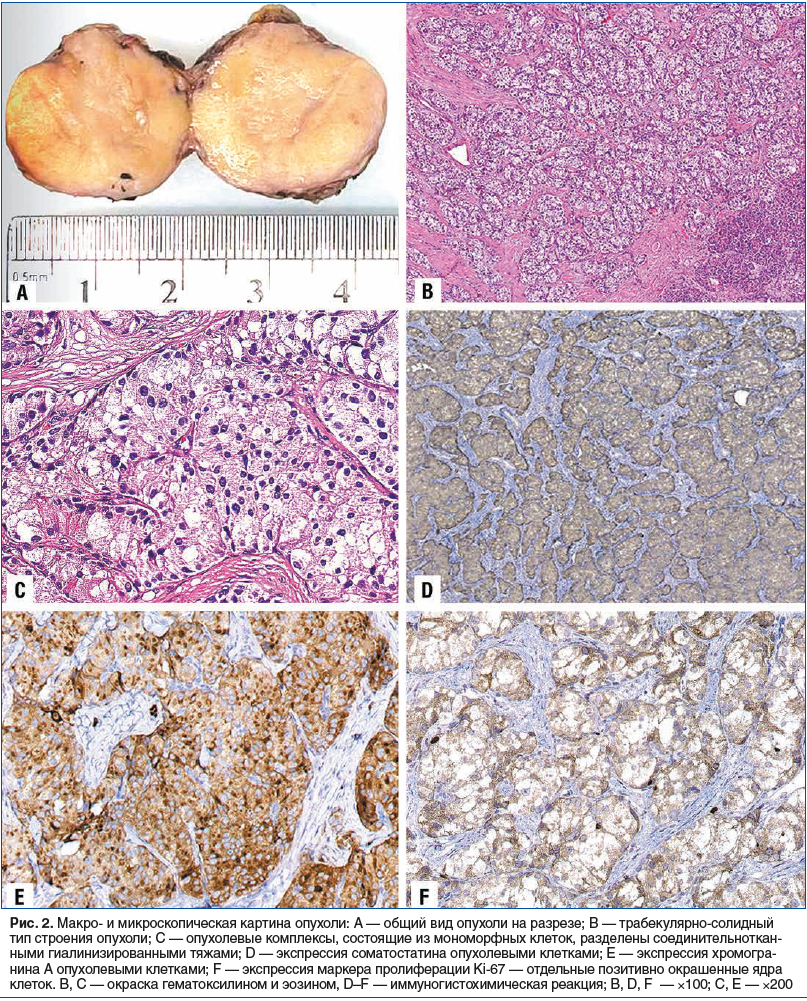
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є—Е, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е, –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ-–Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –і–∞–љ–љ—Л—Е –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –і–Є–∞–≥–љ–Њ–Ј –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л. –Я–∞—Ж–Є–µ–љ—В–Ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ вАФ –∞—В–Є–њ–Є—З–љ–∞—П —А–µ–Ј–µ–Ї—Ж–Є—П –Я–Ц. –£–і–∞–ї–µ–љ–љ–∞—П –Њ–њ—Г—Е–Њ–ї—М –±—Л–ї–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —Е–Њ—А–Њ—И–Њ –Њ—В–≥—А–∞–љ–Є—З–µ–љ–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –Њ–Ї—А—Г–≥–ї–Њ–є —Д–Њ—А–Љ—Л –і–Є–∞–Љ–µ—В—А–Њ–Љ 2,2 —Б–Љ –њ–ї–Њ—В–љ–Њ—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Њ–є –Њ–і–љ–Њ—А–Њ–і–љ–Њ–є –Ї–Њ–љ—Б–Є—Б—В–µ–љ—Ж–Є–Є, –љ–∞ —А–∞–Ј—А–µ–Ј–µ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Є–Љ–µ–ї–∞ –ґ–µ–ї—В–Њ-–±–µ–ї—Л–є —Ж–≤–µ—В (—А–Є—Б. 2A). –Я—А–Є –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є (—А–Є—Б. 2B, C) –Њ–њ—Г—Е–Њ–ї—М –Є–Љ–µ–ї–∞ —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ-–≥–љ–µ–Ј–і–љ—Л–є —В–Є–њ —Б—В—А–Њ–µ–љ–Є—П. –Ъ–Њ–Љ–њ–ї–µ–Ї—Б—Л –Ї–ї–µ—В–Њ–Ї —А–∞–Ј–і–µ–ї–µ–љ—Л —В—П–ґ–∞–Љ–Є –≥–Є–∞–ї–Є–љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б—В—А–Њ–Љ—Л, –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ –Ї–ї–µ—В–Ї–Є –Љ–Њ–љ–Њ–Љ–Њ—А—Д–љ—Л–µ, —Ж–Є–ї–Є–љ–і—А–Є—З–µ—Б–Ї–Њ–є –Є –Ї—Г–±–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Л —Б –Њ–±–Є–ї—М–љ–Њ–є —Б–≤–µ—В–ї–Њ–є —Н–Њ–Ј–Є–љ–Њ—Д–Є–ї—М–љ–Њ–є —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–Њ–є, —Б —Ж–µ–љ—В—А–∞–ї—М–љ–Њ —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –Њ–Ї—А—Г–≥–ї—Л–Љ–Є —П–і—А–∞–Љ–Є –Є –Ј–µ—А–љ–Є—Б—В—Л–Љ —Е—А–Њ–Љ–∞—В–Є–љ–Њ–Љ (–Ї—А—Г–њ–љ–Њ- –Є –Љ–µ–ї–Ї–Њ–Ј–µ—А–љ–Є—Б—В—Л–є —Е—А–Њ–Љ–∞—В–Є–љ –њ–Њ —В–Є–њ—Г ¬Ђ—Б–Њ–ї–Є –Є –њ–µ—А—Ж–∞¬ї). –Ъ–∞—А—В–Є–љ –Љ–Є—В–Њ–Ј–Њ–≤ –љ–µ—В. –Ю–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–∞—П –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–Љ –Љ–µ—В–Њ–і–Њ–Љ, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А–Њ–Љ—Г –≤ –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Ї–∞—Е –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М –≤—Л—А–∞–ґ–µ–љ–љ–∞—П —Н–Ї—Б–њ—А–µ—Б—Б–Є—П –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤: –Љ–∞—А–Ї–µ—А –Љ–µ–ї–Ї–Є—Е –≤–µ–Ј–Є–Ї—Г–ї вАФ —Б–Є–љ–∞–њ—В–Њ—Д–Є–Ј–Є–љ, –Љ–∞—А–Ї–µ—А –њ–ї–Њ—В–љ—Л—Е —Б–µ–Ї—А–µ—В–Њ—А–љ—Л—Е –≥—А–∞–љ—Г–ї вАФ —Е—А–Њ–Љ–Њ–≥—А–∞–љ–Є–љ –Р, –љ–µ–є—А–Њ–љ—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–∞—П –µ–љ–Њ–ї–∞–Ј–∞. –≠–Ї—Б–њ—А–µ—Б—Б–Є—П –Љ–∞—А–Ї–µ—А–∞ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є Ki-67 —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ –љ–µ –±–Њ–ї–µ–µ 3% (—А–Є—Б. 2DвАУF). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–∞ –≤—Л—Б–Њ–Ї–Њ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–є –Я–∞–љ–Э–≠–Ю, G1, 8240/3.
–Т –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ —Н–њ–Є–Ј–Њ–і–Њ–≤ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–Њ –љ–µ –±—Л–ї–Њ, —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –±—Л–ї–Њ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–Є—В–µ–ї—М–љ—Л–Љ. –Э–∞ —Н—В–∞–њ–µ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –∞–Љ–±—Г–ї–∞—В–Њ—А–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П —Н–њ–Є–Ј–Њ–і–Њ–≤ –≥–Є–њ–Њ–≥–ї–Є–Ї–µ–Љ–Є–Є –љ–µ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М, —Г—А–Њ–≤–µ–љ—М –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є –љ–∞—В–Њ—Й–∞–Ї –≤–∞—А—М–Є—А–Њ–≤–∞–ї –Њ—В 7,4 –і–Њ 9,6 –Љ–Љ–Њ–ї—М/–ї, –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —З–µ–≥–Њ –±—Л–ї –≤–µ—А–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В 2 —В–Є–њ–∞. –Я–∞—Ж–Є–µ–љ—В–Ї–∞ —Б–Њ–±–ї—О–і–∞–µ—В —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є, –њ–Њ–ї—Г—З–∞–µ—В —Б–∞—Е–∞—А–Њ—Б–љ–Є–ґ–∞—О—Й—Г—О —В–µ—А–∞–њ–Є—О (–Љ–µ—В—Д–Њ—А–Љ–Є–љ –њ—А–Њ–ї–Њ–љ–≥–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П 1,5 –≥/—Б—Г—В), –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–∞.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–∞–±–ї—О–і–µ–љ–Є–µ –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г–µ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Є–љ—Б—Г–ї–Є–љ–Њ–Љ—Л, –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В—М –Њ—Б–љ–Њ–≤–љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ-–Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б-–Ї–Њ–≥–Њ –њ–Њ–Є—Б–Ї–∞, –≤–Ї–ї—О—З–∞—П —В–Є–њ–Є—З–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–±—Л —Б –≥–Њ–ї–Њ–і–∞–љ–Є–µ–Љ, –њ–µ—А–≤–Њ–≥–Њ —Н—В–∞–њ–∞ –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є (–Ь–°–Ъ–Ґ-–њ–Њ–Ј–Є—В–Є–≤–љ–∞—П –Є–љ—Б—Г–ї–Є–љ–Њ–Љ–∞) –Є –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ —В–∞–Ї–ґ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ї–∞–Ї –Љ–µ—В–Њ–і–∞ –≤—Л–±–Њ—А–∞ —В–µ—А–∞–њ–Є–Є —Б–Њ–ї–Є—В–∞—А–љ—Л—Е –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Є–љ—Б—Г–ї–Є–љ–Њ–Љ. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –Њ–±—А–∞—Й–∞–µ—В –љ–∞ —Б–µ–±—П –≤–љ–Є–Љ–∞–љ–Є–µ —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–є –≥–Є–њ–µ—А–Є–љ—Б—Г–ї–Є–љ–Є–Ј–Љ –Љ–∞—Б–Ї–Є—А–Њ–≤–∞–ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П —Б–∞—Е–∞—А–љ–Њ–≥–Њ –і–Є–∞–±–µ—В–∞ 2 —В–Є–њ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ (–≤–Њ–Ј—А–∞—Б—В вЙ•45 –ї–µ—В, –Њ–ґ–Є—А–µ–љ–Є–µ, –љ–Є–Ј–Ї–∞—П —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –∞—А—В–µ—А–Є–∞–ї—М–љ–∞—П –≥–Є–њ–µ—А—В–µ–љ–Ј–Є—П).












