–Р–Ї—В—Г–∞–ї—М–љ–Њ—Б—В—М
–£–Ј–ї–Њ–≤—Л–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–©–Ц) —И–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ—Л –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є: –Њ–љ–Є –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤ 16вАУ67% —Б–ї—Г—З–∞–µ–≤ –њ–Њ –і–∞–љ–љ—Л–Љ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–£–Ч–Ш), –≤ 35вАУ50% вАФ –њ–Њ –і–∞–љ–љ—Л–Љ –∞—Г—В–Њ–њ—Б–Є–Є [1]. –Я—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є —Г–Ј–ї–Њ–≤ –©–Ц –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б–Ї–ї—О—З–Є—В—М —А–∞–Ї —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (–†–©–Ц), –Ї–Њ—В–Њ—А—Л–є –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ 7вАУ15% —Б–ї—Г—З–∞–µ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞, –њ–Њ–ї–∞, –љ–∞–ї–Є—З–Є—П –Њ–±–ї—Г—З–µ–љ–Є—П –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, —Б–µ–Љ–µ–є–љ–Њ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ –Є –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ [2].
–†–∞–Ї —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л –Ј–∞–љ–Є–Љ–∞–µ—В –њ–µ—А–≤–Њ–µ –Љ–µ—Б—В–Њ –њ–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є —Б—А–µ–і–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є —Н–љ–і–Њ–Ї—А–Є–љ–љ—Л—Е –ґ–µ–ї–µ–Ј –Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 0,5% –≤ –Њ–±—Й–µ–є —Б—В—А—Г–Ї—В—Г—А–µ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –і–Њ 5% —Б—А–µ–і–Є –Њ–њ—Г—Е–Њ–ї–µ–є –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є [3]. –Ч–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –†–©–Ц –≤ –†–Њ—Б—Б–Є–Є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 1,7вАУ7,6 –љ–∞ 100 000 [4]. –Я–Є–Ї –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –њ—А–Є—Е–Њ–і–Є—В—Б—П –љ–∞ –≤–Њ–Ј—А–∞—Б—В 40вАУ50 –ї–µ—В [5].
–Т —Б—В—А—Г–Ї—В—Г—А–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –†–©–Ц –Њ–Ї–Њ–ї–Њ 75% —Б–Њ—Б—В–∞–≤–ї—П–µ—В –њ–∞–њ–Є–ї–ї—П—А–љ—Л–є —А–∞–Ї, 15% вАФ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л–є, 2вАУ5% вАФ –Љ–µ–і—Г–ї–ї—П—А–љ—Л–є, –Њ–Ї–Њ–ї–Њ 5% вАФ –љ–Є–Ј–Ї–Њ–і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–є —А–∞–Ї, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –∞–љ–∞–њ–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–є.
–Т—Л—П–≤–ї—П–µ–Љ–Њ—Б—В—М –†–©–Ц –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –Ј–∞–Љ–µ—В–љ–Њ –≤—Л—А–Њ—Б–ї–∞: —В–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤ –Ѓ–ґ–љ–Њ–є –Ъ–Њ—А–µ–µ, —З–∞—Б—В–Њ—В–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –©–Ц –≤—Л—А–Њ—Б–ї–∞ —Б 6,4 –і–Њ 40,7 –љ–∞ 100 000 —З–µ–ї–Њ–≤–µ–Ї –≤ –≥–Њ–і –≤ –њ–µ—А–Є–Њ–і —Б 1999 –њ–Њ 2008 –≥. –Т 2009 –≥. –†–©–Ц —Б—В–∞–ї –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –≤—Л—П–≤–ї—П–µ–Љ—Л–Љ —В–Є–њ–Њ–Љ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є –≤ –Ѓ–ґ–љ–Њ–є –Ъ–Њ—А–µ–µ [6]. –≠—В–Њ—В —Д–µ–љ–Њ–Љ–µ–љ —Б–≤—П–Ј–∞–љ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —Б —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –≤–љ–µ–і—А–µ–љ–Є–µ–Љ –£–Ч–Ш –©–Ц, —И–Є—А–Њ–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Љ–Њ—В—А–Њ–≤ –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж, –∞ —В–∞–Ї–ґ–µ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤ –ї–µ–љ –і–µ–є—Б—В–≤–Є–µ–Љ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –≤–љ–µ—И–љ–µ–є —Б—А–µ–і—Л, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є –Є–Њ–љ–Є–Ј–Є—А—Г—О—Й–µ–є —А–∞–і–Є–∞—Ж–Є–Є.
–Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —А–Њ—Б—В —З–Є—Б–ї–∞ –≤—Л—П–≤–ї–µ–љ–љ—Л—Е —Б–ї—Г—З–∞–µ–≤ –†–©–Ц –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–Є—Е –Ј–∞ —Н—В–Є–Љ —В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є–є –≤ –Ѓ–ґ–љ–Њ–є –Ъ–Њ—А–µ–µ –љ–µ –њ—А–Є–≤–µ–ї –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —Б–Љ–µ—А—В–љ–Њ—Б—В–Є, –њ—А–Є —Н—В–Њ–Љ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–ї–Њ—Б—М —З–Є—Б–ї–Њ –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є, –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—А–Њ—Б–ї–Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–µ —А–∞—Б—Е–Њ–і—Л —Б–Є—Б—В–µ–Љ—Л –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ —В–µ–љ–і–µ–љ—Ж–Є–Є –Њ—В–Љ–µ—З–∞—О—В—Б—П –Є –≤ –і—А—Г–≥–Є—Е —А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е, –љ–∞–њ—А–Є–Љ–µ—А –≤–Њ –§—А–∞–љ—Ж–Є–Є –Є –°–®–Р [6вАУ8].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤–µ–і–µ—В—Б—П –њ–Њ–Є—Б–Ї –Љ–∞–ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є—Е –љ–∞ –і–Њ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–Љ —Н—В–∞–њ–µ –Њ–њ—А–µ–і–µ–ї–Є—В—М –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї —Г–Ј–ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –©–Ц –Є, —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Є–Ј–±–µ–ґ–∞—В—М –љ–µ–љ—Г–ґ–љ—Л—Е –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤.
–Ь–µ—В–Њ–і—Л –Њ—Ж–µ–љ–Ї–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ —Г–Ј–ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є —Й–Є—В–Њ–≤–Є–і–љ–Њ–є –ґ–µ–ї–µ–Ј—Л
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ —Г–Ј–ї–Њ–≤–Њ–≥–Њ –Ј–Њ–±–∞
–Я—А–Є–Љ–µ—А–љ–Њ –≤ 50% —Б–ї—Г—З–∞–µ–≤ —Г–Ј–ї—Л –≤—Л—П–≤–ї—П—О—В—Б—П –њ—А–Є —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–є –њ–∞–ї—М–њ–∞—Ж–Є–Є —И–µ–Є, –Њ—Б—В–∞–≤—И–Є–µ—Б—П 50% вАФ —Б–ї—Г—З–∞–є–љ–∞—П –љ–∞—Е–Њ–і–Ї–∞ –њ—А–Є –£–Ч–Ш [9]. –Ю—Б–љ–Њ–≤–љ—Л–µ –Ј–∞–і–∞—З–Є, —В—А–µ–±—Г—О—Й–Є–µ —А–µ—И–µ–љ–Є—П –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–Љ –Њ–±—А–∞—Й–µ–љ–Є–Є –Ї –≤—А–∞—З—Г –њ–∞—Ж–Є–µ–љ—В–∞ —Б –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ —Г–Ј–ї–Њ–≤–Њ–≥–Њ –Ј–Њ–±–∞, вАФ –Њ—Ж–µ–љ–Ї–∞ —Д—Г–љ–Ї—Ж–Є–Є –©–Ц (–Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П —В–Є—А–µ–Њ—В—А–Њ–њ–љ–Њ–≥–Њ –≥–Њ—А–Љ–Њ–љ–∞, –Ґ–Ґ–У), –∞ —В–∞–Ї–ґ–µ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ —Г–Ј–ї–Њ–≤–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ—Г—В–µ–Љ –∞–љ–∞–ї–Є–Ј–∞ –ґ–∞–ї–Њ–±, –∞–љ–∞–Љ–љ–µ–Ј–∞, —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –і–∞–љ–љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ-–Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є.
–І–∞—Й–µ –≤—Б–µ–≥–Њ –њ–∞—Ж–Є–µ–љ—В –њ—А–µ–і—К—П–≤–ї—П–µ—В –ґ–∞–ї–Њ–±—Л –љ–∞ –љ–∞–ї–Є—З–Є–µ –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–∞ –њ–µ—А–µ–і–љ–µ–є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є —И–µ–Є, –Њ—Е—А–Є–њ–ї–Њ—Б—В—М –≥–Њ–ї–Њ—Б–∞, –Њ—Й—Г—Й–µ–љ–Є–µ –Ї–Њ–Љ–Ї–∞ –≤ –≥–Њ—А–ї–µ, –Ј–∞—В—А—Г–і–љ–µ–љ–Є–µ –≥–ї–Њ—В–∞–љ–Є—П [10].
–Я—А–Њ–≤–Њ–і–Є—В—Б—П –Њ—Ж–µ–љ–Ї–∞ –і–∞–љ–љ—Л—Е –∞–љ–∞–Љ–љ–µ–Ј–∞, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В —Г–Ї–∞–Ј—Л–≤–∞—В—М –љ–∞ –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —А–Є—Б–Ї —А–∞–Ј–≤–Є—В–Є—П –†–©–Ц (–Њ–±–ї—Г—З–µ–љ–Є–µ –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є –≤ –і–µ—В—Б–Ї–Њ–Љ –Є –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ; —Б–µ–Љ–µ–є–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј –†–©–Ц —Г —А–Њ–і—Б—В–≤–µ–љ–љ–Є–Ї–Њ–≤ –њ–µ—А–≤–Њ–є —Б—В–µ–њ–µ–љ–Є —А–Њ–і—Б—В–≤–∞; –±—Л—Б—В—А—Л–є —А–Њ—Б—В —Г–Ј–ї–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –і–Є—Б—Д–Њ–љ–Є–µ–є; –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ —Г–Ј–ї–Њ–≤–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –њ–Њ–Ј–Є—В—А–Њ–љ–љ–Њ-—Н–Љ–Є—Б—Б–Є–Њ–љ–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є —Б 18-—Д—В–Њ—А–і–µ–Ј–Њ–Ї—Б–Є–≥–ї—О–Ї–Њ–Ј–Њ–є, –§–Ф–У-–Я–≠–Ґ).
–Я—А–Є —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–Љ –Њ–±—Б–ї–µ–і–Њ–≤–∞ –љ–Є–Є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –Њ—Ж–µ–љ–Ї–∞ —А–∞–Ј–Љ–µ—А–Њ–≤, –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є –Є –њ–ї–Њ—В–љ–Њ—Б—В–Є —Г–Ј–ї–∞. –Т—Л—П–≤–ї–µ–љ–Є–µ –њ—А–Є –њ–∞–ї—М–њ–∞—Ж–Є–Є –њ–ї–Њ—В–љ–Њ–≥–Њ, –Љ–∞–ї–Њ–њ–Њ–і–≤–Є–ґ–љ–Њ–≥–Њ, —З–∞—Й–µ –±–µ–Ј–±–Њ–ї–µ–Ј–љ–µ–љ–љ–Њ–≥–Њ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –њ—А–Њ–µ–Ї—Ж–Є–Є –©–Ц, —Б–њ–∞—П–љ–љ–Њ–≥–Њ —Б –Њ–Ї—А—Г–ґ–∞—О—Й–Є–Љ–Є —В–Ї–∞–љ—П–Љ–Є, —И–µ–є–љ–Њ–є –ї–Є–Љ—Д–∞–і–µ–љ–Њ–њ–∞—В–Є–Є –Љ–Њ–ґ–µ—В —Б–ї—Г–ґ–Є—В—М –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є –Њ–њ—Г—Е–Њ–ї–Є. –•–Њ—В—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –њ–∞–ї—М–њ–∞—Ж–Є–Є –њ—А–Є —Г–Ј–ї–Њ–≤–Њ–Љ –Ј–Њ–±–µ –љ–µ–ї—М–Ј—П –Њ—В—А–Є—Ж–∞—В—М, –Њ–љ–∞ –љ–µ —П–≤–ї—П–µ—В—Б—П –љ–∞–і–µ–ґ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –Њ—Ж–µ–љ–Ї–Є —А–∞–Ј–Љ–µ—А–∞ –Є —З–Є—Б–ї–∞ —Г–Ј–ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є [11]. –Ю—Б–Љ–Њ—В—А, –Њ—Ж–µ–љ–Ї–∞ –ґ–∞–ї–Њ–± –Є –∞–љ–∞–Љ–љ–µ–Ј–∞ —Б–ї—Г–ґ–∞—В –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ –і–ї—П –≤—Л–і–µ–ї–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≥—А—Г–њ–њ—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ–Њ –†–©–Ц, –Ї–Њ—В–Њ—А—Л–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –£–Ч–Ш.
–£–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ
–£–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –©–Ц вАФ –і–Њ—Б—В—Г–њ–љ—Л–є, –≤—Л—Б–Њ–Ї–Њ–Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–є, –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–є –Љ–µ—В–Њ–і –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–є—Б—П –Њ—В—Б—Г—В—Б—В–≤–Є–µ–Љ –ї—Г—З–µ–≤–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –њ—А–Њ—Ж–µ–і—Г—А—Г –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ –Є –Њ—Ж–µ–љ–Є–≤–∞—В—М –і–Є–љ–∞–Љ–Є–Ї—Г —А–Њ—Б—В–∞ —Г–Ј–ї–Њ–≤. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –£–Ч–Ш –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –†–©–Ц —Б–Њ—Б—В–∞–≤–ї—П–µ—В 69вАУ100%, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М вАФ 55вАУ98,4%. –Ю—Б–љ–Њ–≤–љ—Л–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ —Н—Е–Њ–≥—А–∞—Д–Є–Є —П–≤–ї—П–µ—В—Б—П –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Њ—В —Г—А–Њ–≤–љ—П –њ–Њ–і–≥–Њ—В–Њ–≤–Ї–Є —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞, –≤—Л–њ–Њ–ї–љ—П—О—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –Ї–ї–∞—Б—Б–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–є –∞–њ–њ–∞—А–∞—В—Г—А—Л [12].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Л—Б–Њ–Ї—Г—О —А–∞–Ј—А–µ—И–∞—О—Й—Г—О —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М, –£–Ч–Ш –љ–µ —Б–ї–µ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Љ–µ—В–Њ–і–∞ —Б–Ї—А–Є–љ–Є–љ–≥–∞ –†–©–Ц –≤ —Б–≤—П–Ј–Є —Б –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Ї–∞–Ї —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є, —В–∞–Ї –Є —Б —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –њ–Њ–Ј–Є—Ж–Є–Є: –Љ–µ—В–Њ–і –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–ї—П—В—М –±–Њ–ї—М—И–Њ–µ —З–Є—Б–ї–Њ —Б–ї—Г—З–∞–µ–≤ —Г–Ј–ї–Њ–≤–Њ–≥–Њ –Ї–Њ–ї–ї–Њ–Є–і–љ–Њ–≥–Њ –Ј–Њ–±–∞, 'ee—В–Њ—А—Л–є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–µ –Є–Љ–µ–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П. –†–∞–љ–љ–µ–µ –≤—Л—П–≤–ї–µ–љ–Є–µ –њ–∞–њ–Є–ї–ї—П—А–љ—Л—Е –Љ–Є–Ї—А–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ (–Њ–њ—Г—Е–Њ–ї–Є –Љ–µ–љ–µ–µ 1 —Б–Љ) –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є—П –љ–∞ –њ—А–Њ–≥–љ–Њ–Ј.
–Ю—Б–љ–Њ–≤–љ–∞—П —А–Њ–ї—М –£–Ч–Ш –њ—А–Є —Г–Ј–ї–Њ–≤–Њ–Љ –Ј–Њ–±–µ вАФ —Г—В–Њ—З–љ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї —В–Њ–љ–Ї–Њ–Є–≥–Њ–ї—М–љ–Њ–є –∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ–Њ–є –±–Є–Њ–њ—Б–Є–Є (–Ґ–Р–С), –љ–∞–≤–Є–≥–∞—Ж–Є—П –њ—А–Є –µ–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є, –Њ—Ж–µ–љ–Ї–∞ –Љ–µ—Б—В–љ–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –њ—А–Њ—Ж–µ—Б—Б–∞ –Є —Б–Њ—Б—В–Њ—П–љ–Є—П –ї–Є–Љ—Д–Њ—Г–Ј–ї–Њ–≤ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ [13].
–Я–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –≤—Л–њ–Њ–ї–љ–µ–љ–Є—О –£–Ч–Ш: 1) –њ–∞–ї—М–њ–Є—А—Г–µ–Љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –љ–∞ —И–µ–µ; 2) —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —И–µ–є–љ—Л—Е –ї–Є–Љ—Д–Њ—Г–Ј–ї–Њ–≤; 3) —Б–µ–Љ–µ–є–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј –†–©–Ц; 4) –Њ–±–ї—Г—З–µ–љ–Є–µ –≥–Њ–ї–Њ–≤—Л –Є —И–µ–Є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ; 5) –њ–∞—А–∞–ї–Є—З –≥–Њ–ї–Њ—Б–Њ–≤–Њ–є —Б–Ї–ї–∞–і–Ї–Є; 6) —Б–Є–Љ–њ—В–Њ–Љ—Л –і–Є—Б—Д–∞–≥–Є–Є; 7) —Г–Ј–ї–Њ–≤—Л–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –©–Ц, —Б–ї—Г—З–∞–є–љ–Њ –≤—Л—П–≤–ї–µ–љ–љ—Л–µ –њ—А–Є –§–Ф–У-–Я–≠–Ґ; 8) –Њ–њ–µ—А–∞—Ж–Є–Є –њ–Њ –њ–Њ–≤–Њ–і—Г –†–©–Ц –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ [14].
–£–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М —И–Є—А–Њ–Ї–Є–є —Б–њ–µ–Ї—В—А —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е –њ–Њ —Н—Е–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–Љ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ –Є —А–∞–Ј–Љ–µ—А–∞–Љ —Г–Ј–ї–Њ–≤ –©–Ц. –≠—В–Њ —Б–Њ–Ј–і–∞–µ—В —В—А—Г–і–љ–Њ—Б—В–Є –≤ –Њ—Ж–µ–љ–Ї–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –Ґ–Р–С. –Я–Њ–і–Њ–Ј—А–Є—В–µ–ї—М–љ—Л–Љ–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —А–∞–Ї–∞ –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є —П–≤–ї—П—О—В—Б—П: –љ–µ—А–Њ–≤–љ—Л–µ –Ї—А–∞—П, –љ–∞–ї–Є—З–Є–µ –Љ–Є–Ї—А–Њ–Ї–∞–ї—М—Ж–Є–љ–∞—В–Њ–≤ –Є –≤–µ—А—В–Є–Ї–∞–ї—М–љ–∞—П –Њ—А–Є–µ–љ—В–∞—Ж–Є—П —Г–Ј–ї–∞ (—Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –±–Њ–ї–µ–µ 90%) [2]. –Ю–і–љ–∞–Ї–Њ –Ї–∞–ґ–і—Л–є –Є–Ј —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, –≤–Ј—П—В—Л—Е –Њ—В–і–µ–ї—М–љ–Њ, –љ–µ –Њ–±–ї–∞–і–∞–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є –њ—А–µ–і—Б–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є —Ж–µ–љ–љ–Њ—Б—В—М—О, —З—В–Њ –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –њ–Њ–≤–Њ–і–Њ–Љ –Ї —Б–Њ–Ј–і–∞–љ–Є—О –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є, –Њ—Ж–µ–љ–Є–≤–∞—О—Й–µ–є —Г–Ј–ї—Л –©–Ц –њ–Њ —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є —Н—Е–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї. –° —Н—В–Њ–є —Ж–µ–ї—М—О –≤ 2009 –≥. E. Hovart et al. —А–∞–Ј—А–∞–±–Њ—В–∞–ї–Є –£–Ч-–Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О TIRADS (Thyroid Imaging Reporting and Data System). –Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї—А—Г–њ–љ–Њ–≥–Њ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є TIRADS –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –†–©–Ц —Б–Њ—Б—В–∞–≤–Є–ї–∞ 88% [15]. –Ю–љ–∞ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Б–ї–Њ–ґ–љ–Њ–є –≤ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –≤ —А—Г—В–Є–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ, —З—В–Њ –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –њ–Њ–Є—Б–Ї–∞ –і—А—Г–≥–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ —Б–Є—Б—В–µ–Љ—Л TIRADS (–Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–є —В–Є—А–µ–Њ–Є–і–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є (ATA), –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –Ї–Њ–ї–ї–µ–і–ґ–∞ —А–∞–і–Є–Њ–ї–Њ–≥–Є–Є (ACR-TIRADS), –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є —В–Є—А–µ–Њ–Є–і–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є (EU-TIRADS), –Ъ–Њ—А–µ–є—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ—Л (Kw-TIRADS) –Є –і—А.) [2, 16вАУ19].
–Т –†–Њ—Б—Б–Є–є—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ –≤–µ–і–µ–љ–Є—О –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –†–©–Ц –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—О –Х–≤—А–Њ–њ–µ–є—Б–Ї–Њ–є —В–Є—А–µ–Њ–Є–і–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є (EU-TIRADS) (—В–∞–±–ї. 1) [14].

–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є Y. Sych et al. [20] –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Е–Њ—А–Њ—И–∞—П –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ–Њ—Б—В—М –Є —Б–Њ–≥–ї–∞—Б–Њ–≤–∞–љ–љ–Њ—Б—В—М –Ј–∞–Ї–ї—О—З–µ–љ–Є–є –Љ–µ–ґ–і—Г –≤—А–∞—З–∞–Љ–Є –£–Ч–Ш –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є EU-TIRADS (–Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –Ї–∞–њ–њ–∞ –Ъ–Њ—Н–љ–∞ 0,67). –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М EU-TIRADS –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –†–©–Ц —Б–Њ—Б—В–∞–≤–Є–ї–∞ 89,74вАУ92,31%, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М вАФ –Њ–Ї–Њ–ї–Њ 60%, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Г—Б–њ–µ—И–љ–Њ –њ—А–Є–Љ–µ–љ—П—В—М –µ–µ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ.
–Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В—Б—П –њ–Њ–Є—Б–Ї –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –£–Ч-–њ—А–Є–Ј–љ–∞–Ї–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –†–©–Ц. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, —И–Є—А–Њ–Ї–Њ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–∞ –Њ—Ж–µ–љ–Ї–∞ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤ —Г–Ј–ї–∞—Е, –і–ї—П —З–µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П —Ж–≤–µ—В–Њ–≤–Њ–µ –і–Њ–њ–њ–ї–µ—А–Њ–≤—Б–Ї–Њ–µ –Ї–∞—А—В–Є—А–Њ–≤–∞–љ–Є–µ (–¶–Ф–Ъ). –≠—В–Њ –£–Ч-—В–µ—Е–љ–Њ–ї–Њ–≥–Є—П, –Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –љ–∞ —А–µ–≥–Є—Б—В—А–∞—Ж–Є–Є —Б–Ї–Њ—А–Њ—Б—В–Є –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –Є –µ–≥–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є –≤ —В–Ї–∞–љ—П—Е. –Т —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є M. Cho et al. [21] –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ —Г–Ј–ї—Л –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —А–∞–Ј–ї–Є—З–∞—О—В—Б—П –њ–Њ —В–Є–њ—Г –≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є, –њ—А–Є—З–µ–Љ –Є–љ—В—А–∞–љ–Њ–і—Г–ї—П—А–љ—Л–є —В–Є–њ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –±—Л–ї –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л–Љ –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є. –Ь–µ—В–Њ–і–Є–Ї–∞ –¶–Ф–Ъ –Є–Љ–µ–µ—В —А—П–і –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–≤: –љ–µ–Є–Ј–±–µ–ґ–љ—Л–µ –Є—Б–Ї–∞–ґ–µ–љ–Є—П –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П, —Д–Њ–љ–Њ–≤—Л–є —И—Г–Љ, –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Њ—В —Г–≥–ї–∞ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–∞—В—З–Є–Ї–∞. –Я—А–Є –Њ—Ж–µ–љ–Ї–µ —Б—В–µ–њ–µ–љ–Є –≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є —Г–Ј–ї–Њ–≤ –Ї—А–∞–є–љ–µ –≤–∞–ґ–љ—Л –Ї–Њ—А—А–µ–Ї—В–љ—Л–µ –љ–∞—Б—В—А–Њ–є–Ї–Є —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞.
–І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –¶–Ф–Ъ –≤ –Њ—В–Њ–±—А–∞–ґ–µ–љ–Є–Є —Б–Њ—Б—Г–і–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ–Њ–≤—Л—И–µ–љ–∞ –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –£–Ч–Ш —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ї–Њ–љ—В—А–∞—Б—В–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Ф–∞–љ–љ—Л–µ –ї–Є—В–µ—А–∞—В—Г—А—Л –њ–Њ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –©–Ц —Б –Ї–Њ–љ—В—А–∞—Б—В–љ—Л–Љ —Г—Б–Є–ї–µ–љ–Є–µ–Љ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л [12]. B. Zhang et al. [22] –≤—Л—П–≤–Є–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ –Ј–∞—Е–≤–∞—В–µ –Ї–Њ–љ—В—А–∞—Б—В–љ–Њ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –Љ–µ–ґ–і—Г –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є (–Ї–Њ–ї—М—Ж–µ–≤–Є–і–љ—Л–є —В–Є–њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П) –Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є (–≥–µ—В–µ—А–Њ–≥–µ–љ–љ—Л–є —В–Є–њ) —Г–Ј–ї–∞–Љ–Є –Є —Б–≤—П–Ј–∞–ї–Є –µ–≥–Њ —Б –љ–µ—А–∞–≤–љ–Њ–Љ–µ—А–љ—Л–Љ —А–Њ—Б—В–Њ–Љ —Б–Њ—Б—Г–і–Њ–≤ –Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ–Љ –Ї—А–Њ–≤–Њ—В–Њ–Ї–∞ –≤–љ—Г—В—А–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є. –°–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Ї–Њ–љ—В—А–∞—Б—В-—Г—Б–Є–ї–µ–љ–љ–Њ–≥–Њ –£–Ч–Ш –Є –Њ—Ж–µ–љ–Ї–Є —Г–Ј–ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –њ–Њ TIRADS —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —В–Њ—З–љ–Њ—Б—В—М —Б 90,3% –і–Њ 96,0% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ –£–Ч–Ш (—А<0,01) [23].
–£–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–∞—П —Н–ї–∞—Б—В–Њ–≥—А–∞—Д–Є—П вАФ –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ–∞—П –Љ–µ—В–Њ–і–Є–Ї–∞ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —Г–Ј–ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –©–Ц, –Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –љ–∞ –Є–Ј–Љ–µ—А–µ–љ–Є–Є –Є—Е —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б–≤–Њ–є—Б—В–≤ (–ґ–µ—Б—В–Ї–Њ—Б—В–Є). –Т—Л—Б–Њ–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –ґ–µ—Б—В–Ї–Њ—Б—В–Є –±–Њ–ї–µ–µ —Е–∞—А–∞–Ї—В–µ—А–љ—Л –і–ї—П –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е —Г–Ј–ї–Њ–≤. –Ь–µ—В–Њ–і –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї –≤—Л—Б–Њ–Ї—Г—О —З—Г–≤—Б —В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М (95,3%), —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М (98,2%) –Є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —В–Њ—З–љ–Њ—Б—В—М (96%) –і–ї—П –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –†–©–Ц [24].
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –і–≤–∞ –Љ–µ—В–Њ–і–∞ вАФ –Ї–Њ–Љ–њ—А–µ—Б—Б–Є–Њ–љ–љ–∞—П —Н–ї–∞—Б—В–Њ–≥—А–∞—Д–Є—П –Є —Н–ї–∞—Б—В–Њ–≥—А–∞—Д–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б–і–≤–Є–≥–Њ–≤—Л—Е –≤–Њ–ї–љ. –Ш–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В—М —Н–ї–∞—Б—В–Њ–≥—А–∞—Д–Є–Є –Ј–∞–≤–Є—Б–Є—В –Њ—В –Ї–≤–∞–ї–Є—Д–Є–Ї–∞—Ж–Є–Є –Є –Њ–њ—Л—В–∞ –≤—А–∞—З–∞ –£–Ч-–і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, —В—А–µ–±—Г–µ—В—Б—П —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–µ –Њ–±—Г—З–µ–љ–Є–µ. –Ь–µ—В–Њ–і –љ–µ –Ј–∞–Љ–µ–љ—П–µ—В —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –£–Ч–Ш –Є —П–≤–ї—П–µ—В—Б—П –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Л–Љ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–Њ–Љ –њ—А–Є –Њ—В–±–Њ—А–µ —Г–Ј–ї–Њ–≤, —В—А–µ–±—Г—О—Й–Є—Е –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ґ–Р–С. –Я—А–Є –љ–∞–ї–Є—З–Є–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є —Б –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–Њ–є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ґ–Р–С —Г—З–∞—Б—В–Ї–Њ–≤ —Б –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є –ґ–µ—Б—В–Ї–Њ—Б—В—М—О –њ–Њ –і–∞–љ–љ—Л–Љ —Н–ї–∞—Б—В–Њ–≥—А–∞—Д–Є–Є [25].
–Ґ–Њ–љ–Ї–Њ–Є–≥–Њ–ї—М–љ–∞—П –∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ–∞—П –±–Є–Њ–њ—Б–Є—П
–Ґ–Њ–љ–Ї–Њ–Є–≥–Њ–ї—М–љ–∞—П –∞—Б–њ–Є—А–∞—Ж–Є–Њ–љ–љ–∞—П –±–Є–Њ–њ—Б–Є—П (–њ–Њ–і –£–Ч-–Ї–Њ–љ—В—А–Њ–ї–µ–Љ —П–≤–ї—П–µ—В—Б—П ¬Ђ–Ј–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Г–Ј–ї–Њ–≤ –©–Ц –Є –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –≤—Л—Б–Њ–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є (65вАУ98%) –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є (72вАУ100%). –Т–љ–µ–і—А–µ–љ–Є–µ –Ґ–Р–С –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї—Г—О –њ—А–∞–Ї—В–Є–Ї—Г –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–Ј–Є–ї–Њ —З–Є—Б–ї–Њ –љ–µ–љ—Г–ґ–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є —Г–Ј–ї–∞–Љ–Є [26]. –Ґ–Р–С –њ—А–Њ–≤–Њ–і–Є—В—Б—П –≤ —Б–ї—Г—З–∞–µ, –µ—Б–ї–Є —А–∞–Ј–Љ–µ—А —Г–Ј–ї–∞ –©–Ц —А–∞–≤–µ–љ –Є–ї–Є –њ—А–µ–≤—Л—И–∞–µ—В 1 —Б–Љ. –Я—А–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П—Е –Љ–µ–љ–µ–µ 1 —Б–Љ, –µ—Б–ї–Є –њ–∞—Ж–Є–µ–љ—В –љ–µ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –≥—А—Г–њ–њ–µ —А–Є—Б–Ї–∞ –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е —Д–Њ—А–Љ –†–©–Ц, –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ґ–Р–С –љ–µ—Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –£–Ч-—Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї [19].
–Т 2007 –≥. –≤ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–Љ –Є–љ—Б—В–Є—В—Г—В–µ —А–∞–Ї–∞ –°–®–Р (–≥. –С–µ—В–µ—Б–і–∞) –±—Л–ї–∞ –њ—А–µ–і–ї–Њ–ґ–µ–љ–∞ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П Bethesda –і–ї—П —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–Ї–ї—О—З–µ–љ–Є–є —Г–Ј–ї–Њ–≤ –©–Ц, –≤ –Ї–Њ—В–Њ—А–Њ–є –≤—Л–і–µ–ї—П—О—В 6 –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є—Е –Ї–∞—В–µ–≥–Њ—А–Є–є, —А–∞–Ј–ї–Є—З–∞—О—Й–Є—Е—Б—П –њ–Њ —А–Є—Б–Ї—Г –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –Є —В–∞–Ї—В–Є–Ї–µ –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞. –Т 2017 –≥. –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П Bethesda –±—Л–ї–∞ –њ–µ—А–µ—Б–Љ–Њ—В—А–µ–љ–∞, —А–Є—Б–Ї–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –і–ї—П –Ї–∞–ґ–і–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –±—Л–ї–Є —Г—В–Њ—З–љ–µ–љ—Л –љ–∞ –Њ—Б–љ–Њ–≤–µ –љ–Њ–≤—Л—Е –і–∞–љ–љ—Л—Е –≤ –Њ–±–ї–∞—Б—В–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –©–Ц [27]. –Т –Њ—Б–љ–Њ–≤–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–є —А–µ–Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –ї–µ–ґ–∞—В –і–∞–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П Yu. Nikiforov et al., –≤ —Е–Њ–і–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М —З–∞—Б—В–Њ—В–∞ –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е –Є—Б—Е–Њ–і–Њ–≤ –≤ –≥—А—Г–њ–њ–∞—Е –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ –Є –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–Њ–≤ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –њ–∞–њ–Є–ї–ї—П—А–љ–Њ–≥–Њ —А–∞–Ї–∞. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–є –Є–љ–Ї–∞–њ—Б—Г–ї–Є—А–Њ–≤–∞–љ–љ—Л–є e2–∞—А–Є–∞–љ—В (encapsulated follicular variant of papillary thyroid carcinoma, EFVPTC) —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –љ–µ–∞–≥—А–µ—Б—Б–Є–≤–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –Є–љ–≤–∞–Ј–Є–≤–љ—Л—Е –≤–∞—А–Є–∞–љ—В–Њ–≤, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ–µ—А–µ–Є–Љ–µ–љ–Њ–≤–∞—В—М –µ–≥–Њ –≤ –љ–µ–Є–љ–≤–∞–Ј–Є–≤–љ—Г—О —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Г—О –Њ–њ—Г—Е–Њ–ї—М —Б —П–і—А–∞–Љ–Є –њ–∞–њ–Є–ї–ї—П—А–љ–Њ–≥–Њ —В–Є–њ–∞ (noninvasive follicular thyroid neoplasm with papillary-like nuclear features, NIFTP) –Є –њ—А–Њ–≤–Њ–і–Є—В—М –Љ–µ–љ–µ–µ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ [28]. NIFTP —Б–Њ—Б—В–∞–≤–ї—П–µ—В –і–Њ 13% –Њ—В –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ —Б–ї—Г—З–∞–µ–≤ –†–©–Ц, –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є Bethesda –њ—А–Є–≤–µ–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О —А–Є—Б–Ї–∞ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –і–ї—П III –Є IV –Ї–∞—В–µ–≥–Њ—А–Є–є [29].
–°–Њ–Ј–і–∞–љ–Є–µ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є Bethesda –Њ–±–ї–µ–≥—З–Є–ї–Њ –Ї–Њ–Љ–Љ—Г–љ–Є–Ї–∞—Ж–Є—О –Љ–µ–ґ–і—Г —Ж–Є—В–Њ–ї–Њ–≥–∞–Љ–Є, –ї–µ—З–∞—Й–Є–Љ–Є –≤—А–∞—З–∞–Љ–Є (—Е–Є—А—Г—А–≥–Є, —Н–љ–і–Њ–Ї—А–Є–љ–Њ–ї–Њ–≥–Є) –Є —А–∞–і–Є–Њ–ї–Њ–≥–∞–Љ–Є, —Г–≤–µ–ї–Є—З–Є–ї–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —В–Њ—З–љ–Њ—Б—В—М –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М –Ґ–Р–С, —З—В–Њ –њ—А–Є–≤–µ–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О —З–Є—Б–ї–∞ –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е —Г–Ј–ї–∞—Е –©–Ц [30]. –¶–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ї–∞—В–µ–≥–Њ—А–Є—П Bethesda –Њ–њ—А–µ–і–µ–ї—П–µ—В –і–∞–ї—М–љ–µ–є—И—Г—О —В–∞–Ї—В–Є–Ї—Г –≤–µ–і–µ–љ–Є—П (—В–∞–±–ї. 2).
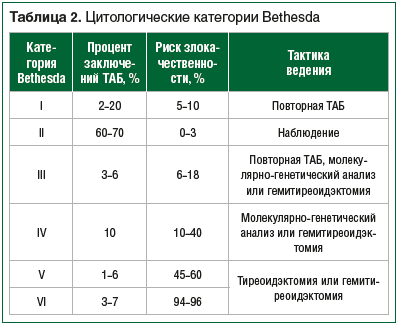
–£–Ј–ї—Л III –Є IV –Ї–∞—В–µ–≥–Њ—А–Є–Є Bethesda –љ–∞–Є–±–Њ–ї–µ–µ —Б–ї–Њ–ґ–љ—Л –≤ –њ–ї–∞–љ–µ –Њ—Ж–µ–љ–Ї–Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є. –£–Ј–ї—Л III –Ї–∞—В–µ–≥–Њ—А–Є–Є (–∞—В–Є–њ–Є—П –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П / —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П, atypia of undetermined significance / follicular lesion of undetermined significance, AUS/FLUS) –њ–Њ –і–∞–љ–љ—Л–Љ —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Њ–і–µ—А–ґ–∞—В –Ї–ї–µ—В–Ї–Є —Б –∞—А—Е–Є—В–µ–Ї—В—Г—А–љ–Њ–є –Є/–Є–ї–Є —П–і–µ—А–љ–Њ–є –∞—В–Є–њ–Є–µ–є (—П–і–µ—А–љ—Л–µ –±–Њ—А–Њ–Ј–і–Ї–Є, —Г–≤–µ–ї–Є—З–µ–љ–љ—Л–µ —П–і—А–∞ —Б –≥–Є–њ–Њ—Е—А–Њ–Љ–љ—Л–Љ —Е—А–Њ–Љ–∞—В–Є–љ–Њ–Љ, –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ї–Њ–љ—В—Г—А–∞ –Є —Д–Њ—А–Љ—Л —П–і–µ—А), –Ї–Њ—В–Њ—А–∞—П –Њ—В–ї–Є—З–∞–µ—В –Є—Е –Њ—В –і–Њ–±—А–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е —Г–Ј–ї–Њ–≤, –љ–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞ –і–ї—П –Ј–∞–Ї–ї—О—З–µ–љ–Є—П –Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–Љ —Е–∞—А–∞–Ї—В–µ—А–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П. –Т–µ—А–Њ—П—В–љ–Њ—Б—В—М –†–©–Ц —Б–Њ—Б—В–∞–≤–ї—П–µ—В 6вАУ18% –њ—А–Є –Є—Б–Ї–ї—О—З–µ–љ–Є–Є NIFTP. –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –њ–Њ–≤—В–Њ—А–љ–∞—П –Ґ–Р–С, –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї–Њ—В–Њ—А–Њ–ЄћЖ —Г—В–Њ—З–љ—П—О—В—Б—П –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –Є –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О [31].
–Ю–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Ї–∞—В–µ–≥–Њ—А–Є–Є IV (—Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–∞—П –љ–µ–Њ–њ–ї–∞–Ј–Є—П / –њ–Њ–і–Њ–Ј—А–µ–љ–Є–µ –љ–∞ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Г—О –љ–µ–Њ–њ–ї–∞–Ј–Є—О, follicular neoplasm or suspicious for a follicular neoplasm, FN/SFN) –њ—А–Є —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В —Б–Њ–±–Њ–є —Б–Ї–Њ–њ–ї–µ–љ–Є–µ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, –Њ–±—А–∞–Ј—Г—О—Й–Є—Е –Љ–Є–Ї—А–Њ—Д–Њ–ї–ї–Є–Ї—Г–ї—Л –ї–Є–±–Њ –љ–∞—Б–ї–∞–Є–≤–∞—О—Й–Є—Е—Б—П –і—А—Г–≥ –љ–∞ –і—А—Г–≥–∞ (–љ–∞—А—Г—И–µ–љ–Є–µ –∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є), –љ–Њ –љ–µ –Є–Љ–µ—О—Й–Є—Е —П–і–µ—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є, —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –і–ї—П –њ–∞–њ–Є–ї–ї—П—А–љ–Њ–≥–Њ —А–∞–Ї–∞. FN/SFN –≤—Л—П–≤–ї—П—О—В—Б—П –≤ 10% –≤—Б–µ—Е –њ—Г–љ–Ї—В–Є—А—Г–µ–Љ—Л—Е —Г–Ј–ї–Њ–≤ –Є –Є–Љ–µ—О—В —А–Є—Б–Ї –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є 10вАУ40% –њ—А–Є –Є—Б–Ї–ї—О—З–µ–љ–Є–Є NIFTP.
–Т —Б–ї—Г—З–∞–µ –љ–µ–Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ–≥–Њ/–љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–≥–Њ –Ј–∞–Ї–ї—О—З–µ–љ–Є—П –њ–Њ –і–∞–љ–љ—Л–Љ –Ґ–Р–С –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ core-–±–Є–Њ–њ—Б–Є–Є. –Я—А–Њ—Ж–µ–і—Г—А–∞ –≤—Л–њ–Њ–ї–љ—П–µ—В—Б—П –њ–Њ–і –Ї–Њ–љ—В—А–Њ–ї–µ–Љ –£–Ч–Ш. –Ш–≥–ї–∞ –і–ї—П core-–±–Є–Њ–њ—Б–Є–Є —Б–Њ—Б—В–Њ–Є—В –Є–Ј —Б—В–Є–ї–µ—В–∞, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–µ–≥–Њ –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є–µ —Б–Ї–≤–Њ–Ј—М –Љ—П–≥–Ї–Є–µ —В–Ї–∞–љ–Є, –Є —А–µ–ґ—Г—Й–µ–є –Ї–∞–љ—О–ї–Є, –Ї–Њ—В–Њ—А–∞—П —Б–ї—Г–ґ–Є—В –і–ї—П –Ј–∞–±–Њ—А–∞ –Њ–±—А–∞–Ј—Ж–Њ–≤. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б—В—А–Њ–µ–љ–Є—П –Є–≥–ї—Л –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ–Њ–ї—Г—З–Є—В—М –±–Њ–ї—М—И–Њ–є –Њ–±—К–µ–Љ –Љ–∞—В–µ—А–Є–∞–ї–∞ –і–ї—П –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ, –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Њ—Ж–µ–љ–Ї–Є –Ї–∞–њ—Б—Г–¶ b—Л —Г–Ј–ї–∞. –Т —А–∞–±–Њ—В–µ M. Paja et al. [32] core-–±–Є–Њ–њ—Б–Є—П –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–∞ –±–Њ–ї—М—И—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М (96%) –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М (93,7%) –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –њ–Њ–≤—В–Њ—А–љ–Њ–є –Ґ–Р–С –і–ї—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –Ї–∞—В–µ–≥–Њ—А–Є–Є III. –Ъ –љ–µ–і–Њ—Б—В–∞—В–Ї–∞–Љ –Љ–µ—В–Њ–і–∞ –Љ–Њ–ґ–љ–Њ –Њ—В–љ–µ—Б—В–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ —Б—В–∞–љ–і–∞—А—В–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Њ—Ж–µ–љ–Ї–Є –Њ–±—А–∞–Ј—Ж–Њ–≤, –∞ —В–∞–Ї–ґ–µ —В–µ—Е–љ–Є—З–µ—Б–Ї—Г—О —Б–ї–Њ–ґ–љ–Њ—Б—В—М –Љ–µ—В–Њ–і–∞ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Ґ–Р–С. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –і–Њ–ї–ґ–љ–Њ –≤—Л–њ–Њ–ї–љ—П—В—М—Б—П –Њ–њ—Л—В–љ—Л–Љ —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–Љ, –±–Њ–ї—М—И–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –≤—Л–±–Њ—А –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–є –і–ї–Є–љ—Л –Є–≥–ї—Л –Є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–∞ —П –Њ—Ж–µ–љ–Ї–∞ —В—А–∞–µ–Ї—В–Њ—А–Є–Є –µ–µ –≤–≤–µ–і–µ–љ–Є—П –њ—А–Є –£–Ч–Ш, —З—В–Њ –њ–Њ–≤—Л—И–∞–µ—В –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—Ж–µ–і—Г—А—Л [33].
–Ц–Є–і–Ї–Њ—Б—В–љ–∞—П —Ж–Є—В–Њ–ї–Њ–≥–Є—П (–Ц–¶) –©–Ц вАФ –Љ–µ—В–Њ–і –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –Ї–ї–µ—В–Њ—З–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї –Є–Ј —Г–Ј–ї–∞, –њ–Њ–ї—Г—З–∞–µ–Љ—Л–є –њ—А–Є –њ—Г–љ–Ї—Ж–Є–Є, –њ–Њ–Љ–µ—Й–∞–µ—В—Б—П –≤ –њ—А–Њ–±–Є—А–Ї—Г —Б –Ї–Њ–љ—Б–µ—А–≤–Є—А—Г—О—Й–Є–Љ —А–∞—Б—В–≤–Њ—А–Њ–Љ, —Ж–µ–љ—В—А–Є—Д—Г–≥–Є—А—Г–µ—В—Б—П, —Б –њ–Њ–Љ–Њ—Й—М—О –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–±–Њ—А–∞ —А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ –љ–∞–љ–Њ—Б–Є—В—Б—П –љ–∞ –њ—А–µ–і–Љ–µ—В–љ–Њ–µ —Б—В–µ–Ї–ї–Њ –Є –Њ–Ї—А–∞—И–Є–≤–∞–µ—В—Б—П. –Ъ–Њ–љ–µ—З–љ—Л–Љ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ —П–≤ –ї—П–µ—В—Б—П –≥–Њ—В–Њ–≤—Л–є —Б—В–µ–Ї–ї–Њ–њ—А–µ–њ–∞—А–∞—В, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –≤—Б–µ –Ї–ї–µ—В–Ї–Є —В–Њ–љ–Ї–Є–Љ —Б–ї–Њ–µ–Љ —Б–Њ—Б—А–µ–і–Њ—В–Њ—З–µ–љ—Л –≤ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є —А–∞–Ј–Љ–µ—А–Њ–Љ 13вАУ20 –Љ–Љ2. –Ь–µ—В–Њ–і –њ–Њ–Ј–≤–Њ–ї—П–µ—В –ї—Г—З—И–µ —Б–Њ—Е—А–∞–љ—П—В—М –Є —В—А–∞–љ—Б–њ–Њ—А—В–Є—А–Њ–≤–∞—В—М –Ї–ї–µ—В–Њ—З–љ—Л–є –Љ–∞—В–µ—А–Є–∞–ї, –∞ —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ—П—В—М –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—В–Њ–і—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є (–Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ, –Є–Љ–Љ—Г–љ–Њ—Ж–Є—В–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ). –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –ї—Г—З—И–µ –Њ—Ж–µ–љ–Є—В—М –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б—В—А–Њ–µ–љ–Є—П —П–і–µ—А –Ї–ї–µ—В–Њ–Ї, —В–∞–Ї –Ї–∞–Ї –≤ –Љ–∞–Ј–Ї–µ –Њ—В—Б—Г—В—Б—В–≤—Г—О—В —Б–≥—Г—Б—В–Ї–Є –Ї—А–Њ–≤–Є –Є —Д–Є–±—А–Є–љ–∞ [34]. –І—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ц–¶ —Б–Њ—Б—В–∞–≤–ї—П–µ—В 67%, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М вАФ 90%, —В–Њ—З–љ–Њ—Б—В—М вАФ 78%, –Ґ–Р–С вАФ 74, 58, 67% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Ц–¶ –Є –Ґ–Р–С —П–≤–ї—П—О—В—Б—П –≤–Ј–∞–Є–Љ–љ–Њ –і–Њ–њ–Њ–ї–љ—П—О—Й–Є–Љ–Є –і—А—Г–≥ –і—А—Г–≥–∞ –Љ–µ—В–Њ–і–∞–Љ–Є, –Є—Е —Б–Њ–≤–Љ–µ—Б—В–љ–Њ–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ–Њ–≤—Л—И–∞–µ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї—Г—О —В–Њ—З–љ–Њ—Б—В—М [4].
–Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Њ –њ—А–Є –≤–µ–і–µ–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г–Ј–ї–∞–Љ–Є III –Є IV –Ї–∞—В–µ–≥–Њ—А–Є–є Bethesda [13]. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤—Л—Б–Њ–Ї–Њ—Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —В–Њ—З–µ—З–љ–Њ–є –Љ—Г—В–∞—Ж–Є–Є BRAFV600E (–≤—Б—В—А–µ—З–∞–µ—В—Б—П –њ—А–Є –њ–∞–њ–Є–ї–ї—П—А–љ–Њ–Љ –†–©–Ц –≤ 45% —Б–ї—Г—З–∞–µ–≤). BRAFV600E –≤ 6,9% —Б–ї—Г—З–∞–µ–≤ –†–©–Ц —Б–Њ—З–µ—В–∞–µ—В—Б—П —Б TERT, —З—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–≤–Є—В–Є—О –≤—Л—Б–Њ–Ї–Њ–∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е —В–Є–њ–Њ–≤ –Њ–њ—Г—Е–Њ–ї–Є —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–µ—Ж–Є–і–Є–≤–∞ (68,6%) –Є —Г—Е—Г–і—И–∞–µ—В –њ—А–Њ–≥–љ–Њ–Ј [35, 36]. ATA —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –њ–∞–љ–µ–ї–Є (ThyroSeq v2, Afirma). –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ–∞–љ–µ–ї–Є –Є–Ј 7 –≥–µ–љ–Њ–≤ (BRAF, NRAS, HRAS, KRAS, RET/PTC1, RET/PTC3, PAX8/PPAR—Г) –і–ї—П —Г—В–Њ—З–љ–µ–љ–Є—П –і–Є–∞–≥–љ–Њ–Ј–∞ —Г–Ј–ї–Њ–≤ IV –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–Њ–Ї–∞–Ј–∞–ї–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М 57вАУ75%, —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В—М вАФ 97вАУ100% [2, 14].
–Я–Њ–Љ–Є–Љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ—Г—В–∞—Ж–Є–є –≥–µ–љ–Њ–≤ —В–∞–Ї–ґ–µ –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П —Г—А–Њ–≤–µ–љ—М –Љ–Є–Ї—А–Њ–†–Э–Ъ вАФ —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї, –≤–ї–Є—П—О—Й–Є—Е –љ–∞ —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ—Г—О –Є –њ–Њ—Б—В—В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Њ–љ–љ—Г—О —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –≥–µ–љ–Њ–≤. –Ь–Є–Ї—А–Њ–†–Э–Ъ –Љ–Њ–≥—Г—В —Б–ї—Г–ґ–Є—В—М –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–∞—А–Ї–µ—А–∞–Љ–Є –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞, –∞ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Є—Е —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є —Б–ї—Г–ґ–Є—В –≤—Б–њ–Њ–Љ–Њ–≥–∞—В–µ–ї—М–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –њ—А–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –†–©–Ц [37]. –Я—А–Њ–≤–Њ–і—П—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Њ—Ж–µ–љ–Є–≤–∞—О—Й–Є–µ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –њ—А–Њ—Д–Є–ї–µ–Љ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –Љ–Є–Ї—А–Њ–†–Э–Ъ –Є –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞ eb–Њ–Љ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є –©–Ц. –Т —А–∞–±–Њ—В–µ M. Knyazeva et al. [38] —А–µ—Ж–Є–њ—А–Њ–Ї–љ–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ —А–µ–≥—Г–ї—П—Ж–Є–Є —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є miR-146b –Є miR-451 –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ, —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б–Њ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–µ–є –Є –Є–љ–≤–∞–Ј–Є–≤–љ—Л–Љ —А–Њ—Б—В–Њ–Љ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л—Е –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –©–Ц.
–Ы–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ –Љ–µ—В–Њ–і—Л –Є–≥—А–∞—О—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –њ—А–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Г–Ј–ї–Њ–≤ –©–Ц. –Ю—Ж–µ–љ–Ї–∞ –±–∞–Ј–∞–ї—М–љ–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Љ–µ–і—Г–ї–ї—П—А–љ–Њ–≥–¶ e —А–∞–Ї–∞ (–Ь–†–©–Ц) –Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –Ґ–Р–С –њ–Њ —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є. –Я–Њ –і–∞–љ–љ—Л–Љ C.-Y. Liu et al. [39], –Ь–†–©–Ц –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П –њ—А–Є –Ґ–Р–С –≤ 91,7% —Б–ї—Г—З–∞–µ–≤, 4,8% –њ–Њ–њ–∞–і–∞–ї–Є –≤ –Ї–∞—В–µ–≥–Њ—А–Є—О FN/SFN, 2,1% вАФ –≤ –Ї–∞—В–µ–≥–Њ—А–Є—О AUS/FLUS, –µ—Й–µ –і–ї—П 1,4% —В–Є–њ —А–∞–Ї–∞ –љ–µ –±—Л–ї –њ—А–∞–≤–Є–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ. –Ъ–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—Ж–µ–љ–Є–≤–∞—В—М —Б —Г—З–µ—В–Њ–Љ –≥–µ–љ–і–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–ЄћЖ –≤–µ—А—Е–љ–µ–ЄћЖ –≥—А–∞–љ–Є—Ж—Л —А–µ—Д–µ—А–µ–љ—Б–∞ (–ґ–µ–љ—Й–Є–љ—Л вАФ –і–Њ 5 –њ–≥/–Љ–ї, –Љ—Г–ґ—З–Є–љ—Л вАФ –і–Њ 12 –њ–≥/–Љ–ї) [14]. –Я–Њ–≤—Л—И–µ–љ–Є–µ –±–∞–Ј–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞ –≤—Л—И–µ 100 –њ–≥/–Љ–ї –Ї—А–∞–ЄћЖ–љ–µ –њ–Њ–і–Њ–Ј—А–Є—В–µ–ї—М–љ–Њ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ь–†–©–Ц –Є —П–≤–ї—П–µ—В—Б—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –Њ–њ–µ—А–∞—Ж–Є–Є; —Г–Љ–µ—А–µ–љ–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–∞ (10вАУ100 –њ–≥/–Љ–ї) —В—А–µ–±—Г–µ—В –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ґ–Р–С –Є–Ј —Г–Ј–ї–∞ —Б–Њ —Б–Љ—Л–≤–Њ–Љ –љ–∞ –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ –ї–Є–±–Њ –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б—В–Є–Љ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ —В–µ—Б—В–∞ —Б –≥–ї—О–Ї–Њ–љ–∞—В–Њ–Љ –Ї–∞–ї—М—Ж–Є—П / –њ–µ–љ—В–∞–≥–∞—Б—В—А–Є–љ–Њ–Љ.
–†–∞–і–Є–Њ–љ—Г–Ї–ї–Є–і–љ—Л–µ –Љ–µ—В–Њ–і—Л
–Я–Њ–Ј–Є—В—А–Њ–љ–љ–Њ-—Н–Љ–Є—Б—Б–Є–Њ–љ–љ–∞—П —В–Њ–Љ–Њ–≥—А–∞—Д–Є—П —Б 18-—Д—В–Њ—А–і–µ–Ј–Њ–Ї—Б–Є–≥–ї—О–Ї–Њ–Ј–Њ–є, –Њ—В–ї–Є—З–∞—П—Б—М –±–Њ–ї—М—И–µ–є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –Є –Љ–µ–љ—М—И–µ–є —Б—В–Њ–Є–Љ–Њ—Б—В—М—О –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Њ–±–ї–∞–і–∞–µ—В –±–ї–Є–Ј–Ї–Њ–є –Ї 100% —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –њ—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є –†–©–Ц [40], –Њ–і–љ–∞–Ї–Њ –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ —А—Г—В–Є–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ —Г–Ј–ї–Њ–≤ –©–Ц –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є –ї—Г—З–µ–≤–Њ–є –љ–∞–≥—А—Г–Ј–Ї–Є. –§–Ф–У-–Я–≠–Ґ —П–≤–ї—П–µ—В—Б—П —В–µ—Б—В–Њ–Љ –Є—Б–Ї–ї—О—З–µ–љ–Є—П –і–ї—П –†–©–Ц —Б –≤—Л—Б–Њ–Ї–Њ–є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В—М—О (83,3%) –Є –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є –њ—А–Є —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Г–Ј–ї–∞—Е [41].
–°—Ж–Є–љ—В–Є–≥—А–∞—Д–Є—П вАФ —Н—В–Њ –Љ–µ—В–Њ–і —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є, –Ј–∞–Ї–ї—О—З–∞—О—Й–Є–є—Б—П –≤–Њ –≤–≤–µ–і–µ–љ–Є–Є –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ —А–∞–і–Є–Њ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Є–Ј–Њ—В–Њ–њ–∞ –Є –њ–Њ–ї—Г—З–µ–љ–Є–Є –і–≤—Г–Љ–µ—А–љ–Њ–≥–Њ –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П –њ—Г—В–µ–Љ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Є—Б–њ—Г—Б–Ї–∞–µ–Љ–Њ–≥–Њ –Є–Љ–Є ќ≥-–Є–Ј–ї—Г—З–µ–љ–Є—П –Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–є –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –©–Ц. –Э–∞–Є–±–Њ–ї–µ–µ –Є–Ј—Г—З–µ–љ–љ—Л–Љ –†–§–Я –і–ї—П –Њ—Ж–µ–љ–Ї–Є —Г–Ј–ї–Њ–≤ –©–Ц —П–≤–ї—П–µ—В—Б—П –Ь–Ш–С–Ш (–Љ–µ—В–Њ–Ї—Б–Є–Є–Ј–Њ–±—Г—В–Є–ї–Є–Ј–Њ–љ–Є—В—А–Є–ї), –Љ–µ—З–µ–љ–љ—Л–є 99m–Ґ—Б-–њ–µ—А—В–µ—Е–љ–µ—В–∞—В–Њ–Љ. –Я–Њ–њ–∞–і–∞—П –≤ –Ї–ї–µ—В–Ї—Г, –Њ–љ –ї–Њ–Ї–∞–ї–Є–Ј—Г–µ—В—Б—П –љ–∞ –Љ–µ–Љ–±—А–∞–љ–∞—Е –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–ЄћЖ, —Б—В–µ–њ–µ–љ—М –µ–≥–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –Њ—В–Њ–±—А–∞–ґ–∞–µ—В –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –Љ–Њ–ґ–µ—В —Г—З–Є—В—Л–≤–∞—В—М—Б—П –і–ї—П –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –†–©–Ц. –Э–∞ —Б–µ–≥–Њ–і–љ—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ ¬Ђ–≥–Њ—А—П—З–Є–µ¬ї —Г–Ј–ї—Л, –њ–Њ –і–∞–љ–љ—Л–Љ —Б—Ж–Є–љ—В–Є–≥—А–∞—Д–Є–Є —Б 99m–Ґ—Б-–Ь–Ш–С–Ш, —З–∞—Й–µ —П–≤–ї—П—О—В—Б—П –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і–ї–Є—В–µ–ї—М–љ—Г—О —Д–Є–Ї—Б–∞—Ж–Є—О –Ь–Ш–С–Ш [42]. –°—Ж–Є–љ—В–Є–≥—А–∞—Д–Є—П —Б 99m–Ґ—Б-–Ь–Ш–С–Ш —П–≤–ї—П–µ—В—Б—П —В–µ—Б—В–Њ–Љ –Є—Б–Ї–ї—О—З–µ–љ–Є—П —Б–Њ 100% –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ–Њ–є –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–љ–љ–Њ—Б—В—М—О, –Њ—В—Б—Г—В—Б—В–≤–Є–µ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –≤ —Г–Ј–ї–µ –†–§–Я –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ—М—О –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –Є—Б–Ї–ї—О—З–Є—В—М –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В—М [43].
–Т—Л—П–≤–ї–µ–љ–Є–µ —Г–Ј–ї–Њ–≤ III –Є IV –Ї–∞—В–µ–≥–Њ—А–Є–є Bethesda —П–≤–ї—П–µ—В—Б—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –Ї –њ—А–Њ–≤–µ–і–µ–љ–Є—О –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –ї–Є–±–Њ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –І–∞—Й–µ –≤—Б–µ–≥–Њ –њ—А–Њ–≤–Њ–і–Є—В—Б—П —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ вАФ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –љ–µ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В–Є –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ ATA –≥–µ–Љ–Є—В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є—П –≤ –і–∞–љ–љ–Њ–Љ —Б–ї—Г—З–∞–µ —П–≤–ї—П–µ—В—Б—П –Њ–њ–µ—А–∞—Ж–Є–µ–є –≤—Л–±–Њ—А–∞ [2]. –° f3—В—М –Њ–њ–µ—А–∞—Ж–Є–Є —Б–Њ—Б—В–Њ–Є—В –≤ —Г–і–∞–ї–µ–љ–Є–Є –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–є –і–Њ–ї–Є –©–Ц, –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ–ї–∞–љ–Њ–≤–Њ–µ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б –Њ—Ж–µ–љ–Ї–Њ–є –Ї–∞–њ—Б—Г–ї—Л —Г–Ј–ї–∞. –С–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є —Б–µ–≥–Њ–і–љ—П –≤—Л—Б—В—Г–њ–∞—О—В –њ—А–Њ—В–Є–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Ј–∞–Љ–Њ—А–Њ–ґ–µ–љ–љ—Л—Е —Б—А–µ–Ј–Њ–≤ —Г–Ј–ї–Њ–≤—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є –і–ї—П –Є–љ—В—А–∞–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤—Б–ї–µ–і—Б—В–≤–Є–µ –µ–≥–Њ –љ–Є–Ј–Ї–Њ–є —З f3–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є —Б–њ–µ—Ж–Є—Д–Є—З–љ–Њ—Б—В–Є. –І–µ—А–µ–Ј 6вАУ8 –љ–µ–і. –њ–Њ—Б–ї–µ –Њ–њ–µ—А–∞—Ж–Є–Є —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–∞ –Њ—Ж–µ–љ–Ї–∞ —В–Є—А–µ–Њ–Є–і–љ–Њ–≥–Њ —Б—В–∞—В—Г—Б–∞, –≤–Ї–ї—О—З–∞—О—Й–∞—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Ґ–Ґ–У –Є —Б–≤–Њ–±–Њ–і–љ–Њ–≥–Њ –Ґ4 –≤ –Ї—А–Њ–≤–Є. –Я—А–Є –≤—Л—П–≤–ї–µ–љ–Є–Є —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–Њ–є –∞–і–µ–љ–Њ–Љ—Л –ї–Є–±–Њ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ –Є–љ–≤–∞–Ј–Є–≤–љ–Њ–≥–Њ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ —А–∞–Ї–∞ –њ–Њ –і–∞–љ–љ—Л–Љ –≥–Є—Б—В–Њ–ї–Њ–≥–Є–Є —А–∞—Б—И–Є—А–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞ (–Ј–∞–≤–µ—А—И–∞—О—Й–∞—П —В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є—П) –љ–µ —В—А–µ–±—Г–µ—В—Б—П. –Т —Б–ї—Г—З–∞–µ –≤—Л—П–≤–ї–µ–љ–Є—П –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е –њ–Њ–і—В–Є–њ–Њ–≤ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ–Њ–≥–Њ —А–∞–Ї–∞ (–Є–љ–Ї–∞–њ—Б—Г–ї–Є—А–Њ–≤–∞–љ–љ—Л–є —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л–є —А–∞–Ї —Б —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –Є–љ–≤–∞–Ј–Є–µ–є, —И–Є—А–Њ–Ї–Њ–Є–љ–≤–∞–Ј–Є–≤–љ—Л–є —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л–є —А–∞–Ї) –њ—А–Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–¶ 8 —В—А–µ–±—Г–µ—В—Б—П –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –Ј–∞–≤–µ—А—И–∞—О—Й–µ–є —В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є–Є вАФ —Г–і–∞–ї–µ–љ–Є–µ –Њ—Б—В–∞–≤—И–µ–є—Б—П –і–Њ–ї–Є –©–Ц [35]. –Т —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ —В–Њ—В–∞–ї—М–љ–∞—П —В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є—П —П–≤–ї—П–µ—В—Б—П –Њ–њ–µ—А–∞—Ж–Є–µ–є –≤—Л–±–Њ—А–∞ –њ—А–Є –љ–µ–Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Г–Ј–ї–∞—Е –©–Ц. –°–Њ–≥–ї–∞—Б–љ–Њ T. Angell et al. [44] –і–Њ 44% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г–Ј–ї–∞–Љ–Є –©–Ц III –Є IV –Ї–∞—В–µ–≥–Њ—А–Є–є Bethesda –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П —В–Њ—В–∞–ї—М–љ–Њ–є —В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є–Є –≤ –Ї–∞—З–µ—Б—В–≤–µ –Є—Б—Е–Њ–і–љ–Њ–є –Њ–њ–µ—А–∞—Ж–Є–Є. –Ґ–Њ—В–∞–ї—М–љ–∞—П —В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є—П –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–∞ —Б –±–Њ–ї—М—И–Є–Љ —А–Є—Б–Ї–Њ–Љ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥–µ–Љ–Є—В–Є—А–µ–Њ–Є–і—Н–Ї—В–Њ–Љ–Є–µ–є: —В–∞–Ї, —А–Є—Б–Ї –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –≤–Њ–Ј–≤—А–∞—В–љ–Њ–≥–Њ –≥–Њ—А—В–∞–љ–љ–Њ–≥–Њ –љ–µ—А–≤–∞ –≤—Л—А–∞—Б—В–∞–µ—В –≤ 1,9 —А–∞–Ј–∞, —Б—В–Њ–є–Ї–Њ–≥–Њ –≥–Є–њ–Њ–њ–∞—А–∞—В–Є—А–µ–Њ–Ј–∞ вАФ –≤ 3,2 —А–∞–Ј–∞, –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –≥–µ–Љ–∞—В–Њ–Љ—Л вАФ –≤ 2,6 —А–∞–Ј–∞ [45].
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–°–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В—М —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤—Л—Е, —Ж–Є—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —А–∞–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї —Г–Ј–ї–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –µ–≥–Њ —Д–µ–љ–Њ—В–Є–њ–Є—З–µ—Б–Ї—Г—О –Ї–∞—А—В–Є–љ—Г. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤–µ–і–µ—В—Б—П –њ–Њ–Є—Б–Ї –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Д–µ–љ–Њ—В–Є–њ–Њ–Љ —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є –©–Ц –Є –Є—Е —А–Є—Б–Ї–Њ–Љ –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ—Б—В–Є. –Т –і–∞–љ–љ–Њ–Љ –Њ–±–Ј–Њ—А–µ –±—Л–ї–Є –њ—А–µ–і—Б f2–∞–≤–ї–µ–љ—Л —А–∞–Ј–ї–Є—З–љ—Л–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—В–Њ–і—Л, –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л–µ –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є III –Є IV –Ї–∞—В–µ–≥–Њ—А–Є–є Bethesda, –њ–Њ–Ј–≤–Њ–ї—П—О—Й–Є–µ –њ–Њ–≤—Л—Б–Є—В—М —В–Њ—З–љ–Њ—Б—В—М –њ—А–µ–і–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л—Е –Њ–њ—Г—Е–Њ–ї–µ–є. –Я—А–Њ–і–Њ–ї–ґ–∞—О—В—Б—П –њ–Њ–Є—Б–Ї–Є –љ–Њ–≤—Л—Е –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤, –≤–Ї–ї—О—З–∞—О—Й–Є—Е —А–∞–і–Є–Њ–Є–Ј–Њ—В–Њ–њ–љ—Л–µ, –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є –ї—Г—З–µ–≤—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —А–∞–Ј—А–∞–±–∞—В—Л–≤–∞—О—В—Б—П —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–Њ—В–Њ–Ї–Њ–ї—Л –≤–µ–і–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л–Љ–Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –≤ –±—Г–і—Г—Й–µ–Љ –њ–Њ–Ј–≤–Њ–ї—П—В –Ј–∞–Љ–µ—В–љ–Њ —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г –љ–µ–Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –©–Ц.








.gif)



