–ü–Α―²–Ψ–Φ–Ψ―Ä―³–Ψ–Ζ –Ξ–Γ–ù, –Ϋ–Α–±–Μ―é–¥–Α–Β–Φ―΄–Ι –≤ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄, –≤–Ψ –Φ–Ϋ–Ψ–≥–Ψ–Φ ―¹–≤―è–Ζ–Α–Ϋ ―¹ –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ ―ç―²–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Η―΅–Η–Ϋ ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Α. –ö–Μ–Α―¹―¹–Η–Κ–Η –Ψ―²–Β―΅–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι –Η –Ζ–Α―Ä―É–±–Β–Ε–Ϋ–Ψ–Ι –Φ–Β–¥–Η―Ü–Η–Ϋ―΄ –Η–Φ–Β–Μ–Η –¥–Β–Μ–Ψ –Ω―Ä–Β–Η–Φ―É―â–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ ―¹ –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ–Η, ―¹―²―Ä–Α–¥–Α―é―â–Η–Φ–Η –Κ–Ψ―Ä–Ψ–Ϋ–Α―Ä–Ϋ–Ψ–Ι –±–Ψ–Μ–Β–Ζ–Ϋ―¨―é ―¹–Β―Ä–¥―Ü–Α, –Ζ–Α―΅–Α―¹―²―É―é –Ω–Β―Ä–Β–Ϋ–Β―¹―à–Η–Φ–Η –Κ–Α–Κ–Η–Β-–Μ–Η–±–Ψ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ-―¹–Ψ―¹―É–¥–Η―¹―²―΄–Β ―¹–Ψ–±―΄―²–Η―è. –Γ–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ, –≤ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Κ–Α―Ä―²–Η–Ϋ–Β –≤–Β–¥―É―â–Η–Φ–Η ―è–≤–Μ―è–Μ–Η―¹―¨ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η ―¹–Η―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–Ι –¥–Η―¹―³―É–Ϋ–Κ―Ü–Η–Η –Μ–Β–≤–Ψ–≥–Ψ –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Α.
–Γ―²–Α–Ϋ–¥–Α―Ä―² ―³–Α―Ä–Φ–Α–Κ–Ψ―²–Β―Ä–Α–Ω–Η–Η ―¹–Η―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–Ι –Ξ–Γ–ù –±―΄–Μ –Ω―Ä–Β–¥–Μ–Ψ–Ε–Β–Ϋ –ï–≤―Ä–Ψ–Ω–Β–Ι―¹–Κ–Η–Φ –Ψ–±―â–Β―¹―²–≤–Ψ–Φ –Κ–Α―Ä–¥–Η–Ψ–Μ–Ψ–≥–Ψ–≤ –≤ 2008 –≥., –Η –≤ –Ϋ–Ψ–≤―΄―Ö ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η―è―Ö 2012 –≥. –≤ –Ϋ–Β–≥–Ψ –±―΄–Μ–Η –≤–Ϋ–Β―¹–Β–Ϋ―΄ –Ϋ–Β–Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―΄–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è [1]. –‰―²–Α–Κ, –Μ–Β―΅–Β–Ϋ–Η–Β –Ϋ–Α―΅–Η–Ϋ–Α–Β―²―¹―è ―¹ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä–Α –ê–ü–Λ, –≤ ―¹–Μ―É―΅–Α–Β –Β–≥–Ψ –Ϋ–Β–Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²–Η – –±–Μ–Ψ–Κ–Α―²–Ψ―Ä–Α ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤ –Α–Ϋ–≥–Η–Ψ―²–Β–Ϋ–Ζ–Η–Ϋ–Α II, –≤ ―¹–Μ―É―΅–Α–Β –Η–Φ–Β―é―â–Β–≥–Ψ―¹―è –Ζ–Α―¹―²–Ψ―è – –Β―â–Β –Η –¥–Η―É―Ä–Β―²–Η–Κ–Α. –Γ–Μ–Β–¥―É―é―â–Η–Φ ―ç―²–Α–Ω–Ψ–Φ ―è–≤–Μ―è–Β―²―¹―è –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β β-–Α–¥―Ä–Β–Ϋ–Ψ–±–Μ–Ψ–Κ–Α―²–Ψ―Ä–Α –Η –Α–Ϋ―²–Α–≥–Ψ–Ϋ–Η―¹―²–Α –Α–Μ―¨–¥–Ψ―¹―²–Β―Ä–Ψ–Ϋ–Α. –ü―Ä–Η –Ϋ–Β―É―¹–Ω–Β―à–Ϋ–Ψ―¹―²–Η ―²–Β―Ä–Α–Ω–Η–Η –Ω―Ä–Η–Φ–Β–Ϋ―è―é―²―¹―è –¥―Ä―É–≥–Η–Β –≥―Ä―É–Ω–Ω―΄ –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ (―¹–Β―Ä–¥–Β―΅–Ϋ―΄–Β –≥–Μ–Η–Κ–Ψ–Ζ–Η–¥―΄, ―ç―²–Η–Μ–Ψ–≤―΄–Β ―ç―³–Η―Ä―΄ –Ψ–Φ–Β–≥–Α–3 –ü–ù–•–ö –Η –¥―Ä.), –Η―¹–Ω–Ψ–Μ―¨–Ζ―É―é―²―¹―è ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Β ―É―¹―²―Ä–Ψ–Ι―¹―²–≤–Α – –Η–Φ–Ω–Μ–Α–Ϋ―²–Η―Ä―É–Β–Φ―΄–Β –Κ–Α―Ä–¥–Η–Ψ–≤–Β―Ä―²–Β―Ä―΄-–¥–Β―³–Η–±―Ä–Η–Μ–Μ―è―²–Ψ―Ä―΄ (–‰–ö–î), –Α–Ω–Ω–Α―Ä–Α―²―΄ –¥–Μ―è –Κ–Α―Ä–¥–Η–Α–Μ―¨–Ϋ–Ψ–Ι ―Ä–Β―¹–Η–Ϋ―Ö―Ä–Ψ–Ϋ–Η–Ζ–Η―Ä―É―é―â–Β–Ι ―²–Β―Ä–Α–Ω–Η–Η, –≤ –Κ–Ψ–Ϋ–Β―΅–Ϋ―΄―Ö ―¹―²–Α–¥–Η―è―Ö – –Ω–Β―Ä–Β―¹–Α–¥–Κ–Α ―¹–Β―Ä–¥―Ü–Α, –Η–Φ–Ω–Μ–Α–Ϋ―²–Α―Ü–Η―è –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –Μ–Β–≤―΄―Ö –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Ψ–≤ –Η–Μ–Η –Φ–Η–Ϋ–Η-–Η–Ϋ–≤–Α–Ζ–Η–≤–Ϋ―΄―Ö –Ϋ–Α―¹–Ψ―¹–Ψ–≤ [1]. –ö–Α–Κ–Ψ–≤–Ψ –Ε–Β –Φ–Β―¹―²–Ψ –¥–Η―É―Ä–Β―²–Η–Κ–Ψ–≤ –≤ –¥–Α–Ϋ–Ϋ–Ψ–Ι ―¹―Ö–Β–Φ–Β –Μ–Β―΅–Β–Ϋ–Η―è?
–£ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è –¥–Η―É―Ä–Β―²–Η–Κ–Η –Ζ–Α–Ϋ–Η–Φ–Α―é―² –Ψ–¥–Ϋ–Ψ –Η–Ζ –≤–Β–¥―É―â–Η―Ö –Φ–Β―¹―²–Ψ –≤ –Μ–Β―΅–Β–Ϋ–Η–Η ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η. –ü―Ä–Η ―ç―²–Ψ–Φ –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ ―¹ ―²–Ψ―΅–Κ–Η –Ζ―Ä–Β–Ϋ–Η―è –¥–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Φ–Β–¥–Η―Ü–Η–Ϋ―΄ –¥–Η―É―Ä–Β―²–Η–Κ–Η – ―¹–Α–Φ―΄–Β –Ϋ–Β–Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Ϋ―΄–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²―΄ –¥–Μ―è ―²–Β―Ä–Α–Ω–Η–Η –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –Ξ–Γ–ù. –Γ –Ψ–¥–Ϋ–Ψ–Ι ―¹―²–Ψ―Ä–Ψ–Ϋ―΄, –Η―Ö ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²―¨ –¥–Μ―è –Μ–Β―΅–Β–Ϋ–Η―è –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –¥–Β–Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Α―Ü–Η–Β–Ι –Ϋ–Β –≤―΄–Ζ―΄–≤–Α–Β―² ―¹–Ψ–Φ–Ϋ–Β–Ϋ–Η–Ι. –Γ –¥―Ä―É–≥–Ψ–Ι, –¥–Α–Ε–Β –Ω―Ä–Η –Ε–Β–Μ–Α–Ϋ–Η–Η, –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η–Β –Ω–Μ–Α―Ü–Β–±–Ψ-–Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä―É–Β–Φ―΄―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι ―¹ –Φ–Ψ―΅–Β–≥–Ψ–Ϋ–Ϋ―΄–Φ–Η –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α–Φ–Η –≤―΄–≥–Μ―è–¥–Η―² ―²―Ä―É–¥–Ϋ–Ψ–Ψ―¹―É―â–Β―¹―²–≤–Η–Φ―΄–Φ. –î–Μ―è ―²–Α–Κ–Ψ–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ ―¹–Ψ–Ζ–¥–Α–Ϋ–Η–Β –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ ―¹―Ä–Β–¥–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Ξ–Γ–ù, –≤―Ö–Ψ–¥―è―â–Η–Β –≤ –Ϋ–Β–Β –±–Ψ–Μ―¨–Ϋ―΄–Β –Ζ–Α–≤–Β–¥–Ψ–Φ–Ψ –±―É–¥―É―² –Μ–Η―à–Β–Ϋ―΄ –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ―¹―²–Η –Ω―Ä–Η–Ϋ–Η–Φ–Α―²―¨ –Φ–Ψ―΅–Β–≥–Ψ–Ϋ–Ϋ―΄–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²―΄, ―΅―²–Ψ –≤―΄–≥–Μ―è–¥–Η―² –Ω―Ä–Α–Κ―²–Η―΅–Β―¹–Κ–Η –Ϋ–Β–≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ―΄–Φ. –‰―¹―Ö–Ψ–¥―è –Η–Ζ ―ç―²–Ψ–≥–Ψ, –¥–Η―É―Ä–Β―²–Η–Κ–Η a priori –Ω―Ä–Η―΅–Η―¹–Μ–Β–Ϋ―΄ –Κ –Ψ―¹–Ϋ–Ψ–≤–Ϋ―΄–Φ –Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ―΄–Φ –Μ–Β–Κ–Α―Ä―¹―²–≤–Α–Φ –¥–Μ―è –Μ–Β―΅–Β–Ϋ–Η―è –Ξ–Γ–ù [1–3].
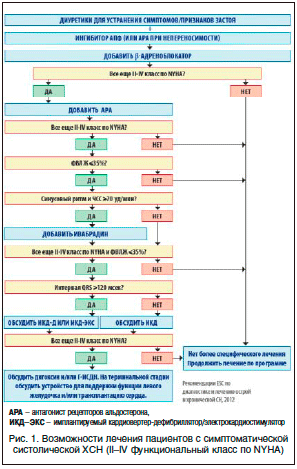
–ù–Α–Η–±–Ψ–Μ–Β–Β ―΅–Β―²–Κ–Ψ ―ç―²–Ψ –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ –≤ –Α–Μ–≥–Ψ―Ä–Η―²–Φ–Β –Μ–Β―΅–Β–Ϋ–Η―è ―¹–Η―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–Ι –Ξ–Γ–ù, ―¹–Ψ–≥–Μ–Α―¹–Ϋ–Ψ ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η―è–Φ ESC-2012 (―Ä–Η―¹. 1, ―Ü–Η―². –Ω–Ψ [1]). –ö–Α–Κ –Φ–Ψ–Ε–Ϋ–Ψ ―É–≤–Η–¥–Β―²―¨, –¥–Η―É―Ä–Β―²–Η–Κ–Η ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Ψ–≤–Α–Ϋ―΄ –≤–Ϋ–Β –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Κ–Μ–Α―¹―¹–Α –≤―¹–Β–Φ –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ ―¹ –Η–Φ–Β―é―â–Η–Φ―¹―è –Ψ―²–Β―΅–Ϋ―΄–Φ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Ψ–Φ.
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –¥–Η―É―Ä–Β―²–Η–Κ–Η –Ω―Ä–Η–Φ–Β–Ϋ―è―é―²―¹―è –¥–Μ―è ―É―¹―²―Ä–Α–Ϋ–Β–Ϋ–Η―è –Ψ―²–Β―΅–Ϋ–Ψ–≥–Ψ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Α –Η ―É–Μ―É―΅―à–Β–Ϋ–Η―è –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η–Κ–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ξ–Γ–ù. –ü―Ä–Η –Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ–Φ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η ―ç―²–Η ―¹―Ä–Β–¥―¹―²–≤–Α –Ω–Ψ–Ζ–≤–Ψ–Μ―è―é―² ―É–Φ–Β–Ϋ―¨―à–Η―²―¨ ―΅–Η―¹–Μ–Ψ –≥–Ψ―¹–Ω–Η―²–Α–Μ–Η–Ζ–Α―Ü–Η–Ι, ―΅―²–Ψ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤―É–Β―² –¥–Ψ―¹―²–Η–Ε–Β–Ϋ–Η―é –¥–≤―É―Ö –Η–Ζ ―à–Β―¹―²–Η –Ψ―¹–Ϋ–Ψ–≤–Ϋ―΄―Ö ―Ü–Β–Μ–Β–Ι –Ω―Ä–Η –Μ–Β―΅–Β–Ϋ–Η–Η –Ξ–Γ–ù. –ë–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –¥–Η―É―Ä–Β―²–Η–Κ–Ψ–≤ (–Κ―Ä–Ψ–Φ–Β ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α) –Ϋ–Β –Ζ–Α–Φ–Β–¥–Μ―è―é―² –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –Ξ–Γ–ù –Η –Ϋ–Β ―É–Μ―É―΅―à–Α―é―² –Ω―Ä–Ψ–≥–Ϋ–Ψ–Ζ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö. –‰―Ö –≤–Μ–Η―è–Ϋ–Η–Β –Ϋ–Α –Κ–Α―΅–Β―¹―²–≤–Ψ –Ε–Η–Ζ–Ϋ–Η –Ω―Ä–Η –Ϋ–Β–Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ–Φ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Η (―É–¥–Α―Ä–Ϋ―΄–Β –¥–Ψ–Ζ―΄ 1 ―Ä–Α–Ζ –≤ 3–7 –¥–Ϋ–Β–Ι) –Φ–Ψ–Ε–Β―² –±―΄―²―¨ –¥–Α–Ε–Β –Ϋ–Β–≥–Α―²–Η–≤–Ϋ―΄–Φ.
–Γ–Ψ–≥–Μ–Α―¹–Ϋ–Ψ ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Φ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Φ ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η―è–Φ, –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α ―è–≤–Μ―è–Β―²―¹―è –±–Ψ–Μ–Β–Β –Ω―Ä–Η–Β–Φ–Μ–Β–Φ―΄–Φ –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –¥―Ä―É–≥–Η–Φ–Η –¥–Η―É―Ä–Β―²–Η–Κ–Α–Φ–Η –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Κ–Μ–Α―¹―¹–Α [1–3]. –ö–Α–Κ–Ψ–≤―΄ –¥–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β –Ω―Ä–Β–Η–Φ―É―â–Β―¹―²–≤–Α –¥–Α–Ϋ–Ϋ–Ψ–≥–Ψ ―¹―Ä–Β–¥―¹―²–≤–Α, –Ω–Ψ–Ζ–≤–Ψ–Μ–Η–≤―à–Η–Β –≤―΄–¥–Β–Μ–Η―²―¨ –Β–≥–Ψ –Η–Ζ ―΅–Η―¹–Μ–Α –¥―Ä―É–≥–Η―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤?
–£ –Ω–Β―Ä–≤―É―é –Ψ―΅–Β―Ä–Β–¥―¨ ―ç―²–Ψ ―¹–≤―è–Ζ–Α–Ϋ–Ψ ―¹ –Β–≥–Ψ –Α–Ϋ―²–Η–Α–Μ―¨–¥–Ψ―¹―²–Β―Ä–Ψ–Ϋ–Ψ–≤―΄–Φ –Η –Α–Ϋ―²–Η―³–Η–±―Ä–Ψ―²–Η―΅–Β―¹–Κ–Η–Φ –¥–Β–Ι―¹―²–≤–Η–Β–Φ, –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Ϋ―΄–Φ –Κ–Α–Κ –≤ ―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄―Ö, ―²–Α–Κ –Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö ―Ä–Α–±–Ψ―²–Α―Ö. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, ―¹–Μ–Β–¥―É–Β―² –Ψ―²–Φ–Β―²–Η―²―¨ –Μ―É―΅―à―É―é –±–Β–Ζ–Ψ–Ω–Α―¹–Ϋ–Ψ―¹―²―¨ –Η –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²―¨ ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ ―³―É―Ä–Ψ―¹–Β–Φ–Η–¥–Ψ–Φ [2, 3].
–£ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄ –≤ –Α―Ä―¹–Β–Ϋ–Α–Μ–Β –≤―Ä–Α―΅–Β–Ι-–Κ–Α―Ä–¥–Η–Ψ–Μ–Ψ–≥–Ψ–≤ –Ϋ–Α―à–Β–Ι ―¹―²―Ä–Α–Ϋ―΄ –Ω–Ψ―è–≤–Η–Μ―¹―è –Ψ―Ä–Η–≥–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Ι ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥ –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è –ë―Ä–Η―²–Ψ–Φ–Α―Ä. –≠―²–Ψ –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² –¥–Ψ–±–Η―²―¨―¹―è –¥–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Β–Η–Φ―É―â–Β―¹―²–≤ –≤ –Μ–Β―΅–Β–Ϋ–Η–Η.
–Δ–Ψ―Ä–Α―¹–Β–Φ–Η–¥ ―¹ –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ―΄–Φ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η–Β–Φ –Ω―Ä–Η –¥–Ψ–Μ–≥–Ψ―¹―Ä–Ψ―΅–Ϋ–Ψ–Φ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η –Ϋ–Β –≤―΄–Ζ―΄–≤–Α–Β―² –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι ―É―Ä–Ψ–≤–Ϋ―è –Κ–Α–Μ–Η―è –Κ―Ä–Ψ–≤–Η, –Α –¥–Ψ–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ ―É―Ä–Ψ–≤–Ϋ–Β–Φ –Κ–Α–Μ–Η―è ―¹―΄–≤–Ψ―Ä–Ψ―²–Κ–Η –Κ―Ä–Ψ–≤–Η –Φ–Β–Ϋ–Β–Β 3,5 –Φ–Φ–Ψ–Μ―¨/–Μ –Ϋ–Β –Ψ―²–Μ–Η―΅–Α–Β―²―¹―è –Ψ―² ―²–Α–Κ–Ψ–≤–Ψ–Ι ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö –Ω–Μ–Α―Ü–Β–±–Ψ. –£–Φ–Β―¹―²–Β ―¹ ―²–Β–Φ ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥ ―¹ –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ―΄–Φ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η–Β–Φ –Ϋ–Β –Ψ–Κ–Α–Ζ―΄–≤–Α–Β―² –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–≥–Ψ –≤–Μ–Η―è–Ϋ–Η―è –Ϋ–Α ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Κ–Α–Μ―¨―Ü–Η―è –Η –Φ–Α–≥–Ϋ–Η―è, –Ϋ–Β –Η–Ζ–Φ–Β–Ϋ―è–Β―² –≥–Μ–Η–Κ–Β–Φ–Η―΅–Β―¹–Κ–Η–Ι –Η –Μ–Η–Ω–Η–¥–Ϋ―΄–Ι –Ω―Ä–Ψ―³–Η–Μ―¨ [4].
–Δ–Ψ―Ä–Α―¹–Β–Φ–Η–¥ ―¹ –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ―΄–Φ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η–Β–Φ –Ϋ–Β –≤–Ζ–Α–Η–Φ–Ψ–¥–Β–Ι―¹―²–≤―É–Β―² ―¹ –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Α–Φ–Η (–≤–Α―Ä―³–Α―Ä–Η–Ϋ–Ψ–Φ, ―³–Β–Ϋ–Ω―Ä–Ψ–Κ―É–Φ–Ψ–Ϋ–Ψ–Φ), ―¹–Β―Ä–¥–Β―΅–Ϋ―΄–Φ–Η –≥–Μ–Η–Κ–Ψ–Ζ–Η–¥–Α–Φ–Η –Η–Μ–Η –Ψ―Ä–≥–Α–Ϋ–Η―΅–Β―¹–Κ–Η–Φ–Η –Ϋ–Η―²―Ä–Α―²–Α–Φ–Η. –ü―Ä–Η ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è ―¹ β-–±–Μ–Ψ–Κ–Α―²–Ψ―Ä–Α–Φ–Η, –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä–Α–Φ–Η –ê–ü–Λ, –±–Μ–Ψ–Κ–Α―²–Ψ―Ä–Α–Φ–Η ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α –Α–Ϋ–≥–Η–Ψ―²–Β–Ϋ–Ζ–Η–Ϋ–Α II, –±–Μ–Ψ–Κ–Α―²–Ψ―Ä–Α–Φ–Η –Κ–Α–Μ―¨―Ü–Η–Β–≤―΄―Ö –Κ–Α–Ϋ–Α–Μ–Ψ–≤ –Ϋ–Β –±―΄–Μ–Ψ –≤―΄―è–≤–Μ–Β–Ϋ–Ψ –Ϋ–Ψ–≤―΄―Ö –Η–Μ–Η ―É―¹–Η–Μ–Β–Ϋ–Η―è ―É–Ε–Β –Η–Φ–Β―é―â–Η―Ö―¹―è –Ϋ–Β–Ε–Β–Μ–Α―²–Β–Μ―¨–Ϋ―΄―Ö ―è–≤–Μ–Β–Ϋ–Η–Ι. –Δ–Α–Κ–Ε–Β –Ψ―²―¹―É―²―¹―²–≤―É―é―² ―³–Α―Ä–Φ–Α–Κ–Ψ–Κ–Η–Ϋ–Β―²–Η―΅–Β―¹–Κ–Η–Β –Η–Μ–Η ―³–Α―Ä–Φ–Α–Κ–Ψ–¥–Η–Ϋ–Α–Φ–Η―΅–Β―¹–Κ–Η–Β –≤–Ζ–Α–Η–Φ–Ψ–¥–Β–Ι―¹―²–≤–Η―è ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è ―¹–Ψ ―¹–Ω–Η―Ä–Ψ–Ϋ–Ψ–Μ–Α–Κ―²–Ψ–Ϋ–Ψ–Φ [4].
–ù–Ψ –≤―¹–Β–≥–¥–Α –Μ–Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²―¨ –Ω―Ä–Η–Β–Φ–Α –Η–Μ–Η –≤―΄–±–Ψ―Ä –¥–Ψ–Ζ―΄ –¥–Η―É―Ä–Β―²–Η–Κ–Α –¥–Ψ–Μ–Ε–Ϋ―΄ –Ζ–Α–≤–Η―¹–Β―²―¨ ―²–Ψ–Μ―¨–Κ–Ψ –Ψ―² –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η–Κ–Η? –‰–Ζ–≤–Β―¹―²–Ϋ–Ψ, ―΅―²–Ψ –Ω–Ψ―¹–Μ–Β –Ψ―Ü–Β–Ϋ–Κ–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Ω–Α―Ü–Η–Β–Ϋ―²–Α, ―³–Η–Ζ–Η–Κ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è, –Α –Η–Ϋ–Ψ–≥–¥–Α –¥–Α–Ε–Β –Η –Ω–Ψ―¹–Μ–Β ―ç―Ö–Ψ–Κ–Α―Ä–¥–Η–Ψ–≥―Ä–Α―³–Η–Η –Η ―Ä–Β–Ϋ―²–≥–Β–Ϋ–Ψ–≥―Ä–Α―³–Η–Η –≥―Ä―É–¥–Ϋ–Ψ–Ι –Κ–Μ–Β―²–Κ–Η –Κ–Μ–Η–Ϋ–Η―Ü–Η―¹―² ―΅–Α―¹―²–Ψ ―¹―²–Α–Μ–Κ–Η–≤–Α–Β―²―¹―è ―¹ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―΅–Β―¹–Κ–Η–Φ–Η ―¹–Μ–Ψ–Ε–Ϋ–Ψ―¹―²―è–Φ–Η, –Ζ–Α―²―Ä―É–¥–Ϋ―è―é―â–Η–Φ–Η –≤―΄–±–Ψ―Ä –Α–¥–Β–Κ–≤–Α―²–Ϋ–Ψ–Ι ―²–Α–Κ―²–Η–Κ–Η –Μ–Β―΅–Β–Ϋ–Η―è [5, 6]. –‰–Ζ–≤–Β―¹―²–Ϋ―΄ –Ϋ–Β―¹–Ψ–Φ–Ϋ–Β–Ϋ–Ϋ―΄–Β –¥–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨―¹―²–≤–Α ―²–Ψ–≥–Ψ, ―΅―²–Ψ –¥–Μ―è ―ç―²–Η―Ö ―Ü–Β–Μ–Β–Ι –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –Φ–Ψ–Ζ–≥–Ψ–≤–Ψ–≥–Ψ –Ϋ–Α―²―Ä–Η–Ι―É―Ä–Β―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω–Β–Ω―²–Η–¥–Α (–€–ù–ü) –Η–Μ–Η –Β–≥–Ψ NT-–Κ–Ψ–Ϋ―Ü–Β–≤–Ψ–≥–Ψ –Ω―Ä–Β–¥―à–Β―¹―²–≤–Β–Ϋ–Ϋ–Η–Κ–Α (NT-–Ω―Ä–Ψ–€–ù–ü) [6–11]. –ü―Ä–Η ―ç―²–Ψ–Φ –¥–Α–Ϋ–Ϋ―΄–Ι –Φ–Β―²–Ψ–¥ –Ω–Ψ―΅―²–Η ―¹―Ä–Α–Ζ―É –≤―΄―à–Β–Μ –Ζ–Α –Ω―Ä–Β–¥–Β–Μ―΄ ―΅–Η―¹―²–Ψ –Ϋ–Α―É―΅–Ϋ–Ψ–≥–Ψ –Η ―¹ ―É―¹–Ω–Β―Ö–Ψ–Φ –Ω―Ä–Η–Φ–Β–Ϋ―è–Β―²―¹―è –≤ ―Ä–Β–Α–Μ―¨–Ϋ–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ–Β [7, 12]. –û–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β –€–ù–ü –Ζ–Ϋ–Α―΅–Η–Φ–Ψ –Ψ–±–Μ–Β–≥―΅–Α–Β―² –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ –¥–Η―³―³–Β―Ä–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―É―é –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ―É –Ω―Ä–Η –Ψ―¹―²―Ä–Ψ–Ι –Ψ–¥―΄―à–Κ–Β, –Ϋ–Ψ –Η –Ω–Ψ–Φ–Ψ–≥–Α–Β―² ―΅–Β―²–Κ–Ψ –Ψ–Ω―Ä–Β–¥–Β–Μ–Η―²―¨ ―¹―²–Β–Ω–Β–Ϋ―¨ –¥–Η―¹―³―É–Ϋ–Κ―Ü–Η–Η ―¹–Β―Ä–¥―Ü–Α –Η/–Η–Μ–Η ―É―¹–Ω–Β―à–Ϋ–Ψ―¹―²―¨ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Φ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η [7, 12–14].
–£ ―¹–≤―è–Ζ–Η ―¹ ―ç―²–Η–Φ –Ϋ–Α–Φ–Η –±―΄–Μ–Ψ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ψ –Ψ–¥–Ϋ–Ψ―Ü–Β–Ϋ―²―Ä–Ψ–≤–Ψ–Β ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Β –Ψ―²–Κ―Ä―΄―²–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β, ―Ü–Β–Μ―¨―é –Κ–Ψ―²–Ψ―Ä–Ψ–≥–Ψ ―è–≤–Μ―è–Μ–Ψ―¹―¨ –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β ―¹―Ä–Α–≤–Ϋ–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ω―Ä–Ψ–Μ–Ψ–Ϋ–≥–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è –Η ―³―É―Ä–Ψ―¹–Β–Φ–Η–¥–Α ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Ξ–Γ–ù II–III –Λ–ö, –Ψ―²–Β―΅–Ϋ―΄–Φ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Ψ–Φ –Η –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Φ ―É―Ä–Ψ–≤–Ϋ–Β–Φ –Ϋ–Α―²―Ä–Η–Ι―É―Ä–Β―²–Η―΅–Β―¹–Κ–Η―Ö –Ω–Β–Ω―²–Η–¥–Ψ–≤ –Ϋ–Α ―¹―²–Β–Ω–Β–Ϋ―¨ ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η―è –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η NT-–Ω―Ä–Ψ–€–ù–ü.
–£ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –±―΄–Μ–Η –≤–Κ–Μ―é―΅–Β–Ϋ―΄ 40 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Ξ–Γ–ù II–III –Λ–ö –Η―à–Β–Φ–Η―΅–Β―¹–Κ–Ψ–Ι ―ç―²–Η–Ψ–Μ–Ψ–≥–Η–Η ―¹ –Λ–£ –¦–• –Φ–Β–Ϋ–Β–Β 40%, ―Ä–Α–Ζ–¥–Β–Μ–Β–Ϋ–Ϋ―΄―Ö –Ϋ–Α –¥–≤–Β ―Ä–Α–≤–Ϋ―΄–Β –≥―Ä―É–Ω–Ω―΄ –Φ–Β―²–Ψ–¥–Ψ–Φ ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Α―Ü–Η–Η –≤ –Κ–Ψ–Ϋ–≤–Β―Ä―²–Α―Ö. –ü–Β―Ä–≤–Α―è –≥―Ä―É–Ω–Ω–Α –≤ –Κ–Α―΅–Β―¹―²–≤–Β –¥–Η―É―Ä–Β―²–Η–Κ–Α –Ω–Ψ–Μ―É―΅–Α–Μ–Α ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥ –Ω―Ä–Ψ–Μ–Ψ–Ϋ–≥–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è (–ë―Ä–Η―²–Ψ–Φ–Α―Ä, ―³–Α―Ä–Φ–Α―Ü–Β–≤―²–Η―΅–Β―¹–Κ–Α―è –Κ–Ψ–Φ–Ω–Α–Ϋ–Η―è «–Δ–Α–Κ–Β–¥–Α»), –≤―²–Ψ―Ä–Α―è – ―³―É―Ä–Ψ―¹–Β–Φ–Η–¥. –Δ–Η―²―Ä–Ψ–≤–Α–Ϋ–Η–Β –¥–Ψ–Ζ―΄ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Ψ―¹―¨ –Ω–Ψ ―¹―²–Α–Ϋ–¥–Α―Ä―²–Ϋ–Ψ–Ι ―¹―Ö–Β–Φ–Β –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Ψ―²–Β―΅–Ϋ–Ψ–≥–Ψ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Α. –Γ―Ä–Ψ–Κ ―²–Β―Ä–Α–Ω–Η–Η – 3 –Φ–Β―¹. (12 –Ϋ–Β–¥.). –£―¹–Β –Η–Ζ―É―΅–Α–Β–Φ―΄–Β –Ω–Α―Ä–Α–Φ–Β―²―Ä―΄ –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Η―¹―¨ –Η―¹―Ö–Ψ–¥–Ϋ–Ψ –≤ –Κ–Ψ–Ϋ―Ü–Β –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è, ―²–Α–Κ–Ε–Β –±―΄–Μ–Η –Ω―Ä–Β–¥―É―¹–Φ–Ψ―²―Ä–Β–Ϋ―΄ –¥–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄–Β –≤–Η–Ζ–Η―²―΄ –¥–Μ―è ―²–Η―²―Ä–Ψ–≤–Α–Ϋ–Η―è –¥–Ψ–Ζ―΄ –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ –Η –Ψ―Ü–Β–Ϋ–Κ–Η –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²–Η –Μ–Β―΅–Β–Ϋ–Η―è.
–ö―Ä–Η―²–Β―Ä–Η―è–Φ–Η –≤–Κ–Μ―é―΅–Β–Ϋ–Η―è ―è–≤–Μ―è–Μ–Η―¹―¨: –Ξ–Γ–ù II–III –Λ–ö –Η―à–Β–Φ–Η―΅–Β―¹–Κ–Ψ–Ι ―ç―²–Η–Ψ–Μ–Ψ–≥–Η–Η (–≤ ―Ä–Α–Φ–Κ–Α―Ö –Ϋ–Α―à–Β–Ι ―Ä–Α–±–Ψ―²―΄ –≤ –Ϋ–Β–Β –≤–Κ–Μ―é―΅–Α–Μ–Η―¹―¨ –Ω–Α―Ü–Η–Β–Ϋ―²―΄, –Ω–Β―Ä–Β–Ϋ–Β―¹―à–Η–Β –Η–Ϋ―³–Α―Ä–Κ―² –Φ–Η–Ψ–Κ–Α―Ä–¥–Α, –¥–Ψ–Κ―É–Φ–Β–Ϋ―²–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Ι –Ω–Ψ –≤―΄–Ω–Η―¹–Κ–Α–Φ –Η–Μ–Η –Φ–Β―²–Ψ–¥–Α–Φ–Η –≤–Η–Ζ―É–Α–Μ–Η–Ζ–Α―Ü–Η–Η) ―¹ ―¹–Η―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Ψ–Ι –¥–Η―¹―³―É–Ϋ–Κ―Ü–Η–Β–Ι –¦–• (–Λ–£ –¦–• 40% –Η –Φ–Β–Ϋ–Β–Β), ―¹–Η–Ϋ―É―¹–Ψ–≤―΄–Ι ―Ä–Η―²–Φ, –Ψ―²–Β―΅–Ϋ―΄–Ι ―¹–Η–Ϋ–¥―Ä–Ψ–Φ, –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–Β ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η–Β –Ϋ–Α―²―Ä–Η–Ι―É―Ä–Β―²–Η―΅–Β―¹–Κ–Η―Ö –Ω–Β–Ω―²–Η–¥–Ψ–≤ (NT-–Ω―Ä–Ψ–€–ù–ü –±–Ψ–Μ–Β–Β 750 –Ω–≥/–Φ–Μ). –£―¹–Β –Ω–Α―Ü–Η–Β–Ϋ―²―΄ –Ω–Ψ–¥–Ω–Η―¹―΄–≤–Α–Μ–Η –Η–Ϋ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Β ―¹–Ψ–≥–Μ–Α―¹–Η–Β, –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ –±―΄–Μ –Ψ–¥–Ψ–±―Ä–Β–Ϋ –Μ–Ψ–Κ–Α–Μ―¨–Ϋ―΄–Φ –Κ–Ψ–Φ–Η―²–Β―²–Ψ–Φ –Ω–Ψ ―ç―²–Η–Κ–Β. –ü–Α―Ü–Η–Β–Ϋ―²–Α–Φ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η ―¹―²–Α–Ϋ–¥–Α―Ä―²–Ϋ–Ψ–Β ―³–Η–Ζ–Η–Κ–Α–Μ―¨–Ϋ–Ψ–Β –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β, –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Η –±–Η–Ψ―Ö–Η–Φ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Α–Ϋ–Α–Μ–Η–Ζ–Α –Κ―Ä–Ψ–≤–Η ―¹–Ψ–≥–Μ–Α―¹–Ϋ–Ψ –Η–Φ–Β―é―â–Η–Φ―¹―è ―¹―²–Α–Ϋ–¥–Α―Ä―²–Α–Φ –Ψ–Κ–Α–Ζ–Α–Ϋ–Η―è –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Ι –Ω–Ψ–Φ–Ψ―â–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ ―¹ –Ξ–Γ–ù. –Γ–Ψ–Ω―É―²―¹―²–≤―É―é―â–Α―è ―²–Β―Ä–Α–Ω–Η―è –Ϋ–Α–Ζ–Ϋ–Α―΅–Α–Μ–Α―¹―¨ ―¹–Ψ–≥–Μ–Α―¹–Ϋ–Ψ –Η–Φ–Β―é―â–Η–Φ―¹―è ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η―è–Φ –Η –≤–Κ–Μ―é―΅–Α–Μ–Α –≤ ―¹–Β–±―è –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä―΄ –ê–ü–Λ/―¹–Α―Ä―²–Α–Ϋ―΄, β-–Α–¥―Ä–Β–Ϋ–Ψ–±–Μ–Ψ–Κ–Α―²–Ψ―Ä―΄, –Α–Ϋ―²–Α–≥–Ψ–Ϋ–Η―¹―²―΄ –Φ–Η–Ϋ–Β―Ä–Α–Μ–Ψ–Κ–Ψ―Ä―²–Η–Κ–Ψ–Η–¥–Ϋ―΄―Ö ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤, –Ω―Ä–Η –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η – –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―¹–Η–Ϋ―É―¹–Ψ–≤–Ψ–≥–Ψ ―É–Ζ–Μ–Α –Η–≤–Α–±―Ä–Α–¥–Η–Ϋ –Η ―¹–Β―Ä–¥–Β―΅–Ϋ―΄–Ι –≥–Μ–Η–Κ–Ψ–Ζ–Η–¥ –¥–Η–≥–Ψ–Κ―¹–Η–Ϋ. –î–Μ―è –Φ–Η–Ϋ–Η–Φ–Η–Ζ–Α―Ü–Η–Η –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ–≥–Ψ –≤–Μ–Η―è–Ϋ–Η―è ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ –Ϋ–Α –Η–Ζ―É―΅–Α–Β–Φ―΄–Β –Ω–Α―Ä–Α–Φ–Β―²―Ä―΄ –Η ―ç–Μ–Β–Κ―²―Ä–Ψ–Μ–Η―²–Ϋ―΄–Ι –Ω―Ä–Ψ―³–Η–Μ―¨ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Μ–Η―¹―¨ –Β–¥–Η–Ϋ―΄–Β ―¹―Ö–Β–Φ―΄ –Μ–Β―΅–Β–Ϋ–Η―è – –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä –ê–ü–Λ –Μ–Η–Ζ–Η–Ϋ–Ψ–Ω―Ä–Η–Μ –Η–Μ–Η, –≤ ―¹–Μ―É―΅–Α–Β –Ϋ–Β–Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²–Η –Μ–Η–Ζ–Η–Ϋ–Ψ–Ω―Ä–Η–Μ–Α, –±–Μ–Ψ–Κ–Α―²–Ψ―Ä ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤ –Α–Ϋ–≥–Η–Ψ―²–Β–Ϋ–Ζ–Η–Ϋ–Α II –≤–Α–Μ―¹–Α―Ä―²–Α–Ϋ, β-–Α–¥―Ä–Β–Ϋ–Ψ–±–Μ–Ψ–Κ–Α―²–Ψ―Ä –±–Η―¹–Ψ–Ω―Ä–Ψ–Μ–Ψ–Μ (–ö–Ψ–Ϋ–Κ–Ψ―Ä), –Α–Ϋ―²–Α–≥–Ψ–Ϋ–Η―¹―² –Φ–Η–Ϋ–Β―Ä–Α–Μ–Ψ–Κ–Ψ―Ä―²–Η–Κ–Ψ–Η–¥–Ϋ―΄―Ö ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Ψ–≤ ―ç–Ω–Μ–Β―Ä–Β–Ϋ–Ψ–Ϋ.
–û–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η NT-proBNP –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Ψ―¹―¨ –Ϋ–Α –Α–≤―²–Ψ–Φ–Α―²–Η―΅–Β―¹–Κ–Ψ–Φ –Α–Ϋ–Α–Μ–Η–Ζ–Α―²–Ψ―Ä–Β Cobas 411 (Roche Diagnostics). –£ –Ψ―¹–Ϋ–Ψ–≤–Β –Φ–Β―²–Ψ–¥–Α –Μ–Β–Ε–Η―² –Η–Φ–Φ―É–Ϋ–Ψ―³–Β―Ä–Φ–Β–Ϋ―²–Ϋ―΄–Ι –Α–Ϋ–Α–Μ–Η–Ζ (–Ω―Ä–Η–Ϋ―Ü–Η–Ω «―¹―ç–Ϋ–¥–≤–Η―΅–Α»). –≠―Ö–Ψ–Κ–Α―Ä–¥–Η–Ψ–≥―Ä–Α―³–Η―΅–Β―¹–Κ–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η –Ϋ–Α –Α–Ω–Ω–Α―Ä–Α―²–Β iE33 (Philips). –Γ–Η―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ―É―é ―³―É–Ϋ–Κ―Ü–Η―é –¦–• –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Η –Ω–Ψ ―¹―²–Α–Ϋ–¥–Α―Ä―²–Ϋ–Ψ–Φ―É –Ω―Ä–Ψ―²–Ψ–Κ–Ψ–Μ―É, ―³―Ä–Α–Κ―Ü–Η―é –≤―΄–±―Ä–Ψ―¹–Α –¦–• – –Ω–Ψ –Γ–Η–Φ–Ω―¹–Ψ–Ϋ―É. –î–Μ―è –Ψ―Ü–Β–Ϋ–Κ–Η –Κ–Α―΅–Β―¹―²–≤–Α –Ε–Η–Ζ–Ϋ–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Μ–Η ―¹―²–Α–Ϋ–¥–Α―Ä―²–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―É―é –Α–Ϋ–Κ–Β―²―É «–û–Ω―Ä–Ψ―¹–Ϋ–Η–Κ –€–Η–Ϋ–Ϋ–Β―¹–Ψ―²―¹–Κ–Ψ–≥–Ψ ―É–Ϋ–Η–≤–Β―Ä―¹–Η―²–Β―²–Α –¥–Μ―è –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨―é» (–€LHFQ-Minnesota Living With Heart Failure Questionnaire), –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²―¨ ―³–Η–Ζ–Η―΅–Β―¹–Κ–Ψ–Ι –Ϋ–Α–≥―Ä―É–Ζ–Κ–Η –Ψ―Ü–Β–Ϋ–Η–≤–Α–Μ–Η –Ω–Ψ ―²–Β―¹―²―É 6-–Φ–Η–Ϋ―É―²–Ϋ–Ψ–Ι ―Ö–Ψ–¥―¨–±―΄.
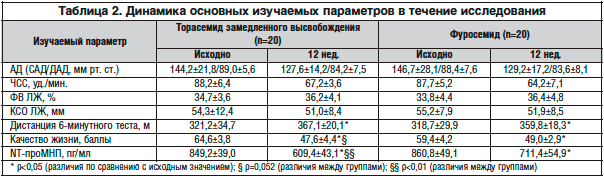
–Γ―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Α―è –Ψ–±―Ä–Α–±–Ψ―²–Κ–Α –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Α―¹―¨ ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ω―Ä–Ψ–≥―Ä–Α–Φ–Φ―΄ SPSS for Windows 14.0. –£ ―¹–Μ―É―΅–Α–Β –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Η―è –¥–Α–Ϋ–Ϋ―΄―Ö –≤ –≤–Η–¥–Β M±m –€ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤―É–Β―² ―¹―Ä–Β–¥–Ϋ–Β–Φ―É –Α―Ä–Η―³–Φ–Β―²–Η―΅–Β―¹–Κ–Ψ–Φ―É, m – ―¹―²–Α–Ϋ–¥–Α―Ä―²–Ϋ–Ψ–Ι –Ψ―à–Η–±–Κ–Β ―¹―Ä–Β–¥–Ϋ–Β–≥–Ψ. –ü―Ä–Η –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–Φ ―Ä–Α―¹–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Η –≤―΄–±–Ψ―Ä–Ψ–Κ –Ω–Ψ –≥–Η―¹―²–Ψ–≥―Ä–Α–Φ–Φ–Β ―΅–Α―¹―²–Ψ―², –Κ―Ä–Η―²–Β―Ä–Η―è–Φ –ö–Ψ–Μ–Φ–Ψ–≥–Ψ―Ä–Ψ–≤–Α-–Γ–Φ–Η―Ä–Ϋ–Ψ–≤–Α, –€–Α–Ϋ–Ϋ–Α-–Θ–Η―²–Ϋ–Η, –Ω–Ψ ―ç–Κ―¹―Ü–Β―¹―¹―É –Η –Α―¹–Η–Φ–Φ–Β―²―Ä–Η–Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ―¹―²―¨ ―Ä–Α–Ζ–Μ–Η―΅–Η―è –Ψ―Ü–Β–Ϋ–Η–≤–Α–Μ–Η –Ω–Ψ –Κ―Ä–Η―²–Β―Ä–Η―é –Γ―²―¨―é–¥–Β–Ϋ―²–Α, –Ω―Ä–Η –Ϋ–Β–Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–Φ – –Ω–Ψ ―Ä–Α–Ϋ–≥–Ψ–≤–Ψ–Φ―É –Κ―Ä–Η―²–Β―Ä–Η―é –£–Η–Μ–Κ–Ψ–Κ―¹–Ψ–Ϋ–Α. –†–Α–Ζ–Μ–Η―΅–Η―è ―¹―Ä–Β–¥–Ϋ–Η―Ö –≤–Β–Μ–Η―΅–Η–Ϋ, –Α ―²–Α–Κ–Ε–Β –Κ–Ψ―Ä―Ä–Β–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ―΄–Β ―¹–≤―è–Ζ–Η –Ω―Ä–Η–Ζ–Ϋ–Α–≤–Α–Μ–Η―¹―¨ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ―΄–Φ–Η –Ω―Ä–Η ―É―Ä–Ψ–≤–Ϋ–Β –Ζ–Ϋ–Α―΅–Η–Φ–Ψ―¹―²–Η ―Ä<0,05. –ö–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Α―è ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Α –±–Ψ–Μ―¨–Ϋ―΄―Ö –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Α –≤ ―²–Α–±–Μ–Η―Ü–Β 1, –¥–Η–Ϋ–Α–Φ–Η–Κ–Α –Η–Ζ―É―΅–Α–Β–Φ―΄―Ö –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι – –≤ ―²–Α–±–Μ–Η―Ü–Β 2.
–‰–Ζ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Ϋ―΄―Ö ―²–Α–±–Μ–Η―Ü –≤–Η–¥–Ϋ–Ψ, ―΅―²–Ψ –Κ–Α–Κ–Η―Ö-–Μ–Η–±–Ψ ―Ä–Α–Ζ–Μ–Η―΅–Η–Ι –Ω–Ψ –Η–Ζ―É―΅–Α–Β–Φ―΄–Φ –Ω–Α―Ä–Α–Φ–Β―²―Ä–Α–Φ –Φ–Β–Ε–¥―É –≥―Ä―É–Ω–Ω–Α–Φ–Η –Ϋ–Β –±―΄–Μ–Ψ –≤―΄―è–≤–Μ–Β–Ϋ–Ψ. –û―²–Φ–Β―΅–Α–Μ–Η―¹―¨ –¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ –≤―΄―¹–Ψ–Κ–Η–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Κ–Ψ–Φ–Ψ―Ä–±–Η–¥–Ϋ–Ψ―¹―²–Η (–≤ ―¹―Ä–Β–¥–Ϋ–Β–Φ –±–Ψ–Μ–Β–Β 2 ―¹–Ψ―΅–Β―²–Α–Ϋ–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι) –Η ―¹―²–Β–Ω–Β–Ϋ―¨ –Α–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –Κ―É―Ä–Β–Ϋ–Η―è –≤ –Η–Ζ―É―΅–Α–Β–Φ–Ψ–Ι –≥―Ä―É–Ω–Ω–Β. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –≥―Ä―É–Ω–Ω―΄ –±―΄–Μ–Η ―¹–Ψ–Ω–Ψ―¹―²–Α–≤–Η–Φ―΄ –Ω–Ψ –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤―É –Η –¥–Ψ–Ζ–Α–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤, –Η―¹–Ω–Ψ–Μ―¨–Ζ―É―é―â–Η―Ö―¹―è –≤ ―¹―Ö–Β–Φ–Β –Μ–Β―΅–Β–Ϋ–Η―è. –Γ―Ä–Β–¥–Ϋ―è―è –¥–Ψ–Ζ–Α ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è –≤ –Ω―Ä–Ψ―Ü–Β―¹―¹–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è ―¹–Ψ―¹―²–Α–≤–Η–Μ–Α 12,4±2,6 –Φ–≥, ―³―É―Ä–Ψ―¹–Β–Φ–Η–¥–Α – 54,2±4,8 –Φ–≥.
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, ―²–Β―Ä–Α–Ω–Η―è, –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Ϋ–Α―è –Ϋ–Α ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η―è―Ö, –Ω―Ä–Η–≤–Ψ–¥–Η–Μ–Α –Κ –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–Φ―É ―É–Μ―É―΅―à–Β–Ϋ–Η―é ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―¹―²–Α―²―É―¹–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Η ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η―é –Η–Φ–Β―é―â–Β–Ι―¹―è ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η–Κ–Η. –£ –Ψ–±–Β–Η―Ö –≥―Ä―É–Ω–Ω–Α―Ö –Ϋ–Α ―³–Ψ–Ϋ–Β –Μ–Β―΅–Β–Ϋ–Η―è –Ϋ–Α–±–Μ―é–¥–Α–Μ–Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ–Β ―É–Μ―É―΅―à–Β–Ϋ–Η–Β –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²–Η ―³–Η–Ζ–Η―΅–Β―¹–Κ–Ψ–Ι –Ϋ–Α–≥―Ä―É–Ζ–Κ–Η, ―É–Μ―É―΅―à–Β–Ϋ–Η–Β –Κ–Α―΅–Β―¹―²–≤–Α –Ε–Η–Ζ–Ϋ–Η –±–Ψ–Μ―¨–Ϋ―΄―Ö, ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η –Ϋ–Α―²―Ä–Η–Ι―É―Ä–Β―²–Η―΅–Β―¹–Κ–Η―Ö –≥–Ψ―Ä–Φ–Ψ–Ϋ–Ψ–≤. –£–Φ–Β―¹―²–Β ―¹ ―²–Β–Φ, –≤ –≥―Ä―É–Ω–Ω–Β ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è –Φ―΄ –Ψ–Ω―Ä–Β–¥–Β–Μ–Η–Μ–Η ―²–Β–Ϋ–¥–Β–Ϋ―Ü–Η―é –Κ –±–Ψ–Μ–Β–Β –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–Φ―É ―É–Μ―É―΅―à–Β–Ϋ–Η―é –Κ–Α―΅–Β―¹―²–≤–Α –Ε–Η–Ζ–Ϋ–Η (―Ä=0,052) –Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –±–Ψ–Μ–Β–Β –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–Β ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ–Β–Ι NT-–Ω―Ä–Ψ–€–ù–ü (―Ä<0,01). –Γ ―΅–Β–Φ ―ç―²–Ψ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ ―¹–≤―è–Ζ–Α–Ϋ–Ψ?
–ü―Ä–Ψ–Μ–Ψ–Ϋ–≥–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Β –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η–Β ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É–Β―²―¹―è –Φ–Β–¥–Μ–Β–Ϋ–Ϋ―΄–Φ –Ϋ–Α―΅–Α–Μ–Ψ–Φ –¥–Β–Ι―¹―²–≤–Η―è, –Ϋ–Β –Ω―Ä–Η–≤–Ψ–¥–Η―² –Κ ―Ä–Α–Ζ–≤–Η―²–Η―é –Η–Φ–Ω–Β―Ä–Α―²–Η–≤–Ϋ―΄―Ö –Ω–Ψ–Ζ―΄–≤–Ψ–≤ –Κ –Φ–Ψ―΅–Β–Η―¹–Ω―É―¹–Κ–Α–Ϋ–Η―é –Η ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É–Β―²―¹―è –±–Ψ–Μ–Β–Β –≤―΄―¹–Ψ–Κ–Ψ–Ι –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ―¹―²―¨―é –¥–Β–Ι―¹―²–≤–Η―è –Ω―Ä–Η ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Η ―¹ –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ–Ψ–Ι –Ϋ–Β–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è [15, 16].
–Δ–Ψ―Ä–Α―¹–Β–Φ–Η–¥ –Ω―Ä–Ψ–Μ–Ψ–Ϋ–≥–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è –Ψ–±–Β―¹–Ω–Β―΅–Η–≤–Α–Β―² –Ω–Ψ―¹―²–Β–Ω–Β–Ϋ–Ϋ–Ψ–Β –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η–Β –Α–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –≤–Β―â–Β―¹―²–≤–Α, –Ω–Ψ–Ζ–≤–Ψ–Μ―è―è ―¹–Ϋ–Η–Ζ–Η―²―¨ –Κ–Ψ–Μ–Β–±–Α–Ϋ–Η―è –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –≤ –Ω–Μ–Α–Ζ–Φ–Β –Κ―Ä–Ψ–≤–Η, –Ψ―²–Φ–Β―΅–Α―é―â–Η–Β―¹―è –Ω―Ä–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Η –¥―Ä―É–≥–Η―Ö ―³–Ψ―Ä–Φ ―¹ –Ϋ–Β–Φ–Β–¥–Μ–Β–Ϋ–Ϋ―΄–Φ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η–Β–Φ. –î–Α–Ϋ–Ϋ–Α―è –Ϋ–Ψ–≤–Α―è –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ–Α―è ―³–Ψ―Ä–Φ–Α –Ψ–±–Μ–Α–¥–Α–Β―² –≤―¹–Β–Φ–Η ―¹–≤–Ψ–Ι―¹―²–≤–Α–Φ–Η, ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Ϋ―΄–Φ–Η –¥–Μ―è ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Ψ–≤ –Ϋ–Β–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è. –£ ―²–Ψ –Ε–Β –≤―Ä–Β–Φ―è –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² ―É–Μ―É―΅―à–Η―²―¨ –Κ–Α―΅–Β―¹―²–≤–Ψ –Ε–Η–Ζ–Ϋ–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±–Μ–Α–≥–Ψ–¥–Α―Ä―è –Ψ―²―¹―É―²―¹―²–≤–Η―é –Η–Φ–Ω–Β―Ä–Α―²–Η–≤–Ϋ―΄―Ö –Ω–Ψ–Ζ―΄–≤–Ψ–≤, –±–Β–Ζ –Ψ–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Η–Ι –Ω–Ψ–≤―¹–Β–¥–Ϋ–Β–≤–Ϋ–Ψ–Ι –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η, ―΅―²–Ψ, –Ψ―΅–Β–≤–Η–¥–Ϋ–Ψ, –Η –Ω–Ψ―¹–Μ―É–Ε–Η–Μ–Ψ –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι –≤―΄―è–≤–Μ–Β–Ϋ–Η―è ―²–Β–Ϋ–¥–Β–Ϋ―Ü–Η–Η –Κ –±–Ψ–Μ–Β–Β –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–Φ―É ―É–Μ―É―΅―à–Β–Ϋ–Η―é –Κ–Α―΅–Β―¹―²–≤–Α –Ε–Η–Ζ–Ϋ–Η –±–Ψ–Μ―¨–Ϋ―΄―Ö, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥ –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ ―³―É―Ä–Ψ―¹–Β–Φ–Η–¥–Ψ–Φ.
–ö–Α–Κ ―É–Ε–Β –≥–Ψ–≤–Ψ―Ä–Η–Μ–Ψ―¹―¨ –≤―΄―à–Β, ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥ –Ψ–±–Μ–Α–¥–Α–Β―² –Ω–Ψ–Φ–Η–Φ–Ψ ―¹–Ψ–±―¹―²–≤–Β–Ϋ–Ϋ–Ψ –Α–Ϋ―²–Η–¥–Η―É―Ä–Β―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ ―ç―³―³–Β–Κ―²–Α –Β―â–Β –Η –Α–Ϋ―²–Η–Α–Μ―¨–¥–Ψ―¹―²–Β―Ä–Ψ–Ϋ–Ψ–≤―΄–Φ –Η –Α–Ϋ―²–Η―³–Η–±―Ä–Ψ―²–Η―΅–Β―¹–Κ–Η–Φ–Η ―¹–≤–Ψ–Ι―¹―²–≤–Α–Φ–Η, ―΅―²–Ψ –≤–Β–¥–Β―² –Κ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–Φ―É –≤–Μ–Η―è–Ϋ–Η―é –Ϋ–Α –Ω–Α―²–Ψ―³–Η–Ζ–Η–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Β –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ―΄ –≤ –Φ–Η–Ψ–Κ–Α―Ä–¥–Β –Η ―É–Φ–Β–Ϋ―¨―à–Α–Β―² –Ϋ–Α–≥―Ä―É–Ζ–Κ―É –Ϋ–Α –Κ–Α―Ä–¥–Η–Ψ–Φ–Η–Ψ―Ü–Η―²―΄. –≠―²–Ψ –Ω―Ä–Ψ―è–≤–Μ―è–Β―²―¹―è ―³–Α–Κ―²–Ψ–Φ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ –±–Ψ–Μ–Β–Β –Ζ–Ϋ–Α―΅–Η–Φ–Ψ–≥–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―è ―É―Ä–Ψ–≤–Ϋ―è NT-–Ω―Ä–Ψ–€–ù–ü –≤ –Ϋ–Α―à–Β–Ι ―Ä–Α–±–Ψ―²–Β. –ü–Ψ–¥–Ψ–±–Ϋ–Α―è –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ–Α―è –¥–Η–Ϋ–Α–Φ–Η–Κ–Α ―¹–≤–Η–¥–Β―²–Β–Μ―¨―¹―²–≤―É–Β―² –Ψ –±–Ψ–Μ–Β–Β –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–Φ ―É―¹–Ω–Β―Ö–Β –Μ–Β―΅–Β–Ϋ–Η―è –Η –Ω–Ψ–≤―΄―à–Α–Β―² –≤–Β―Ä–Ψ―è―²–Ϋ–Ψ―¹―²―¨ –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ–Ψ–≥–Ψ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Η―¹―Ö–Ψ–¥–Α. –‰–Ζ–≤–Β―¹―²–Ϋ–Ψ, ―΅―²–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –Ϋ–Α―²―Ä–Η–Ι―É―Ä–Β―²–Η―΅–Β―¹–Κ–Η―Ö –≥–Ψ―Ä–Φ–Ψ–Ϋ–Ψ–≤ –Ϋ–Β ―²–Ψ–Μ―¨–Κ–Ψ ―É–Φ–Β–Ϋ―¨―à–Α–Β―² –≤―Ä–Β–Φ―è –¥–Ψ –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Ω―Ä–Α–≤–Η–Μ―¨–Ϋ–Ψ–Ι ―¹―Ö–Β–Φ―΄ –Μ–Β―΅–Β–Ϋ–Η―è, –Ϋ–Ψ –Η –≤–Β–¥–Β―² –Κ –±–Ψ–Μ–Β–Β –±―΄―¹―²―Ä–Ψ–Ι –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ–Ψ–Ι –¥–Η–Ϋ–Α–Φ–Η–Κ–Β ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤, –Α ―²–Α–Κ–Ε–Β ―¹–Ϋ–Η–Ε–Α–Β―² ―Ä–Α―¹―Ö–Ψ–¥―΄ –Ϋ–Α –Μ–Β―΅–Β–Ϋ–Η–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Α [7]. –Γ―²–Ψ–Η–Φ–Ψ―¹―²―¨ –Ψ–Κ–Α–Ζ–Α–Ϋ–Η―è –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Ι –Ω–Ψ–Φ–Ψ―â–Η –Ω―Ä–Η ―ç―²–Ψ–Φ ―¹–Ϋ–Η–Ε–Α–Β―²―¹―è –Ϋ–Α 26% –Κ–Α–Κ –¥–Μ―è ―¹―²–Α―Ü–Η–Ψ–Ϋ–Α―Ä–Α, ―²–Α–Κ –Η –¥–Μ―è ―¹–Η―¹―²–Β–Φ―΄ –Ζ–¥―Ä–Α–≤–Ψ–Ψ―Ö―Ä–Α–Ϋ–Β–Ϋ–Η―è –≤ ―Ü–Β–Μ–Ψ–Φ [17].
–ù–Α–Φ–Η ―²–Α–Κ–Ε–Β –Η–Ζ―É―΅–Α–Μ–Η―¹―¨ –¥–Α–Ϋ–Ϋ―΄–Β –Ψ –≤–Μ–Η―è–Ϋ–Η–Η ―¹―Ö–Β–Φ –¥–Η―É―Ä–Β―²–Η―΅–Β―¹–Κ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Ϋ–Α ―ç–Μ–Β–Κ―²―Ä–Ψ–Μ–Η―²–Ϋ―΄–Ι –Ω―Ä–Ψ―³–Η–Μ―¨ –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤. –ö–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―é –Κ–Α–Μ–Η―è –Η –Ϋ–Α―²―Ä–Η―è –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Η –Η―¹―Ö–Ψ–¥–Ϋ–Ψ, ―΅–Β―Ä–Β–Ζ 2, 4 –Η 12 –Ϋ–Β–¥. –Μ–Β―΅–Β–Ϋ–Η―è. –£ –≥―Ä―É–Ω–Ω–Β ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ζ–Α–Φ–Β–¥–Μ–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Β–Ϋ–Η―è –Ϋ–Β –±―΄–Μ–Ψ –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ ―¹–Μ―É―΅–Α–Β–≤ –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι ―ç–Μ–Β–Κ―²―Ä–Ψ–Μ–Η―²–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―³–Η–Μ―è –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ―΄–Φ–Η –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è–Φ–Η. –£ –≥―Ä―É–Ω–Ω–Β ―³―É―Ä–Ψ―¹–Β–Φ–Η–¥–Α ―É 3 (15%) –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Φ―΄ –Ϋ–Α–±–Μ―é–¥–Α–Μ–Η ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Β ―¹–Ψ–¥–Β―Ä–Ε–Α–Ϋ–Η―è –Κ–Α–Μ–Η―è –Ϋ–Η–Ε–Β –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ―΄―Ö –≥―Ä–Α–Ϋ–Η―Ü (3,5 –Φ–Φ–Ψ–Μ―¨/–Μ), –≤ –Ψ–¥–Ϋ–Ψ–Φ ―¹–Μ―É―΅–Α–Β –Ω–Ψ―²―Ä–Β–±–Ψ–≤–Α–≤―à–Β–Β –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η –¥–Ψ–Ζ―΄ –Α–Ϋ―²–Α–≥–Ψ–Ϋ–Η―¹―²–Ψ–≤ –Α–Μ―¨–¥–Ψ―¹―²–Β―Ä–Ψ–Ϋ–Α –Η –≤–Ϋ―É―²―Ä–Η–≤–Β–Ϋ–Ϋ–Ψ–Ι –Η–Ϋ―³―É–Ζ–Η–Η ―¹–Ψ–Μ–Β–Ι –Κ–Α–Μ–Η―è. –ù–Β―¹–Ψ–Φ–Ϋ–Β–Ϋ–Ϋ–Ψ, ―΅―²–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―΅–Α―¹―²–Ψ―²―΄ –≥–Η–Ω–Ψ–Κ–Α–Μ–Η–Β–Φ–Η–Η ―²–Α–Κ–Ε–Β –Ψ–Κ–Α–Ζ―΄–≤–Α–Β―² ―¹–≤–Ψ–Β –≤–Μ–Η―è–Ϋ–Η–Β –Κ–Α–Κ –Ϋ–Α ―¹–Α–Φ–Ψ―΅―É–≤―¹―²–≤–Η–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Α, ―²–Α–Κ –Η –Ϋ–Α ―΅–Α―¹―²–Ψ―²―É –Ω–Ψ―²–Β–Ϋ―Ü–Η–Α–Μ―¨–Ϋ―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι ―²–Β―Ä–Α–Ω–Η–Η.
–û―²―¹―É―²―¹―²–≤–Η–Β –≤–Μ–Η―è–Ϋ–Η―è –Μ–Β―΅–Β–Ϋ–Η―è –Ϋ–Α ―ç―Ö–Ψ–Κ–Α―Ä–¥–Η–Ψ–≥―Ä–Α―³–Η―΅–Β―¹–Κ–Η–Β –Ω–Α―Ä–Α–Φ–Β―²―Ä―΄, ―¹–Κ–Ψ―Ä–Β–Β –≤―¹–Β–≥–Ψ, –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Β–Ϋ–Ψ –Ϋ–Β–±–Ψ–Μ―¨―à–Ψ–Ι –≤―΄–±–Ψ―Ä–Κ–Ψ–Ι –Η/–Η–Μ–Η –Φ–Α–Μ―΄–Φ ―¹―Ä–Ψ–Κ–Ψ–Φ –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤.
–£ –Ϋ–Α―à–Β–Ι ―Ä–Α–±–Ψ―²–Β ―²–Α–Κ–Ε–Β –Ψ–±―Ä–Α―â–Α–Μ–Α –Ϋ–Α ―¹–Β–±―è –≤–Ϋ–Η–Φ–Α–Ϋ–Η–Β –Η―¹―Ö–Ψ–¥–Ϋ–Α―è ―É―¹–Κ–Ψ―Ä–Β–Ϋ–Ϋ–Α―è –ß–Γ–Γ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Ξ–Γ–ù, –Ω–Ψ―²―Ä–Β–±–Ψ–≤–Α–≤―à–Α―è –≤ 15–20% ―¹–Μ―É―΅–Α–Β–≤ –¥–Ψ–±–Α–≤–Μ–Β–Ϋ–Η―è –Κ ―Ü–Β–Μ–Β–≤–Ψ–Ι –¥–Ψ–Ζ–Β β––Α–¥―Ä–Β–Ϋ–Ψ–±–Μ–Ψ–Κ–Α―²–Ψ―Ä–Α –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä–Ψ–≤ –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―¹–Η–Ϋ―É―¹–Ψ–≤–Ψ–≥–Ψ ―É–Ζ–Μ–Α.
–ù–Β―¹–Ψ–Φ–Ϋ–Β–Ϋ–Ϋ–Ψ, ―΅―²–Ψ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ϋ–Ψ–Β –Ϋ–Α–Φ–Η –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Η–Φ–Β–Β―² ―¹–≤–Ψ–Η –Ψ–≥―Ä–Α–Ϋ–Η―΅–Β–Ϋ–Η―è – ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄–Β –Κ–Α–Κ ―¹ –¥–Η–Ζ–Α–Ι–Ϋ–Ψ–Φ, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²―è–Φ–Η –≤―΄–±–Ψ―Ä–Κ–Η, ―²–Α–Κ –Η ―¹ –Ϋ–Β–≤―΄―¹–Ψ–Κ–Ψ–Ι ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Ψ–Ι –Φ–Ψ―â–Ϋ–Ψ―¹―²―¨―é –Η –Ψ―²–Ϋ–Ψ―¹–Η―²–Β–Μ―¨–Ϋ–Ψ –Ϋ–Β–±–Ψ–Μ―¨―à–Η–Φ ―¹―Ä–Ψ–Κ–Ψ–Φ –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è, ―΅―²–Ψ –¥–Ψ–Μ–Ε–Ϋ–Ψ ―É―΅–Η―²―΄–≤–Α―²―¨―¹―è –Ω―Ä–Η –Η–Ϋ―²–Β―Ä–Ω―Ä–Β―²–Α―Ü–Η–Η –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄―Ö ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤.
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –Ϋ–Β–≤―΄―¹–Ψ–Κ―É―é –¥–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨–Ϋ―É―é –±–Α–Ζ―É, –Ω–Β―²–Μ–Β–≤―΄–Β –¥–Η―É―Ä–Β―²–Η–Κ–Η ―è–≤–Μ―è―é―²―¹―è –Ψ–¥–Ϋ–Ψ–Ι –Η–Ζ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤–Α–Ε–Ϋ―΄―Ö –≥―Ä―É–Ω–Ω –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Ξ–Γ–ù –Η –Ψ―²–Β―΅–Ϋ―΄–Φ ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Ψ–Φ. –Δ–Ψ―Ä–Α―¹–Β–Φ–Η–¥ –≤―¹–Μ–Β–¥―¹―²–≤–Η–Β ―¹–≤–Ψ–Β–Ι ―³–Α―Ä–Φ–Α–Κ–Ψ–¥–Η–Ϋ–Α–Φ–Η–Κ–Η –Η ―³–Α―Ä–Φ–Α–Κ–Ψ–Κ–Η–Ϋ–Β―²–Η–Κ–Η –Ψ–±–Μ–Α–¥–Α–Β―² –Ω―Ä–Β–Η–Φ―É―â–Β―¹―²–≤–Ψ–Φ –Ω–Β―Ä–Β–¥ ―³―É―Ä–Ψ―¹–Β–Φ–Η–¥–Ψ–Φ. –ü―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―²–Ψ―Ä–Α―¹–Β–Φ–Η–¥–Α –Ω―Ä–Ψ–Μ–Ψ–Ϋ–≥–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² ―É–Μ―É―΅―à–Η―²―¨ –Κ–Α―΅–Β―¹―²–≤–Ψ –Ε–Η–Ζ–Ϋ–Η, –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²―¨ ―²–Β―Ä–Α–Ω–Η–Η –Η, –≤ –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ–Φ ―¹―΅–Β―²–Β, –Ω―Ä–Η–≤–Β―¹―²–Η –Κ –Ω–Ψ–≤―΄―à–Β–Ϋ–Η―é –Ω―Ä–Η–≤–Β―Ä–Ε–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Κ –Μ–Β―΅–Β–Ϋ–Η―é –Η –±–Μ–Α–≥–Ψ–Ω―Ä–Η―è―²–Ϋ–Ψ–Φ―É –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Φ―É –Η―¹―Ö–Ψ–¥―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Ξ–Γ–ù.