
–Т–≤–µ–і–µ–љ–Є–µ
–°–Є–љ–і—А–Њ–Љ —А–∞–Ј–і—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Ї–Є—И–µ—З–љ–Є–Ї–∞ (–°–†–Ъ) –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Г 10вАУ15% –љ–∞—Б–µ–ї–µ–љ–Є—П –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ, –Ј–љ–∞—З–Є–Љ–Њ –≤–ї–Є—П–µ—В –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –≤–ї–µ—З–µ—В –Ј–∞ —Б–Њ–±–Њ–є –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ —Б–Њ—Ж–Є–∞–ї—М–љ–Њ-—Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–µ –Ј–∞—В—А–∞—В—Л –і–ї—П –Њ–±—Й–µ—Б—В–≤–∞ –≤ —Ж–µ–ї–Њ–Љ [1]. –Я–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—П –°–†–Ъ –≤–Ї–ї—О—З–∞–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—Б—Б–Є–Є –Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –њ–Њ –Њ—Б–Є ¬Ђ–Љ–Њ–Ј–≥ вАФ –Ї–Є—И–µ—З–љ–Є–Ї¬ї, –і–Є—Б—Д—Г–љ–Ї—Ж–Є—О –Є–Љ–Љ—Г–љ–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –љ–Є–Ј–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є, –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є, —З—В–Њ –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –≤–µ–і–µ—В –Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є –љ–∞—А—Г—И–µ–љ–Є—О –Љ–Њ—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є [2]. –Ь–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ —В–Њ, —З—В–Њ –Љ–Њ–і—Г–ї—П—Ж–Є—П –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –Ї–ї—О—З–µ–≤—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –°–†–Ъ [3вАУ5]. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Є–Љ–µ—О—В—Б—П –і–∞–љ–љ—Л–µ –Њ —И–µ—Б—В–Є–Ї—А–∞—В–љ–Њ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —А–Є—Б–Ї–∞ —А–∞–Ј–≤–Є—В–Є—П –°–†–Ъ –њ–Њ—Б–ї–µ —Н–њ–Є–Ј–Њ–і–∞ –Њ—Б—В—А–Њ–є –Ї–Є—И–µ—З–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Б—А–µ–і—Б—В–≤, –≤–ї–Є—П—О—Й–Є—Е –љ–∞ –Ї–Є—И–µ—З–љ—Г—О –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Г (–њ—А–µ-, –њ—А–Њ–±–Є–Њ—В–Є–Ї–Є, —Д–µ–Ї–∞–ї—М–љ–∞—П —В—А–∞–љ—Б–њ–ї–∞–љ—В–∞—Ж–Є—П), –≤ –ї–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [6вАУ8]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Н–Ї—Б–њ–µ—А—В—Л –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Ї–Є—И–µ—З–љ–Є–Ї–∞ –Љ–Њ–≥—Г—В –±—Л—В—М –њ—А–µ–і–Є–Ї—В–Њ—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –Њ–њ—А–µ–і–µ–ї—П—В—М —Е–∞—А–∞–Ї—В–µ—А –µ–≥–Њ —В–µ—З–µ–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –Њ—В–≤–µ—В –љ–∞ –ї–µ—З–µ–±–љ—Л–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П [9, 10].
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Ї–Є—И–µ—З–љ–Є–Ї —З–µ–ї–Њ–≤–µ–Ї–∞ –љ–∞—Б–µ–ї–µ–љ –Њ–≥—А–Њ–Љ–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Љ–Є–Ї—А–Њ–Њ—А–≥–∞–љ–Є–Ј–Љ–Њ–≤, —Б–Њ–≤–Њ–Ї—Г–њ–љ—Л–є –≥–µ–љ–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е –њ–Њ —З–Є—Б–ї—Г –≥–µ–љ–Њ–≤ –≤ 13 —А–∞–Ј –њ—А–µ–≤—Л—И–∞–µ—В —В–∞–Ї–Њ–≤–Њ–є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞-—Е–Њ–Ј—П–Є–љ–∞ [11]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤ –Њ–±–ї–∞—Б—В–Є –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ–є –≥–µ–љ–µ—В–Є–Ї–Є –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤ –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–Љ —В—А–∞–Ї—В–µ —З–µ–ї–Њ–≤–µ–Ї–∞ –Њ–±–Є—В–∞–µ—В –±–Њ–ї–µ–µ 2000 –≤–Є–і–Њ–≤ –±–∞–Ї—В–µ—А–Є–є, –њ—А–Є—З–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –Є–Ј –љ–Є—Е –Њ—В–љ–Њ—Б—П—В—Б—П –Ї —З–µ—В—Л—А–µ–Љ –Њ—Б–љ–Њ–≤–љ—Л–Љ —В–Є–њ–∞–Љ: Bacteroidota, Firmicutes, Actinobacteriota –Є Proteobacteria [12]. –Ъ–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ—В–∞ вАФ –Њ—З–µ–љ—М –і–Є–љ–∞–Љ–Є—З–љ–∞—П —Б—В—А—Г–Ї—В—Г—А–∞, –њ—А–µ—В–µ—А–њ–µ–≤–∞—О—Й–∞—П –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —В–µ—З–µ–љ–Є–µ –≤—Б–µ–є –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞, –µ–µ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л–є —Б–Њ—Б—В–∞–≤ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б–њ–Њ—Б–Њ–±–Њ–Љ —А–Њ–і–Њ—А–∞–Ј—А–µ—И–µ–љ–Є—П (–Ї–µ—Б–∞—А–µ–≤–Њ —Б–µ—З–µ–љ–Є–µ –Є–ї–Є –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–µ —А–Њ–і—Л) –Є –Љ–µ—В–Њ–і–Њ–Љ –≤—Б–Ї–∞—А–Љ–ї–Є–≤–∞–љ–Є—П (–≥—А—Г–і–љ–Њ–µ –Є–ї–Є –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–µ) [13]. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –Љ–Є–Ї—А–Њ–±–љ–Њ–µ —Б–Њ–Њ–±—Й–µ—Б—В–≤–Њ –њ—А–Њ–і–Њ–ї–ґ–∞–µ—В –≤–Є–і–Њ–Є–Ј–Љ–µ–љ—П—В—М—Б—П –њ–Њ–і –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ —Д–∞–Ї—В–Њ—А–Њ–≤ –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Б—А–µ–і—Л, –≤–Ї–ї—О—З–∞—П —А–µ–≥–Є–Њ–љ –њ—А–Њ–ґ–Є–≤–∞–љ–Є—П, –њ—А–Є–µ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б—В—А–µ—Б—Б, –і–Є–µ—В—Г –Є –Њ–±—А–∞–Ј –ґ–Є–Ј–љ–Є [14вАУ16].
–°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Ј–і–Њ—А–Њ–≤—Л–є —Б–Њ—Б—В–∞–≤ –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Ї–Є—И–µ—З–љ–Є–Ї–∞ —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ–Њ–є –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Њ–є –і–ї—П –њ—А–∞–≤–Є–ї—М–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞, –∞ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ—Г—В—Г–∞–ї–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –Њ—В–љ–Њ—И–µ–љ–Є–є –Љ–µ–ґ–і—Г –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П–Љ–Є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Є —Е–Њ–Ј—П–Є–љ–Њ–Љ –≤–µ–і–µ—В –Ї —А–∞–Ј–≤–Є—В–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є [17, 18]. –Т–Њ –Љ–љ–Њ–≥–Є—Е —А–∞–±–Њ—В–∞—Е –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–љ—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ —Б–і–≤–Є–≥–Є –≤ –Љ–Є–Ї—А–Њ–±–љ–Њ–Љ –њ–µ–є–Ј–∞–ґ–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ, –Њ–і–љ–∞–Ї–Њ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–Њ–≤–Њ–ї—М–љ–Њ —А–∞–Ј–љ–Њ—А–Њ–і–љ—Л –Є –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–≤—Л [19вАУ21].
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ—Ж–µ–љ–Є—В—М —Б–Њ—Б—В–∞–≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л —Г –±–Њ–ї—М–љ—Л—Е —Б –°–†–Ъ –≤–Њ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є —Б –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–Є—Й–µ–≤—Л–Љ–Є –њ—А–Є–≤—Л—З–Ї–∞–Љ–Є, —Г—А–Њ–≤–љ–µ–Љ —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є, –∞ —В–∞–Ї–ґ–µ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л–і–µ–ї–µ–љ–љ—Л—Е —Д–µ–љ–Њ—В–Є–њ–Њ–≤.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Я–Њ–і –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –≤ –љ–∞—И–µ–Љ —Ж–µ–љ—В—А–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М 263 –њ–∞—Ж–Є–µ–љ—В–∞ (189 –ґ–µ–љ—Й–Є–љ, 74 –Љ—Г–ґ—З–Є–љ—Л) —Б –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –°–†–Ъ, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Є –Р—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Ї–Њ–ї–Њ–њ—А–Њ–Ї—В–Њ–ї–Њ–≥–Њ–≤ –†–Њ—Б—Б–Є–Є [22]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Њ–і–Њ–±—А–µ–љ–Њ –ї–Њ–Ї–∞–ї—М–љ—Л–Љ —Н—В–Є—З–µ—Б–Ї–Є–Љ –Ї–Њ–Љ–Є—В–µ—В–Њ–Љ –§–У–С–Ю–£ –Т–Ю –Ю–Љ–У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є (–њ—А–Њ—В–Њ–Ї–Њ–ї вДЦ 2 –Њ—В 01.12.2021). –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–Є–ї 29 [25; 35] –ї–µ—В. –§–Њ—А–Љ–∞ –°–†–Ъ —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –і–Є–∞—А–µ–Є (–°–†–Ъ-–Ф) –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ —Г 84 (31,9%) —З–µ–ї–Њ–≤–µ–Ї, –°–†–Ъ —Б –њ—А–µ–Њ–±–ї–∞–і–∞–љ–Є–µ–Љ –Ј–∞–њ–Њ—А–∞ (–°–†–Ъ-–Ч) вАФ —Г 92 (34,8%), –°–†–Ъ —Б–Њ —Б–Љ–µ—И–∞–љ–љ—Л–Љ –≤–∞—А–Є–∞–љ—В–Њ–Љ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ—В–Њ—А–Є–Ї–Є (–°–†–Ъ-–°–Љ) вАФ —Г 71 (26,9%), –љ–µ–Ї–ї–∞—Б—Б–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–є –≤–∞—А–Є–∞–љ—В –°–†–Ъ (–°–†–Ъ-–Э) вАФ —Г 16 (6,4%). –Ы–µ–≥–Ї–Њ–µ —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Г 110 (41,9%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї–Њ–µ вАФ —Г 99 (37,6%), —В—П–ґ–µ–ї–Њ–µ вАФ —Г 54 (20,5%).
–Э–∞—Б—В–Њ—П—Й–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ–Љ —А–∞–љ–µ–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л, –≥–і–µ, —Б–Њ–≥–ї–∞—Б–љ–Њ –∞–≤—В–Њ—А—Б–Ї–Њ–є –Ї–Њ–љ—Ж–µ–њ—Ж–Є–Є, –љ–∞ –Њ—Б–љ–Њ–≤–µ –Є–Ј—Г—З–µ–љ–Є—П —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤ –≥–µ–љ–µ—В–Є–Ї–Є –Є —Н–њ–Є–≥–µ–љ–µ—В–Є–Ї–Є –њ—А–µ–і–ї–Њ–ґ–µ–љ–Њ –≤—Л–і–µ–ї–µ–љ–Є–µ —Д–µ–љ–Њ—В–Є–њ–Њ–≤ –°–†–Ъ [23]. –Ф–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –Ї–∞–ґ–і–Њ–≥–Њ —Д–µ–љ–Њ—В–Є–њ–∞ –Є–Ј –≤—Б–µ–є –Ї–Њ–≥–Њ—А—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Є –≤—Л–і–µ–ї–µ–љ—Л –њ–Њ–і–≥—А—Г–њ–њ—Л: –њ–Њ–і–≥—А—Г–њ–њ–∞ 1 вАФ ¬Ђ–њ–Њ—Б—В–Є–љ—Д–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –°–†–Ъ¬ї (n=45) —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –њ—А–Є –љ–∞–ї–Є—З–Є–Є —Б–≤—П–Ј–Є –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–µ—А–≤—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б —Н–њ–Є–Ј–Њ–і–Њ–Љ –Њ—Б—В—А–Њ–є –Ї–Є—И–µ—З–љ–Њ–є –Є–љ—Д–µ–Ї—Ж–Є–Є, –њ–Њ–і–≥—А—Г–њ–њ–∞ 2 вАФ —Д–µ–љ–Њ—В–Є–њ ¬Ђ–°–†–Ъ —Г –ї–Є—Ж —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ¬ї (n=49) вАФ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ 25 –Є –±–Њ–ї–µ–µ –Ї–≥/–Љ2; –њ–Њ–і–≥—А—Г–њ–њ–∞ 3 вАФ ¬Ђ–Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л–є –°–†–Ъ¬ї (n=75) вАФ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ–µ—А–µ–Ї—А–µ—Б—В–∞ –°–†–Ъ —Б –і—А—Г–≥–Є–Љ–Є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞–Љ–Є –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞; –њ–Њ–і–≥—А—Г–њ–њ–∞ 4 вАФ ¬Ђ—Н—Б—Б–µ–љ—Ж–Є–∞–ї—М–љ—Л–є –°–†–Ъ¬ї (n=51) вАФ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –і—А—Г–≥–Є—Е —Д–µ–љ–Њ—В–Є–њ–Њ–≤. –Т –≥—А—Г–њ–њ—Г –Ї–Њ–љ—В—А–Њ–ї—П –≤–Њ—И–ї–Є 40 –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж, —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л—Е –њ–Њ –њ–Њ–ї—Г –Є –≤–Њ–Ј—А–∞—Б—В—Г —Б –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є —Б –°–†–Ъ.
–Ф–ї—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П –њ–Њ—Б—В–∞–≤–ї–µ–љ–љ–Њ–є —Ж–µ–ї–Є –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Љ–µ—В–Њ–і–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є (–Љ–µ—В–Њ–і–Њ–Љ –Ї–Њ–љ–≤–µ—А—В–Њ–≤) —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Д–µ–љ–Њ—В–Є–њ–∞–Љ–Є –Њ—В–Њ–±—А–∞–љ–Њ 40 –Њ–±—А–∞–Ј—Ж–Њ–≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л (–њ–Њ 10 –Њ–±—А–∞–Ј—Ж–Њ–≤ –Ї–∞–ґ–і–Њ–≥–Њ) –Є 10 –Њ–±—А–∞–Ј—Ж–Њ–≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж (–≥—А—Г–њ–њ–∞ –Ї–Њ–љ—В—А–Њ–ї—П). –°–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є–µ –±–Є–Њ–±–∞–љ–Ї–∞ –Њ–±—А–∞–Ј—Ж–Њ–≤ –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Ї–Є—И–µ—З–љ–Є–Ї–∞ —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤ –љ–∞—И–µ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –љ–∞ –±–∞–Ј–µ –Ю–Ю–Ю ¬Ђ–Ъ–љ–Њ–Љ–Є–Ї—Б¬ї (–≥. –Ь–Њ—Б–Ї–≤–∞).
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г 220 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Д–µ–љ–Њ—В–Є–њ–∞–Љ–Є –°–†–Ъ –Є 40 —З–µ–ї–Њ–≤–µ–Ї –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М –Њ—Ж–µ–љ–Ї–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ–Њ –Њ–њ—А–Њ—Б–љ–Є–Ї—Г GSRS –Є —Ж–Є—Д—А–Њ–≤–Њ–є –≤–µ—А—Б–Є–Є –≤–Є–Ј—Г–∞–ї—М–љ–Њ-–∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–ЄћЖ —И–Ї–∞–ї—Л; —Б—В—А—Г–Ї—В—Г—А–∞ —А–∞—Ж–Є–Њ–љ–∞, –њ–Є—Й–µ–≤—Л–µ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є—П –Є –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–љ—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М —Б–Њ–≥–ї–∞—Б–љ–Њ –Њ–њ—А–Њ—Б–љ–Є–Ї–∞–Љ WHO CINDI program questionnaire [24] –Є ¬Ђ–Ш–љ—Д–Њ—А–Љ–∞—Ж–Є—П –Њ –њ–Є—В–∞–љ–Є–Є –Є –њ–Є—Й–µ–≤–Њ–Љ –њ–Њ–≤–µ–і–µ–љ–Є–Є¬ї [25]; –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є вАФ –њ–Њ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є —И–Ї–∞–ї–µ —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є HADS [26]; —Г—А–Њ–≤–µ–љ—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є —В—А–µ–≤–Њ–≥–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ вАФ –њ–Њ –Є–љ–і–µ–Ї—Б—Г –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є VSI [27].
–Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –Є –ї–Є—Ж –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞ –±–∞–Ј–µ –¶–Э–Ш–Ы –§–У–С–Ю–£ –Т–Ю –Ю–Љ–У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –≥–Њ—А–Љ–Њ–љ–∞ —Б—В—А–µ—Б—Б–∞ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Г—В—А–µ–љ–љ–µ–є –Є –≤–µ—З–µ—А–љ–µ–є –њ–Њ—А—Ж–Є—П—Е —Б–ї—О–љ—Л (–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є –љ–∞–±–Њ—А —Д–Є—А–Љ—Л Diagnostics Biochem Canada Inc., –Ъ–∞–љ–∞–і–∞), –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –і–Њ—Д–∞–Љ–Є–љ–∞ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є (–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –љ–∞–±–Њ—А—Л —Д–Є—А–Љ—Л IBL, –У–µ—А–Љ–∞–љ–Є—П), –Љ–∞—А–Ї–µ—А–∞ —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –Ј–Њ–љ—Г–ї–Є–љ–∞ –≤ –Ї–∞–ї–µ (–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–є –љ–∞–±–Њ—А —Д–Є—А–Љ—Л Immundiagnostik, –У–µ—А–Љ–∞–љ–Є—П) –Љ–µ—В–Њ–і–Њ–Љ –Є–Љ–Љ—Г–љ–Њ—Д–µ—А–Љ–µ–љ—В–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞.
–°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–є –∞–љ–∞–ї–Є–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–µ–і–µ–љ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ–∞–Ї–µ—В–Њ–≤ –њ—А–Є–Ї–ї–∞–і–љ—Л—Е –њ—А–Њ–≥—А–∞–Љ–Љ Microsoft Excel –Є Statistica v.10.0 (—А—Г—Б–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ–љ–∞—П –≤–µ—А—Б–Є—П). –Т —Б–≤—П–Ј–Є —Б –љ–∞–ї–Є—З–Є–µ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П, –Њ—В–ї–Є—З–љ–Њ–≥–Њ –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ, –і–ї—П –≤—Б–µ—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є –њ–Њ–і—Б—З–µ—В –Љ–µ–і–Є–∞–љ—Л (–Ь–µ), 25-–≥–Њ (–†25) –Є 75-–≥–Њ (–†75) –њ—А–Њ—Ж–µ–љ—В–Є–ї–µ–є. –Ф–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≥—А—Г–њ–њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ї—А–Є—В–µ—А–Є–є –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є (U) –Є –Ї—А–Є—В–µ—А–Є–є –Ъ—А–∞—Б–Ї–µ–ї–ї–∞ вАФ –£–Њ–ї–ї–Є—Б–∞ (–Э). –Ф–ї—П –∞–љ–∞–ї–Є–Ј–∞ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –Є –∞–љ–∞–ї–Є–Ј–∞ —З–∞—Б—В–Њ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Ї—А–Є—В–µ—А–Є–ЄћЖ —Б–Њ–њ—А—П–ґ–µ–љ–љ–Њ—Б—В–Є ѕЗ2 –Я–Є—А—Б–Њ–љ–∞. –°—В–µ–њ–µ–љ—М –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –њ–µ—А–µ–Љ–µ–љ–љ—Л–Љ–Є —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–Є –Љ–µ—В–Њ–і–Њ–Љ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –°–њ–Є—А–Љ–µ–љ–∞ —Б –Њ—Ж–µ–љ–Ї–Њ–є –Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В–∞ —А–∞–љ–≥–Њ–≤–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є (rs). –†–µ–Ј—Г–ї—М—В–∞—В—Л —Б—З–Є—В–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є –њ—А–Є p<0,05.
–Р–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –±–Є–Њ–±–∞–љ–Ї–∞ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ—А–Њ–≤–µ–і–µ–љ —Б –њ–Њ–Љ–Њ—Й—М—О –њ–ї–∞—В—Д–Њ—А–Љ—Л ¬Ђ–Ъ–љ–Њ–Љ–Є–Ї—Б-–С–Є–Њ—В–∞¬ї (https://biota.knomics.ru/). –Ґ–∞–Ї—Б–Њ–љ–Њ–Љ–Є—П –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М —Б –њ–Њ–Љ–Њ—Й—М—О –љ–∞–Є–≤–љ–Њ–≥–Њ –±–∞–ЄћЖ–µ—Б–Њ–≤—Б–Ї–Њ–≥–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—В–Њ—А–∞ QIIME2, –Њ–±—Г—З–µ–љ–љ–Њ–≥–Њ –љ–∞ –±–∞–Ј–µ SILVA v138 (https://www.arb-silva.de/documentation/release-138/). –Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–ЄћЖ –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Љ–Є–Ї—А–Њ–±–љ–Њ–≥–Њ —Б–Њ–Њ–±—Й–µ—Б—В–≤–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ—Л PICRUSt, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –њ—Г—В–µ–ЄћЖ –Є –Љ–Њ–і—Г–ї–µ–ЄћЖ вАФ –њ–Њ –±–∞–Ј–∞–Љ KEGG –Є MetaCyc.
–Ф–ї—П –Є–Ј—Г—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–Є–є –≤ –Њ–±—Й–µ–є –Ї–Њ–Љ–њ–Њ–Ј–Є—Ж–Є–Њ–љ–љ–Њ–є —Б—В—А—Г–Ї—В—Г—А–µ –Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–µ –Њ–±—А–∞–Ј—Ж–Њ–≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Љ–љ–Њ–≥–Њ–Љ–µ—А–љ—Л–є –і–Є—Б–њ–µ—А—Б–Є–Њ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј (PERMANOVA), –Љ–µ—В—А–Є–Ї—Г –∞–ї—М—Д–∞-—А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є—П –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Є–љ–і–µ–Ї—Б–∞ –®–µ–љ–љ–Њ–љ–∞. –Ь–љ–Њ–ґ–µ—Б—В–≤–µ–љ–љ—Г—О –Ї–Њ—А—А–µ–Ї—В–Є—А–Њ–≤–Ї—Г —В–µ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≤—Л–њ–Њ–ї–љ—П–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ—Ж–µ–і—Г—А—Л –С–µ–љ–і–ґ–∞–Љ–Є–љ–Є вАФ –•–Њ—Е–±–µ—А–≥–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
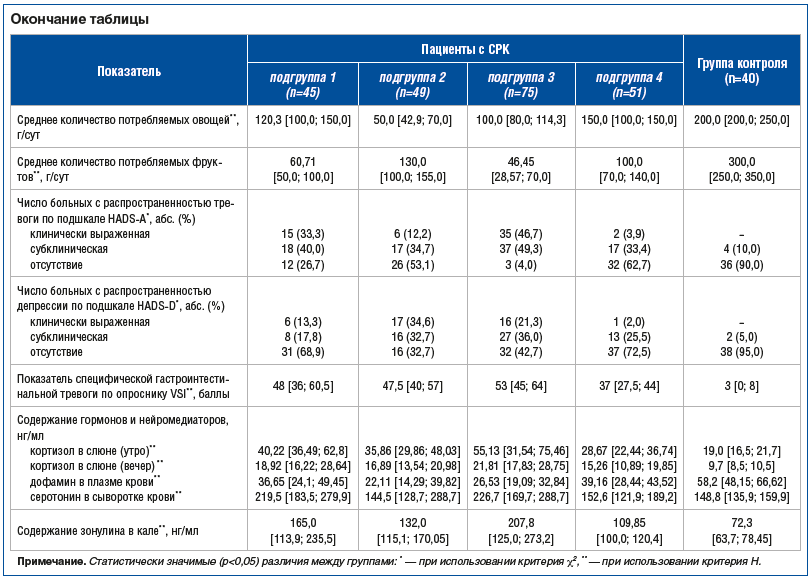
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤, –њ–Є—Й–µ–≤—Л–µ –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є—П, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є, —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ–Њ–є —В—А–µ–≤–Њ–≥–Є, –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—Л–і–µ–ї–µ–љ–љ—Л—Е —Д–µ–љ–Њ—В–Є–њ–Њ–≤ –Є —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –≤ —В–∞–±–ї–Є—Ж–µ.

–Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤—Л–±–Њ—А–Ї–∞ –Њ–±—А–∞–Ј—Ж–Њ–≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М —А–∞–љ–і–Њ–Љ–љ–Њ, –і–ї—П –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –∞—Б—Б–Њ—Ж–Є–∞—В–Є–≤–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–є –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–Њ—Б—В–∞–≤–∞ –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л —Б –Є–Ј—Г—З–∞–µ–Љ—Л–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є (–і–Є–µ—В–∞, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є, —Б–µ–Ї—А–µ—Ж–Є—П –≥–Њ—А–Љ–Њ–љ–∞ —Б—В—А–µ—Б—Б–∞ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞, –љ–µ–є—А–Њ–Љ–µ–і–Є–∞—В–Њ—А–Њ–≤ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ –Є –і–Њ—Д–∞–Љ–Є–љ–∞, —Г—А–Њ–≤–µ–љ—М –Љ–∞—А–Ї–µ—А–∞ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є –Ј–Њ–љ—Г–ї–Є–љ–∞ –≤ –Ї–∞–ї–µ) –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –і–∞–љ–љ—Л–µ –Њ–њ–Є—Б–∞–љ–љ–Њ–є –Ї–Њ–≥–Њ—А—В—Л.
–Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –Љ–Є–Ї—А–Њ–±–Є–Њ—В–∞ –Ї–Є—И–µ—З–љ–Є–Ї–∞ –њ—А–Є –Є–Ј—Г—З–µ–љ–Є–Є –Љ–µ—В–Њ–і–Њ–Љ 16s-—Б–µ–Ї–≤–µ–љ–Є—А–Њ–≤–∞–љ–Є—П –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ–Њ–є –†–Э–Ъ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –≤–Є–і–Њ–≤ –±–∞–Ї—В–µ—А–Є–є (—А–Є—Б. 1). –°—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤—Л—П–≤–ї–µ–љ—Л –њ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О –∞–ї—М—Д–∞-—А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є—П (—А=0,039).

–Ю –њ–Њ–≤—Л—И–µ–љ–Є–Є –∞–ї—М—Д–∞-—А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є—П –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ—А–Є –°–†–Ъ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ї–Є—Ж–∞–Љ–Є –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П —А–∞–љ–µ–µ —Г–ґ–µ —Б–Њ–Њ–±—Й–∞–ї–Њ—Б—М –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [28вАУ30], –љ–Њ —В–∞–Ї–ґ–µ –±—Л–ї–Є –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л–µ –і–∞–љ–љ—Л–µ, –≥–і–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П [31вАУ33] –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–Є–є [19, 34, 35].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є —Б–Њ—Б—В–∞–≤–∞ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –љ–µ –±—Л–ї–Њ, –Є–і–µ–љ—В–Є—Д–Є—Ж–Є—А–Њ–≤–∞–љ—Л –Њ—В–і–µ–ї—М–љ—Л–µ –Љ–Є–Ї—А–Њ–±–љ—Л–µ —В–∞–Ї—Б–Њ–љ—Л, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ –Њ–±–Є–ї–Є–µ –Ї–Њ—В–Њ—А—Л—Е –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–∞–Ј–ї–Є—З–∞–µ—В—Б—П –Љ–µ–ґ–і—Г –і–≤—Г–Љ—П –≥—А—Г–њ–њ–∞–Љ–Є. –Ґ–∞–Ї, —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –њ–Њ–≤—Л—И–µ–љ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–∞–Ї—В–µ—А–Є–є Firmicutes, Actinobacteriota –Є Proteobacteria –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ Bacteroidota, Desulfobacterota.
–Ю—В–љ–Њ—Б–Є—В–µ–ї—М–љ–∞—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –±–∞–Ї—В–µ—А–Є–є –љ–∞ —Г—А–Њ–≤–љ–µ —В–Є–њ–∞ –≤ –Њ–±—А–∞–Ј—Ж–∞—Е –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ (n=40) –Є –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж (n=10) –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –љ–∞ —А–Є—Б—Г–љ–Ї–∞—Е 1, 2.

–Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ—А–Є –њ–Њ–і—Б—З–µ—В–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П Firmicutes : Bacteroidota, –Ї–Њ—В–Њ—А—Л–є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ —Б–Њ—Б—В–∞–≤–Є–ї 2,35, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж вАФ 1,33 (—А=0,041). –Ю–± —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П Firmicutes : Bacteroidota —Б–Њ–Њ–±—Й–∞–ї–Њ—Б—М –≤–Њ –Љ–љ–Њ–≥–Є—Е –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е —А–∞–љ–µ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [28, 29, 36, 37].
–Т –Њ–±—А–∞–Ј—Ж–∞—Е –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Њ–±—А–∞–Ј—Ж–∞–Љ–Є –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —А–∞–Ј–ї–Є—З–Є—П –љ–∞ —Г—А–Њ–≤–љ–µ —Б–µ–Љ–µ–є—Б—В–≤ –≤ –≤–Є–і–µ —Г–≤–µ–ї–Є—З–µ–љ–Є—П –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В–Є Ruminococcaceae, Lachnospiraceae, Veillonellaceae –љ–∞ —Д–Њ–љ–µ —Б–љ–Є–ґ–µ–љ–Є—П –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ Bifidobacteriaceae, Bacteroidaceae, Prevotellaceae, –∞ —В–∞–Ї–ґ–µ —А–Њ–і–Њ–≤ вАФ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ Bacteroides, Faecalibacterium, Bifidobacterium –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–Є–Є —З–Є—Б–ї–∞ —Г—Б—В–Њ–є—З–Є–≤—Л—Е –Ї –ґ–µ–ї—З–Є –±–∞–Ї—В–µ—А–Є–є Alistipes –Є Blautia.
–Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –≤ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –љ–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –Ї–∞–Ї –њ–Њ —Б–Њ—Б—В–∞–≤—Г, —В–∞–Ї –Є –њ–Њ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–Љ—Г –њ–Њ—В–µ–љ—Ж–Є–∞–ї—Г –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж –Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –њ–Њ—Б–ї–µ —А–∞–Ј–і–µ–ї–µ–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –љ–∞ –≥—А—Г–њ–њ—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ–Њ–і—В–Є–њ–∞, —Б—В–µ–њ–µ–љ–Є —В—П–ґ–µ—Б—В–Є –Є –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Л—Е —Д–µ–љ–Њ—В–Є–њ–Њ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Ґ–∞–Ї, –≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–Ф —Б–љ–Є–ґ–µ–љ–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –±—Г—В–Є—А–∞—В–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤ Ruminococcaceae (—А=0,038) –Є Erysipelatoclostridiaceae (—А=0,008), –Њ—В–љ–Њ—Б—П—Й–Є—Е—Б—П –Ї —В–Є–њ—Г Firmicutes, –∞ —В–∞–Ї–ґ–µ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Methanobrevibacter —В–Є–њ–∞ Euryarchaeota (—А=0,004). –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae —А–Њ–і–∞ Escherichia / Shigella —В–Є–њ–∞ Proteobacteria (—А=0,019). –Ь–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Б–Є–љ—В–µ–Ј–∞ –Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ—Г—В–µ–Љ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≥–ї—Г—В–∞—А–∞—В–∞ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Ј–љ–∞—З–Є–Љ–Њ –љ–Є–ґ–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –ї–Є—Ж–∞–Љ–Є –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П –Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є —Б –°–†–Ъ —Б –і—А—Г–≥–Є–Љ–Є —В–Є–њ–∞–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П –Ї–Є—И–µ—З–љ–Њ–є –Љ–Њ—В–Њ—А–Є–Ї–Є (—А=0,004).
–Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–Ч –≤ –±–Њ–ї—М—И–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –±–∞–Ї—В–µ—А–Є–Є —А–Њ–і–∞ Methanobrevibacter (—А=0,006) –Є —А–Њ–і–∞ Alistipes —В–Є–њ–∞ Bacteroidota (—А=0,029), –≤ –Љ–µ–љ—М—И–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –±–∞–Ї—В–µ—А–Є–Є —А–Њ–і–∞ Sutterella —В–Є–њ–∞ Proteobacteria (—А=0,033).
–Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–°–Љ –≤ –Љ–µ–љ—М—И–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–ї–Є—Б—М –±–∞–Ї—В–µ—А–Є–Є —Б–µ–Љ–µ–є—Б—В–≤–∞ Ruminococcaceae —В–Є–њ–∞ Firmicutes (—А=0,008) –Є –њ–Њ—А—П–і–Ї–∞ Clostridiales —В–Є–њ–∞ Firmicutes (—А=0,024).
–Т –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ c —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ—В–∞ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –≤–Є–і–Њ–≤, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–∞—Б—М –љ–Є–Ј–Ї–Њ–є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є –љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –∞–і–∞–њ—В–Є—А–Њ–≤–∞—В—М—Б—П –Ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О —Д–∞–Ї—В–Њ—А–Њ–≤ –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Б—А–µ–і—Л. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –Њ–±—А–∞–Ј—Ж–∞—Е –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤ –±–Њ–ї—М—И–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –ї–Є—Ж–∞–Љ–Є –Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ–Є —Б –ї–µ–≥–Ї–Є–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –≤—Б—В—А–µ—З–∞–ї–Є—Б—М –±–∞–Ї—В–µ—А–Є–Є —А–Њ–і–Њ–≤ Ruminococcus torques group (—А=0,011) –Є Blautia (—А=0,021), –≤ –Љ–µ–љ—М—И–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ вАФ –±—Г—В–Є—А–∞—В–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є–µ –±–∞–Ї—В–µ—А–Є–Є —Б–µ–Љ–µ–є—Б—В–≤–∞ Ruminococcaceae (—А=0,042) –Є –≤–Є–і–∞ Bacteroides stercoris —В–Є–њ–∞ Bacteroidota (—А=0,026). –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –Ї–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –°–†–Ъ —В–∞–Ї–ґ–µ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–∞—Б—М –љ–Є–Ј–Ї–Є–Љ —Б–Є–љ—В–µ–Ј–Њ–Љ –±—Г—В–Є—А–∞—В–∞ (—А=0,003).
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –љ–∞–Љ–Є –і–∞–љ–љ—Л–µ —Б–Њ–≥–ї–∞—Б—Г—О—В—Б—П —Б –Є–Љ–µ—О—Й–Є–Љ–Є—Б—П –≤ –ї–Є—В–µ—А–∞—В—Г—А–µ. –Ґ–∞–Ї, –≤ —А–∞–±–Њ—В–µ M. Pozuelo et al. [38] —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–Ф –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤ Ruminococcaceae, Clostridiales, Erysipelotrichaceae, Methanobacteriaceae; –Њ —Б–љ–Є–ґ–µ–љ–Є–Є —З–Є—Б–ї–∞ Methanobacteriaceae –≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–Ф —Б–Њ–Њ–±—Й–∞–ї–Є C. Carco et al. [39] –Є T. Ringel-Kulka et al. [40]. –Т —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –Њ–±–Ј–Њ—А–µ 24 –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–Є—Б–ї–∞ —Б—В—А–Њ–≥–Є—Е –∞–љ–∞—Н—А–Њ–±–Њ–≤, –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –љ–Є–Ј–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є —Г—Б–Є–ї–µ–љ–Є–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Њ—В–Њ—А–Є–Ї–Є –њ—А–Є –°–†–Ъ-–Ф –њ—А–Є–≤–Њ–і–Є—В –Ї —А–∞–Ј–Љ–љ–Њ–ґ–µ–љ–Є—О –љ–µ–њ—А–Є—Е–Њ—В–ї–Є–≤—Л—Е –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae [41].
–Т –љ–µ–і–∞–≤–љ–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ —Г —Б—Г–±—К–µ–Ї—В–Њ–≤ —Б –°–†–Ъ-–Ч –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–∞—П –≤—Л—А–∞–±–Њ—В–Ї–∞ –Љ–µ—В–∞–љ–∞ –≤ –≤—Л–і—Л—Е–∞–µ–Љ–Њ–Љ –≤–Њ–Ј–і—Г—Е–µ –њ—А—П–Љ–Њ –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–Љ—Г –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–Њ–і–µ—А–ґ–∞–љ–Є—О –Љ–µ—В–∞–љ–Њ–≥–µ–љ–Њ–≤ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Ј–∞ —Б—З–µ—В –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Methanobrevibacter [42]. –•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Љ–µ—В–∞–љ –Ј–∞–Љ–µ–і–ї—П–µ—В –њ–µ—А–Є—Б—В–∞–ї—М—В–Є–Ї—Г —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —А–∞–Ј–≤–Є—В–Є—О –Ј–∞–њ–Њ—А–Њ–≤ [18].
–°–љ–Є–ґ–µ–љ–Є–µ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є Sutterella wadsworthensis –љ–∞—А—П–і—Г —Б Oxalobacter formigenes –Є Bacteroides pectinophilus —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –њ–Њ–Ї–∞–Ј–∞–љ–Њ –≤ —А–∞–±–Њ—В–µ I. Masoodi et al. [43]. –Т –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —А–∞–±–Њ—В–∞—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Alistipes —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–Ф –Є –°–†–Ъ-–°–Љ [31, 44, 45], –≤ –і—А—Г–≥–Њ–є вАФ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Г –і–µ—В–µ–є —Б –°–†–Ъ-–Ч [46].
–Ф–∞–љ–љ—Л–µ, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П —Б–≤—П–Ј–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–∞ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е —Б—В–µ–њ–µ–љ—П—Е —В—П–ґ–µ—Б—В–Є –°–†–Ъ, –љ–µ–Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л. –Р—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –Љ–µ–ґ–і—Г —В—П–ґ–µ—Б—В—М—О –Ї–Є—И–µ—З–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –°–†–Ъ –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ Ruminococcus torques –Њ—В–Љ–µ—З–µ–љ–∞ –≤ —А–∞–±–Њ—В–∞—Е E. Malinen et al. [47] –Є J. Yang et al. [48]. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –±–∞–Ї—В–µ—А–Є–Є —А–Њ–і–∞ Ruminococcus torques group –Љ–Њ–≥—Г—В –Є–љ–і—Г—Ж–Є—А–Њ–≤–∞—В—М —Б–µ–Ї—А–µ—Ж–Є—О –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –±–µ–ї–Ї–∞ —Д–ї–∞–≥–µ–ї–ї–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є —Б–њ–Њ—Б–Њ–±–µ–љ –Ј–∞–њ—Г—Б–Ї–∞—В—М –≥—Г–Љ–Њ—А–∞–ї—М–љ—Л–є –Њ—В–≤–µ—В —З–µ—А–µ–Ј —В–Њ–ї–ї-–њ–Њ–і–Њ–±–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л —А–∞—Б–њ–Њ–Ј–љ–∞–≤–∞–љ–Є—П –Њ–±—А–∞–Ј–Њ–≤ [49]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, Ruminococcus torques –Љ–Њ–ґ–µ—В —А–∞—Б—Й–µ–њ–ї—П—В—М –Љ—Г—Ж–Є–љ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞, –љ–∞—А—Г—И–∞—П —Ж–µ–ї–Њ—Б—В–љ–Њ—Б—В—М —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞ [50].
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Ї–Њ–Љ–Љ–µ–љ—Б–∞–ї—М–љ—Л–µ –±–∞–Ї—В–µ—А–Є–Є Bacteroides stercoris, —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–Њ—В–Њ—А—Л—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –љ–∞–Љ–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —В—П–ґ–µ–ї—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –°–†–Ъ, –Њ–±–ї–∞–і–∞—О—В –Є–Љ–Љ—Г–љ–Њ–Љ–Њ–і—Г–ї–Є—А—Г—О—Й–Є–Љ–Є —Б–≤–Њ–є—Б—В–≤–∞–Љ–Є, —Б–Є–љ—В–µ–Ј–Є—А—Г—П –Ї–Њ–љ—К—О–≥–Є—А–Њ–≤–∞–љ–љ—Г—О –ї–Є–љ–Њ–ї–µ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г [51вАУ53].
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–є –Љ–µ–ґ–і—Г —В–∞–Ї—Б–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –°–†–Ъ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤—Л—П–≤–ї–µ–љ—Л: –њ—А—П–Љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–∞—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Methanobrevibacter –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –Ј–∞–њ–Њ—А–∞ (rs=0,583, —А=0,003), –Њ–±—А–∞—В–љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–∞—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –±—Г—В–Є—А–∞—В–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤ Ruminococcaceae –Є Erysipelatoclostridiaceae –Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –±–Њ–ї–Є (rs=-0,429, —А=0,026; rs=-0,391, —А=0,041 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –∞ —В–∞–Ї–ґ–µ –њ—А—П–Љ–∞—П –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–∞—П —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Ruminococcus torques group –Є —В–∞–Ї–Є–Љ–Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –°–†–Ъ, –Ї–∞–Ї –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–∞—П –±–Њ–ї—М –Є –і–Є–∞—А–µ—П (rs=0,515, p<0,001; rs=0,488, p=0,017 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Ч–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–Њ –њ—Г—В–Є —Б–Є–љ—В–µ–Ј–∞ –±—Г—В–Є—А–∞—В–∞ —В–∞–Ї–ґ–µ –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –±–Њ–ї–Є (rs=-0,607, —А=0,001).

–Т –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е —А–∞–љ–µ–µ —А–∞–±–Њ—В–∞—Е –Њ–њ–Є—Б–∞–љ—Л –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–∞—П —Б–≤—П–Ј—М –Ї–Є—И–µ—З–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –°–†–Ъ —Б –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ Gammaproteobacteria –Є –Њ—В—А–Є—Ж–∞—В–µ–ї—М–љ—Л–µ —Б–≤—П–Ј–Є —Б –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ Bifidobacterium spp. (–і–ї—П –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –±–Њ–ї–Є), Faecalibacterium spp., Eubacterium rectale –Є –±—Г—В–Є—А–∞—В–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е Ruminococcus (–і–ї—П –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –±–Њ–ї–Є, –Љ–µ—В–µ–Њ—А–Є–Ј–Љ–∞) [44]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є G. Kim et al. [54] —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–∞ Methanobrevibacter —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ-–Ч –±—Л–ї–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ–Є –±–∞–ї–ї–∞–Љ–Є –њ—А–Є –Њ—Ж–µ–љ–Ї–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –Ј–∞–њ–Њ—А–∞. –Т —А–∞–±–Њ—В–µ J. Yang et al. [48] –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –±–∞–Ї—В–µ—А–Є–є Ruminococcus torques group –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ —Н–љ—В–µ—А–Њ—Е—А–Њ–Љ–∞—Д—Д–Є–љ–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –≤ –±–Є–Њ–њ—В–∞—В–∞—Е —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є, —Б—В–µ–њ–µ–љ—М—О —В—П–ґ–µ—Б—В–Є –°–†–Ъ, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –Є —З–∞—Б—В–Њ—В–Њ–є –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –±–Њ–ї–Є, –∞ —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ—В–Њ–є –і–µ—Д–µ–Ї–∞—Ж–Є–Є.
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Б–Њ—Б—В–∞–≤ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Ј–∞–≤–Є—Б–Є—В –Њ—В –і–Є–µ—В—Л —З–µ–ї–Њ–≤–µ–Ї–∞. –Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П Firmicutes : Bacteroidota, —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ–Є –њ–Є—Й–µ–≤—Л–Љ–Є –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є—П–Љ–Є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М —В—П–≥–∞ –Ї —Б–ї–∞–і–Ї–Њ–є (ѕЗ2=18,23, p=0,004) –Є –Љ—Г—З–љ–Њ–є (ѕЗ2=15,47, p=0,029) –њ–Є—Й–µ, –Ї–Њ–љ–і–Є—В–µ—А—Б–Ї–Є–Љ –Є–Ј–і–µ–ї–Є—П–Љ (ѕЗ2=20,56, p=0,002). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Н—В–Є –њ–∞—Ж–Є–µ–љ—В—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ–Њ –±–Њ–ї—М—И–µ –њ–Њ—В—А–µ–±–ї—П–ї–Є –і–Њ–±–∞–≤–ї–µ–љ–љ–Њ–≥–Њ —Б–∞—Е–∞—А–∞ (ѕЗ2=33,52, p<0,001). –Т –ї–Є—В–µ—А–∞—В—Г—А–µ –Њ–њ–Є—Б–∞–љ–Њ, —З—В–Њ –і–Є–µ—В–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ —Б–∞—Е–∞—А–∞, —В–∞–Ї –ґ–µ –Ї–∞–Ї –Є –і–Є–µ—В–∞ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–Є—А–Њ–≤, –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —В–Є–њ–∞ Bacteroidota –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—О вАФ –±–∞–Ї—В–µ—А–Є–є —В–Є–њ–∞ Firmicutes [55]. –Я–Њ–і–Њ–±–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л —Б–≤—П–Ј—Л–≤–∞—О—В —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є—П, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–∞—Е–∞—А–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є—Е –±–∞–Ї—В–µ—А–Є–є —В–Є–њ–∞ Firmicutes —Б–≤—П–Ј–∞–љ–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –њ—А–Њ–Є–Ј–≤–Њ–і—Б—В–≤–∞ –Ї–Њ—А–Њ—В–Ї–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В –Є –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—Б–≤–Њ–µ–љ–Є–µ–Љ —Н–љ–µ—А–≥–Є–Є, –≤—Л—А–∞–±–∞—В—Л–≤–∞—О—Й–µ–є—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Д–µ—А–Љ–µ–љ—В–∞—Ж–Є–Є —Г–≥–ї–µ–≤–Њ–і—Б–Њ–і–µ—А–ґ–∞—Й–Є—Е –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –њ–Є—Й–Є [56].
–Ґ—П–≥–∞ –Ї –ґ–Є—А–љ–Њ–є –њ–Є—Й–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–∞—Б—М —Б –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Alistipes (ѕЗ2=11,45, p=0,025), —З—В–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ –Є –≤ —А—П–і–µ –і—А—Г–≥–Є—Е —А–∞–±–Њ—В, –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—Й–Є—Е —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —В–Њ–ї–µ—А–∞–љ—В–љ—Л—Е –Ї –ґ–µ–ї—З–Є Alistipes, Bilophila, Ruminococcus gnavus, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ, —Г –ї–Є—Ж, –њ—А–Є–і–µ—А–ґ–Є–≤–∞—О—Й–Є—Е—Б—П –і–Є–µ—В—Л —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –љ–∞—Б—Л—Й–µ–љ–љ—Л—Е –ґ–Є—А–Њ–≤ [14, 57вАУ59].
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –Є –љ–Є–Ј–Ї–Є–Љ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ–Љ —Б–≤–µ–ґ–Є—Е –Њ–≤–Њ—Й–µ–є –Є —Д—А—Г–Ї—В–Њ–≤ –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –≤—Л—П–≤–ї—П–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –±—Г—В–Є—А–∞—В–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤ Ruminococcaceae –Є Erysipelatoclostridiaceae (ѕЗ2=26,03, p<0,001; ѕЗ2=20,74, p=0,002 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ), –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Bifidobacterium (ѕЗ2=29,55, p<0,001), –∞ —В–∞–Ї–ґ–µ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –љ–Є–Ј–Ї–∞—П –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–Њ –њ—Г—В–Є —Б–Є–љ—В–µ–Ј–∞ –±—Г—В–Є—А–∞—В–∞ (ѕЗ2=35,59, p<0,001). –•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ–Є—Й–µ–≤—Л–µ –≤–Њ–ї–Њ–Ї–љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г—О—В—Б—П –±–∞–Ї—В–µ—А–Є—П–Љ–Є —В–Њ–ї—Б—В–Њ–є –Ї–Є—И–Ї–Є —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–Њ—А–Њ—В–Ї–Њ—Ж–µ–њ–Њ—З–µ—З–љ—Л—Е –ґ–Є—А–љ—Л—Е –Ї–Є—Б–ї–Њ—В, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Љ–∞—Б–ї—П–љ–Њ–є [55].
–Ч–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ, —З—В–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤ Ruminococcaceae –Є Erysipelatoclostridiaceae, –∞ —В–∞–Ї–ґ–µ –љ–Є–Ј–Ї–∞—П –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –±—Г—В–Є—А–∞—В–∞ —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ—Л —Б —Г—А–Њ–≤–љ–µ–Љ —Д–µ–Ї–∞–ї—М–љ–Њ–≥–Њ –Ј–Њ–љ—Г–ї–Є–љ–∞, —П–≤–ї—П—О—Й–µ–≥–Њ—Б—П –Ї–Њ—Б–≤–µ–љ–љ—Л–Љ –Љ–∞—А–Ї–µ—А–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —Н–њ–Є—В–µ–ї–Є–∞–ї—М–љ–Њ–є –њ—А–Њ–љ–Є—Ж–∞–µ–Љ–Њ—Б—В–Є (rs=-0,404, —А=0,021; rs=-0,399, —А=0,034; rs=-0,516, —А=0,006 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Я–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Ј–Њ–љ—Г–ї–Є–љ–∞ —В–∞–Ї–ґ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї—Б—П —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є Ruminococcus torques group (rs=0,485, —А=0,019).
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ–Њ—П–≤–ї—П–µ—В—Б—П –≤—Б–µ –±–Њ–ї—М—И–µ –і–∞–љ–љ—Л—Е –Њ —В–Њ–Љ, —З—В–Њ –Љ–Њ–і—Г–ї—П—Ж–Є—П –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є—В—Л –Љ–Њ–ґ–µ—В –Є–Ј–Љ–µ–љ—П—В—М –±–Є–Њ—Б–Є–љ—В–µ–Ј, –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –Є –Њ–±—А–∞—В–љ—Л–є –Ј–∞—Е–≤–∞—В –љ–µ–є—А–Њ—В—А–∞–љ—Б–Љ–Є—В—В–µ—А–Њ–≤ [60вАУ62], —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –њ—А–Є –°–†–Ъ. –Т –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–Њ–≤ Escherichia / Shigella –Є Ruminococcus torques group –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є (rs=0,478, —А=0,008; rs=0,612, p<0,001 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ).
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –љ–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Љ–µ–ґ–і—Г —Б–Њ–Ї—А–∞—Й–µ–љ–Є–µ–Љ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Bifidobacterium –Є –≤—Л—Б–Њ–Ї–Є–Љ–Є –±–∞–ї–ї–∞–Љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –і–µ–њ—А–µ—Б—Б–Є–Є –њ–Њ —И–Ї–∞–ї–µ HADS –Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –Є–љ–і–µ–Ї—Б–∞ VSI (rs=-0,364, —А=0,038; rs=-0,401, —А=0,022 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –†–∞–љ–µ–µ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –і–µ–њ—А–µ—Б—Б–Є–≤–љ–Њ–µ –њ–Њ–≤–µ–і–µ–љ–Є–µ –Љ–Њ–ґ–љ–Њ –Њ–±–ї–µ–≥—З–Є—В—М —Б –њ–Њ–Љ–Њ—Й—М—О –њ—А–Њ–±–Є–Њ—В–Є–Ї–Њ–≤, —Б–Њ–і–µ—А–ґ–∞—Й–Є—Е —И—В–∞–Љ–Љ—Л Bifidobacterium, –Ј–∞ —Б—З–µ—В –≤–ї–Є—П–љ–Є—П –љ–∞ —Б–Є–љ—В–µ–Ј –і–Њ—Д–∞–Љ–Є–љ–∞ –Є —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ [63, 64].
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —Б–Њ—Б—В–∞–≤–∞ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Л—Е —Д–µ–љ–Њ—В–Є–њ–Њ–≤ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–і–≥—А—Г–њ–њ—Л 1 –њ–Њ–≤—Л—И–µ–љ–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–Њ–≤ Bacteroides (—А=0,047) –Є Escherichia / Shigella —Б–µ–Љ–µ–є—Б—В–≤–∞ Enterobacteriaceae (—А=0,021), –Њ–і–љ–∞–Ї–Њ —Б–љ–Є–ґ–µ–љ–∞ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В—М –±—Г—В–Є—А–∞—В–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –±–∞–Ї—В–µ—А–Є–є —Б–µ–Љ–µ–є—Б—В–≤ Erysipelatoclostridiaceae (—А=0,003) –Є Ruminococcaceae (—А=0,038). –Я—А–Є —Н—В–Њ–Љ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–µ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–Њ–≤ Escherichia / Shigella –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –Ј–Њ–љ—Г–ї–Є–љ–∞ –≤ –Ї–∞–ї–µ (rs=0,502, —А=0,005; rs=0,627, p<0,001 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ).
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–і–≥—А—Г–њ–њ—Л 2 –≤—Л—П–≤–ї–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–Њ–≤ Bifidobacterium (—А=0,019) –Є Bacteroides (—А=0,034) –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ вАФ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–Њ–≤ Alistipes (—А=0,004) –Є Methanobrevibacter (—А=0,001). –Я—А–Є —Н—В–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–µ —З–Є—Б–ї–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Bifidobacterium –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –±–Њ–ї–Є (rs=-0,443, —А=0,007), —Б –±–∞–ї–ї–∞–Љ–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –і–µ–њ—А–µ—Б—Б–Є–Є –њ–Њ —И–Ї–∞–ї–µ HADS (rs=-0,579, —А=0,002) –Є –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –і–Њ—Д–∞–Љ–Є–љ–∞ (rs=0,633, p<0,001), –∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Alistipes вАФ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Ј–Њ–љ—Г–ї–Є–љ–∞ –≤ –Ї–∞–ї–µ (rs=0,436, —А=0,004).
–£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–і–≥—А—Г–њ–њ—Л 3 –њ–Њ–≤—Л—И–µ–љ–Њ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Ruminococcus torques group (—А=0,021) –љ–∞ —Д–Њ–љ–µ –Ј–љ–∞—З–Є–Љ–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П —З–Є—Б–ї–∞ –±—Г—В–Є—А–∞—В–њ—А–Њ–і—Г—Ж–Є—А—Г—О—Й–Є—Е –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–Њ–≤ Lactobacillus (—А=0,038), Erysipelatoclostridium (—А=0,006) –Є —Б–µ–Љ–µ–є—Б—В–≤–∞ Ruminococcaceae (—А=0,016). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–і–≥—А—Г–њ–њ—Л 3 –Њ—В–Љ–µ—З–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Methanobrevibacter (—А=0,010). –Я—А–Є —Н—В–Њ–Љ –Ї–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–∞–љ–љ–Њ–є –њ–Њ–і–≥—А—Г–њ–њ—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–∞—Б—М –љ–Є–Ј–Ї–Є–Љ —Б–Є–љ—В–µ–Ј–Њ–Љ –±—Г—В–Є—А–∞—В–∞ (—А=0,002). –Я–Њ–≤—Л—И–µ–љ–Є–µ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Ruminococcus torques group –≤ –њ–Њ–і–≥—А—Г–њ–њ–µ 3 –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –±–Њ–ї–Є (rs=0,413, —А=0,005), –і–Є–∞—А–µ–Є (rs=0,369, —А=0,025), —В—П–ґ–µ—Б—В—М—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (rs=0,572, —А=0,001), —Г—А–Њ–≤–љ–µ–Љ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є (rs=0,461, —А=0,004) –Є –Ј–Њ–љ—Г–ї–Є–љ–∞ –≤ –Ї–∞–ї–µ (rs=0,519, —А=0,003). –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Lactobacillus –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ —Б –≤—Л—Б–Њ–Ї–Є–Љ–Є –±–∞–ї–ї–∞–Љ–Є —В—А–µ–≤–Њ–≥–Є –њ–Њ —И–Ї–∞–ї–µ HADS (rs=-0,384, —А=0,031), –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –≤ —Г—В—А–µ–љ–љ–µ–є –њ–Њ—А—Ж–Є–Є —Б–ї—О–љ—Л (rs=-0,401, —А=0,018), –∞ —В–∞–Ї–ґ–µ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–ї–Њ—Б—М —Б —В—П–≥–Њ–є –Ї —Б–Њ–ї–µ–љ–Њ–є –њ–Є—Й–µ (ѕЗ2=13,68, p=0,021).
–Ь–Є–Ї—А–Њ–±–Є–Њ—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–і–≥—А—Г–њ–њ—Л 4 –Њ–Ї–∞–Ј–∞–ї–∞—Б—М —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–Њ–є —Б —В–∞–Ї–Њ–≤–Њ–є —Г –ї–Є—Ж –≥—А—Г–њ–њ—Л –Ї–Њ–љ—В—А–Њ–ї—П, –Њ—В–Љ–µ—З–µ–љ–∞ –ї–Є—И—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Б–љ–Є–ґ–µ–љ–Є—О —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –±–∞–Ї—В–µ—А–Є–є —А–Њ–і–∞ Bifidobacterium.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ъ–Є—И–µ—З–љ–∞—П –Љ–Є–Ї—А–Њ–±–Є–Њ—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –°–†–Ъ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –Ј–і–Њ—А–Њ–≤—Л–Љ–Є –ї–Є—Ж–∞–Љ–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –±–Њ–ї—М—И–Є–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –≤–Є–і–Њ–≤ –±–∞–Ї—В–µ—А–Є–є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –љ–Є–Ј–Ї–Њ–є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –Є –љ–µ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –∞–і–∞–њ—В–Є—А–Њ–≤–∞—В—М—Б—П –Ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О —Д–∞–Ї—В–Њ—А–Њ–≤ –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Б—А–µ–і—Л, –љ–∞—Е–Њ–і–Є—В—Б—П –≤ —В–µ—Б–љ–Њ–є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є —Б –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –њ–Є—В–∞–љ–Є—П, —Г—А–Њ–≤–љ–µ–Љ —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є, –∞ —В–∞–Ї–ґ–µ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж –њ–Њ —В–∞–Ї—Б–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г —Б–Њ—Б—В–∞–≤—Г –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤–∞—А–Є–∞–љ—В–∞ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П –Є —Д–µ–љ–Њ—В–Є–њ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –љ–∞—И–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В —Д–∞–Ї—В —В–Њ–≥–Њ, —З—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–∞ –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –Ј–≤–µ–љ–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –°–†–Ъ –Є —З—В–Њ –Љ–Њ–і—Г–ї—П—Ж–Є—П –Ї–Є—И–µ—З–љ–Њ–є –Љ–Є–Ї—А–Њ–±–Є–Њ—В—Л –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –і–Є–µ—В—Л, –≤—Л—Б–Њ–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є) –Є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Д–µ–љ–Њ—В–Є–њ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Љ–Њ–ґ–µ—В —Б—В–∞—В—М –Љ–Є—И–µ–љ—М—О ¬Ђ—В–∞—А–≥–µ—В–љ–Њ–є¬ї —В–µ—А–∞–њ–Є–Є –њ—А–Њ–±–Є–Њ—В–Є—З–µ—Б–Ї–Є–Љ–Є —И—В–∞–Љ–Љ–∞–Љ–Є.












