–Т–≤–µ–і–µ–љ–Є–µ
–°–Њ–≥–ї–∞—Б–љ–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—О –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –њ–Њ–і –≥–∞—Б—В—А–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ–Њ–є —А–µ—Д–ї—О–Ї—Б–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О (–У–≠–†–С) –њ–Њ–љ–Є–Љ–∞—О—В —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–µ —А–µ—Ж–Є–і–Є–≤–Є—А—Г—О—Й–µ–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ, –≤ –Њ—Б–љ–Њ–≤–µ —А–∞–Ј–≤–Є—В–Є—П –Ї–Њ—В–Њ—А–Њ–≥–Њ –ї–µ–ґ–Є—В –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ—В–Њ—А–љ–Њ-—Н–≤–∞–Ї—Г–∞—В–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ј–∞–±—А–Њ—Б—Г —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –ґ–µ–ї—Г–і–Ї–∞ –Є/–Є–ї–Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є –≤ –њ–Є—Й–µ–≤–Њ–і —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≤–њ–ї–Њ—В—М –і–Њ —Н—А–Њ–Ј–Є–≤–љ–Њ-—П–Ј–≤–µ–љ–љ–Њ–≥–Њ —Н–Ј–Њ—Д–∞–≥–Є—В–∞ (—А–µ—Д–ї—О–Ї—Б-—Н–Ј–Њ—Д–∞–≥–Є—В–∞) –Є —Ж–Є–ї–Є–љ–і—А–Њ–Ї–ї–µ—В–Њ—З–љ–Њ–є –Љ–µ—В–∞–њ–ї–∞–Ј–Є–Є [1].
–Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–Є–љ—П—В–Њ –≤—Л–і–µ–ї—П—В—М –љ–µ—Н—А–Њ–Ј–Є–≤–љ—Г—О —А–µ—Д–ї—О–Ї—Б–љ—Г—О –±–Њ–ї–µ–Ј–љ—М (–Э–≠–†–С), –Ї–Њ—В–Њ—А–∞—П –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤, –Є —Н—А–Њ–Ј–Є–≤–љ—Л–є —Н–Ј–Њ—Д–∞–≥–Є—В [1]. –Я—А–Є —Н—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –і–Є–∞–≥–љ–Њ–Ј –Э–≠–†–С –њ—А–∞–≤–Њ–Љ–Њ—З–µ–љ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –ґ–∞–ї–Њ–±, –≤—Л–Ј–≤–∞–љ–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —А–µ—Д–ї—О–Ї—Б–Њ–Љ, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ї–∞—В–∞—А–∞–ї—М–љ–Њ–≥–Њ —Н–Ј–Њ—Д–∞–≥–Є—В–∞ –Є–ї–Є –±–µ–Ј –≤–Є–і–Є–Љ—Л—Е —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Б–ї–Є–Ј–Є—Б—В–Њ–ЄћЖ –Њ–±–Њ–ї–Њ—З–Ї–Є –њ–Є—Й–µ–≤–Њ–і–∞, –∞ —В–∞–Ї–ґ–µ –љ–µ –њ—А–Є–љ–Є–Љ–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В—Л –Є–Ј –≥—А—Г–њ–њ—Л –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –њ—А–Њ—В–Њ–љ–љ–Њ–є –њ–Њ–Љ–њ—Л –Є–ї–Є –Э2-–≥–Є—Б—В–∞–Љ–Є–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤. –Ю—В–і–µ–ї—М–љ—Г—О –њ—А–Њ–±–ї–µ–Љ—Г –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —В–Њ—В —Д–∞–Ї—В, —З—В–Њ –њ—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –Ї–Њ–љ—В—А–Њ–ї–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –У–≠–†–С –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–∞ —Б –њ–Њ–≤—Л—И–µ–љ–љ—Л–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є вАФ –њ–Є—Й–µ–≤–Њ–і–∞ –С–∞—А—А–µ—В—В–∞ –Є –∞–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ—Л –њ–Є—Й–µ–≤–Њ–і–∞.
–≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ—Б–ї–µ–і–љ–Є—Е –ї–µ—В —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –љ–µ—Г–Ї–ї–Њ–љ–љ–Њ–є —В–µ–љ–і–µ–љ—Ж–Є–Є –Ї —А–Њ—Б—В—Г —З–∞—Б—В–Њ—В—Л –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –У–≠–†–С —Б—А–µ–і–Є –≤–Ј—А–Њ—Б–ї–Њ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–∞—А—М–Є—А—Г–µ—В –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —А–µ–≥–Є–Њ–љ–∞ –Є –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 13% [2вАУ4]. –Т –†–Њ—Б—Б–Є–Є —З–∞—Б—В–Њ—В–∞ –≤—Л—П–≤–ї–µ–љ–Є—П –У–≠–†–С, –њ–Њ –і–∞–љ–љ—Л–Љ –Њ—В–і–µ–ї—М–љ—Л—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П –≤ 11,3вАУ23,6% [5, 6], –љ–∞ –і–Њ–ї—О –њ–Є—Й–µ–≤–Њ–і–∞ –С–∞—А—А–µ—В—В–∞ –њ—А–Є—Е–Њ–і–Є—В—Б—П –і–Њ 8% —Б–ї—Г—З–∞–µ–≤ –У–≠–†–С –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є [7, 8].
–§–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞ –У–≠–†–С –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Є—Е —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є
–®–Є—А–Њ–Ї–∞—П –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В—М –У–≠–†–С –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б–≤—П–Ј–∞–љ–∞ —Б –Љ—Г–ї—М—В–Є—Д–∞–Ї—В–Њ—А–љ–Њ–є –њ—А–Є—А–Њ–і–Њ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Т—Б–µ —Д–∞–Ї—В–Њ—А—Л —А–Є—Б–Ї–∞, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є–µ —А–∞–Ј–≤–Є—В–Є—О –У–≠–†–С, –Љ–Њ–ґ–љ–Њ —А–∞–Ј–і–µ–ї—П—В—М –љ–∞ –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–µ –Є –љ–µ–Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–µ. –Ъ –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –Ї—Г—А–µ–љ–Є–µ, –Є–Ј–±—Л—В–Њ—З–љ–∞—П –Љ–∞—Б—Б–∞ —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є–µ, –Ї –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–Љ вАФ –њ—А–Є–µ–Љ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—Й–Є—Е —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—О –љ–Є–ґ–љ–µ–≥–Њ –њ–Є—Й–µ–≤–Њ–і–љ–Њ–≥–Њ —Б—Д–Є–љ–Ї—В–µ—А–∞ (–Э–Я–°), –љ–∞–њ—А–Є–Љ–µ—А —Е–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–Њ–≤, –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–≤ –Ї–∞–ї—М—Ж–Є—П, –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, ќ≤-–∞–і—А–µ–љ–Њ–±–ї–Њ–Ї–∞—В–Њ—А–Њ–≤, –Љ–Є–Њ—В—А–Њ–њ–љ—Л—Е —Б–њ–∞–Ј–Љ–Њ–ї–Є—В–Є–Ї–Њ–≤, –љ–Є—В—А–∞—В–Њ–≤, –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤, —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞, –±–Є—Б—Д–Њ—Б—Д–Њ–љ–∞—В–Њ–≤ –Є –і—А. [9]. –Я—А–Є –љ–∞–ї–Є—З–Є–Є –У–≠–†–С –Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ—В–Љ–µ–љ—Л —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М –≤–Њ–њ—А–Њ—Б –Њ–± –Є–Ј–Љ–µ–љ–µ–љ–Є–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ—Л–Љ –≤—Л–±–Њ—А–Њ–Љ —В–µ—Е —Б—А–µ–і—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ –≤–ї–Є—П—О—В –љ–∞ —А–µ–ї–∞–Ї—Б–∞—Ж–Є—О –Э–Я–°, –Љ–Њ—В–Њ—А–Є–Ї—Г –њ–Є—Й–µ–≤–Њ–і–∞ –Є–ї–Є –Ј–∞—В—А—Г–і–љ—П—О—Й–Є–µ –µ–≥–Њ –Ї–ї–Є—А–µ–љ—Б.
–Ъ –љ–µ–Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–∞–Љ —А–Є—Б–Ї–∞ –У–≠–†–С –Њ—В–љ–Њ—Б—П—В—Б—П –Љ—Г–ґ—Б–Ї–Њ–є –њ–Њ–ї, –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 50 –ї–µ—В –Є –≥—А—Л–ґ–∞ –њ–Є—Й–µ–≤–Њ–і–љ–Њ–≥–Њ –Њ—В–≤–µ—А—Б—В–Є—П –і–Є–∞—Д—А–∞–≥–Љ—Л (–У–Я–Ю–Ф). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М —П–≤–ї—П–µ—В—Б—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ, –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ –Ї —А–∞–Ј–≤–Є—В–Є—О –У–≠–†–С.
–Я–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ L.H. Eusebi et al. [2], –Њ–±—К–µ–і–Є–љ–Є–≤—И–µ–≥–Њ –і–∞–љ–љ—Л–µ 102 –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (–±–Њ–ї–µ–µ 460 —В—Л—Б. —Г—З–∞—Б—В–љ–Є–Ї–Њ–≤), —Д–∞–Ї—В–Њ—А–∞–Љ–Є —А–Є—Б–Ї–∞ –У–≠–†–С —П–≤–ї—П—О—В—Б—П –≤–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 50 –ї–µ—В (–Њ—В–љ–Њ—И–µ–љ–Є–µ —И–∞–љ—Б–Њ–≤ (–Ю–®) 1,32, 95% –Ф–Ш 1,12вАУ1,54), –Ї—Г—А–µ–љ–Є–µ (–Ю–® 1,26, 95% –Ф–Ш 1,04вАУ1,52), –њ—А–Є–µ–Љ –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л—Е –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є–ї–Є –∞—Б–њ–Є—А–Є–љ–∞ (–Ю–® 1,44, 95% –Ф–Ш 1,10вАУ1,88) –Є –љ–∞–ї–Є—З–Є–µ –Њ–ґ–Є—А–µ–љ–Є—П (–Ю–® 1,73, 95% –Ф–Ш 1,46вАУ2,06).
–Ш–љ—В–µ—А–µ—Б–љ–Њ, —З—В–Њ –≤ –°–µ–≤–µ—А–љ–Њ–є –Р–Љ–µ—А–Є–Ї–µ –Є –Х–≤—А–Њ–њ–µ –љ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –њ–Њ–ї–Њ–Љ –Є —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –У–≠–†–С, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –Ѓ–ґ–љ–Њ–є –Р–Љ–µ—А–Є–Ї–µ –Є –љ–∞ –С–ї–Є–ґ–љ–µ–Љ –Т–Њ—Б—В–Њ–Ї–µ –ґ–µ–љ—Й–Є–љ—Л –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 40% —З–∞—Й–µ —Б–Њ–Њ–±—Й–∞—О—В –Њ —Б–Є–Љ–њ—В–Њ–Љ–∞—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [2]. –Ю–і–љ–∞–Ї–Њ —Г –Љ—Г–ґ—З–Є–љ –≤ 1,57 (95% –Ф–Ш 1,40вАУ1,76) —А–∞–Ј–∞ —З–∞—Й–µ –≤—Л—П–≤–ї—П–µ—В—Б—П —Н—А–Њ–Ј–Є–≤–љ—Л–є —Н–Ј–Њ—Д–∞–≥–Є—В, –њ–Є—Й–µ–≤–Њ–і –С–∞—А—А–µ—В—В–∞ –Є —А–∞–Ј–≤–Є–≤–∞—О—Й–∞—П—Б—П –љ–∞ –µ–≥–Њ —Д–Њ–љ–µ –∞–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ–∞ –њ–Є—Й–µ–≤–Њ–і–∞ [10].
–Т–Њ–Ј—А–∞—Б—В —Б—В–∞—А—И–µ 50 –ї–µ—В —В–µ—Б–љ–Њ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ –љ–µ —В–Њ–ї—М–Ї–Њ —Б –љ–∞–ї–Є—З–Є–µ–Љ –У–≠–†–С, –љ–Њ –Є —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—Л—Б–Њ–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–є –њ–Њ –њ–Њ–≤–Њ–і—Г —Н—А–Њ–Ј–Є–≤–љ–Њ–≥–Њ —Н–Ј–Њ—Д–∞–≥–Є—В–∞ –Є —Б—В—А–Є–Ї—В—Г—А –њ–Є—Й–µ–≤–Њ–і–∞ [2, 11]. –Я—А–Є–Љ–µ—З–∞—В–µ–ї—М–љ–Њ, —З—В–Њ –≤ –Ї–Њ–љ—Ж–µ 1980-—Е –≥–Њ–і–Њ–≤ –Ј—А–µ–ї—Л–є –Є –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В –љ–µ –±—Л–ї–Є —Б–≤—П–Ј–∞–љ—Л —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —Н—А–Њ–Ј–Є–≤–љ–Њ–≥–Њ —Н–Ј–Њ—Д–∞–≥–Є—В–∞ [12]. –Я–Њ–і–Њ–±–љ—Л–є —Д–µ–љ–Њ–Љ–µ–љ, –њ–Њ –Љ–љ–µ–љ–Є—О —Н–Ї—Б–њ–µ—А—В–Њ–≤, –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—К—П—Б–љ–µ–љ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–Љ –Ї–Њ–≥–Њ—А—В–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–Љ –ї—О–і–Є, —А–Њ–ґ–і–µ–љ–љ—Л–µ –≤ –±–Њ–ї–µ–µ —А–∞–љ–љ–µ–Љ –њ–Њ–Ї–Њ–ї–µ–љ–Є–Є, –Љ–µ–љ–µ–µ —Б–Ї–ї–Њ–љ–љ—Л –Ї —А–∞–Ј–≤–Є—В–Є—О –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —З–µ–Љ –Є—Е –њ–Њ—В–Њ–Љ–Ї–Є, –Ї–Њ–≥–і–∞ –Њ–љ–Є –і–Њ—Б—В–Є–≥–∞—О—В —В–Њ–≥–Њ –ґ–µ –≤–Њ–Ј—А–∞—Б—В–∞ [13]. –Ґ–∞–Ї–Њ–є –Ї–Њ–≥–Њ—А—В–љ—Л–є —Н—Д—Д–µ–Ї—В, —Б–Ї–Њ—А–µ–µ –≤—Б–µ–≥–Њ, —Б–≤—П–Ј–∞–љ —Б –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤ –Њ–Ї—А—Г–ґ–∞—О—Й–µ–є —Б—А–µ–і—Л, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є —З–Є—Б–ї–∞ –ї–Є—Ж —Б –Є–Ј–±—Л—В–Њ—З–љ–Њ–є –Љ–∞—Б—Б–Њ–є —В–µ–ї–∞ –Є –Њ–ґ–Є—А–µ–љ–Є–µ–Љ.
–Ю–ґ–Є—А–µ–љ–Є–µ —П–≤–ї—П–µ—В—Б—П –Њ—Б–љ–Њ–≤–љ—Л–Љ –Љ–Њ–і–Є—Д–Є—Ж–Є—А—Г–µ–Љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ —А–Є—Б–Ї–∞ –У–≠–†–С [2]. –Я—А–Є —Н—В–Њ–Љ –≤–∞–ґ–љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Є –Њ–ґ–Є—А–µ–љ–Є–Є –Є–Љ–µ–µ—В –љ–µ —Б–∞–Љ —Д–∞–Ї—В –љ–∞–ї–Є—З–Є—П –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ, –∞ —Е–∞—А–∞–Ї—В–µ—А —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –ґ–Є—А–Њ–≤–Њ–є –Ї–ї–µ—В—З–∞—В–Ї–Є. –Р–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ –Ї–∞–ґ–µ—В—Б—П –±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л–Љ, —З–µ–Љ –Њ–ґ–Є—А–µ–љ–Є–µ –≤ —Ж–µ–ї–Њ–Љ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б–Є–Љ–њ—В–Њ–Љ—Л –У–≠–†–С –Є —Н—А–Њ–Ј–Є–≤–љ—Л–є —Н–Ј–Њ—Д–∞–≥–Є—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ —Б–≤—П–Ј–∞–љ—Л —Б –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Є–љ–і–µ–Ї—Б–∞ –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ) [14]. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ S. Singh et al. [15], –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–µ –Њ–ґ–Є—А–µ–љ–Є–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї —Н—А–Њ–Ј–Є–≤–љ–Њ–≥–Њ —Н–Ј–Њ—Д–∞–≥–Є—В–∞ (–Ю–® 1,87, 95% –Ф–Ш 1,51вАУ2,31), –њ–Є—Й–µ–≤–Њ–і–∞ –С–∞—А—А–µ—В—В–∞ (–Ю–® 1,98, 95% –Ф–Ш 1,52вАУ2,31) –Є –∞–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ—Л –њ–Є—Й–µ–≤–Њ–і–∞ (–Ю–® 2,51, 95% –Ф–Ш 1,54вАУ4,06).
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л, –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–∞—П –ґ–Є—А–Њ–≤–∞—П —В–Ї–∞–љ—М —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Д–ї—О–Ї—Б–Њ–≤, –љ–µ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В—Б—П —В–Њ–ї—М–Ї–Њ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ–Љ (–њ–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–±—А—О—И–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –У–Я–Ю–Ф), –љ–Њ —В–∞–Ї–ґ–µ –≤–Ї–ї—О—З–∞—О—В –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Б–Є–љ—В–µ–Ј –∞–і–Є–њ–Њ—Ж–Є—В–∞–Љ–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤ —Б –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–Њ–Љ, —З—В–Њ –≤ –Ї–Њ–љ–µ—З–љ–Њ–Љ –Є—В–Њ–≥–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –±–µ–ї–Ї–Њ–≤ –њ–ї–Њ—В–љ—Л—Е –Ї–Њ–љ—В–∞–Ї—В–Њ–≤ –≤ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–µ –њ–Є—Й–µ–≤–Њ–і–∞ –Є —Б–љ–Є–ґ–µ–љ–Є—О –µ–µ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—О –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї —А–µ—Д–ї—О–Ї—В–∞—В–∞ [16]. –Э–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤—Л—П–≤–Є–ї–Є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О –Ї–Њ—А—А–µ–ї—П—Ж–Є—О –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ –∞–і–Є–њ–Њ–Ї–Є–љ–∞ –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є –ї–µ–њ—В–Є–љ–∞ –Є —В—П–ґ–µ—Б—В—М—О —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –У–≠–†–С, —Н—А–Њ–Ј–Є–≤–љ—Л–Љ —Н–Ј–Њ—Д–∞–≥–Є—В–Њ–Љ [16, 17]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ—Л–Љ –Њ–ґ–Є—А–µ–љ–Є–µ–Љ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Ш–Ь–Ґ –Њ–њ–Є—Б–∞–љ–Њ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –≤ –Њ–±–ї–∞—Б—В–Є –≥–∞—Б—В—А–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ–Њ–≥–Њ –њ–µ—А–µ—Е–Њ–і–∞ –њ–ї–Њ—Й–∞–і–Є –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –ґ–Є—А–∞, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–µ–≥–Њ –њ–∞—А–∞–Ї—А–Є–љ–љ—Л–є —Н—Д—Д–µ–Ї—В [18].
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л —В–∞–Ї–ґ–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ—Л–µ —Б–≤—П–Ј–Є —Г—А–Њ–≤–љ—П –ї–µ–њ—В–Є–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Б –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є –Ї–Є—Б–ї–Њ—В–љ–Њ—Б—В–Є –≤ –Ї–∞—А–і–Є–∞–ї—М–љ–Њ–Љ –Њ—В–і–µ–ї–µ –Є —В–µ–ї–µ –ґ–µ–ї—Г–і–Ї–∞: —А–∞–Ј–±—А–Њ—Б–Њ–Љ, –Є–љ–і–µ–Ї—Б–Њ–Љ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ—Б—В–Є –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ —А–Э, —Б –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ –≤—А–µ–Љ–µ–љ–Є —А–Э>8 –≤ –њ–Є—Й–µ–≤–Њ–і–µ [19]. –Ю—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –љ–∞–ї–Є—З–Є–µ –Њ–ґ–Є—А–µ–љ–Є—П —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –љ–µ–Ї–Є—Б–ї–Њ—В–љ—Л—Е —А–µ—Д–ї—О–Ї—Б–Њ–≤, –Є —Н—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б –љ–∞–ї–Є—З–Є–µ–Љ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≥–µ–њ–∞—В–Њ–±–Є–ї–Є–∞—А–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –љ–∞—А—Г—И–µ–љ–Є–є [20, 21]. –Т —Ж–µ–ї–Њ–Љ —А—П–і–µ —А–∞–±–Њ—В —Б–Њ–Њ–±—Й–∞–µ—В—Б—П –Њ —Б–≤—П–Ј–Є –У–≠–†–С —Б –љ–µ–∞–ї–Ї–Њ–≥–Њ–ї—М–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є –±–Њ–ї–µ–Ј–љ—М—О –њ–µ—З–µ–љ–Є (–Э–Р–Ц–С–Я) –Є –ґ–µ–ї—З–љ–Њ–Ї–∞–Љ–µ–љ–љ–Њ–є –±–Њ–ї–µ–Ј–љ—М—О (–Ц–Ъ–С) [22вАУ25]. –•–Њ—А–Њ—И–Њ –Є–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Э–Р–Ц–С–Я —Г—Е—Г–і—И–µ–љ–Є–µ —Б–≤–Њ–є—Б—В–≤ –ґ–µ–ї—З–Є –Ј–∞ —Б—З–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ –љ–µ–є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –Љ—Г—Ж–Є–љ–∞ –Є –ґ–µ–ї—З–љ—Л—Е –Ї–Є—Б–ї–Њ—В, –∞ —В–∞–Ї–ґ–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ—В–Њ—А–Є–Ї–Є –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —А–Є—Б–Ї—Г —А–∞–Ј–≤–Є—В–Є—П –і—Г–Њ–і–µ–љ–Њ–≥–∞—Б—В—А–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞ (–Ф–У–≠–†) [23, 26]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ц–Ъ–С, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –≤ –њ–µ—А–Є–Њ–і –њ–Њ—Б–ї–µ —Е–Њ–ї–µ—Ж–Є—Б—В—Н–Ї—В–Њ–Љ–Є–Є, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–љ–∞—П —Б–µ–Ї—А–µ—Ж–Є—П —Е–Њ–ї–µ—Ж–Є—Б—В–Њ–Ї–Є–љ–Є–љ–∞ –≤ –Њ—В–≤–µ—В –љ–∞ –њ—А–Є–µ–Љ –њ–Є—Й–Є, —З—В–Њ —П–≤–ї—П–µ—В—Б—П —Д–∞–Ї—В–Њ—А–Њ–Љ, —Г—З–∞—Б—В–≤—Г—О—Й–Є–Љ –≤ —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є–Є –Э–Я–° –Є, –≤–µ—А–Њ—П—В–љ–Њ, –њ–Њ–≤—Л—И–µ–љ–љ–Њ–є —З–∞—Б—В–Њ—В–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞ [27]. –°–Њ–Њ–±—Й–∞–µ—В—Б—П, —З—В–Њ —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А —А–µ—Д–ї—О–Ї—В–∞—В–∞ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г 1/4 –±–Њ–ї—М–љ—Л—Е —Б –У–≠–†–С [28].
–Х—Й–µ –Њ–і–љ–Є–Љ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –У–≠–†–С —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Њ–ґ–Є—А–µ–љ–Є–µ–Љ —П–≤–ї—П—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П –і–Є–µ—В—Л. –І—А–µ–Ј–Љ–µ—А–љ–Њ–µ –њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –ґ–Є—А–∞ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Б–µ–Ї—А–µ—Ж–Є–Є —В–∞–Ї–Є—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –Ї–∞–Ї —Б–µ–Ї—А–µ—В–Є–љ –Є —Е–Њ–ї–µ—Ж–Є—Б—В–Њ–Ї–Є–љ–Є–љ, –Ї–Њ—В–Њ—А—Л–µ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, —Б—В–Є–Љ—Г–ї–Є—А—Г—О—В —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є–µ –Э–Я–° [29]. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ M. Fox et al. [30], –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Њ –њ–Њ–≤—Л—И–µ–љ–љ—Г—О —З–∞—Б—В–Њ—В—Г –Є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Д–ї—О–Ї—Б–Њ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–і–µ—А–ґ–Є–≤–∞—О—Й–Є—Е—Б—П –і–Є–µ—В—Л —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –ґ–Є—А–Њ–≤.
–Ь–µ—Е–∞–љ–Є–Ј–Љ—Л —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞ –њ—А–Є –У–≠–†–С
–Ъ–ї—О—З–µ–≤—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –У–≠–†–С —П–≤–ї—П–µ—В—Б—П —Б—В–Њ–є–Ї–Њ–µ –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ—В–Њ—А–Є–Ї–Є –њ–Є—Й–µ–≤–Њ–і–∞ –Є/–Є–ї–Є –ґ–µ–ї—Г–і–Ї–∞ —Б —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Д–ї—О–Ї—Б–Њ–≤ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –Є–Ј –љ–Є–ґ–µ–ї–µ–ґ–∞—Й–Є—Е –Њ—В–і–µ–ї–Њ–≤ –≤ –і–Є—Б—В–∞–ї—М–љ—Л–є –Њ—В–і–µ–ї –њ–Є—Й–µ–≤–Њ–і–∞ [31].
–Ъ –Њ—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞ –Њ—В–љ–Њ—Б—П—В—Б—П:
-
–Э–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –∞–љ—В–Є—А–µ—Д–ї—О–Ї—Б–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Б–љ–Є–ґ–µ–љ–Є—П –і–∞–≤–ї–µ–љ–Є—П –≤ –Э–Я–°, —Г–≤–µ–ї–Є—З–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л —Н–њ–Є–Ј–Њ–і–Њ–≤ –µ–≥–Њ —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є —А–µ–ї–∞–Ї—Б–∞—Ж–Є–Є, –љ–∞—А—Г—И–µ–љ–Є—П –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А—Л –Э–Я–° –њ—А–Є –У–Я–Ю–Ф [32, 33].
-
–Я—А–Є –У–Я–Ю–Ф –Э–Я–° –њ–µ—А–µ–Љ–µ—Й–∞–µ—В—Б—П –Є–Ј –Ј–Њ–љ—Л –≤—Л—Б–Њ–Ї–Њ–≥–Њ –≤–љ—Г—В—А–Є–±—А—О—И–љ–Њ–≥–Њ –≤ –Ј–Њ–љ—Г –љ–Є–Ј–Ї–Њ–≥–Њ –≤–љ—Г—В—А–Є–≥—А—Г–і–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —А–∞–Ј–Њ–±—Й–µ–љ–Є–µ –≤–љ—Г—В—А–µ–љ–љ–µ–≥–Њ –Є –љ–∞—А—Г–ґ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–≤ –∞–љ—В–Є—А–µ—Д–ї—О–Ї—Б–љ–Њ–≥–Њ –±–∞—А—М–µ—А–∞, —З—В–Њ –љ–∞—А—Г—И–∞–µ—В –µ–≥–Њ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–µ. –Я—А–Є –У–Я–Ю–Ф —Б—В—А–∞–і–∞–µ—В –њ–Є—Й–µ–≤–Њ–і–љ—Л–є –Ї–ї–Є—А–µ–љ—Б, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —З–∞—Б—В–Њ—В–∞ —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л—Е —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є–є –Э–Я–°, –њ—А–Њ–Є—Б—Е–Њ–і–Є—В —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ ¬Ђ–Ї–Є—Б–ї–Њ—В–љ–Њ–≥–Њ –Ї–∞—А–Љ–∞–љ–∞¬ї [34].
-
–£—Е—Г–і—И–µ–љ–Є–µ –Ї–ї–Є—А–µ–љ—Б–∞ –њ–Є—Й–µ–≤–Њ–і–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Њ—Б–ї–∞–±–ї–µ–љ–Є—П –µ–≥–Њ –њ–µ—А–Є—Б—В–∞–ї—М—В–Є–Ї–Є, —Г–Љ–µ–љ—М—И–µ–љ–Є—П —Б–µ–Ї—А–µ—Ж–Є–Є —Б–ї—О–љ—Л, –±–Є–Ї–∞—А–±–Њ–љ–∞—В–Њ–≤ –Є –Љ—Г—Ж–Є–љ–∞ –њ–Є—Й–µ–≤–Њ–і–љ–Њ–є —Б–ї–Є–Ј–Є.
-
–Э–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ—В–Њ—А–љ–Њ-—Н–≤–∞–Ї—Г–∞—В–Њ—А–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ґ–µ–ї—Г–і–Ї–∞, –Ї–Њ—В–Њ—А–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Г—Е—Г–і—И–µ–љ–Є–µ–Љ –µ–≥–Њ –∞–Ї–Ї–Њ–Љ–Њ–і–∞—Ж–Є–Є –Є –∞–љ—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є –і–Є—Б–Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є–µ–є, —Б–Њ–Ј–і–∞—О—Й–Є–Љ–Є —Г—Б–ї–Њ–≤–Є—П –і–ї—П –Ф–У–≠–†, –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤—Е–Њ–і—П—В –і–µ—В–µ—А–≥–µ–љ—В—Л (—В–Њ–Ї—Б–Є—З–љ—Л–µ –ґ–µ–ї—З–љ—Л–µ –Ї–Є—Б–ї–Њ—В—Л, –ї–Є–Ј–Њ–ї–µ—Ж–Є—В–Є–љ –Є —В—А–Є–њ—Б–Є–љ), –Њ—В—П–≥–Њ—Й–∞—О—Й–Є–µ —В–µ—З–µ–љ–Є–µ –У–≠–†–С –Є –њ–Њ–≤—Л—И–∞—О—Й–Є–µ —А–Є—Б–Ї —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П —Н—А–Њ–Ј–Є–≤–љ–Њ–≥–Њ —Н–Ј–Њ—Д–∞–≥–Є—В–∞ –Є –њ–Є—Й–µ–≤–Њ–і–∞ –С–∞—А—А–µ—В—В–∞ [35]. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ —Н–≤–∞–Ї—Г–∞—Ж–Є–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є—П —Д—Г–љ–і–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –ґ–µ–ї—Г–і–Ї–∞ –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–Њ —Б —Г—З–∞—Й–µ–љ–Є–µ–Љ —Н–њ–Є–Ј–Њ–і–Њ–≤ —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є —А–µ–ї–∞–Ї—Б–∞—Ж–Є–Є –Э–Я–°, —Б —Н—В–Є–Љ —Б–≤—П–Ј—Л–≤–∞—О—В –≤—Л—Б–Њ–Ї—Г—О —З–∞—Б—В–Њ—В—Г –њ–µ—А–µ–Ї—А–µ—Б—В–∞ –У–≠–†–С —Б —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –і–Є—Б–њ–µ–њ—Б–Є–µ–є (–§–Ф) [36].
-
–Э–∞–ї–Є—З–Є–µ —Д–µ–љ–Њ–Љ–µ–љ–∞ –≤–Є—Б—Ж–µ—А–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Г —З–∞—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–є –≤–љ–Њ—Б–Є—В —Б–≤–Њ–є –≤–Ї–ї–∞–і –≤ —А–∞–Ј–≤–Є—В–Є–µ –Љ–Њ—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, —З—В–Њ —В–∞–Ї–ґ–µ –Њ–±—К—П—Б–љ—П–µ—В –њ–µ—А–µ–Ї—А–µ—Б—В –У–≠–†–С —Б —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞–Љ–Є –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞.
–Я–Њ–і—Е–Њ–і—Л –Ї –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –У–≠–†–С
–Ф–Є–∞–≥–љ–Њ–Ј –У–≠–†–С —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–µ—В—Б—П –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є —Е–∞—А–∞–Ї—В–µ—А–љ—Л—Е –ґ–∞–ї–Њ–±, –і–∞–љ–љ—Л—Е –∞–љ–∞–Љ–љ–µ–Ј–∞ –Є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–µ —А–µ—Д–ї—О–Ї—Б-—Н–Ј–Њ—Д–∞–≥–Є—В–∞ –њ—А–Є —Н–љ–і–Њ—Б–Ї–Њ–њ–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є, –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞ –њ—А–Є —А–Э-–Љ–µ—В—А–Є–Є –Є —А–Э-–Є–Љ–њ–µ–і–∞–љ—Б–Њ–Љ–µ—В—А–Є–Є, –Љ–Њ—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –њ—А–Є –Љ–∞–љ–Њ–Љ–µ—В—А–Є–Є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–∞–Ј—А–µ—И–µ–љ–Є—П).
–Ґ–Є–њ–Є—З–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –У–≠–†–С —П–≤–ї—П—О—В—Б—П –Є–Ј–ґ–Њ–≥–∞ –Є —А–µ–≥—Г—А–≥–Є—В–∞—Ж–Є—П –Ї–Є—Б–ї—Л–Љ. –°—А–µ–і–Є –і—А—Г–≥–Є—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –Љ–Њ–≥—Г—В –≤—Б—В—А–µ—З–∞—В—М—Б—П –Њ–і–Є–љ–Њ—Д–∞–≥–Є—П (–±–Њ–ї—М –њ–Њ —Е–Њ–і—Г –њ–Є—Й–µ–≤–Њ–і–∞ –њ—А–Є –≥–ї–Њ—В–∞–љ–Є–Є) –Є —Н–Ј–Њ—Д–∞–≥–Њ–і–Є–љ–Є—П (–±–Њ–ї—М –њ–Њ —Е–Њ–і—Г –њ–Є—Й–µ–≤–Њ–і–∞ –±–µ–Ј —Б–≤—П–Ј–Є —Б –њ—А–Є–µ–Љ–Њ–Љ –њ–Є—Й–Є). –Я—А–Є —Г–Ї–∞–Ј–∞–љ–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–Љ –љ–∞ –љ–∞–ї–Є—З–Є–µ —Г –љ–µ–≥–Њ –Ј–∞—В—А—Г–і–љ–µ–љ–Є–є –њ—А–Є –≥–ї–Њ—В–∞–љ–Є–Є (–і–Є—Б—Д–∞–≥–Є—П) –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –±–µ–Ј–Њ—В–ї–∞–≥–∞—В–µ–ї—М–љ–Њ –љ–∞–њ—А–∞–≤–Є—В—М –њ–∞—Ж–Є–µ–љ—В–∞ –љ–∞ —А–µ–љ—В–≥–µ–љ–Њ—Б–Ї–Њ–њ–Є—О –њ–Є—Й–µ–≤–Њ–і–∞ —Б —Ж–µ–ї—М—О –Њ—Ж–µ–љ–Ї–Є –µ–≥–Њ –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П –≥—А—Г–±–Њ–є –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є (—Б—В–µ–љ–Њ–Ј, —Б—В—А–Є–Ї—В—Г—А–∞, –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–µ –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ) [1, 37]. –Ю—В–і–µ–ї—М–љ—Г—О –њ—А–Њ–±–ї–µ–Љ—Г –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –≤–љ–µ–њ–Є—Й–µ–≤–Њ–і–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –У–≠–†–С –Є–ї–Є —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –Љ–∞—Б–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (–Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П, –Њ—В–Њ—А–Є–љ–Њ–ї–∞—А–Є–љ–≥–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П, –њ—Г–ї—М–Љ–Њ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П, —Б—В–Њ–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П), –Ї–Њ—В–Њ—А—Л–µ –Ј–∞—В—А—Г–і–љ—П—О—В –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є —Г–≤–µ–ї–Є—З–Є–≤–∞—О—В –≤—А–µ–Љ—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –і–Є–∞–≥–љ–Њ–Ј–∞, –∞ —Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –Є –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є [1, 37вАУ39].
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –У–≠–†–С –њ—А–Є –њ–µ—А–≤–Є—З–љ–Њ–є –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ –і–Є–∞–≥–љ–Њ–Ј–∞ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –і–Њ–ї–ґ–љ—Л –±—Л—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ—Л –љ–∞ —Н–Ј–Њ—Д–∞–≥–Њ–≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–Њ—Б–Ї–Њ–њ–Є—О [1, 36]. –Я—А–Є —Н—В–Њ–Љ, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ы–Є–Њ–љ—Б–Ї–Њ–Љ—Г –Ї–Њ–љ—Б–µ–љ—Б—Г—Б—Г, —Г–±–µ–і–Є—В–µ–ї—М–љ—Л–Љ–Є –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞–Љ–Є –У–≠–†–С –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —Н–љ–і–Њ—Б–Ї–Њ–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –ї–Є—И—М –Њ–±–љ–∞—А—Г–ґ–µ–љ–Є–µ —Н–Ј–Њ—Д–∞–≥–Є—В–∞ –≤—Л—Б–Њ–Ї–Њ–є —Б—В–µ–њ–µ–љ–Є (—Б—В–µ–њ–µ–љ–Є C –Є–ї–Є D –њ–Њ –Ы–Њ—Б-–Р–љ–і–ґ–µ–ї–µ—Б—Б–Ї–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є), –і–ї–Є–љ–љ–Њ–≥–Њ —Б–µ–≥–Љ–µ–љ—В–∞ –њ–Є—Й–µ–≤–Њ–і–∞ –С–∞—А—А–µ—В—В–∞ –Є–ї–Є –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–є —Б—В—А–Є–Ї—В—Г—А—Л [40]. –Т –Ї–Њ–љ—Б–µ–љ—Б—Г—Б–µ –∞–Ї—Ж–µ–љ—В–Є—А—Г–µ—В—Б—П –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ–Љ, —З—В–Њ —Н—В–∞–ї–Њ–љ–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –У–≠–†–С —П–≤–ї—П—О—В—Б—П –Љ–µ—В–Њ–і—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—Й–Є–µ –љ–∞–ї–Є—З–Є–µ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞ (—В–∞–±–ї. 1), –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, pH-–Є–Љ–њ–µ–і–∞–љ—Б–Њ–Љ–µ—В—А–Є—П, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ј–∞—Д–Є–Ї—Б–Є—А–Њ–≤–∞—В—М —А–∞–Ј–ї–Є—З–љ—Л–µ —А–µ—Д–ї—О–Ї—Б—Л (–ґ–Є–і–Ї–Є–µ, –≥–∞–Ј–Њ–Њ–±—А–∞–Ј–љ—Л–µ –Є —Б–Љ–µ—И–∞–љ–љ—Л–µ), –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –Є—Е –Ї–Є—Б–ї–Њ—В–љ–Њ—Б—В–Є. –Ґ–∞–Ї–ґ–µ –і–ї—П –≤—Л—П–≤–ї–µ–љ–Є—П –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –њ–Є—Й–µ–≤–Њ–і–∞ –Ы–Є–Њ–љ—Б–Ї–Є–є –Ї–Њ–љ—Б–µ–љ—Б—Г—Б —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В –Њ—Ж–µ–љ–Є–≤–∞—В—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Љ–∞–љ–Њ–Љ–µ—В—А–Є–Є –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–∞–Ј—А–µ—И–µ–љ–Є—П —Б –њ—А–Њ–≤–Њ–Ї–∞—Ж–Є–Њ–љ–љ—Л–Љ —В–µ—Б—В–Њ–Љ (–њ—П—В—М –≥–ї–Њ—В–Ї–Њ–≤ –≤–Њ–і—Л –њ–Њ 2 –Љ–ї —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ <4 —Б) [40]. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –њ–µ—А–µ—Б–Љ–Њ—В—А –і–Є–∞–≥–љ–Њ–Ј–∞ —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ —Б–њ–µ–Ї—В—А–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е —В–µ—Б—В–Њ–≤, –Њ–њ–Є—Б–∞–љ–љ—Л—Е –≤—Л—И–µ, –љ–µ–Њ–±—Е–Њ–і–Є–Љ –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Њ—В–≤–µ—В–∞ –љ–∞ –њ—А–Њ–≤–Њ–і–Є–Љ—Г—О —В–µ—А–∞–њ–Є—О –Ш–Я–Я –≤ —В–µ—З–µ–љ–Є–µ 4вАУ8 –љ–µ–і. [1].
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –Ш–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є—П –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –У–≠–†–С [40] Table 1. Interpretation of oesophageal test results in the context of GERD [40] –Ґ–∞–±–ї–Є—Ж–∞ 1. –Ш–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є—П –Є–љ—Б—В—А—Г–Љ–µ–љ—В–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –У–≠–†–С [40] Table 1. Interpretation of oesophageal test results in the context of GERD [40]](/upload/medialibrary/5c4/283-1.png)
–Я—А–Є–љ—Ж–Є–њ—Л –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Љ–Њ—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –У–≠–†–С
–¶–µ–ї–Є –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –У–≠–†–С –≤–Ї–ї—О—З–∞—О—В –њ–Њ–ї–љ–Њ–µ —Г—Б—В—А–∞–љ–µ–љ–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –Ј–∞–ґ–Є–≤–ї–µ–љ–Є–µ —Н—А–Њ–Ј–Є–≤–љ–Њ-—П–Ј–≤–µ–љ–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –њ–Є—Й–µ–≤–Њ–і–∞ –Є –њ—А–µ–і–Њ—В–≤—А–∞—Й–µ–љ–Є–µ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –њ–Є—Й–µ–≤–Њ–і–∞ –С–∞—А—А–µ—В—В–∞ –Є –∞–і–µ–љ–Њ–Ї–∞—А—Ж–Є–љ–Њ–Љ—Л –њ–Є—Й–µ–≤–Њ–і–∞ [1].
–Т–∞–ґ–љ–∞—П —А–Њ–ї—М –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –Ї—Г—А–∞—Ж–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –У–≠–†–С –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П –≤–Њ –≤—Б–µ—Е –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞—Е –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е [1, 41, 42]. –Ь–µ—А–Њ–њ—А–Є—П—В–Є—П –њ–Њ –љ–µ–Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤–Ї–ї—О—З–∞—О—В –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —А–µ–ґ–Є–Љ–∞ –њ–Є—В–∞–љ–Є—П (5вАУ6-—А–∞–Ј–Њ–≤–Њ–µ –њ–Є—В–∞–љ–Є–µ, –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –і–ї–Є—В–µ–ї—М–љ—Л—Е –Є–љ—В–µ—А–≤–∞–ї–Њ–≤ –Љ–µ–ґ–і—Г –њ—А–Є–µ–Љ–∞–Љ–Є –њ–Є—Й–Є –Є –њ–Њ–Ј–і–љ–Є—Е –њ—А–Є–µ–Љ–Њ–≤ –њ–Є—Й–Є, –љ–µ–±–Њ–ї—М—И–Њ–є –Њ–±—К–µ–Љ –њ–Њ—А—Ж–Є–є), –≤—Л—П–≤–ї–µ–љ–Є–µ –Є –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –≤ —А–∞—Ж–Є–Њ–љ–µ –њ—А–Њ–і—Г–Ї—В–Њ–≤-—В—А–Є–≥–≥–µ—А–Њ–≤, –Є—Б–Ї–ї—О—З–µ–љ–Є–µ –Є–љ—В–µ–љ—Б–Є–≤–љ—Л—Е —Д–Є–Ј–Є—З–µ—Б–Ї–Є—Е –љ–∞–≥—А—Г–Ј–Њ–Ї –Є —А–∞–±–Њ—В—Л –≤ –љ–∞–Ї–ї–Њ–љ, —Б–Њ–љ —Б –њ—А–Є–њ–Њ–і–љ—П—В—Л–Љ –≥–Њ–ї–Њ–≤–љ—Л–Љ –Ї–Њ–љ—Ж–Њ–Љ –Ї—А–Њ–≤–∞—В–Є, –њ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є вАФ –Њ—В–Љ–µ–љ—Г –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–љ–Є–ґ–∞—О—Й–Є—Е —В–Њ–љ—Г—Б –Э–Я–°. –Я–∞—Ж–Є–µ–љ—В –≤ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–Љ –њ–Њ—А—П–і–Ї–µ –і–Њ–ї–ґ–µ–љ –±—Л—В—М –њ—А–Њ–Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Њ—В–Ї–∞–Ј–∞ –Њ—В –Ї—Г—А–µ–љ–Є—П. –Ъ—А–∞–є–љ–µ –≤–∞–ґ–љ—Л–Љ —Г—Б–ї–Њ–≤–Є–µ–Љ, —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –і–Њ—Б—В–Є–ґ–µ–љ–Є—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –љ–∞–і —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –У–≠–†–С, —П–≤–ї—П–µ—В—Б—П –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –Љ–∞—Б—Б—Л —В–µ–ї–∞. –Ш—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –Ш–Ь–Ґ –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ—А–µ –љ–∞ 3,5 –Ї–≥/–Љ2 —Г–ї—Г—З—И–∞–µ—В –Ї–Њ–љ—В—А–Њ–ї—М –љ–∞–і —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є –У–≠–†–С –≤ 1,5вАУ2,4 —А–∞–Ј–∞ [15]. –Я–Њ—В–µ—А—П –≤–µ—Б–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –≤—А–µ–Љ–µ–љ–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –Ї–Є—Б–ї–Њ—В—Л –љ–∞ –њ–Є—Й–µ–≤–Њ–і –≤ 2 —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е (—Б 5,6 –і–Њ 3,7% –Є —Б 8,0 –і–Њ 5,5% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ) [43, 44].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –У–≠–†–С —П–≤–ї—П–µ—В—Б—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ, –≤ –Њ—Б–љ–Њ–≤–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ–µ—А–≤–Є—З–љ–Њ –ї–µ–ґ–Є—В –љ–∞—А—Г—И–µ–љ–Є–µ –Љ–Њ—В–Њ—А–Є–Ї–Є –≥–∞—Б—В—А–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ–Њ–є –Ј–Њ–љ—Л, —Б—В–∞–љ–і–∞—А—В–Њ–Љ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Ї–Є—Б–ї–Њ—В–Њ–њ—А–Њ–і—Г–Ї—Ж–Є–Є –ґ–µ–ї—Г–і–Ї–∞. –Э–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ш–Я–Я –≤ —Б—В–∞–љ–і–∞—А—В–љ–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–µ —Г–Љ–µ–љ—М—И–∞–µ—В —Б–Ї–Њ—А–Њ—Б—В—М —Б–µ–Ї—А–µ—Ж–Є–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –Њ–±—К–µ–Љ –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —Б–Њ–Ї–∞ –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–љ–Є–Ј–Є—В—М –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–Є–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї —А–µ—Д–ї—О–Ї—В–∞—В–∞ [45]. –Ю–і–љ–∞–Ї–Њ –њ–Њ–ї–љ—Л–є –Њ—В–≤–µ—В –љ–∞ —В–µ—А–∞–њ–Є—О –Ш–Я–Я, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –і–∞–љ–љ—Л–Љ–Є –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞, –љ–∞–±–ї—О–і–∞–µ—В—Б—П –љ–µ –±–Њ–ї–µ–µ —З–µ–Љ –≤ 80% —Б–ї—Г—З–∞–µ–≤ [46], —З—В–Њ —В—А–µ–±—Г–µ—В –Њ—Ж–µ–љ–Ї–Є –њ—А–Є–≤–µ—А–ґ–µ–љ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–∞, —Б–Њ—Б—В–∞–≤–∞ —А–µ—Д–ї—О–Ї—В–∞—В–∞ (—Б–Љ–µ—И–∞–љ–љ—Л–є –Є–ї–Є —Й–µ–ї–Њ—З–љ–Њ–є) –Є –њ–µ—А–µ—Е–Њ–і–∞ –љ–∞ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ—Л–µ —Б—Е–µ–Љ—Л (–≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –Ш–Я–Я), –≤–Ї–ї—О—З–∞—О—Й–Є–µ: –∞–љ—В–∞—Ж–Є–і—Л, —Н–Ј–Њ—Д–∞–≥–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А—Л, –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Є, —Г—А—Б–Њ–і–µ–Ј–Њ–Ї—Б–Є—Е–Њ–ї–µ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г, —А–µ–±–∞–Љ–Є–њ–Є–і [1].
–Т –і–∞–љ–љ–Њ–є –Њ–±–Ј–Њ—А–љ–Њ–є —Б—В–∞—В—М–µ –Њ—Б–Њ–±–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ —Г–і–µ–ї–µ–љ–Њ –њ—А–Є–љ—Ж–Є–њ–∞–Љ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Љ–Њ—В–Њ—А–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –У–≠–†–С.
–°–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –Њ–±–Ј–Њ—А—Л –Є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј—Л –і–µ–Љ–Њ–љ—Б—В—А–Є—А—Г—О—В, —З—В–Њ —В–µ—А–∞–њ–Є—П –Ш–Я–Я —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–Љ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–∞, —З–µ–Љ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Ш–Я–Я [47], —В–∞–Ї –Ї–∞–Ї –њ–Њ–≤—Л—И–µ–љ–Є–µ —В–Њ–љ—Г—Б–∞ –Э–Я–° –Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—П –Љ–Њ—В–Њ—А–Є–Ї–Є –Њ—А–≥–∞–љ–Њ–≤ –≥–∞—Б—В—А–Њ—Н–Ј–Њ—Д–∞–≥–µ–∞–ї—М–љ–Њ–є –Ј–Њ–љ—Л —П–≤–ї—П—О—В—Б—П –≤–∞–ґ–љ—Л–Љ–Є —Ж–µ–ї—П–Љ–Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –У–≠–†–С –Ї–∞–Ї –њ—А–Є –Ї–Є—Б–ї–Њ—В–љ—Л—Е, —В–∞–Ї –Є –њ—А–Є —Б–Љ–µ—И–∞–љ–љ—Л—Е —А–µ—Д–ї—О–Ї—Б–∞—Е [48]. –Ъ –Њ—Б–Њ–±—Л–Љ –≥—А—Г–њ–њ–∞–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б–ї–µ–і—Г–µ—В –Њ—В–љ–µ—Б—В–Є –ї–Є—Ж —Б –Ф–У–≠–†, —Б —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –њ–µ—А–µ–Ї—А–µ—Б—В–∞ —Б –§–Ф, –і–ї–Є—В–µ–ї—М–љ—Л–Љ –њ—А–Є–µ–Љ–Њ–Љ –Ш–Я–Я [49]. –Я–Њ—Б–ї–µ–і–љ–µ–µ —Б–≤—П–Ј—Л–≤–∞—О—В —Б —В–µ–Љ, —З—В–Њ –Ш–Я–Я —В–Њ—А–Љ–Њ–Ј—П—В –Љ–Њ—В–Њ—А–љ–Њ-—Н–≤–∞–Ї—Г–∞—В–Њ—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –ґ–µ–ї—Г–і–Ї–∞ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П –Ї–Є—Б–ї–Њ—В–Њ–Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ –њ–µ–њ—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–Є–і—А–Њ–ї–Є–Ј–∞ –њ–Є—Й–µ–≤–Њ–≥–Њ –Ї–Њ–Љ–Ї–∞ –љ–∞ —Д–Њ–љ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П –њ—А–Њ–і—Г–Ї—Ж–Є–Є —Б–Њ–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –Ї–Њ–Љ–њ–µ–љ—Б–∞—В–Њ—А–љ–Њ–є –≥–Є–њ–µ—А–≥–∞—Б—В—А–Є–љ–µ–Љ–Є–Є. –° —Н—В–Є—Е –њ–Њ–Ј–Є—Ж–Є–є –≤–Ї–ї—О—З–µ–љ–Є–µ –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ –≤ —Б—Е–µ–Љ—Г –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї –∞–љ—В–Є—Б–µ–Ї—А–µ—В–Њ—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є —П–≤–ї—П–µ—В—Б—П –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –Њ–њ—А–∞–≤–і–∞–љ–љ—Л–Љ –Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞—В—М —Г–Ї–∞–Ј–∞–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –Љ–Њ—В–Њ—А–Є–Ї–Є [50].
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ —В–Њ, —З—В–Њ –Љ–љ–Њ–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г–±–µ–і–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –У–≠–†–С –Є —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л —Н–њ–Є–Ј–Њ–і–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —А–µ—Д–ї—О–Ї—Б–∞ –њ—А–Є –і–Њ–±–∞–≤–ї–µ–љ–Є–Є –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ –Ї —Б—В–∞–љ–і–∞—А—В–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ш–Я–Я [51вАУ54], –Љ–µ–ґ–і—Г —Н–Ї—Б–њ–µ—А—В–∞–Љ–Є –≤—Б–µ –µ—Й–µ –µ—Б—В—М –љ–µ–Ї–Њ—В–Њ—А—Л–µ –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є—П –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ –њ—А–Є –У–≠–†–С [52, 53, 55]. –Ю–і–Њ–±—А–µ–љ–љ—Л–µ –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –і–ї—П –ї–µ—З–µ–љ–Є—П –У–≠–†–С –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Є, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –њ—А–Њ—Д–Є–ї—М–љ—Л—Е –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2.
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –Я—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Є, –Њ–і–Њ–±—А–µ–љ–љ—Л–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –У–≠–†–С, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –њ—А–Њ—Д–Є–ї—М- –љ—Л—Е –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤ [1, 41, 56вАУ60] Table 2. Prokinetics approved for the treatment of GERD, in accordance with the recommendations –Ґ–∞–±–ї–Є—Ж–∞ 2. –Я—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Є, –Њ–і–Њ–±—А–µ–љ–љ—Л–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –У–≠–†–С, –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ–Є –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е –њ—А–Њ—Д–Є–ї—М- –љ—Л—Е –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ–Њ–±—Й–µ—Б—В–≤ [1, 41, 56вАУ60] Table 2. Prokinetics approved for the treatment of GERD, in accordance with the recommendations](/upload/medialibrary/b62/283-2.png)
–Я—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Є —П–≤–ї—П—О—В—Б—П —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –≥—А—Г–њ–њ–Њ–є, –Ї–Њ—В–Њ—А–∞—П —Г—Б–Є–ї–Є–≤–∞–µ—В –Є –Ї–Њ–Њ—А–і–Є–љ–Є—А—Г–µ—В –Љ—Л—И–µ—З–љ—Л–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –≤–Ї–ї—О—З–∞—П –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є—О –Љ–µ–ґ–і—Г —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —Б–µ–≥–Љ–µ–љ—В–∞–Љ–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞, —В–µ–Љ —Б–∞–Љ—Л–Љ —Г—Б–Є–ї–Є–≤–∞—П –і–≤–Є–ґ–µ–љ–Є–µ –≤–љ—Г—В—А–Є–њ—А–Њ—Б–≤–µ—В–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ [61]. –Я–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–Є—И–µ–љ–Є —В–µ—А–∞–њ–Є–Є –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–Љ –≤ —Г—Б–ї–Њ–≤–Є—П—Е –У–≠–†–С –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–∞ —А–Є—Б—Г–љ–Ї–µ.
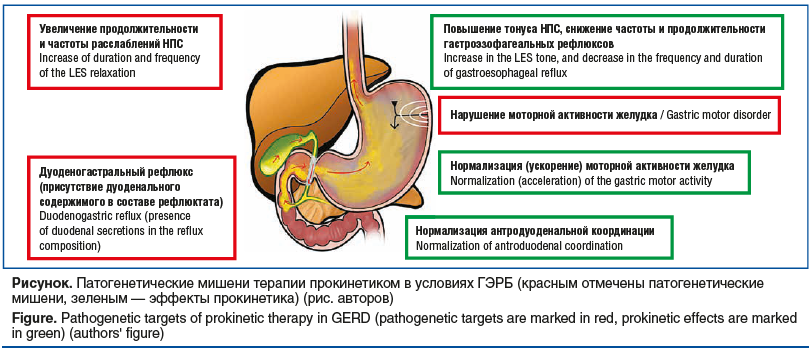
–°—А–µ–і–Є –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ –≤—Л–і–µ–ї—П—О—В –і–≤–µ –Њ—Б–љ–Њ–≤–љ—Л–µ –≥—А—Г–њ–њ—Л: –∞–љ—В–∞–≥–Њ–љ–Є—Б—В—Л (–±–ї–Њ–Ї–∞—В–Њ—А—Л) D2-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –і–Њ—Д–∞–Љ–Є–љ–∞ (–Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і, –і–Њ–Љ–њ–µ—А–Є–і–Њ–љ, –Є—В–Њ–њ—А–Є–і) –Є –∞–≥–Њ–љ–Є—Б—В—Л (–∞–Ї—В–Є–≤–∞—В–Њ—А—Л) 5-–Э–Ґ4-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ —Б–µ—А–Њ—В–Њ–љ–Є–љ–∞ (—Ж–Є–Ј–∞–њ—А–Є–і, –Љ–Њ–Ј–∞–њ—А–Є–і, –њ—А—Г–Ї–∞–ї–Њ–њ—А–Є–і, —В–µ–≥–∞—Б–µ—А–Њ–і, –≤–µ–ї—Г—Б–µ—В—А–∞–≥). –С–ї–Њ–Ї–Є—А—Г—П D2-—А–µ—Ж–µ–њ—В–Њ—А—Л –Є –∞–Ї—В–Є–≤–Є—А—Г—П 5-–Э–Ґ4-—А–µ—Ж–µ–њ—В–Њ—А—Л, –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Є –њ—А–Є–≤–Њ–і—П—В –Ї –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞ –Є–Ј –Њ–Ї–Њ–љ—З–∞–љ–Є–є —Е–Њ–ї–Є–љ-–µ—А–≥–Є—З–µ—Б–Ї–Є—Е –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤ –љ–µ—А–≤–љ—Л—Е —Б–њ–ї–µ—В–µ–љ–Є–є, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л—Е –≤ —Б—В–µ–љ–Ї–µ –ґ–µ–ї—Г–і–Ї–∞ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є. –Т–Њ–Ј–љ–Є–Ї–∞—О—Й–µ–µ –≤–Њ–Ј–±—Г–ґ–і–µ–љ–Є–µ –Ь3-—Е–Њ–ї–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –љ–∞ –Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В —Г—Б–Є–ї–µ–љ–Є—О –Љ–Њ—В–Њ—А–Є–Ї–Є –њ–Є—Й–µ–≤–Њ–і–∞ –Є –ґ–µ–ї—Г–і–Ї–∞.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —Б–њ–µ–Ї—В—А –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Њ–±–ї–∞–і–∞—О—Й–Є—Е –њ—А–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, –Ј–∞–Љ–µ—В–љ–Њ —А–∞—Б—И–Є—А–Є–ї—Б—П (—В–∞–±–ї. 3). –†–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ—Л –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О, –љ–∞—Е–Њ–і—П—В—Б—П –љ–∞ —Б—В–∞–і–Є–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б–њ—Л—В–∞–љ–Є–є –Є–ї–Є –Њ–±–ї–∞–і–∞—О—В –Є–Ј–≤–µ—Б—В–љ—Л–Љ –њ—А–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —В–∞–Ї–Є–µ –Љ–Њ–ї–µ–Ї—Г–ї—Л, –Ї–∞–Ї –∞–Ї–Њ—В–Є–∞–Љ–Є–і, –±—Г—Б–њ–Є—А–Њ–љ, —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –∞–Ј–Є—В—А–Њ–Љ–Є—Ж–Є–љ, –Љ–Є—В–µ–Љ—Ж–Є–љ–∞–ї (–њ—А–Њ–Є–Ј–≤–Њ–і–љ–Њ–µ —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ–∞), –ї–µ–≤–Њ—Б—Г–ї—М–њ–Є—А–Є–і, –Љ–Є—А—В–∞–Ј–∞–њ–Є–љ, –Ї–∞–Љ–Є—Ж–Є–љ–∞–ї, —Ж–Є–љ–Є—В–∞–њ—А–Є–і, —А–µ–ї–∞–Љ–Њ—А–µ–ї–Є–љ (RM-131), —Г–ї–µ–Љ–Њ—А–µ–ї–Є–љ, –±–Њ—В—Г–ї–Є–љ–Є—З–µ—Б–Ї–Є–є —В–Њ–Ї—Б–Є–љ –Є –і—А. [62].

–Ю—Б—В–∞–љ–Њ–≤–Є–Љ—Б—П –љ–∞ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–µ –Њ—В–і–µ–ї—М–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б –њ—А–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ, –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є–Є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є. –Я–µ—А–≤—Л–Љ–Є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—П–Љ–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є–Ј –≥—А—Г–њ–њ—Л –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ —П–≤–ї—П—О—В—Б—П –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і –Є –і–Њ–Љ–њ–µ—А–Є–і–Њ–љ. –Р–љ—В–Є–і–Њ—Д–∞–Љ–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і–∞ –Є –і–Њ–Љ–њ–µ—А–Є–і–Њ–љ–∞ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В —Ж–µ–ї—Л–є —Б–њ–µ–Ї—В—А –њ—А–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –≤–Ї–ї—О—З–∞—П –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —В–Њ–љ—Г—Б–∞ –Э–Я–° –Є –Љ–Њ—В–Њ—А–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Њ–≤ –≥–∞—Б—В—А–Њ–і—Г–Њ–і–µ–љ–∞–ї—М–љ–Њ–є –Ј–Њ–љ—Л. –Я—А–Є —Н—В–Њ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і–∞ –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –і–Њ—Д–∞–Љ–Є–љ–Њ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л –≤ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ —Б–Њ–њ—А—П–ґ–µ–љ–∞ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —В–∞–Ї–Є—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, –Ї–∞–Ї –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, —Б–Њ–љ–ї–Є–≤–Њ—Б—В—М, –±–µ—Б–њ–Њ–Ї–Њ–є—Б—В–≤–Њ, —Н–Ї—Б—В—А–∞–њ–Є—А–∞–Љ–Є–і–љ—Л–µ —А–∞—Б—Б—В—А–Њ–є—Б—В–≤–∞, –і–µ–њ—А–µ—Б—Б–Є—П, —З—В–Њ –ї–Є–Љ–Є—В–Є—А—Г–µ—В –Ї—Г—А—Б–Њ–≤–Њ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–љ—В–Є–і–Њ—Д–∞–Љ–Є–љ–µ—А–≥–Є—З–µ—Б–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є–Ј –≥—А—Г–њ–њ—Л –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–µ–Љ–µ –Љ–Њ–≥—Г—В –њ—А–Є–≤–Њ–і–Є—В—М –Ї —А–∞–Ј–≤–Є—В–Є—О –≥–Є–њ–µ—А–њ—А–Њ–ї–∞–Ї—В–Є–љ–µ–Љ–Є–Є, –≥–∞–ї–∞–Ї—В–Њ—А–µ–Є –Є –≥–Є–љ–µ–Ї–Њ–Љ–∞—Б—В–Є–Є, —З—В–Њ —В–∞–Ї–ґ–µ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В –Є—Е –і–ї–Є—В–µ–ї—М–љ–Њ–µ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ [45, 63].
–Я–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –і–Њ–Љ–њ–µ—А–Є–і–Њ–љ –±—Л–ї —Б–≤—П–Ј–∞–љ —Б —Б–µ—А–і–µ—З–љ—Л–Љ–Є –∞—А–Є—В–Љ–Є—П–Љ–Є –Є–Ј-–Ј–∞ –µ–≥–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –Ї–∞–ї–Є–µ–≤—Л–µ –Ї–∞–љ–∞–ї—Л –њ—А–Њ–≤–Њ–і—П—Й–µ–є —Б–Є—Б—В–µ–Љ—Л –Љ–Є–Њ–Ї–∞—А–і–∞, —З—В–Њ –њ—А–Є–≤–µ–ї–Њ –Ї –≤–љ–µ—Б–µ–љ–Є—О –≤ –Є–љ—Б—В—А—Г–Ї—Ж–Є–Є –Ї –њ—А–µ–њ–∞—А–∞—В—Г —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—О –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –µ–≥–Њ –њ—А–Є–µ–Љ–∞. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Х–≤—А–Њ–њ–µ–є—Б–Ї–∞—П —Д–∞—А–Љ–∞–Ї–Њ–њ–µ—П –њ–µ—А–µ–≤–µ–ї–∞ –њ—А–µ–њ–∞—А–∞—В –Є–Ј —Б—В–∞—В—Г—Б–∞ ¬Ђ–±–µ–Ј—А–µ—Ж–µ–њ—В—Г—А–љ—Л–є¬ї –≤ —Б—В–∞—В—Г—Б ¬Ђ–Њ—В–њ—Г—Б–Ї–∞–µ—В—Б—П –њ–Њ —А–µ—Ж–µ–њ—В—Г –≤—А–∞—З–∞¬ї. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –Љ–µ—В–Њ–Ї–ї–Њ–њ—А–∞–Љ–Є–і–Њ–Љ –і–Њ–Љ–њ–µ—А–Є–і–Њ–љ –Є–Љ–µ–µ—В –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–є —А–Є—Б–Ї —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е —Б–Њ–±—Л—В–Є–є –≤ —Ж–µ–ї–Њ–Љ –њ—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –µ–≥–Њ –Љ–µ–љ–µ–µ 30 –Љ–≥/—Б—Г—В, —В–∞–Ї–∞—П –і–Њ–Ј–Є—А–Њ–≤–Ї–∞ –љ–µ –≤—Л–Ј—Л–≤–∞–µ—В —Г–і–ї–Є–љ–µ–љ–Є—П –Є–љ—В–µ—А–≤–∞–ї–∞ QT, —Б–Њ–≥–ї–∞—Б–љ–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј—Г –њ—А–Њ—Д–Є–ї—П —Б–µ—А–і–µ—З–љ–Њ–є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –њ—А–µ–њ–∞—А–∞—В–∞ –≤ 2018 –≥. [64], –љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і—Г–µ—В—Б—П –Є–Ј–±–µ–≥–∞—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –і–Њ–Љ–њ–µ—А–Є–і–Њ–љ–∞, –µ—Б–ї–Є –Ї–Њ—А—А–Є–≥–Є—А–Њ–≤–∞–љ–љ—Л–є –Є–љ—В–µ—А–≤–∞–ї QT –љ–∞ —Н–ї–µ–Ї—В—А–Њ–Ї–∞—А–і–Є–Њ–≥—А–∞–Љ–Љ–µ –њ–∞—Ж–Є–µ–љ—В–∞ —Б–Њ—Б—В–∞–≤–ї—П–µ—В >470 –Љ—Б —Г –Љ—Г–ґ—З–Є–љ –Є >450 –Љ—Б —Г –ґ–µ–љ—Й–Є–љ [61]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б–Њ–Њ–±—Й–∞–µ—В—Б—П, —З—В–Њ —Б–ї–µ–і—Г–µ—В —Б–Њ–±–ї—О–і–∞—В—М –Њ—Б—В–Њ—А–Њ–ґ–љ–Њ—Б—В—М –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –і–Њ–Љ–њ–µ—А–Є–і–Њ–љ–∞ —Б –∞–≥–µ–љ—В–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Є–Ј–Љ–µ–љ—П—О—В –Є–ї–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Є—А—Г—О—В—Б—П —Ж–Є—В–Њ—Е—А–Њ–Љ–Њ–Љ –†450 (CYP) 3A4 (–љ–∞–њ—А–Є–Љ–µ—А, —Н—А–Є—В—А–Њ–Љ–Є—Ж–Є–љ), –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–µ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –Љ–Њ–≥—Г—В –±—Л—В—М —Б–≤—П–Ј–∞–љ—Л —Б —А–Є—Б–Ї–Њ–Љ –≤–љ–µ–Ј–∞–њ–љ–Њ–є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Љ–µ—А—В–Є [65].
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –љ–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є—О –У–≠–†–С [1, 66] –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Л–±–Њ—А–∞ –Є–Ј –≥—А—Г–њ–њ—Л –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–Љ–Є–Љ–Њ –±–ї–Њ–Ї–Є—А–Њ–≤–∞–љ–Є—П D2-—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Є–љ–≥–Є–±–Є—А—Г–µ—В —Д–µ—А–Љ–µ–љ—В –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ—Н—Б—В–µ—А–∞–Ј—Г, —А–µ–≥—Г–ї–Є—А—Г—О—Й—Г—О –≤—Л—А–∞–±–Њ—В–Ї—Г –∞—Ж–µ—В–Є–ї—Е–Њ–ї–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є —Г—Б–Є–ї–Є–≤–∞–µ—В –њ—А–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Њ–µ –і–µ–є—Б—В–≤–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞. –†–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Є–ї–Њ—В–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [67] –њ–Њ–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –њ—А–Є–µ–Љ –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞ –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ 150 –Љ–≥/—Б—Г—В –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 4 –љ–µ–і. —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–∞–µ—В —З–∞—Б—В–Њ—В—Г –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —А–µ—Д–ї—О–Ї—Б–Њ–≤ –Є –Њ–±–ї–µ–≥—З–∞–µ—В —Б–Є–Љ–њ—В–Њ–Љ—Л –У–≠–†–С –±–µ–Ј –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤.
–Я—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞ (–У–∞–љ–∞—В–Њ–љ¬Ѓ) –≤ —Б–Њ—Б—В–∞–≤–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–ЄћЖ —В–µ—А–∞–њ–Є–Є —Б –Ш–Я–Я –њ—А–Є –У–≠–†–С –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –Њ–љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В —В–Њ–љ—Г—Б –Э–Я–° –Є —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –Љ–Њ—В–Њ—А–љ–Њ-—Н–≤–∞–Ї—Г–∞—В–Њ—А–љ—Г—О —Д—Г–љ–Ї—Ж–Є—О –ґ–µ–ї—Г–і–Ї–∞, —Г–ї—Г—З—И–∞–µ—В –µ–≥–Њ –∞–Ї–Ї–Њ–Љ–Њ–і–∞—Ж–Є—О [48, 68]. –Ш—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –Ш–Я–Я –њ–Њ–Ї–∞–Ј–∞–ї —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –≤ –ї–µ—З–µ–љ–Є–Є –≤–љ–µ–њ–Є—Й–µ–≤–Њ–і–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є –У–≠–†–С [69].
–Т—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ-—Е–ї–Њ—А–Є–і–∞ —В–∞–Ї–ґ–µ –±—Л–ї –Њ—В–Љ–µ—З–µ–љ —Н–Ї—Б–њ–µ—А—В–∞–Љ–Є –†–Є–Љ—Б–Ї–Њ–≥–Њ —Д–Њ–љ–і–∞ –њ–Њ –Є–Ј—Г—З–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —В–µ—А–∞–њ–Є–Є –§–Ф. –Я—А–Є —Н—В–Њ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –і–Њ–Ї–∞–Ј–∞–љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Є –ї–µ—З–µ–љ–Є–Є –њ–Њ—Б—В–њ—А–∞–љ–і–Є–∞–ї—М–љ–Њ–≥–Њ –і–Є—Б—В—А–µ—Б—Б-—Б–Є–љ–і—А–Њ–Љ–∞ [70], –љ–Њ –Є –њ—А–Є –ї–µ—З–µ–љ–Є–Є —Н–њ–Є–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –±–Њ–ї–Є –Є —Б–Љ–µ—И–∞–љ–љ–Њ–≥–Њ –≤–∞—А–Є–∞–љ—В–∞ –і–Є—Б–њ–µ–њ—Б–Є–Є –≤–љ–µ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ –µ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ –љ–∞ —Б–Є–Љ–њ—В–Њ–Љ—Л —А–∞–Ј–ї–Є—З–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –≤–∞—А–Є–∞–љ—В–Њ–≤ –і–Є—Б–њ–µ–њ—Б–Є–Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –≤ —А—П–і–µ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–Њ–≤ –Є —Б–Є—Б—В–µ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Њ–±–Ј–Њ—А–Њ–≤ [71, 72]. –Ґ–∞–Ї, –њ–Њ –і–∞–љ–љ—Л–Љ –і–≤—Г—Е –Ї—А—Г–њ–љ—Л—Е –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–Њ–≤, —В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–∞—Б—М –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –і–Є—Б–њ–µ–њ—Б–Є–Є –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і—А—Г–≥–Є–Љ–Є –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–∞–Љ–Є [70, 72], –њ—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Њ—В–∞ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —П–≤–ї–µ–љ–Є–є –њ—А–Є –њ—А–Є–µ–Љ–µ –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞ –±—Л–ї–∞ —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ–∞ —Б —В–∞–Ї–Њ–≤–Њ–є –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ [73, 74]. –Т –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ-–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є G. Holtmann et al. [74] —Б —Г—З–∞—Б—В–Є–µ–Љ 523 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –§–Ф –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і –љ–µ —Г–≤–µ–ї–Є—З–Є–≤–∞–ї –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є–љ—В–µ—А–≤–∞–ї–∞ QT –і–∞–ґ–µ –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Г–≤–µ–ї–Є—З–µ–љ–љ—Л—Е –≤ 3 —А–∞–Ј–∞ –і–Њ–Ј–Є—А–Њ–≤–Њ–Ї –≤ —В–µ—З–µ–љ–Є–µ 8 –љ–µ–і. –Т–∞–ґ–љ–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –≤—Б–µ —Г–њ–Њ–Љ—П–љ—Г—В—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–µ–і–µ–љ—Л –љ–∞ –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–µ –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞ (–У–∞–љ–∞—В–Њ–љ¬Ѓ) –Є —Н–Ї—Б—В—А–∞–њ–Њ–ї–Є—А–Њ–≤–∞—В—М –Є—Е —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞ –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞ –љ–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ –Ї–ї—О—З–µ–≤–Њ–µ –Љ–µ—Б—В–Њ –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –Є –њ–µ—А—Б–Є—Б—В–µ–љ—Ж–Є–Є —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –У–≠–†–С –Њ—В–≤–Њ–і–Є—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П–Љ –Љ–Њ—В–Њ—А–Є–Ї–Є –њ–Є—Й–µ–≤–Њ–і–∞ –Є –ґ–µ–ї—Г–і–Ї–∞, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–≤–Њ–і—П—В –Ї —А–µ—В—А–Њ–≥—А–∞–і–љ—Л–Љ –Ј–∞–±—А–Њ—Б–∞–Љ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –ґ–µ–ї—Г–і–Ї–∞ (–∞ —Г —З–∞—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ вАФ –Є –і–≤–µ–љ–∞–і—Ж–∞—В–Є–њ–µ—А—Б—В–љ–Њ–є –Ї–Є—И–Ї–Є) –≤ –і–Є—Б—В–∞–ї—М–љ—Л–є –Њ—В–і–µ–ї –њ–Є—Й–µ–≤–Њ–і–∞. –£–Ї–∞–Ј–∞–љ–љ—Л–є —Д–∞–Ї—В –Њ–±–Њ—Б–љ–Њ–≤—Л–≤–∞–µ—В —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –і–Њ–±–∞–≤–ї–µ–љ–Є—П –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤ –≤ —Б—Е–µ–Љ—Л —В–µ—А–∞–њ–Є–Є –У–≠–†–С –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –Ї –Ш–Я–Я, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –Ф–У–≠–†, –∞ —В–∞–Ї–ґ–µ –њ—А–Є —Б–Њ—З–µ—В–∞–љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –У–≠–†–С –Є –§–Ф.
–Т –Ї–∞—З–µ—Б—В–≤–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤—Л–±–Њ—А–∞ –Є–Ј –≥—А—Г–њ–њ—Л –њ—А–Њ–Ї–Є–љ–µ—В–Є–Ї–Њ–≤, —Г—З–Є—В—Л–≤–∞—П –і–Њ–Ї–∞–Ј–∞–љ–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –≤—Л—Б–Њ–Ї–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞—В—М –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Є—В–Њ–њ—А–Є–і–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і–∞.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–Ы–Є–≤–Ј–∞–љ –Ь–∞—А–Є—П –Р–љ–∞—В–Њ–ї—М–µ–≤–љ–∞ вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, —З–ї–µ–љ-–Ї–Њ—А—А–µ—Б–њ–Њ–љ–і–µ–љ—В –†–Р–Э, –Ј–∞–≤–µ–і—Г—О—Й–∞—П –Ї–∞—Д–µ–і—А–Њ–є —Д–∞–Ї—Г–ї—М—В–µ—В—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є, —А–µ–Ї—В–Њ—А –§–У–С–Ю–£
–Т–Ю –Ю–Љ–У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 644099, –†–Њ—Б—Б–Є—П, –≥. –Ю–Љ—Б–Ї, —Г–ї. –Ы–µ–љ–Є–љ–∞, –і. 12; ORCID iD 0000-0002-6581-7017.
–У–∞—Г—Б –Ю–ї—М–≥–∞ –Т–ї–∞–і–Є–Љ–Є—А–Њ–≤–љ–∞ вАФ –Ї.–Љ.–љ., –і–Њ—Ж–µ–љ—В –Ї–∞—Д–µ–і—А—Л —Д–∞–Ї—Г–ї—М—В–µ—В—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є –§–У–С–Ю–£ –Т–Ю –Ю–Љ–У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 644099, –†–Њ—Б—Б–Є—П, –≥. –Ю–Љ—Б–Ї, —Г–ї. –Ы–µ–љ–Є–љ–∞, –і. 12; ORCID iD 0000-0001-9370-4768.
–С–Њ—А–і–Є–љ –Ф–Љ–Є—В—А–Є–є –°—В–∞–љ–Є—Б–ї–∞–≤–Њ–≤–Є—З вАФ –і.–Љ.–љ., –Ј–∞–≤–µ–і—Г—О—Й–Є–є –Њ—В–і–µ–ї–Њ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є–Є –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є –ґ–µ–ї–µ–Ј—Л, –ґ–µ–ї—З–љ—Л—Е –њ—Г—В–µ–є –Є –≤–µ—А—Е–љ–Є—Е –Њ—В–і–µ–ї–Њ–≤ –њ–Є—Й–µ–≤–∞—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞ –У–С–£–Ч –Ь–Ъ–Э–¶ –Є–Љ–µ–љ–Є –Р.–°. –Ы–Њ–≥–Є–љ–Њ–≤–∞ –Ф–Ч–Ь; 111123, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —И. –≠–љ—В—Г–Ј–Є–∞—Б—В–Њ–≤, –і. 86, —Б—В—А. 6; –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –њ—А–Њ–њ–µ–і–µ–≤—В–Є–Ї–Є –≤–љ—Г—В—А–µ–љ–љ–Є—Е –±–Њ–ї–µ–Ј–љ–µ–є –Є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є –§–У–С–Ю–£ –Т–Ю –Ь–У–Ь–°–£ –Є–Љ. –Р.–Ш. –Х–≤–і–Њ–Ї–Є–Љ–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 127473, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Ф–µ–ї–µ–≥–∞—В—Б–Ї–∞—П, –і. 20, —Б—В—А. 1; –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –Њ–±—Й–µ–є –≤—А–∞—З–µ–±–љ–Њ–є –њ—А–∞–Ї—В–Є–Ї–Є –Є —Б–µ–Љ–µ–є–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –§–У–С–Ю–£ –Т–Ю –Ґ–≤–µ—А—Б–Ї–Њ–є –У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 170100, –†–Њ—Б—Б–Є—П, –≥. –Ґ–≤–µ—А—М, —Г–ї. –°–Њ–≤–µ—В—Б–Ї–∞—П, –і. 4; ORCID iD 0000-0003-2815-3992.
–Ы–Є—Б–Њ–≤—Б–Ї–Є–є –Ь–∞–Ї—Б–Є–Љ –Р–љ–і—А–µ–µ–≤–Є—З вАФ –Њ—А–і–Є–љ–∞—В–Њ—А –Ї–∞—Д–µ–і—А—Л —Д–∞–Ї—Г–ї—М—В–µ—В—Б–Ї–Њ–є —В–µ—А–∞–њ–Є–Є –Є –≥–∞—Б—В—А–Њ—Н–љ—В–µ—А–Њ–ї–Њ–≥–Є–Є –§–У–С–Ю–£ –Т–Ю –Ю–Љ–У–Ь–£ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 644099, –†–Њ—Б—Б–Є—П, –≥. –Ю–Љ—Б–Ї, —Г–ї. –Ы–µ–љ–Є–љ–∞, –і. 12; ORCID iD 0000-0001-9674-0545.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –У–∞—Г—Б –Ю–ї—М–≥–∞ –Т–ї–∞–і–Є–Љ–Є—А–Њ–≤–љ–∞, e-mail: gaus_olga@bk.ru.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 15.03.2023.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 05.04.2023.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 26.04.2023.
About the authors:
Maria A. Livzan вАФ Dr. Sc. (Med.), Professor, Corresponding Member of the Russian Academy of Sciences, Head of the Department of Faculty Therapy and Gastroenterology, rector, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0002-6581-7017.
Olga V. Gaus вАФ C. Sc. (Med.), Assistant Professor of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9370-4768.
Dmitry S. Bordin вАФ Dr. Sc. (Med.), Head of the Department of Pathology of the Pancreas, Biliary Tract and Upper Digestive Tract, A.S. Loginov Moscow Clinical Research Center; 86, bldg. 6, Entuziastov Road, Moscow, 111123, Russian Federation; Professor of the Department of Propaedeutics of Internal Medicine and Gastroenterology, A.I. Yevdokimov Moscow State University of Medicine and Dentistry; 20/1, bldg. 1, Delegatskaya str., Moscow, 127473, Russian Federation; Professor of the Department of General Medical Practice and Family Medicine, Tver State Medical University; 4, Sovetskaya Str., Tver, 170100, Russian Federation; ORCID iD 0000-0003-2815-3992.
Maxim M. Lisovskiy вАФ resident of the Department of Faculty Therapy and Gastroenterology, Omsk State Medical University; 12, Lenin str., Omsk, 644099, Russian Federation; ORCID iD 0000-0001-9674-0545.
Contact information: Olga V. Gaus, e-mail: gaus_olga@bk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 15.03.2023.
Revised 05.04.2023.
Accepted 26.04.2023.












