Введение
Согласно современным представлениям функциональные заболевания (ФЗ) желудочно-кишечного тракта (ЖКТ) возникают вследствие нарушения взаимодействия между головным мозгом и желудочно-кишечным трактом, что приводит к изменениям моторики пищеварительного тракта, иммунной функции его слизистой оболочки, микробиоты кишечника, различных процессов в центральной нервной системе (ЦНС), способствует развитию висцеральной гиперчувствительности и в конечном счете развитию различных симптомов [1]. С одной стороны, разные патогенетические механизмы или их сочетания могут приводить к развитию одного и того же симптома, и тогда для его устранения будет недостаточно воздействия на один механизм патогенеза, может потребоваться применение двух или трех препаратов. С другой стороны, общность патогенетических механизмов различных ФЗ ЖКТ может привести к формированию сочетанной патологии или синдрома перекреста (overlap-syndrome) ФЗ ЖКТ. При этом заметно увеличивается как количество симптомов со стороны разных отделов ЖКТ, так и количество препаратов для их купирования. На практике это приводит к полипрагмазии, увеличению числа побочных эффектов, снижению комплаентности и эффективности лечения.
Одним из вариантов решения данной проблемы служит применение фитопрепаратов, обладающих многоцелевым действием. Концепция мультитаргетной (multi-target) терапии, пришедшая из фитомедицины, предполагает вместо назначения нескольких средств, влияющих на отдельные звенья патогенеза заболевания, применение одного препарата, одновременно воздействующего на несколько звеньев [2]. Доказано, что растительные компоненты в большинстве случаев обладают множественными эффектами, а сочетание различных растительных компонентов за счет синергии позволяет повысить эффективность терапевтического воздействия, снизить дозу каждого из них в препарате, минимизируя частоту побочных эффектов [2–4]. Мультитаргетная терапия функциональных расстройств ЖКТ позволяет воздействовать одновременно как на различные звенья патогенеза заболевания (моторные нарушения, висцеральную гиперчувствительность, иммунные нарушения, воспалительные реакции, нарушения микрофлоры), так и на несколько функциональных расстройств (owerlap-syndrome) [1, 2, 5, 6]. Представленный потенциал растительных препаратов заставляет внимательней отнестись к этой группе лекарственных средств.
В настоящем обзоре рассмотрены эффекты и механизмы действия биологически активной добавки (БАД) Тамиз.
Компоненты фитопрепарата
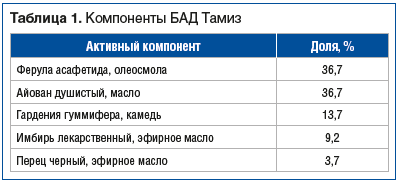
Фитопрепарат БАД Тамиз [капсулы 200 мг, Kadila Pharmaceuticals Limited, Индия] представляет собой растительный препарат для мультитаргетного воздействия, клиническая эффективность которого при ФЗ ЖКТ подтверждена в 2 открытых наблюдательных исследованиях [7, 8]. Кроме того, эффективность каждого из компонентов БАД Тамиз доказана экспериментально и клинически. Растительные компоненты, входящие в состав препарата, представлены в таблице 1.
Ферула асафетида (Ferula asafoetida)
Спазмолитический эффект ферулы асафетиды был изучен в эксперименте на тонкой кишке, в стенку которой вводили ацетилхолин, гистамин и хлорид калия. Предварительное введение экстракта ферулы асафетиды снижало спонтанную сократительную активность кишки более чем в 2 раза. Результаты эксперимента позволили сделать вывод, что спазмолитический эффект ферулы асафетиды обусловлен взаимодействием с мускариновыми, адреналиновыми и гистаминовыми рецепторами гладкой мускулатуры, или влиянием на мобилизацию ионов кальция, ответственных за неспецифическое сокращение гладкой мускулатуры [9–11]. Предварительное введение коллоидного раствора ферулы асафетиды крысам оказало противоязвенное действие при развитии язв желудка, вызванных стрессом, действием аспирина и перевязкой привратника в течение 4 ч, что связано с увеличением продукции муцина и уменьшением клеточной инфильтрации [10, 12]. По данным экспериментов, включение ферулы асафетиды в рацион крыс приводило к увеличению содержания панкреатических ферментов (липазы, амилазы) и тонкокишечных дисахаридаз (сахаразы), но не влияло на желчевыделение [10, 13, 14]. Время транзита пищевых масс по ЖКТ сокращалось предположительно за счет уменьшения времени постабсорбтивной толстокишечной фазы, без влияния на абсорбцию нутриентов [13, 15]. Обезболивающий эффект ферулы асафетиды был доказан и в тонической, и в фазовой ноцицептивной модели. Это свидетельствует о том, что она обладает обезболивающими свойствами центрального и периферического действия [16]. Применение ферулы асафетиды показало достоверный противовоспалительный эффект в тесте с отеком, вызванным каррагеном, а также антиоксидантный эффект, связанный со способностью ингибировать липоксигеназу, в эксперименте с поглощением свободных радикалов [16]. Ферула асафетида показала противогрибковую активность в отношении Trichoderma harzianum, Pleurotus spp., A. niger, C. albicans, C. cylindracea, C. blanki, C. krusei, C. glabrata, C. tropicalis, Saccharomyces cerevisiae, Blastocystis sp. 3 подтипа [17–20]. Антибактериальная активность ферулы асафетиды продемонстрирована в отношении Staphylococcus aureus, Enterococcus faecalis, Streptococcus mutans, Streptococcus sobrinus, Streptococcus sanguis, Streptococcus salivarius, Escherichia coli, Shigella flexneri и Klebsiella pneumoniaе [21, 22].
Применение ферулы асафетиды у пациентов с функциональной диспепсией изучено в двойном слепом плацебо-контролируемом исследовании, где качество жизни пациентов в основной группе достоверно улучшилось по сравнению с группой плацебо. Симптомы диспепсии достоверно уменьшились у 80% пациентов, в том числе уменьшилось вздутие живота у 58%, улучшился аппетит у 69%, уменьшилось ощущение переполнения после еды у 74%, улучшилась моторика у 75% и пищеварение у 77% пациентов [23].
Ажгон (айован) (Trachyspermum ammi)
На различных экспериментальных моделях показаны спазмолитические эффекты айована, опосредованные блокированием Са++ каналов и антихолинергическим действием [24–27]. В эксперименте на мышах с этанол-индуцированными язвами показано, что ажгон оказывает выраженное дозозависимое противоязвенное дейcтвие (достоверно уменьшается количество этанол-индуцированных язв), в высоких дозах превосходящее действие циметидина; наблюдалось также значительное снижение лейкоцитарной и геморрагической инфильтрации слизистой оболочки желудка. Кроме того, было показано, что компоненты ажгона блокируют Н+/К+ АТФ-азу и оказывают действие, сходное с действием ингибиторов протонной помпы [28]. У мышей с пептическими язвами желудка, вызванными ибупрофеном, ажгон также показал выраженный дозозависимый противоязвенный эффект, который выражался в достоверном уменьшении числа и площади язвенных поражений, эффект был сравним с эффектом омепразола [29]. Ажгон, наряду с пиперином и ферулой асафетидой, достоверно уменьшал время транзита пищи по кишечнику, что было показано в эксперименте, где эти специи были включены в рацион питания крыс в течение 6 нед. [15]. На фоне равномерного включения ажгона в рацион питания крыс на протяжении 6–8 нед. увеличивалась выработка желчных кислот на 30%. Однократный прием большой дозы ажгона приводил к значительному увеличению секреции желчных кислот (66%), твердых веществ желчи (71%), что сопровождалось общим увеличением желчевыделения на 41% [13]. В ряде экспериментов ажгон и его основной компонент тимол показали разнообразные антиоксидантные свойства [30, 31]. Ажгон способен значительно ингибировать свободные радикалы, что было показано с использованием дифенилпикрилгидразила и супероксид-анионных радикалов. Этот эффект был сопоставим с антиоксидантной активностью аскорбиновой кислоты [30]. Противовоспалительная активность экстрактов семян ажгона была показана на модели каррагинан-индуцированного воспаления [32]. В различных экспериментах ажгон показал широкий спектр антибактериальной активности в отношении Staphylococcus aureus, Pseudomonas aeruginosa, Escherichia coli, Salmonella typhimuriu, Enterococcus faecalis, Streptococcus pyogenes, Klebsiella pneumoniae, Bacillus cereus, Bacillus subtilis, Lactobacillus acidophilus, Micrococcus luteus, Streptococcus pneumoniae, в том числе против госпитальных штаммов [33–36]. Продемонстрирована противогрибковая активность ажгона в отношении Сandida spp., Aspergillus spp. [35].
Гардения гуммифера (Gardenia gummifera)
В эксперименте на мышах с аспирин-индуцированной язвой гардения гуммифера оказывала достоверный дозозависимый противоязвенный эффект, сопоставимый с действием ранитидина. Наблюдалось достоверное дозозависимое снижение кислотности желудочного сока, общей кислотности и объема желудочного содержимого, наряду с достоверным снижением индекса ульцерогенности. Эффективность гастропротективного действия составила 44,6 и 70,6% в группах, получавших препарат гардении гуммиферы в дозе 150 мг/кг и 300 мг/кг соответственно, по сравнению с 83% в группе животных, получавших ранитидин [37]. Гардения гуммифера показала дозозависимый антиоксидантный эффект в отношении 2,2-дифенилпикрилгидразила (DPPH) и оксида азота [38, 39]. В эксперименте была продемонстрирована антибактериальная активность гардении гуммиферы в отношении S. aureus, K. pneumoniae и E. aerogenes [40].
Имбирь (Zingiber)
Показано дозозависимое спазмолитическое действие имбиря за счет антагонистических влияний на ацетилхолиновые, гистаминовые и серотониновые рецепторы и/или прямого действия на Са++ каналы [41]. Экспериментальные данные свидетельствуют о том, что на фоне применения имбиря время продвижения пищевых масс по ЖКТ уменьшалось [15]. Ежедневное включение имбиря в пищу, по данным эксперимента, способствовало увеличению желчевыделения за счет стимуляции выработки желчных кислот и секреции их в желчь, что стимулировало выработку панкреатической липазы, химотрипсина, амилазы и трипсина [13]. Химические соединения, входящие в состав имбиря (гингерол, шогаол и др.), обладают широким спектром противовоспалительной и антиоксидантной активности. Они блокируют 5-липоксигеназу и простагландинсинтетазу, ингибируют синтез провоспалительных цитокинов (интерлейкина (ИЛ) 1, фактора некроза опухоли α (ФНО-α), ИЛ-8). Было показано, что в макрофагах шогаол снижал экспрессию генов NO-синтазы и циклооксигеназы (ЦОГ) 2 [42]. В эксперименте на модели синдрома раздраженной кишки (СРК) с диареей у мышей было показано, что на фоне приема имбиря значительно уменьшался отек и стихала воспалительная активность в толстой кишке за счет снижения экспрессии провоспалительных факторов (ФНО-α, ИЛ-6, NO-синтазы), в результате чего нормализовались частота дефекации и консистенции стула [41]. В экспериментальных моделях было продемонстрировано, что применение имбиря способствовало значительному снижению перекисного окисления липидов, повышению уровня антиоксидантных ферментных систем и сывороточного глутатиона [42–44]. Также имбирь оказывал антиоксидантное действие при поражении печени, индуцированном этанолом [42, 45]. В различных экспериментах была показана противомикробная и противогрибковая активность имбиря [46]. Результаты клинических испытаний продемонстрировали прокинетический эффект употребления имбиря (ускорение времени опорожнения желудка, увеличение количества антральных сокращений), что позволило использовать его для лечения желудочной диспепсии [47, 48]. Гастропротективный эффект имбиря был показан в исследовании, в котором принимали участие 43 пациента с остеоартритом. Пациенты были распределены в группы: 22 пациента принимали диклофенак, 21 пациент принимал специфические комбинации с имбирем. В группе пациентов, принимавших имбирь, было зарегистрировано значительное повышение уровня простагландинов 1, 2, F2a в слизистой оболочке желудка, что увеличивало ее протективную функцию [49].
Черный перец (Piper nigrum)
Экспериментальные данные свидетельствуют о том, что экстракт черного перца достоверно и дозозависимо ослаблял кишечный спазм, вызванный воздействием хлорида калия (не рецептор-опосредованный эффект) и карбохола (рецептор-опосредованный эффект) посредством блокирования притока внутриклеточного кальция [50]. Пиперин, активный ингредиент черного перца, в эксперименте значительно снижал спастические сокращения мышц живота, вызванные интраперитонеальным введением мышам уксусной кислоты [51]. Обезболивающий эффект пиперина был продемонстрирован в эксперименте в тесте реакции на горячую тарелку. Использование пиперина достоверно уменьшало болевой порог и время реакции животных на горячее. Эффект был сопоставим с обезболивающим эффектом индометацина [51]. В эксперименте на мышах было показано, что использование пиперина достоверно и дозозависимо снижает индекс ульцерогенности у мышей после голодания в течение 16 ч [51]. Пиперин также оказал дозозависимое противоязвенное действие в эксперименте, где поражение слизистой оболочки было вызвано стрессом, воздействием индометацина и соляной кислоты. Применение пиперина было достоверно ассоциировано со снижением желудочной секреции и активности пепсина [52]. В клиническом испытании у 40 пациентов с дисфагией был доказан дозозависимый эффект пиперина в отношении улучшения качества глотания и ускорения глотательного акта [53].
Компоненты черного перца ингибировали ФНО-α-зависимую активацию ядерного фактора каппа (NF-κB), пролиферацию опухолевых клеток, перекисное окисление липидов и активность ЦОГ-1 и ЦОГ-2 [54]. В различных экспериментах на клетках рака желудка и рака толстой кишки пиперин продемонстрировал противоопухолевую активность, преимущественно за счет влияния на факторы апоптоза. Показано также активирующее влияние пиперина на систему антиоксидантных ферментов (супероксиддисмутазу, глутатион-пероксидазу и др.), а также ингибирующее влияние на различные провоспалительные цитокиновые механизмы [55].
Разовое кормление крыс высокими дозами черного перца приводило к увеличению количества твердых веществ (солей желчных кислот, билирубина, фосфолипидов, холестерина, аминокислот, стероидов, ферментов, порфиринов и др.) в желчи, в то время как равномерное включение небольших доз черного перца в питание в течение 4 нед. способствовало увеличению жидкой части желчи и относительному снижению количества твердых веществ в ней [56].
Черный перец оказывает стимулирующее действие на выработку слюны и слюнной амилазы, ферментов поджелудочной железы (амилазы, липазы, протеазы, трипсина, химотрипсина), стимулирует активность тонкокишечной липазы, сахаразы, мальтазы [13, 14, 57, 58]. Благодаря этим свойствам применение пиперина и других специй сокращает время транзита пищевых масс по ЖКТ за счет уменьшения времени постабсорбтивной толстокишечной фазы, которая обычно длится дольше всего. Таким образом, пиперин, не влияя на абсорбцию полезных веществ, может быть использован для борьбы с запором и снижения риска колоректального рака [13]. Ускорение времени транзита кишечного содержимого показано в эксперименте, где применение пиперина у мышей в течение 6 нед. достоверно ускоряло время транзита пищевых масс по ЖКТ [15, 57]. С другой стороны, пиперин обладает доказанными антидиарейными свойствами при диарее, вызванной гиперсекрецией ионов хлора, касторовым маслом и сульфатом магния у мышей [59, 60].
Пиперин и его производные в экспериментальных моделях показали широкий спектр антибактериальной и противогельминтной активности в отношении Candida albicans, Pseudomonas aeruginosa, B. subtilis, Streptobacillus spр., Staphylococcus aureus, E. coli, Salmonella typhi, Aspergillus niger, A. flavus, A. fumigatus, Listeria monocytogenes, Leishmania donovani, L. amazonensis, Trypanosoma cruzi [55].
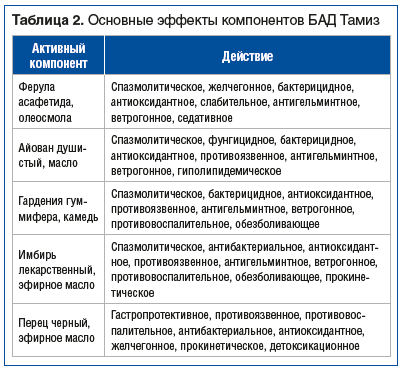
Данные об основных эффектах компонентов БАД Тамиз из разных источников представлены в таблице 2.
Заключение
Представленные данные свидетельствуют о том, что компоненты БАД Тамиз обладают разнообразными доказанными фармакологическими эффектами и оказывают положительное действие на органы пищеварительной системы, нормализуя моторику, секрецию, микробиоту, уменьшая воспаление.
Потенциальная способность Тамиза воздействовать практически на все патогенетические механизмы ФЗ ЖКТ, доказанная в эксперименте, нуждается в дальнейшем изучении при лечении пациентов с функциональной патологией. Результаты собственных клинических исследований показали эффективность представленного препарата в лечении пациентов с функциональным запором и СРК с преобладанием запора. При этом наблюдали достоверное уменьшение не только симптомов запора, но и эпигастральных болей, тошноты, ощущения переполнения, раннего насыщения [7]. Приоритетное направление использования препарата — желудочно-кишечные функциональные расстройства (функциональная диспепсия, запор, связанный с СРК, функциональный запор, дисфункциональные расстройства билиарной системы).












