–Т–≤–µ–і–µ–љ–Є–µ
–Я—А–Є–љ—П—В–∞—П –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Ї–Њ–љ—Ж–µ–њ—Ж–Є—П —Б–Є–љ—В–µ–Ј–∞ –Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≥–Њ—А–Љ–Њ–љ–Њ–≤ —П–Є—З–љ–Є–Ї–Њ–≤, –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤ –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ–µ–є —Б —Г—З–µ—В–Њ–Љ –Є—Е –±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –Є –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –љ–µ —В–Њ–ї—М–Ї–Њ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є, –љ–Њ –Є —Н–њ–Є–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є. –£—З–∞—Б—В–љ–Є–Ї–∞–Љ–Є —А–µ–≥—Г–ї—П—Ж–Є–Є –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ –Є –Њ–≤—Г–ї—П—Ж–Є–Є —П–≤–ї—П—О—В—Б—П —Н—Б—В—А–Њ–≥–µ–љ—Л, –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ –Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ [1], –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –≤–∞–ґ–љ—Л–Љ —Б—З–Є—В–∞–µ—В—Б—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Є—Е –њ–ї–∞–Ј–Љ–µ–љ–љ—Л—Е —Д—А–∞–Ї—Ж–Є–є. –Я—А–Њ–і—Г–Ї—Ж–Є—П —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ–Њ–є, –∞ –Є–Љ–µ–љ–љ–Њ –≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б–Њ–Љ –Є –≥–Є–њ–Њ—Д–Є–Ј–Њ–Љ. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ 25% –∞–љ–і—А–Њ–≥–µ–љ–Њ–≤ —Г –ґ–µ–љ—Й–Є–љ –Њ–±—А–∞–Ј—Г—О—В—Б—П –≤ —П–Є—З–љ–Є–Ї–∞—Е, 25% вАФ –≤ –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞—Е, –Њ—Б—В–∞–ї—М–љ—Л–µ —Б–Є–љ—В–µ–Ј–Є—А—Г—О—В—Б—П –≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е —В–Ї–∞–љ—П—Е –Є–Ј –Њ–і–љ–Є—Е –Є —В–µ—Е –ґ–µ –Є—Б—Е–Њ–і–љ—Л—Е —Б—Г–±—Б—В—А–∞—В–Њ–≤-–њ—А–Њ–≥–Њ—А–Љ–Њ–љ–Њ–≤ (–і–µ–≥–Є–і—А–Њ—Н–њ–Є–∞–љ–і—А–Њ—Б—В–µ—А–Њ–љ (–Ф–У–≠–Р) –Є –і–µ–≥–Є–і—А–Њ—Н–њ–Є–∞–љ–і—А–Њ—Б—В–µ—А–Њ–љ–∞ —Б—Г–ї—М—Д–∞—В (–Ф–У–≠–Р–°)), —Б–Є–љ—В–µ–Ј –Ї–Њ—В–Њ—А—Л—Е –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–∞–Љ–Є. –¶–Є—А–Ї—Г–ї–Є—А—Г—О—Й–Є–є –ґ–µ –≤ –Ї—А–Њ–≤–Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ —Г –ґ–µ–љ—Й–Є–љ —Б–њ–Њ—Б–Њ–±–µ–љ –Ї –Ї–Њ–љ–≤–µ—А—Б–Є–Є –≤ 5ќ±-–і–Є–≥–Є–і—А–Њ—В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ –Є 17ќ≤-—Н—Б—В—А–∞–і–Є–Њ–ї –≤ —В–Ї–∞–љ—П—Е-–Љ–Є—И–µ–љ—П—Е. –Я–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–∞—П –Ї–Њ–љ–≤–µ—А—Б–Є—П —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞ –Є –µ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —В–Ї–∞–љ–Є-–Љ–Є—И–µ–љ–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—В—Б—П –њ—А–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ [1вАУ3].
–§–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є —П–Є—З–љ–Є–Ї–Њ–≤ –Є —А–µ–∞–ї–Є–Ј–∞—Ж–Є—П —Д–∞–Ї—В–Њ—А–Њ–≤ –±–µ—Б–њ–ї–Њ–і–Є—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П —Б –њ–Њ–Ј–Є—Ж–Є–є –љ–∞—А—Г—И–µ–љ–Є–є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Н—В–∞–ґ–µ–є —А–µ–≥—Г–ї—П—Ж–Є–Є, –∞ —В–∞–Ї–ґ–µ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –њ–∞—В—В–µ—А–љ–Њ–≤ –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Љ–Є—В–Њ—Е–Њ–љ–і—А–Є–∞–ї—М–љ–Њ–≥–Њ –Њ–±–Љ–µ–љ–∞ –Є —Б–љ–Є–ґ–µ–љ–Є—П —Б–µ–љ—Б–Є—В–Є–≤–љ–Њ—Б—В–Є —А–µ—Ж–µ–њ—В–Њ—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ –≤ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л—Е –Њ—А–≥–∞–љ–∞—Е [2, 3]. –Ґ–∞–Ї, –љ–∞–њ—А–Є–Љ–µ—А, –ї–∞—В–µ–љ—В–љ—Л–є –Є —В–Ї–∞–љ–µ–≤—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –љ–∞—А—Г—И–µ–љ–Є–µ–Љ —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –і—Л—Е–∞—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є —В–Ї–∞–љ–µ–є [4, 5]. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –≥–Є–њ–Њ–Ї—Б–Є–Є –≤ –Ї–ї–µ—В–Ї–∞—Е –Є —В–Ї–∞–љ—П—Е, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤, –Њ—В—А–∞–ґ–∞–µ—В—Б—П –љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–Є —Н–љ–і–Њ—В–µ–ї–Є—П —Б–Њ—Б—Г–і–Њ–≤ –Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –Њ–Њ—Ж–Є—В–Њ–≤ –Є –Њ–≤—Г–ї—П—Ж–Є–Є. –Я–Њ—Б–ї–µ–і–љ—П—П —П–≤–ї—П–µ—В—Б—П –Ї–≤–Є–љ—В—Н—Б—Б–µ–љ—Ж–Є–µ–є –±–∞–ї–∞–љ—Б–∞ –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ-–Ї–ї–µ—В–Њ—З–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, —Б–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–є —А–µ—Ж–µ–њ—Ж–Є–Є –Є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–≥–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П.
–Т—Л—П–≤–ї–µ–љ–Є–µ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –њ—А–Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е –і–Њ–±–∞–≤–Њ–Ї —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —Ж–µ–ї—М—О [6, 7]. –Р–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л–µ –Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —Б–≤–Њ–є—Б—В–≤–∞ –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–Њ–≤, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ –±–µ–ї–Ї–∞–Љ –≤ —Ж–Є–Ї–ї–µ –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ [6, 8], –Є–Ј–≤–µ—Б—В–љ—Л –і–∞–≤–љ–Њ. –Э–Њ—А–Љ–∞–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л —А–Њ—Б—В–∞, —Б–Њ–Ј—А–µ–≤–∞–љ–Є—П –Њ–Њ—Ж–Є—В–Њ–≤ –Є –ї—О—В–µ–Њ–ї–Є–Ј —Б–≤—П–Ј–∞–љ—Л —Б –і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т, –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –° –Є D, –Ї–Њ—В–Њ—А—Л–µ –≤—Л—Б—В—Г–њ–∞—О—В –Ї–Њ—Д–∞–Ї—В–Њ—А–∞–Љ–Є —Д–µ—А–Љ–µ–љ—В–Њ–≤, –Љ–µ–і–Є–∞—В–Њ—А–∞–Љ–Є —Б–Є—Б—В–µ–Љ—Л ¬Ђ–≥–Є–њ–Њ—В–∞–ї–∞–Љ—Г—Б вАФ –≥–Є–њ–Њ—Д–Є–Ј вАФ —П–Є—З–љ–Є–Ї–Є¬ї –Є –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л –Ј–∞ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –≥–Њ—А–Љ–Њ–љ–∞–Љ –≤ –Њ—А–≥–∞–љ–∞—Е-–Љ–Є—И–µ–љ—П—Е [9вАУ11]. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–љ–Њ–≥–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є [6, 8, 9, 12, 13], –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В—Л –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є—О —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –≥–Њ—А–Љ–Њ–љ–Њ–≤ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є —Г—Б—В—А–∞–љ–µ–љ–Є–µ –љ–∞—А—Г—И–µ–љ–Є–є –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ (–Э–Ь–¶). –Ґ–µ–љ–і–µ–љ—Ж–Є—П –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –±–µ—Б–њ–ї–Њ–і–Є—П –Є —Б–љ–Є–ґ–µ–љ–Є—О –Њ–≤–∞—А–Є–∞–ї—М–љ–Њ–≥–Њ —А–µ–Ј–µ—А–≤–∞ —П–Є—З–љ–Є–Ї–Њ–≤ –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –Ј–∞—Б—В–∞–≤–ї—П–µ—В –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Є—Б–Ї–∞—В—М –љ–Њ–≤—Л–µ –њ—Г—В–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Њ–Њ—Ж–Є—В–Њ- –Є —Д–Њ–ї–ї–Є–Ї—Г–ї–Њ–≥–µ–љ–µ–Ј–∞, —З—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ—А–Є–≤–ї–µ–Ї–∞–µ—В –≤–љ–Є–Љ–∞–љ–Є–µ –Є –Ї —Б—В—А–∞—В–µ–≥–Є–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ [14], –Ї–Њ—В–Њ—А—Л–µ —П–≤–ї—П—О—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –≤–∞–ґ–љ—Л—Е —Н—В–∞–њ–Њ–≤ –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞. –≠—В–Њ –≤—Б–µ —А–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ–Њ—В–љ–Њ—И–µ–љ–Є–є —П–Є—З–љ–Є–Ї–Њ–≤ –Є –љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –ґ–µ–љ—Й–Є–љ—Л.
–Ф–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–Њ–≤ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї –Њ–і–Є–љ –Є–Ј –њ—Г—Б–Ї–Њ–≤—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—П –і–Є—Б—Д—Г–љ–Ї—Ж–Є–є —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –°—А–µ–і–Є –њ—А–Є—З–Є–љ –Є—Е —А–∞–Ј–≤–Є—В–Є—П —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —Б—В—А–µ—Б—Б, –њ–µ—А–µ—Г—В–Њ–Љ–ї–µ–љ–Є–µ, –љ–Њ –Є –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞, –Є –≤ –±–Њ–ї—М—И–µ–є –Љ–µ—А–µ –µ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ. –°—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ—Л–µ –љ–µ–є—А–Њ—Н–љ–і–Њ–Ї—А–Є–љ–љ—Л–µ –Є –Њ–±–Љ–µ–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —Г –ґ–µ–љ—Й–Є–љ –≤–Ј–∞–Є–Љ–Њ-—Б–≤—П–Ј–∞–љ—Л —В–∞–Ї–ґ–µ —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –Њ—В–≤–µ—В–∞ [10, 15]. –Р–і–∞–њ—В–∞—Ж–Є—П –ґ–µ–љ—Б–Ї–Њ–≥–Њ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї —А–∞–Ј–ї–Є—З–љ—Л–Љ –љ–∞–≥—А—Г–Ј–Ї–∞–Љ —В—А–µ–±—Г–µ—В –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ –њ–Њ—В—А–µ–±–ї–µ–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Љ–Є–љ–µ—А–∞–ї–Њ–≤. –Э–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–µ –Ј–љ–∞–љ–Є—П –Є –љ–µ–і–Њ–њ–Њ–љ–Є–Љ–∞–љ–Є–µ –њ—А–Њ–±–ї–µ–Љ—Л –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ—А–Є–≤–Њ–і—П—В –Ї –љ–µ—Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–Љ—Г –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –≤–Є—В–∞–Љ–Є–љ–љ–Њ-–Љ–Є–љ–µ—А–∞–ї—М–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤, –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–µ–Љ—Г –і–Њ–ї–ґ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –≤—Л—П–≤–Є—В—М –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Б–Њ–і–µ—А–ґ–∞–љ–Є—П –љ–µ–Ї–Њ—В–Њ—А—Л—Е –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Љ–Є–Ї—А–Њ–љ—Г—В—А–Є–µ–љ—В–Њ–≤ –≤ –Ї—А–Њ–≤–Є —Г –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Я—А–Њ–≤–µ–і–µ–љ–Њ –њ—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –Њ–і–љ–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –≤ –Ї–Њ—В–Њ—А–Њ–µ –≤–Ї–ї—О—З–∞–ї–Є –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 18вАУ24 –ї–µ—В, –Њ–±—А–∞—В–Є–≤—И–Є—Е—Б—П –љ–∞ –њ—А–Є–µ–Љ –Ї –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥—Г –≤ –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Є–є –љ–∞—Г—З–љ–Њ-–Њ–±—А–∞–Ј–Њ–≤–∞—В–µ–ї—М–љ—Л–є —Ж–µ–љ—В—А –Ш–љ—Б—В–Є—В—Г—В–∞ –Љ–µ–і–Є—Ж–Є–љ—Л –Є –њ—Б–Є—Е–Њ–ї–Њ–≥–Є–Є –Т. –Ч–µ–ї—М–Љ–∞–љ–∞ –Э–Њ–≤–Њ—Б–Є–±–Є—А—Б–Ї–Њ–≥–Њ –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ —Б –ґ–∞–ї–Њ–±–∞–Љ–Є –љ–∞ –Э–Ь–¶ –Є–ї–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П –∞–љ–і—А–Њ–≥–µ–љ–Ј–∞–≤–Є—Б–Є–Љ–Њ–є –і–µ—А–Љ–Њ–њ–∞—В–Є–Є (–∞–Ї–љ–µ, —Б–µ–±–Њ—А–µ—П, –∞–ї–Њ–њ–µ—Ж–Є—П).
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П: –љ–∞—А—Г—И–µ–љ–Є—П –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞ (–Њ–ї–Є–≥–Њ–Љ–µ–љ–Њ—А–µ—П, –∞–љ–Њ–Љ–∞–ї—М–љ—Л–µ –Љ–∞—В–Њ—З–љ—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –і–Є—Б–Љ–µ–љ–Њ—А–µ—П), –Љ–Њ–ї–Њ–і–Њ–є –≤–Њ–Ј—А–∞—Б—В, –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ –і–Њ–±—А–Њ–≤–Њ–ї—М–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ –љ–∞ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П: –љ–∞–ї–Є—З–Є–µ –њ–Њ—А–Њ–Ї–Њ–≤ —А–∞–Ј–≤–Є—В–Є—П –њ–Њ–ї–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤, –Њ—Б—В—А—Л–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ–ї–Њ–≤—Л—Е –Њ—А–≥–∞–љ–Њ–≤, –±–µ—А–µ–Љ–µ–љ–љ–Њ—Б—В—М.
–Я—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј –Ї–ї–Є–љ–Є–Ї–Њ-–∞–љ–∞–Љ–љ–µ—Б—В–Є—З–µ—Б–Ї–Є—Е –Є –∞–љ—В—А–Њ–њ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е, –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є –≤ 1-—О —Д–∞–Ј—Г –Љ–µ–љ—Б—В—А—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–Є–Ї–ї–∞, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є (–§–°–У, –Ы–У, –њ—А–Њ–ї–∞–Ї—В–Є–љ, —Н—Б—В—А–∞–і–Є–Њ–ї, 17-–Ю–Э –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ, –Ф–У–≠–Р–°, —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ, –Ї–Њ—А—В–Є–Ј–Њ–ї), –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Њ—Д–Є–ї—П —Б –Њ—Ж–µ–љ–Ї–Њ–є —Г—А–Њ–≤–љ—П –≥–ї—О–Ї–Њ–Ј—Л, —Д–µ—А—А–Є—В–Є–љ–∞, —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л, –≤–Є—В–∞–Љ–Є–љ–∞ –Т12 –Є 25(OH)D —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є, –∞ —В–∞–Ї–ґ–µ —Г—А–Њ–≤–љ—П –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞ –Є —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤/–Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ –Ї—А–Њ–≤–Є [16], –Є–љ—В–µ—А–њ—А–µ—В–Є—А–Њ–≤–∞–љ—Л –і–∞–љ–љ—Л–µ —Н—Е–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–Њ–≤ –Љ–∞–ї–Њ–≥–Њ —В–∞–Ј–∞.
–Ф–ї—П –Њ–±—А–∞–±–Њ—В–Ї–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –њ—А–Њ–≥—А–∞–Љ–Љ–љ—Л–є –њ–∞–Ї–µ—В Statistics 18.0 for Windows (Biostat). –Э–Њ—А–Љ–∞–ї—М–љ–Њ—Б—В—М —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–Є—В–µ—А–Є—П –®–∞–њ–Є—А–Њ вАФ –£–Є–ї–Ї–∞. –Ч–љ–∞—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –≤–Є–і–µ —Б—А–µ–і–љ–µ–≥–Њ (M) –Є —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П (SD), –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –≤ –≥—А—Г–њ–њ–∞—Е –Њ–њ—А–µ–і–µ–ї—П–ї–Є –њ–Њ t-–Ї—А–Є—В–µ—А–Є—О –°—В—М—О–і–µ–љ—В–∞ –Є —Б—З–Є—В–∞–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–Љ–Є –њ—А–Є p<0,05. –†–∞–Ј–ї–Є—З–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Њ–і–љ–Њ—Д–∞–Ї—В–Њ—А–љ–Њ–≥–Њ –і–Є—Б–њ–µ—А—Б–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞, –Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞ вАФ –£–Є—В–љ–Є –Є –Ї—А–Є—В–µ—А–Є—П –§–Є—И–µ—А–∞.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П
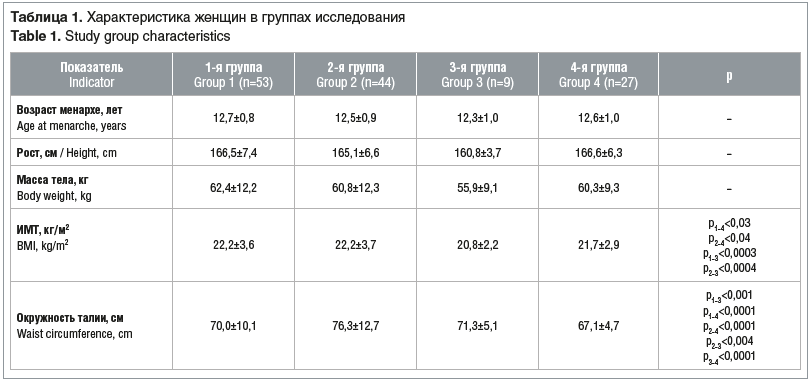
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Њ—И–ї–Њ 133 –ґ–µ–љ—Й–Є–љ—Л, –Ї–Њ—В–Њ—А—Л–µ –±—Л–ї–Є —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ—Л –≤ 4 –≥—А—Г–њ–њ—Л. –Я–µ—А–≤—Г—О –≥—А—Г–њ–њ—Г —Б–Њ—Б—В–∞–≤–Є–ї–Є –Љ–Њ–ї–Њ–і—Л–µ –ґ–µ–љ—Й–Є–љ—Л (n=53) —Б –Э–Ь–¶ (—И–Є—Д—А –њ–Њ –Ь–Ъ–С-10): –Њ–ї–Є–≥–Њ–Љ–µ–љ–Њ—А–µ—П N91.3, –∞–љ–Њ–Љ–∞–ї—М–љ—Л–µ –Љ–∞—В–Њ—З–љ—Л–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П N92.0-N92.2, –і–Є—Б–Љ–µ–љ–Њ—А–µ—П N94.4-N94.5); 2-—О –≥—А—Г–њ–њ—Г (n=44) вАФ –ґ–µ–љ—Й–Є–љ—Л —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –≥–Є–њ–µ—А–∞–љ–і—А–Њ–≥–µ–љ–Є–Є (–У–Р) (–∞–Ї–љ–µ –Є –њ–Њ—Б—В–∞–Ї–љ–µ, –∞–ї–Њ–њ–µ—Ж–Є—П, —Б–µ–±–Њ—А–µ—П) –Є –Э–Ь–¶; 3-—О –≥—А—Г–њ–њ—Г (n=9) вАФ –ґ–µ–љ—Й–Є–љ—Л —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –У–Р –±–µ–Ј –Э–Ь–¶, 4-—О –≥—А—Г–њ–њ—Г (n=27) вАФ –ґ–µ–љ—Й–Є–љ—Л –±–µ–Ј –У–Р –Є –Э–Ь–¶ (–њ—А–Њ—Е–Њ–і–Є–≤—И–Є–µ –Љ–µ–і-–Њ—Б–Љ–Њ—В—А, —Г—Б–ї–Њ–≤–љ–Њ –Ј–і–Њ—А–Њ–≤—Л–µ).
–°–Њ–≥–ї–∞—Б–љ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ —Д–Є–Ј–Є–Ї–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞–Є–±–Њ–ї—М—И–Є–є –Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ (–Ш–Ь–Ґ), —Е–Њ—В—П –Є –љ–∞—Е–Њ–і–Є–≤—И–Є–є—Б—П –≤ –њ—А–µ–і–µ–ї–∞—Е –љ–Њ—А–Љ–∞–ї—М–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ —Г –ґ–µ–љ—Й–Є–љ —Б –Э–Ь–¶ –≤ 1-–є –Є 2-–є –≥—А—Г–њ–њ–∞—Е (—В–∞–±–ї. 1). –Ш–Ь–Ґ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є—П–Љ, –Њ–і–љ–∞–Ї–Њ –Є–Ј–Љ–µ—А–µ–љ–Є–µ –Њ–Ї—А—Г–ґ–љ–Њ—Б—В–Є —В–∞–ї–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М –љ–∞–Є–±–Њ–ї—М—И–Є–µ –Ј–љ–∞—З–µ–љ–Є—П —Г –ґ–µ–љ—Й–Є–љ —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –У–Р. –≠—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –Њ—В—А–∞–ґ–∞–ї–Њ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –∞–±–і–Њ–Љ–Є–љ–∞–ї—М–љ–Њ–є –њ–Њ–і–Ї–Њ–ґ–љ–Њ–є –ґ–Є—А–Њ–≤–Њ–є —В–Ї–∞–љ–Є —Г –ґ–µ–љ—Й–Є–љ 2-–є –Є 3-–є –≥—А—Г–њ–њ. –•–∞—А–∞–Ї—В–µ—А–љ–Њ, —З—В–Њ —Г –Ј–і–Њ—А–Њ–≤—Л—Е –ґ–µ–љ—Й–Є–љ –Њ–Ї—А—Г–ґ–љ–Њ—Б—В—М —В–∞–ї–Є–Є –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –љ–∞–Є–Љ–µ–љ—М—И–µ–є.
–Т —Е–Њ–і–µ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–Є–љ–Њ–≤ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ —А–∞–Ј–ї–Є—З–∞–ї–Є—Б—М –≤ –≥—А—Г–њ–њ–∞—Е —Б—А–∞–≤–љ–µ–љ–Є—П (—В–∞–±–ї. 2). –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л –∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–ї–Є —Б —Г—З–µ—В–Њ–Љ —А–µ—Д–µ—А–µ–љ—Б–љ—Л—Е –љ–Њ—А–Љ–∞—В–Є–≤–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –ї–∞–±–Њ—А–∞—В–Њ—А–Є–Є, –≤ –Ї–Њ—В–Њ—А–Њ–є –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ. –Ю–і–љ–∞–Ї–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –Ы–У/–§–°–У –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –±–Њ–ї—М—И–µ, —Е–Њ—В—П –Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ, —Г –ґ–µ–љ—Й–Є–љ 2-–є –≥—А—Г–њ–њ—Л вАФ 1,2¬±1,3 (–Љ–µ–і–Є–∞–љ–∞ 0,9) –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Њ—Б—В–∞–ї—М–љ—Л–Љ–Є: –≤ 1-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е вАФ 1,16¬±2,8 (–Љ–µ–і–Є–∞–љ–∞ 0,7) –Є 1,0¬±0,4 (–Љ–µ–і–Є–∞–љ–∞ 0,7) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –°—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –њ—А–Њ–ї–∞–Ї—В–Є–љ–∞ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –±–ї–Є–ґ–µ –Ї –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–Љ, –љ–∞–Є–±–Њ–ї—М—И–Є–Љ –Њ–Ї–∞–Ј–∞–ї—Б—П —Г—А–Њ–≤–µ–љ—М –њ—А–Њ–ї–∞–Ї—В–Є–љ–∞ –≤ –≥—А—Г–њ–њ–µ –ґ–µ–љ—Й–Є–љ —Б –Э–Ь–¶ –Є –У–Р (—Б–Љ. —В–∞–±–ї. 2). –Ь–µ–ґ–і—Г —В–µ–Љ —Г –Ї–∞–ґ–і–Њ–є —З–µ—В–≤–µ—А—В–Њ–є –ґ–µ–љ—Й–Є–љ—Л 1, 2 –Є 3-–є –≥—А—Г–њ–њ –Њ–њ—А–µ–і–µ–ї–µ–љ–∞ –≥–Є–њ–µ—А–њ—А–Њ–ї–∞–Ї—В–Є–љ–µ–Љ–Є—П (–і–Є–∞–њ–∞–Ј–Њ–љ –Ј–љ–∞—З–µ–љ–Є–є –Њ—В 737 –і–Њ 1079 –Љ–Х–і/–ї): 25,8% –ґ–µ–љ—Й–Є–љ —Б –Э–Ь–¶ –Є –У–Р, 23,3% –Є 22,2% –ґ–µ–љ—Й–Є–љ 1-–є –Є 3-–є –≥—А—Г–њ–њ.

–£ –Ї–∞–ґ–і–Њ–є —В—А–µ—В—М–µ–є –ґ–µ–љ—Й–Є–љ—Л 1, 2 –Є 3-–є –≥—А—Г–њ–њ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Н—Е–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –≤ –Њ–±—К–µ–Љ–µ —П–Є—З–љ–Є–Ї–Њ–≤: —Г 41% –ґ–µ–љ—Й–Є–љ 1-–є –Є 2-–є –≥—А—Г–њ–њ –Є —Г 44% –ґ–µ–љ—Й–Є–љ 3-–є –≥—А—Г–њ–њ—Л —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л –њ—А–Є–Ј–љ–∞–Ї–Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П –Њ–±—К–µ–Љ–∞ —П–Є—З–љ–Є–Ї–Њ–≤ –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Є—Е —Б—В—А—Г–Ї—В—Г—А—Л (–Љ—Г–ї—М—В–Є—Д–Њ–ї–ї–Є–Ї—Г–ї—П—А–љ—Л–µ –Є–ї–Є –њ–Њ–ї–Є–Ї–Є—Б—В–Њ–Ј–љ—Л–µ —П–Є—З–љ–Є–Ї–Є). –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ —Н—Е–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –њ—А–Є–Ј–љ–∞–Ї–Є –∞–љ–Њ–≤—Г–ї—П—Ж–Є–Є –≤—Л—П–≤–ї–µ–љ—Л —Г 26,1, 32,3 –Є 35% –ґ–µ–љ—Й–Є–љ 1, 2 –Є 3-–є –≥—А—Г–њ–њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Р–љ–∞–ї–Є–Ј —Г—А–Њ–≤–љ—П –∞–љ–і—А–Њ–≥–µ–љ–љ—Л—Е —Б—В–µ—А–Њ–Є–і–Њ–≤ –≤ –≥—А—Г–њ–њ–∞—Е —Б—А–∞–≤–љ–µ–љ–Є—П –љ–µ –≤—Л—П–≤–Є–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є. –Ю–і–љ–∞–Ї–Њ –≤–Њ 2-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–µ —Г—А–Њ–≤–љ–Є –Ї–Њ—А—В–Є–Ј–Њ–ї–∞ –Є –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ, —З–µ–Љ –≤ 1-–є –≥—А—Г–њ–њ–µ, –Ј–љ–∞—З–µ–љ–Є—П 17-–Ю–Э –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є (—Б–Љ. —В–∞–±–ї. 2).
–Э–Є–Ј–Ї–Є–µ —Г—А–Њ–≤–љ–Є 25(OH)D —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г –ґ–µ–љ—Й–Є–љ 1, 2 –Є 3-–є –≥—А—Г–њ–њ. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї 4-–є –≥—А—Г–њ–њ—Л —Г—А–Њ–≤–љ–Є 25(OH)D –љ–µ –Њ–њ—А–µ–і–µ–ї—П–ї–Є—Б—М –Є–Ј-–Ј–∞ –Њ—В—Б—Г—В—Б—В–≤–Є—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–є. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–Є–Ј–Ї–Є–µ —Г—А–Њ–≤–љ–Є –≤–Є—В–∞–Љ–Є–љ–∞ D –Ї–Њ—А—А–µ–ї–Є—А—Г—О—В —Б —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є. –Я—А–Є –Є–Ј—Г—З–µ–љ–Є–Є —Г—А–Њ–≤–љ–µ–є –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П. –Т 4-–є –≥—А—Г–њ–њ–µ —Г –ґ–µ–љ—Й–Є–љ –±–µ–Ј –Э–Ь–¶ –Є –У–Р —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є (4,7¬±0,4 –Љ–Љ–Њ–ї—М/–ї) –Є –Њ–Ї—А—Г–ґ–љ–Њ—Б—В—М —В–∞–ї–Є–Є –±—Л–ї–Є –љ–∞–Є–Љ–µ–љ—М—И–Є–Љ–Є (—Б–Љ. —В–∞–±–ї. 1). –£ –ґ–µ–љ—Й–Є–љ 1-–є –Є 2-–є –≥—А—Г–њ–њ (p<0,001) –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –≤—Л—Б–Њ–Ї–Њ–љ–Њ—А–Љ–∞–ї—М–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є вАФ 5,1¬±0,5 –Є 5,2¬±0,9 –Љ–Љ–Њ–ї—М/–ї, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ 3-–є –Є 4-–є –≥—А—Г–њ–њ–∞—Е –Њ–љ–Є –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Љ–µ–љ—М—И–µ вАФ 4,9¬±0,3 –Є 4,7¬±0,4 –Љ–Љ–Њ–ї—М/–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Т —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л–µ (p<0,0002) —А–∞–Ј–ї–Є—З–Є—П –≤ —Г—А–Њ–≤–љ–µ –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞ –њ–ї–∞–Ј–Љ—Л –Ї—А–Њ–≤–Є, —Е–Њ—В—П –Ј–љ–∞—З–µ–љ–Є—П –±—Л–ї–Є —А–∞—Б—Ж–µ–љ–µ–љ—Л –Ї–∞–Ї –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–µ: —Г –ґ–µ–љ—Й–Є–љ 1-–є –≥—А—Г–њ–њ—Л 11,5¬±2,9 –Љ–Ї–Љ–Њ–ї—М/–ї, –≤–Њ 2-–є –Є 3-–є –≥—А—Г–њ–њ–∞—Е –љ–Є–ґ–µ вАФ 9,7¬±2,8 –Є 9,4 ¬±2,7 –Љ–Ї–Љ–Њ–ї—М/–ї —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–•–∞—А–∞–Ї—В–µ—А–љ–Њ, —З—В–Њ –≤ 1, 2 –Є 3-–є –≥—А—Г–њ–њ–∞—Е —Г –ґ–µ–љ—Й–Є–љ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –њ–Њ–≥—А–∞–љ–Є—З–љ–Њ –љ–Є–Ј–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –≤–Є—В–∞–Љ–Є–љ–∞ –Т12, —З—В–Њ –Љ–Њ–≥–ї–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ—П–Љ –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞ –Ї—А–Њ–≤–Є. –Ґ–∞–Ї–ґ–µ –≤ —Н—В–Є—Е –≥—А—Г–њ–њ–∞—Е –≤—Л—П–≤–ї–µ–љ—Л –љ–Є–Ј–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П —Д–µ—А—А–Є—В–Є–љ–∞ —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Ї—А–Њ–≤–Є, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—Й–Є–µ –Њ –ї–∞—В–µ–љ—В–љ–Њ–Љ –і–µ—Д–Є—Ж–Є—В–µ –ґ–µ–ї–µ–Ј–∞ [4, 5]. –£—А–Њ–≤–љ–Є —Д–µ—А—А–Є—В–Є–љ–∞ –Ї—А–Њ–≤–Є –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –њ–Њ–≥—А–∞–љ–Є—З–љ–Њ –љ–Є–Ј–Ї–Є–Љ–Є –≤–Њ –≤—Б–µ—Е —В—А–µ—Е –≥—А—Г–њ–њ–∞—Е –ґ–µ–љ—Й–Є–љ, –Є–Љ–µ—О—Й–Є—Е —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П. –Э–∞–Є–Љ–µ–љ—М—И–Є–µ –Ј–љ–∞—З–µ–љ–Є—П —Д–µ—А—А–Є—В–Є–љ–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л —Г –ґ–µ–љ—Й–Є–љ —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –У–Р (—В–∞–±–ї. 3).

–£—З–Є—В—Л–≤–∞—П –љ–∞–є–і–µ–љ–љ—Л–µ –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞ —Г –ґ–µ–љ—Й–Є–љ —Б –Э–Ь–¶, –±—Л–ї–∞ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–∞ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В—М –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –≥—А—Г–њ–њ —Б—А–∞–≤–љ–µ–љ–Є—П. –Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –≥–µ–Љ–Њ—Б—В–∞—В–Є—З–µ—Б–Ї–Є—Е —А–µ–∞–Ї—Ж–Є–є –Є–≥—А–∞—О—В —Д—А–∞–≥–Љ–µ–љ—В—Л –Љ–µ–Љ–±—А–∞–љ, –Њ—В–і–µ–ї—П–µ–Љ—Л–µ –њ—А–Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Є –∞–њ–Њ–њ—В–Њ–Ј–µ –Ї–ї–µ—В–Њ–Ї, –Њ–±–ї–∞–і–∞—О—Й–Є–µ –њ—А–Њ–Ї–Њ–∞–≥—Г–ї—П–љ—В–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –Ъ –љ–Є–Љ –Њ—В–љ–Њ—Б—П—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ —В—А–Њ–Љ–±–Њ—Ж–Є—В—Л –Є —Н–љ–і–Њ—В–µ–ї–Є–Њ—Ж–Є—В—Л, –љ–Њ –Є –Љ–Њ–љ–Њ—Ж–Є—В—Л [17]. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ–љ–љ–Њ –Љ–Њ–љ–Њ—Ж–Є—В—Л, —П–≤–ї—П—О—Й–Є–µ—Б—П –Є—Б—В–Њ—З–љ–Є–Ї–∞–Љ–Є –і–µ–љ–і—А–Є—В–љ—Л—Е –Ї–ї–µ—В–Њ–Ї, —Г—З–∞—Б—В–≤—Г—О—В –≤ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, –∞ –Ј–љ–∞—З–Є—В, –Є –µ–≥–Њ —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –Ї –±–∞–Ї—В–µ—А–Є–∞–ї—М–љ—Л–Љ –Є –≤–Є—А—Г—Б–љ—Л–Љ –Є–љ—Д–µ–Ї—Ж–Є—П–Љ. –Ю–±–љ–∞—А—Г–ґ–µ–љ–Њ, —З—В–Њ –љ–∞–Є–Љ–µ–љ—М—И–∞—П —З–Є—Б–ї–µ–љ–љ–Њ—Б—В—М –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є –љ–∞–±–ї—О–і–∞–ї–∞—Б—М —Г –ґ–µ–љ—Й–Є–љ 1-–є –Є 2-–є –≥—А—Г–њ–њ, –Є–Љ–µ—О—Й–Є—Е –Э–Ь–¶, вАФ 9,17¬±1,3% –Є 8,88¬±1,8% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –±√≥–ї—М—И–∞—П —З–Є—Б–ї–µ–љ–љ–Њ—Б—В—М –≤ 3-–є –Є 4-–є –≥—А—Г–њ–њ–∞—Е вАФ 9,5¬±1,7% –Є 9,7¬±1,8% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ.
–Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є –±—Л–ї–Њ —А–∞—Б—Б—З–Є—В–∞–љ–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤/–Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤, –Ї–Њ—В–Њ—А–Њ–µ –≤ 1-–є –Є 4-–є –≥—А—Г–њ–њ–∞—Е —Б–Њ—Б—В–∞–≤–Є–ї–Њ 3,8 –Є 3,9 —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ; –≤ 3-–є –≥—А—Г–њ–њ–µ вАФ 4,0; –≤–Њ 2-–є –≥—А—Г–њ–њ–µ –Њ–Ї–∞–Ј–∞–ї–Њ—Б—М –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ вАФ 4,4 (p<0,0001).
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я—А–Њ–≤–µ–і–µ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –≤—Л—П–≤–Є–ї –ї–∞—В–µ–љ—В–љ—Л–є –і–µ—Д–Є—Ж–Є—В –ґ–µ–ї–µ–Ј–∞, –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–µ —Г—А–Њ–≤–љ–Є –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –≤–Є—В–∞–Љ–Є–љ–∞ D, –љ–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ —Г –ґ–µ–љ—Й–Є–љ, –Є–Љ–µ–≤—И–Є—Е –њ—А–Њ—П–≤–ї–µ–љ–Є—П –У–Р –Є –Э–Ь–¶. –£ –Ї–∞–ґ–і–Њ–є —В—А–µ—В—М–µ–є –њ–∞—Ж–Є–µ–љ—В–Ї–Є 1, 2 –Є 3-–є –≥—А—Г–њ–њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –∞–љ–Њ–≤—Г–ї—П—Ж–Є—П, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–≤—И–∞—П—Б—П –љ–Є–Ј–Ї–Є–Љ–Є —Г—А–Њ–≤–љ—П–Љ–Є 25(OH)D, —Г—З–∞—Б—В–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –і–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –њ–Њ–≤—Л—И–µ–љ–Є–Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї –Ї –§–°–У –Є –≤ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е —Б–Є–љ—В–µ–Ј–∞ –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ [16, 18, 19].
–Т–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Њ–≤—Г–ї—П—Ж–Є–Є –Њ—В–≤–Њ–і—П—В –≤–Є—В–∞–Љ–Є–љ—Г –Т12 [8, 12, 14, 15], –њ–Њ–≥—А–∞–љ–Є—З–љ–Њ –љ–Є–Ј–Ї–Є–µ —Г—А–Њ–≤–љ–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Э–Ь–¶ –Є –У–Р. –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –≥–Є–њ–Њ–Ї—Б–Є—П, –≤–Њ–Ј–љ–Є–Ї—И–∞—П –љ–∞ —Д–Њ–љ–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Є –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –ґ–µ–ї–µ–Ј–∞, —Б–љ–Є–ґ–∞–µ—В –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ –≤—Б–µ—Е –Ј–≤–µ–љ—М–µ–≤ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –∞ —В–∞–Ї–ґ–µ –≤–ї–Є—П–µ—В –љ–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї—Г—О –Ї–Њ–љ–≤–µ—А—Б–Є—О –≥–Њ—А–Љ–Њ–љ–Њ–≤. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–Є –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т –Є –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞—А—Г—И–∞–µ—В—Б—П –Љ–µ—В–Є–ї–Є—А–Њ–≤–∞–љ–Є–µ –Ф–Э–Ъ, –Љ–Є–Ї—А–Њ–†–Э–Ъ –Є –≥–Є—Б—В–Њ–љ–Њ–≤ [11, 14, 20]. –Т–Є—В–∞–Љ–Є–љ –Т6, –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–Є–є —Н—Б—В—А–Њ–≥–µ–љ–Њ–њ–Њ–і–Њ–±–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ, –≤–ї–Є—П–µ—В –љ–∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ ќ≥-–∞–Љ–Є–љ–Њ–Љ–∞—Б–ї—П–љ–Њ–є –Ї–Є—Б–ї–Њ—В—Л, —Г—З–∞—Б—В–≤—Г—П —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –≤ –≤–Њ—Б–њ–Њ–ї–љ–µ–љ–Є–Є —Г—А–Њ–≤–љ—П –њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞. –Ф–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –°, –Т6 –Є —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є–љ–∞–Ї—В–Є–≤–∞—Ж–Є–Є —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –≤ –њ–µ—З–µ–љ–Є [11вАУ13, 20] –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –≥–Њ–љ–∞–і–Њ—В—А–Њ–њ–љ—Л—Е, –∞–љ—В–Є–Њ–Ї—Б–Є–і–∞–љ—В–љ—Л—Е –Є –љ–µ–є—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤.
–Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞—В—М –њ–µ—А–≤—Л–µ –њ—А–Њ—П–≤–ї–µ–љ–Є—П –Є–љ—Б—Г–ї–Є–љ–Њ—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є, –Ї–Њ—В–Њ—А—Л–µ –Њ—В—А–∞–ґ–∞—О—В—Б—П –љ–∞ —Б–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ—Б—В–Є –Њ–≤—Г–ї—П—В–Њ—А–љ—Л—Е —Ж–Є–Ї–ї–Њ–≤ –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –ґ–µ–љ—Й–Є–љ—Л. –£–≤–µ–ї–Є—З–µ–љ–Є–µ –Њ–Ї—А—Г–ґ–љ–Њ—Б—В–Є —В–∞–ї–Є–Є –Є –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ–µ–є –≥–ї—О–Ї–Њ–Ј—Л –Ї—А–Њ–≤–Є —Г –ґ–µ–љ—Й–Є–љ —Б –У–Р –Є –Э–Ь–¶ –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ—В–љ–µ—Б—В–Є –Є—Е –≤ –≥—А—Г–њ–њ—Г –≤—Л—Б–Њ–Ї–Њ–≥–Њ —А–Є—Б–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –∞–љ–Њ–≤—Г–ї—П—В–Њ—А–љ—Л—Е —Ж–Є–Ї–ї–Њ–≤.
–°—А–∞–≤–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ –Є –Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є –Ї—А–Њ–≤–Є, –∞ —В–∞–Ї–ґ–µ —А–∞—Б—З–µ—В —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є—П –ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤/–Љ–Њ–љ–Њ—Ж–Є—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Г—Б—В–∞–љ–Њ–≤–Є—В—М –љ–∞–Є–±–Њ–ї—М—И—Г—О –ї–∞–±–Є–ї—М–љ–Њ—Б—В—М –Є–Љ–Љ—Г–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г –ґ–µ–љ—Й–Є–љ —Б –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –У–Р –Є –Э–Ь–¶. –£ —В—А–µ—В–Є –Є–Ј –љ–Є—Е –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Н—Е–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Ї—А–Є—В–µ—А–Є–Є –∞–љ–Њ–≤—Г–ї—П—В–Њ—А–љ—Л—Е —Ж–Є–Ї–ї–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Є—Б—М –і–Є—Б—Д—Г–љ–Ї—Ж–Є–µ–є –≥–Є–њ–Њ—В–∞–ї–∞–Љ–Њ-–≥–Є–њ–Њ—Д–Є–Ј–∞—А–љ–Њ-–љ–∞–і–њ–Њ—З–µ—З–љ–Є–Ї–Њ–≤–Њ-—П–Є—З–љ–Є–Ї–Њ–≤–Њ–є –Њ—Б–Є.
–£ –ґ–µ–љ—Й–Є–љ —Б –У–Р –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –њ–Њ–≥—А–∞–љ–Є—З–љ—Л–µ —Г—А–Њ–≤–љ–Є –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞ –Ї—А–Њ–≤–Є, —З—В–Њ —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞–ї–Њ —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є—О –њ—А–Њ—П–≤–ї–µ–љ–Є–є —Б–Њ—Б—Г–і–Є—Б—В–Њ-—Н–љ–і–Њ—В–µ–ї–Є–∞–ї—М–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є. –У–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ –ї–µ–≥–Ї–Њ –≤—Б—В—Г–њ–∞–µ—В –≤ —Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ —А–µ–∞–Ї—Ж–Є–Є –Ј–∞ —Б—З–µ—В —Б—Г–ї—М—Д–≥–Є–і—А–Є–ї—М–љ–Њ–є –≥—А—Г–њ–њ—Л (SH-) —Б –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ–Љ –∞–≥—А–µ—Б—Б–Є–≤–љ—Л—Е –Ї–Є—Б–ї–Њ—А–Њ–і–љ—Л—Е —А–∞–і–Є–Ї–∞–ї–Њ–≤, –њ–Њ–≤—А–µ–ґ–і–∞—О—Й–Є—Е —В–Ї–∞–љ–Є [19, 21]. –Ф–µ—Д–Є—Ж–Є—В —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞ вАФ –∞–Љ–Є–љ–Њ–Ї–Є—Б–ї–Њ—В—Л, –Ї–Њ—В–Њ—А–∞—П —Б–Є–љ—В–µ–Ј–Є—А—Г–µ—В—Б—П –Є–Ј –Љ–µ—В–Є–Њ–љ–Є–љ–∞ –Є –Њ–±—А–∞—В–љ–Њ –Ї–Њ–љ–≤–µ—А—В–Є—А—Г–µ—В—Б—П –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –≥—А—Г–њ–њ—Л –Т. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Њ–њ—А–µ–і–µ–ї–µ–љ—Л –љ–Є–Ј–Ї–Є–µ –њ–Њ—А–Њ–≥–Њ–≤—Л–µ —Г—А–Њ–≤–љ–Є —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Г –ґ–µ–љ—Й–Є–љ —Б –Э–Ь–¶ –Є –У–Р. –§–Њ–ї–Є–µ–≤–∞—П –Ї–Є—Б–ї–Њ—В–∞ —П–≤–ї—П–µ—В—Б—П –њ–µ—А–µ–љ–Њ—Б—З–Є–Ї–Њ–Љ –Љ–µ—В–Є–ї—М–љ—Л—Е –≥—А—Г–њ–њ –Љ–µ–ґ–і—Г –Њ—А–≥–∞–љ–Є—З–µ—Б–Ї–Є–Љ–Є —Б–Њ–µ–і–Є–љ–µ–љ–Є—П–Љ–Є, –∞ —В–∞–Ї–ґ–µ —Г—З–∞—Б—В–≤—Г–µ—В –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ –ї–Є–њ–Є–і–Њ–≤ –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–Є –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞, —В–µ–Љ —Б–∞–Љ—Л–Љ –Њ–Ї–∞–Ј—Л–≤–∞—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б—В–µ–љ–Ї–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –≤ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л—Е –Њ—А–≥–∞–љ–∞—Е.
–£–≤–µ–ї–Є—З–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –љ–µ–Њ–±—К—П—Б–љ–Є–Љ–Њ–≥–Њ –±–µ—Б–њ–ї–Њ–і–Є—П –≤ –њ–Њ—Б–ї–µ–і–љ–µ–µ –≤—А–µ–Љ—П –Ј–∞—Б—В–∞–≤–ї—П–µ—В –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –Є—Б–Ї–∞—В—М –љ–Њ–≤—Л–µ –њ—Г—В–Є –≤–ї–Є—П–љ–Є—П –љ–∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –Њ–Њ—Ж–Є—В–Њ- –Є —Д–Њ–ї–ї–Є–Ї—Г–ї–Њ–≥–µ–љ–µ–Ј–∞. –Т —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ –≤–∞–ґ–љ–∞—П —А–Њ–ї—М –≤ –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –Њ–≤—Г–ї—П—Ж–Є–Є –Њ—В–≤–Њ–і–Є—В—Б—П –≤–Є—В–∞–Љ–Є–љ–∞–Љ –≥—А—Г–њ–њ—Л –Т (—Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В–µ, –Т6, –Т12), –Њ–і–љ–Є–Љ –Є–Ј –њ—А–Є–≤–ї–µ–Ї–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є —Б—З–Є—В–∞–µ—В—Б—П –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ–љ—Л—Е –Ї–Њ–Љ–њ–ї–µ–Ї—Б–Њ–≤ –і–ї—П —Г–ї—Г—З—И–µ–љ–Є—П –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П –≥–Њ—А–Љ–Њ–љ–Њ–≤ —Б —А–µ—Ж–µ–њ—В–Њ—А–љ—Л–Љ –∞–њ–њ–∞—А–∞—В–Њ–Љ –Ї–ї–µ—В–Њ–Ї. –Т–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –≤ —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Р–љ–≥–Є–Њ–≤–Є—В¬Ѓ, —Б–Њ–Ј–і–∞–љ–љ–Њ–≥–Њ –і–ї—П –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Є –ї–µ—З–µ–љ–Є—П –≥–Є–њ–µ—А–≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–µ–Љ–Є–Є, –≤–Ї–ї—О—З–∞—О—Й–µ–≥–Њ: —Д–Њ–ї–Є–µ–≤—Г—О –Ї–Є—Б–ї–Њ—В—Г –≤ —Б–њ–µ—Ж–Є–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –і–Њ–Ј–µ 5 –Љ–≥; –њ–Є—А–Є–і–Њ–Ї—Б–Є–љ–∞ –≥–Є–і—А–Њ—Е–ї–Њ—А–Є–і (–≤–Є—В–∞–Љ–Є–љ –Т6) 4 –Љ–≥ –Є —Ж–Є–∞–љ–Њ–Ї–Њ–±–∞–ї–∞–Љ–Є–љ (–≤–Є—В–∞–Љ–Є–љ –Т12) 0,006 –Љ–≥. –Э–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –і–≤—Г—Е –і–µ—Б—П—В–Ї–Њ–≤ –ї–µ—В –Р–љ–≥–Є–Њ–≤–Є—В¬Ѓ —И–Є—А–Њ–Ї–Њ –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ–±–ї–∞—Б—В—П—Е –Љ–µ–і–Є—Ж–Є–љ—Л, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –≤ –∞–Ї—Г—И–µ—А—Б—В–≤–µ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є, –і–Њ–Ї–∞–Ј–∞–≤ —Б–≤–Њ—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М. –Ф–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П —Б—В–∞–љ–і–∞—А—В–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ—А–Є–µ–Љ–∞ 1 —В–∞–±–ї–µ—В–Ї–Є –≤ –і–µ–љ—М –≤ —В–µ—З–µ–љ–Є–µ 1 –Љ–µ—Б. —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –Ї–Њ–љ—В—А–Њ–ї–µ–Љ —Г—А–Њ–≤–љ—П –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ–∞ –≤ –Ї—А–Њ–≤–Є. –Ґ–µ—А–∞–њ–Є—О –і–∞–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –Љ–Њ–ґ–љ–Њ –њ–Њ–≤—В–Њ—А—П—В—М, –Њ—А–Є–µ–љ—В–Є—А—Г—П—Б—М –љ–∞ —Г—А–Њ–≤–љ–Є —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –≤–Є—В–∞–Љ–Є–љ–∞ –Т12 —Г –ґ–µ–љ—Й–Є–љ —Б –Э–Ь–¶.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г –Љ–Њ–ї–Њ–і—Л—Е –ґ–µ–љ—Й–Є–љ —Б –Э–Ь–¶ –Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є –У–Р —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л –њ—А–Є–Ј–љ–∞–Ї–Є –ї–∞—В–µ–љ—В–љ–Њ–≥–Њ –і–µ—Д–Є—Ж–Є—В–∞ –ґ–µ–ї–µ–Ј–∞ –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤–Є—В–∞–Љ–Є–љ–∞ D, –∞ —В–∞–Ї–ґ–µ –њ–Њ–≥—А–∞–љ–Є—З–љ–Њ –љ–Є–Ј–Ї–Є–µ —Г—А–Њ–≤–љ–Є —Д–Њ–ї–Є–µ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –Є –≤–Є—В–∞–Љ–Є–љ–∞ –Т12 –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —З—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—З–Є—В—Л–≤–∞—В—М –њ—А–Є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –≤—Л—П–≤–ї—П–µ–Љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Є —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–Є –њ–ї–∞–љ–∞ –ї–µ—З–µ–љ–Є—П. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ –≤ —Н—В–Њ–є –≥—А—Г–њ–њ–µ –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є —Г—А–Њ–≤–љ–µ–є –≤–Є—В–∞–Љ–Є–љ–Њ–≤ –Є –Љ–Є–љ–µ—А–∞–ї–Њ–≤ –≤ –Ї—А–Њ–≤–Є –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є.
–°–≤–µ–і–µ–љ–Є–µ –Њ–± –∞–≤—В–Њ—А–µ:
–Ъ—Г–і–Є–љ–Њ–≤–∞ –Х–≤–≥–µ–љ–Є—П –У–µ–љ–љ–∞–і—М–µ–≤–љ–∞ вАФ –і.–Љ.–љ., –і–Њ—Ж–µ–љ—В –Ї–∞—Д–µ–і—А—Л –∞–Ї—Г—И–µ—А—Б—В–≤–∞ –Є –≥–Є–љ–µ–Ї–Њ–ї–Њ–≥–Є–Є –Ш–љ—Б—В–Є—В—Г—В–∞ –Љ–µ–і–Є—Ж–Є–љ—Л –Є –њ—Б–Є- —Е–Њ–ї–Њ–≥–Є–Є –Т. –Ч–µ–ї—М–Љ–∞–љ–∞ –Э–Њ–≤–Њ—Б–Є–±–Є—А—Б–Ї–Њ–≥–Њ –≥–Њ—Б—Г–і–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞; 630090, –≥. –Э–Њ–≤–Њ—Б–Є–±–Є—А—Б–Ї, —Г–ї. –Я–Є—А–Њ–≥–Њ–≤–∞, –і. 1; ORCID iD 0000-0002-1987-0343.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Ъ—Г–і–Є–љ–Њ–≤–∞ –Х–≤–≥–µ–љ–Є—П –У–µ–љ–љ–∞–і—М–µ–≤–љ–∞, e-mail: e.kudinova@g.nsu.ru.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –∞–≤—В–Њ—А –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 03.07.2022.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 26.07.2022.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 18.08.2022.
About the author:
Evgeniya G. Kudinova вАФ Dr. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology, V. Zelman Institute of Medicine and Psychology, Novosibirsk State University; 1, Pirogov str., Novosibirsk, 630090, Russian Federation; ORCID iD 0000-0002-1987-0343. Contact information: Evgeniya G. Kudinova, e-mail: e.kudinova@g.nsu.ru.
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 03.07.2022.
Revised 26.07.2022.
Accepted 18.08.2022.












