Введение
Хронические цервициты (ХЦ) занимают лидирующее место по распространенности среди цервикальной патологии, наблюдаются у абсолютного большинства (до 70%) пациенток гинекологического профиля [1–3], встречаются в любом возрасте, но чаще в репродуктивном, при восходящем пути инфицирования нарушая рецептивность к наиболее репродуктивно значимым гормонам как в шейке матки, так и в эндометрии [4, 5]. Наиболее значимыми предикторами ХЦ являются нарушения вагинального и цервикального микробиоценоза с ростом бактериальных ассоциаций на фоне нарушения локального иммунного гомеостаза [6, 7]. Длительное течение заболевания с этиологически подтвержденным бактериальным компонентом, в частности хламидийным, у женщин молодого репродуктивного возраста может обусловливать появление проблем репродукции, что придает этому заболеванию значительную медико-социальную и демографическую значимость [8, 9].
В условиях интегрального эффекта бактериальных ассоциаций возникает проблема в лечении ХЦ, обусловленная резистентностью микроорганизмов к проводимой терапии, возникающей на фоне злоупотребления антибиотиками с селекцией резидентной флоры, чрезвычайной сложностью проникновения антибиотиков к возбудителю через сформированные последним биопленки [10]. Следует отметить, что представленная в Клинических рекомендациях антибактериальная терапия направлена на лидирующих возбудителей, вызывающих заболевание в моноварианте, и не охватывает весь спектр персистирующих бактериальных ассоциаций, способствуя их длительному сохранению1. В результате на фоне локальной иммуносупрессии и длительно существующей бактериальной инвазии у латентно персистирующих вирусных инфекций появляется реальная возможность активации, создающей предпосылки для неопластической трансформации [11].
Для повышения клинической эффективности лечения ХЦ следует учитывать группу лидирующих возбудителей заболевания. По данным ряда исследователей, ведущими микроорганизмами, поражающими цервикальный эпителий, является хламидийная инфекция2. Не менее важную роль в снижении колонизационной резистентности играет и микоплазменная инфекция3,4. Однако постоянный рост в последние годы резистентности к антибиотикам диктует необходимость изменения унифицированных врачебных подходов к стандартной антибактериальной терапии, но с учетом актуальных клинических рекомендаций [12–14]. Разработка патогенетически обоснованной терапии требует проведения научного детерминантного поиска препаратов с низким уровнем резистентности к ним возбудителей, удобных в применении для повышения комплаентности, с высоким уровнем безопасности и хорошей переносимостью.В связи со сказанным выше обоснованным представляется изучение отечественного антибактериального препарата Минолексин® («АВВА РУС», Россия), капсулы для приема внутрь, содержащие 100 мг миноциклина — препарата из группы тетрациклинов5. К преимуществам препарата можно отнести следующие: более высокий антибактериальный эффект ввиду лучшего, в отличие от доксициклина, всасывания в ЖКТ и проникновения в ткани за счет более высокой (в 5 раз) липофильности; лучшее проникновение через утолщенный липидный слой мембран микроорганизмов; минимальные побочные эффекты в виде расстройств функции ЖКТ; минимальный риск формирования фоточувствительности кожи, отсутствие перекрестной резистентности с другими препаратами тетрациклиновой группы, показанной в ряде зарубежных исследований как in vitro, так и in vivo [15–17]. Актуальность изучения эффективности миноциклина при лечении ХЦ обусловлена и тем, что препарат эффективно работает в биопленках, образованных, в частности, микроорганизмами цервикальных биотопов: метициллин-резистентным золотистым стафилококком (MRSA), Candida auris, Candida albicans, Porphyromonas gingivalis, Tannerella forsythia, Fusobacterium nucleatum, Streptococcus gordonii, Actinomyces naeslundii, Parvimonas micra [18].
Цель исследования: оценить клиническую эффективность, безопасность терапии миноциклином и комплаентность пациенток с бактериально-ассоциированными ХЦ.
Материал и методы
Проведено многоцентровое наблюдательное проспективное клиническое исследование в параллельных группах в трех женских консультациях, медицинских центрах г. Екатеринбурга. Лабораторные исследования осуществлялись централизованно в лаборатории «СИТИЛАБ». Инструментальные исследования проводились на базе женских консультаций и медицинских центров.
По результатам обследования диагноз «хронический цервицит, ассоциированный с бактериальной инфекцией» поставлен 62 пациенткам, из которых 60 были включены в настоящее исследование. Критерии включения: возраст от 18 до 45 лет; рост, масса тела без ограничений; цитологически подтвержденный диагноз «хронический цервицит, ассоциированный с бактериальной инфекцией»; длительность заболевания от 1 до 3 мес.; отсутствие терапии до отбора в исследование в течение 1 мес.; раса, национальность, профессия, регион проживания — без ограничений; подписанное информированное согласие. Критерии невключения: беременность; лактация; наличие генитальных вирусных инфекций; нарушение гистоархитектоники шейки матки; наличие предраковой патологии шейки матки (неоплазии); наличие декомпенсированной экстрагенитальной и гинекологической патологии; отказ от информированного согласия; онкологическая патология гениталий; аллергическая реакция на компоненты препаратов. Критерии исключения: нарушение режима применения лекарственных препаратов; отказ от проведения запланированных по протоколу исследований, развитие аллергических реакций на лекарственные препараты, принимаемые в соответствии с протоколом исследования.
Обследование включало в себя: сбор анамнеза; анализ течения заболевания; общеклиническое исследование; рН-метрию влагалища; микроскопическое исследование мазков из влагалища и цервикального канала; ПЦР на вирус простого герпеса 1-го и 2-го типа, на вирус папилломы человека, хламидийную, микоплазменную инфекцию из цервикального канала (согласно Клиническим рекомендациям Минздрава России) — перед назначением и после проведенного лечения, а также цитоскрининг. Молекулярно-биологическое исследование вагинальной микробиоты осуществлялось методом ПЦР с детекцией результатов в режиме реального времени и использованием реагентов Фемофлор-13 (ООО «НПО ДНК-Технология»). Оценку микробиоценоза проводили согласно технологии по применению теста Фемофлор-13: нормоценоз (абсолютный нормоценоз) — вариант биоценоза, при котором доля нормофлоры в его составе была более 90%, количество Ureaplasma spp., Mycoplasma spp., Candida spp. — менее 104 гэ/мл; условный нормоценоз — вариант биоценоза, при котором доля нормофлоры в его составе была более 90%, количество Ureaplasma spp., Mycoplasma spp., Candida spp. — более 104 гэ/мл; умеренный (аэробный или анаэробный) дисбиоз — вариант биоценоза, при котором доля лактобактерий в его составе определялась в пределах 20–80% и была увеличена доля аэробов или анаэробов; выраженный (аэробный, анаэробный или смешанный) дисбиоз — вариант биоценоза, в составе которого доля аэробов или анаэробов была более 20%, а доля лактобактерий — менее 20% [19]. Инструментальное обследование включало в себя проведение кольпоскопии перед терапией и через 30 дней после ее начала.
Распределение пациенток в группы для назначения терапии проводилось рандомизированно — методом случайной выборки. В 1-ю группу вошла 31 пациентка, которым с 1-го дня после установления диагноза назначался антибактериальный препарат миноциклин (Минолексин®) по 100 мг 2 р/сут утром и вечером, независимо от приема пищи, в течение 10 дней + антимикотик-пребиотик Экофуцин® по 1 суппозиторию 1 р/сут интравагинально 6 дней для профилактики кандидозного вульвовагинита, начиная с 3-го дня антибиотикотерапии. Во 2-ю группу вошли 29 пациенток, которым также сразу после установки диагноза назначался препарат доксициклин 100 мг 2 р/сут 10 дней + антимикотик-пребиотик Экофуцин® по 1 суппозиторию 1 р/сут интравагинально 6 дней, начиная с 3-го дня антибиотикотерапии, для профилактики кандидозного вульвовагинита.
На протяжении всего периода лечения пациенткам давалась рекомендация воздерживаться от половых контактов. Контроль клинико-лабораторной эффективности осуществлялся через 10 дней от начала терапии, клинико-инструментальной эффективности — через 30 дней после начала терапии. Оценка переносимости лечения и комплаентности осуществлялась путем анкетирования пациенток по 5-балльной визуально-аналоговой шкале (ВАШ): 1 балл означал плохую переносимость, 2 балла — хорошую ближе к плохой, 3 балла — хорошую, 4 балла — хорошую ближе к отличной, 5 баллов — отличную переносимость препарата. Для оценки профиля безопасности фиксировали все нежелательные явления (НЯ) на фоне применения терапии с их описанием.
Статистическую обработку данных проводили с помощью программного пакета SPSS Statistics версии 20.0. Качественные показатели представлены как n — число наблюдений, Р — относительный показатель (%), mр — ошибка репрезентативности относительного показателя. Статистическую значимость различий проверяли с помощью критерия χ2 Пирсона. Критический уровень значимости (p) при проверке статистических гипотез принимался равным значениям <0,05.
Результаты и обсуждение
На этапе включения в исследование в 24 (40,0±3,2%) наблюдениях жалобы отсутствовали. Остальные пациентки предъявляли жалобы, стандартные для проявлений воспалительного процесса репродуктивного тракта, включая патологические выделения из половых путей, кровомазание, зуд, жжение. Клиническая картина при осмотре в зеркалах характеризовалась патологическими выделениями из половых путей и гиперемией как цервикального (у 100% пациенток), так и вагинального эпителия у большинства пациенток — 33 (55,0±4,7%) и свидетельствовало о вовлечении влагалища в инфекционный процесс.
Оценка цервико-вагинального микробиоценоза по результатам теста Фемофлор-13 перед началом лечения демонстрировала доминирование умеренного и выраженного дисбиоза практически у всех пациенток со значительным преимуществом выраженного дисбиоза при сравнении с показателями «абсолютного нормоценоза», «условного нормоценоза» и «умеренного дисбиоза» (χ2=12,821, р=0,0001; χ2=12,821, р=0,0001; χ2=10,429, р=0,0002 соответственно). Спектр микроорганизмов перед проведением лечения был представлен у абсолютного большинства пациенток ассоциациями микроорганизмов как анаэробных, так и аэробных, с доминированием аэробных, в соотношении 2:3. Доминирующим возбудителем была Chlamidia trachomatis, которая выявлялась у каждой третьей пациентки. В единичных случаях встречались возбудители микоплазменной (Micoplasma genitalium), трихомонадной и гонококковой инфекции. У всех пациенток до лечения в заключении цитолога отмечалась значительная неспецифическая воспалительная реакция в экзоцервиксе. По результатам кольпоскопии у всех пациенток имели место гиперемия экзоцервикса, расширенные сосуды, в 63% случаев на фоне эктопии шейки матки.
Обе группы были сопоставимы по возрасту, соматической патологии, паритету, гинекологическим заболеваниям (миома, эндометриоз, синдром поликистозных яичников). Через 10 дней антибактериальной терапии почти все пациентки обеих групп не предъявляли жалоб, что значительно отличалось от результатов опроса до терапии. У единичных пациенток остались жалобы на выделения и кровомазание. Различия между 1-й и 2-й группами по параметрам «нет жалоб», «выделения», «кровомазание» оказались статистически незначимыми (χ2=1,523, р=0,846; χ2=1,835, р=0,952; χ2=1,952, р=0,951 соответственно).
При осмотре после антибактериальной терапии гипер-емия экзоцервикса и вагинального эпителия наблюдалась лишь в единичных случаях как в 1-й, так и во 2-й группе — 3,2±0,1% и 6,9±1,1% соответственно, что значимо меньше, чем до терапии (χ2=13,274, р=0,0001), со статистически незначимыми межгрупповыми различиями. Выделения из цервикального канала практически не наблюдались в обеих группах в сравнении с осмотром до терапии (χ2=14,823, р=0,0001; χ2=12,491, р=0,002 соответственно).
В результате терапии Минолексином и доксициклином значительно возросло количество пациенток с нормоценозом (абсолютным и условным) (р=0,0001 и р=0,0002 для 1-й и 2-й группы соответственно), не выявлено пациенток с выраженным дисбиозом в обеих группах, умеренный дисбиоз обнаружен лишь в единичных наблюдениях (р=0,0001 и р=0,0001 в 1-й и 2-й группе соответственно). Однако межгрупповые различия оказались статистически значимыми по показателю «абсолютный нормоценоз» теста Фемофлор-13 (табл. 1).

Присутствие микроорганизмов после антибактериальной терапии было выявлено в единичных случаях в виде хламидийной инфекции после миноциклина и в значительно большем количестве после доксициклина, меж-групповые различия значимы (χ2=11,276, р=0,00001). Количество пациенток со смешанной флорой в виде ассоциаций микроорганизмов значительно снизилось в обеих группах, более выраженно в 1-й группе по сравнению со 2-й группой (χ2=11,314, р=0,00001; χ2=10,246, р=0,0001 соответственно) (табл. 2). Полученные результаты могут свидетельствовать о высокой эффективности миноциклина для эрадикации возбудителей уровагинального дисбиоза, что согласуется с данными ряда зарубежных исследований [18].

Доля пациенток с отсутствием клинических субъективных и объективных признаков ХЦ по данным осмотра, лабораторного и инструментального обследования при динамическом наблюдении (через 30 дней от начала терапии) составила абсолютное большинство, однако различающееся в группах. Так, в 1-й группе пациенток без субъективных и объективных признаков цервицита было 27 (87,1±8,2%). У 4 пациенток выявлены признаки метапластического эпителия по результатам кольпоскопии, с незначительной воспалительной реакцией (расширенные кровеносные сосуды) по данным цитологического исследования (нейтрофилы в небольшом количестве). Во 2-й группе пациенток без субъективных и объективных признаков цервицита было большинство — 19 (65,5±6,1%), однако это меньше, чем в 1-й группе (χ2=11,235, р=0,0002), что свидетельствовало о более высокой клинической эффективности Минолексина.
Через 30 дней после проведенного курса лечения у 28 (90,3±8,2%) пациенток 1-й группы в мазке на онкоцитологию отсутствовала воспалительная реакция. Во 2-й группе на этом же сроке отсутствие воспалительной реакции в мазке на онкоцитологию констатировали у 23 (79,3±7,1%) пациенток. Полученные данные свидетельствуют о высокой клинической эффективности обоих препаратов, однако разница между группами оказалась статистически значимой (χ2=12,325, р=0,0002).
Через 30 дней после терапии оригинальный сквамозный эпителий выявлен у 27 (87,1±8,1%) пациенток 1-й группы и у 19 (65,5±5,8%) пациенток 2-й группы (χ2=11,235, р=0,0002).
Доля пациенток с отличной и хорошей переносимостью (по ВАШ) в группе миноциклина составила 96,8±8,8%, в то время как в группе доксициклина — 82,9% (χ2=12,382, р=0,0001). Полученные данные об отличной переносимости миноциклина совпадают с результатами зарубежных исследований по применению препарата в дерматовенерологии [20].
Пациентки 1-й группы отметили более высокую приверженность препарату (Минолексин®) по сравнению с пациентками 2-й группы (доксициклин), доля пациенток с оценкой 5 баллов в 1-й группе составила 80,6±7,2% (n=25), во 2-й — 62,1±5,5% (n=18) (χ2=7,275, р=0,001).
Частота развития НЯ на фоне приема миноциклина не превышала 3,2% (единичные случаи головокружения, диспепсических расстройств и головной боли), что значительно отличалось от результатов приема доксициклина. В целом НЯ зарегистрированы у 3 (9,7±0,7%) пациенток 1-й группы и у 15 (51,7±4,8%) пациенток 2-й группы (χ2=10,328, р=0,0001) (см. рисунок). Ни в одном случае не потребовалось отмены препарата, все пациентки завершили исследование. Минимальное количество НЯ на фоне приема Минолексина c высокой приверженностью пациенток данной терапии соответствовало результатам ряда отечественных и зарубежных исследований по миноциклину [21, 22].
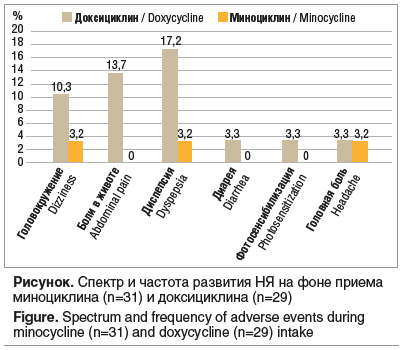
На фоне применения Экофуцина при антибактериальной терапии в обеих группах проявлений кандидозной инфекции не отмечалось.
Заключение
Учитывая, что миноциклин (Минолексин®) обладает рядом преимуществ — широким спектром действия, активностью в отношении грамположительных и грамотрицательных бактерий, хламидий, микоплазм, условно-патогенной флоры, низким уровнем резистентности микроорганизмов к нему, отсутствием перекрестной резистентности с другими препаратами тетрациклинового ряда, высокой липофильностью и высокими концентрациями в тканях, активностью в биопленках, возможностью назначения при почечной недостаточности (поскольку он выводится через гепатобилиарную cистему и пищеварительный тракт), а также высокой клинической эффективностью с низким уровнем побочных эффектов и высокой приверженностью терапии, — данный системный антибиотик группы тетрациклинов может рассматриваться как препарат выбора для антибактериальной терапии пациенток с ХЦ.
1Клинические рекомендации по диагностике и лечению заболеваний, сопровождающихся патологическими выделениями из половых путей женщин. М.: РОАГ; 2019.
2Клинические рекомендации Минздрава России. Хламидийная инфекция. 2021. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/schema/194_1 (дата обращения: 15.11.2023).
3Клинические рекомендации Минздрава России. Урогенитальные заболевания, вызванные Mycoplasma genitalium. 2021. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/schema/216_1 (дата обращения: 15.11.2023).
4Клинические рекомендации Минздрава России. 2021. Воспалительные болезни шейки матки, влагалища и вульвы. (Электронный ресурс.) URL: https://www.elevit.ru/sites/g/files/vrxlpx38816/files/2022-10/Воспалительные%20болезни%20шейки%20матки%2C.pdf. (дата обращения: 15.11.2023).
5Инструкция по медицинскому применению лекарственного препарата Минолексин® (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=cccf5ba1-4b64-463a-a038-8133ace1a797 (дата обращения: 15.11.2023).
Сведения об авторах:
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заслуженный врач РФ, заведующая кафедрой акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Кононова Ирина Николаевна — д.м.н., доцент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; заместитель директора ООО «МЦДПО»; 125424, Россия, г. Москва, Волоколамское ш., д. 73, оф. 252; ORCID iD 0000-0003-3483-9464.
Карева Елена Николаевна — д.м.н., профессор кафедры молекулярной фармакологии и радиобиологии им. П.В. Сергеева РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; профессор кафедры фармакологии лечебного факультета ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119991, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-9441-3468.
Шмакова Надежда Александровна — врач акушер-гинеколог первой категории ООО МЦ «АНГИО ЛАЙН ПЛЮС»; 620027, Россия, г. Екатеринбург, ул. Большакова, д. 95; ORCID iD 0000-0002-4797-3876.
Грабан Ирина Владимировна — врач акушер-гинеколог высшей категории ООО Медицинский центр «Эдельвейс»; 624000, Россия, г. Арамиль, ул. 1 Мая, д. 2а.
Огурцова Татьяна Александровна — акушер-гинеколог высшей категории ГБУЗ СО «ЕКПЦ»; 620137, Россия, г. Екатеринбург, ул. Комсомольская, д. 9; ORCID iD 0000-0001-6180-0288.
Контактная информация: Кононова Ирина Николаевна, e-mail: irkonmed@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 26.10.2023.
Поступила после рецензирования 10.11.2023.
Принята в печать 28.11.2023.
About the authors:
Yuliya E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-7830-2290.
Irina N. Kononova — Dr. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Deputy Director, LLC "Interregional Center for Continuing Professional Education"; office 252, 73, Volokolamskoe Hwy, Moscow, 125424, Russian Federation; ORCID iD 0000-0003-3483-9464.
Elena N. Kareva — Dr. Sc. (Med.), Professor of the P.V. Sergeev Department of Molecular Pharmacology and Radiobiology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; Professor of the Department of Pharmacology of the Medical Faculty, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, Build. 2, Trubetskaya str., Moscow, 119991, Russian Federation; ORCID iD 0000-0002-9441-3468.
Nadezhda A. Shmakova — obstetrician-gynecologist of the first category, LLC Medical Center "ANGIO LINE PLUS"; 95, Bolshakova str., Yekaterinburg, 620027, Russian Federation; ORCID iD 0000-0002-4797-3876.
Irina V. Graban — obstetrician-gynecologist of the highest category, LLC Medical Center "Edelweiss"; 3a, 1st of May str., Aramil, 624000, Russian Federation.
Tatiana A. Ogurtsova — obstetrician-gynecologist of the highest category, Yekaterinburg Clinical Perinatal Center; 9, Komsomolskaya str., Yekaterinburg, 620137, Russian Federation; ORCID iD 0000-0001-6180-0288.
Contact information: Irina N. Kononova, e-mail: irkonmed@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 26.10.2023.
Revised 10.11.2023.
Accepted 28.11.2023.












