–í–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ
–†–į–∑–≤–ł—ā–ł–Ķ –ĺ—Ā—ā—Ä–ĺ–≥–ĺ –ł–Ĺ—Ą–į—Ä–ļ—ā–į –ľ–ł–ĺ–ļ–į—Ä–ī–į (–ė–ú) –Ķ–∂–Ķ–≥–ĺ–ī–Ĺ–ĺ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É–Ķ—ā—Ā—Ź –Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ —É 7 –ľ–Ľ–Ĺ —á–Ķ–Ľ–ĺ–≤–Ķ–ļ –Ĺ–į –Ĺ–į—ą–Ķ–Ļ –Ņ–Ľ–į–Ĺ–Ķ—ā–Ķ [1, 2]. –ü—Ä–ł —ć—ā–ĺ–ľ —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –í—Ā–Ķ–ľ–ł—Ä–Ĺ–ĺ–Ļ –ĺ—Ä–≥–į–Ĺ–ł–∑–į—Ü–ł–ł –∑–ī—Ä–į–≤–ĺ–ĺ—Ö—Ä–į–Ĺ–Ķ–Ĺ–ł—Ź —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ —É–ľ–Ķ–Ĺ—Ć—ą–į–Ķ—ā—Ā—Ź —Ā —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł, –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –∑–į —Ā—á–Ķ—ā —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—Ź –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ļ–ĺ–ľ–Ņ–ĺ–Ĺ–Ķ–Ĺ—ā–į [3]. –ü–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–≥–ĺ –†–Ķ–≥–ł—Ā—ā—Ä–į –ĺ—Ā—ā—Ä–ĺ–≥–ĺ –ł–Ĺ—Ą–į—Ä–ļ—ā–į –ľ–ł–ĺ¬≠–ļ–į—Ä–ī–į, —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–ł—Ä—É—é—Č–Ķ–≥–ĺ –≤ –≥. –Ę–ĺ–ľ—Ā–ļ–Ķ —Ā 1984 –≥., –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ—Ć–Ĺ–į—Ź –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ĺ–į—Ö–ĺ–ī—Ź—Č–ł—Ö—Ā—Ź –≤ –Ņ—Ä–ĺ—Ą–ł–Ľ—Ć–Ĺ–ĺ–ľ —Ā—ā–į—Ü–ł–ĺ–Ĺ–į—Ä–Ķ —Ā –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć—é –ļ—Ä—É–≥–Ľ–ĺ—Ā—É—ā–ĺ—á–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –ł–Ĺ–≤–į–∑–ł–≤–Ĺ–ĺ–Ļ –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł–ļ–ł –ł –ł–Ĺ—ā–Ķ—Ä–≤–Ķ–Ĺ—Ü–ł–ĺ–Ĺ–Ĺ—č—Ö –≤–ľ–Ķ—ą–į—ā–Ķ–Ľ—Ć—Ā—ā–≤, –∑–į –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł–Ķ 30 –Ľ–Ķ—ā —É–ľ–Ķ–Ĺ—Ć—ą–ł–Ľ–į—Ā—Ć –Ņ—Ä–ł–Ī–Ľ–ł–∑–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ĺ–į 6% (—Ā 15% –≤ 1984 –≥. –ī–ĺ 8,9% –≤ 2016 –≥.) [4]. –í–ľ–Ķ—Ā—ā–Ķ —Ā —ā–Ķ–ľ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ —Ā–ľ–Ķ—Ä—ā–Ĺ–ĺ—Ā—ā–ł –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –ė–ú –∑–į–ļ–ĺ–Ĺ–ĺ–ľ–Ķ—Ä–Ĺ–ĺ –Ņ—Ä–ł–≤–ĺ–ī–ł—ā –ļ —Ā—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–ľ—É —É–≤–Ķ–Ľ–ł—á–Ķ–Ĺ–ł—é —á–ł—Ā–Ľ–į –Ľ—é–ī–Ķ–Ļ, –≤—č–∂–ł–≤—ą–ł—Ö –Ņ–ĺ—Ā–Ľ–Ķ –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ļ –ļ–į—ā–į—Ā—ā—Ä–ĺ—Ą—č, –ļ–ĺ—ā–ĺ—Ä—č–Ķ —Ā–ĺ—Ā—ā–į–≤–Ľ—Ź—é—ā –ĺ—Ā–ĺ–Ī—É—é —Ā–ĺ—Ü–ł–į–Ľ—Ć–Ĺ–ĺ-–ľ–Ķ–ī–ł—Ü–ł–Ĺ—Ā–ļ—É—é –≥—Ä—É–Ņ–Ņ—É. –í –Ņ–ĺ—Ā—ā¬≠–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ —Ā–ĺ—Ö—Ä–į–Ĺ—Ź–Ķ—ā—Ā—Ź –≤—č—Ā–ĺ–ļ–į—Ź –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –ĺ—ā –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ī–ĺ–Ľ–Ķ–∑–Ĺ–ł —Ā–Ķ—Ä–ī—Ü–į (–ė–Ď–°), –ī–ĺ—Ā—ā–ł–≥–į—Ź, –Ņ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä—č, 15% –≤ –Ņ–Ķ—Ä–≤—č–Ļ –≥–ĺ–ī –ł 35% –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ—Ā–Ľ–Ķ–ī—É—é—Č–ł—Ö 5 –Ľ–Ķ—ā [5‚Äď8]. –í–į–∂–Ĺ–ĺ –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ, –Ņ–ĺ–ľ–ł–ľ–ĺ –≤—č—Ā–ĺ–ļ–ĺ–Ļ –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—ā–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ł—Ā—Ö–ĺ–ī–į, –≤ –ļ–ĺ–≥–ĺ—Ä—ā–Ķ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ—č—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ĺ–Ķ –ľ–Ķ–Ĺ–Ķ–Ķ –∑–Ĺ–į—á–ł–ľ—č–ľ –ĺ–ļ–į–∑—č–≤–į–Ķ—ā—Ā—Ź –ł —Ä–į–∑–≤–ł—ā–ł–Ķ —ā—Ź–∂–Ķ–Ľ—č—Ö, –∑–į—á–į—Ā—ā—É—é –∂–ł–∑–Ĺ–Ķ—É–≥—Ä–ĺ–∂–į—é—Č–ł—Ö —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ-—Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö —Ā–ĺ–Ī—č—ā–ł–Ļ (–°–°–°), —ā–į–ļ–ł—Ö –ļ–į–ļ –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ—č–Ļ –ė–ú, –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ļ –ł–Ľ–ł —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł, –≤–ĺ–∑–Ĺ–ł–ļ–Ĺ–ĺ–≤–Ķ–Ĺ–ł–Ķ –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ —Ä–ł—ā–ľ–į —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł. –£–ļ–į–∑–į–Ĺ–Ĺ—č–Ķ —Ā–ĺ–Ī—č—ā–ł—Ź –Ņ—Ä–ł–≤–ĺ–ī—Ź—ā –ļ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ—É —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł—é –ļ–į—á–Ķ—Ā—ā–≤–į –∂–ł–∑–Ĺ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –į —ā–į–ļ–∂–Ķ –ļ –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ—č–ľ –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł—Ź–ľ –ł –ī–ĺ—Ä–ĺ–≥–ĺ—Ā—ā–ĺ—Ź—Č–Ķ–ľ—É –Ľ–Ķ—á–Ķ–Ĺ–ł—é [9, 10].
–ě–Ņ—ā–ł–ľ–ł–∑–į—Ü–ł—Ź –Ľ–Ķ—á–Ķ–Ī–Ĺ–ĺ-–Ņ—Ä–ĺ—Ą–ł–Ľ–į–ļ—ā–ł—á–Ķ—Ā–ļ–ł—Ö –ľ–Ķ—Ä–ĺ–Ņ—Ä–ł—Ź—ā–ł–Ļ –ī–Ľ—Ź –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł—Ö –ė–ú, –≤–į–∂–Ĺ–į –≤ —Ü–Ķ–Ľ—Ź—Ö –Ņ—Ä–Ķ–ī–ĺ—ā–≤—Ä–į—Č–Ķ–Ĺ–ł—Ź –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–°, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≥—Ä—É–Ņ–Ņ —Ä–ł—Ā–ļ–į, –Ĺ—É–∂–ī–į—é—Č–ł—Ö—Ā—Ź –≤ –ł–Ĺ—ā–Ķ–Ĺ—Ā–ł–≤–Ĺ–ĺ–Ļ –ľ–Ķ–ī–ł—Ü–ł–Ĺ—Ā–ļ–ĺ–Ļ –Ņ–ĺ–ľ–ĺ—Č–ł. –ü—Ä–ł —ć—ā–ĺ–ľ –≤–į–∂–Ĺ–ĺ —ā–į–ļ–∂–Ķ –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–ł—ā—Ć –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ—É—é –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ľ–Ķ—á–Ķ–Ĺ–ł—é. –°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä—č –Ĺ–į–ł–Ī–ĺ–Ľ–Ķ–Ķ –ī–ĺ—Ā—ā—É–Ņ–Ĺ—č–ľ–ł –Ņ—Ä–Ķ–ī–ł–ļ—ā–ĺ—Ä–į–ľ–ł –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į —Ź–≤–Ľ—Ź—é—ā—Ā—Ź —Ā–Ľ–Ķ–ī—É—é—Č–ł–Ķ —Ą–į–ļ—ā–ĺ—Ä—č: —Ā–ĺ—Ö—Ä–į–Ĺ—Ź—é—Č–į—Ź—Ā—Ź –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć –≤ –≤–ł–ī–Ķ —Ā—ā–Ķ–Ĺ–ĺ–ļ–į—Ä–ī–ł–ł –Ĺ–į–Ņ—Ä—Ź–∂–Ķ–Ĺ–ł—Ź –≤—č—Ā–ĺ–ļ–ĺ–≥–ĺ —Ą—É–Ĺ–ļ—Ü–ł–ĺ–Ĺ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ļ–Ľ–į—Ā—Ā–į –ł–Ľ–ł –ł—ą–Ķ–ľ–ł—á–Ķ—Ā–ļ–ł—Ö –ł–∑–ľ–Ķ–Ĺ–Ķ–Ĺ–ł–Ļ —Ā–Ķ–≥–ľ–Ķ–Ĺ—ā–į ST –Ņ—Ä–ł –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–ł–ł –Ĺ–į–≥—Ä—É–∑–ĺ—á–Ĺ—č—Ö –Ņ—Ä–ĺ–Ī; —Ą–ĺ—Ä–ľ–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ –≥–ł–Ņ–Ķ—Ä—ā—Ä–ĺ—Ą–ł–ł –Ľ–Ķ–≤–ĺ–≥–ĺ –∂–Ķ–Ľ—É–ī–ĺ—á–ļ–į; –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ķ —Ā–ł—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ł –ī–ł–į—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ą—É–Ĺ–ļ—Ü–ł–ł —Ā–Ķ—Ä–ī—Ü–į; –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ļ–ĺ–Ĺ—ā—Ä–ĺ–Ľ—Ź –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź –ł —á–į—Ā—ā–ĺ—ā—č —Ā–Ķ—Ä–ī–Ķ—á–Ĺ—č—Ö —Ā–ĺ–ļ—Ä–į—Č–Ķ–Ĺ–ł–Ļ; –Ĺ–Ķ–ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł–Ķ —Ü–Ķ–Ľ–Ķ–≤—č—Ö –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–Ķ–Ļ –Ľ–ł–Ņ–ł–ī–ĺ–≥—Ä–į–ľ–ľ—č. –°—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –ĺ–ļ–į–∑—č–≤–į—é—ā —ā–į–ļ–∂–Ķ –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ķ–ľ–ĺ–Ļ –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł, –Ķ–Ķ —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤–ł–Ķ —Ā–ĺ–≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č–ľ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ [7, 11].
–í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ķ –≤—Ä–Ķ–ľ—Ź –Ņ—Ä–ĺ–Ī–Ľ–Ķ–ľ–į –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é –ĺ—Ā—ā–į–Ķ—ā—Ā—Ź –ĺ–ī–Ĺ–ĺ–Ļ –ł–∑ —Ā–į–ľ—č—Ö –į–ļ—ā—É–į–Ľ—Ć–Ĺ—č—Ö –≤ –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł–ł. –í —Ö–ĺ–ī–Ķ –ľ–Ĺ–ĺ–≥–ĺ—á–ł—Ā–Ľ–Ķ–Ĺ–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ —Ā—Ä–Ķ–ī–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł—Ö –ė–ú, –≤—č—Ź–≤–Ľ–Ķ–Ĺ–į –Ĺ–ł–∑–ļ–į—Ź –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł—é –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į–ľ–ł —Ā –ī–ĺ–ļ–į–∑–į–Ĺ–Ĺ—č–ľ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ–ľ –Ĺ–į –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź [12‚Äď15]. –Ě–ł–∑–ļ–į—Ź –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł, —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ī–į–Ĺ–Ĺ—č–ľ —Ä–į–Ĺ–ī–ĺ–ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ, –į—Ā—Ā–ĺ—Ü–ł–ł—Ä–ĺ–≤–į–Ĺ–į —Ā –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–Ĺ—č–ľ —É—Ä–ĺ–≤–Ĺ–Ķ–ľ —Ā–ľ–Ķ—Ä—ā–Ĺ–ĺ—Ā—ā–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –≤—č—Ā–ĺ–ļ–ĺ–≥–ĺ —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ-—Ā–ĺ—Ā—É–ī–ł—Ā—ā–ĺ–≥–ĺ —Ä–ł—Ā–ļ–į [16, 17].
–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ–ĺ–ł—Ā–ļ –Ņ—Ä–Ķ–ī–ł–ļ—ā–ĺ—Ä–ĺ–≤ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź –į–ļ—ā—É–į–Ľ—Ć–Ĺ–ĺ–Ļ –Ĺ–į—É—á–Ĺ–ĺ–Ļ –∑–į–ī–į—á–Ķ–Ļ. –í—č—Ā–ĺ–ļ–į—Ź –ł–∑–ľ–Ķ–Ĺ—á–ł–≤–ĺ—Ā—ā—Ć –Ī–ĺ–Ľ—Ć—ą–ł–Ĺ—Ā—ā–≤–į –Ņ—Ä–ĺ–≥–Ĺ–ĺ—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤ –ī–į–Ķ—ā –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā—Ć –ł—Ö –ļ–ĺ—Ä—Ä–Ķ–ļ—Ü–ł–ł —Ā –Ņ–ĺ—Ā–Ľ–Ķ–ī—É—é—Č–ł–ľ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ–ľ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –ł –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–į –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź. –Ē–Ľ—Ź –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–Ķ–Ĺ–ł—Ź —ā—Ä–į–Ĺ—Ā–Ľ—Ź—Ü–ł–ł —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ –Ĺ–į—É—á–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–Ļ –≤ —Ä—É—ā–ł–Ĺ–Ĺ—É—é –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ—É—é –Ņ—Ä–į–ļ—ā–ł–ļ—É –Ņ—Ä–Ķ–ī–Ľ–į–≥–į–Ķ—ā—Ā—Ź —Ä–į–∑—Ä–į–Ī–ĺ—ā–ļ–į –≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ł—Ö —ą–ļ–į–Ľ-—Ä–ł—Ā–ļ–ĺ–ľ–Ķ—ā—Ä–ĺ–≤, –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—Č–ł—Ö –≤–ł–∑—É–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į—ā—Ć –Ņ–ĺ—ā–Ķ–Ĺ—Ü–ł–į–Ľ—Ć–Ĺ—č–Ļ —Ä–ł—Ā–ļ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö —Ā–ĺ–Ī—č—ā–ł–Ļ –ł –≤–ĺ–∑–ľ–ĺ–∂–Ĺ–ĺ—Ā—ā–ł –Ķ–≥–ĺ –ľ–ĺ–ī–ł—Ą–ł–ļ–į—Ü–ł–ł.
–¶–Ķ–Ľ—Ć –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź: —Ä–į–∑—Ä–į–Ī–ĺ—ā–į—ā—Ć –≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ—É—é —ą–ļ–į–Ľ—É-—Ä–ł—Ā–ļ–ĺ–ľ–Ķ—ā—Ä –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–° –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 5 –Ľ–Ķ—ā –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į —Ā —É—á–Ķ—ā–ĺ–ľ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ľ–Ķ—á–Ķ–Ĺ–ł—é.
–ú–į—ā–Ķ—Ä–ł–į–Ľ –ł –ľ–Ķ—ā–ĺ–ī—č
–í —Ä–į–Ī–ĺ—ā–Ķ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ—č —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –į–Ĺ–į–Ľ–ł–∑–į –ī–į–Ĺ–Ĺ—č—Ö –Ņ—Ä–ĺ—Ā–Ņ–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –Ņ—Ź—ā–ł–Ľ–Ķ—ā–Ĺ–Ķ–≥–ĺ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –∑–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ–ł, –≤—č–∂–ł–≤—ą–ł–ľ–ł –Ņ–ĺ—Ā–Ľ–Ķ –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ė–ú (n=115, –ľ–Ķ–ī–ł–į–Ĺ–į –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź ‚ÄĒ 4 –≥–ĺ–ī–į –ł 9 –ľ–Ķ—Ā.) –ł –∑–į—Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č–ľ–ł –≤ –Ī–į–∑–Ķ –ī–į–Ĺ–Ĺ—č—Ö –†–Ķ–≥–ł—Ā—ā—Ä–į –ĺ—Ā—ā—Ä–ĺ–≥–ĺ –ł–Ĺ—Ą–į—Ä–ļ—ā–į –ľ–ł–ĺ–ļ–į—Ä–ī–į (–≥. –Ę–ĺ–ľ—Ā–ļ). –ź–Ĺ–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ľ–ł—Ā—Ć —Ā–Ľ–Ķ–ī—É—é—Č–ł–Ķ –ļ–ĺ–Ĺ–Ķ—á–Ĺ—č–Ķ —ā–ĺ—á–ļ–ł: –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ—č–Ļ –ė–ú, –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–į—Ü–ł–ł –Ņ–ĺ –Ņ–ĺ–≤–ĺ–ī—É –ĺ–Ī–ĺ—Ā—ā—Ä–Ķ–Ĺ–ł—Ź –ė–Ď–°, –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł (–•–°–Ě) –ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ä–ł—ā–ľ–į —Ā–Ķ—Ä–ī—Ü–į. –í —Ā–Ľ—É—á–į–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–į—Ü–ł–ł –ļ–ĺ–Ĺ–Ķ—á–Ĺ—č—Ö —ā–ĺ—á–Ķ–ļ –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 5 –Ľ–Ķ—ā –Ņ–ĺ—Ā–Ľ–Ķ –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ė–ú –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į —Ā—á–ł—ā–į–Ľ–ĺ—Ā—Ć –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–ľ (n=71). –ď—Ä—É–Ņ–Ņ—É —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—Ź —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā—č –Ī–Ķ–∑ —Ä–į–∑–≤–ł—ā–ł—Ź —É–ļ–į–∑–į–Ĺ–Ĺ—č—Ö –°–°–° –≤ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ (n=44).
–ė—Ā–Ņ–ĺ–Ľ—Ć–∑—É–Ķ–ľ—č–Ļ –≤ –ļ–į—á–Ķ—Ā—ā–≤–Ķ –ĺ–ī–Ĺ–ĺ–≥–ĺ –ł–∑ –Ņ—Ä–Ķ–ī–ł–ļ—ā–ĺ—Ä–ĺ–≤ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į –ł–Ĺ–ī–Ķ–ļ—Ā V (–ł–Ĺ–ī–Ķ–ļ—Ā –∂–ł–∑–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā–ł) —Ź–≤–Ľ—Ź–Ķ—ā—Ā—Ź —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–ľ —Ą–į—Ä–ľ–į–ļ–ĺ—ć–Ņ–ł–ī–Ķ–ľ–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –į–Ĺ–į–Ľ–ł–∑–į –∂–ł–∑–Ĺ–Ķ–Ĺ–Ĺ–ĺ–Ļ –Ĺ–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ—Ā—ā–ł –Ĺ–į–∑–Ĺ–į—á–į–Ķ–ľ—č—Ö –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ [18, 19]. –í –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–Ļ —Ä–į–Ī–ĺ—ā–Ķ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ—Ā—Ź —Ą–ĺ—Ä–ľ–į–Ľ–ł–∑–ĺ–≤–į–Ĺ–Ĺ—č–Ļ –Ņ–ĺ–ī—Ö–ĺ–ī –ļ –ī–Ķ–Ľ–Ķ–Ĺ–ł—é –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ—č—Ö —Ā—Ä–Ķ–ī—Ā—ā–≤ –Ĺ–į 2 –≥—Ä—É–Ņ–Ņ—č –Ņ–ĺ –Ņ—Ä–ł–Ĺ—Ü–ł–Ņ—É –ī–ĺ–ļ–į–∑–į–Ĺ–Ĺ–ĺ—Ā—ā–ł –ł—Ö –≤–Ľ–ł—Ź–Ĺ–ł—Ź –Ĺ–į –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł—Ö –ė–ú. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –ł–Ĺ–ī–Ķ–ļ—Ā V –Ņ—Ä–ł—Ā–≤–į–ł–≤–į–Ľ—Ā—Ź –Ľ–Ķ–ļ–į—Ä—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ —Ā—Ä–Ķ–ī—Ā—ā–≤–į–ľ —á–Ķ—ā—č—Ä–Ķ—Ö –≥—Ä—É–Ņ–Ņ: –į–Ĺ—ā–ł–į–≥—Ä–Ķ–≥–į–Ĺ—ā–į–ľ, ő≤-–į–ī—Ä–Ķ–Ĺ–ĺ–Ī–Ľ–ĺ–ļ–į—ā–ĺ—Ä–į–ľ, –ł–Ĺ–≥–ł–Ī–ł—ā–ĺ—Ä–į–ľ –į–Ĺ–≥–ł–ĺ—ā–Ķ–Ĺ–∑–ł–Ĺ–Ņ—Ä–Ķ–≤—Ä–į—Č–į—é—Č–Ķ–≥–ĺ —Ą–Ķ—Ä–ľ–Ķ–Ĺ—ā–į (–ł–Ľ–ł –Ī–Ľ–ĺ–ļ–į—ā–ĺ—Ä–į–ľ —Ä–Ķ—Ü–Ķ–Ņ—ā–ĺ—Ä–ĺ–≤ –į–Ĺ–≥–ł–ĺ—ā–Ķ–Ĺ–∑–ł–Ĺ–į II –≤ —Ā–Ľ—É—á–į–Ķ –Ĺ–Ķ–Ņ–Ķ—Ä–Ķ–Ĺ–ĺ—Ā–ł–ľ–ĺ—Ā—ā–ł –Ņ–ĺ—Ā–Ľ–Ķ–ī–Ĺ–ł—Ö), —Ā—ā–į—ā–ł–Ĺ–į–ľ. –ö –≥—Ä—É–Ņ–Ņ–Ķ N –Ī—č–Ľ–ł –ĺ—ā–Ĺ–Ķ—Ā–Ķ–Ĺ—č –ĺ—Ā—ā–į–Ľ—Ć–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ķ–ľ—č–Ķ –≤ –Ľ–Ķ—á–Ķ–Ĺ–ł–ł –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ł—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö: –Ĺ–ł—ā—Ä–į—ā—č, –ī–ł—É—Ä–Ķ—ā–ł–ļ–ł, –Ī–Ľ–ĺ–ļ–į—ā–ĺ—Ä—č –ļ–į–Ľ—Ć—Ü–ł–Ķ–≤—č—Ö –ļ–į–Ĺ–į–Ľ–ĺ–≤, –į–Ĺ—ā–ł–ļ–ĺ–į–≥—É–Ľ—Ź–Ĺ—ā—č, –į–Ĺ—ā–ł–į—Ä–ł—ā–ľ–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č, –ľ–ł–ĺ–ļ–į—Ä–ī–ł–į–Ľ—Ć–Ĺ—č–Ķ —Ü–ł—ā–ĺ–Ņ—Ä–ĺ—ā–Ķ–ļ—ā–ĺ—Ä—č.
–Ē–Ľ—Ź –ł–∑—É—á–Ķ–Ĺ–ł—Ź –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö, –Ņ–Ķ—Ä–Ķ–∂–ł–≤—ą–ł—Ö –Ņ—Ź—ā–ł–Ľ–Ķ—ā–Ĺ–ł–Ļ —Ä—É–Ī–Ķ–∂ –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ā–Ľ–Ķ –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ė–ú, –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł —ā–Ķ—Ā—ā –ú–ĺ—Ä–ł—Ā–ļ–ł ‚ÄĒ –ď—Ä–ł–Ĺ–į, –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ—Ź—é—Č–ł–Ļ —Ā–ĺ–Ī–ĺ–Ļ –ļ–Ľ–ł–Ĺ–ł–ļ–ĺ-–Ņ—Ā–ł—Ö–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ—É—é –ľ–Ķ—ā–ĺ–ī–ł–ļ—É, –Ņ—Ä–Ķ–ī–Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–Ĺ—É—é –ī–Ľ—Ź —Ā–ļ—Ä–ł–Ĺ–ł–Ĺ–≥–ĺ–≤–ĺ–≥–ĺ –≤—č—Ź–≤–Ľ–Ķ–Ĺ–ł—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ –ļ–ĺ–ľ–Ņ–Ľ–į–Ķ–Ĺ—ā–Ĺ—č—Ö –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –≤ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ļ –Ņ—Ä–į–ļ—ā–ł–ļ–Ķ [20]. –Ę–Ķ—Ā—ā —Ā–ĺ—Ā—ā–ĺ–ł—ā –ł–∑ —á–Ķ—ā—č—Ä–Ķ—Ö –≤–ĺ–Ņ—Ä–ĺ—Ā–ĺ–≤, –ĺ—Ü–Ķ–Ĺ–ł–≤–į—é—Č–ł—Ö —Ä–Ķ–≥—É–Ľ—Ź—Ä–Ĺ–ĺ—Ā—ā—Ć —Ā–ĺ–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź —Ä–Ķ–∂–ł–ľ–į –Ņ—Ä–ł–Ķ–ľ–į –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤, –Ņ—Ä–ł —ć—ā–ĺ–ľ –ļ–į–∂–ī—č–Ļ –ĺ—ā—Ä–ł—Ü–į—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –ĺ—ā–≤–Ķ—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ķ—ā—Ā—Ź –≤ 1 –Ī–į–Ľ–Ľ, –Ņ–ĺ–Ľ–ĺ–∂–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ ‚ÄĒ –≤ 0 –Ī–į–Ľ–Ľ–ĺ–≤. –ü—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ—č–ľ–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é –≤ –Ĺ–į—Ā—ā–ĺ—Ź—Č–Ķ–ľ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł —Ā—á–ł—ā–į–Ľ–ł—Ā—Ć –Ī–ĺ–Ľ—Ć–Ĺ—č–Ķ, –Ĺ–į–Ī—Ä–į–≤—ą–ł–Ķ –Ņ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ —ā–Ķ—Ā—ā–į 3‚Äď4 –Ī–į–Ľ–Ľ–į. –ü–į—Ü–ł–Ķ–Ĺ—ā—č, –Ĺ–į–Ī—Ä–į–≤—ą–ł–Ķ –ĺ—ā 0 –ī–ĺ 2 –Ī–į–Ľ–Ľ–ĺ–≤, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ–ł—Ā—Ć –ļ–į–ļ –Ĺ–Ķ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ—č–Ķ –Ľ–Ķ—á–Ķ–Ĺ–ł—é.
–°—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ—É—é –ĺ–Ī—Ä–į–Ī–ĺ—ā–ļ—É —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–ĺ–≤ –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ī–Ķ–ľ–ĺ–≤–Ķ—Ä—Ā–ł–ł –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ—č SPSS Statistics Desktop, V.22.0 (–ļ–ĺ–ľ–Ņ–į–Ĺ–ł—Ź IBM). –ö—Ä–ł—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –∑–Ĺ–į—á–ł–ľ–ĺ—Ā—ā–ł p –Ņ—Ä–ł –Ņ—Ä–ĺ–≤–Ķ—Ä–ļ–Ķ —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł—Ö –≥–ł–Ņ–ĺ—ā–Ķ–∑ –Ņ—Ä–ł–Ĺ—Ź—ā —Ä–į–≤–Ĺ—č–ľ 0,05. –Ē–Ľ—Ź –Ņ–ĺ—Ā—ā—Ä–ĺ–Ķ–Ĺ–ł—Ź –ľ–į—ā–Ķ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –ł –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–° –Ņ—Ä–ł–ľ–Ķ–Ĺ—Ź–Ľ–ł –ľ–Ĺ–ĺ–≥–ĺ—Ą–į–ļ—ā–ĺ—Ä–Ĺ—č–Ļ –Ľ–ĺ–≥–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł–ĺ–Ĺ–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑ (—Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ľ–Ķ—ā–ĺ–ī–į –Ņ–ĺ—ą–į–≥–ĺ–≤–ĺ–≥–ĺ –ł—Ā–ļ–Ľ—é—á–Ķ–Ĺ–ł—Ź –Ņ–Ķ—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č—Ö –ł–∑ –ľ–ĺ–ī–Ķ–Ľ–ł). –í –ļ–į—á–Ķ—Ā—ā–≤–Ķ –ļ—Ä–ł—ā–Ķ—Ä–ł—Ź —Ā–ĺ–≥–Ľ–į—Ā–ł—Ź –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ľ–ł –Ņ—Ä–ĺ—Ü–Ķ–Ĺ—ā –Ņ—Ä–į–≤–ł–Ľ—Ć–Ĺ–ĺ–Ļ –ļ–Ľ–į—Ā—Ā–ł—Ą–ł–ļ–į—Ü–ł–ł, –į —ā–į–ļ–∂–Ķ –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł —á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć –ł —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–ĺ—Ā—ā—Ć –ľ–ĺ–ī–Ķ–Ľ–ł. –ě–Ī—Č—É—é –ĺ—Ü–Ķ–Ĺ–ļ—É —Ā–ĺ–≥–Ľ–į—Ā–ł—Ź –ľ–ĺ–ī–Ķ–Ľ–ł –ł —Ä–Ķ–į–Ľ—Ć–Ĺ—č—Ö –ī–į–Ĺ–Ĺ—č—Ö –Ņ—Ä–ĺ–≤–ĺ–ī–ł–Ľ–ł —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ —ā–Ķ—Ā—ā–į —Ā–ĺ–≥–Ľ–į—Ā–ł—Ź –•–ĺ—Ā–ľ–Ķ—Ä–į ‚ÄĒ –õ–Ķ–ľ–Ķ—ą–Ķ–≤–į. –ö–į—á–Ķ—Ā—ā–≤–ĺ –ľ–ĺ–ī–Ķ–Ľ–ł –ĺ—Ü–Ķ–Ĺ–ł–≤–į–Ľ–ł —ā–į–ļ–∂–Ķ —Ā –Ņ–ĺ–ľ–ĺ—Č—Ć—é ROC-–į–Ĺ–į–Ľ–ł–∑–į —Ā –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ–ľ –∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź –Ņ–Ľ–ĺ—Č–į–ī–ł –Ņ–ĺ–ī ROC-–ļ—Ä–ł–≤–ĺ–Ļ.
–†–Ķ–∑—É–Ľ—Ć—ā–į—ā—č
–ė—Ā—Ā–Ľ–Ķ–ī—É–Ķ–ľ–į—Ź –ļ–ĺ–≥–ĺ—Ä—ā–į –Ī—č–Ľ–į –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–į –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ–ĺ –ľ—É–∂—á–ł–Ĺ–į–ľ–ł (60%). –°—Ä–Ķ–ī–Ĺ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ā–ĺ—Ā—ā–į–≤–ł–Ľ 62¬Ī10 –Ľ–Ķ—ā. –Ė–Ķ–Ĺ—Č–ł–Ĺ—č –Ī—č–Ľ–ł —Ā—ā–į—Ä—ą–Ķ –ľ—É–∂—á–ł–Ĺ –Ņ—Ä–ł–Ī–Ľ–ł–∑–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ –Ĺ–į 10 –Ľ–Ķ—ā (—Ä=0,001). –ü–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ—č–Ļ –≤ –Ņ—Ä–ĺ—ą–Ľ–ĺ–ľ –ė–ú –ł–ľ–Ķ–Ľ—Ā—Ź —É 16,5% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, —Ā—ā–Ķ–Ĺ–ĺ–ļ–į—Ä–ī–ł—Ź –Ĺ–į–Ņ—Ä—Ź–∂–Ķ–Ĺ–ł—Ź –ī–ĺ –ł–Ĺ–ī–Ķ–ļ—Ā–Ĺ–ĺ–≥–ĺ –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ —Ā–ĺ–Ī—č—ā–ł—Ź –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–į —É 56% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –≥–ł–Ņ–Ķ—Ä—ā–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–į—Ź –Ī–ĺ–Ľ–Ķ–∑–Ĺ—Ć ‚ÄĒ —É 80%. –•–°–Ě –ī–ĺ –ł–Ĺ–ī–Ķ–ļ—Ā–Ĺ–ĺ–≥–ĺ –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ —Ā–ĺ–Ī—č—ā–ł—Ź –≤—Ā—ā—Ä–Ķ—á–į–Ľ–į—Ā—Ć —É 34% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, —Ā–į—Ö–į—Ä–Ĺ—č–Ļ –ī–ł–į–Ī–Ķ—ā 2 —ā–ł–Ņ–į ‚ÄĒ —É 22,6%, 46% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ļ—É—Ä–ł–Ľ–ł.
–í —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –Ņ—Ź—ā–ł–Ľ–Ķ—ā–Ĺ–Ķ–≥–ĺ –Ņ—Ä–ĺ—Ā–Ņ–Ķ–ļ—ā–ł–≤–Ĺ–ĺ–≥–ĺ –Ĺ–į–Ī–Ľ—é-–ī–Ķ–Ĺ–ł—Ź –Ī—č–Ľ–ĺ —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ–ĺ, —á—ā–ĺ —É 20% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ —Ä–į–∑–≤–ł–Ľ—Ā—Ź –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ—č–Ļ –ė–ú, —É 41% –≤–ĺ–∑–Ĺ–ł–ļ–Ľ–ł –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł—Ź —Ä–ł—ā–ľ–į –ł–Ľ–ł –Ņ—Ä–ĺ–≤–ĺ–ī–ł–ľ–ĺ—Ā—ā–ł —Ā–Ķ—Ä–ī—Ü–į, 44% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –ľ–ł–Ĺ–ł–ľ—É–ľ 1 —Ä–į–∑ –Ī—č–Ľ–ł –≥–ĺ—Ā–Ņ–ł—ā–į–Ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ—č –≤ —Ā–≤—Ź–∑–ł —Ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ–ľ –ė–Ď–°, –į 31% ‚ÄĒ –≤ —Ā–≤—Ź–∑–ł —Ā –Ņ—Ä–ĺ–≥—Ä–Ķ—Ā—Ā–ł—Ä–ĺ–≤–į–Ĺ–ł–Ķ–ľ —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ–Ļ –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā–ł. –ė–Ĺ—ā–Ķ—Ä–≤–Ķ–Ĺ—Ü–ł–ĺ–Ĺ–Ĺ–į—Ź –ł/–ł–Ľ–ł —Ö–ł—Ä—É—Ä–≥–ł—á–Ķ—Ā–ļ–į—Ź —Ä–Ķ–≤–į—Ā–ļ—É–Ľ—Ź—Ä–ł–∑–į—Ü–ł—Ź –≤—č–Ņ–ĺ–Ľ–Ĺ–Ķ–Ĺ–į —É 22% –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ—č—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö.
–Ē–Ľ—Ź –Ņ–ĺ–ł—Ā–ļ–į –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā–į –∑–Ĺ–į—á–ł–ľ—č—Ö –Ņ—Ä–Ķ–ī–ł–ļ—ā–ĺ—Ä–ĺ–≤ —Ä–į–∑–≤–ł—ā–ł—Ź –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–° –≤ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –≤ –Ľ–ĺ–≥–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ļ —Ä–Ķ–≥—Ä–Ķ—Ā—Ā–ł–ĺ–Ĺ–Ĺ—č–Ļ –į–Ĺ–į–Ľ–ł–∑ –≤–ļ–Ľ—é—á–į–Ľ–ł –≤—Ā–Ķ –Ņ—Ä–ł–∑–Ĺ–į–ļ–ł, –ļ–ĺ—ā–ĺ—Ä—č–Ķ —ā–Ķ–ĺ—Ä–Ķ—ā–ł—á–Ķ—Ā–ļ–ł –ľ–ĺ–≥–Ľ–ł –Ņ–ĺ–≤–Ľ–ł—Ź—ā—Ć –Ĺ–į –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į: –ī–Ķ–ľ–ĺ–≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–ł–Ķ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ–ł, –į–Ĺ–į–ľ–Ĺ–Ķ—Ā—ā–ł—á–Ķ—Ā–ļ–ł–Ķ –ī–į–Ĺ–Ĺ—č–Ķ, –ļ–ĺ–ľ–ĺ—Ä–Ī–ł–ī–Ĺ—č–Ļ —Ą–ĺ–Ĺ, –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –ĺ—Ā—ā—Ä–ĺ–≥–ĺ –ė–ú –ł —ā–į–ļ—ā–ł–ļ—É –≤–Ķ–ī–Ķ–Ĺ–ł—Ź –≤ –ĺ—Ā—ā—Ä–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ, –ĺ–Ī—ä–Ķ–ľ –Ņ–ĺ—Ä–į–∂–Ķ–Ĺ–ł—Ź –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–≥–ĺ —Ä—É—Ā–Ľ–į, —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł—Ā—ā–ł–ļ—É –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –≤ –ĺ—Ā—ā—Ä—É—é —Ą–į–∑—É –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź –ł –≤ –ĺ—ā–ī–į–Ľ–Ķ–Ĺ–Ĺ–ĺ–ľ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ, –ī–į–Ĺ–Ĺ—č–Ķ —Ą–į—Ä–ľ–į–ļ–ĺ—ć–Ņ–ł–ī–Ķ–ľ–ł–ĺ–Ľ–ĺ–≥–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –į–Ĺ–į–Ľ–ł–∑–į, –į —ā–į–ļ–∂–Ķ —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–Ĺ–ĺ–ľ—É –Ľ–Ķ—á–Ķ–Ĺ–ł—é.
–í —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –ľ–Ĺ–ĺ–≥–ĺ–ľ–Ķ—Ä–Ĺ–ĺ–Ļ —Ā—ā–į—ā–ł—Ā—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ĺ–Ī—Ä–į–Ī–ĺ—ā–ļ–ł –Ī—č–Ľ–ł –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ–Ķ–Ĺ—č –Ņ—Ä–Ķ–ī–ł–ļ—ā–ĺ—Ä—č –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į, –ļ–ĺ—ā–ĺ—Ä—č–Ķ –≤ —Ā–ĺ–≤–ĺ–ļ—É–Ņ–Ĺ–ĺ—Ā—ā–ł –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź—é—ā —Ā —ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć—é –ī–ĺ 77% –Ņ—Ä–Ķ–ī—Ā–ļ–į–∑—č–≤–į—ā—Ć –≤—č—Ā–ĺ–ļ—É—é –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā—Ć —Ä–į–∑–≤–ł—ā–ł—Ź –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–° –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 5 –Ľ–Ķ—ā –Ņ–ĺ—Ā–Ľ–Ķ –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ė–ú (—á—É–≤—Ā—ā–≤–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā—Ć ‚ÄĒ 84%, —Ā–Ņ–Ķ—Ü–ł—Ą–ł—á–Ĺ–ĺ—Ā—ā—Ć ‚ÄĒ 66%) [21]. –í —á–ł—Ā–Ľ–ĺ —ā–į–ļ–ł—Ö –Ņ—Ä–Ķ–ī–ł–ļ—ā–ĺ—Ä–ĺ–≤ –≤–ĺ—ą–Ľ–ł: –Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ —É–ī–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –≤–Ķ—Ā–į –∂–ł–∑–Ĺ–Ķ–Ĺ–Ĺ–ĺ –≤–į–∂–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤ –ĺ–Ī—Č–Ķ–Ļ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ (–ł–Ĺ–ī–Ķ–ļ—Ā V) –Ĺ–į —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ–ľ—É—é –Ņ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ —ā–Ķ—Ā—ā–į –ú–ĺ—Ä–ł—Ā–ļ–ł ‚ÄĒ –ď—Ä–ł–Ĺ–į (—Ä=0,04), –Ĺ–į–Ľ–ł—á–ł–Ķ –•–°–Ě –ī–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ—Ā—ā—Ä–ĺ–Ļ –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ļ –ļ–į—ā–į—Ā—ā—Ä–ĺ—Ą—č (—Ä=0,001), –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ü–Ķ–Ľ–Ķ–≤—č—Ö —É—Ä–ĺ–≤–Ĺ–Ķ–Ļ —Ā–ł—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź —á–Ķ—Ä–Ķ–∑ 1 –≥–ĺ–ī –Ņ–ĺ—Ā–Ľ–Ķ –ė–ú (—Ä=0,003), –į —ā–į–ļ–∂–Ķ –≤–ĺ–∑—Ä–į—Ā—ā 75 –Ľ–Ķ—ā –ł —Ā—ā–į—Ä—ą–Ķ –Ĺ–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –ł–Ĺ–ī–Ķ–ļ—Ā–Ĺ–ĺ–≥–ĺ –ė–ú (—Ä=0,001) (—ā–į–Ī–Ľ. 1).

–Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ĺ–į–Ľ–ł—á–ł–Ķ –•–°–Ě, –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ–ĺ–Ļ –ī–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –ł–Ĺ–ī–Ķ–ļ—Ā–Ĺ–ĺ–≥–ĺ –ė–ú, —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ľ–ĺ —ą–į–Ĺ—Ā—č –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į –≤ 9,5 —Ä–į–∑–į. –ě—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ü–Ķ–Ľ–Ķ–≤—č—Ö –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ —Ā–ł—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź —ā–į–ļ–∂–Ķ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ –≤–Ľ–ł—Ź–Ľ–ĺ –Ĺ–į –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź, —É–≤–Ķ–Ľ–ł—á–ł–≤–į—Ź —Ä–ł—Ā–ļ —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ-—Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ –≤ 5 —Ä–į–∑. –í–ĺ–∑—Ä–į—Ā—ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į 75 –Ľ–Ķ—ā –ł —Ā—ā–į—Ä—ą–Ķ —É–≤–Ķ–Ľ–ł—á–ł–≤–į–Ľ –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā—Ć –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –≤ 8,5 —Ä–į–∑–į. –ė–∑ –≤—Ā–Ķ—Ö –≤–ĺ—ą–Ķ–ī—ą–ł—Ö –≤ –ľ–ĺ–ī–Ķ–Ľ—Ć –Ņ–Ķ—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č—Ö –Ķ–ī–ł–Ĺ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ –Ņ—Ä–Ķ–ī–ł–ļ—ā–ĺ—Ä–ĺ–ľ, –Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ –≤–Ľ–ł—Ź—é—Č–ł–ľ –Ĺ–į —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į, —Ź–≤–ł–Ľ—Ā—Ź –ł–Ĺ—ā–Ķ–≥—Ä–į–Ľ—Ć–Ĺ—č–Ļ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć, —Ä–į–≤–Ĺ—č–Ļ –Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ł—é —É–ī–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –≤–Ķ—Ā–į –∂–ł–∑–Ĺ–Ķ–Ĺ–Ĺ–ĺ –≤–į–∂–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤ –ĺ–Ī—Č–Ķ–Ļ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ –Ĺ–į —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é. –≠—ā–ĺ—ā –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć –ł–∑–ľ–Ķ–Ĺ—Ź–Ķ—ā—Ā—Ź –≤ –ī–ł–į–Ņ–į–∑–ĺ–Ĺ–Ķ –ĺ—ā 0 –ī–ĺ 4 –ł, —Ā–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č–ľ –ī–į–Ĺ–Ĺ—č–ľ, —É–ľ–Ķ–Ĺ—Ć—ą–į–Ķ—ā —Ä–ł—Ā–ļ –°–°–° –Ĺ–į 61% –Ĺ–į –ļ–į–∂–ī—É—é –Ķ–ī–ł–Ĺ–ł—Ü—É –∑–Ĺ–į—á–Ķ–Ĺ–ł—Ź, —ā. –Ķ. –Ņ—Ä–ł –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ –≤—č—Ā–ĺ–ļ–ĺ–Ļ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é –ł —ā–Ķ—Ä–į–Ņ–ł–ł, —Ā–ĺ–ĺ—ā–≤–Ķ—ā—Ā—ā–≤—É—é—Č–Ķ–Ļ —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł—Ź–ľ, —Ä–ł—Ā–ļ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź —Ā–Ĺ–ł–∂–į–Ķ—ā—Ā—Ź –≤ 2,5 —Ä–į–∑–į.
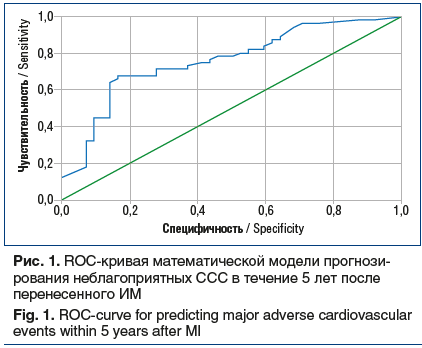
–ö–į—á–Ķ—Ā—ā–≤–ĺ –ľ–į—ā–Ķ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł –Ī—č–Ľ–ĺ –Ņ—Ä–ĺ–≤–Ķ—Ä–Ķ–Ĺ–ĺ —Ā –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł–Ķ–ľ ROC-–į–Ĺ–į–Ľ–ł–∑–į (—Ä–ł—Ā. 1). –ü–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ–ĺ–Ķ –∑–Ĺ–į—á–Ķ–Ĺ–ł–Ķ –Ņ–Ľ–ĺ—Č–į–ī–ł –Ņ–ĺ–ī –ļ—Ä–ł–≤–ĺ–Ļ —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–ĺ 0,764 (95% –ī–ĺ–≤–Ķ—Ä–ł—ā–Ķ–Ľ—Ć–Ĺ—č–Ļ –ł–Ĺ—ā–Ķ—Ä–≤–į–Ľ 0,67‚Äď0,86, p<0,001), —á—ā–ĺ —Ö–į—Ä–į–ļ—ā–Ķ—Ä–ł–∑—É–Ķ—ā –ļ–į—á–Ķ—Ā—ā–≤–ĺ —Ä–į–∑—Ä–į–Ī–ĺ—ā–į–Ĺ–Ĺ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł –ļ–į–ļ —Ö–ĺ—Ä–ĺ—ą–Ķ–Ķ. –£—Ā–Ľ–ĺ–≤–Ĺ–į—Ź –≥—Ä–į–Ĺ–ł—Ü–į, —Ä–į–∑–ī–Ķ–Ľ—Ź—é—Č–į—Ź –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ĺ–į 2 –≥—Ä—É–Ņ–Ņ—č (—Ā –Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–ľ –ł –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č–ľ –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä—É–Ķ–ľ—č–ľ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į), –Ņ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ –į–Ĺ–į–Ľ–ł–∑–į ROC-–ļ—Ä–ł–≤–ĺ–Ļ —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 0,6.
–ü–ĺ—Ā—Ä–Ķ–ī—Ā—ā–≤–ĺ–ľ –ľ–į—ā–Ķ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ł—Ö —Ä–į—Ā—á–Ķ—ā–ĺ–≤ –Ĺ–į –∑–į–ļ–Ľ—é—á–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–ľ —ć—ā–į–Ņ–Ķ —Ä–į–∑—Ä–į–Ī–ĺ—ā–į–Ĺ–į –≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–į—Ź —ą–ļ–į–Ľ–į-—Ä–ł—Ā–ļ–ĺ–ľ–Ķ—ā—Ä –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –ľ–į—ā–Ķ–ľ–į—ā–ł—á–Ķ—Ā–ļ–ĺ–Ļ –ľ–ĺ–ī–Ķ–Ľ–ł (—Ä–ł—Ā. 2). –ü—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ–į—Ź —ą–ļ–į–Ľ–į –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –≤—č—á–ł—Ā–Ľ—Ź—ā—Ć —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–° –≤ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –Ņ—Ä–ł –ľ–ł–Ĺ–ł–ľ–į–Ľ—Ć–Ĺ—č—Ö –≤—Ä–Ķ–ľ–Ķ–Ĺ–Ĺ—č—Ö –∑–į—ā—Ä–į—ā–į—Ö –ł –Ī–Ķ–∑ –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–ł—Ź —Ā–Ņ–Ķ—Ü–ł–į–Ľ—Ć–Ĺ—č—Ö —É—Ā—ā—Ä–ĺ–Ļ—Ā—ā–≤ (–ļ–į–Ľ—Ć–ļ—É–Ľ—Ź—ā–ĺ—Ä–ĺ–≤, –ļ–ĺ–ľ–Ņ—Ć—é—ā–Ķ—Ä–Ĺ—č—Ö –Ņ—Ä–ĺ–≥—Ä–į–ľ–ľ).

–ě–Ī—Ā—É–∂–ī–Ķ–Ĺ–ł–Ķ
–í —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–Ķ –Ņ—Ä–ĺ–≤–Ķ–ī–Ķ–Ĺ–Ĺ–ĺ–≥–ĺ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ĺ–į –ĺ—Ā–Ĺ–ĺ–≤–į–Ĺ–ł–ł –Ņ–ĺ–Ņ—É–Ľ—Ź—Ü–ł–ĺ–Ĺ–Ĺ–ĺ–≥–ĺ –†–Ķ–≥–ł—Ā—ā—Ä–į –ĺ—Ā—ā—Ä–ĺ–≥–ĺ –ł–Ĺ—Ą–į—Ä–ļ—ā–į –ľ–ł–ĺ¬≠–ļ–į—Ä–ī–į —É—Ā—ā–į–Ĺ–ĺ–≤–Ľ–Ķ–Ĺ –ļ–ĺ–ľ–Ņ–Ľ–Ķ–ļ—Ā —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤, –ĺ–ļ–į–∑—č–≤–į—é—Č–ł—Ö –∑–Ĺ–į—á–ł–ľ–ĺ–Ķ –≤–Ľ–ł—Ź–Ĺ–ł–Ķ –Ĺ–į –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–Ķ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į, –≤–ļ–Ľ—é—á–į—é—Č–ł–Ļ –ł–∑–≤–Ķ—Ā—ā–Ĺ—č–Ķ —Ą–į–ļ—ā–ĺ—Ä—č —Ä–ł—Ā–ļ–į —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ-—Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ, —ā–į–ļ–ł–Ķ –ļ–į–ļ —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–į—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć, —Ā—ā–į—Ä—á–Ķ—Ā–ļ–ł–Ļ –≤–ĺ–∑—Ä–į—Ā—ā, –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ü–Ķ–Ľ–Ķ–≤–ĺ–≥–ĺ –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź, –ĺ—Ā–ĺ–Ī–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ĺ–į–∑–Ĺ–į—á–į–Ķ–ľ–ĺ–Ļ –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł. –í–ľ–Ķ—Ā—ā–Ķ —Ā —ā–Ķ–ľ –≤ —ą–ļ–į–Ľ—É-—Ä–ł—Ā–ļ–ĺ–ľ–Ķ—ā—Ä –≤–ĺ—ą–Ķ–Ľ —ā–į–ļ–ĺ–Ļ –Ņ–ĺ–ļ–į–∑–į—ā–Ķ–Ľ—Ć, –ļ–į–ļ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł—é, —É—Ä–ĺ–≤–Ķ–Ĺ—Ć –ļ–ĺ—ā–ĺ—Ä–ĺ–Ļ –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ľ—Ā—Ź –Ņ–ĺ –ĺ–Ņ—Ä–ĺ—Ā–Ĺ–ł–ļ—É –ú–ĺ—Ä–ł—Ā–ļ–ł ‚ÄĒ –ď—Ä–ł–Ĺ–į. –Ę–į–ļ–ł–ľ –ĺ–Ī—Ä–į–∑–ĺ–ľ, –Ņ–ĺ–Ľ—É—á–Ķ–Ĺ–Ĺ—č–Ķ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā—č –Ķ—Č–Ķ —Ä–į–∑ –Ņ–ĺ–ī—á–Ķ—Ä–ļ–ł–≤–į—é—ā –≤–į–∂–Ĺ–ĺ—Ā—ā—Ć —Ā–ĺ–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź –≤—Ä–į—á–Ķ–Ī–Ĺ—č—Ö —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–į—Ü–ł–Ļ –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ–ł, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł–ľ–ł –ė–ú. –°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ –ī–į–Ĺ–Ĺ—č–ľ –Ľ–ł—ā–Ķ—Ä–į—ā—É—Ä—č –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł—é –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, —Ā—ā—Ä–į–ī–į—é—Č–ł—Ö —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ–ł –Ĺ–Ķ–ł–Ĺ—Ą–Ķ–ļ—Ü–ł–ĺ–Ĺ–Ĺ—č–ľ–ł –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł—Ź–ľ–ł, –Ĺ–ł–∑–ļ–į—Ź, –∑–į—á–į—Ā—ā—É—é –Ĺ–Ķ –ī–ĺ—Ā—ā–ł–≥–į—é—Č–į—Ź 50% [12, 13]. –í –ļ—Ä—É–Ņ–Ĺ–ĺ–ľ –ľ–Ķ—ā–į–į–Ĺ–į–Ľ–ł–∑–Ķ (–Ī–ĺ–Ľ–Ķ–Ķ 350 —ā—č—Ā. –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, —Ā—ā—Ä–į–ī–į—é—Č–ł—Ö –ė–Ď–°) –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł—é —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į —ā–ĺ–Ľ—Ć–ļ–ĺ 57% –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 2 –Ľ–Ķ—ā –Ĺ–į–Ī–Ľ—é–ī–Ķ–Ĺ–ł—Ź, –Ņ—Ä–ł —ć—ā–ĺ–ľ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł—Ö –ė–ú, –Ī—č–Ľ–į –Ĺ–Ķ—Ā–ļ–ĺ–Ľ—Ć–ļ–ĺ –≤—č—ą–Ķ –ł —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 66%, —ā–ĺ–≥–ī–į –ļ–į–ļ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ī–Ķ–∑ –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā–Ķ–Ĺ–Ĺ–ĺ–Ļ –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ļ –ļ–į—ā–į—Ā—ā—Ä–ĺ—Ą—č —Ā–ĺ—Ā—ā–į–≤–ł–Ľ–į 50% [14]. –Ě–Ķ–ĺ–Ī—Ö–ĺ–ī–ł–ľ–ĺ –ĺ—ā–ľ–Ķ—ā–ł—ā—Ć, —á—ā–ĺ –ī–į–∂–Ķ –≤ –ļ—Ä—É–Ņ–Ĺ—č—Ö —Ä–į–Ĺ–ī–ĺ–ľ–ł–∑–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—č—Ö –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź—Ö —Ą–ł–ļ—Ā–ł—Ä—É–Ķ—ā—Ā—Ź –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–į—Ź –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ľ–Ķ—á–Ķ–Ĺ–ł—é. –Ę–į–ļ, –Ĺ–į–Ņ—Ä–ł–ľ–Ķ—Ä, –≤ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł CURE 46,2% –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤ –Ņ—Ä–Ķ—Ä—č–≤–į–Ľ–ł –Ņ—Ä–ł–Ķ–ľ –ļ–Ľ–ĺ–Ņ–ł–ī–ĺ–≥—Ä–Ķ–Ľ–į –≤ —Ā–ĺ—Ā—ā–į–≤–Ķ –ī–≤–ĺ–Ļ–Ĺ–ĺ–Ļ –į–Ĺ—ā–ł–į–≥—Ä–Ķ–≥–į–Ĺ—ā–Ĺ–ĺ–Ļ —ā–Ķ—Ä–į–Ņ–ł–ł –Ī–ĺ–Ľ–Ķ–Ķ —á–Ķ–ľ –Ĺ–į 5 –ī–Ĺ–Ķ–Ļ, –į –ļ–į–∂–ī—č–Ļ –Ņ—Ź—ā—č–Ļ —É—á–į—Ā—ā–Ĺ–ł–ļ –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł—Ź –Ņ—Ä–Ķ–ļ—Ä–į—ā–ł–Ľ –Ņ—Ä–ł–Ķ–ľ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–į —Ä–į–Ĺ—Ć—ą–Ķ –≤—Ä–Ķ–ľ–Ķ–Ĺ–ł [15].
–í–ľ–Ķ—Ā—ā–Ķ —Ā —ā–Ķ–ľ –≤–∑–į–ł–ľ–ĺ—Ā–≤—Ź–∑—Ć –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é —Ā –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ł–ľ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ–ľ –ė–Ď–° –Ĺ–į—Ö–ĺ–ī–ł—ā —Ā–≤–ĺ–Ķ –Ņ–ĺ–ī—ā–≤–Ķ—Ä–∂–ī–Ķ–Ĺ–ł–Ķ –≤ —Ä–į–Ī–ĺ—ā–į—Ö –ĺ—ā–Ķ—á–Ķ—Ā—ā–≤–Ķ–Ĺ–Ĺ—č—Ö –ł –∑–į—Ä—É–Ī–Ķ–∂–Ĺ—č—Ö —É—á–Ķ–Ĺ—č—Ö. –í –ł—Ā—Ā–Ľ–Ķ–ī–ĺ–≤–į–Ĺ–ł–ł —ą–≤–Ķ–Ļ—Ü–į—Ä—Ā–ļ–ł—Ö —É—á–Ķ–Ĺ—č—Ö, –≤–ļ–Ľ—é—á–į—é—Č–Ķ–ľ 4349 –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā –ė–ú, –≤—č—Ā–ĺ–ļ–į—Ź —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–Ĺ–ĺ–ľ—É –Ľ–Ķ—á–Ķ–Ĺ–ł—é –Ī—č–Ľ–į –į—Ā—Ā–ĺ—Ü–ł–ł—Ä–ĺ–≤–į–Ĺ–į —Ā–ĺ –∑–Ĺ–į—á–ł–ľ—č–ľ —Ā–Ĺ–ł–∂–Ķ–Ĺ–ł–Ķ–ľ –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā–ł —Ā–ľ–Ķ—Ä—ā–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ł—Ā—Ö–ĺ–ī–į –≤ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ [22]. –°–ĺ–≥–Ľ–į—Ā–Ĺ–ĺ —Ā–ĺ–Ī—Ā—ā–≤–Ķ–Ĺ–Ĺ—č–ľ —Ä–į–Ĺ–Ķ–Ķ –ĺ–Ņ—É–Ī–Ľ–ł–ļ–ĺ–≤–į–Ĺ–Ĺ—č–ľ –ī–į–Ĺ–Ĺ—č–ľ –Ĺ–ł–∑–ļ–į—Ź –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł—é –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ņ–Ķ—Ä–Ķ–Ĺ–Ķ—Ā—ą–ł—Ö –ė–ú, –Ņ–ĺ–≤—č—ą–į–Ķ—ā —Ä–ł—Ā–ļ —Ä–į–∑–≤–ł—ā–ł—Ź –Ņ–ĺ–≤—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –ė–ú –≤ 3 —Ä–į–∑–į –Ņ–ĺ —Ā—Ä–į–≤–Ĺ–Ķ–Ĺ–ł—é —Ā –Ņ–į—Ü–ł–Ķ–Ĺ—ā–į–ľ–ł, –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ—č–ľ–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é. –ö—Ä–ĺ–ľ–Ķ —ć—ā–ĺ–≥–ĺ, —É –Ņ–į—Ü–ł–Ķ–Ĺ—ā–ĺ–≤, –Ĺ–Ķ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ—č—Ö –Ľ–Ķ—á–Ķ–Ĺ–ł—é, –≤ 2 —Ä–į–∑–į —á–į—Č–Ķ —Ä–Ķ–≥–ł—Ā—ā—Ä–ł—Ä—É—é—ā—Ā—Ź —Ä–į–∑–Ľ–ł—á–Ĺ—č–Ķ –≤–ł–ī—č –Ĺ–į—Ä—É—ą–Ķ–Ĺ–ł–Ļ —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ–≥–ĺ —Ä–ł—ā–ľ–į [23]. –í–ľ–Ķ—Ā—ā–Ķ —Ā —ā–Ķ–ľ –Ņ–ĺ–≤–Ľ–ł—Ź—ā—Ć –Ĺ–į –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā—Ć –Ľ–Ķ—á–Ķ–Ĺ–ł—é –ļ—Ä–į–Ļ–Ĺ–Ķ —Ā–Ľ–ĺ–∂–Ĺ–ĺ, —ā–į–ļ –ļ–į–ļ –∑–Ĺ–į—á–ł—ā–Ķ–Ľ—Ć–Ĺ–į—Ź —á–į—Ā—ā—Ć –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ—č—Ö –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö –Ĺ–ł –Ņ—Ä–ł –ļ–į–ļ–ł—Ö –ĺ–Ī—Ā—ā–ĺ—Ź—ā–Ķ–Ľ—Ć—Ā—ā–≤–į—Ö –Ĺ–Ķ –≥–ĺ—ā–ĺ–≤—č –Ņ—Ä–ł–Ĺ–ł–ľ–į—ā—Ć —Ä–Ķ–ļ–ĺ–ľ–Ķ–Ĺ–ī–ĺ–≤–į–Ĺ–Ĺ—č–Ķ –ľ–Ķ–ī–ł–ļ–į–ľ–Ķ–Ĺ—ā–ĺ–∑–Ĺ—č–Ķ –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā—č. –Ē–Ľ—Ź —É–Ľ—É—á—ą–Ķ–Ĺ–ł—Ź –ľ–ĺ—ā–ł–≤–į—Ü–ł–ł –Ī–ĺ–Ľ—Ć–Ĺ—č—Ö —Ā–Ľ–Ķ–ī—É–Ķ—ā —É–ī–Ķ–Ľ—Ź—ā—Ć –≤—Ä–Ķ–ľ—Ź —Ā–į–Ĺ–ł—ā–į—Ä–Ĺ–ĺ-–Ņ—Ä–ĺ—Ā–≤–Ķ—ā–ł—ā–Ķ–Ľ—Ć–Ĺ–ĺ–Ļ —Ä–į–Ī–ĺ—ā–Ķ, —Ā –Ņ—Ä–Ķ–ī–ĺ—Ā—ā–į–≤–Ľ–Ķ–Ĺ–ł–Ķ–ľ –ł–ľ –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł–ł –ĺ –∑–į–Ī–ĺ–Ľ–Ķ–≤–į–Ĺ–ł–ł, –ĺ –ľ–Ķ—ā–ĺ–ī–į—Ö –Ķ–≥–ĺ –Ľ–Ķ—á–Ķ–Ĺ–ł—Ź, –ĺ –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–Ķ –ł –≤–Ķ—Ä–ĺ—Ź—ā–Ĺ–ĺ—Ā—ā–ł —Ä–į–∑–≤–ł—ā–ł—Ź —ā—Ź–∂–Ķ–Ľ—č—Ö —Ā–Ķ—Ä–ī–Ķ—á–Ĺ–ĺ-—Ā–ĺ—Ā—É–ī–ł—Ā—ā—č—Ö –ĺ—Ā–Ľ–ĺ–∂–Ĺ–Ķ–Ĺ–ł–Ļ [24‚Äď25]. –í —ć—ā–ĺ–ľ –ļ–ĺ–Ĺ—ā–Ķ–ļ—Ā—ā–Ķ —Ä–į—Ā–ļ—Ä—č–≤–į—é—ā—Ā—Ź –≤—Ā–Ķ –Ņ—Ä–Ķ–ł–ľ—É—Č–Ķ—Ā—ā–≤–į –Ņ—Ä–Ķ–ī–Ľ–į–≥–į–Ķ–ľ–ĺ–≥–ĺ —Ā–Ņ–ĺ—Ā–ĺ–Ī–į –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–° —Ā —É—á–Ķ—ā–ĺ–ľ –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é, —ā–į–ļ –ļ–į–ļ –ī–į–∂–Ķ –≤–ĺ –≤—Ä–Ķ–ľ—Ź –į–ľ–Ī—É–Ľ–į—ā–ĺ—Ä–Ĺ–ĺ–≥–ĺ –Ņ—Ä–ł–Ķ–ľ–į –Ņ–į—Ü–ł–Ķ–Ĺ—ā—É –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –Ĺ–į–≥–Ľ—Ź–ī–Ĺ–ĺ –Ņ—Ä–ĺ–ī–Ķ–ľ–ĺ–Ĺ—Ā—ā—Ä–ł—Ä–ĺ–≤–į–Ĺ–ĺ –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä—É–Ķ–ľ–ĺ–Ķ —É–Ľ—É—á—ą–Ķ–Ĺ–ł–Ķ –ļ–Ľ–ł–Ĺ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ —ā–Ķ—á–Ķ–Ĺ–ł—Ź –ė–Ď–° –≤ –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–ľ –Ņ–Ķ—Ä–ł–ĺ–ī–Ķ –Ņ—Ä–ł –Ņ–ĺ–≤—č—ą–Ķ–Ĺ–ł–ł –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é.
–ó–į–ļ–Ľ—é—á–Ķ–Ĺ–ł–Ķ
–°–ĺ–≤–ĺ–ļ—É–Ņ–Ĺ–ĺ—Ā—ā—Ć —Ą–į–ļ—ā–ĺ—Ä–ĺ–≤, –≤–ļ–Ľ—é—á–į—é—Č–ł—Ö: –Ņ—Ä–ĺ–ł–∑–≤–Ķ–ī–Ķ–Ĺ–ł–Ķ —É–ī–Ķ–Ľ—Ć–Ĺ–ĺ–≥–ĺ –≤–Ķ—Ā–į –∂–ł–∑–Ĺ–Ķ–Ĺ–Ĺ–ĺ –≤–į–∂–Ĺ—č—Ö –Ņ—Ä–Ķ–Ņ–į—Ä–į—ā–ĺ–≤ –≤ –ĺ–Ī—Č–Ķ–Ļ —Ā—ā—Ä—É–ļ—ā—É—Ä–Ķ –Ĺ–į–∑–Ĺ–į—á–Ķ–Ĺ–ł–Ļ (–ł–Ĺ–ī–Ķ–ļ—Ā V) –Ĺ–į —Ā—ā–Ķ–Ņ–Ķ–Ĺ—Ć –Ņ—Ä–ł–≤–Ķ—Ä–∂–Ķ–Ĺ–Ĺ–ĺ—Ā—ā–ł –Ľ–Ķ—á–Ķ–Ĺ–ł—é, –ĺ–Ņ—Ä–Ķ–ī–Ķ–Ľ—Ź–Ķ–ľ–ĺ–Ļ –Ņ–ĺ —Ä–Ķ–∑—É–Ľ—Ć—ā–į—ā–į–ľ —ā–Ķ—Ā—ā–į –ú–ĺ—Ä–ł—Ā–ļ–ł ‚ÄĒ –ď—Ä–ł–Ĺ–į; —Ö—Ä–ĺ–Ĺ–ł—á–Ķ—Ā–ļ—É—é —Ā–Ķ—Ä–ī–Ķ—á–Ĺ—É—é –Ĺ–Ķ–ī–ĺ—Ā—ā–į—ā–ĺ—á–Ĺ–ĺ—Ā—ā—Ć, –ī–ł–į–≥–Ĺ–ĺ—Ā—ā–ł—Ä–ĺ–≤–į–Ĺ–Ĺ—É—é –ī–ĺ —Ä–į–∑–≤–ł—ā–ł—Ź –ĺ—Ā—ā—Ä–ĺ–Ļ –ļ–ĺ—Ä–ĺ–Ĺ–į—Ä–Ĺ–ĺ–Ļ –ļ–į—ā–į—Ā—ā—Ä–ĺ—Ą—č; –ĺ—ā—Ā—É—ā—Ā—ā–≤–ł–Ķ –ī–ĺ—Ā—ā–ł–∂–Ķ–Ĺ–ł—Ź —Ü–Ķ–Ľ–Ķ–≤—č—Ö —É—Ä–ĺ–≤–Ĺ–Ķ–Ļ —Ā–ł—Ā—ā–ĺ–Ľ–ł—á–Ķ—Ā–ļ–ĺ–≥–ĺ –į—Ä—ā–Ķ—Ä–ł–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ –ī–į–≤–Ľ–Ķ–Ĺ–ł—Ź —á–Ķ—Ä–Ķ–∑ 1 –≥–ĺ–ī –Ņ–ĺ—Ā–Ľ–Ķ –ė–ú; –≤–ĺ–∑—Ä–į—Ā—ā 75 –Ľ–Ķ—ā –ł –Ī–ĺ–Ľ–Ķ–Ķ –Ĺ–į –ľ–ĺ–ľ–Ķ–Ĺ—ā –ł–Ĺ–ī–Ķ–ļ—Ā–Ĺ–ĺ–≥–ĺ –ė–ú, ‚ÄĒ –Ņ–ĺ–∑–≤–ĺ–Ľ—Ź–Ķ—ā –Ņ—Ä–Ķ–ī—Ā–ļ–į–∑—č–≤–į—ā—Ć —Ä–į–∑–≤–ł—ā–ł–Ķ –Ĺ–Ķ–Ī–Ľ–į–≥–ĺ–Ņ—Ä–ł—Ź—ā–Ĺ—č—Ö –°–°–° –≤ —ā–Ķ—á–Ķ–Ĺ–ł–Ķ 5 –Ľ–Ķ—ā –Ņ–ĺ—Ā—ā–ł–Ĺ—Ą–į—Ä–ļ—ā–Ĺ–ĺ–≥–ĺ –Ņ–Ķ—Ä–ł–ĺ–ī–į. –ü—Ä–ł —ć—ā–ĺ–ľ –ī–Ľ—Ź –ĺ–Ī–Ķ—Ā–Ņ–Ķ—á–Ķ–Ĺ–ł—Ź –ľ–į–ļ—Ā–ł–ľ–į–Ľ—Ć–Ĺ–ĺ–≥–ĺ —É–ī–ĺ–Ī—Ā—ā–≤–į –ł –Ĺ–į–≥–Ľ—Ź–ī–Ĺ–ĺ–Ļ –≤–ł–∑—É–į–Ľ–ł–∑–į—Ü–ł–ł –Ņ—Ä–ĺ–≥–Ĺ–ĺ–∑–ł—Ä—É–Ķ–ľ–ĺ–≥–ĺ —Ä–ł—Ā–ļ–į –ľ–ĺ–∂–Ķ—ā –Ī—č—ā—Ć –ł—Ā–Ņ–ĺ–Ľ—Ć–∑–ĺ–≤–į–Ĺ–į –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ–į—Ź –≥—Ä–į—Ą–ł—á–Ķ—Ā–ļ–į—Ź —ą–ļ–į–Ľ–į-—Ä–ł—Ā–ļ–ĺ–ľ–Ķ—ā—Ä.
–°–≤–Ķ–ī–Ķ–Ĺ–ł—Ź –ĺ–Ī –į–≤—ā–ĺ—Ä–į—Ö:
–ö—É–∂–Ķ–Ľ–Ķ–≤–į –ē–Ľ–Ķ–Ĺ–į –ź–Ĺ–ī—Ä–Ķ–Ķ–≤–Ĺ–į ‚ÄĒ –ļ.–ľ.–Ĺ., –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –ľ–ł–ĺ–ļ–į—Ä–ī–į –Ě–ė–ė –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł–ł, –Ę–ĺ–ľ—Ā–ļ–ł–Ļ –Ě–ė–ú–¶; 634012, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ę–ĺ–ľ—Ā–ļ, —É–Ľ. –ö–ł–Ķ–≤—Ā–ļ–į—Ź, –ī. 111–į; ORCID iD 0000-0002-8070-2234.
–§–Ķ–ī—é–Ĺ–ł–Ĺ–į –í–Ķ—Ä–į –ź–Ľ–Ķ–ļ—Ā–į–Ĺ–ī—Ä–ĺ–≤–Ĺ–į ‚ÄĒ –ľ–Ľ–į–ī—ą–ł–Ļ –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –ľ–ł–ĺ–ļ–į—Ä–ī–į –Ě–ė–ė –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł–ł, –Ę–ĺ–ľ—Ā–ļ–ł–Ļ –Ě–ė–ú–¶; 634012, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ę–ĺ–ľ—Ā–ļ, —É–Ľ. –ö–ł–Ķ–≤—Ā–ļ–į—Ź, –ī. 111–į.
–ź–Ľ–Ķ–ļ—Ā–į–Ĺ–ī—Ä–Ķ–Ĺ–ļ–ĺ –í–ł–ļ—ā–ĺ—Ä–ł—Ź –ź–Ĺ–į—ā–ĺ–Ľ—Ć–Ķ–≤–Ĺ–į ‚ÄĒ –ľ–Ľ–į–ī—ą–ł–Ļ –Ĺ–į—É—á–Ĺ—č–Ļ —Ā–ĺ—ā—Ä—É–ī–Ĺ–ł–ļ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –ľ–ł–ĺ–ļ–į—Ä–ī–į –Ě–ė–ė –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł–ł, –Ę–ĺ–ľ—Ā–ļ–ł–Ļ –Ě–ė–ú–¶; 634012, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ę–ĺ–ľ—Ā–ļ, —É–Ľ. –ö–ł–Ķ–≤—Ā–ļ–į—Ź, –ī. 111–į.
–ö–ĺ–Ĺ–ī—Ä–į—ā—Ć–Ķ–≤ –ú–ł—Ö–į–ł–Ľ –ģ—Ä—Ć–Ķ–≤–ł—á ‚ÄĒ –≤—Ä–į—á-–ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –ľ–ł–ĺ–ļ–į—Ä–ī–į –Ě–ė–ė –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł–ł, –Ę–ĺ–ľ—Ā–ļ–ł–Ļ –Ě–ė–ú–¶; 634012, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ę–ĺ–ľ—Ā–ļ, —É–Ľ. –ö–ł–Ķ–≤—Ā–ļ–į—Ź, –ī. 111–į.
–ź–Ņ—ā–Ķ–ļ–į—Ä—Ć –í–Ľ–į–ī–ł–ľ–ł—Ä –Ē–ľ–ł—ā—Ä–ł–Ķ–≤–ł—á ‚ÄĒ –ī.–ľ.–Ĺ., –∑–į–≤–Ķ–ī—É—é—Č–ł–Ļ –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł–Ķ–ľ –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –ľ–ł–ĺ–ļ–į—Ä–ī–į –Ě–ė–ė –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł–ł, –Ę–ĺ–ľ—Ā–ļ–ł–Ļ –Ě–ė–ú–¶; 634012, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ę–ĺ–ľ—Ā–ļ, —É–Ľ. –ö–ł–Ķ–≤—Ā–ļ–į—Ź, –ī. 111–į.
–ď–į—Ä–≥–į–Ĺ–Ķ–Ķ–≤–į –ź–Ľ–Ľ–į –ź–Ĺ–į—ā–ĺ–Ľ—Ć–Ķ–≤–Ĺ–į ‚ÄĒ –ī.–ľ.–Ĺ., –Ņ—Ä–ĺ—Ą–Ķ—Ā—Ā–ĺ—Ä, —Ä—É–ļ–ĺ–≤–ĺ–ī–ł—ā–Ķ–Ľ—Ć –ĺ—ā–ī–Ķ–Ľ–Ķ–Ĺ–ł—Ź –Ņ–į—ā–ĺ–Ľ–ĺ–≥–ł–ł –ľ–ł–ĺ–ļ–į—Ä–ī–į –Ě–ė–ė –ļ–į—Ä–ī–ł–ĺ–Ľ–ĺ–≥–ł–ł, –Ę–ĺ–ľ—Ā–ļ–ł–Ļ –Ě–ė–ú–¶; 634012, –†–ĺ—Ā—Ā–ł—Ź, –≥. –Ę–ĺ–ľ—Ā–ļ, —É–Ľ. –ö–ł–Ķ–≤—Ā–ļ–į—Ź, –ī. 111–į; ORCID iD 0000-0002-9488-6900.
–ö–ĺ–Ĺ—ā–į–ļ—ā–Ĺ–į—Ź –ł–Ĺ—Ą–ĺ—Ä–ľ–į—Ü–ł—Ź: –ö—É–∂–Ķ–Ľ–Ķ–≤–į –ē–Ľ–Ķ–Ĺ–į –ź–Ĺ–ī—Ä–Ķ–Ķ–≤–Ĺ–į, e-mail: snigireva1209@rambler.ru. –ü—Ä–ĺ–∑—Ä–į—á–Ĺ–ĺ—Ā—ā—Ć —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –ī–Ķ—Ź—ā–Ķ–Ľ—Ć–Ĺ–ĺ—Ā—ā–ł: –Ĺ–ł–ļ—ā–ĺ –ł–∑ –į–≤—ā–ĺ—Ä–ĺ–≤ –Ĺ–Ķ –ł–ľ–Ķ–Ķ—ā —Ą–ł–Ĺ–į–Ĺ—Ā–ĺ–≤–ĺ–Ļ –∑–į–ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤–į–Ĺ–Ĺ–ĺ—Ā—ā–ł –≤ –Ņ—Ä–Ķ–ī—Ā—ā–į–≤–Ľ–Ķ–Ĺ–Ĺ—č—Ö –ľ–į—ā–Ķ—Ä–ł–į–Ľ–į—Ö –ł–Ľ–ł –ľ–Ķ—ā–ĺ–ī–į—Ö. –ö–ĺ–Ĺ—Ą–Ľ–ł–ļ—ā –ł–Ĺ—ā–Ķ—Ä–Ķ—Ā–ĺ–≤ –ĺ—ā—Ā—É—ā—Ā—ā–≤—É–Ķ—ā. –°—ā–į—ā—Ć—Ź –Ņ–ĺ—Ā—ā—É–Ņ–ł–Ľ–į 14.09.2020, –Ņ–ĺ—Ā—ā—É–Ņ–ł–Ľ–į –Ņ–ĺ—Ā–Ľ–Ķ —Ä–Ķ—Ü–Ķ–Ĺ–∑–ł—Ä–ĺ–≤–į–Ĺ–ł—Ź 28.09.2020, –Ņ—Ä–ł–Ĺ—Ź—ā–į –≤ –Ņ–Ķ—á–į—ā—Ć 12.10.2020.
About the authors:
Elena A. Kuzheleva ‚ÄĒ Cand. of Sci. (Med.), Researcher of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation; ORCID iD 0000-0003-4019-3735.
Vera A. Fedyunina ‚ÄĒ Junior Researcher of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Victoria A. Alexandrenko ‚ÄĒ Junior Researcher of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Mikhail A. Kondratiev ‚ÄĒ cardiologist of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Vladimir A. Aptekar ‚ÄĒ Dr. of Sci. (Med.), Head of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation.
Alla A. Garganeeva ‚ÄĒ Dr. of Sci. (Med.), Professor, Head of the Department of Myocardial Pathology, Research Institute of Cardiology at the Tomsk National Research Medical Center of the Russian Academy of Sciences: 111A, Kievskaya str., Tomsk, 634012, Russian Federation; ORCID iD 0000-0002-9488-6900.
Contact information: Elena A. Kuzheleva, e-mail: snigireva1209@rambler.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 14.09.2020, revised 28.09.2020, accepted 12.10.2020.












