Введение
Увеличение ожидаемой продолжительности жизни в развитых странах имеет не только положительные стороны: с общим постарением населения возрастает и число пациентов, страдающих сенильной деменцией. Деменция представляет собой ведущий клинический синдром при различных атрофических заболеваниях головного мозга. В любом случае причиной развития болезни является утрата нейронами нормальной функции. Деменция характеризуется столь тяжелым снижением интеллектуальных способностей, что наносится ущерб социальной и профессиональной адаптации пациента. При этом на первый план выступают такие симптомы, как нарушение памяти, ослабление концентрации внимания, нарушение восприятия, мышления, ориентированности, аффективные нарушения, и, наконец, депрессивная и тревожная симптоматика.
Увеличение ожидаемой продолжительности жизни в развитых странах имеет не только положительные стороны: с общим постарением населения возрастает и число пациентов, страдающих сенильной деменцией. Деменция представляет собой . В любом случае причиной развития болезни является утрата нейронами нормальной функции. Деменция характеризуется столь тяжелым снижением интеллектуальных способностей, что наносится ущерб социальной и профессиональной адаптации пациента. При этом на первый план выступают такие симптомы, как нарушение памяти, ослабление концентрации внимания, нарушение восприятия, мышления, ориентированности, аффективные нарушения, и, наконец, депрессивная и тревожная симптоматика.Подсчитано, что деменцией страдают 10% лиц старше 65 лет и 20% лиц старше 75 лет. И только у 10% этих больных выявляемые причины деменции могут быть устранены (Katzmann, 1976). При анализе секционного материала в качестве причины возрастной деменции более чем в 50% случаев обнаруживают болезнь Альцгеймера, примерно в 12–20% – цереброваскулярные заболевания и от 16% до 20% – сочетание обоих состояний (O’Brien, 1977; Tomlinson et al., 1970). Другие специфические основные заболевания обнаруживаются только в около 10% всех случаев (Brun, 1987).
Ключевым синдромом деменции является психоорганический синдром поражения головного мозга.
Течение первичной дегенеративной деменции типа Альцгеймера характеризуется постепенным, малозаметным началом и обычно быстрым прогрессированием симптомов на поздней стадии заболевания. Согласно данным Hoyer (1988), первичная деменция сопровождается уменьшением энергетического обмена веществ в головном мозге. Для болезни Альцгеймера, наряду с нарушениями в сфере нейротрансмиттеров, специфическими и типичными являются нейродегенеративные изменения: отложения амилоид–b–протеина, а также образование сенильных бляшек и нейрофибриллярных клубков, которые в процессе заболевания распространяются все далее, поражая более глубокие структуры головного мозга. Установлена связь между концентрацией нейрофибриллярных клубков и степенью тяжести деменции (Tomlinso, Henderson, 1976), хотя в последнее время поднимается вопрос о том, является ли отложение амилоида причиной или следствием развития заболевания. Патогенетическая терапия деменции до сих пор не представляется возможной, поскольку причина ее остается либо неизвестной (SDAT – сенильная деменция типа Альцгеймера), либо не поддающейся воздействию (MID – мультиинфарктная деменция (МИД)). Существующие в настоящее время подходы в лечении деменции основываются, например, на улучшении вазодилататорных и реологических параметров, на улучшении доставки и использования кислорода и глюкозы, на замещении необходимых трансмиттеров, например, допамина, серотонина или ацетилхолина.
Терапия первичной деменции, а также сенильной деменции типа Альцгеймера и мультиинфарктной деменции является многоплановой. Ее главная цель – лечение когнитивных расстройств, а также улучшение социальной интеграции пациентов и компенсация их личностных изменений.
При помощи распространенных так называемых «препаратов против Альцгеймера», например, агонистов холина или блокаторов холинэстеразы, можно достичь только условного клинического эффекта. Поэтому ведущие исследователи в области болезни Альцгеймера прежде всего рекомендуют применение ноотропных препаратов уже на ранней стадии заболевания. Остается нерешенным вопрос, какую роль способны сыграть гемодериваты в лечении симптомов деменции. В этой связи проведение проспективного контролируемого исследования эффективности гемодеривата с априори убедительным дизайном приобретает особую актуальность и значимость.
Актовегин
Актовегин представляет собой депротеинизированный гемодиализат, уже в течение 30 лет используемый при лечении деменции. Представление о механизмах его действия сводилось к улучшению нарушенного энергетического статуса клеток путем повышения доставки кислорода и глюкозы, а также за счет усиления утилизации глюкозы. Данное воздействие на обмен веществ в клетке обнаруживается на различных уровнях его оценки. Препарат вызывает, особенно в условиях дефицита, улучшение энергетического состояния клеток как путем повышения поступления в них глюкозы и кислорода, так и путем более интенсивного использования кислорода и глюкозы.
Данное воздействие на клеточный обмен веществ может быть доказано на различных уровнях.
Стимуляция потребления кислорода обнаруживалась на клеточных системах различного происхождения (Jaeger et al., 1965; Pichotka et al., 1965; Mori et al., 1974). Соответствующее действие может быть продемонстрировано на срезах тканей (Breuer et al., 1961). Повышение утилизации кислорода было доказано и в экспериментах на органах, подвергавшихся перфузии гемодиализатом (Reichel et al., 1965). De Groot и соавт. (1990) обнаружили на культуре гепатоцитов, что способность к выживанию последних в условиях гипоксии может значительно повышаться при применении Актовегина.
Так, например, под действием Актовегина транспорт глюкозы из крови в головной мозг может повышаться на одну треть (Quadbeck et al., 1972). Как показало одновременное добавление антител к инсулину, развитие этого эффекта является инсулиннезависимым (Bachmann et al., 1968). Известное с 1968 года по исследованиям на жировой ткани (Parade et al., 1968) инсулиноподобное действие гемодиализата на обмен углеводов было позже подтверждено другими исследователями (Obermeir– Kusser et al., 1989; Machiano et al., 1989; Machiano et al., 1990). Исходя из этого можно постулировать существование мест связывания для данного препарата на определенных рецепторах. При этом речь идет о локализованных на клеточной мембране переносчиках глюкозы, которые активируются одним или несколькими компонентами гемодиализата, приводя таким образом к усилению транспорта глюкозы, соответствующему 50% максимального эффекта инсулина.
То, что применение гемодиализата приводит не только к повышению интрацеллюлярного уровня глюкозы, но и, как результат такового, к воздействию на баланс энергии, следует из исследований на собаках, у которых с введением наркоза был нарушен обмен энергии в головном мозге. В сравнении с контрольной группой у животных, получавших Актовегин, отмечалось не только более высокое потребление кислорода и глюкозы, но и более высокие концентрации АТФ и основных нуклеотидов.
Изучение ЭЭГ в условиях недостатка кислорода косвенно подтверждают эти данные. Крысы были помещены в атмосферу с парциальной концентрацией кислорода, соответствующей высотам 8700 метров (Quadbeck et al., 1972) и 10 000 метров над уровнем моря (Hoyer, 1980). В обоих исследованиях было продемонстрировано протективное воздействие Актовегина.
Благоприятное воздействие Актовегина на церебральный обмен веществ в условиях гипоксии отметили Hoyer и Betz (1989). У старых крыс (возраст – 2 года) исследовались метаболизм глюкозы и энергетический статус в коре головного мозга и гиппокампе по истечении 15 минут полной ишемии и затем после постишемической рециркуляции. В коре головного мозга было обнаружено восстановление сниженного по сравнению с контрольной группой уровня креатинфосфата и, в особенности, АТФ. В гиппокампе, где обусловленные гипоксией нарушения энергетического обмена вызвали еще более выраженный дефицит, снижение креатинфосфата за более длительный промежуток времени было полностью предотвращено. Этот эффект оказался несколько менее выраженным в отношении уровня АТФ.
Различными авторами было проведено изучение ЭЭГ в рамках клинических исследований. В одном двойном слепом, плацебо–контролируемом одномоментном исследовании у пробандов путем применения барбитуратов было спровоцировано нарушение сознания. Уже спустя 30 минут после перорального приема Актовегина можно было обнаружить его эффект, проявлявшийся в восстановлении сознания как электроэнцефалографически, так и психометрически (Krauskopf et al., 1987).
Эти данные подтвердили Saletu и соавт. (1991) в другом аналогичном плацебо–контролируемом, двойном слепом исследовании у пожилых пробандов посредством компьютеризированного ЭЭГ–спектрального анализа, психометрических и психофизиологических тестов. В последующем коротком, двойном слепом, плацебо–контролируемом исследовании те же авторы исследовали действие парентерально вводимого Актовегина у пациентов, страдавших ассоциированными с возрастом нарушениями памяти (AAMI), при помощи визуализирующей методики топографического ЭЭГ–картирования и когнитивного ответа на возбуждение, в частности, P–300.
На ЭЭГ выявлялись значительные изменения параметров, типичных для бодрствования – отмечалось улучшение бодрствования в следующих топографических областях: теменной, лобной и височно–затылочной (Saletu et al., 1991).
Р–300 амплитуда значительно повышалась по сравнению с плацебо, особенно в центральной и височной областях. Это повышение может считаться индикатором пригодности ресурсов для обработки когнитивной информации (Semlitsch et al., 1991).
Подводя итоги, надо сказать, что широко распространенному предубеждению о клинической неэффективности Актовегина противопоставляется серия клинических и клинико–фармакологических исследований, которая может полностью отобразить отдельные эффекты его терапевтического воздействия. Oswald (Oswald et al., 1991) в одном клиническом исследовании, используя «скорость выполнения когнитивных функций» в качестве оценочного критерия, смог доказать улучшение сознания по скорости «жидких» когнитивных процессов. В каждую рандомизированную группу в условиях двойного слепого метода было включено по 64 пациента с легкой и средней степенью тяжести психоорганического синдрома, ежедневно принимавших per os Актовегин либо плацебо. На восьмой неделе лечения Актовегином наблюдались значительные улучшения как у отдельно взятых пациентов, так и при сопоставлении результатов между группами пациентов. Скорость осуществления когнитивных функций оценивалась с помощью проведения трех тестов, каждый из которых оценивает качество и скорость когнитивной обработки информации. В частности, они включали в себя тест по установлению взаимосвязи между числами (ZVT–G), тест с лабиринтом (LT–G) и тест с числами и символами (ZS–G). Тесная взаимосвязь между величинами скорости обработки информации и способностью решать повседневные проблемы может считаться эмпирически доказанной (Oswald et al., 1985; Oswald 1982; Oswald, Seus, 1975). Более того, было показано, что психометрически доказанные улучшения этих основных когнитивных функциональных сфер сопровождаются характерным изменением активности головного мозга (Koffler, Harrer 1989) и изменением ЭЭГ в покое (Weidenhammer, Engel, 1989).
При помощи короткого синдромального теста (SKT) может быть продемонстрировано, правда, с ограничениями, какая именно составляющая памяти и внимания затронута патологическим процессом. Этот тест и гериатрическая шкала клинической оценки Sandoz (SCAG) являлись критериями сравнительной оценки в одном плацебо–контролируемом, двойном слепом исследовании на двух группах пациентов (по 23 человека в каждой), находящихся в стационаре с легкой до умеренной степенью тяжести психоорганического синдрома (Lehmann et al., 1990; Kinzler et al., 1988). После двух недель инфузионной терапии Актовегином пациенты основной группы продемонстрировали по сравнению с пациентами группы плацебо значительное улучшение показателей по обоим тестам. Это подтверждалось и общей клинической оценкой лечащего врача.
Полученные в этом исследовании данные позволяют предположить, что при проведении длительной инфузионной терапии можно достигнуть еще более выраженного положительного эффекта. На этом основании было проведено настоящее исследование с аналогичным дизайном и с 4–недельной продолжительностью лечения.
Методы
Методы обследования
Установление диагноза деменции и дифференциальный диагноз проводились в соответствии с выводами Консенсуса (Amaducci et al., 1990) по критериям DSM–III–R (1987), NINCDS–ADRDA, а также по ишемической шкале Хачинского (Hachinsky Ischemic Score, Hachinsky, 1975; Rosen et al., 1980). Для практической оценки степени тяжести заболевания использовались выводы исследования по быстрой оценке психического здоровья (Mini Mental State Examination (MMSE), Forstein et al., 1975) и короткий синдромальный тест (SKT, Erzigkeit, 1986). Оценочная шкала депрессии Монтгомери–Асберга (Montgomery–Asberg Depression Rating Scale (MADRS), Montgomery, 1979; Neumann, 1988) применялась для исключения тяжелой депрессии. Кроме этого, была проведена компьютерная томография (КТ) с целью подтверждения соответствия полученных данных диагнозу по DSM–III–R.
В соответствии с рекомендациями Kanowsky и соавт. (1990) эффективность ноотропных препаратов должна одновременно оцениваться по трем направлениям: психопатологически, психометрически и по поведению. На психопатологическом уровне проводится сторонняя оценка клинических симптомов и синдромов. На психометрическом уровне предлагается объективное тестирование. Поведение оценивается путем проведения как самооценки, так и оценки со стороны с учетом возрастных способностей пациентов.
В соответствии с этими требованиями мы исследовали шесть критериев по указанным трем направлениям:
- скорость когнитивных процессов (улучшение «жидких» когнитивных процессов),
- способность осуществления когнитивных функций (улучшение функции памяти),
- психоорганическая клиническая картина (улучшения по клинической оценке различных врачей),
- заключение врача (эффективность лечения с точки зрения врача),
- мнение пациента (личная оценка терапевтического эффекта пациентом),
- потребность в уходе (снижение потребности в постороннем уходе с точки зрения обслуживающего персонала).
Скорость и способность к осуществлению когнитивных функций выявлялась при проведении короткого синдромального теста по методике Эрцигкайта (Erzigkeit). Клиническое значение имела степень тяжести нарушений внимания и памяти в зависимости от преморбидного уровня интеллектуальных способностей, оцениваемая многократным тестом по общему интеллектуальному развитию с выбором из предложенных слов (Mehrfach–Wortwahl–Intelligenztest, Lehrl, 1977).
Психоорганические поражения регистрировались с помощью гериатрической шкалы, предложенной Sandoz (Sandoz Clinical Assessment Geriatric Scale (SCAG), Venn, 1983). SCAG состоит из 18 вопросов, охватывающих когнитивные, аффективные, а также соматические нарушения, социальное поведение и способность вызывать дифференцированные клинические оценки врачей. Помимо этого, оценивался общий эффект от проводимой терапии с точки зрения врачей по шкале клинической оценки лечащего врача (Clinical Global Impression Scale, (CGI)). Важный дополнительный источник информации об эффективности ноотропного препарата – собственное мнение пациента, а также оценка поведения пациента со стороны. Собственная оценка пациента регистрировалась при помощи Нюрнбергской возрастной описи (Nuernberg–Alters–Inventar (NAI), Oswald u. Fleischmann, 1986), включавшей Нюрнбергскую шкалу собственной оценки (Nuernberger–Alters–Selbstueberteilungsskala (NAS)). NAS позволяет пациенту самостоятельно описать терапевтический эффект по 12 отдельным критериям: соматическим (например, сон), функциональным (память) и социальным (различные визиты).
Мнение сторонних наблюдателей регистрировалось при помощи шкалы сестринского наблюдения для стационарного лечения (Nurses Observation Scale for Inpatient Treatment (NOSIE)), а также при помощи так называемой ADL–шкалы (шкалы повседневной активности).
Дизайн исследования
Исследование было спланировано, как двухцентровое, рандомизированное, плацебо–контролируемое и двойное слепое, включавшее 2 х 60 престарелых пациентов, находящихся в стационаре по поводу дегенеративной деменции типа Альцгеймера (например, вероятной болезни Альцгеймера) или мультиинфарктной деменции легкой и средней степени тяжести. На основании результатов предыдущего исследования (Kinzler et al., 1988; Saletu et al., 1991) в данной работе была выбрана продолжительность терапии в течение четырех недель. Исследование происходило в трех различных гериатрических стационарах в Вене, а также в одном гериатрическом отделении во Фрайбурге.
Параметрами, использовавшимися для сравнительного анализа, являлись SKT и CGI, другие параметры учитывались, как описательные.
Исследование началось со скрининга (по критериям включения и исключения, неврологического и психиатрического обследования, MMSE, MADRS, HIS, SKT, CT, общего клинического обследования, ЭКГ, лабораторных обследований) с двухнедельной фазой адаптации и подготовки. Затем следовал четырехнедельный период лечения с рандомизированным разделением на группы. Оцениваемые параметры контролировались после второй и четвертой недель лечения. В конце исследования были повторно проведены общее клиническое и лабораторное обследование, ЭКГ для контроля надежности и безопасности исследуемого препарата.
Выборка пациентов
В исследование были включены 120 пациентов мужского и женского пола, в возрасте от 50 до 85 лет, находящихся в стационаре, которые прошли подробное нейропсихиатрическое обследование, включавшее КТ головы, необходимое согласно DSM–III–R и NINCDS–ADRAD для подтверждения диагноза неосложненной деменции легкой и средней степени (первичной дегенеративной деменции типа Альцгеймера, в том числе болезни Альцгеймера и мультиинфарктной деменции). Определение степени тяжести заболевания осуществлялось при помощи MMSE (10–23 пункты) и SKT (9–21 пункты), а оценка сопутствующей депрессивной симптоматики – при помощи MADRS. Критическим показателем MADRS считалось 40 баллов, были исключены тяжелая и очень тяжелая степени депрессивной симптоматики, которая может маскировать так называемую «псевдодеменцию».
Медикаментозное лечение и дозы
Изучаемый препарат Актовегин находился в форме раствора для инфузии во флаконах по 250 мл, с концентрацией, соответствующей содержанию 2 г сухого вещества. Препарат плацебо (изотонический раствор натрия хлорида) имел аналогичный внешний вид и этикетку. Для соответствия по цвету раствора плацебо и основного препарата (желтоватый цвет) в плацебо был использован фармакологически нейтральный краситель. На первой неделе терапии в первой половине дня пациентам проводились ежедневные (за исключением воскресенья) инфузии 250 мл препарата в течение 2 часов. В последующие 3 недели препарат вводился по понедельникам, средам и пятницам, с четырехчасовой продолжительностью 2–х инфузий по 250 мл раствора.
Статистический анализ
Для сравнения между группами параметров эффективности по SCAG, NOSIE, NAS и SKT была определена разница между баллами, полученными в ходе лечения, и баллами, полученными в первый день исследования (исходные значения после 2–недельного периода адаптации), затем значения сравнивались по группам между собой. Для СGI было проведено непосредственное сравнение баллов между группами.
Только для главных критериев оценки по шкалам CGI и SKT были проведены тесты для сравнительной оценки различий между группами по исходным значениям и значениям на 4–й неделе лечения. Все другие подгрупповые результаты, а также прочие параметры были подвергнуты описательному анализу. Для статистического анализа был использован тест Вилкоксона (Wilkoxon) для независимых групп сравнения. В рамках сравнительного статистического анализа данных шкал CGI И SKT был рассчитан двусторонний показатель ошибки первого типа (опровержение нулевой гипотезы). Для обоих параметров оценки была проведена коррекция вероятности ошибки по методу Холм–Бонферрони (Holm–Bonferroni).
Результаты
Общие данные
В исследование по плану были включены 120 пациентов мужского и женского пола, в возрасте от 50 до 85 лет, находящихся в стационаре с оговоренными степенями тяжести деменции типа Альцгеймера или мультиинфарктной деменции.
Пациенты основной группы в среднем были в возрасте 72,8±9,5 лет (в группе плацебо 74,6±7,3 лет) и по шкале MMSE набрали 16,25±3,5 балла (в группе плацебо 16,65±2,9 балла). Исходные значения параметров эффективности отдельно по каждому центру исследования представлены в таблице 1. Видно, что пациенты в Вене в среднем имели более тяжелую степень заболевания, поэтому показатели улучшения также представлены отдельно по каждому центру исследования.

Пациенты с тяжелой или очень тяжелой сопутствующей депрессивной симптоматикой, которая может имитировать псевдодеменцию, были исключены из исследования. У 46,7% пациентов основной группы и у 48,3% группы плацебо не было выявлено какой–либо сопутствующей депрессивной симптоматики. Легкая степень выраженности депрессии обнаружена у 25% основной группы и у 27,7% группы плацебо, умеренная степень – у 28,3% и 30% соответственно. Данные показатели соответствуют нашему опыту о размерах и распространенности депрессивной симптоматики на фоне сенильной деменции типа Альцгеймера (SDAT) или при мультиинфарктной деменции (MID).
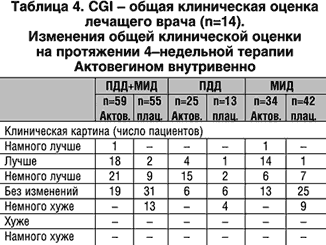
Разделение по подгруппам в соответствии с диагнозом SDAT или MID во Фрайбурге привело к почти равному распределению числа пациентов, а в Вене подгруппа пациентов с MID была значительно больше (табл. 1).
В каждом центре разделение пациентов в группу Актовегина или плацебо осуществлялось по коду рандомизации, с включением в каждую группу по 30 человек. Сравнительный статистический анализ не выявил различий между центрами и общей выборкой, касающихся значимости полученных результатов, так что уже может обсуждаться в своем роде «подтверждение копированием», хотя размер улучшения в некоторых легких случаях во Фрайбурге был выше ожидаемого показателя.
В целом 6 пациентов были вынуждены прервать исследование досрочно, причем 1 пациент относился к основной группе. У данного пациента на 3–й неделе лечения наступило респираторное осложнение, причем лечащим врачом не исключалась связь с применением исследуемого препарата. У 5 других пациентов (из группы плацебо) лечение было прекращено из–за перелома шейки бедра, возникновения двигательного беспокойства и в остальных трех случаях – из–за отзыва согласия на участие в исследовании.
Пятая часть пациентов принимала дополнительное медикаментозное лечение по поводу сопутствующих заболеваний, таких как сердечная недостаточность, ишемическая болезнь сердца, повышенное артериальное давление, артроз и других типичных для пожилого возраста заболеваний. Ни в общей выборке, ни при учете по отдельным группам не было подтверждено влияние сопутствующего приема препаратов на различие в эффективности между Актовегином и плацебо. В течение всего периода исследования почти для всех сопутствующих препаратов поддерживался неизмененный режим.
Данные по эффективности
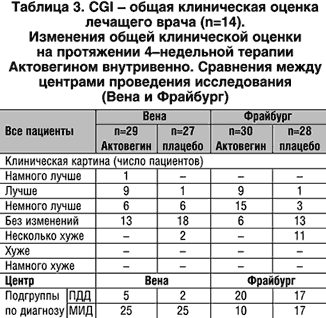
Критериями оценки эффективности при сравнительном анализе являлись изменение общего состояния по нейропсихологической картине заболевания, оцениваемое лечащим врачом (СGI, пункт 2), а также способность к осуществлению и скорость осуществления когнитивных функций пациентов, измерявшиеся при помощи короткого синдромального теста (SKT). Согласно CGI у 32% пациентов группы Актовегина обнаружился отчетливый терапевтический эффект («значительное улучшение» и «очень значительное улучшение») по сравнению с 4% в группе плацебо. Такое значимое различие (p<0,01; таблица 2) обнаружилось как в общей выборке (сравнительный статистический анализ), так и в обоих центрах (p<0,05; таблица 3) и в группах по отдельным заболеваниям (p<0,05; таблица 4), исключая пациентов с SDAT в Вене.
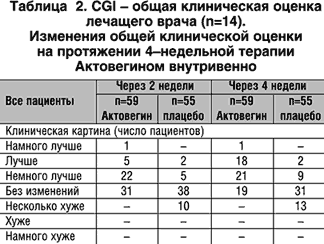

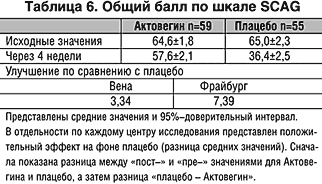
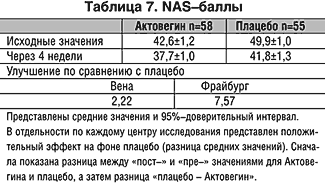
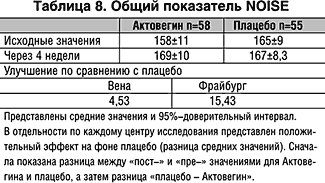
Нюрнбергская шкала для самооценки пожилых людей продемонстрировала аналогичным образом значительное превосходство Актовегина над плацебо (p<0,01). По оценке со стороны и по самооценке во Фрайбурге отмечены наиболее значимые показатели улучшения (табл. 6 и 7).
В общей сложности у 8 из 114 пациентов сообщалось о возникновении нежелательных событий. В частности, речь шла о двигательном возбуждении, переломе шейки бедра, приступе головокружения в группе плацебо; при приеме Актовегина было отмечено следующее: одышка/цианоз, эйфория, ухудшение зрения и приступ головокружения. В случае одышки/цианоза не исключается связь с препаратом, назначенным врачом, проводившим исследование, в связи с чем из соображений безопасности лечение было прекращено в начале третьей недели терапии.
В общей сложности у 8 из 114 пациентов сообщалось о возникновении нежелательных событий. В частности, речь шла о двигательном возбуждении, переломе шейки бедра, приступе головокружения в группе плацебо; при приеме Актовегина было отмечено следующее: одышка/цианоз, эйфория, ухудшение зрения и приступ головокружения. В случае одышки/цианоза не исключается связь с препаратом, назначенным врачом, проводившим исследование, в связи с чем из соображений безопасности лечение было прекращено в начале третьей недели терапии.Изменения на ЭКГ были отмечены у одного пациента группы плацебо (81–летний пациент – мерцание предсердий) и у двух пациентов основной группы (67 и 80 лет; в каждом случае – неполная блокада правой ножки пучка Гиса).
Данные клинического и лабораторного обследования, а также контрольные исследования уровня кровяного давления и пульса не выявили различий между группами как до начала исследования, так и после его завершения.
Обсуждение результатов
Эффективность Актовегина была доказана в ходе четырехнедельного курса терапии у пациентов с когнитивными расстройствами на фоне первичной дегенеративной деменции типа Альцгеймера или на фоне мультиинфарктной деменции в рамках проспективного исследования с убедительными статистическими критериями. Данные сравнительного статистического анализа (SKT, CGI) показали, что в ходе терапии Актовегином было достигнуто статистически значимое улучшение когнитивных функций, памяти и «жидких» когнитивных процессов, что также нашло отражение в клинической оценке лечащего врача. Улучшение по описательным параметрам оценки (SCAG, NAD, NOSIE) свидетельствует о том, что на фоне терапии Актовегином изменяются в положительную сторону общая картина заболевания, общее самочувствие пациентов и их потребность в уходе.
Такого рода положительные заключения, сделанные в ходе независимых наблюдений (по данным статистического анализа они не являются случайными) со всей очевидностью подтверждают клиническую эффективность препарата. Включенные в исследование пациенты страдали когнитивными расстройствами от легкой до умеренной степени тяжести по критериям DSM–III–R. Дополнительно учитывались волевые расстройства и аффективные нарушения, как характерные признаки психического синдрома при органическом поражении головного мозга. Два центра проведения исследования отличались между собой по степени тяжести заболевания. У более тяжело больных пациентов из Вены обнаружился слабый положительный плацебо–эффект. В отношении деменции степень улучшения была также незначительной по сравнению с Фрайбургом.
Дополнительные условия, такие как сопутствующие заболевания и сопутствующий прием лекарств, соответствовали возрасту пациентов. В обеих исследуемых группах они были равномерно распределены по интенсивности, степени тяжести и частоте возникновения.
Принимая во внимание терапевтическую значимость препарата, полученные данные подтверждают имеющийся клинический опыт по его использованию в качестве эффективной фармакологической терапии у пациентов с легкой и средней степенью тяжести деменции при очевидной безопасности препарата. Качество жизни таких пациентов, их работоспособность и способность к адекватному восприятию могут быть под влиянием терапии изменены в положительную сторону. Как и в предыдущих исследованиях (Kinzler et al., 1988; Saletu et al., 1991), в настоящем исследовании тоже могут считаться доказанными улучшение социального поведения и способности к совместной деятельности, аффективная стабилизация, повышение инициативности, а также обратное развитие нарушений памяти и внимания.
В последнее время особенно необходимы повышенные критерии оценки (предоставляемой окружающими их лицами) участия пациентов в повседневной жизни, а также объективное измерение функции памяти, которую так важно сохранить людям в преклонном возрасте. Эти данные позволяют объективно оценивать эффективность лечения, что и использовалось в предложенном исследовании. У больных были улучшены память, внимание и концентрация наряду с зависимой от настроения и уровня бодрствования повседневной работоспособностью.
Выбранные временные рамки наблюдения и терапии в соответствии с требуемыми критериями являются относительно малыми (по меньшей мере, необходимо три месяца: Amaducci et al., 1990; Kanowski et al., 1990). Однако необходимый и значимый эффект все–таки выявился, что, по нашему мнению, может быть связано с внутривенным применением препарата, обеспечившим более быстрое наступление эффекта.
Результаты настоящего исследования не демонстрируют значимого риска развития побочных эффектов, на основании чего можно сделать вывод о преимущественном соотношении польза/вред в сторону терапевтической выгоды.
По материалам Zeitung Geriatrie












