–£ –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е –≤ —Б–≤—П–Ј–Є —Б –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ —В–µ—З–µ–љ–Є—П (—Б–Ї—Г–і–љ–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞) –Є —В—А—Г–і–љ–Њ—Б—В—П–Љ–Є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Њ–њ—Г—Е–Њ–ї—М –Љ–Њ–ґ–µ—В –і–Њ–ї–≥–Є–µ –≥–Њ–і—Л –љ–Є–Ї–∞–Ї –љ–µ –њ—А–Њ—П–≤–ї—П—В—М—Б—П, –Є –Њ–љ–Є –Њ–±—А–∞—Й–∞—О—В—Б—П –Ј–∞ –њ–Њ–Љ–Њ—Й—М—О —Г–ґ–µ –љ–∞ –њ–Њ–Ј–і–љ–Є—Е —Б—В–∞–і–Є—П—Е (–Љ–µ—Б—В–љ–Њ—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ –Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–µ —Д–Њ—А–Љ—Л) [10].
–Э–µ—Г–Ї–ї–Њ–љ–љ—Л–є —А–Њ—Б—В –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –†–Я–Ц —В—А–µ–±—Г—О—В –≤—Л–і–µ–ї–µ–љ–Є—П —Н—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≤ –Њ—Б–Њ–±—Г—О –Ї–∞—В–µ–≥–Њ—А–Є—О –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –°–Њ—Ж–Є–∞–ї—М–љ–∞—П –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М –њ—А–Њ–±–ї–µ–Љ—Л –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–µ—В—Б—П –љ–µ–Њ–±—А–∞—В–Є–Љ—Л–Љ —Б—В–∞—А–µ–љ–Є–µ–Љ –љ–∞—Б–µ–ї–µ–љ–Є—П.
–†–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–Є–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Д–Њ—А–Љ –†–Я–Ц –Є –≤ —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ —И–Є—А–Њ–Ї–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—О —А–∞–Ј–ї–Є—З–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г—О—В —В–Њ–Љ—Г, —З—В–Њ –±–Њ–ї—М–љ—Л–µ –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј–∞—В—М—Б—П —Г —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –≤—А–∞—З–µ–±–љ—Л—Е –Њ–±–ї–∞—Б—В–µ–є – —В–µ—А–∞–њ–µ–≤—В–Њ–≤, —Е–Є—А—Г—А–≥–Њ–≤, –љ–µ–≤—А–Њ–њ–∞—В–Њ–ї–Њ–≥–Њ–≤, –њ—А–Њ–Ї—В–Њ–ї–Њ–≥–Њ–≤ – –і–Њ —В–Њ–≥–Њ, –Ї–∞–Ї –љ–∞–њ—А–∞–≤–ї—П—О—В—Б—П –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –Ї –Њ–љ–Ї–Њ—Г—А–Њ–ї–Њ–≥—Г.
–Ф–Њ—Б—В–Є–≥–љ—Г—В—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ —Г—Б–њ–µ—Е–Є –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –†–Я–Ц, –Њ–і–љ–∞–Ї–Њ –Њ—Б—В–∞–µ—В—Б—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –њ—А–Њ–≥–љ–Њ–Ј –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є —Г–ї—Г—З—И–µ–љ–Є—П –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В–Є –Є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е –†–Я–Ц –≤ —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –≤–њ–µ—А–≤—Л–µ –Њ–±—А–∞—В–Є–≤—И–Є—Е—Б—П –±–Њ–ї—М–љ—Л—Е –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П III –Є IV —Б—В–∞–і–Є–Є –±–Њ–ї–µ–Ј–љ–Є. –Т —Г—Б–ї–Њ–≤–Є—П—Е –≤—Л—П–≤–ї–µ–љ–Є—П –і–∞–љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞ –њ–Њ–Ј–і–љ–Є—Е —Б—В–∞–і–Є—П—Е –Њ—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–∞—П —В–µ—А–∞–њ–Є—П [1,2,6,11]. –£ –±–Њ–ї—М–љ—Л—Е III —Б—В–∞–і–Є–Є —Б –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ —А–µ–≥–Є–Њ–љ–∞—А–љ—Л—Е –ї–Є–Љ—Д–∞—В–Є—З–µ—Б–Ї–Є—Е —Г–Ј–ї–Њ–≤ –Є IV —Б—В–∞–і–Є–Є –±–Њ–ї–µ–Ј–љ–Є —Б –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–Љ –њ–Њ—А–∞–ґ–µ–љ–Є–µ–Љ –Ї–Њ—Б—В–µ–є —Б–Ї–µ–ї–µ—В–∞ —З–∞—Б—В–Њ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ —А–∞–Ј–ї–Є—З–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є, –љ–µ –Ї—Г–њ–Є—А—Г—О—Й–Є–є—Б—П –±–∞–Ј–Њ–≤–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є.
–Ч–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Њ—Ж–µ–љ–Ї–∞ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є (–Ъ–Ц) —Б—В–∞–ї–∞ –њ—А–Є–љ–Є–Љ–∞—В—М –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –≤ –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є. –Т–Њ–Ј—А–∞—Б—В–∞–µ—В –Є–љ—В–µ—А–µ—Б –Ї –њ—А–µ–њ–∞—А–∞—В–∞–Љ, —Б–љ–Є–ґ–∞—О—Й–Є–Љ –Є –Ї—Г–њ–Є—А—Г—О—Й–Є–Љ –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ, —В–∞–Ї –Ї–∞–Ї —Н—В–Њ –Њ–і–Є–љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –≤–ї–Є—П—О—Й–Є—Е –љ–∞ –Ъ–Ц –і–∞–љ–љ—Л—Е –±–Њ–ї—М–љ—Л—Е. –С–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ –≤ —В–µ—З–µ–љ–Є–µ –ґ–Є–Ј–љ–Є —Г 70% –±–Њ–ї—М–љ—Л—Е –†–Я–Ц —Б –Љ–µ—В–∞—Б—В–∞–Ј–∞–Љ–Є –≤ –Ї–Њ—Б—В—П—Е. –Ґ–Њ–ї—М–Ї–Њ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ—В–Є–µ –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞ –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ 156 –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –љ–∞—А—П–і—Г —Б –і—А—Г–≥–Є–Љ–Є –њ–∞—А–∞–Љ–µ—В—А–∞–Љ–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Є –Ъ–Ц [4,12] –Є –Ї–∞—З–µ—Б—В–≤–Њ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П. –Т —Н—В–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Б—В–µ–њ–µ–љ—М –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –≤ –Њ–љ–Ї–Њ–ї–Њ–≥–Є–Є –љ–∞—А—П–і—Г —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –Ї—А–Є—В–µ—А–Є—П–Љ–Є – –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М—О, –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–Љ –Њ—В–≤–µ—В–Њ–Љ, –±–µ–Ј—А–µ—Ж–Є–і–Є–≤–љ–Њ–є –≤—Л–ґ–Є–≤–∞–µ–Љ–Њ—Б—В—М—О [12,14].
–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є —П–≤–ї—П–µ—В—Б—П –∞–Ї—В–Є–≤–Є–Ј–∞—Ж–Є—П –±–Њ–ї–µ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –љ–µ —В–Њ–ї—М–Ї–Њ –њ—А–Є –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є —Б –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –∞–ї—М–≥–Њ–≥–µ–љ–∞–Љ–Є, –љ–Њ –Є –њ—А–Є —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–Є –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, —З—В–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Б–Є–ї–Є–≤–∞–µ—В –±–Њ–ї–µ–≤–Њ–є –Њ—В–≤–µ—В. –Т —Н—В–Њ–Љ —Б–ї—Г—З–∞–µ –±–Њ–ї–µ–≤—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–µ –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е (–≤ –Ї–Њ–ґ–µ, —Б–ї–Є–Ј–Є—Б—В—Л—Е –Њ–±–Њ–ї–Њ—З–Ї–∞—Е, —Б—В–µ–љ–Ї–∞—Е –њ–Њ–ї—Л—Е –Њ—А–≥–∞–љ–Њ–≤, –Ї–∞–њ—Б—Г–ї–∞—Е –њ–∞—А–µ–љ—Е–Є–Љ–∞—В–Њ–Ј–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤ –≥—Г–±—З–∞—В–Њ–є –Є –Љ–Є–љ–µ—А–∞–ї—М–љ–Њ–є —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–є –Ї–Њ—Б—В–µ–є –Є –≤ –љ–∞–і–Ї–Њ—Б—В–љ–Є—Ж–µ), –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—В —Б –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї, –Љ–µ–і–Є–∞—В–Њ—А–∞–Љ–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Є–ї–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —В–Ї–∞–љ–µ–є. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г—Б–Є–ї–µ–љ–љ—Л–є –њ–Њ—В–Њ–Ї –±–Њ–ї–µ–≤–Њ–є –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Є –≤ –≤–Є–і–µ –±–Є–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є—Е –Є–Љ–њ—Г–ї—М—Б–Њ–≤ –њ–Њ—Б—В—Г–њ–∞–µ—В –≤ —Б–њ–Є–љ–љ–Њ–є –Љ–Њ–Ј–≥, –∞ –Ј–∞—В–µ–Љ –≤ –≤—Л—И–µ–ї–µ–ґ–∞—Й–Є–µ –Њ—В–і–µ–ї—Л –¶–Э–°. –Т–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –Є –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А–Њ–≤ —В–∞–Ї–Є–Љ–Є –Љ–µ–і–Є–∞—В–Њ—А–∞–Љ–Є, –Ї–∞–Ї –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л (Pg), –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ—Л–µ –Є–Њ–љ—Л –≤–Њ–і–Њ—А–Њ–і–∞ –Э+, —Н–љ–і–Њ—В–µ–ї–Є–љ—Л (–Њ—Б–Њ–±–µ–љ–љ–Њ –Х–Ґ–1), —Б—Г–±—Б—В–∞–љ—Ж–Є—П –†, –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ—Л (IL), —Д–∞–Ї—В–Њ—А –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є (TNF– a) –Є –і—А., –Ї–Њ—В–Њ—А—Л–µ –Є–Љ–µ—О—В —Б–≤–Њ—О —Б–њ–µ—Ж–Є—Д–Є–Ї—Г –≤ —Г—Б–ї–Њ–≤–Є—П—Е –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [11,17–20].
–Ю–і–љ–Є–Љ –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –±–Њ–ї–Є (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є) —П–≤–ї—П–µ—В—Б—П –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є–µ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ (Pg). –Х—Й–µ –≤ 1995 –≥. –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л —П–≤–ї—П—О—В—Б—П –њ—Г—Б–Ї–Њ–≤—Л–Љ–Є –Љ–µ–і–Є–∞—В–Њ—А–∞–Љ–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –Њ–±—А–∞–Ј—Г—О—В—Б—П –Є–Ј –∞—А–∞—Е–Є–і–Њ–љ–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ —Ж–Є–Ї–ї–Њ–Њ–Ї—Б–Є–≥–µ–љ–∞–Ј—Л (–¶–Ю–У) –Є –µ–µ –њ—А–Њ–Є–Ј–≤–Њ–і–љ—Л—Е (–¶–Ю–У–1 –Є –¶–Ю–У–2). –Я—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ—Л —Г—З–∞—Б—В–≤—Г—О—В –≤ –њ–Њ–≤—Л—И–µ–љ–Є–Є —Б–Є–љ—Б–µ—В–Є–Ј–∞—Ж–Є–Є –Є –љ–∞–њ—А—П–Љ—Г—О –≤–Њ–Ј–±—Г–ґ–і–∞—О—В –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А—Л –њ—Г—В–µ–Љ —Б–≤—П–Ј—Л–≤–∞–љ–Є—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –њ—А–Њ—Б—В–∞–љ–Њ–Є–і–љ—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤. –Я—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –њ–Њ–Ј–ґ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ –≤–Є–і—Л –Њ–њ—Г—Е–Њ–ї–µ–≤—Л—Е –Ї–ї–µ—В–Њ–Ї –Є –∞—Б—Б–Њ—Ж–Є–Є—А–Њ–≤–∞–љ–љ—Л–µ –Њ–њ—Г—Е–Њ–ї–µ–≤—Л–µ –Љ–∞–Ї—А–Њ—Д–∞–≥–Є –≤—Л—Б–≤–Њ–±–Њ–ґ–і–∞—О—В –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –¶–Ю–У–2 –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –њ—А–Њ–Є–Ј–≤–Њ–і—П—В –±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ [22– 24].
–Ш–Ј—Г—З–µ–љ–Є–µ –¶–Ю–У —Б —В–µ—Е –њ–Њ—А —Б—В–∞–ї–Њ –Њ–і–љ–Њ–є –Є–Ј –≤–∞–ґ–љ–µ–є—И–Є—Е –њ—А–Њ–±–ї–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, –∞ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У –і–∞–≤–љ–Њ –њ—А–Є–Љ–µ–љ—П—О—В—Б—П –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ –Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –Є –±–Њ–ї–Є. –У–ї–∞–≤–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –¶–Ю–У —П–≤–ї—П–µ—В—Б—П —В–Њ, —З—В–Њ —Н—В–Є –њ—А–µ–њ–∞—А–∞—В—Л –њ–Њ–і–∞–≤–ї—П—О—В –Њ–±–µ –Є–Ј–Њ—Д–Њ—А–Љ—Л – –Є –¶–Ю–У–1, –Є –¶–Ю–У–2. –Я—А–Є —Н—В–Њ–Љ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –Ї–Њ–љ—Б—В–Є—В—Г—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –¶–Ю–У–1 –Љ–Њ–ґ–µ—В –≤—Л–Ј—Л–≤–∞—В—М —Б–µ—А—М–µ–Ј–љ—Л–µ –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –Ї—А–Њ–≤–Њ—В–Њ—З–Є–≤–Њ—Б—В—М –Є —П–Ј–≤—Л –Ц–Ъ–Ґ, –њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М. –Т –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ–Њ—Б—В—М —Н—В–Њ–Љ—Г —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–µ –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У–2 –ї–Є—И–µ–љ—Л –њ–Њ–і–Њ–±–љ—Л—Е –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –Є—Е –њ—А–Є –ї–µ—З–µ–љ–Є–Є —А–∞–Ї–Њ–≤–Њ–є –±–Њ–ї–Є. –С–Њ–ї–µ–µ —В–Њ–≥–Њ, –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞–ї—М–љ—Л–µ —А–∞–±–Њ—В—Л –і–∞—О—В –Њ—Б–љ–Њ–≤–∞–љ–Є—П –і—Г–Љ–∞—В—М –Њ–± —Г—З–∞—Б—В–Є–Є –¶–Ю–У–2 –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј–∞ –Є —А–Њ—Б—В–∞ –Њ–њ—Г—Е–Њ–ї–Є [25,26].
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Г –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї—М–љ—Л—Е, –Ї—А–Њ–Љ–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П, –Є–љ–≥–Є–±–Є—В–Њ—А—Л –¶–Ю–У–2 –Љ–Њ–≥—Г—В –Є–Љ–µ—В—М –Є –њ—А–Њ—В–Є–≤–Њ–Њ–њ—Г—Е–Њ–ї–µ–≤—Л–є —Н—Д—Д–µ–Ї—В, —Е–Њ—В—П –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –і–ї—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Н—В–Њ–≥–Њ –њ—А–µ–і–њ–Њ–ї–Њ–ґ–µ–љ–Є—П –њ–Њ—В—А–µ–±—Г—О—В—Б—П –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —А–Њ–ї–Є –¶–Ю–У–2 –њ—А–Є —А–∞–Ј–ї–Є—З–љ—Л—Е –≤–Є–і–∞—Е –Ј–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є.
–Я—А–µ–њ–∞—А–∞—В—Л –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–≤ –Ј–∞—А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–Є —Б–µ–±—П —Б –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–є —Б—В–Њ—А–Њ–љ—Л –≤ —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–Є–Є, –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –Є –і—А. –Њ–±–ї–∞—Б—В—П—Е –Љ–µ–і–Є—Ж–Є–љ—Л.
–° 2007 –≥. –≤ –†–Њ—Б—Б–Є–Є –њ–Њ—П–≤–Є–ї—Б—П –љ–Њ–≤—Л–є –Є–љ—К–µ–Ї—Ж–Є–Њ–љ–љ—Л–є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ, –≥–µ–љ–µ—А–Є–Ї –Ь–Њ–≤–∞–ї–Є—Б–∞ –Р–Љ–µ–ї–Њ—В–µ–Ї—Б, –њ—А–Њ–Є–Ј–≤–Њ–і–Є–Љ—Л–є –Ї–Њ–Љ–њ–∞–љ–Є–µ–є –°–Њ—В–µ–Ї—Б. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –ї–Њ–≥–Є—З–љ–Њ –±—Л–ї–Њ –њ—А–Њ–≤–µ—Б—В–Є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ–µ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—В–Є—Е –і–≤—Г—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤.
–¶–µ–ї—М –і–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л. –Я—А–Њ–≤–µ—Б—В–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ—Г—О –Њ—Ж–µ–љ–Ї—Г –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –њ–Њ–±–Њ—З–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≥—А—Г–њ–њ—Л –Њ–Ї—Б–Є–Ї–∞–Љ–Њ–≤ –≤ –і–≤—Г—Е —Д–Њ—А–Љ–∞—Е – –≥–µ–љ–µ—А–Є–Ї–∞ –Р–Љ–µ–ї–Њ—В–µ–Ї—Б–∞ –Є –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Ь–Њ–≤–∞–ї–Є—Б–∞ – —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ–Є —Д–Њ—А–Љ–∞–Љ–Є –†–Я–Ц, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –±–∞–Ј–Њ–≤—Г—О –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О, –Њ—Ж–µ–љ–Є—В—М –≤–ї–Є—П–љ–Є–µ —В–µ—А–∞–њ–Є–Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ –≤ —Ж–µ–ї–Њ–Љ –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Н—В–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є.
–Ю—Ж–µ–љ–Є—В—М –∞–љ–∞–ї—М–≥–µ—В–Є—З–µ—Б–Ї—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –љ–µ—Б—В–µ—А–Њ–Є–і–љ–Њ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≥—А—Г–њ–њ—Л –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ – –Р–Љ–µ–ї–Њ—В–µ–Ї—Б –њ—А–Є —В–µ—А–∞–њ–Є–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Я–Ц. –Я—А–Њ–≤–µ—Б—В–Є –Њ—Ж–µ–љ–Ї—Г –≤–ї–Є—П–љ–Є—П –ї–µ—З–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –љ–∞ —Д–Њ–љ–µ –±–∞–Ј–Њ–≤–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е –†–Я–Ц.
–Ь–∞—В–µ—А–Є–∞–ї—Л –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Њ –≤–Ї–ї—О—З–µ–љ–Њ 60 –±–Њ–ї—М–љ—Л—Е –Љ–µ—Б—В–љ–Њ—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –Є –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –†–Я–Ц, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О –Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –њ—А–µ–њ–∞—А–∞—В—Л –Є–Ј –≥—А—Г–њ–њ—Л –Э–Я–Т–Я –њ—А–Є –±–Њ–ї–µ–≤–Њ–Љ —Б–Є–љ–і—А–Њ–Љ–µ –≤ –Ї–ї–Є–љ–Є–Ї–µ –љ–∞ –±–∞–Ј–µ –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–≥–Њ –љ–∞—Г—З–љ–Њ––Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М—Б–Ї–Њ–≥–Њ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—В–Є—В—Г—В–∞ –Є–Љ. –Я.–Р. –У–µ—А—Ж–µ–љ–∞ –Є —Г—А–Њ—Ж–µ–љ—В—А–∞ –њ–Њ–ї–Є–Ї–ї–Є–љ–Є–Ї–Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –і–Є—Б–њ–∞–љ—Б–µ—А–∞ вДЦ 1 —Б —П–љ–≤–∞—А—П –њ–Њ –Є—О–ї—М 2009 –≥. –Ш—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ —П–≤–ї—П–ї–Є—Б—М –Љ–µ—В–∞—Б—В–∞—В–Є—З–µ—Б–Ї–Є–µ –Њ—З–∞–≥–Є –≤ –Ї–Њ—Б—В—П—Е —Б–Ї–µ–ї–µ—В–∞ –Є –њ–Њ–Ј–≤–Њ–љ–Ї–∞—Е (68,3%). –Э–∞ –≤—В–Њ—А–Њ–Љ –Љ–µ—Б—В–µ –њ–Њ –Є—Б—В–Њ—З–љ–Є–Ї—Г –±–Њ–ї–Є –±—Л–ї–Њ –Љ–µ—Б—В–љ–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –Њ–њ—Г—Е–Њ–ї–Є (–њ—А–Њ—А–∞—Б—В–∞–љ–Є–µ –≤ –Њ–Ї—А—Г–ґ–∞—О—Й–Є–µ —В–Ї–∞–љ–Є –Є –Ї–ї–µ—В—З–∞—В–Ї—Г, –ї–Є–Љ—Д–Њ—Г–Ј–ї—Л, 31,7%).
–Т—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л –њ–Њ–ї—Г—З–∞–ї–Є –њ—А–µ–њ–∞—А–∞—В—Л –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–≤ –Ї—Г—А—Б–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ 10 –і–љ–µ–є –≤–љ—Г—В—А–Є–Љ—Л—И–µ—З–љ–Њ –њ–Њ 15 –Љ–≥ (–Њ–і–љ–∞ –Є–љ—К–µ–Ї—Ж–Є—П) –≤ —Б—Г—В–Ї–Є: 1–—П –≥—А—Г–њ–њ–∞ (30 –±–Њ–ї—М–љ—Л—Е) –њ–Њ–ї—Г—З–∞–ї–∞ –Ь–Њ–≤–∞–ї–Є—Б, –∞ 2–—П – –Р–Љ–µ–ї–Њ—В–µ–Ї—Б (30 –±–Њ–ї—М–љ—Л—Е). –С—Л–ї–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П, –Љ–∞—В–µ—А–Є–∞–ї—Л –Є—Б—В–Њ—А–Є–є –±–Њ–ї–µ–Ј–љ–Є –Є –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л–µ –Ї–∞—А—В—Л –±–Њ–ї—М–љ—Л—Е. –Ф–Є–∞–≥–љ–Њ–Ј –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ –і–∞–љ–љ—Л–Љ–Є –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤–Ї–ї—О—З–∞—П –њ—А–Њ—Б—В–∞—В–—Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–є –∞–љ—В–Є–≥–µ–љ (–Я–°–Р) –Є –≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О –≤–µ—А–Є—Д–Є–Ї–∞—Ж–Є—О –Њ–њ—Г—Е–Њ–ї–Є. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –±–Њ–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–Є–ї 65 –ї–µ—В (–Њ—В 48 –і–Њ 88 –ї–µ—В). –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е –њ–Њ —Б—В–∞–і–Є—П–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –≤ —В–∞–±–ї–Є—Ж–µ 1. 1–—П –≥—А—Г–њ–њ–∞ (–Ь–Њ–≤–∞–ї–Є—Б) —Б–Њ—Б—В–Њ—П–ї–∞ –Є–Ј 8 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б III —Б—В–∞–і–Є–µ–є –Є 22 —Б IV —Б—В–∞–і–Є–µ–є —А–∞–Ї–∞ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л; 2–—П –≥—А—Г–њ–њ–∞ (–Р–Љ–µ–ї–Њ—В–µ–Ї—Б) —Б–Њ—Б—В–Њ—П–ї–∞ –Є–Ј 11 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б III –Є 19 —Б IV —Б—В–∞–і–Є–µ–є –†–Я–Ц. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ–±–µ –њ–Њ–і–≥—А—Г–њ–њ—Л –±—Л–ї–Є –Њ–і–љ–Њ—А–Њ–і–љ—Л –њ–Њ —Б–≤–Њ–µ–Љ—Г —Б–Њ—Б—В–∞–≤—Г. –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞—О—Й–Є—Е –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤—Г—О —В–µ—А–∞–њ–Є—О, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –≤ —В–∞–±–ї–Є—Ж–µ 2.
–£—З–Є—В—Л–≤–∞—П –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Њ–њ—Г—Е–Њ–ї–Є, –Љ—Л –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є —Б—В–∞–љ–і–∞—А—В–љ—Л–µ —Б—Е–µ–Љ—Л –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞—О—Й–Є–µ –∞–≥–Њ–љ–Є—Б—В –Ы–У–†–У –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –∞–љ—В–Є–∞–љ–і—А–Њ–≥–µ–љ–Њ–Љ.
–Я–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–є –∞–љ–і—А–Њ–≥–µ–љ–љ–Њ–є –±–ї–Њ–Ї–∞–і–µ –Ј–∞–≤–Є—Б–µ–ї–Є –Њ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤: –≤–Њ–Ј—А–∞—Б—В–∞ –±–Њ–ї—М–љ–Њ–≥–Њ, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Њ–њ—Г—Е–Њ–ї–Є, —Г—А–Њ–≤–љ—П –Я–°–Р, —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Њ–њ—Г—Е–Њ–ї–Є, –Є—Б—Е–Њ–і–љ–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Ъ–Ц, –≤ –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е – –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—Л–±–Њ—А–∞ –±–Њ–ї—М–љ–Њ–≥–Њ.
–Ш–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Њ—Ж–µ–љ–Є–≤–∞–ї–∞—Б—М –њ–Њ –≤–Є–Ј—Г–∞–ї—М–љ–Њ––∞–љ–∞–ї–Њ–≥–Њ–≤–Њ–є —Ж–Є—Д—А–Њ–≤–Њ–є —И–Ї–∞–ї–µ –±–Њ–ї–Є (–Т–Р–®) –Є –≤–µ—А–±–∞–ї—М–љ–Њ–є —И–Ї–∞–ї–µ –±–Њ–ї–Є (—А–Є—Б. 1).
–£ –≤—Б–µ—Е 19 –±–Њ–ї—М–љ—Л—Е —Б –Љ–µ—Б—В–љ–Њ—А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ –Њ—В–Љ–µ—З–∞–ї—Б—П –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ —Б—А–µ–і–љ–µ–є –Є —Б–Є–ї—М–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є (–≤ —Б—А–µ–і–љ–µ–Љ 6±2,2) –њ–Њ —И–Ї–∞–ї–µ –≤–µ—А–±–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –±–Њ–ї–Є. –£ 41 –±–Њ–ї—М–љ–Њ–≥–Њ —Б –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ –Є –Љ–µ—В–∞—Б—В–∞–Ј–∞–Љ–Є –≤ –Ї–Њ—Б—В—П—Е —Б–Ї–µ–ї–µ—В–∞ –Њ—В–Љ–µ—З–∞–ї—Б—П –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ —Б–Є–ї—М–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –Є –љ–µ—Б—В–µ—А–њ–Є–Љ—Л–µ –±–Њ–ї–Є (–≤ —Б—А–µ–і–љ–µ–Љ 8,3±2,1).
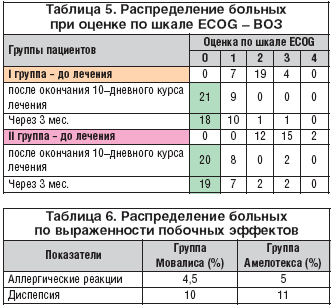
–Ъ–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –њ–Њ —И–Ї–∞–ї–µ –Т–Ю–Ч – ECOG (—В–∞–±–ї. 3).
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–Ъ—Г—А—Б –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я —Б–Њ—Б—В–∞–≤–ї—П–ї 10 –і–љ–µ–є, –Њ–±—Й–Є–є –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –Ј–∞ –±–Њ–ї—М–љ—Л–Љ–Є —Б–Њ—Б—В–∞–≤–Є–ї 6 –Љ–µ—Б.
–Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є–µ –љ–∞–Ј–љ–∞—З–∞–ї–Њ—Б—М –њ–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є – –њ—А–Є —Н–њ–Є–Ј–Њ–і–Є—З–µ—Б–Ї–Њ–Љ –њ–Њ—П–≤–ї–µ–љ–Є–Є –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є. –Ю—В–Љ–µ—З–∞–ї–∞—Б—М —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –њ–Њ—В—А–µ–±–љ–Њ—Б—В–Є –≤ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є–Є –і–Њ 3 —А–∞–Ј (3 –Є–љ—К–µ–Ї—Ж–Є–Є) –≤ –љ–µ–і–µ–ї—О.
–£—А–Њ–≤–µ–љ—М –Я–°–Р –і–Њ –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П –≤–∞—А—М–Є—А–Њ–≤–∞–ї –Њ—В 12,5 –і–Њ 997 –љ–≥/–Љ–ї. –Я–Њ—Б–ї–µ 10––і–љ–µ–≤–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Я–°–Р –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 15% –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ.
–Э–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Њ—В–Љ–µ—З–∞–ї–∞—Б—М –≤—Л—А–∞–ґ–µ–љ–љ–∞—П –і–Є–љ–∞–Љ–Є–Ї–∞ —Г–ї—Г—З—И–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –Є –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –Њ—В—А–∞–ґ–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–∞—Е 4 –Є 5.
–Т—Б–µ –±–Њ–ї—М–љ—Л–µ –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –њ–Њ—Б–ї–µ 10––і–љ–µ–≤–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–Њ–Љ –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Ї–∞–Ј–∞–ї–Є—Б—М –Њ—В —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –Х—Б–ї–Є –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є–Ј 60 –±–Њ–ї—М–љ—Л—Е –Њ–±–µ–Є—Е –≥—А—Г–њ–њ —В–Њ–ї—М–Ї–Њ 5 (8%) –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є —Б–ї–∞–±—Г—О –±–Њ–ї—М, –∞ –Њ—Б—В–∞–ї—М–љ—Л–µ 55 (92%) –±–Њ–ї—М–љ—Л—Е –ґ–∞–ї–Њ–≤–∞–ї–Є—Б—М –љ–∞ —Б–Є–ї—М–љ—Л–є –Є–ї–Є —Б—А–µ–і–љ–µ–є –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –±–Њ–ї–µ–≤–Њ–є —Б–Є–љ–і—А–Њ–Љ, —В–Њ –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П 10––і–љ–µ–≤–љ–Њ–≥–Њ –Ї—Г—А—Б–∞ —В–µ—А–∞–њ–Є–Є –±–Њ–ї—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–Є–ї–∞—Б—М, –Є –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (45 –Є–Ј 60), –њ–Њ–ї–љ–Њ—Б—В—М—О –Њ—В–Љ–µ—З–∞–ї–Є –µ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ –≥—А—Г–њ–њ–∞–Љ –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л —Б–Њ–њ–Њ—Б—В–∞–≤–Є–Љ—Л–µ –і–∞–љ–љ—Л–µ: 9 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Ј 1––є –≥—А—Г–њ–њ—Л –Є 6 –Є–Ј 2––є –≥—А—Г–њ–њ—Л –Њ—Й—Г—Й–∞–ї–Є –±–Њ–ї—М —Б–ї–∞–±—Г—О (1–3 –±–∞–ї–ї–∞). –Я–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –±–Њ–ї—М—О —Б—А–µ–і–љ–µ–є —Б–Є–ї—Л –Є–ї–Є —Б–Є–ї—М–љ–Њ–є –±–Њ–ї—М—О (–Њ—В 4 –і–Њ 10 –±–∞–ї–ї–Њ–≤) –љ–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –љ–Є –≤ 1––є, –љ–Є –≤–Њ 2––є –≥—А—Г–њ–њ–µ.
–Т –і–∞–ї—М–љ–µ–є—И–µ–Љ (–≤ —В–µ—З–µ–љ–Є–µ 6 –Љ–µ—Б. –љ–∞–±–ї—О–і–µ–љ–Є—П) –њ–∞—Ж–Є–µ–љ—В—Л –Є–Ј –Њ–±–µ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –≥—А—Г–њ–њ —В–∞–Ї–ґ–µ –љ–µ –љ—Г–ґ–і–∞–ї–Є—Б—М –≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –Њ–њ–Є–Њ–Є–і–љ—Л—Е –∞–љ–∞–ї—М–≥–µ—В–Є–Ї–Њ–≤, –∞ –Э–Я–Т–Я –њ—А–Є–Љ–µ–љ—П–ї–Є —Н–њ–Є–Ј–Њ–і–Є—З–µ—Б–Ї–Є.
–Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤—Б–µ –±–Њ–ї—М–љ—Л–µ –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –њ–Њ–ї—Г—З–∞—В—М –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —В–µ—А–∞–њ–Є—О –≤ –Њ–±—К–µ–Љ–µ –Ь–Р–С –≤ –њ—А–µ—А—Л–≤–Є—Б—В–Њ–Љ —А–µ–ґ–Є–Љ–µ. –Ч–∞ –њ–µ—А–Є–Њ–і 6––Љ–µ—Б—П—З–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ–љ–Є —Н–њ–Є–Ј–Њ–і–Є—З–µ—Б–Ї–Є –Є—Б–њ—Л—В—Л–≤–∞–ї–Є –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –њ—А–Є–µ–Љ–µ –Њ–±–µ–Ј–±–Њ–ї–Є–≤–∞—О—Й–Є—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –Э–Я–Т–Я (–Ь–Њ–≤–∞–ї–Є—Б –Є –Р–Љ–µ–ї–Њ—В–µ–Ї—Б).
–Я—А–Є –і–Њ—Б—В–Є–ґ–µ–љ–Є–Є —А–µ–≥—А–µ—Б—Б–Є–Є –Є–ї–Є —Б—В–Њ–є–Ї–Њ–є —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–∞, —Б–љ–Є–ґ–µ–љ–Є–Є –Я–°–Р –љ–Є–ґ–µ 4 –љ–≥/–Љ–ї (–≤ –і–≤—Г—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ—А–µ–љ–Є—П—Е —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –≤ 1 –Љ–µ—Б.) –Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –Є –Њ–±—Б—В—А—Г–Ї—В–Є–≤–љ—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ –≤ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є –і–µ–ї–∞–ї—Б—П –њ–µ—А–µ—А—Л–≤. –Т –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П —З–µ—А–µ–Ј –Ї–∞–ґ–і—Л–µ 3 –Љ–µ—Б. –Њ–њ—А–µ–і–µ–ї—П–ї—Б—П —Г—А–Њ–≤–µ–љ—М –Я–°–Р —Б—Л–≤–Њ—А–Њ—В–Ї–Є –Є –Њ—Ж–µ–љ–Є–≤–∞–ї–Њ—Б—М –Ъ–Ц, –±–Њ–ї—М–љ—Л–µ –Ј–∞–њ–Њ–ї–љ—П–ї–Є —Б—В–∞–љ–і–∞—А—В–љ—Л–µ –Њ–њ—А–Њ—Б–љ–Є–Ї–Є.
–Ю—Ж–µ–љ–Ї–∞ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –≤–Ї–ї—О—З–∞–ї–∞ –≤ —Б–µ–±—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є, —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–µ –Њ–±—Б–ї—Г–ґ–Є–≤–∞–љ–Є–µ –±–µ–Ј –њ–Њ—Б—В–Њ—А–Њ–љ–љ–µ–є –њ–Њ–Љ–Њ—Й–Є, –љ–∞–ї–Є—З–Є–µ –њ–Њ—В–µ–љ—Ж–Є–Є –Є –ї–Є–±–Є–і–Њ, –Њ—Ж–µ–љ–Ї–∞ –њ–Њ —И–Ї–∞–ї–µ IPSS.
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Ъ–Ц –±–Њ–ї—М–љ—Л—Е –і–Њ —В–µ—А–∞–њ–Є–Є —Б–њ—Г—Б—В—П 10 –і–љ–µ–є –Є 3 –Љ–µ—Б. –њ–Њ—Б–ї–µ —В–µ—А–∞–њ–Є–Є –≥–Њ–≤–Њ—А—П—В –Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ —Г–ї—Г—З—И–µ–љ–Є–Є —Б–∞–Љ–Њ—З—Г–≤—Б—В–≤–Є—П –Є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї —Б–∞–Љ–Њ–Њ–±—Б–ї—Г–ґ–Є–≤–∞–љ–Є—О —Г –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е. –Т –≥—А—Г–њ–њ–µ –Р–Љ–µ–ї–Њ—В–µ–Ї—Б–∞ 2 –±–Њ–ї—М–љ—Л—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –≤—Б—В–∞–≤–∞–ї–Є —Б –њ–Њ—Б—В–µ–ї–Є (4 –±–∞–ї–ї–∞ –њ–Њ —И–Ї–∞–ї–µ ECOG) –Є 15 –±–Њ–ї—М–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–Є –≤ –њ–Њ—Б—В–µ–ї–Є –±–Њ–ї–µ–µ 50% –і–љ–µ–≤–љ–Њ–≥–Њ –≤—А–µ–Љ–µ–љ–Є. –І–µ—А–µ–Ј 10 –і–љ–µ–є 20 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ—Г—О —Д–Є–Ј–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М, –∞ 8 –Њ—В–Љ–µ—З–∞–ї–Є –Њ—В–і–µ–ї—М–љ—Л–µ —Б–Є–Љ–њ—В–Њ–Љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —Е–Њ—В—П —З–µ—А–µ–Ј 3 –Љ–µ—Б. —Н—В–Њ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–µ –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Є–Ј–Љ–µ–љ–Є–ї–Њ—Б—М –≤ —Е—Г–і—И—Г—О —Б—В–Њ—А–Њ–љ—Г. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –Є –≤ –≥—А—Г–њ–њ–µ –Ь–Њ–≤–∞–ї–Є—Б–∞: —З–µ—А–µ–Ј 10 –і–љ–µ–є –љ–Њ—А–Љ–∞–ї—М–љ–∞—П —Д–Є–Ј–Є—З–µ—Б–Ї–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –±—Л–ї–∞ –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–∞ —Г 21 –±–Њ–ї—М–љ–Њ–≥–Њ –Є 9 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ—В–Љ–µ—З–∞–ї–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б –Њ—В–і–µ–ї—М–љ—Л–Љ–Є –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –І–µ—А–µ–Ј 3 –Љ–µ—Б. –≤ –≥—А—Г–њ–њ–µ –Ь–Њ–≤–∞–ї–Є—Б–∞, –Ї–∞–Ї –Є –≤ –≥—А—Г–њ–њ–µ –Р–Љ–µ–ї–Њ—В–µ–Ї—Б–∞, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є ECOG –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г—Е—Г–і—И–Є–ї–Є—Б—М, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –Њ–±—Л—З–љ—Л–Љ –њ—А–Є —В–∞–Ї–Њ–є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞.
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –і–∞—О—В –Њ—Б–љ–Њ–≤–∞–љ–Є—П –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—В—М, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —Н—В–Є–Њ—В—А–Њ–њ–љ–Њ–є —В–µ—А–∞–њ–Є–µ–є —Г–ї—Г—З—И–∞–µ—В –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –†–Я–Ц –Ї–∞–Ї –≤ –њ–µ—А–Є–Њ–і –ї–µ—З–µ–љ–Є—П, —В–∞–Ї –Є –≤ –Њ—В–і–∞–ї–µ–љ–љ–Њ–Љ –њ–µ—А–Є–Њ–і–µ.
–Э–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –њ–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є, —В–Є–њ–Є—З–љ—Л–µ –і–ї—П –≤—Б–µ—Е –Э–Я–Т–Я. –Ю–љ–Є –љ–µ –љ–Њ—Б–Є–ї–Є –Њ–њ–∞—Б–љ–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ –Є –љ–µ —П–≤–ї—П–ї–Є—Б—М –њ—А–Є—З–Є–љ–Њ–є –Њ—В–Љ–µ–љ—Л —В–µ—А–∞–њ–Є–Є –≤ –≥—А—Г–њ–њ–∞—Е, —З—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ —Е–Њ—А–Њ—И–µ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –±–Њ–ї—М–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Љ–µ–ї–Њ–Ї—Б–Є–Ї–∞–Љ–∞ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Є —Г –Њ—А–Є–≥–Є–љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Ь–Њ–≤–∞–ї–Є—Б–∞, –Є –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞–≤—И–µ–є –Р–Љ–µ–ї–Њ—В–µ–Ї—Б. –Ф–∞–љ–љ—Л–µ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –≤ —В–∞–±–ї–Є—Ж–µ 6, –Њ—В—А–∞–ґ–∞—О—В –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л–µ –Є –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ–љ—Л—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤.
–Э–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –≤—Л—П–≤–ї–µ–љ–Њ, —З—В–Њ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є –≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Є —З–∞—Б—В–Њ—В—Л –њ–Њ–±–Њ—З–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–Љ–µ–ї–Њ—В–µ–Ї—Б –Є –Ь–Њ–≤–∞–ї–Є—Б.
–Т—Л–≤–Њ–і—Л
1) –Я—А–µ–њ–∞—А–∞—В –Р–Љ–µ–ї–Њ—В–µ–Ї—Б –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –і–Њ—Б—В–∞—В–Њ—З–љ—Л–є –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤–Њ–є —Н—Д—Д–µ–Ї—В –Є –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –њ—А–Є –±–Њ–ї–Є —Б—А–µ–і–љ–µ–є –Є —Б–Є–ї—М–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є.
2) –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–∞ –Р–Љ–µ–ї–Њ—В–µ–Ї—Б —Б—А–∞–≤–љ–Є–Љ–∞ —Б –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤—Л–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ –Є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞ –Ь–Њ–≤–∞–ї–Є—Б.
3) –Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –њ—А–Њ—В–Є–≤–Њ–±–Њ–ї–µ–≤–Њ–є —В–µ—А–∞–њ–Є–Є –Р–Љ–µ–ї–Њ—В–µ–Ї—Б–Њ–Љ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –Є –љ–µ —В—А–µ–±—Г—О—В –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞.



–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –У—Г—А–Є–љ–∞ –Ы.–Ш. –Я–Њ–±–Њ—З–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є —А–∞–Ї–∞ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л // –†–Њ—Б—Б. –Њ–љ–Ї–Њ–ї. –ґ—Г—А–љ–∞–ї. – 2003. – –°. 15–19.
2. –Ъ–∞—А—П–Ї–Є–љ –Ю.–С., –°–≤–Є—А–Є–і–Њ–≤–∞ –Ґ.–Т. –†–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–є —А–∞–Ї –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л: —А–µ–Ј—Г–ї—М—В–∞—В—Л –ї–µ—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є // –Ь–∞—В–µ—А–Є–∞–ї—Л –Я–ї–µ–љ—Г–Љ–∞ –њ—А–∞–≤–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Ю–±—Й–µ—Б—В–≤–∞ –£—А–Њ–ї–Њ–≥–Њ–≤. –Ю–Љ—Б–Ї, 1999.
3. –Ь–∞—В–≤–µ–µ–≤ –С.–Я., –Ъ–∞—А—П–Ї–Є–љ –Ю.–С., –Ь–∞—В–≤–µ–µ–≤ –Т.–С., –Р–ї—П–µ–≤ –Ѓ.–У., –†—Г—Б–∞–Ї–Њ–≤ –Ш.–У. –Є –і—А. –Ч–Њ–Љ–µ—В–∞ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ —А–∞–Ї–Њ–Љ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л (—А–µ–Ј—Г–ї—М—В–∞—В—Л –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П) // –°–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П –Њ–љ–Ї–Њ–ї–Њ–≥–Є—П. – 2004. – –Ґ–Њ–Љ 06. – вДЦ 3.
4. –Э–Њ–≤–Є–Ї –Р.–Р., –Ш–Њ–љ–Њ–≤–∞ –Ґ.–Ш., –Ъ–∞–є–љ–і –Я. –Ъ–Њ–љ—Ж–µ–њ—Ж–Є—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є –≤ –Љ–µ–і–Є—Ж–Є–љ–µ. – –°–њ–±.: –≠–Ы–С–Ш, 1999. – 140 —Б.
5. –Я—Г—И–Ї–∞—А—М –Ф.–Ѓ., –Ф—М—П–Ї–Њ–≤ –Т.–Т., –С–µ—А–љ–Є–Ї–Њ–≤ –Р.–Э. –Ъ–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є – –љ–Њ–≤–∞—П –њ–∞—А–∞–і–Є–≥–Љ–∞ –Љ–µ–і–Є—Ж–Є–љ—Л // –§–∞—А–Љ–∞—В–µ–Ї–∞. – 2005. – вДЦ11(106). – –°. 15–16.
6. –†—Г—Б–∞–Ї–Њ–≤ –Ш.–У., –Р–ї–µ–Ї—Б–µ–µ–≤ –С.–ѓ. –У–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –≥–µ–љ–µ—А–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–≥–Њ —А–∞–Ї–∞ –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј—Л. – –°–Њ–≤—А–µ–Љ. –Њ–љ–Ї–Њ–ї. – 2000. – –Ґ.2, вДЦ3. – –°. 92–94.
7. –°—В–∞—А–Є–љ—Б–Ї–Є–є –Т.–Т. –Р–љ–∞–ї–Є–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Ч–Э–Ю –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –Њ—В –љ–Є—Е –љ–∞—Б–µ–ї–µ–љ–Є—П –†–Њ—Б—Б–Є–Є. – –Ь–∞—В–µ—А–Є–∞–ї—Л V –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ —Б—К–µ–Ј–і–∞ –Њ–љ–Ї–Њ–ї–Њ–≥–Њ–≤.–Ъ–∞–Ј–∞–љ—М, 2000. – –°. 86–88.
8. –І–Є—Б—Б–Њ–≤ –Т. –Ш., –°—В–∞—А–Є–љ—Б–Ї–Є–є –Т. –Т., –Я–µ—В—А–Њ–≤–∞ –У. –Т. (—А–µ–і.) –Ч–ї–Њ–Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ –љ–Њ–≤–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –†–Њ—Б—Б–Є–Є –≤ 2005 –≥–Њ–і—Г (–Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М). – –Ь–Њ—Б–Ї–≤–∞, 2007: —Б—В—А. 98.
9. –І–Є—Б—Б–Њ–≤ –Т. –Ш., –°—В–∞—А–Є–љ—Б–Ї–Є–є –Т. –Т., –Я–µ—В—А–Њ–≤–∞ –У. –Т. (—А–µ–і.) –°–Њ—Б—В–Њ—П–љ–Є–µ –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –љ–∞—Б–µ–ї–µ–љ–Є—О –†–Њ—Б—Б–Є–Є –≤ 2005 –≥–Њ–і—Г. – –Ь–Њ—Б–Ї–≤–∞, 2006: —Б—В—А. 104.
10. –І–Є—Б—Б–Њ–≤ –Т.–Ш. –Я–µ—А—Б–њ–µ–Ї—В–Є–≤—Л —А–∞–Ј–≤–Є—В–Є—П –њ–∞–ї–ї–Є–∞—В–Є–≤–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –±–Њ–ї—М–љ—Л–Љ –≤ –†–Њ—Б—Б–Є–Є. –Ґ–µ–Ј–Є—Б—Л –і–Њ–Ї–ї–∞–і–Њ–≤ IV –Т—Б–µ—А–Њ—Б—Б–Є–є—Б–Ї–Њ–є –Ї–Њ–љ—Д–µ—А–µ–љ—Ж–Є–Є.– –Ь., 1999, – –°. 6.
11. Alvarez F J, Fyffe R E 2000 Nociceptors for the 21st century. Current Review of Pain 4(6):451–458 ;
12. Aus G, Abbou C, Bolla M et al. Guidelines on prostate cancer, 2006 edition Carter B.S., et.al. In “Reviews on Endocrine–related cancer”, 1991, pp.13–18.
13. Cella D.F., Bonomi A.E. // Measuring quality of life: 1995 update. – Oncology. – Chicago, 1995. – P.1–14.
14. Charwick D.J., Gillat D.A., Gingell J.C. // Medical and surgical orchidectomy: patient’s choice // Br. Med. J. – 1991. – Vol. 302. – P. 72.
15. Cella D.F. // Quality of life: The concept. – J. Of Palliat. Care. – 1992. – Vol. 8., вДЦ3 – P.8–13.
16. Daniell HW, Dunn SR, Ferguson DW et al.// Progressive osteoporosis during androgen deprivation therapy for prostate cancer.// J. Urol. – 2000. – V. 163. – P.181–6.
17. Girling D.J., Hopwood P., Ahmedzai S. // Assessing quality of life in palliative oncology. – Progress in Palliative Care. – 1994. – Vol. 2, вДЦ3. – P. 80–86.
18. Drake MT, Clarke BL, Khosia S. Bisphosphonates: mechanism of action and role in clinical practice. Mayo Clin Proc 2008;83:1032–45 ,
19. Honore P, Luger NM, Sabino MA, Schwei MJ, Rogers SD, Mach DB, ‘Keefe PF, Ramnaraine ML, Clohisy DR, Mantyh PW. Osteoprotegerin locks bone cancer–induced skeletal destruction, skeletal pain and pain–related neurochemical reorganization of the spinal cord. Nat Med 000;6:521–8 ,
20. Halvorson KG, Sevcik MA, Ghilardi JR, Rosol TJ, Mantyh PW. Similarities and differences in tumor growth, skeletal remodeling and pain in an steolytic and osteoblastic model of bone cancer. Clin J Pain 2006;22:587–600 ;
21. Nelson J B, Carducci M A 2000 The role of endothelin–1 and endothelin receptor antagonists in prostate cancer. BJU International 85(Suppl 2):45–48
22. Kundu N, Yang Q Y, Dorsey R et al 2001 Increased cyclooxygenase–2 (COX–2) expression and activity in a murine model of metastatic breast cancer. International Journal of Cancer 93(5):681–686
23. Molina M A, Sitja–Arnau M, Lemoine M G et al 1999 Increased cyclooxygenase–2 expression in human pancreatic carcinomas and cell lines: growth inhibition by nonsteroidal anti–inflammatory drugs. Cancer Research 59(17):4356–4362
24. Ohno R, Yoshinaga K, Fujita T et al 2001 Depth of invasion parallels increased cyclooxygenase–2 levels in patients with gastric carcinoma. Cancer 91(10):1876–1881
25. Masferrer J L, Leahy K M, Koki A T et al 2000 Antiangiogenic and antitumor activities of cyclooxygenase–2 inhibitors. Cancer Research 60(5):1306–1311
26. Moore B C, Simmons D L 2000 COX–2 inhibition, apoptosis, and chemoprevention by nonsteroidal anti–inflammatory drugs. Current Medicinal Chemistry












