–Т—Л—А–∞–ґ–∞–µ–Љ –Є—Б–Ї—А–µ–љ–љ—О—О –±–ї–∞–≥–Њ–і–∞—А–љ–Њ—Б—В—М –∞–≤—В–Њ—А–∞–Љ –і–∞–љ–љ–Њ–є —Б—В–∞—В—М–Є –Ј–∞ –Љ–µ–ґ–і–Є—Б—Ж–Є–њ–ї–Є–љ–∞—А–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—О –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Њ–є –њ–ї–Њ—В–љ–Њ—Б—В–Є –Є —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б—В—А—Г–Ї—В—Г—А –≥–ї–∞–Ј–∞ –≤ –љ–Њ—А–Љ–µ –Є –њ—А–Є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–µ (–Ю–£–У). –Р–≤—В–Њ—А—Л –њ–Њ–њ—Л—В–∞–ї–Є—Б—М –≤—Л—П–≤–Є—В—М –Ї–ї—О—З–µ–≤—Л–µ –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –Є —Б–Ї–ї–µ—А—Л –Ї–∞–Ї –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–µ –Љ–∞—А–Ї–µ—А—Л —А–∞–Ј–≤–Є—В–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ю–і–љ–∞–Ї–Њ –≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –≤—Л–±–Њ—А–Ї–∞ –њ–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤—Г –≥–ї–∞–Ј –≤ –њ—А–Є–љ—Ж–Є–њ–µ –љ–µ —П–≤–ї—П–ї–∞—Б—М —А–µ–њ—А–µ–Ј–µ–љ—В–∞—В–Є–≤–љ–Њ–є (–њ–Њ 20 –Ј–і–Њ—А–Њ–≤—Л—Е –Є –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –≥–ї–∞–Ј, —З—В–Њ —П–≤–љ–Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –і–ї—П —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –≤—Л–≤–Њ–і–Њ–≤), –∞ –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–Є –Є–Ј–Љ–µ—А–µ–љ–Є–є –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є —А–∞–Ј–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –≤ —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ —Г—З–Є—В—Л–≤–∞–ї–Є—Б—М. –Ш –±–µ–Ј —Б–Њ–Љ–љ–µ–љ–Є—П, –≤–Њ –Љ–љ–Њ–≥–Њ–Љ —Н—В–Њ –њ–Њ–≤–ї–Є—П–ї–Њ –љ–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤.
–°—В–Њ–Є—В –њ—А–Є–Ј–љ–∞—В—М, —З—В–Њ –≤ –Љ–Є—А–Њ–≤–Њ–є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –љ–∞—Г—З–љ—Л—Е –Є–ї–Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–Є –Є–Ј–Љ–µ—А–µ–љ–Є–є –њ–Њ—З—В–Є –љ–Є–Ї–Њ–≥–і–∞ –љ–µ —Г—З–Є—В—Л–≤–∞—О—В—Б—П, —З—В–Њ –Ј–∞—З–∞—Б—В—Г—О –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—И–Є–±–Њ—З–љ–Њ–Љ—Г –і–Є–∞–≥–љ–Њ–Ј—Г –Є –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ–Љ—Г –≤—Л–±–Њ—А—Г —Б–њ–Њ—Б–Њ–±–∞ –ї–µ—З–µ–љ–Є—П. –Ш —Н—В–Њ —Б–µ–≥–Њ–і–љ—П –њ—А–Њ–±–ї–µ–Љ–∞ –≤—Б–µ–є –Љ–Є—А–Њ–≤–Њ–є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є, –Ї–Њ–≥–і–∞, –љ–∞–њ—А–Є–Љ–µ—А, –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ—Л–µ –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–Є –Є–Ј–Љ–µ—А–µ–љ–Є–є –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Т–У–Ф) —А–∞–Ј–љ—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є —З–∞—Б—В–Њ –њ—А–µ–≤—Л—И–∞—О—В 15вАУ20% –Є –±–Њ–ї–µ–µ [1, 2]. –Ь–µ–ґ–і—Г —В–µ–Љ –≤ —В–µ—Е–љ–Є–Ї–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є–Ј–Љ–µ—А–µ–љ–Є–є —Б—З–Є—В–∞—О—В—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є, –µ—Б–ї–Є –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–∞—П –њ–Њ–≥—А–µ—И–љ–Њ—Б—В—М –Є–Ј–Љ–µ—А–µ–љ–Є–є –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 2%.
–°—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤–µ—А—И–Є–љ–Њ–є —Б–≤–Њ–µ–є –љ–∞—Г—З–љ–Њ–є –Є –Њ—А–≥–∞–љ–Є–Ј–∞—В–Њ—А—Б–Ї–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є –У–µ—А–Љ–∞–љ –Ы—О–і–≤–Є–≥ –§–µ—А–і–Є–љ–∞–љ–і —Д–Њ–љ –У–µ–ї—М–Љ–≥–Њ–ї—М—Ж —Б—З–Є—В–∞–ї –њ–Њ—Б—В—А–Њ–µ–љ–љ—Л–є –њ–Њ –µ–≥–Њ –Є–љ–Є—Ж–Є–∞—В–Є–≤–µ –≤ –®–∞—А–ї–Њ—В—В–µ–љ–±—Г—А–≥–µ –≤ 1877 –≥. –њ–µ—А–≤—Л–є –≤ –Љ–Є—А–µ –Ш–љ—Б—В–Є—В—Г—В –Љ–µ—В—А–Њ–ї–Њ–≥–Є–Є (—В–Њ–≥–і–∞ –§–Є–Ј–Є–Ї–Њ-—В–µ—Е–љ–Є—З–µ—Б–Ї–Њ–µ –Є–Љ–њ–µ—А—Б–Ї–Њ–µ –≤–µ–і–Њ–Љ—Б—В–≤–Њ, –∞ –љ—Л–љ–µ вАФ –§–Є–Ј–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—В–Є—В—Г—В –С–µ—А–ї–Є–љ—Б–Ї–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞), —З—В–Њ–±—Л —Б–Њ–Ј–і–∞–≤–∞—В—М –≤—Л—Б–Њ–Ї–Њ—В–Њ—З–љ—Л–µ —Б—А–µ–і—Б—В–≤–∞ –Є–Ј–Љ–µ—А–µ–љ–Є—П. –§–Є–Ј–Є–Ї, –Љ–µ—Е–∞–љ–Є–Ї, –∞–Ї—Г—Б—В–Є–Ї, –Љ–µ—В–µ–Њ—А–Њ–ї–Њ–≥, —Д–Є–Ј–Є–Њ–ї–Њ–≥ –Є –≤–Њ–µ–љ–љ—Л–є –≤—А–∞—З –У–µ–ї—М–Љ–≥–Њ–ї—М—Ж —Г–ґ–µ —В–Њ–≥–і–∞ –њ—А–µ–Ї—А–∞—Б–љ–Њ –њ–Њ–љ–Є–Љ–∞–ї, —З—В–Њ –±–µ–Ј —В–Њ—З–љ—Л—Е –Є–Ј–Љ–µ—А–µ–љ–Є–є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Ј–∞–љ–Є–Љ–∞—В—М—Б—П –љ–∞—Б—В–Њ—П—Й–µ–є –љ–∞—Г–Ї–Њ–є, –≤–Ї–ї—О—З–∞—П –Є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—О –Ї–∞–Ї —А–∞–Ј–і–µ–ї –Љ–µ–і–Є—Ж–Є–љ—Л. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ —А–µ–і–Ї–Њ –≤—Б—В—А–µ—В–Є—И—М —А–∞–±–Њ—В—Л, –≤ –Ї–Њ—В–Њ—А—Л—Е –≤—Л–≤–Њ–і—Л –Њ—Б–љ–Њ–≤–∞–љ—Л –љ–∞ —Г—З–µ—В–µ –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–µ–є –Є–Ј–Љ–µ—А–µ–љ–Є–є.
–Ь—Л —Г–ґ–µ –±–Њ–ї–µ–µ 30 –ї–µ—В –Ј–∞–љ–Є–Љ–∞–µ–Љ—Б—П –њ—А–Њ–±–ї–µ–Љ–Њ–є –Ю–£–У –љ–∞ –Љ–µ–ґ-–і–Є—Б—Ж–Є–њ–ї–Є–љ–∞—А–љ–Њ–Љ —Г—А–Њ–≤–љ–µ, –Є –њ–Њ—Н—В–Њ–Љ—Г –љ–∞–Љ —П—Б–љ–∞ –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В—М –Ј–∞–Ї–Њ–љ–∞–Љ –Љ–µ—Е–∞–љ–Є–Ї–Є —В–µ—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–ї—Г—З–Є–ї–Є –∞–≤—В–Њ—А—Л —Б—В–∞—В—М–Є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ –Ј–∞–і–∞—З–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –≤ –њ—А–Є–Љ–µ–љ–µ–љ–љ—Л—Е –∞–≤—В–Њ—А–∞–Љ–Є –Љ–µ—В–Њ–і–Є–Ї–∞—Е, –∞ —В–∞–Ї–ґ–µ –≤ —В—А–∞–Ї—В–Њ–≤–Ї–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є–Љ–µ—О—В—Б—П –љ–µ –≤ –њ–Њ–ї–љ–Њ–є –Љ–µ—А–µ –Ї–Њ—А—А–µ–Ї—В–љ—Л–µ, –∞ –Є–љ–Њ–≥–і–∞ –Є –Њ—И–Є–±–Њ—З–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞—Е –≥–ї–∞–Ј–∞, –Ї–Њ—В–Њ—А—Л–µ –≤–Њ –Љ–љ–Њ–≥–Њ–Љ –Є –Њ–њ—А–µ–і–µ–ї—П—О—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї—Г—О —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—О –≥–ї–∞–Ј–∞ –њ—А–Є –Ю–£–У.
–°—В–Њ–Є—В –Њ—Б–Њ–±–Њ –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ –Љ—Л —Б —Г–≤–∞–ґ–µ–љ–Є–µ–Љ –Њ—В–љ–Њ—Б–Є–Љ—Б—П –Ї –∞–≤—В–Њ—А–∞–Љ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є —Е–Њ—А–Њ—И–Њ –њ–Њ–љ–Є–Љ–∞–µ–Љ, –Ї–∞–Ї–Є–µ —В—А—Г–і–љ–Њ—Б—В–Є –Њ–љ–Є –њ—А–µ–Њ–і–Њ–ї–µ–ї–Є –≤ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ –Ј–∞–і–∞—З–Є. –Ю–і–љ–∞–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –∞—А—Е–∞–Є—З–љ—Л—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є –Њ–± –Њ—В—Б—Г—В—Б—В–≤–Є–Є –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–∞–љ–љ–Њ–є —А–∞–±–Њ—В—Л –≤—Б–µ—Е —Б—В—А—Г–Ї—В—Г—А –≥–ї–∞–Ј–∞ —Б—Л–≥—А–∞–ї–Њ —Б –∞–≤—В–Њ—А–∞–Љ–Є –Ј–ї—Г—О —И—Г—В–Ї—Г: –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Є—Е —В—А–∞–Ї—В–Њ–≤–Ї–∞ –≤ –±–Њ–ї—М—И–µ–є —З–∞—Б—В–Є –њ—А–Њ—В–Є–≤–Њ—А–µ—З–∞—В –Ј–∞–Ї–Њ–љ–∞–Љ –Љ–µ—Е–∞–љ–Є–Ї–Є.
–Т —З–∞—Б—В–љ–Њ—Б—В–Є, –Њ–і–љ–Є–Љ –Є–Ј –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Л—Е –∞–≤—В–Њ—А–∞–Љ–Є –љ–∞—Г—З–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —П–≤–ї—П–µ—В—Б—П –≤—Л–≤–Њ–і –Њ —Б–љ–Є–ґ–µ–љ–Є–Є –Њ–Ї—Г–ї—П—А–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –≤ –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –≥–ї–∞–Ј–∞—Е –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –Ј–і–Њ—А–Њ–≤—Л–Љ–Є. –≠—В–Њ –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–∞—П –Њ—И–Є–±–Ї–∞. –Ф–∞–ї–µ–µ –Љ—Л –њ–Њ—Б—В–∞—А–∞–µ–Љ—Б—П –Ї—А–∞—В–Ї–Њ –Њ–±—К—П—Б–љ–Є—В—М –Є –Њ–±–Њ—Б–љ–Њ–≤–∞—В—М –љ–µ–∞–і–µ–Ї–≤–∞—В–љ–Њ—Б—В—М —Н—В–Њ–≥–Њ –Є –і—А—Г–≥–Є—Е –≤—Л–≤–Њ–і–Њ–≤ –∞–≤—В–Њ—А–Њ–≤. –Э–Њ —Б–љ–∞—З–∞–ї–∞ —А–∞–Ј–±–µ—А–µ–Љ—Б—П –≤ –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П—Е –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є—Е –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –Т–µ–і—М –±–µ–Ј —Н—В–Њ–≥–Њ –±—Г–і–µ—В –љ–µ –њ–Њ–љ—П—В–љ–∞ —Б—Г—В—М –љ–∞—И–Є—Е –Ј–∞–Љ–µ—З–∞–љ–Є–є. –Ш —В–Њ–≥–і–∞ –Њ—И–Є–±–Ї–Є, –Ї–Њ—В–Њ—А—Л–µ —Б–і–µ–ї–∞–ї–Є –∞–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є, –±—Г–і—Г—В –њ–Њ–≤—В–Њ—А—П—В—М –Є –і—А—Г–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –≥–ї–∞–Ј–∞.
![–†–Є—Б—Г–љ–Њ–Ї. –Ю–±–Њ–±—Й–µ–љ–љ—Л–є —Е–Њ–і –Ї—А–Є–≤—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–Є–≥–Є–і–љ–Њ—Б—В–Є, —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є (—Б–Њ—Б—В–Њ—П–љ–Є—П —Д—Г–љ–Ї—Ж–Є–є —Б–Ї–ї–µ—А—Л) –Є –Т–У–Ф –≤ —А–∞–Ј–љ—Л–µ –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –њ–µ—А–Є–Њ–і—Л –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—А–Є –Т–Ю–У –Є –Ю–£–У [3]. –®–Ї–∞–ї–∞ –≤–Њ–Ј—А–∞—Б—В–∞ –≤—Л–±—А–∞–љ–∞ –љ–µ —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ —И–∞–≥–Њ–Љ 10 –ї–µ—В, –∞ —Б–Њ–≥–ї–∞—Б–љ–Њ –њ–µ—А–Є–Њ–і–∞–Љ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–≥–Њ —Б—В–∞—А–µ–љ–Є—П –†–Є—Б—Г–љ–Њ–Ї. –Ю–±–Њ–±—Й–µ–љ–љ—Л–є —Е–Њ–і –Ї—А–Є–≤—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–Є–≥–Є–і–љ–Њ—Б—В–Є, —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є (—Б–Њ—Б—В–Њ—П–љ–Є—П —Д—Г–љ–Ї—Ж–Є–є —Б–Ї–ї–µ—А—Л) –Є –Т–У–Ф –≤ —А–∞–Ј–љ—Л–µ –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –њ–µ—А–Є–Њ–і—Л –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞ –њ—А–Є –Т–Ю–У –Є –Ю–£–У [3]. –®–Ї–∞–ї–∞ –≤–Њ–Ј—А–∞—Б—В–∞ –≤—Л–±—А–∞–љ–∞ –љ–µ —Б —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–Љ —И–∞–≥–Њ–Љ 10 –ї–µ—В, –∞ —Б–Њ–≥–ї–∞—Б–љ–Њ –њ–µ—А–Є–Њ–і–∞–Љ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–≥–Њ —Б—В–∞—А–µ–љ–Є—П](/upload/medialibrary/73c/231-1.png)
–Ф–ї—П –њ–Њ—П—Б–љ–µ–љ–Є—П –њ–Њ—Б–ї–µ–і–љ–Є—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є–є –Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ю–£–У –Љ—Л –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–∞ —А–Є—Б—Г–љ–Ї–µ –Њ–±–Њ–±—Й–µ–љ–љ—Г—О —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї—Г—О –і–Є–∞–≥—А–∞–Љ–Љ—Г –љ–∞—И–Є—Е –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–Є—Е –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —В—Л—Б—П—З–∞—Е –Ј–і–Њ—А–Њ–≤—Л—Е –Є –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –≥–ї–∞–Ј –љ–∞ –њ–љ–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ ORA (Rie—Бhert, –°–®–Р) (–њ–Њ —Б–Њ–±—Б—В–≤–µ–љ–љ—Л–Љ –љ–Њ–≤—Л–Љ –Є –њ—А–Њ—Б—В—Л–Љ –Љ–µ—В–Њ–і–Є–Ї–∞–Љ), –∞ —В–∞–Ї–ґ–µ —Б –њ–Њ–Љ–Њ—Й—М—О –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —Б—В–∞—В–Є—З–µ—Б–Ї–Њ–є –∞–њ–њ–ї–∞–љ–∞—Ж–Є–Њ–љ–љ–Њ–є —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є –і–≤—Г–Љ—П —А–∞–Ј–љ—Л–Љ–Є –≥—А—Г–Ј–∞–Љ–Є –њ–Њ –љ–∞—И–µ–є —А–∞—Б—З–µ—В–љ–Њ–є —Б—Е–µ–Љ–µ. –≠—В–Є –Є–Ј–Љ–µ—А–µ–љ–Є—П —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –њ—А–Є –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ–Љ –Њ–±—К–µ–Љ–µ –≥–ї–∞–Ј–∞ –Ј–∞ –≤—А–µ–Љ—П 0,02 —Б (–њ–љ–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ ORA) –Є 0,25 —Б (–∞–њ–њ–ї–∞–љ–∞—Ж–Є–Њ–љ–љ–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –≥—А—Г–Ј–Њ–Љ 10 –Є 15 –≥ –њ–Њ –Ь–∞–Ї–ї–∞–Ї–Њ–≤—Г) c 15-–Љ–Є–љ—Г—В–љ—Л–Љ –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –Љ–µ–ґ–і—Г –Є–Ј–Љ–µ—А–µ–љ–Є—П–Љ–Є, —В. –µ. –≤ —Г—Б–ї–Њ–≤–Є—П—Е, –±–ї–Є–Ј–Ї–Є—Е –Ї ¬Ђ–Ј–∞–Ї—А—Л—В–Њ–є –≥–Є–і—А–∞–≤–ї–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ–µ –≥–ї–∞–Ј–∞¬ї, –Ї–Њ–≥–і–∞ –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П–ї—Б—П.
–Ш–Ј —А–Є—Б—Г–љ–Ї–∞ —Е–Њ—А–Њ—И–Њ –≤–Є–і–љ–Њ, —З—В–Њ –і–Њ 45 –ї–µ—В –Є–Ј–Љ–µ–љ–µ–љ–Є–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Д–Є–±—А–Њ–Ј–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –≥–ї–∞–Ј–∞ (–§–Ю–У), —Г—А–Њ–≤–љ—П –Т–У–Ф –Є —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є —Б–Ї–ї–µ—А—Л –љ–µ—В. –Ю–і–љ–∞–Ї–Њ –љ–∞—З–Є–љ–∞—П —Б 45 –ї–µ—В —А–Є–≥–Є–і–љ–Њ—Б—В—М –Ј–і–Њ—А–Њ–≤—Л—Е –≥–ї–∞–Ј –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П. –Т –Њ—В–≤–µ—В —Б–Є–љ—Е—А–Њ–љ–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В—Б—П –Є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф. –Ш–Љ–µ–љ–љ–Њ –≤ –Њ—В–≤–µ—В –љ–∞ —А–Њ—Б—В —А–Є–≥–Є–і–љ–Њ—Б—В–Є (–ґ–µ—Б—В–Ї–Њ—Б—В–Є) –§–Ю–У –њ–Њ–≤—Л—И–∞–µ—В—Б—П –Т–У–Ф, –∞ –љ–µ —Б–∞–Љ–Њ –њ–Њ —Б–µ–±–µ –Є–Ј-–Ј–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ ¬Ђ–Ј–∞—Б–Њ—А–µ–љ–Є—П¬ї –њ—Г—В–µ–є –Њ—В—В–Њ–Ї–∞ –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ. –Я–Њ—Н—В–Њ–Љ—Г –Њ—Б–љ–Њ–≤–љ–∞—П –њ—А–Є—З–Є–љ–∞ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –Њ—Д—В–∞–ї—М–Љ–Њ–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є (–Т–Ю–У) вАФ —Н—В–Њ –њ–Њ—Б—В–µ–њ–µ–љ–љ—Л–є —А–Њ—Б—В —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У.
–Ю—В–Љ–µ—В–Є–Љ, —З—В–Њ –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –љ–Њ—А–Љ–∞–ї—М–љ—Л–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –њ—А–Њ—Ж–µ—Б—Б —Б—В–∞—А–µ–љ–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є –≤–Њ –≤—Б–µ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ–µ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ —З–µ–ї–Њ–≤–µ–Ї–∞, –Ї–Њ–≥–і–∞ —А–Є–≥–Є–і–љ–Њ—Б—В—М (–ґ–µ—Б—В–Ї–Њ—Б—В—М) —Б—В–µ–љ–Њ–Ї —Б–Њ—Б—Г–і–Њ–≤ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —А–∞—Б—В–µ—В, –∞ –≤ –Њ—В–≤–µ—В —Б–Є–љ—Е—А–Њ–љ–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –Є —Г—А–Њ–≤–µ–љ—М –Р–Ф. –Ш –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є, –Є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є —Б–µ–≥–Њ–і–љ—П –Є—Б–њ—Л—В—Л–≤–∞—О—В —В—А—Г–і–љ–Њ—Б—В–Є —Б –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П —Ж–µ–ї–µ–≤–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ –њ—А–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–µ–љ–Ј–Є–Є, –Т–Ю–У –Є–ї–Є –Ю–£–У –љ–µ —В–Њ–ї—М–Ї–Њ –Є–Ј-–Ј–∞ –Њ—В—Б—Г—В—Б—В–≤–Є—П –Њ–±—К–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ –µ–≥–Њ –і–Њ—Б—В–Є–ґ–µ–љ–Є—П, –љ–Њ –Є –Є–Ј-–Ј–∞ –љ–∞–ї–Є—З–Є—П ¬Ђ—З–µ—А–љ—Л—Е –і—Л—А¬ї –≤ —В–µ–Њ—А–Є—П—Е –Є—Е –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞. –Я—А–∞–Ї—В–Є–Ї—Г—О—Й–Є–µ –≤—А–∞—З–Є —Е–Њ—А–Њ—И–Њ –Ј–љ–∞—О—В, –Ї–∞–Ї —В—А—Г–і–љ–Њ –±—Л–≤–∞–µ—В –Њ—В–і–µ–ї–Є—В—М –Т–Ю–У –Њ—В —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–є ¬Ђ–њ—А–µ–≥–ї–∞—Г–Ї–Њ–Љ—Л¬ї –Є–ї–Є –њ–Њ–і–Њ–Ј—А–µ–љ–Є—П –љ–∞ –Ю–£–У, –Є—Б–њ–Њ–ї—М–Ј—Г—П —В–∞–Ї–Њ–є –љ–µ –≤ –њ–Њ–ї–љ–Њ–є –Љ–µ—А–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–є –Ї—А–Є—В–µ—А–Є–є, –Ї–∞–Ї ¬Ђ—Г—А–Њ–≤–µ–љ—М –Т–У–Ф¬ї [4вАУ6].
–Ю–і–љ–∞–Ї–Њ —Б–µ–≥–Њ–і–љ—П –Љ–љ–Њ–≥–Є–µ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є –Є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є —Г–ґ–µ —З–µ—В–Ї–Њ –њ–Њ–љ–Є–Љ–∞—О—В, —З—В–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Р–Ф –Є–ї–Є –Т–У–Ф –њ—А–Є –Т–Ю–У –њ–Њ—З–µ–Љ—Г-—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б—В–∞—А–µ—О—Й–µ–Љ—Г –Њ—А–≥–∞–љ–Є–Ј–Љ—Г –Ј–і–Њ—А–Њ–≤–Њ–≥–Њ —З–µ–ї–Њ–≤–µ–Ї–∞! –Ш —З—В–Њ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–є –њ—Г—В—М –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –њ—А–Є –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А—В–Њ–љ–Є–Є, –Т–Ю–У –Є–ї–Є –Ю–£–У, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –≤—Б–µ–≥–і–∞ —Г—Е—Г–і—И–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б—Л –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –Є —Г—Б–Ї–Њ—А—П–µ—В —Б—В–∞—А–µ–љ–Є–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е —Б—В—А—Г–Ї—В—Г—А. –Р —Н—В–Њ –љ–µ–Љ–Є–љ—Г–µ–Љ–Њ –њ—А–Є–≤–µ–і–µ—В –Ї —Б–ї–µ–і—Г—О—Й–µ–Љ—Г (—Г–ґ–µ —А—Г–Ї–Њ—В–≤–Њ—А–љ–Њ–Љ—Г!) —Б–Ї–∞—З–Ї—Г –Р–Ф –Є–ї–Є –Т–У–Ф –Є –Ї —Г—Б–Ї–Њ—А–µ–љ–Є—О –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Б—В–∞—А–µ–љ–Є—П.
–Ю–њ—А–Њ—Б 111 —Б–ї—Г—З–∞–є–љ–Њ –≤—Л–±—А–∞–љ–љ—Л—Е –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Є—Е –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Њ–≤ (2004) –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ (87%) –≤—А–∞—З–µ–є –њ–Њ–Ј–≤–Њ–ї—П–ї–Є –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б –Т–Ю–У –±–µ–Ј —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –њ–µ—А–µ—Е–Њ–і–∞ –≤ –Ю–£–У –Є–Љ–µ—В—М –Є—Б—В–Є–љ–љ–Њ–µ –Т–У–Ф >25 –Љ–Љ —А—В. —Б—В., –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –њ–Њ—З—В–Є 30% –≤—А–∞—З–µ–є –њ–Њ–Ј–≤–Њ–ї—П–ї–Є —В–∞–Ї–Є–Љ –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Є–Љ–µ—В—М —Г—А–Њ–≤–µ–љ—М –Т–У–Ф >30 –Љ–Љ —А—В. —Б—В. –і–Њ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є. –Ш —В–Њ–ї—М–Ї–Њ –њ—А–Є –њ—А–µ–≤—Л—И–µ–љ–Є–Є —Н—В–Њ–≥–Њ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ—А–Њ–≥–∞ –Є—Б—В–Є–љ–љ–Њ–≥–Њ –Т–У–Ф –њ—А–Є–љ–Є–Љ–∞–ї–Є—Б—М –Љ–µ—А—Л –Ї –µ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—О. –£—А–Њ–≤–µ–љ—М –Т–У–Ф –Њ—В 28 –і–Њ 30 –Љ–Љ —А—В. —Б—В. —Б—З–Є—В–∞–ї–Є –њ–Њ—А–Њ–≥–Њ–Љ 62% –≤—А–∞—З–µ–є, –∞ —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –Њ—В 22 –і–Њ 27 –Љ–Љ —А—В. —Б—В. вАФ 71% –≤—А–∞—З–µ–є [3]. –Я–Њ—Н—В–Њ–Љ—Г –Љ—Л —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ —Б–Њ–≥–ї–∞—Б–љ—Л —Б –∞–≤—В–Њ—А–∞–Љ–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є –≤ –Њ—В–Ї–ї–Є–Ї–µ —Б—В–∞—В—М–Є –≤ —В–Њ–Љ, —З—В–Њ ¬Ђ—Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Є –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ –Т–У–Ф –љ–µ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≥–ї–∞—Г–Ї–Њ–Љ–∞¬ї (—А. 932).
–Ф–ї—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –§–Ю–У –њ—А–Є –Т–Ю–У –Є –њ—А–Є –Ю–£–У –Љ—Л –≤–≤–µ–ї–Є –љ–Њ–≤–Њ–µ –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –њ–Њ–љ—П—В–Є–µ вАФ —Д–ї—Г–Ї—В—Г–∞—Ж–Є—П. –≠—В–Њ –Љ–µ—А–∞ —В–µ–Ї—Г—Й–µ–є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Њ–±–Њ–ї–Њ—З–Ї–Є –≥–ї–∞–Ј–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—В—М —Б–≤–Њ–Є –Њ—Б–љ–Њ–≤–љ—Л–µ —Д—Г–љ–Ї—Ж–Є–Є (–Љ—Л –Є—Е –љ–∞—И–ї–Є –Є –Њ–њ–Є—Б–∞–ї–Є –≤ 2009 –≥.): –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М —В—Г—А–≥–Њ—А –≥–ї–∞–Ј–∞, –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞—В—М –њ—Г–ї—М—Б –Р–Ф (—В. –µ. –љ–Є–≤–µ–ї–Є—А–Њ–≤–∞—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –Њ–±—К–µ–Љ–∞ —Б–Њ—Б—Г–і–Њ–≤ –≤ —Б–Є—Б—В–Њ–ї—Г-–і–Є–∞—Б—В–Њ–ї—Г, –њ—А–Є–≤–Њ–і—П—Й–µ–µ –Ї –Љ–Є–Ї—А–Њ–Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –Њ–±—К–µ–Љ–∞ –≥–ї–∞–Ј–∞), –≤—Л—В–∞–ї–Ї–Є–≤–∞—В—М –Ј–∞ —Б—З–µ—В –і—А–µ–љ–Є—А–Њ–≤–∞–љ–Є—П –љ–∞—А—Г–ґ—Г –њ–Њ –њ—Г—В—П–Љ –Њ—В—В–Њ–Ї–∞ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ—Г—О –ґ–Є–і–Ї–Њ—Б—В—М –Є –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—В—М –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є —В–µ–Ї—Г—Й–Є–є –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ [6вАУ8].
–≠—В–Є —Д—Г–љ–Ї—Ж–Є–Є –§–Ю–У –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В –Ј–∞ —Б—З–µ—В —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А —Б–Ї–ї–µ—А—Л, –∞ –Љ–Њ–Ј–≥ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В —В–µ–Ї—Г—Й–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Љ–µ—Е–∞–љ–Њ—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≤ —Б–Ї–ї–µ—А–µ, –∞ —В–∞–Ї–ґ–µ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –≤ —Б–Ї–ї–µ—А–µ. –Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –≤ –≥–ї–∞–Ј—Г –љ–µ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В—Б—П, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є –њ–Њ–Ї–∞ –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –≤ –≥–ї–∞–Ј—Г –±–∞—А–Њ—А–µ—Ж–µ–њ—В–Њ—А—Л [9, 10]. –Ґ–Њ –µ—Б—В—М –Љ–Њ–Ј–≥ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ—В –љ–µ —Г—А–Њ–≤–µ–љ—М –Т–У–Ф, –∞ —В–µ–Ї—Г—Й–Є–є –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞.
–≠—В–Њ –њ–µ—А–≤–Њ–µ –±–∞–Ј–Њ–≤–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –≤ –±–Є–Њ–Љ–µ—Е–∞–љ–Є–Ї–µ –§–Ю–У. –Я—А–Є—З–µ–Љ –≥–ї–∞–≤–љ–∞—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –Ј–∞–і–∞—З–∞ –≥–ї–∞–Ј–∞ вАФ —Н—В–Њ –µ–ґ–µ—Б—Г—В–Њ—З–љ–Њ–µ –њ—А–Њ–Ї–∞—З–Є–≤–∞–љ–Є–µ —З–µ—А–µ–Ј –µ–≥–Њ –њ–Њ–ї–Њ—Б—В—М –њ–Њ—Б—В–Њ—П–љ–љ–Њ–≥–Њ –Њ–±—К–µ–Љ–∞ –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є (–Њ–Ї–Њ–ї–Њ 4,5 –Љ–Ї–ї/–Љ–Є–љ) –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≤ –љ–Њ—А–Љ–µ. –Р–љ–∞–ї–Њ–≥–Є—З–љ–Њ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–∞—П —Б–Є—Б—В–µ–Љ–∞ –µ–ґ–µ—Б—Г—В–Њ—З–љ–Њ –њ—А–Њ–Ї–∞—З–Є–≤–∞–µ—В —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –љ–∞–Љ, –њ—А–Є–Љ–µ—А–љ–Њ –њ–Њ—Б—В–Њ—П–љ–љ—Л–є –Њ–±—К–µ–Љ –Ї—А–Њ–≤–Є (–Є–љ–Њ–≥–і–∞ 2вАУ4 –Љ3) –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≤–Њ –≤—Б–µ—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е –Њ—А–≥–∞–љ–Є–Ј–Љ–∞.
–Т—В–Њ—А–Њ–µ –±–∞–Ј–Њ–≤–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –≤ –±–Є–Њ–Љ–µ—Е–∞–љ–Є–Ї–µ –§–Ю–У вАФ —Н—В–Њ —В–Њ, —З—В–Њ –і–∞–≤–ї–µ–љ–Є–µ –≤ –≥–ї–∞–Ј—Г –Љ–Њ–ґ–µ—В –≤–Њ–Ј–љ–Є–Ї–љ—Г—В—М —В–Њ–ї—М–Ї–Њ —В–Њ–≥–і–∞, –Ї–Њ–≥–і–∞ –§–Ю–У —Б–Њ–ґ–Љ–µ—В —Б–љ–∞—А—Г–ґ–Є –≤—Б–µ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ—Л–µ —Б—В—А—Г–Ї—В—Г—А—Л (–Ї–Њ—В–Њ—А—Л–µ –њ–Њ —Б–≤–Њ–µ–є —Б—Г—В–Є —Б–Њ—Б—В–Њ—П—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –Є–Ј –љ–µ—Б–ґ–Є–Љ–∞–µ–Љ—Л—Е –≤–Њ–і—П–љ–Є—Б—В—Л—Е –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–є). –≠—В–Њ —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –і–Њ —Б–Є—Е –њ–Њ—А –љ–µ–њ–Њ–љ—П—В–љ–Њ –Њ–≥—А–Њ–Љ–љ–Њ–Љ—Г —З–Є—Б–ї—Г —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —Б—З–Є—В–∞—О—В, —З—В–Њ –≤ —В–Ї–∞–љ—П—Е –≥–ї–∞–Ј–∞ –µ—Б—В—М —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –Є ¬Ђ—А–∞—Б–њ–Є—А–∞–µ—В –Є–Ј–љ—Г—В—А–Є¬ї –Ї–∞–њ—Б—Г–ї—Г –≥–ї–∞–Ј–∞, —Б–Њ–Ј–і–∞–≤–∞—П –Т–У–Ф [11], –Є–ї–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є—З–Є–љ—Л –њ–Њ–≤—Л—И–µ–љ–Є—П –Т–У–Ф –≤ –≥–ї–∞–Ј—Г –љ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л, –∞ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П –Њ—В—В–Њ–Ї—Г –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є [12].
–≠—В–Є –∞—А—Е–∞–Є—З–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –Њ–≥—А–Њ–Љ–љ–Њ–Љ—Г —З–Є—Б–ї—Г –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–є –≥–ї–∞–Ј–∞ –њ–Њ–љ—П—В—М, —З—В–Њ —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –≤ –≥–ї–∞–Ј—Г –≤ –Ї–∞–ґ–і—Л–є –Љ–Њ–Љ–µ–љ—В –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Г—А–Њ–≤–љ–µ–Љ –Њ–±—К–µ–Љ–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У –њ—А–Є –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–Љ –Њ–±—К–µ–Љ–µ –≥–ї–∞–Ј–∞. –У–Њ–≤–Њ—А—П –Ї–Њ—А–Њ—В–Ї–Њ: –Ї–∞–Ї–Њ–≤–∞ —А–Є–≥–Є–і–љ–Њ—Б—В—М, —В–∞–Ї–Њ–≤ –Є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф (—А<0,001) [3, 6]. –Ш –љ–µ –љ–∞–Њ–±–Њ—А–Њ—В! –≠—В–Њ —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –њ—А–Њ—П–≤–ї–µ–љ–Є–µ –Ј–∞–Ї–Њ–љ–∞ –њ—А–Є—А–Њ–і—Л –Є —В–µ–Њ—А–Є–Є –Њ–±–Њ–ї–Њ—З–µ–Ї.
–Э–∞ —А–Є—Б—Г–љ–Ї–µ —В–∞–Ї–ґ–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Њ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ –њ–Њ–і–≤–Є–ґ–љ–Њ–µ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–µ –њ–Њ–ї–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Њ–±—Л—З–љ–Њ 10вАУ15 –ї–µ—В, –≤ —А–∞–Љ–Ї–∞—Е –Ї–Њ—В–Њ—А–Њ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–≥–Њ —Б—В–∞—А–µ–љ–Є—П –Ї–∞–њ—Б—Г–ї—Л –≥–ї–∞–Ј–∞. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —Н—В–Њ–≥–Њ —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ 2вАУ3 —А–∞–Ј–∞, –∞ —Д–ї—Г–Ї—В—Г–∞—Ж–Є—П –њ–∞–і–∞–µ—В –≤ 4вАУ8 —А–∞–Ј [13, 14]. –§–Ю–У —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є —В–µ—А—П–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤—Л–њ–Њ–ї–љ—П—В—М —Б–≤–Њ–Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –≤ –њ–Њ–ї–љ–Њ–Љ –Њ–±—К–µ–Љ–µ. –Я–Њ–і—З–µ—А–Ї–љ–µ–Љ, —З—В–Њ —Н—В–Њ—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–≥–Њ —Б—В–∞—А–µ–љ–Є—П –§–Ю–У –њ—А–Є–≤–Њ–і–Є—В –Ї –Њ—В–≤–µ—В–љ–Њ–Љ—Г –Є –Є–љ–Њ–≥–і–∞ –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Њ–Љ—Г —Б–Ї–∞—З–Ї—Г —Г—А–Њ–≤–љ—П –Т–У–Ф. –Ы—Г—З—И–µ –≤—Б–µ–≥–Њ —Н—В–Њ—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –Њ–њ–Є—Б—Л–≤–∞–µ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–µ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Є–Ј–≤–µ—Б—В–љ–Њ–≥–Њ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–∞, –і–Њ—Ж–µ–љ—В–∞ –°–Я–±–Ь–Р–Я–Ю –У.–Т. –†–Њ–і–Ј–µ–≤–Є—З (2000): ¬Ђ–У–ї–∞—Г–Ї–Њ–Љ–∞ вАФ —Н—В–Њ —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–µ —Б—В–∞—А–µ–љ–Є–µ –≥–ї–∞–Ј–∞, –Њ–њ–µ—А–µ–ґ–∞—О—Й–µ–µ –≤–Њ–Ј—А–∞—Б—В¬ї!
–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є —А–∞–±–Њ—В–µ –Љ–Њ—А—Д–Њ–ї–Њ–≥–∞ –Э.–Ы. –Я—А–Є–≥–Њ–ґ–Є–љ–Њ–є [—Ж–Є—В. –њ–Њ 15, —Б. 57] ¬Ђ–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В —Б—З–Є—В–∞—В—М, —З—В–Њ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –і–Є—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –Є –∞—В—А–Њ—Д–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤, –≤–µ–і—Г—Й–Є—Е –Ї –Є—Б—З–µ–Ј–љ–Њ–≤–µ–љ–Є—О —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ–ї–Њ–Ї–Њ–љ –Є–Ј —Б—В—А–Њ–Љ—Л —Б–Ї–ї–µ—А—Л, –Ї –љ–∞—А–∞—Б—В–∞—О—Й–µ–Љ—Г —Б–Ї–ї–µ—А–Њ–Ј—Г –Є –Њ–ґ–Є—А–µ–љ–Є—О, —Б–Ї–ї–µ—А–∞ —В–µ—А—П–µ—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї —А–∞—Б—В—П–ґ–µ–љ–Є—О –Є –Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –њ—А–Є —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –≥–ї–∞–Ј–∞, –њ—А–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П—Е –Њ—В—В–Њ–Ї–∞ –Є –њ—А–Є—В–Њ–Ї–∞ –Ї—А–Њ–≤–Є –Є –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ—Л—Е –ґ–Є–і–Ї–Њ—Б—В–µ–є¬ї. –Ф–µ–є—Б—В–≤–Є—В–µ–ї—М–љ–Њ, –Љ–љ–Њ–≥–Њ–µ —Г–ґ–µ –±—Л–ї–Њ —Б–і–µ–ї–∞–љ–Њ –Є –і–Њ–Ї–∞–Ј–∞–љ–Њ –≤ –±–Њ–ї–µ–µ —А–∞–љ–љ–Є—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е –љ–∞—И–Є–Љ–Є —Г—З–Є—В–µ–ї—П–Љ–Є. –Э–∞–і–Њ –њ—А–Њ—Б—В–Њ —З–∞—Й–µ –≤–Њ–Ј–≤—А–∞—Й–∞—В—М—Б—П –Ї —Д—Г–љ–і–∞–Љ–µ–љ—В–∞–ї—М–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ, —З—В–Њ–±—Л –љ–∞–Ї–Њ–љ–µ—Ж-—В–Њ —Б—Г–Љ–µ—В—М ¬Ђ—Г–≤–Є–і–µ—В—М¬ї –Є –і—А—Г–≥–Є–µ –Є—Е –≥—А–∞–љ–Є –љ–∞ –љ–Њ–≤–Њ–Љ –≤–Є—В–Ї–µ –Њ–±–Њ–±—Й–µ–љ–Є–є [16].
–Ш—В–∞–Ї, –њ–µ—А–≤–Њ–µ –Ї–ї—О—З–µ–≤–Њ–µ –Ј–≤–µ–љ–Њ –≤ —А–∞–Ј–≤–Є—В–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ вАФ —Н—В–Њ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л –Є–Ј-–Ј–∞ —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–≥–Њ —Б—В–∞—А–µ–љ–Є—П, –њ—А–Є—З–µ–Љ —Н—В–Њ—В –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Ж–µ—Б—Б –љ–∞–±–ї—О–і–∞–µ—В—Б—П –≤ –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –≥–ї–∞–Ј–∞—Е –Њ–±—Л—З–љ–Њ –њ–Њ—Б–ї–µ 45 –ї–µ—В –Є –і–∞–ї–µ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –≤–Њ–Ј—А–∞—Б—В–∞ (—А<0,001) [13, 14]. –Ч–і–µ—Б—М —Б—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –ї—О–±–Њ–µ —А—Г–Ї–Њ—В–≤–Њ—А–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≤ –≥–ї–∞–Ј—Г –±—Г–і–µ—В —В–∞–Ї–ґ–µ –њ—А–Є–≤–Њ–і–Є—В—М –Ї –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–Љ—Г —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–Љ—Г —Б—В–∞—А–µ–љ–Є—О —Б–Ї–ї–µ—А—Л, —А–Њ—Б—В—Г –µ–µ —В–µ–Ї—Г—Й–µ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є –Ї –Њ—В–≤–µ—В–љ–Њ–Љ—Г —Б–Ї–∞—З–Ї—Г —Г—А–Њ–≤–љ—П –Т–У–Ф [7].
–Я–Њ—Н—В–Њ–Љ—Г –љ–∞—И–µ —З–∞—Б—В–Њ –љ–µ–Њ–њ—А–∞–≤–і–∞–љ–љ–Њ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ –Є–ї–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –і–ї—П —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Т–У–Ф –±—Г–і–µ—В –≤—Б–µ–≥–і–∞ –њ—А–Є–≤–Њ–і–Є—В—М –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О —В–µ–Ї—Г—Й–µ–≥–Њ –Њ–±—К–µ–Љ–∞ –≥–ї–∞–Ј–∞, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г —Б–Њ–Ї—А–∞—Й–µ–љ–Є—О –Њ–±—К–µ–Љ–∞ –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й–µ–є –≤ –њ–Њ–ї–Њ—Б—В–Є –≥–ї–∞–Ј–∞ —Б–≤–µ–ґ–µ–є –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є –Є –Ї –Њ—В–≤–µ—В–љ–Њ–Љ—Г —Г—Б–Ї–Њ—А–µ–љ–љ–Њ–Љ—Г —Б—В–∞—А–µ–љ–Є—О –§–Ю–У. –Ш –≤–∞–ґ–љ–Њ, —З—В–Њ —Н—В–Њ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –Є –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ –њ—А–Є–≤–µ–і–µ—В –Ї –Њ—З–µ—А–µ–і–љ—Л–Љ —Б–Ї–∞—З–Ї–∞–Љ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є –Т–У–Ф.
–Т—В–Њ—А–Њ–µ –Ї–ї—О—З–µ–≤–Њ–µ –Ј–≤–µ–љ–Њ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –Ю–£–У вАФ —Н—В–Њ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–∞—П —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –і–Є—Б–Ї–∞ –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –љ–µ—А–≤–∞ (–Ф–Ч–Э) –Ї —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є, –Ї–Њ—В–Њ—А–∞—П –њ—А–Є–≤–Њ–і–Є—В –Ї –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є (–њ–µ—А–µ–≥–Є–±—Г, —Б–ґ–∞—В–Є—О –Є —Б–Ї–Њ–ї—Г) –∞–Ї—Б–Њ–љ–Њ–≤ –≥–∞–љ–≥–ї–Є–Њ–Ј–љ—Л—Е –Ї–ї–µ—В–Њ–Ї. –Ш –Ј–і–µ—Б—М —Б—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ–Њ–≤—Л—И–µ–љ–љ–∞—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В—М –∞–Ї—Б–Њ–љ–Њ–≤ –Ї –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –≤ –Њ–±–ї–∞—Б—В–Є –Ф–Ч–Э –њ—А–Є—Б—Г—Й–∞ –Є–Љ–µ–љ–љ–Њ —З–µ–ї–Њ–≤–µ–Ї—Г, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –µ–≥–Њ –∞–Ї—Б–Њ–љ–∞—Е –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В –Љ–Є–µ–ї–Є–љ–Њ–≤–∞—П –Њ–±–Њ–ї–Њ—З–Ї–∞ –≤ –Љ–µ—Б—В–µ –Є—Е –њ–µ—А–µ—Е–Њ–і–∞ —Б–Ї–≤–Њ–Ј—М —Б—В—А—Г–Ї—В—Г—А—Л —А–µ—И–µ—В—З–∞—В–Њ–є –њ–ї–∞—Б—В–Є–љ–Ї–Є —Б–Ї–ї–µ—А—Л [10].
–Ф–µ—Д–Њ—А–Љ–∞—Ж–Є—П –∞–Ї—Б–Њ–љ–Њ–≤, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ—А–Є–≤–Њ–і–Є—В –љ–µ —В–Њ–ї—М–Ї–Њ –Ї —З–∞—Б—В–Є—З–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –∞–Ї—Б–Њ–љ–Њ-–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —В–Њ–Ї–∞, –љ–Њ –Є –Ї –≤–Њ–Ј—А–∞—Б—В–∞–љ–Є—О —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–њ—А–Њ—В–Є–≤–ї–µ–љ–Є—П –∞–Ї—Б–Њ–љ–Њ–≤ –≤ –Њ—З–∞–≥–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є. –Т–љ—Г—В—А–Є –≥–ї–∞–Ј–∞ –≤ –Љ–µ—Б—В–∞—Е –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –∞–Ї—Б–Њ–љ–Њ–≤ –њ–µ—А–µ–і —А–µ—И–µ—В—З–∞—В–Њ–є –Љ–µ–Љ–±—А–∞–љ–Њ–є —Б–Ї–ї–µ—А—Л –≤–Њ–Ј–љ–Є–Ї–∞–µ—В ¬Ђ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–∞—П –љ–µ–є—А–Њ–њ–∞—В–Є—П¬ї, –њ—А–Є –Ї–Њ—В–Њ—А–Њ–є –≤ –Ј—А–Є—В–µ–ї—М–љ—Л–µ —Г—З–∞—Б—В–Ї–Є –Ї–Њ—А—Л –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ—А–Є—Е–Њ–і–Є—В –Њ—В –Ї–Њ–ї–±–Њ—З–µ–Ї –Є –њ–∞–ї–Њ—З–µ–Ї –Њ—Б–ї–∞–±–ї–µ–љ–љ—Л–є —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї (—Б—В–∞—В–Є—З–µ—Б–Ї–Њ–µ —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–µ –љ–∞–њ—А—П–ґ–µ–љ–Є–µ). –Ш –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —В–∞–Ї–Њ–є —Б–Є–≥–љ–∞–ї –Љ–Њ–Ј–≥ –њ—А–Њ—Б—В–Њ –Є–≥–љ–Њ—А–Є—А—Г–µ—В –Ї–∞–Ї –Ј–∞–≤–µ–і–Њ–Љ–Њ —Б–ї–∞–±—Л–є, —В. –µ. –Њ—Б–ї–∞–±–ї–µ–љ–љ—Л–є –≤ –Љ–µ—Б—В–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –∞–Ї—Б–Њ–љ–∞ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л–є –љ–Њ—А–Љ–∞–ї—М–љ—Л–є —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–є –Є–Љ–њ—Г–ї—М—Б –Њ—В –Ї–Њ–ї–±–Њ—З–µ–Ї –Є –њ–∞–ї–Њ—З–µ–Ї –Љ–Њ–Ј–≥–Њ–Љ –љ–µ –≤–Њ—Б–њ—А–Є–љ–Є–Љ–∞–µ—В—Б—П. –°—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –Ј–і–µ—Б—М —А–µ—З—М –≤ –њ—А–Є–љ—Ж–Є–њ–µ –љ–µ –Є–і–µ—В –Њ –њ–∞—В–Њ–ї–Њ–≥–Є–Є –і—А—Г–≥–Є—Е —Б—В—А—Г–Ї—В—Г—А –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Є—З–Є–љ–∞ —Д–∞—В–∞–ї—М–љ–Њ–≥–Њ –Њ—Б–ї–∞–±–ї–µ–љ–Є—П —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–≥–љ–∞–ї–∞ –Њ—В –њ–∞–ї–Њ—З–µ–Ї –Є –Ї–Њ–ї–±–Њ—З–µ–Ї —А–∞—Б–њ–Њ–ї–∞–≥–∞–µ—В—Б—П –≤—Б–µ–≥–і–∞ —В–Њ–ї—М–Ї–Њ –≤ –Љ–µ—Б—В–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –∞–Ї—Б–Њ–љ–Њ–≤ –љ–∞ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –ґ–µ—Б—В–Ї–Њ–Љ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–Љ –њ–Њ—П—Б–Ї–µ. –Ш –Љ—Л —Е–Њ—А–Њ—И–Њ –Ј–љ–∞–µ–Љ –Њ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –њ–Њ–ї–љ–Њ–≥–Њ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—П –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П –њ—А–Є —Б–љ–Є–ґ–µ–љ–Є–Є –Т–У–Ф –≤ –≥–ї–∞–Ј–∞—Е —Б –љ–∞—З–∞–ї—М–љ–Њ–є –Ю–£–У [17]: —А–∞—Б–њ—А—П–Љ–Є–≤—И–Є–µ—Б—П –њ–Њ—Б–ї–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –∞–Ї—Б–Њ–љ—Л –љ–∞—З–Є–љ–∞—О—В –і–Њ—Б—В–∞–≤–ї—П—В—М –≤ –Љ–Њ–Ј–≥ —Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Є–є —Б–Є–≥–љ–∞–ї –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –љ–∞–њ—А—П–ґ–µ–љ–Є—П –≤ –≤–Њ–ї—М—В–∞—Е.
–°–µ–≥–Њ–і–љ—П —Б—В–∞–ї–Њ –њ–Њ–љ—П—В–љ–Њ, —З—В–Њ –Њ–і–љ–Є–Љ –Є–Ј –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ—Л—Е –њ—Г—В–µ–є –±–Њ—А—М–±—Л —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–Њ–Ј–і–∞–љ–Є–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –і–ї—П —Г–≤–µ–ї–Є—З–µ–љ–Є—П —Н–ї–µ–Ї—В—А–Њ–њ—А–Њ–≤–Њ–і–Є–Љ–Њ—Б—В–Є –∞–Ї—Б–Њ–љ–Њ–≤ –≤ –Љ–µ—Б—В–µ –Є—Е –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є.
–Ы—Г—З—И–µ –≤—Б–µ–≥–Њ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –њ—А–Њ—Ж–µ—Б—Б–∞ –Љ–µ—Б—В–љ–Њ–є –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –∞–Ї—Б–Њ–љ–Њ–≤ –љ–∞ –ґ–µ—Б—В–Ї–Њ–Љ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–Љ –Њ–±–Њ–і–Ї–µ –њ—А–Є –Є—Е –і–∞–ї—М–љ–µ–є—И–µ–Љ –Њ—Б–∞–ґ–Є–≤–∞–љ–Є–Є –Ї–Ј–∞–і–Є —Б–Њ–≤–Љ–µ—Б—В–љ–Њ —Б–Њ —Б—В—А—Г–Ї—В—Г—А–∞–Љ–Є —А–µ—И–µ—В—З–∞—В–Њ–є –њ–ї–∞—Б—В–Є–љ–Ї–Є —Б–Ї–ї–µ—А—Л –Љ–Њ–ґ–љ–Њ –љ–∞–і–µ–ґ–љ–Њ –Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Њ—В—Б–ї–µ–і–Є—В—М –њ–Њ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–Љ—Г –Є–Ј–Љ–µ–љ–µ–љ–Є—О –Њ–±—К–µ–Љ–∞ —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –Ф–Ч–Э –љ–∞ —В–Њ–Љ–Њ–≥—А–∞—Д–µ —В–Є–њ–∞ HRT-II. –І–µ–Љ –±–Њ–ї—М—И–µ –Њ–±—К–µ–Љ —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є, —В–µ–Љ –±–Њ–ї—М—И–µ –њ—А–Њ–≥–Є–±–∞–µ—В—Б—П —Ж–µ–ї–Є–Ї–Њ–Љ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –Ф–Ч–Э (–Њ—Б–∞–ґ–Є–≤–∞–µ—В—Б—П –Ї–Ј–∞–і–Є, –љ–∞–њ—А–Є–Љ–µ—А, –Ї–∞–Ї –њ–ї—Г–љ–ґ–µ—А –≤ —И–њ—А–Є—Ж–µ), –њ—А–Є—З–µ–Љ –љ–∞–Є–±–Њ–ї—М—И–∞—П –і–µ—Д–Њ—А–Љ–∞—Ж–Є—П –∞–Ї—Б–Њ–љ–Њ–≤ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –њ–Њ –Ї—А–∞—П–Љ –Ф–Ч–Э –њ—А–Є –њ–µ—А–µ–≥–Є–±–µ –љ–∞ –ґ–µ—Б—В–Ї–Њ–Љ –Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –Њ—Б—В—А–Њ–Љ —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–Љ –Њ–±–Њ–і–Ї–µ, —В. –µ. –Є–Љ–µ–љ–љ–Њ –љ–∞ –Ї—А–∞—П—Е —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ–±–Њ–і–Ї–∞ –≤–Њ–Ј–љ–Є–Ї–∞—О—В —Б–∞–Љ—Л–µ –±–Њ–ї—М—И–Є–µ –њ–Њ –≤–µ–ї–Є—З–Є–љ–µ –і–µ—Д–Њ—А–Љ–∞—Ж–Є–Є –∞–Ї—Б–Њ–љ–Њ–≤. –Ш –Є–Љ–µ–љ–љ–Њ –Њ–±–Њ–±—Й–µ–љ–љ—Л–є –њ–∞—А–∞–Љ–µ—В—А ¬Ђ–Њ–±—К–µ–Љ —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є¬ї –ї—Г—З—И–µ –≤—Б–µ–≥–Њ —Н—В–Њ –Њ—В—Б–ї–µ–ґ–Є–≤–∞–µ—В [18, 19]. –Ш–Ј —Б–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ —Б–ї–µ–і—Г–µ—В –≤–∞–ґ–љ—Л–є –≤—Л–≤–Њ–і: —З–µ–Љ –≤—Л—И–µ —В–µ–Ї—Г—Й–∞—П —А–Є–≥–Є–і–љ–Њ—Б—В—М (–ґ–µ—Б—В–Ї–Њ—Б—В—М) —Б–Ї–ї–µ—А—Л, —В–µ–Љ –±–Њ–ї–µ–µ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ–є –±—Г–і–µ—В –і–µ—Д–Њ—А–Љ–∞—Ж–Є—П –∞–Ї—Б–Њ–љ–Њ–≤ –≤ –Њ–±–ї–∞—Б—В–Є —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ–±–Њ–і–Ї–∞.
–°—В–Њ–Є—В —А–∞—Б—Б–Љ–Њ—В—А–µ—В—М —В–∞–Ї–ґ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–µ –Њ—И–Є–±–Њ—З–љ–Њ–µ –Љ–љ–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ —З–µ–Љ –≤—Л—И–µ —А–Є–≥–Є–і–љ–Њ—Б—В—М —Б–Ї–ї–µ—А—Л (–Є –≤—Е–Њ–і—П—Й–Є—Е –≤ –љ–µ–µ —Б—В—А—Г–Ї—В—Г—А –Ф–Ч–Э), —В–µ–Љ –±—Г–і–µ—В –Љ–µ–љ—М—И–µ —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є—П. –Р —З–µ–Љ –Љ–µ–љ—М—И–µ —А–Є–≥–Є–і–љ–Њ—Б—В—М (–ґ–µ—Б—В–Ї–Њ—Б—В—М) –Ф–Ч–Э, —В–µ–Љ —П–Ї–Њ–±—Л —Н—В–∞ —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї –њ—А–Њ–≥–Є–±—Г —Г –Ф–Ч–Э –≤–Њ–Ј—А–∞—Б—В–µ—В. –≠—В–Њ —Б—А–Њ–і–љ–Є –Љ–Є—Д—Г –Њ –≤–ї–Є—П–љ–Є–Є —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–∞ —Г—А–Њ–≤–µ–љ—М –Т–У–Ф.
–Х—Б–ї–Є —Б–Љ–Њ—В—А–µ—В—М –≤ –Ї–Њ—А–µ–љ—М, —В–Њ –Њ–±—К–µ–Љ —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –і–∞–ґ–µ —Г –Љ–Њ–ї–Њ–і–Њ–≥–Њ —Н–ї–∞—Б—В–Є—З–љ–Њ–≥–Њ –Ф–Ч–Э –±—Г–і–µ—В –Ј–∞–≤–Є—Б–µ—В—М –Њ—В –њ–µ—А–µ–њ–∞–і–∞ (–љ–µ –њ—Г—В–∞—В—М —Б –≥—А–∞–і–Є–µ–љ—В–Њ–Љ!) –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Т–І–Ф) –Є –Т–У–Ф. –°—В–Њ–Є—В –њ–Њ—П—Б–љ–Є—В—М –љ–∞ –њ—А–Є–Љ–µ—А–µ –Ї–ї—О—З–µ–≤–Њ–µ —А–∞–Ј–ї–Є—З–Є–µ —Н—В–Є—Е –і–≤—Г—Е —В–µ—А–Љ–Є–љ–Њ–≤, –Ї–Њ—В–Њ—А—Л–µ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –љ–µ –≤–њ–Њ–ї–љ–µ –Ї–Њ—А—А–µ–Ї—В–љ–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ. –Я–µ—А–µ–њ–∞–і –≤—Л—Б–Њ—В вАФ —Н—В–Њ —А–∞–Ј–љ–Є—Ж–∞ –≤ –≤—Л—Б–Њ—В–µ –і–≤—Г—Е –≥–Њ—А–љ—Л—Е –≤–µ—А—И–Є–љ –Є–ї–Є –і–≤—Г—Е —В–Њ—З–µ–Ї (–љ–∞—З–∞–ї—М–љ–Њ–є –Є –Ї–Њ–љ–µ—З–љ–Њ–є) –њ—А–Є —Б–њ—Г—Б–Ї–µ –∞–ї—М–њ–Є–љ–Є—Б—В–∞ —Б –≤–µ—А—И–Є–љ—Л. –Ґ–Њ –µ—Б—В—М –њ–µ—А–µ–њ–∞–і вАФ —Н—В–Њ –∞–±—Б–Њ–ї—О—В–љ–∞—П —А–∞–Ј–љ–Є—Ж–∞ –Ј–љ–∞—З–µ–љ–Є–є, –љ–∞–њ—А–Є–Љ–µ—А, —Г—А–Њ–≤–љ—П –Т–У–Ф –Є –Т–І–Ф –≤ –Љ–Љ —А—В. —Б—В. –Р –≥—А–∞–і–Є–µ–љ—В вАФ —Н—В–Њ —Б–Ї–Њ—А–Њ—Б—В—М –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Н—В–Њ–є –∞–±—Б–Њ–ї—О—В–љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л –Ј–љ–∞—З–µ–љ–Є–є, –љ–∞–њ—А–Є–Љ–µ—А, –њ–Њ —В–Њ–ї—Й–Є–љ–µ —А–µ—И–µ—В—З–∞—В–Њ–є –њ–ї–∞—Б—В–Є–љ–Ї–Є —Б–Ї–ї–µ—А—Л. –Я–Њ –∞–љ–∞–ї–Њ–≥–Є–Є —Б –≥–Њ—А–∞–Љ–Є вАФ —Н—В–Њ —Б–Ї–Њ—А–Њ—Б—В—М –њ–Њ—В–µ—А–Є –≤—Л—Б–Њ—В—Л –њ—А–Є —Б–њ—Г—Б–Ї–µ –∞–ї—М–њ–Є–љ–Є—Б—В–∞ —Б –≥–Њ—А—Л. –Ь–Њ–ґ–љ–Њ –±—Л—Б—В—А–Њ ¬Ђ–њ–Њ—В–µ—А—П—В—М –≤—Л—Б–Њ—В—Г¬ї вАФ –Љ–∞—Б—В–µ—А—Б–Ї–Є —Б–њ—Г—Б—В–Є—В—М—Б—П –њ–Њ –∞–ї—М–њ–Є–љ–Є—Б—В—Б–Ї–Њ–є –≤–µ—А–µ–≤–Ї–µ –≤–љ–Є–Ј –≤–і–Њ–ї—М –Њ—В–≤–µ—Б–љ–Њ–є —Б–Ї–∞–ї—Л, –∞ –Љ–Њ–ґ–љ–Њ –Љ–µ–і–ї–µ–љ–љ–Њ —Б–њ—Г—Б–Ї–∞—В—М—Б—П –њ–µ—И–Ї–Њ–Љ –њ–Њ –і–ї–Є–љ–љ–Њ–є –Њ–±–≤–Њ–і—П—Й–µ–є —В—А–Њ–њ–µ. –Э–∞ –њ—Г—В–Є –њ–Њ –Њ—В–≤–µ—Б–љ–Њ–є —Б–Ї–∞–ї–µ –±—Г–і–µ—В –≤—Л—Б–Њ–Ї–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≥—А–∞–і–Є–µ–љ—В–∞ –њ–Њ—В–µ—А–Є –≤—Л—Б–Њ—В—Л (–њ–Њ—В–µ—А–Є —А–∞–Ј–љ–Є—Ж—Л –≤—Л—Б–Њ—В), –∞ –љ–∞ –њ–Њ–ї–Њ–≥–Њ–є —В—А–Њ–њ–µ вАФ –љ–Є–Ј–Ї–Њ–µ, —Е–Њ—В—П –њ–µ—А–µ–њ–∞–і –≤—Л—Б–Њ—В –Є —В–∞–Љ, –Є —В–∞–Љ –±—Г–і–µ—В –Њ–і–Є–љ–∞–Ї–Њ–≤. –Э–Њ –і–ї—П —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –Ф–Ч–Э –≤–∞–ґ–µ–љ –љ–µ –≥—А–∞–і–Є–µ–љ—В, –∞ –њ–µ—А–µ–њ–∞–і —Г—А–Њ–≤–љ–µ–є –Т–У–Ф –Є –Т–І–Ф, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –∞–±—Б–Њ–ї—О—В–љ–Њ–є —А–∞–Ј–љ–Є—Ж–µ —Б–Є–ї, –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –љ–∞ –Ф–Ч–Э —Б –Њ–±–µ–Є—Е —Б—В–Њ—А–Њ–љ. –Ш –њ–Њ–љ—П—В–Є–µ ¬Ђ–≥—А–∞–і–Є–µ–љ—В¬ї —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ—Ж–µ–љ–Є—В—М —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є —Г –Ф–Ч–Э: –Љ—Л –Љ–Њ–ґ–µ–Љ –Є–Љ–µ—В—М –Љ–∞–ї—Л–є –њ–µ—А–µ–њ–∞–і –і–∞–≤–ї–µ–љ–Є–є —Б –Њ–≥—А–Њ–Љ–љ—Л–Љ –≥—А–∞–і–Є–µ–љ—В–Њ–Љ, –∞ –Љ–Њ–ґ–µ–Љ –Є–Љ–µ—В—М –±–Њ–ї—М—И–Њ–є –њ–µ—А–µ–њ–∞–і –і–∞–≤–ї–µ–љ–Є–є, –љ–Њ —Б –Љ–Є–Ј–µ—А–љ—Л–Љ –≥—А–∞–і–Є–µ–љ—В–Њ–Љ!
–Ш —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –Љ–µ—Е–∞–љ–Є–Ї–Є –љ–∞–Љ –≤–∞–ґ–љ–Њ –њ–Њ–љ–Є–Љ–∞—В—М, —З—В–Њ –Є–Ј–љ—Г—В—А–Є —Б–Њ —Б—В–Њ—А–Њ–љ—Л –њ–Њ–ї–Њ—Б—В–Є –≥–ї–∞–Ј–∞ –љ–∞ –њ–ї–Њ—Й–∞–і—М –Ф–Ч–Э –і–µ–є—Б—В–≤—Г–µ—В –Т–У–Ф –њ–ї—О—Б —В–µ–Ї—Г—Й–µ–µ –∞–Ї–Ї–Њ–Љ–Њ–і–∞—Ж–Є–Њ–љ–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ –≤ —Б—В–µ–Ї–ї–Њ–≤–Є–і–љ–Њ–є –Ї–∞–Љ–µ—А–µ (–Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ –њ—А–Є –≤–Ј–≥–ї—П–і–µ –≤–і–∞–ї—М, –њ–Њ—З–µ–Љ—Г вАФ –њ–Њ—П—Б–љ–Є–Љ —З—Г—В—М –њ–Њ–Ј–ґ–µ), –∞ —Б–Њ —Б—В–Њ—А–Њ–љ—Л —З–µ—А–µ–њ–∞ вАФ –Т–І–Ф. –Ш –љ–∞–Љ –≤–∞–ґ–љ–Њ –Ј–љ–∞—В—М –Є–Љ–µ–љ–љ–Њ –∞–±—Б–Њ–ї—О—В–љ—Г—О —А–∞–Ј–љ–Є—Ж—Г –≤ –≤–µ–ї–Є—З–Є–љ–µ —Н—В–Є—Е —Б–Є–ї (—В. –µ. –њ–µ—А–µ–њ–∞–і –і–∞–≤–ї–µ–љ–Є–є), –њ–Њ—В–Њ–Љ—Г —З—В–Њ –Є–Љ–µ–љ–љ–Њ –Њ—В —Н—В–Њ–≥–Њ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є –Ј–∞–≤–Є—Б–Є—В –≤–µ–ї–Є—З–Є–љ–∞ —Б–Љ–µ—Й–µ–љ–Є—П, —В. –µ. —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –Ф–Ч–Э. –Я—А–Є—З–µ–Љ –Ї–∞–Ї –±—Л—Б—В—А–Њ –Є–Ј–Љ–µ–љ—П–µ—В—Б—П —Н—В–∞ —А–∞–Ј–љ–Є—Ж–∞ –і–∞–≤–ї–µ–љ–Є–є –њ–Њ —В–Њ–ї—Й–Є–љ–µ —А–µ—И–µ—В—З–∞—В–Њ–є –њ–ї–∞—Б—В–Є–љ–Ї–Є —Б–Ї–ї–µ—А—Л –і–ї—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П —Б–Ї–ї–Њ–љ–љ–Њ—Б—В–Є –Ф–Ч–Э –Ї —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є, —Г–ґ–µ –љ–µ —В–∞–Ї –≤–∞–ґ–љ–Њ. –Я–Њ—Н—В–Њ–Љ—Г –≤—Л—А–∞–ґ–µ–љ–Є–µ ¬Ђ–≥—А–∞–і–Є–µ–љ—В –Т–У–Ф/–Т–І–Ф¬ї —Б –љ–∞—Г—З–љ–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П —Б—В–Њ–Є—В –њ—А–Є–Љ–µ–љ—П—В—М —В–Њ–ї—М–Ї–Њ –Ї–Њ—А—А–µ–Ї—В–љ–Њ, –љ–∞–њ—А–Є–Љ–µ—А, –і–ї—П –Њ–њ–Є—Б–∞–љ–Є—П —Б–Ї–Њ—А–Њ—Б—В–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –і–∞–≤–ї–µ–љ–Є—П –њ–Њ —В–Њ–ї—Й–Є–љ–µ –Ф–Ч–Э, –∞ –≤ –Њ–±—Й–µ–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –і–ї—П –Њ–њ–Є—Б–∞–љ–Є—П –њ—А–µ–і—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ–Њ—Б—В–Є –Ї —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є —Г –Ф–Ч–Э –≤—Б–µ–≥–і–∞ —Б–ї–µ–і—Г–µ—В —Г–њ–Њ—В—А–µ–±–ї—П—В—М —В–Њ–ї—М–Ї–Њ –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ –≥—А–∞–Љ–Њ—В–љ—Л–є —В–µ—А–Љ–Є–љ вАФ ¬Ђ–њ–µ—А–µ–њ–∞–і –і–∞–≤–ї–µ–љ–Є–є¬ї. –Т–µ–і—М, –Ї–∞–Ї –≥–Њ–≤–Њ—А–Є–ї–Є –≤ –і—А–µ–≤–љ–Њ—Б—В–Є –Ї–Є—В–∞–є—Ж—Л, вАФ ¬Ђ–µ—Б–ї–Є –Љ—Л –њ—А–∞–≤–Є–ї—М–љ–Њ –љ–∞–Ј—Л–≤–∞–µ–Љ, –Ј–љ–∞—З–Є—В, –Љ—Л –њ—А–∞–≤–Є–ї—М–љ–Њ –њ–Њ–љ–Є–Љ–∞–µ–Љ¬ї!
–Ю–і–љ–∞–Ї–Њ –і–∞–ґ–µ –њ—А–Є –≤—Л—Б–Њ–Ї–Њ–є –ґ–µ—Б—В–Ї–Њ—Б—В–Є —А–µ—И–µ—В—З–∞—В–Њ–є –њ–ї–∞—Б—В–Є–љ–Ї–Є —Б–Ї–ї–µ—А—Л –Ф–Ч–Э –µ–µ —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ї —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –Љ–Њ–ґ–µ—В –±—Л—В—М —В–∞–Ї–ґ–µ –≤—Л—Б–Њ–Ї–Њ–є. –Т—Б–њ–Њ–Љ–љ–Є–Љ –ґ–µ—Б—В—П–љ—Г—О –Ї—А—Л—И–Ї—Г –Ї–Њ–љ—Б–µ—А–≤–љ–Њ–є –±–∞–љ–Ї–Є, –Ї–Њ–≥–і–∞ –і–∞–ґ–µ –Њ—В –ї–µ–≥–Ї–Њ–≥–Њ –љ–∞–ґ–∞—В–Є—П —Б–≤–µ—А—Е—Г –њ–∞–ї—М—Ж–µ–Љ –Њ–љ–∞ ¬Ђ–њ—А–Њ—Й–µ–ї–Ї–Є–≤–∞–µ—В—Б—П¬ї –≤–љ—Г—В—А—М. –Т –Љ–µ—Е–∞–љ–Є–Ї–µ —Н—В–Њ —П–≤–ї–µ–љ–Є–µ –љ–∞–Ј—Л–≤–∞–µ—В—Б—П ¬Ђ–њ–Њ—В–µ—А—П —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В–Є¬ї. –Ш–Љ–µ–љ–љ–Њ —В–∞–Ї –≤—Л–≤–Њ—А–∞—З–Є–≤–∞–µ—В—Б—П –Ј–Њ–љ—В–Є–Ї –љ–∞–Є–Ј–љ–∞–љ–Ї—Г –њ—А–Є —Б–Є–ї—М–љ–Њ–Љ –њ–Њ—А—Л–≤–µ –≤–µ—В—А–∞ вАФ —В–µ—А—П–µ—В —Г—Б—В–Њ–є—З–Є–≤–Њ—Б—В—М.
–Ь—Л –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞—В—М —Б–Ї–ї–Њ–љ–љ–Њ—Б—В—М –Ф–Ч–Э –Ї –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–Љ—Г –њ—А–Њ–≥–Є–±—Г (–њ—А–Њ—Й–µ–ї–Ї–Є–≤–∞–љ–Є—О) —Б –њ–Њ–Љ–Њ—Й—М—О –і–≤—Г—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е –Є–Ј–Љ–µ—А–µ–љ–Є–є —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –љ–∞ HRT-II вАФ —Б–љ–∞—З–∞–ї–∞ –±–µ–Ј –Љ–Є–і—А–Є–∞—В–Є–Ї–∞, –∞ –њ–Њ—В–Њ–Љ вАФ —Б –Љ–Є–і—А–Є–∞—В–Є–Ї–Њ–Љ [18, 19]. –Я–Њ—П—Б–љ–Є–Љ —Н—В–Њ. –Я—А–Є —А–∞—Б—Б–ї–∞–±–ї–µ–љ–Є–Є —А–µ—Б–љ–Є—З–љ–Њ–є –Љ—Л—И—Ж—Л –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –љ–∞—В—П–≥–Є–≤–∞—О—В—Б—П –њ–µ—А–µ–і–љ—П—П –Є –Ј–∞–і–љ—П—П –њ–Њ—А—Ж–Є–Є –≤–Њ–ї–Њ–Ї–Њ–љ —А–µ—Б–љ–Є—З–љ–Њ–≥–Њ –њ–Њ—П—Б–Ї–∞, –Є–Ј-–Ј–∞ —З–µ–≥–Њ —Е—А—Г—Б—В–∞–ї–Є–Ї –Њ—Б–∞–ґ–Є–≤–∞–µ—В—Б—П –Ї–Ј–∞–і–Є –Є –≤–ґ–Є–Љ–∞–µ—В—Б—П –≤ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М —Б—В–µ–Ї–ї–Њ–≤–Є–і–љ–Њ–є –Ї–∞–Љ–µ—А—Л (–°–Ъ) [20]. –Я—А–Є —Н—В–Њ–Љ –і–∞–≤–ї–µ–љ–Є–µ –≤ –°–Ъ –ї–Њ–Ї–∞–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –љ–∞ —Д–Њ–љ–µ –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ–≥–Њ —В–µ–Ї—Г—Й–µ–≥–Њ –Т–У–Ф. –Э–∞ –њ—А–∞–Ї—В–Є–Ї–µ —Н—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –Ф–Ч–Э –љ–∞ 45вАУ65% –њ—А–Є–Љ–µ—А–љ–Њ —Г 8% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–£–У, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–Є–Њ–њ–Є–µ–є [19]. –Э–∞–ї–Є—Ж–Њ –≤—Л—Б–Њ–Ї–∞—П –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В—М –Ф–Ч–Э, —З—В–Њ —В—А–µ–±—Г–µ—В –љ–µ–Ј–∞–Љ–µ–і–ї–Є—В–µ–ї—М–љ—Л—Е –і–µ–є—Б—В–≤–Є–є –≤—А–∞—З–∞. –Ш—В–∞–Ї, –≤—В–Њ—А–Њ–µ –Ї–ї—О—З–µ–≤–Њ–µ –Ј–≤–µ–љ–Њ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л вАФ —Н—В–Њ —Б—В–∞—В–Є—З–µ—Б–Ї–∞—П –Є –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–∞—П –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В—М –Ф–Ч–Э.
–¶–µ–ї—М—О —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Т–У–Ф –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є –≥–ї–∞–Ј–∞ –≤ —Б–Є—Б—В–µ–Љ–µ –њ—А–Є—В–Њ–Ї–∞/–Њ—В—В–Њ–Ї–∞ –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞, –∞ –љ–Є–ґ–љ–Є–є —Г—А–Њ–≤–µ–љ—М —Ж–µ–ї–µ–≤–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –≤ –њ—А–Є–љ—Ж–Є–њ–µ –љ–µ –і–Њ–ї–ґ–µ–љ –њ—А–Є–≤–Њ–і–Є—В—М –Ї –≥–Є–њ–Њ—В–Њ–љ–Є–Є. –Ю–і–љ–∞–Ї–Њ –љ–∞–і–µ–ґ–љ—Л–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –Ї—А–Є—В–µ—А–Є–Є –і–ї—П –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ–≥–Њ —А–∞—Б—З–µ—В–∞ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–≥–Њ —Ж–µ–ї–µ–≤–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –љ–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –і–µ–љ—М —В–∞–Ї –Є –љ–µ —А–∞–Ј—А–∞–±–Њ—В–∞–љ—Л. –Ш –≤–Њ–Њ–±—Й–µ, –Ї—А–Є—В–µ—А–Є–є ¬Ђ—Г—А–Њ–≤–µ–љ—М –Т–У–Ф¬ї –≤ –њ—А–Є–љ—Ж–Є–њ–µ –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≥—А–∞–Љ–Њ—В–љ–Њ —А–µ—И–Є—В—М –Ј–∞–і–∞—З—Г –≤—Л–±–Њ—А–∞ —Ж–µ–ї–µ–≤–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П [3, 6]. –Т —А–µ–Ј—Г–ї—М—В–∞—В–µ —А—П–і –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –≤ —А–∞–Ј–љ—Л—Е —Б—В—А–∞–љ–∞—Е –њ—А–µ–і–њ–Є—Б—Л–≤–∞–µ—В –њ—А–Є –Ю–£–У –ї—О–±—Л—Е —Б—В–∞–і–Є–є –Ј–љ–∞—З–Є–Љ–Њ —Б–љ–Є–ґ–∞—В—М —В–µ–Ї—Г—Й–Є–є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф —Б—А–∞–Ј—Г –љ–∞ 30% –Є –±–Њ–ї–µ–µ, –±–µ–Ј —Г—З–µ—В–∞ –і—А—Г–≥–Є—Е –њ–µ—А–≤–Њ–Њ—З–µ—А–µ–і–љ—Л—Е —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –і–∞–љ–љ–Њ–≥–Њ –≥–ї–∞–Ј–∞, –Є –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М вАФ –µ–≥–Њ –њ—А–Є–љ–∞–і–ї–µ–ґ–љ–Њ—Б—В–Є –Ї –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є –Ј–Њ–љ–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У, —В. –µ. –Ї –Ј–Њ–љ–µ –љ–Є–Ј–Ї–Њ–≥–Њ –Т–У–Ф (–і–Њ 13 –Љ–Љ —А—В. —Б—В.); –Ј–Њ–љ–µ —Б—А–µ–і–љ–µ–≥–Њ –Т–У–Ф (14вАУ20 –Љ–Љ —А—В. —Б—В.); –Ј–Њ–љ–µ –њ–Њ–≤—Л—И–µ–љ–љ–Њ–≥–Њ –Т–У–Ф (21вАУ26 –Љ–Љ —А—В. —Б—В); –Ј–Њ–љ–µ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Т–У–Ф (27вАУ32 –Љ–Љ —А—В. —Б—В.); –Ј–Њ–љ–µ —Б—Г–±–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Т–У–Ф (33вАУ39 –Љ–Љ —А—В. —Б—В.) –Є –Ј–Њ–љ–µ –љ–µ–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є–Є –Т–У–Ф (вЙ•40 –Љ–Љ —А—В. —Б—В.) [6, 21].
–Ґ–µ–њ–µ—А—М, –њ–Њ—Б–ї–µ —Б–≤–Њ–µ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П –≤ –њ—А–Њ–±–ї–µ–Љ—Г –Ю–£–У, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –±—Г–і—Г—В –±–Њ–ї–µ–µ –њ–Њ–љ—П—В–љ—Л –љ–∞—И–Є –Ј–∞–Љ–µ—З–∞–љ–Є—П, –Ї–∞—Б–∞—О—Й–Є–µ—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В–Є –љ–∞—Г—З–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≤ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–µ. –Т–µ–і—М –љ–∞ —А–∞–Ј–±–Њ—А–µ –Њ—И–Є–±–Њ–Ї –Љ—Л –≤—Б–µ —Г—З–Є–Љ—Б—П! –Я–Њ–є–і–µ–Љ –њ–Њ –њ–Њ—А—П–і–Ї—Г –Є–Ј–ї–Њ–ґ–µ–љ–Є—П —В–µ–Ї—Б—В–∞.
–Т —Ж–µ–ї–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –∞–≤—В–Њ—А—Л —Г–Ї–∞–Ј—Л–≤–∞—О—В, —З—В–Њ –Њ–љ–Є —Е–Њ—В–µ–ї–Є –Є–Ј–Љ–µ—А—П—В—М –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї—Г—О –њ–ї–Њ—В–љ–Њ—Б—В—М (–∞–≤—В–Њ—А—Л —Б—З–Є—В–∞—О—В, —З—В–Њ —Н—В–Њ —П–Ї–Њ–±—Л –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б–і–µ–ї–∞—В—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В–Є —А–Њ–≥–Њ–≤–Є—Ж—Л) –Є –ґ–µ—Б—В–Ї–Њ—Б—В—М (—А–Є–≥–Є–і–љ–Њ—Б—В—М) –Ј–і–Њ—А–Њ–≤–Њ–≥–Њ –Є –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –≥–ї–∞–Ј–∞. –Я–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В–Є (–≤ –Љ–µ–і–Є—Ж–Є–љ–µ —Н—В–Њ –≤–µ–ї–Є—З–Є–љ–∞, –Њ–±—А–∞—В–љ–∞—П —А–Є–≥–Є–і–љ–Њ—Б—В–Є: El = 1 / Ri), –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —З–µ—А–µ–Ј –њ—А—П–Љ–Њ–µ –Є–ї–Є –Ї–Њ—Б–≤–µ–љ–љ–Њ–µ –Є–Ј–Љ–µ—А–µ–љ–Є–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є Ri. –Я—А–Є—З–µ–Љ –∞–≤—В–Њ—А—Л —П–≤–љ–Њ –љ–µ –њ–Њ–љ–Є–Љ–∞—О—В —В–Њ–≥–Њ, —З—В–Њ, –љ–∞–њ—А–Є–Љ–µ—А, –ї—О–±–Њ–µ —Б–Љ–µ—Й–µ–љ–Є–µ –љ–µ—Б–ґ–Є–Љ–∞–µ–Љ–Њ–є –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є –Є–Ј-–њ–Њ–і —А–Њ–≥–Њ–≤–Є—Ж—Л –≤–љ—Г—В—А—М –≥–ї–∞–Ј–∞ –љ–µ–Љ–Є–љ—Г–µ–Љ–Њ –Є –Љ–≥–љ–Њ–≤–µ–љ–љ–Њ –њ—А–Є–≤–µ–і–µ—В –Ї –Њ—В–≤–µ—В–љ–Њ–Љ—Г —А–∞—Б—И–Є—А–µ–љ–Є—О –§–Ю–У –Є —А–∞—Б—В—П–≥–Є–≤–∞–љ–Є—О –µ–µ –≤–Њ–Ј–≤—А–∞—В–љ–Њ-—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А (–≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —В–∞–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Н—В–Є ¬Ђ–±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ—А—Г–ґ–Є–љ—Л¬ї –±—Г–і—Г—В —А–∞—Б—В—П–љ—Г—В—Л). –Я–Њ—Н—В–Њ–Љ—Г —Б–∞–Љ–Њ –њ–Њ —Б–µ–±–µ –Є–Ј–Љ–µ—А–µ–љ–Є–µ –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ —А–Њ–≥–Њ–≤–Є—Ж—Л –±–µ–Ј —Г—З–µ—В–∞ –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ —Б–Ї–ї–µ—А—Л, –і–∞ –µ—Й–µ –Є –њ—А–Є –Њ–≥—А–∞–љ–Є—З–µ–љ–љ–Њ–Љ (–љ–µ –±–µ—Б–Ї–Њ–љ–µ—З–љ–Њ–Љ) –Њ–±—К–µ–Љ–µ –≥–ї–∞–Ј–∞, —П–≤–ї—П–µ—В—Б—П —Б–µ—А—М–µ–Ј–љ–Њ–є —Б–Є—Б—В–µ–Љ–љ–Њ–є –Њ—И–Є–±–Ї–Њ–є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–∞—А—Г—И–∞–µ—В –Њ—Б–љ–Њ–≤–љ—Л–µ –Ј–∞–Ї–Њ–љ—Л –Љ–µ—Е–∞–љ–Є–Ї–Є. –Ш —В–∞–Ї–Є—Е, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –Њ—И–Є–±–Њ—З–љ—Л—Е —Б—В–∞—В–µ–є –≤ –Љ–Є—А–µ вАФ —Б–Њ—В–љ–Є! –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —Б—Г–і—П –њ–Њ –≤—Б–µ–Љ—Г, –∞–≤—В–Њ—А—Л –њ—Г—В–∞—О—В —Н–ї–∞—Б—В–Є—З–љ–Њ—Б—В—М (–Ї–∞–Ї –њ–∞—А–∞–Љ–µ—В—А, –Њ–±—А–∞—В–љ—Л–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є) —Б–Њ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О —Б–Ї–ї–µ—А—Л (–љ–µ —А–Њ–≥–Њ–≤–Є—Ж—Л!) –Ї –Њ–±—А–∞—В–Є–Љ–Њ–Љ—Г —Г–њ—А—Г–≥–Њ–Љ—Г —А–∞—Б—В—П–ґ–µ–љ–Є—О (–∞–љ–∞–ї–Њ–≥ вАФ –њ—А—Г–ґ–Є–љ–∞ —Б –Ј–∞–њ–∞–Ј–і—Л–≤–∞–љ–Є–µ–Љ). –Т –Љ–µ—Е–∞–љ–Є–Ї–µ —Н—В–Њ –Є–љ–Њ–≥–і–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —В–µ—А–Љ–Є–љ–Њ–Љ ¬Ђ–њ–Њ–і–∞—В–ї–Є–≤–Њ—Б—В—М¬ї. –•–Њ—А–Њ—И–Є–є –њ—А–Є–Љ–µ—А вАФ –љ–∞—А—Г–ґ–љ–∞—П –њ—А—Г–ґ–Є–љ–∞ —Б –і–Њ–≤–Њ–і—З–Є–Ї–Њ–Љ –љ–∞ –і–≤–µ—А–Є, –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—Й–∞—П –µ–µ –Љ–µ–і–ї–µ–љ–љ–Њ–µ, –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ–µ –Ј–∞–Ї—А—Л—В–Є–µ –≤ –Ї–Њ–љ—Ж–µ –њ—А–Њ—Ж–µ—Б—Б–∞. –Ш–Љ–µ–љ–љ–Њ —В–∞–Ї —А–∞–±–Њ—В–∞—О—В —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ —Б—В—А—Г–Ї—В—Г—А—Л –≥–ї–∞–Ј–∞: —Д–∞–Ј–∞ –±—Л—Б—В—А–Њ–≥–Њ ¬Ђ–љ–∞—З–∞–ї–∞ –Ј–∞–Ї—А—Л—В–Є—П –і–≤–µ—А–Є¬ї вАФ —Н—В–Њ —А–∞–±–Њ—В–∞ –≤—Л—Б–Њ–Ї–Њ—А–Є–≥–Є–і–љ–Њ–≥–Њ –љ–∞—А—Г–ґ–љ–Њ–≥–Њ —Б–ї–Њ—П —Б–Ї–ї–µ—А—Л, –љ–µ –Є–Љ–µ—О—Й–µ–≥–Њ –≤—П–Ј–Ї–Њ-—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А, –∞ —Д–∞–Ј–∞ –Љ–µ–і–ї–µ–љ–љ–Њ–≥–Њ ¬Ђ–і–Њ–Ј–∞–Ї—А—Л—В–Є—П –і–≤–µ—А–Є¬ї вАФ —Н—В–Њ —Г–ґ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–∞—П —А–∞–±–Њ—В–∞ —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А –≤ –і–≤—Г—Е –≤–љ—Г—В—А–µ–љ–љ–Є—Е —Б–ї–Њ—П—Е —Б–Ї–ї–µ—А—Л –њ–Њ –≤—Л–і–∞–≤–ї–Є–≤–∞–љ–Є—О –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є –Њ–±—А–∞—В–љ–Њ –њ–Њ–і —А–Њ–≥–Њ–≤–Є—Ж—Г –≤ –Ї–Њ–љ—Ж–µ, –љ–∞–њ—А–Є–Љ–µ—А, –њ–љ–µ–≤–Љ–Њ–≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П (–Є–ї–Є, –Ї–∞–Ї —Г –∞–≤—В–Њ—А–Њ–≤ —Б—В–∞—В—М–Є, –њ—М–µ–Ј–Њ—Н–ї–µ–Ї—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–Ј–ї—Г—З–∞—В–µ–ї—П, —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –љ–∞ —Б–Ї–ї–µ—А–µ –Є–ї–Є —А–Њ–≥–Њ–≤–Є—Ж–µ).
–Э–∞—И–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ —Б–Ї–ї–µ—А–∞ (–Ї–∞–Ї –Є —Б—В–µ–љ–Ї–∞ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ–Њ–≥–Њ —Б–Њ—Б—Г–і–∞) —Б–Њ—Б—В–Њ–Є—В –Є–Ј —В—А–µ—Е —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —Б–ї–Њ–µ–≤, –Ї–Њ–≥–і–∞ –≤ –љ–∞—А—Г–ґ–љ–Њ–Љ —В–Њ–љ–Ї–Њ–Љ —Б–ї–Њ–µ —Б–Ї–ї–µ—А—Л –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ—В—Б—Г—В—Б—В–≤—Г—О—В —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ–ї–Њ–Ї–љ–∞. –Ґ–Њ –µ—Б—В—М –љ–∞—А—Г–ґ–љ—Л–є —Б–ї–Њ–є —Б–Ї–ї–µ—А—Л (–Ї—Б—В–∞—В–Є, —Б–∞–Љ—Л–є —А–Є–≥–Є–і–љ—Л–є!) –≤–µ–і–µ—В —Б–µ–±—П –њ—А–Є ¬Ђ—А–∞—Б—В—П–ґ–µ–љ–Є–Є вАФ —Б–ґ–∞—В–Є–Є¬ї –Ї–∞–Ї —Г–њ—А—Г–≥–∞—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ—А—Г–ґ–Є–љ–∞, –љ–Њ –љ–µ –Ї–∞–Ї –њ–Њ–ї–љ–Њ—Б—В—М—О —Н–ї–∞—Б—В–Є—З–љ–∞—П —Б—В—А—Г–Ї—В—Г—А–∞ ¬Ђ—Б –Ј–∞–њ–∞–Ј–і—Л–≤–∞–љ–Є–µ–Љ¬ї. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є —Н—В–Њ ¬Ђ—Б–Є–ї–Њ–≤–∞—П —Б–Ї–Њ—А–ї—Г–њ–∞ –≥–ї–∞–Ј–∞¬ї, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л–і–µ—А–ґ–Є–≤–∞—В—М –і–∞–ґ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ —Г–і–∞—А–љ—Л–µ –љ–∞–≥—А—Г–Ј–Ї–Є, –Њ–і–љ–∞–Ї–Њ –і–Є–∞–њ–∞–Ј–Њ–љ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–≥–Њ ¬Ђ—А–∞—Б—В—П–ґ–µ–љ–Є—П вАФ —Б–ґ–∞—В–Є—П¬ї –љ–∞—А—Г–ґ–љ–Њ–≥–Њ —Б–ї–Њ—П –§–Ю–У –≤ –љ–Њ—А–Љ–µ –і–∞–ґ–µ –≤ –Љ–Њ–ї–Њ–і–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –і–Њ–≤–Њ–ї—М–љ–Њ –Њ–≥—А–∞–љ–Є—З–µ–љ.
–Т–∞–ґ–љ–Њ–µ –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–µ –Њ—В–ї–Є—З–Є–µ —Б–Ї–ї–µ—А—Л –Њ—В —А–Њ–≥–Њ–≤–Є—Ж—Л –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ —Б–Ї–ї–µ—А–∞ —Б–њ–Њ—Б–Њ–±–љ–∞ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ –Љ–≥–љ–Њ–≤–µ–љ–љ–Њ —А–∞—Б—В—П–≥–Є–≤–∞—В—М—Б—П –≤ –Љ–Њ–Љ–µ–љ—В—Л –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є—П –≤ –≥–ї–∞–Ј—Г –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л –Є –Ј–∞—В–µ–Љ –≤–Њ–Ј–≤—А–∞—Й–∞—В—М—Б—П –≤ –Є—Б—Е–Њ–і–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ ¬Ђ—Б –Ј–∞–њ–∞–Ј–і—Л–≤–∞–љ–Є–µ–Љ¬ї –Ј–∞ —Б—З–µ—В —А–∞–±–Њ—В—Л —Б–≤–Њ–Є—Е –≤—П–Ј–Ї–Њ-—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А. –Ю–і–љ–∞–Ї–Њ, –Ї–∞–Ї –Љ—Л –≤—Б–µ —Е–Њ—А–Њ—И–Њ –Ј–љ–∞–µ–Љ, –≥–µ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –њ–∞—А–∞–Љ–µ—В—А—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –њ—А–Є –њ—А–Њ—Е–Њ–ґ–і–µ–љ–Є–Є –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л –≤ —Б–Є—Б—В–Њ–ї—Г-–і–Є–∞—Б—В–Њ–ї—Г –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–µ –Є–Ј–Љ–µ–љ—П—О—В—Б—П. –Ю—В—Б—Г—В—Б—В–≤–Є–µ –≤ —А–Њ–≥–Њ–≤–Є—Ж–µ –≤—П–Ј–Ї–Њ-—Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А –њ–Њ–Ј–≤–Њ–ї—П–µ—В –µ–є —Б–Њ—Е—А–∞–љ—П—В—М —Б–≤–Њ–Є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є–µ —А–∞–Ј–Љ–µ—А—Л –Є –Њ–њ—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ–Є, –±—Л—В—М –њ—А–Њ–Ј—А–∞—З–љ–Њ–є –Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –ґ–µ—Б—В–Ї–Њ–є, –Љ–∞–ї–Њ—А–∞—Б—В—П–ґ–Є–Љ–Њ–є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —А–∞—Б—Б–µ–Є–≤–∞—О—Й–µ–є –ї–Є–љ–Ј–Њ–є, —З—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–ї—П –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј—А–µ–љ–Є—П –Є, –≤ –Ї–Њ–љ—Ж–µ –Ї–Њ–љ—Ж–Њ–≤, –і–ї—П –≤—Л–ґ–Є–≤–∞–љ–Є—П –≤–Є–і–∞ [10].
–°—А–µ–і–љ–Є–є –Є –≤–љ—Г—В—А–µ–љ–љ–Є–є —Б–ї–Њ–Є —Б–Ї–ї–µ—А—Л, –љ–∞–Њ–±–Њ—А–Њ—В, –±—Г–Ї–≤–∞–ї—М–љ–Њ –њ—А–Њ–љ–Є–Ј–∞–љ—Л —Д–Є–±—А–Њ–±–ї–∞—Б—В–∞–Љ–Є –Є –і—А—Г–≥–Є–Љ–Є —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є —Б—В—А—Г–Ї—В—Г—А–∞–Љ–Є –Є –≤–Њ–ї–Њ–Ї–љ–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–±—А–∞–љ—Л –≤ –њ–ї–∞—Б—В–Є–љ—Л. –≠—В–Є —Б–ї–Њ–Є –њ–ї–∞—Б—В–Є–љ –≤–µ–і—Г—В —Б–µ–±—П –Ї–∞–Ї –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –њ—А—Г–ґ–Є–љ–∞ ¬Ђ—Б —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Ј–∞–њ–∞–Ј–і—Л–≤–∞–љ–Є–µ–Љ¬ї, —З—В–Њ –њ—А–Є –Є—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–Є –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ, –љ–Њ –љ–µ –Љ–≥–љ–Њ–≤–µ–љ–љ–Њ, –∞ –Є–Љ–µ–љ–љ–Њ –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –≤—Л—В–∞–ї–Ї–Є–≤–∞—В—М –љ–∞—А—Г–ґ—Г (–і—А–µ–љ–Є—А–Њ–≤–∞—В—М) –≤–Њ–і—П–љ–Є—Б—В—Г—О –≤–ї–∞–≥—Г, –∞ —В–∞–Ї–ґ–µ –і–µ–Љ–њ—Д–Є—А–Њ–≤–∞—В—М –њ—Г–ї—М—Б–Њ–≤—Г—О –≤–Њ–ї–љ—Г, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й—Г—О –Є–Ј-–Ј–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—К–µ–Љ–∞ –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤ –≤ –≥–ї–∞–Ј—Г –≤–Њ –≤—А–µ–Љ—П —Б–Є—Б—В–Њ–ї—Л-–і–Є–∞—Б—В–Њ–ї—Л [10, 21].
–Я—А–Є –Т–Ю–У –Њ–±—Й–Є–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –і–Є–∞–њ–∞–Ј–Њ–љ ¬Ђ–і—Л—Е–∞–љ–Є—П —Б–Ї–ї–µ—А—Л¬ї –≤ –љ–Њ—А–Љ–µ –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П, –∞ –њ—А–Є –Ю–£–У –і–∞–ї–µ–Ї–Њ –Ј–∞—И–µ–і—И–Є—Е —Б—В–∞–і–Є–є –Ї–∞—В–∞—Б—В—А–Њ—Д–Є—З–µ—Б–Ї–Є –њ–∞–і–∞–µ—В. –°—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –і–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ –±—Л–ї–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–≥–Њ —В–Њ—З–љ–Њ–≥–Њ —В–µ—А–Љ–Є–љ–∞, –Ї–Њ—В–Њ—А—Л–є –±—Л –∞–і–µ–Ї–≤–∞—В–љ–Њ –Њ–њ–Є—Б—Л–≤–∞–ї –њ—А–Њ—Ж–µ—Б—Б —А–∞–±–Њ—В—Л —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А –§–Ю–У. –Я–Њ—Н—В–Њ–Љ—Г –љ–∞–Љ –њ—А–Є—И–ї–Њ—Б—М —В—Й–∞—В–µ–ї—М–љ–Њ —А–∞–Ј–Њ–±—А–∞—В—М—Б—П —Б —Н—В–Є–Љ –Є –≤–≤–µ—Б—В–Є —В–∞–Ї–Њ–є –∞–і–µ–Ї–≤–∞—В–љ—Л–є, —Б –љ–∞—И–µ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П, —В–µ—А–Љ–Є–љ, –Ї–∞–Ї ¬Ђ—Д–ї—Г–Ї—В—Г–∞—Ж–Є—П¬ї. –Ъ–∞–Ї —Г–ґ–µ –±—Л–ї–Њ —Б–Ї–∞–Ј–∞–љ–Њ –≤—Л—И–µ, —Н—В–Њ –љ–Њ–≤–Њ–µ –њ–Њ–љ—П—В–Є–µ –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є, –Ї–Њ—В–Њ—А–Њ–µ –њ–Њ–і—А–Њ–±–љ–Њ —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Њ –≤ –љ–∞—И–µ–Љ –∞–≤—В–Њ—А—Б–Ї–Њ–Љ —А–∞–Ј–і–µ–ї–µ 5.10 ¬Ђ–†–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –≤–Ј–≥–ї—П–і –љ–∞ —А–Њ–ї—М —Б–Њ–µ–і–Є–љ–Є—В–µ–ї—М–љ–Њ–є —В–Ї–∞–љ–Є –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л¬ї –≥–ї–∞–≤—Л ¬Ђ–Я–∞—В–Њ–≥–µ–љ–µ–Ј –Ю–£–У¬ї –≤ –љ–Њ–≤–Њ–Љ –Є–Ј–і–∞–љ–Є–Є ¬Ђ–Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞ –њ–Њ –Ю–£–У¬ї (2023) [21], –∞ —В–∞–Ї–ґ–µ –≤ –љ–∞—И–Є—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є—П—Е [3, 6, 22].
–§–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є —А–Њ–≥–Њ–≤–Є—Ж–∞ вАФ —Н—В–Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –ґ–µ—Б—В–Ї–∞—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–∞—П –ї–Є–љ–Ј–∞, –Ї–Њ—В–Њ—А–∞—П –і–Њ–ї–ґ–љ–∞ —Б–Њ—Е—А–∞–љ—П—В—М —Б–≤–Њ–Є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–Є–µ —А–∞–Ј–Љ–µ—А—Л –Є –Њ–њ—В–Є—З–µ—Б–Ї–Є–µ —Б–≤–Њ–є—Б—В–≤–∞ –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ–Є –і–∞–ґ–µ –≤ –Љ–Њ–Љ–µ–љ—В—Л —Б–Ї–∞—З–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–≥–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Т–У–Ф, –љ–∞–њ—А–Є–Љ–µ—А, –≤–Њ –≤—А–µ–Љ—П –њ—Г–ї—М—Б–Њ–≤–Њ–є –≤–Њ–ї–љ—Л –≤ –≥–ї–∞–Ј–∞—Е —Б —А–∞–Ј–≤–Є—В–Њ–є –Ю–£–У. –≠—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–ї—П —Б–Њ—Е—А–∞–љ–µ–љ–Є—П –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–≥–Њ –Ј—А–µ–љ–Є—П, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –Љ–Њ–Љ–µ–љ—В—Л –Њ–њ–∞—Б–љ–Њ—Б—В–Є. –Ш –њ–Њ–Ї–∞ –Љ–Њ—А—Д–Њ–ї–Њ–≥–Є –љ–µ –Њ–±–љ–∞—А—Г–ґ–Є–ї–Є –≤ —А–Њ–≥–Њ–≤–Є—Ж–µ —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–µ (–њ—А—Г–ґ–Є–љ–љ—Л–µ –њ–Њ —Б—Г—В–Є) —Б—В—А—Г–Ї—В—Г—А—Л [9, 10].
–Я–Њ—Н—В–Њ–Љ—Г —Г—А–Њ–≤–µ–љ—М –Њ—В—А–∞–ґ–µ–љ–Є—П –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ–ї–љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –≤ —А–Њ–≥–Њ–≤–Є—Ж–µ –±—Г–і–µ—В –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б–Њ –Ј–і–Њ—А–Њ–≤–Њ–є —Б–Ї–ї–µ—А–Њ–є —Б —А–∞–Ј–≤–Є—В—Л–Љ–Є —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є–Љ–Є —Б—В—А—Г–Ї—В—Г—А–∞–Љ–Є. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є —А–Њ–≥–Њ–≤–Є—Ж–∞ –Њ–±–ї–∞–і–∞–µ—В —Б–ї–∞–±–Њ–є —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М—О –і–µ–Љ–њ—Д–Є—А–Њ–≤–∞—В—М (—А–∞—Б—Б–µ–Є–≤–∞—В—М) –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ –Ї–Њ–ї–µ–±–∞–љ–Є—П. –Ш –і–ї—П —Н—В–Њ–≥–Њ –љ–µ –љ—Г–ґ–љ–Њ, –Ї–∞–Ї —Н—В–Њ —Б–і–µ–ї–∞–ї–Є –∞–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є, –њ—А–Њ–≤–Њ–і–Є—В—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –≤ –Њ—З–µ—А–µ–і–љ–Њ–є —А–∞–Ј –њ–Њ–і—В–≤–µ—А–і—П—В –њ—А–∞–≤–Є–ї—М–љ–Њ—Б—В—М –Ј–∞–Ї–Њ–љ–Њ–≤ –њ—А–Є—А–Њ–і—Л. –Э–Њ –Ј–∞–Ї–Њ–љ—Л –њ—А–Є—А–Њ–і—Л –љ–∞–і–Њ –љ–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—В—М, –∞ –њ–Њ—Б—В–Њ—П–љ–љ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤ –Ї–ї–Є–љ–Є–Ї–µ!
–Р –≤–Њ—В —А–Є–≥–Є–і–љ–Њ—Б—В—М (–ґ–µ—Б—В–Ї–Њ—Б—В—М) –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –≥–ї–∞–Ј–∞ –±—Г–і–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞—В—М –Њ—В —Б—В–∞–і–Є–Є –Ї —Б—В–∞–і–Є–Є, –Є –њ–Њ—В–Њ–Љ—Г –±—Г–і–µ—В –≤–Њ–Ј—А–∞—Б—В–∞—В—М –Є –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–∞—П –њ–ї–Њ—В–љ–Њ—Б—В—М —Б–Ї–ї–µ—А—Л –Є –њ—А–Є —Н—В–Њ–Љ —Б–љ–Є–ґ–∞—В—М—Б—П –µ–µ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї –і–µ–Љ–њ—Д–Є—А–Њ–≤–∞–љ–Є—О –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Є—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є. –Ґ–Њ –µ—Б—В—М —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М —Б–Ї–ї–µ—А—Л –≥–∞—Б–Є—В—М —Б –њ–Њ–Љ–Њ—Й—М—О —Б–≤–Њ–Є—Е —А–∞–Ј–≤–Є—В—Л—Е —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А –Њ—В—А–∞–ґ–µ–љ–љ—Л–µ –Њ—В –љ–µ–µ –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ–ї–љ—Л –±—Г–і–µ—В —Б–љ–Є–ґ–∞—В—М—Б—П –њ–Њ –Љ–µ—А–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ю–£–У. –Ш –µ—Б–ї–Є –њ–Њ–љ–Є–Љ–∞—В—М –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї—Г—О —Б—Г—Й–љ–Њ—Б—В—М —Н—В–Њ–≥–Њ —П–≤–ї–µ–љ–Є—П, —В–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В—Л –і–ї—П –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є—П —В–∞–Ї–Є—Е –Ј–∞–Ї–Њ–љ–Њ–≤ –њ—А–Є—А–Њ–і—Л —В–∞–Ї–ґ–µ –љ–µ –љ—Г–ґ–љ—Л. –Э—Г–ґ–љ–Њ —В–Њ–ї—М–Ї–Њ –Ј–љ–∞—В—М –Ј–∞–Ї–Њ–љ—Л –њ—А–Є—А–Њ–і—Л.
–°—В–Њ–Є—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Б–њ–Њ—Б–Њ–± –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –≥–ї–∞–Ј —Г–ґ–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –≤ Dynamic contour tonometer Pascal (DCT) –≤ –њ–Њ–њ—Л—В–Ї–µ –њ–µ—А–µ—Б—З–Є—В–∞—В—М –Њ—В—А–∞–ґ–∞—О—Й—Г—О –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї—Г—О —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –§–Ю–У –≤ –Т–У–Ф. –Ь—Л —Г–ґ–µ –њ–Є—Б–∞–ї–Є –Њ–± –Њ–њ–∞—Б–љ–Њ—Б—В–Є —В–∞–Ї–Њ–≥–Њ ¬Ђ–≤–Є–±—А–∞—Ж–Є–Њ–љ–љ–Њ–≥–Њ¬ї –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –≥–ї–∞–Ј —Б —З–∞—Б—В–Њ—В–Њ–є –Њ–Ї–Њ–ї–Њ 100 –У—Ж –њ—А–Є —Б–Ї–ї–Њ–љ–љ–Њ—Б—В–Є –Ї –Њ—В—Б–ї–Њ–є–Ї–µ —Б–µ—В—З–∞—В–Ї–Є –≤ —Б–ї—Г—З–∞–µ —Б–Њ–≤–њ–∞–і–µ–љ–Є—П —З–∞—Б—В–Њ—В—Л –≤–љ–µ—И–љ–µ–≥–Њ –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П —Б —А–µ–Ј–Њ–љ–∞–љ—Б–љ—Л–Љ–Є –Њ–±–µ—А—В–Њ–љ–∞–Љ–Є —Б–Ї–ї–µ—А–∞–ї—М–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є [23, 24]. –Э–Њ –Ј–і–µ—Б—М –≤–∞–ґ–љ–Њ –њ–Њ–љ–Є–Љ–∞—В—М —В–Њ, —З—В–Њ DCT –љ–µ –Љ–Њ–ґ–µ—В –љ–∞–і–µ–ґ–љ–Њ –Є–Ј–Љ–µ—А—П—В—М —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –љ–Є–ґ–µ 12 –Љ–Љ —А—В. —Б—В. –Є–Ј-–Ј–∞ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –љ–Є–Ј–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Њ—В—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –Њ—В —Б–Ї–ї–µ—А—Л —Б–Є–≥–љ–∞–ї–∞. –Ґ–Њ –µ—Б—В—М —Б–њ–Њ—Б–Њ–± –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –≥–ї–∞–Ј —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–µ–љ —В–Њ–ї—М–Ї–Њ –љ–∞ —В–µ—Е –≥–ї–∞–Ј–∞—Е, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є–Љ–µ–µ—В—Б—П —Г–ґ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–є –Є –Ј–∞–Љ–µ—В–љ—Л–є —Б–Ї–∞—З–Њ–Ї —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У (—Д–∞–Ї—В–Є—З–µ—Б–Ї–Є —Н—В–Њ –≥–ї–∞–Ј–∞ —Б–Њ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –ґ–µ—Б—В–Ї–Њ–є –љ–∞—А—Г–ґ–љ–Њ–є —Б—В–µ–љ–Ї–Њ–є, —В. –µ. —Б —Г–ґ–µ –Ј–∞–Љ–µ—В–љ–Њ —А–Є–≥–Є–і–љ–Њ–є —Б–Ї–ї–µ—А–Њ–є).
–У–ї–∞–Ј–∞ —Б –љ–Є–Ј–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –Т–У–Ф –Є—Б—Е–Њ–і–љ–Њ –Є–Љ–µ—О—В –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –љ–Є–Ј–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є –Є–Ј-–Ј–∞ —Е–Њ—А–Њ—И–µ–є —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А —Б–Ї–ї–µ—А—Л, –Ї–Њ—В–Њ—А—Л–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ –і–µ–Љ–њ—Д–Є—А—Г—О—В —Г—А–Њ–≤–µ–љ—М –Њ—В—А–∞–ґ–µ–љ–љ–Њ–≥–Њ –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–≥–љ–∞–ї–∞. –Я–Њ—Н—В–Њ–Љ—Г –і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Б–њ–Њ—Б–Њ–±–∞ –∞–Ї—Г—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –Ї–∞–њ—Б—Г–ї—Г –Ј–і–Њ—А–Њ–≤–Њ–≥–Њ –≥–ї–∞–Ј–∞ –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ–Њ –Є–Љ–µ—О—В –Њ–±—К–µ–Ї—В–Є–≤–љ—Л–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –Є–Ј-–Ј–∞ —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –≤—Л—Б–Њ–Ї–Њ–≥–Њ –Ј–∞—В—Г—Е–∞–љ–Є—П –Њ—В—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —Б–Є–≥–љ–∞–ї–∞ –≤ —Н–ї–∞—Б—В–Є—З–µ—Б–Ї–Є—Е —Б—В—А—Г–Ї—В—Г—А–∞—Е —Б–Ї–ї–µ—А—Л. –Ш —Н—В–Њ —Б–Њ–≤—Б–µ–Љ –љ–µ —Г—З–Є—В—Л–≤–∞–ї–Є –∞–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є.
–° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –∞–≤—В–Њ—А—Л —Б—В–∞—В—М–Є –Ї–Њ–љ—Б—В–∞—В–Є—А—Г—О—В, —З—В–Њ –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–і–±–Є—А–∞–ї–Є –њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г, —З—В–Њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –њ—А–∞–≤–Є–ї—М–љ–Њ. –Ю–і–љ–∞–Ї–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л–є –∞–≤—В–Њ—А–∞–Љ–Є –њ–Њ–і–±–Њ—А –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–Љ—Г —Г—А–Њ–≤–љ—О –Т–У–Ф –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ –љ–µ–≤–µ—А–µ–љ. –Ш –≤–Њ—В –њ–Њ—З–µ–Љ—Г.
–Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, —З–∞—Б—В–Њ—В–∞ –њ—А–Є–Њ—А–Є—В–µ—В–љ–Њ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –љ–µ–њ–Њ–ї–љ–Њ—Ж–µ–љ–љ–Њ–≥–Њ –Ї—А–Є—В–µ—А–Є—П ¬Ђ–Т–У–Ф¬ї –≤ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ –Ю–£–У –≤ –Љ–Є—А–Њ–≤–Њ–є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –≤—Л—Б–Њ–Ї–∞. –Ь—Л –Њ–± —Н—В–Њ–Љ –Љ–љ–Њ–≥–Њ –њ–Є—Б–∞–ї–Є [7, 24], –љ–Њ –∞–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є, –≤–Є–і–Є–Љ–Њ, –љ–µ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ –≤—Б–µ –≥–ї–∞–Ј–∞ –і–µ–ї—П—В—Б—П (–Р.–Я. –Э–µ—Б—В–µ—А–Њ–≤, 1998) –љ–∞ —В—А–Є –Ј–Њ–љ—Л –љ–Њ—А–Љ—Л –Т–У–Ф: –Ј–Њ–љ—Г –љ–Є–Ј–Ї–Њ–є –љ–Њ—А–Љ—Л (9вАУ12 –Љ–Љ —А—В. —Б—В.), –Ј–Њ–љ—Г —Б—А–µ–і–љ–µ–є –љ–Њ—А–Љ—Л (13вАУ16 –Љ–Љ —А—В. —Б—В.) –Є –Ј–Њ–љ—Г –≤—Л—Б–Њ–Ї–Њ–є –љ–Њ—А–Љ—Л (17вАУ22 –Љ–Љ —А—В. —Б—В.) [25], –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—О –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–Љ—Г –і–∞–≤–ї–µ–љ–Є—О –љ–∞ –≥–Є–њ–Њ—В–Њ–љ–Є–Ї–Њ–≤, –љ–Њ—А–Љ–Њ—В–Њ–љ–Є–Ї–Њ–≤ –Є –≥–Є–њ–µ—А—В–Њ–љ–Є–Ї–Њ–≤. –Ь—Л —Г–ґ–µ –љ–∞—Г—З–Є–ї–Є—Б—М –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М –љ–∞ –њ–љ–µ–≤–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–µ ORA –Ј–Њ–љ—Г –љ–Њ—А–Љ—Л –Т–У–Ф –≤ –Љ–Њ–ї–Њ–і–Њ—Б—В–Є –і–∞–ґ–µ —Г –њ–Њ–ґ–Є–ї–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞, —В. –µ. –Њ–њ—А–µ–і–µ–ї—П—В—М –∞–љ–Њ—А–Љ–∞–ї—М–љ–Њ—Б—В—М –µ–≥–Њ —В–µ–Ї—Г—Й–µ–≥–Њ –Т–У–Ф [6]. –Ъ—Б—В–∞—В–Є, —Н—В–Њ –Љ–Њ–ґ–љ–Њ —В–∞–Ї–ґ–µ –њ—А–Њ—Б—В–Њ –≤—Л–њ–Њ–ї–љ–Є—В—М –њ–Њ –љ–∞—И–µ–є –Љ–µ—В–Њ–і–Є–Ї–µ —Б –њ–Њ–Љ–Њ—Й—М—О –њ–љ–µ–≤–Љ–Њ–∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞ Corvis ST [6].
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–≤—В–Њ—А—Л —Б—В–∞—В—М–Є –≤–Ї–ї—О—З–Є–ї–Є –≤ –≥—А—Г–њ–њ—Г —Б –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ —Г—А–Њ–≤–љ–µ–Љ –Т–У–Ф –≥–ї–∞–Ј–∞ –і–∞–ґ–µ —В–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–£–У, –Ї–Њ—В–Њ—А—Л–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –љ–∞ –і–ї–Є—В–µ–ї—М–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –≠—В–Њ –љ–µ–≤–µ—А–љ–Њ –≤ –њ—А–Є–љ—Ж–Є–њ–µ, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –љ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ –Њ–њ—А–µ–і–µ–ї–Є—В—М –Є—Б—В–Є–љ–љ—Г—О —В–µ–Ї—Г—Й—Г—О —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У —Б –Ю–£–У. –Я–Њ—П—Б–љ–Є–Љ —Н—В–Њ. –Р–≤—В–Њ—А—Л –њ—Л—В–∞—О—В—Б—П —Б—А–∞–≤–љ–Є–≤–∞—В—М –Ј–і–Њ—А–Њ–≤—Л–µ –≥–ї–∞–Ј–∞ —Б —А–∞–Ј–љ–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О —А–∞–Ј–≤–Є—В–Є—П –Т–Ю–У —Б –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л–Љ–Є –≥–ї–∞–Ј–∞–Љ–Є, –Ї–Њ–≥–і–∞ —Г —В–µ—Е –Є –і—А—Г–≥–Є—Е –љ–µ –≤—Л—П—Б–љ–µ–љ–∞ –Є—Е –њ—А–Є–љ–∞–і–ї–µ–ґ–љ–Њ—Б—В—М –Ї –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є –Ј–Њ–љ–µ –љ–Њ—А–Љ—Л –Т–У–Ф. –Р –µ—Б–ї–Є —Н—В–Њ–≥–Њ –љ–µ—В, —В–Њ –≥–ї–∞–Ј–∞ —Б –љ–Є–Ј–Ї–Њ–є –Ј–Њ–љ–Њ–є –љ–Њ—А–Љ—Л –Т–У–Ф, –љ–Њ —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –Ю–£–У (—В. –µ. —Г–ґ–µ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В—М—О –§–Ю–У) –Љ–Њ–≥—Г—В –Є–Љ–µ—В—М –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф —Б –≥–ї–∞–Ј–∞–Љ–Є —Б –Т–Ю–У –Є–Ј –Ј–Њ–љ—Л –≤—Л—Б–Њ–Ї–Њ–є –љ–Њ—А–Љ—Л –Т–У–Ф. –Э–Њ –Є —Н—В–Њ –µ—Й–µ –љ–µ –≤—Б–µ.
–Э–∞ —Д–Њ–љ–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–є –Њ–±—К–µ–Љ –§–Ю–У –њ—А–Є —А–∞–Ј–љ–Њ–є —Б—В–∞–і–Є–Є –Ю–£–У –≤—Б–µ–≥–і–∞ —Г–Љ–µ–љ—М—И–µ–љ –Є, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –љ–∞ –љ–µ–Є–Ј–≤–µ—Б—В–љ—Г—О –љ–∞–Љ –≤–µ–ї–Є—З–Є–љ—Г (–±–Є–Њ–Љ–µ—Е–∞–љ–Є–Ї–∞ —Н—В–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –љ–∞–Љ–Є –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ –Њ–њ–Є—Б–∞–љ–∞). –Я–Њ—Н—В–Њ–Љ—Г –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –љ–∞—А—Г–ґ–љ–Њ–≥–Њ –Њ–±–ґ–Є–Љ–∞—О—Й–µ–≥–Њ —Г—Б–Є–ї–Є—П —Б–Њ —Б—В–Њ—А–Њ–љ—Л –§–Ю–У –Є –Ї –Њ—В–≤–µ—В–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П –Т–У–Ф. –Я–Њ—П—Б–љ–Є–Љ —Н—В–Њ.
–І–∞—Б—В–Њ –њ–Њ—Б–ї–µ —Г—Б–Є–ї–µ–љ–Є—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –≤ –≥–ї–∞–Ј–∞—Е —Б –Ю–£–У —Н—В–Њ –љ–Њ–≤–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ –≥–ї–∞–Ј–∞ (–њ—А–Є –Љ–µ–љ—М—И–µ–Љ –µ–≥–Њ –Њ–±—К–µ–Љ–µ) –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ–Њ —В–Њ–ї–Ї—Г–µ—В—Б—П –Љ–љ–Њ–≥–Є–Љ–Є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–∞–Љ–Є –Ї–∞–Ї –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л. –Ф–∞, –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ, —А–Є–≥–Є–і–љ–Њ—Б—В—М —Б–Ї–ї–µ—А—Л –±—Г–і–µ—В –њ—А–Є —Н—В–Њ–Љ —З–∞—Б—В–Є—З–љ–Њ —Б–љ–Є–ґ–µ–љ–∞ (–њ—А—Г–ґ–Є–љ–∞ –Љ–µ–љ–µ–µ —А–∞—Б—В—П–љ—Г—В–∞), –љ–Њ —Н—В–∞ –љ–Њ–≤–∞—П ¬Ђ—А—Г–Ї–Њ—В–≤–Њ—А–љ–∞—П¬ї —А–Є–≥–Є–і–љ–Њ—Б—В—М —П–≤–ї—П–µ—В—Б—П –≤–µ–ї–Є—З–Є–љ–Њ–є, –Ї–Њ—В–Њ—А–∞—П –Љ–Њ–ґ–µ—В –±—Л—В—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –љ–Є–ґ–µ –Є—Б—В–Є–љ–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л –љ–∞ –і–∞–љ–љ—Л–є –Љ–Њ–Љ–µ–љ—В. –Ш —Н—В–Њ, –Ї—Б—В–∞—В–Є, —Б–Њ–≤—Б–µ–Љ –љ–µ –њ–Њ–љ–Є–Љ–∞—О—В –∞–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є. –Ґ–Њ –µ—Б—В—М –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Є –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ –Њ—В—Б–ї–µ–і–Є—В—М –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –њ–Њ —В–∞–Ї–Њ–є –Љ–µ—В–Њ–і–Є–Ї–µ –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ. –Я–Њ—Н—В–Њ–Љ—Г –≤ —А–∞–Љ–Ї–∞—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М –Є—Б—В–Є–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М —В–µ–Ї—Г—Й–µ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л –≤ –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –≥–ї–∞–Ј–∞—Е –њ—А–Є –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–є –Њ—В–Љ–µ–љ–µ –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –≠—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–ї—П —В–Њ–≥–Њ, —З—В–Њ–±—Л —А–µ–∞–ї—М–љ–Њ –Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞—В—М —Б–Ї–Њ—А–Њ—Б—В—М —Б—В–∞—А–µ–љ–Є—П –§–Ю–У, –Ї–Њ—В–Њ—А–∞—П –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ [6, 21вАУ24].
–Я—А–Є–≤–µ–і–µ–Љ –і—А—Г–≥–Њ–є –Ї–Њ–љ–Ї—А–µ—В–љ—Л–є –њ—А–Є–Љ–µ—А. –Я—А–Є –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ–Њ–Љ —Г–Љ–µ–љ—М—И–µ–љ–Є–Є –Њ–±—К–µ–Љ–∞ –≥–ї–∞–Ј–∞ —Б –Ю–£–У –њ—А–Є–Љ–µ—А–љ–Њ –љ–∞ 0,083 –Љ–ї –њ–Њ—Б–ї–µ —Г—Б—В–∞–љ–Њ–≤–Ї–Є –Є–љ—В—А–∞–Њ–Ї—Г–ї—П—А–љ–Њ–є –ї–Є–љ–Ј—Л –±–µ–Ј –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Ј–∞–Љ–µ—В–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Т–У–Ф –Њ—В –Љ–µ—Б—П—Ж–∞ –і–Њ –њ–Њ–ї—Г–≥–Њ–і–∞, –Ї–Њ—В–Њ—А–Њ–µ –њ–Њ—В–Њ–Љ –њ—А–Є—Е–Њ–і–Є—В –Ї –і–Њ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–Љ –Ј–љ–∞—З–µ–љ–Є–µ–Љ. –І—В–Њ –њ—А–Є —Н—В–Њ–Љ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В? –§–Ю–У —Б–Њ–Ї—А–∞—В–Є–ї–∞ —Б–≤–Њ—О –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М, —Б—В–∞–ї–∞ –Љ–µ–љ–µ–µ —А–∞—Б—В—П–љ—Г—В–Њ–є –Є —В–µ–њ–µ—А—М —Б –Љ–µ–љ—М—И–Є–Љ —Г—Б–Є–ї–Є–µ–Љ –Њ–±–ґ–Є–Љ–∞–µ—В —Б—В—А—Г–Ї—В—Г—А—Л –≥–ї–∞–Ј–∞ (–њ—А—Г–ґ–Є–љ–∞ –Љ–µ–љ–µ–µ —А–∞—Б—В—П–љ—Г—В–∞). –Т –Њ—В–≤–µ—В –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ, –љ–Њ –≤—А–µ–Љ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П –Є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф.
–Ш –µ—Б–ї–Є –≥–Њ–≤–Њ—А–Є—В—М –Њ–±—К–µ–Ї—В–Є–≤–љ–Њ, —В–Њ –∞–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є, –Ї —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –љ–µ –њ–Њ–љ–Є–Љ–∞—П —Н—В–Њ–≥–Њ, –≤–Ї–ї—О—З–Є–ї–Є –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Г—О –≥—А—Г–њ–њ—Г –≥–ї–∞–Ј–∞, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є—Б—Е–Њ–і–љ–Њ —В–µ–Ї—Г—Й–∞—П —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У –Љ–∞–ї–Њ —А–∞–Ј–ї–Є—З–∞–ї–∞—Б—М, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤—Б–µ –≥–ї–∞–Ј–∞ –Є–Љ–µ–ї–Є –њ—А–Є–Љ–µ—А–љ–Њ —А–∞–≤–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф. –Ш —Н—В–Њ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ –њ–Њ—В–Њ–Љ—Г, —З—В–Њ –∞–≤—В–Њ—А—Л —П–≤–љ–Њ –љ–µ –Ј–љ–∞–Ї–Њ–Љ—Л —Б –±–Є–Њ–Љ–µ—Е–∞–љ–Є–Ї–Њ–є –≥–ї–∞–Ј–∞. –Т–µ–і—М –µ—Й–µ –≤ 1974 –≥. –Р.–Я. –Э–µ—Б—В–µ—А–Њ–≤ –Є —Б–Њ–∞–≤—В. –≤ –Є—Е –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є –Љ–Њ–љ–Њ–≥—А–∞—Д–Є–Є –њ–Њ–і—З–µ—А–Ї–Є–≤–∞–ї–Є, —З—В–Њ ¬Ђ–љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Т–У–Ф –Њ–Ї–∞–Ј—Л–≤–∞—О—В —В–Њ–ї—М–Ї–Њ —А–Є–≥–Є–і–љ–Њ—Б—В—М —Б–Ї–ї–µ—А—Л –Є –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞¬ї: P0 = f (Ri, V), –≥–і–µ –†0 вАФ –≤–µ–ї–Є—З–Є–љ–∞ –Є—Б—В–Є–љ–љ–Њ–≥–Њ –Т–У–Ф, Ri вАФ —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У, –∞ V вАФ —В–µ–Ї—Г—Й–Є–є –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ [26]. –£ –Р.–Я. –Э–µ—Б—В–µ—А–Њ–≤–∞ –Є —Б–Њ–∞–≤—В. —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Є–Љ–µ–љ–љ–Њ —Г—А–Њ–≤–љ–µ–Љ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У, –∞ –љ–µ —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Г—А–Њ–≤–љ–µ–Љ –Т–У–Ф. –Ґ–Њ –µ—Б—В—М –Ї–∞–Ї–Њ–≤–∞ —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У, —В–∞–Ї–Њ–≤–Њ –Є –Т–У–Ф, –∞ –љ–µ –љ–∞–Њ–±–Њ—А–Њ—В [6, 22].
–Ш–Ј –≤—Б–µ–≥–Њ —Б–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ —Б–ї–µ–і—Г–µ—В, —З—В–Њ –Ї–Њ—А—А–µ–Ї—В–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В—М —Г—А–Њ–≤–љ–Є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є –Т–У–Ф –≤ –≥–ї–∞–Ј–∞—Е —Б –Т–Ю–У –Є —Б –Ю–£–У –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —В–Њ–ї—М–Ї–Њ –њ—А–Є –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Њ—В–Љ–µ–љ–µ –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –њ—А–Є—З–µ–Љ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ–Њ–і–±–Є—А–∞—В—М –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–µ —В–Њ–ї—М–Ї–Њ –Њ–і–љ–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –љ–Њ –Є —Б –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є –Ј–Њ–љ–Њ–є –љ–Њ—А–Љ—Л –Т–У–Ф –≤ –Љ–Њ–ї–Њ–і–Њ—Б—В–Є. –Р–≤—В–Њ—А—Л —Б—В–∞—В—М–Є –љ–µ —Б–і–µ–ї–∞–ї–Є —Н—В–Њ–≥–Њ ¬Ђ–љ–∞ –≤—Е–Њ–і–µ¬ї, –њ–Њ—В–Њ–Љ—Г –Є –њ–Њ–ї—Г—З–Є–ї–Є ¬Ђ–љ–∞ –≤—Л—Е–Њ–і–µ¬ї —Б—В–Њ–ї—М –њ–ї–∞—З–µ–≤–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В, –Ї–Њ–≥–і–∞ –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ–∞—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–∞ –Ј–∞–і–∞—З–Є, –љ–µ–∞–і–µ–Ї–≤–∞—В–љ—Л–є –≤—Л–±–Њ—А –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ –Є —В–µ–Њ—А–µ—В–Є—З–µ—Б–Ї–Є–µ –Њ—И–Є–±–Ї–Є –≤ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ –Є –≤ –Њ—Ж–µ–љ–Ї–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ—А–Є–≤–µ–ї–Є –Ї —В–∞–Ї–Є–Љ –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ—Л–Љ –≤—Л–≤–Њ–і–∞–Љ.
–†–∞–Ј–±–µ—А–µ–Љ –±–Њ–ї–µ–µ –њ–Њ–і—А–Њ–±–љ–Њ –Њ—И–Є–±–Ї–Є –∞–≤—В–Њ—А–Њ–≤ –≤ –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–µ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤. –°—В–Њ–Є—В —Б—А–∞–Ј—Г —Б–Ї–∞–Ј–∞—В—М, —З—В–Њ –ї—О–±–Њ–є –Ї–Њ—Б–≤–µ–љ–љ—Л–є —Б–њ–Њ—Б–Њ–± —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є —Б–љ–∞—З–∞–ї–∞ —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В —В–µ–Ї—Г—Й—Г—О —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У, –∞ –њ–Њ—В–Њ–Љ —А–Є–≥–Є–і–љ–Њ—Б—В—М –њ–µ—А–µ—Б—З–Є—В—Л–≤–∞—О—В –≤ –і–∞–≤–ї–µ–љ–Є–µ —Б –њ–Њ–Љ–Њ—Й—М—О —З–∞—Б—В–Њ –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ—Л—Е, –љ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л—Е –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–µ–є –≤ –≤–Є–і–µ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –ї–Є–љ–µ–µ–Ї –Є–ї–Є —В–∞–±–ї–Є—Ж. –Я—А–Є —Н—В–Њ–Љ —А–Є–≥–Є–і–љ–Њ—Б—В—М –≥–ї–∞–Ј–∞ —Б—З–Є—В–∞—О—В –Љ–∞–ї–Њ –Є–Ј–Љ–µ–љ—З–Є–≤–Њ–є –≤–µ–ї–Є—З–Є–љ–Њ–є (–љ–µ –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 26%) –Є –њ–Њ—Б—В–Њ—П–љ–љ–Њ–є –Ї–∞–Ї –і–ї—П –Ј–і–Њ—А–Њ–≤—Л—Е –≥–ї–∞–Ј, —В–∞–Ї –Є –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е [26]. –Э–µ–Ї–∞—П –њ–Њ—Б—В–Њ—П–љ–љ–∞—П ¬Ђ—Б—А–µ–і–љ—П—П —А–Є–≥–Є–і–љ–Њ—Б—В—М –њ–Њ –±–Њ–ї—М–љ–Є—Ж–µ¬ї. –Э–Њ, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–∞—И–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П [6, 22, 24] –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –і—А—Г–≥–Є—Е –∞–≤—В–Њ—А–Њ–≤ [27, 28], —А–Є–≥–Є–і–љ–Њ—Б—В—М –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М—Б—П –љ–∞ 200вАУ300%. –Ш —Б—А–∞–Ј—Г –≤—Б—В–∞–µ—В –≤–Њ–њ—А–Њ—Б —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —Б –њ–Њ–Љ–Њ—Й—М—О —В–∞–Ї–Њ–≥–Њ –≥—А—Г–±–Њ–≥–Њ —Б–њ–Њ—Б–Њ–±–∞ —А–∞—Б—З–µ—В–љ–Њ–≥–Њ –Є–Ј–Љ–µ—А–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Т–У–Ф –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –њ–Њ—Б—В–∞–≤–Є—В—М –њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–є –і–Є–∞–≥–љ–Њ–Ј –±–µ–Ј —Г—З–µ—В–∞ —В–µ–Ї—Г—Й–µ–≥–Њ —Г—А–Њ–≤–љ—П —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У –Є –Ј–љ–∞—З–µ–љ–Є—П –і–∞–≤–ї–µ–љ–Є—П –≤ –Љ–Њ–ї–Њ–і–Њ—Б—В–Є.
–Р–≤—В–Њ—А—Л —Б—В–∞—В—М–Є –≤ —З–∞—Б—В–Є –Њ—Ж–µ–љ–Ї–Є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –њ—А–Є–≤–Њ–і—П—В –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ Friedenwald (1937) [29], –≤ –Ї–Њ—В–Њ—А–Њ–Љ —А–Є–≥–Є–і–љ–Њ—Б—В—М (—В. –µ. –ґ–µ—Б—В–Ї–Њ—Б—В—М) –≥–ї–∞–Ј–∞ Ri –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤ —Н–Ї–Ј–Њ—В–Є—З–µ—Б–Ї–Є—Е –і–ї—П –ї—О–±–Њ–≥–Њ –≥—А–∞–Љ–Њ—В–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ї–∞ –µ–і–Є–љ–Є—Ж–∞—Е [–Љ–Љ-3] (!) –њ–Њ —Г—А–∞–≤–љ–µ–љ–Є—О:
![]()
–≠—В–Є–Љ ¬Ђ—Г—А–∞–≤–љ–µ–љ–Є–µ–Љ¬ї J.S. Friedenwald –Њ–њ–Є—Б–∞–ї —В—Г —Н–Љ–њ–Є—А–Є—З–µ—Б–Ї—Г—О –Ї—А–Є–≤—Г—О, –Ї–Њ—В–Њ—А—Г—О –Њ–љ –њ–Њ–ї—Г—З–Є–ї –њ–Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Б–њ–Њ—А–љ–Њ–≥–Њ —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–∞. –Ш —Н—В–Њ –ї–Њ–≥–∞—А–Є—Д–Љ–Є—З–µ—Б–Ї–Њ–µ —Г—А–∞–≤–љ–µ–љ–Є–µ –≤ –њ—А–Є–љ—Ж–Є–њ–µ –љ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ј–∞–Ї–Њ–љ–∞–Љ –Љ–µ—Е–∞–љ–Є–Ї–Є.
–Р –≤–Њ—В —Г—А–∞–≤–љ–µ–љ–Є–µ –љ–µ–Љ–µ—Ж–Ї–Њ–≥–Њ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–∞ P. R√ґmer (1913) [30], –љ–∞–Њ–±–Њ—А–Њ—В, –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ј–∞–Ї–Њ–љ–∞–Љ –Љ–µ—Е–∞–љ–Є–Ї–Є, –Є –≤ –љ–µ–Љ —А–Є–≥–Є–і–љ–Њ—Б—В—М —Г –љ–∞–њ–Њ–ї–љ–µ–љ–љ–Њ–є –≤–Њ–і–Њ–є —Н–ї–∞—Б—В–Є—З–љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Ї–∞–Ї –ґ–µ—Б—В–Ї–Њ—Б—В—М –≤ –Њ–±—Й–µ–Љ–Є—А–Њ–≤—Л—Е —Б–Є—Б—В–µ–Љ–љ—Л—Е –µ–і–Є–љ–Є—Ж–∞—Е Pa/m3 (–≤ –њ–∞—Б–Ї–∞–ї—П—Е –љ–∞ –Ї—Г–±–Є—З–µ—Б–Ї–Є–є –Љ–µ—В—А) –њ–Њ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–є —Д–Њ—А–Љ—Г–ї–µ:
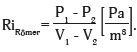
–Ю–і–љ–∞–Ї–Њ –≤ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –њ—А–Є–ґ–Є–ї–∞—Б—М –Є–Љ–µ–љ–љ–Њ –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ–∞—П —Д–Њ—А–Љ—Г–ї–∞ J.S. Friedenwald, –њ—А–Є–≤–Њ–і—П—Й–∞—П –Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –Њ—И–Є–±–Ї–∞–Љ –њ—А–Є –њ–µ—А–µ—Б—З–µ—В–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –≤ –і–∞–≤–ї–µ–љ–Є–µ, –∞ —В–∞–Ї–ґ–µ —З–∞—Б—В–Њ –Ї –Њ—И–Є–±–Њ—З–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ –Њ —В–Њ–Љ, —З—В–Њ —В–∞–Ї–Њ–µ –њ–Њ —Б–≤–Њ–µ–є —Б—Г—В–Є –Њ–±—К–µ–Љ–љ–∞—П —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У.
–°–µ–≥–Њ–і–љ—П –Љ—Л —Г–і–Є–≤–ї—П–µ–Љ—Б—П –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ–є –њ—А–Њ–Ј–Њ—А–ї–Є–≤–Њ—Б—В–Є P. R√ґmer, –Ї–Њ—В–Њ—А—Л–є –±–Њ–ї–µ–µ –≤–µ–Ї–∞ –љ–∞–Ј–∞–і —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –љ–∞–Ј–≤–∞–ї –≥–ї–∞–≤–љ–Њ–µ –Ј–≤–µ–љ–Њ –≤ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–Љ –њ—А–Њ—Ж–µ—Б—Б–µ: ¬Ђ...–Я–µ—А–≤–Є—З–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ—А–Є –≥–ї–∞—Г–Ї–Њ–Љ–µ –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ —Г—Б–ї–Њ–≤–Є—П –і–ї—П –µ–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —П–≤–ї–µ–љ–Є–є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Є—Б–Ї–∞—В—М... –≤ —Б—Г–Љ–Ї–µ –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞.... –Ш–Ј–Љ–µ–љ–µ–љ–Є–µ —Б—Г–Љ–Ї–Є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞, –Ї–Њ—В–Њ—А–Њ–µ –і–Њ —Б–Є—Е –њ–Њ—А —Б–ї–Є—И–Ї–Њ–Љ –Љ–∞–ї–Њ –њ—А–Є–љ–Є–Љ–∞–ї–Њ—Б—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ, —П–≤–ї—П–µ—В—Б—П –њ–µ—А–≤–Є—З–љ—Л–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –≤—Л–Ј—Л–≤–∞–µ—В, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, —А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–Є–µ –Ї –≥–ї–∞—Г–Ї–Њ–Љ–µ. –Ґ–Њ–ї—М–Ї–Њ –њ–Њ—В–Њ–Љ—Г –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —Б–Ї–ї–µ—А—Л –Љ–∞–ї–Њ –њ—А–Є–љ–Є–Љ–∞–ї–Њ—Б—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ, —З—В–Њ –Њ–љ–Њ —З—А–µ–Ј–≤—Л—З–∞–є–љ–Њ –Љ–∞–ї–Њ –Њ–±–љ–∞—А—Г–ґ–Є–≤–∞–µ—В—Б—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Є –∞–љ–∞—В–Њ–Љ–Є—З–µ—Б–Ї–ЄвА¶ –Ш —В–Њ–ї—М–Ї–Њ –µ—Б–ї–Є —Б—З–Є—В–∞—В—М –≥–ї–∞—Г–Ї–Њ–Љ—Г –±–Њ–ї–µ–Ј–љ—М—О —Б–∞–Љ–Њ–і–Њ–≤–ї–µ—О—Й–µ–є, –Ї–Њ—В–Њ—А–∞—П, –Љ–Њ–ґ–µ—В –±—Л—В—М, –Ј–∞–≤–Є—Б–Є—В –Њ—В –њ–µ—А–µ—А–Њ–ґ–і–µ–љ–Є—П —Б—Г–Љ–Ї–Є –≥–ї–∞–Ј–љ–Њ–≥–Њ —П–±–ї–Њ–Ї–∞, –µ—Б–ї–Є —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –њ–Њ–≤—Л—И–µ–љ–Є–µ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П –Ї–∞–Ї —Г—Б–Є–ї–µ–љ–љ–Њ–µ –≤—Л–і–µ–ї–µ–љ–Є–µ –ґ–Є–і–Ї–Њ—Б—В–Є, –∞ –Ј–∞–Ї–ї–∞–і—Л–≤–∞–љ–Є–µ –Ї–∞–Љ–µ—А–љ–Њ–≥–Њ —Г–≥–ї–∞ –Ї–∞–Ї –≤—В–Њ—А–Є—З–љ–Њ–µ —П–≤–ї–µ–љ–Є–µ, —В–Њ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –њ–Њ–љ—П—В–љ—Л–Љ, —З—В–Њ –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –љ–∞—И–Є—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А–Њ–њ—А–Є—П—В–Є–є –Љ—Л –Љ–Њ–ґ–µ–Љ –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Є–µ —Д–∞–Ї—В–Њ—А—Л –Њ–±–Љ–µ–љ–∞ –ґ–Є–і–Ї–Њ—Б—В–µ–є, –љ–Њ –і–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ –љ–µ –Љ–Њ–ґ–µ–Љ –Є–Ј–ї–µ—З–Є—В—М –±–Њ–ї–µ–Ј–љ—М –Ї–∞–Ї —В–∞–Ї–Њ–≤—Г—О¬ї [30].
–Э–Њ –Ї–∞–Ї –ґ–µ –Њ–±—Б—В–Њ—П—В –і–µ–ї–∞ —Б —А–Є–≥–Є–і–љ–Њ—Б—В—М—О –≤ –≥–ї–∞–Ј–∞—Е —Б —А–∞–Ј–љ–Њ–є —А–µ—Д—А–∞–Ї—Ж–Є–µ–є, —В. –µ. –≤ –Њ–±—Л—З–љ—Л—Е –≥–ї–∞–Ј–∞—Е –≥–Є–њ–µ—А–Љ–µ—В—А–Њ–њ–Њ–≤, —Н–Љ–Љ–µ—В—А–Њ–њ–Њ–≤ –Є –Љ–Є–Њ–њ–Њ–≤? –Ф–Њ–±—А–Њ—В–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Љ–Њ–і—Г–ї—П –Ѓ–љ–≥–∞ –љ–∞ –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –њ–Њ–ї–Њ—Б–Ї–∞—Е —Б–Ї–ї–µ—А—Л —Г –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ —Б –Љ–Є–Њ–њ–Є–µ–є –њ—А–Є–≤–µ–ї–Њ –∞–≤—В–Њ—А–∞ –Ї –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ–Њ–Љ—Г –≤—Л–≤–Њ–і—Г –Њ –љ–Є–Ј–Ї–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У –≤ –Љ–Є–Њ–њ–Є—З–µ—Б–Ї–Є—Е –≥–ї–∞–Ј–∞—Е –Є, –∞–љ–∞–ї–Њ–≥–Є—З–љ–Њ, –Ї –≤—Л—Б–Њ–Ї–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є –≥–ї–∞–Ј —Г –і–µ—В–µ–є —Б –љ–∞—З–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А–Љ–µ—В—А–Њ–њ–Є–µ–є [31]. –Ъ –њ–Њ—Е–Њ–ґ–µ–Љ—Г –≤—Л–≤–Њ–і—Г –і–ї—П –Љ–Є–Њ–њ–Є—З–µ—Б–Ї–Є—Е –≥–ї–∞–Ј –њ—А–Є—И–ї–Є –Є –∞–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є.
–Ч–∞–Љ–µ—В–Є–Љ, —З—В–Њ —З–µ–ї–Њ–≤–µ–Ї, –≤—Л—Б–Њ–Ї–Њ—А–∞–Ј–≤–Є—В—Л–µ –Њ–±–µ–Ј—М—П–љ—Л –Є –Љ–љ–Њ–≥–Є–µ –і—А—Г–≥–Є–µ –≤–Є–і—Л –ґ–Є–≤–Њ—В–љ—Л—Е –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –њ–Њ–≥–Њ–ї–Њ–≤–љ–Њ —А–Њ–ґ–і–∞—О—В—Б—П –≥–Є–њ–µ—А–Љ–µ—В—А–Њ–њ–∞–Љ–Є, —В. –µ. —Б –≥–ї–∞–Ј–∞–Љ–Є, —Г –Ї–Њ—В–Њ—А—Л—Е –Ї–Њ—А–Њ—В–Ї–∞—П –њ–µ—А–µ–і–љ–µ-–Ј–∞–і–љ—П—П –Њ—Б—М (–Я–Ч–Ю). –Ш —Н—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Ї–∞–ґ–і–Њ–Љ—Г –≤–Є–і—Г –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –∞–і–∞–њ—В–Є—А–Њ–≤–∞—В—М –і–ї–Є–љ—Г –Я–Ч–Ю (–±—Г–Ї–≤–∞–ї—М–љ–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ —Г–і–ї–Є–љ—П—В—М) –Ї –ґ–Є–Ј–љ–µ–љ–љ—Л–Љ —Г—Б–ї–Њ–≤–Є—П–Љ –Ј—А–Є—В–µ–ї—М–љ–Њ–є —Б—А–µ–і—Л. –Ш–Ј —Н—В–Є—Е –Є–і–µ–є —А–Њ–і–Є–ї–∞—Б—М –љ–∞—И–∞ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–∞—П —В–µ–Њ—А–Є—П –∞–і–∞–њ—В–∞—Ж–Є–Њ–љ–љ–Њ–є –Љ–Є–Њ–њ–Є–Є, –Ї–Њ—В–Њ—А–∞—П –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –њ–Њ–ї–љ–Њ—Б—В—М—О —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ–є, –њ–Њ–Ј–≤–Њ–ї—П–µ—В –љ–∞–і–µ–ґ–љ–Њ –њ—А–µ–і—Б–Ї–∞–Ј—Л–≤–∞—В—М —А–µ–Ј—Г–ї—М—В–∞—В –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ—А—А–µ–Ї—Ж–Є–Є –Є –Ј–∞ 10 –ї–µ—В —Г—Б–њ–µ—И–љ–Њ –∞–њ—А–Њ–±–Є—А–Њ–≤–∞–љ–∞ –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —В—Л—Б—П—З–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [32вАУ34].
–Ю–і–љ–∞–Ї–Њ –Љ–Є–Њ–њ–Є—З–µ—Б–Ї–Є–є –≥–ї–∞–Ј –Є–Љ–µ–µ—В –љ–∞–Є–±–Њ–ї—М—И—Г—О –і–ї–Є–љ—Г –Я–Ч–Ю –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –і–µ—В—Б–Ї–Є–Љ–Є –≥–ї–∞–Ј–∞–Љ–Є –≥–Є–њ–µ—А–Љ–µ—В—А–Њ–њ–Њ–≤ –Є —Н–Љ–Љ–µ—В—А–Њ–њ–Њ–≤. –Ґ–Њ –µ—Б—В—М –§–Ю–У –Љ–Є–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–ї–∞–Ј–∞ —Б–∞–Љ–∞—П —А–∞—Б—В—П–љ—Г—В–∞—П, –Є –њ–Њ—Н—В–Њ–Љ—Г —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У —Г –Љ–Є–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–ї–∞–Ј–∞ –і–Њ–ї–ґ–љ–∞ –±—Л—В—М —Б–∞–Љ–Њ–є –≤—Л—Б–Њ–Ї–Њ–є, –∞ —Г –і–µ—В—Б–Ї–Њ–≥–Њ –љ–µ—А–∞—Б—В—П–љ—Г—В–Њ–≥–Њ –≥–Є–њ–µ—А–Љ–µ—В—А–Њ–њ–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–ї–∞–Ј–∞ вАФ —Б–∞–Љ–Њ–є –љ–Є–Ј–Ї–Њ–є. –Р–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б —Б–Ї–∞—З–Ї–∞ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є –Њ—В–≤–µ—В–љ–Њ–≥–Њ —Б–Ї–∞—З–Ї–∞ –Т–У–Ф –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –≤ –≥–ї–∞–Ј—Г, –Ї–Њ–≥–і–∞ –Љ—Л —А–∞—Б—В—П–≥–Є–≤–∞–µ–Љ –Њ–±–Њ–ї–Њ—З–Ї—Г –≥–ї–∞–Ј–∞ –≤–Њ –≤—А–µ–Љ—П –≤–∞–Ї—Г—Г–Љ–љ–Њ–≥–Њ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ –≥–ї–∞–Ј (–≤–∞–Ї—Г—Г–Љ-–њ–µ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–∞—П –њ—А–Њ–±–∞ –Т–Њ–ї–Ї–Њ–≤–∞ вАФ –°—Г—Е–Є–љ–Є–љ–Њ–є) –Є–ї–Є –≤–Њ–Ј–і–µ–є—Б—В–≤—Г–µ–Љ –љ–∞ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ—Л–є —Б–ї–Њ–є –§–Ю–У –ї–Њ–Ї–∞–ї—М–љ–Њ —Б –њ–Њ–Љ–Њ—Й—М—О –≤–∞–Ї—Г—Г–Љ–љ–Њ–≥–Њ –Ї–Њ–ї–њ–∞—З–Ї–∞-–њ—А–Є—Б–Њ—Б–Ї–Є.
–Э–Њ –Љ—Л –≤—Б–µ-—В–∞–Ї–Є –њ—А–Њ–≤–µ–ї–Є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–∞ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е —Б–Њ—В–љ—П—Е –≥–ї–∞–Ј —Б —А–∞–Ј–љ–Њ–є —А–µ—Д—А–∞–Ї—Ж–Є–µ–є, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є, —З—В–Њ —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є –њ–µ—А–µ—Е–Њ–і–µ –Њ—В –љ–∞—З–∞–ї—М–љ–Њ–є –≥–Є–њ–µ—А–Љ–µ—В—А–Њ–њ–Є–Є –Ї —Н–Љ–Љ–µ—В—А–Њ–њ–Є–Є –Є –Ї –Љ–Є–Њ–њ–Є–Є [14]. –Ш —Н—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ј–∞–Ї–Њ–љ–∞–Љ –Љ–µ—Е–∞–љ–Є–Ї–Є. –≠—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л —В–∞–Ї–ґ–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –≤ –њ—А–Є–љ—Ж–Є–њ–µ –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ–Њ –Њ–њ—А–µ–і–µ–ї—П—В—М –Њ–±—К–µ–Љ–љ—Г—О —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У (—В. –µ. —А–Є–≥–Є–і–љ–Њ—Б—В—М –≤—Б–µ–є –Њ–±–Њ–ї–Њ—З–Ї–Є in vivo –≤ —Ж–µ–ї–Њ–Љ) –љ–∞ —А–∞–Ј—А—Л–≤–љ–Њ–є –Љ–∞—И–Є–љ–µ –њ–Њ –Љ–Њ–і—Г–ї—О –Ѓ–љ–≥–∞ –љ–∞ –≤—Л–і–µ–ї–µ–љ–љ—Л—Е –њ–Њ–ї–Њ—Б–Ї–∞—Е —А–Њ–≥–Њ–≤–Є—Ж—Л –Є–ї–Є —Б–Ї–ї–µ—А—Л. –Э–∞ —Н—В–Њ–Љ —В–∞–Ї–ґ–µ —Б–њ–Њ—В–Ї–љ—Г–ї–Є—Б—М –Є –∞–≤—В–Њ—А—Л —Б—В–∞—В—М–Є.
–Ґ–µ–њ–µ—А—М —А–∞—Б—Б–Љ–Њ—В—А–Є–Љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–є –∞–≤—В–Њ—А–∞–Љ–Є –Љ–µ—В–Њ–і–Є–Ї–Є –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —А–Є–≥–Є–і–љ–Њ—Б—В–Є –§–Ю–У —Б –њ–Њ–Љ–Њ—Й—М—О –і–≤—Г–Ї—А–∞—В–љ–Њ–≥–Њ –њ–љ–µ–≤–Љ–Њ–≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П: —Б–љ–∞—З–∞–ї–∞ –±–µ–Ј –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –≥—А—Г–Ј–∞ 10 –≥ –Є –њ–Њ—Б–ї–µ –µ–≥–Њ —Г—Б—В–∞–љ–Њ–≤–Ї–Є. –≠—В–Њ —Д–∞–Ї—В–Є—З–µ—Б–Ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–і–µ–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ–≥–Њ —Б–њ–Њ—Б–Њ–±–∞ —В–Њ–љ–Њ–≥—А–∞—Д–Є–Є –њ—А–Є —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–є —Г—Б—В–∞–љ–Њ–≤–Ї–µ –љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Г –≥–ї–∞–Ј–∞ –≥—А—Г–Ј–Њ–≤ —А–∞–Ј–љ–Њ–≥–Њ –≤–µ—Б–∞. –Ъ–∞–Ї –љ–Є –њ—А–Є—Б–Ї–Њ—А–±–љ–Њ, –љ–Њ —Б –њ–Њ–Ј–Є—Ж–Є–є —Б–µ–≥–Њ–і–љ—П—И–љ–µ–≥–Њ —Г–≥–ї—Г–±–ї–µ–љ–љ–Њ–≥–Њ –±–Є–Њ–Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ–Њ–љ–Є–Љ–∞–љ–Є—П —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є –§–Ю–У —В–∞–Ї–Є–µ —Б–њ–Њ—Б–Њ–±—Л –≤ –њ—А–Є–љ—Ж–Є–њ–µ –Њ—И–Є–±–Њ—З–љ—Л. –Ш –≤–Њ—В –њ–Њ—З–µ–Љ—Г.
–§–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ —Б–њ–Њ—Б–Њ–±—Л —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є –і–µ–ї—П—В—Б—П –љ–∞ –Ј–∞–Ї—А—Л—В—Л–µ, –Ї–Њ–≥–і–∞ –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ –≤–Њ –≤—А–µ–Љ—П –Є–Ј–Љ–µ—А–µ–љ–Є—П –љ–µ –Љ–µ–љ—П–µ—В—Б—П, –Є –Њ—В–Ї—А—Л—В—Л–µ, –Ї–Њ–≥–і–∞ —Н—В–Њ—В –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ –≤–Њ –≤—А–µ–Љ—П –Є–Ј–Љ–µ—А–µ–љ–Є—П —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П. –Ъ –Ј–∞–Ї—А—Л—В—Л–Љ —Б–њ–Њ—Б–Њ–±–∞–Љ –Њ—В–љ–Њ—Б–Є—В—Б—П –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–∞—П –њ–љ–µ–≤–Љ–Њ—В–Њ–љ–Њ–Љ–µ—В—А–Є—П –Є –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–∞—П —Г–і–∞—А–љ–∞—П —В–Њ–љ–Њ–Љ–µ—В—А–Є—П —З–µ—А–µ–Ј –≤–µ–Ї–Њ, –Ї–Њ–≥–і–∞ –≤—А–µ–Љ—П –Є–Ј–Љ–µ—А–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П–µ—В 20вАУ30 –Љ—Б –Є –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ –љ–µ –Љ–µ–љ—П–µ—В—Б—П. –Ш–Љ–µ–љ–љ–Њ –њ–Њ—Н—В–Њ–Љ—Г –Ј–∞–Ї—А—Л—В—Л–µ —Б–њ–Њ—Б–Њ–±—Л —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є –Є–Љ–µ—О—В —Б–∞–Љ—Г—О –≤—Л—Б–Њ–Ї—Г—О —В–Њ—З–љ–Њ—Б—В—М, –Ї–Њ–≥–і–∞ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–∞—П –њ–Њ–≥—А–µ—И–љ–Њ—Б—В—М –Є–Ј–Љ–µ—А–µ–љ–Є–є –Њ–±—Л—З–љ–Њ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 5%. –Ш —Н—В–Њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б–∞–Љ—Л–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —Б–њ–Њ—Б–Њ–±—Л —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є –≤ —А–∞–Љ–Ї–∞—Е –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л.
¬Ђ–Ю—В–Ї—А—Л—В—Л–µ —Б–њ–Њ—Б–Њ–±—Л¬ї —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є –Є–Ј-–Ј–∞ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ–±—К–µ–Љ–∞ –≥–ї–∞–Ј–∞ –≤–Њ –≤—А–µ–Љ—П –Є–Ј–Љ–µ—А–µ–љ–Є—П –Є–Љ–µ—О—В —Б–µ—А—М–µ–Ј–љ—Л–µ –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–Є –Є–Ј–Љ–µ—А–µ–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –і–Њ—Е–Њ–і—П—В –і–Њ 15вАУ25% –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Љ–Њ–Љ–µ–љ—В —Б–∞–Љ–Њ–≥–Њ –Є–Ј–Љ–µ—А–µ–љ–Є—П, –љ–Њ –Є –Є–Ј-–Ј–∞ —В–Њ–≥–Њ, —З—В–Њ –њ–Њ—В–Њ–Љ —Н—В–∞ –њ–Њ–≥—А–µ—И–љ–Њ—Б—В—М –µ—Й–µ –Ј–∞–Љ–µ—В–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –Є–Ј-–Ј–∞ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ–Њ–≥–Њ —Г—А–∞–≤–љ–µ–љ–Є—П J.S. Friedenwald –њ—А–Є –њ–µ—А–µ—Б—З–µ—В–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –≤ –Т–У–Ф.
–£—Б—В–∞–љ–Њ–≤–Ї–∞ –ї—О–±–Њ–≥–Њ –≥—А—Г–Ј–∞ –љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Г –љ–∞ –≤—А–µ–Љ—П –±–Њ–ї–µ–µ 0,5 —Б, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –њ—А–Є–≤–µ–і–µ—В –Ї –≤—Л–і–∞–≤–ї–Є–≤–∞–љ–Є—О –Є–Ј –≥–ї–∞–Ј–∞ –Ј–∞ —Н—В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї–Њ–є-—В–Њ –Љ–∞–ї–Њ–є —З–∞—Б—В–Є –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є, –њ—А–Є—З–µ–Љ –µ–µ –Њ–±—К–µ–Љ –±—Г–і–µ—В —В–µ–Љ –±–Њ–ї—М—И–µ, —З–µ–Љ –≤—Л—И–µ –Є—Б—Е–Њ–і–љ–∞—П —В–µ–Ї—Г—Й–∞—П —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У.
–Ч–∞–Љ–µ—В–Є–Љ, —З—В–Њ –∞–≤—В–Њ—А—Л —Б—В–∞—В—М–Є –њ–Њ–і—З–µ—А–Ї–љ—Г–ї–Є, —З—В–Њ –Њ–љ–Є –њ—А–Њ–≤–Њ–і–Є–ї–Є –Є–Ј–Љ–µ—А–µ–љ–Є—П —Б –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –≥—А—Г–Ј–Њ–Љ –≤ 10 –≥ –љ–∞ –Ї–∞–ґ–і–Њ–Љ –≥–ї–∞–Ј—Г 5 —А–∞–Ј –њ–Њ–і—А—П–і! –Ь–µ–ґ–і—Г —В–µ–Љ –ї—О–±–Њ–є —В–Њ–љ–Њ–Љ–µ—В—А–Є—Б—В —Б –Љ–љ–Њ–≥–Њ–ї–µ—В–љ–Є–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–Љ –Њ–њ—Л—В–Њ–Љ –њ—А–µ–Ї—А–∞—Б–љ–Њ –Ј–љ–∞–µ—В, —З—В–Њ –≤—В–Њ—А–Њ–µ –Є–Ј–Љ–µ—А–µ–љ–Є–µ –Т–У–Ф –њ–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –≥—А—Г–Ј–∞ —Б–ї–µ–і—Г–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М –љ–µ —А–∞–љ–µ–µ, —З–µ–Љ —З–µ—А–µ–Ј 15вАУ20 –Љ–Є–љ –њ–Њ—Б–ї–µ –њ–µ—А–≤–Њ–≥–Њ, –Ї–Њ–≥–і–∞ –≥–ї–∞–Ј —Г—Б–њ–µ–≤–∞–µ—В –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є—В—М —Б–≤–Њ–є –њ–µ—А–≤–Њ–љ–∞—З–∞–ї—М–љ—Л–є –Њ–±—К–µ–Љ. –Х—Б–ї–Є –њ—А–Њ–≤–Њ–і–Є—В—М –њ–Њ–≤—В–Њ—А–љ—Л–µ –Є–Ј–Љ–µ—А–µ–љ–Є—П –Т–У–Ф –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –±–µ–Ј –Ј–∞–Љ–µ—В–љ—Л—Е –њ–µ—А–µ—А—Л–≤–Њ–≤, —В–Њ —Б –Ї–∞–ґ–і—Л–Љ –Є–Ј–Љ–µ—А–µ–љ–Є–µ–Љ –Њ–±—К–µ–Љ –≥–ї–∞–Ј–∞ –±—Г–і–µ—В –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ —Г–Љ–µ–љ—М—И–∞—В—М—Б—П –љ–∞ –љ–µ–Є–Ј–≤–µ—Б—В–љ—Г—О –≤–µ–ї–Є—З–Є–љ—Г. –Ґ–Њ –µ—Б—В—М –≤—Б–µ –љ–µ–і–Њ—Б—В–∞—В–Ї–Є –Є–Ј–Љ–µ—А–µ–љ–Є—П –Т–У–Ф –≤ —Б–Њ—Б—В–Њ—П–љ–Є–Є ¬Ђ–Њ—В–Ї—А—Л—В–Њ–є –≥–Є–і—А–∞–≤–ї–Є—З–µ—Б–Ї–Њ–є —Б–Є—Б—В–µ–Љ—Л¬ї —Б –Ї–∞–ґ–і—Л–Љ —В–∞–Ї–Є–Љ –њ–Њ–≤—В–Њ—А–љ—Л–Љ –Є–Ј–Љ–µ—А–µ–љ–Є–µ–Љ —В–Њ–ї—М–Ї–Њ —Г—Б—Г–≥—Г–±–ї—П—О—В—Б—П. –Э–∞–њ—А–Є–Љ–µ—А, —В—А–∞–љ—Б–њ–∞–ї—М–њ–µ–±—А–∞–ї—М–љ—Л–є —В–Њ–љ–Њ–Љ–µ—В—А –Я–Є–ї–µ—Ж–Ї–Њ–≥–Њ –≤—Л–њ—Г—Б–Ї–∞ –†—П–Ј–∞–љ—Б–Ї–Њ–≥–Њ –њ—А–Є–±–Њ—А–љ–Њ–≥–Њ –Ј–∞–≤–Њ–і–∞ –≤ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –Ш–У–Ф вАФ 01 –Є 02 diathera –Є–Ј–Љ–µ—А—П–µ—В —Б—А–µ–і–љ–µ–µ –Т–У–Ф –њ–Њ—Б–ї–µ 2вАУ5 –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–є —И—В–Њ–Ї–∞ –љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Г —Б–Њ –≤—Б–µ–Љ–Є –≤—Л—В–µ–Ї–∞—О—Й–Є–Љ–Є –Є–Ј —Н—В–Њ–≥–Њ –Љ–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–Љ–Є –њ–Њ–≥—А–µ—И–љ–Њ—Б—В—П–Љ–Є –Є–Ј–Љ–µ—А–µ–љ–Є–є. –Я—А–∞–≤–і–∞, –њ–Њ—Б–ї–µ–і–љ—П—П –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є—П —В–Њ–љ–Њ–Љ–µ—В—А–∞ –Ш–У–Ф вАФ 03 diathera —Г–ґ–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –њ—А–Њ–≤–Њ–і–Є—В—М —В–Њ–ї—М–Ї–Њ –Њ–і–љ–Њ–Ї—А–∞—В–љ–Њ–µ –Є–Ј–Љ–µ—А–µ–љ–Є–µ –Т–У–Ф —З–µ—А–µ–Ј –≤–µ–Ї–Њ, —З—В–Њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ–≤—Л—И–∞–µ—В —В–Њ—З–љ–Њ—Б—В—М –Є–Ј–Љ–µ—А–µ–љ–Є—П.
–Я–Њ—Н—В–Њ–Љ—Г –≤—Б—П —Б–µ—А–Є—П —В–∞–Ї–Є—Е –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ—Л—Е —Н–Ї—Б–њ–µ—А–Є–Љ–µ–љ—В–Њ–≤ вАФ —Б –Є–Ј–Љ–µ—А–µ–љ–Є—П–Љ–Є 5 —А–∞–Ј –њ–Њ–і—А—П–і вАФ –Є –њ—А–Є–≤–µ–ї–∞ –∞–≤—В–Њ—А–Њ–≤ –Ї –љ–∞—Г—З–љ–Њ–Љ—Г –њ—А–Њ–≤–∞–ї—Г. –§–∞–Ї—В–Є—З–µ—Б–Ї–Є –Њ–љ–Є —Б–љ–∞—З–∞–ї–∞ ¬Ђ–≤—Л–і–∞–≤–Є–ї–Є –Є–Ј –≥–ї–∞–Ј–∞¬ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–є –Њ–±—К–µ–Љ –≤–Њ–і—П–љ–Є—Б—В–Њ–є –≤–ї–∞–≥–Є –Є –њ–Њ–ї—Г—З–Є–ї–Є ¬Ђ–љ–∞ –≤—Л—Е–Њ–і–µ¬ї –ї–Њ–ґ–љ—Л–є —А–µ–Ј—Г–ї—М—В–∞—В вАФ –њ–Њ–љ–Є–ґ–µ–љ–љ—Г—О —А–Є–≥–Є–і–љ–Њ—Б—В—М –§–Ю–У –≤ –≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –≥–ї–∞–Ј–∞—Е.
–Ш —В–µ–њ–µ—А—М —Б—В–Њ–Є—В –Њ—В–і–µ–ї—М–љ–Њ —Б–Ї–∞–Ј–∞—В—М –Њ –Ј–∞–±–ї—Г–ґ–і–µ–љ–Є–Є –Љ–љ–Њ–≥–Є—Е —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–Њ–≤ –≤–Њ –≤—Б–µ–Љ –Љ–Є—А–µ –Њ –≤–ї–Є—П–љ–Є–Є —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–∞ —Г—А–Њ–≤–µ–љ—М –Т–У–Ф. –Р–≤—В–Њ—А—Л —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –≤ –њ–ї–µ–љ—Г —Н—В–Њ–≥–Њ –Љ–Є—Д–∞ –Є —В–∞–Ї–ґ–µ –њ–Њ–њ—Л—В–∞–ї–Є—Б—М —Г—З–µ—Б—В—М –≤ —Б–≤–Њ–µ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —В–Њ–ї—Й–Є–љ—Г —А–Њ–≥–Њ–≤–Є—Ж—Л. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ —З–µ–Љ –±–Њ–ї—М—И–µ —В–Њ–ї—Й–Є–љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л, —В–µ–Љ –±–Њ–ї—М—И–µ –µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —В–Њ—З–љ–Њ—Б—В—М –Є–Ј–Љ–µ—А–µ–љ–Є–є –Т–У–Ф. –≠—В–Њ –Љ–Є—Д. –Т–Њ –≤—Б–µ—Е –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ–Њ–њ—Л—В–Ї–∞—Е –љ–∞–є—В–Є —В–∞–Ї—Г—О —Б–≤—П–Ј—М —Б—А–∞–≤–љ–Є–≤–∞—О—В—Б—П —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є–Ј–Љ–µ—А–µ–љ–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л —Б —А–µ–Ј—Г–ї—М—В–∞—В–∞–Љ–Є –Є–Ј–Љ–µ—А–µ–љ–Є—П –Т–У–Ф –Њ—В–Ї—А—Л—В—Л–Љ–Є –Є–ї–Є –Ј–∞–Ї—А—Л—В—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є. –Ф–∞–љ–љ—Л–µ –Њ–±–Њ–Є—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –Є–Ј–Љ–µ—А–µ–љ–Є—П —А–∞–Ј–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ (—В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –Є –і–∞–≤–ї–µ–љ–Є—П) –Љ–Њ–ґ–љ–Њ —Б—А–∞–≤–љ–Є–≤–∞—В—М —В–Њ–ї—М–Ї–Њ —Б —Г—З–µ—В–Њ–Љ –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–Є –Є–Ј–Љ–µ—А–µ–љ–Є–є –Ї–∞–ґ–і—Л–Љ –Є–Ј –љ–Є—Е, –њ—А–Є—З–µ–Љ –њ—А–Є –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–Љ —А–∞–≤–µ–љ—Б—В–≤–µ —А–Є–≥–Є–і–љ–Њ—Б—В–Є –Є —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є –≤ –Є—Б—Б–ї–µ–і—Г–µ–Љ—Л—Е –≥–ї–∞–Ј–∞—Е. –≠—В–Њ –Ј–∞–Ї–Њ–љ –Љ–µ—В—А–Њ–ї–Њ–≥–Є–Є –Є –≤–Њ–Њ–±—Й–µ –≥—А–∞–Љ–Њ—В–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є —З–µ–ї–Њ–≤–µ–Ї–∞.
–Ъ–Њ–≥–і–∞ –ґ–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Є–Ј—Г—З–∞—О—В —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ —А–∞–Ј–љ—Л–µ –≥–ї–∞–Ј–∞, –љ–∞–њ—А–Є–Љ–µ—А, —Б —А–∞–Ј–љ–Њ–є —А–Є–≥–Є–і–љ–Њ—Б—В—М—О –Є —Б —А–∞–Ј–љ—Л–Љ –Я–Ч–Ю –Є –і—А., –∞ —В–Њ—З–љ–Њ—Б—В—М –Є–Ј–Љ–µ—А–µ–љ–Є–є –љ–µ —Г—З–Є—В—Л–≤–∞–µ—В—Б—П, —В–Њ —Н—В–Њ —Г–ґ–µ —В—А—Г–і–љ–Њ –Њ—В–љ–µ—Б—В–Є –Ї –љ–∞—Г—З–љ—Л–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П–Љ. –Ш —Н—В–Њ –±–Њ–ї—М –≤—Б–µ–є –Љ–Є—А–Њ–≤–Њ–є –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є. –Ь—Л –Њ ¬Ђ—А–Њ–≥–Њ–≤–Є—З–љ–Њ–Љ –Љ–Є—Д–µ¬ї —В–∞–Ї–ґ–µ –њ–Є—Б–∞–ї–Є, –љ–Њ —Б–µ–є—З–∞—Б —Е–Њ—В–Є–Љ –љ–∞–њ–Њ–Љ–љ–Є—В—М —З–Є—В–∞—В–µ–ї—П–Љ, —З—В–Њ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ N. Feltgen et al. [1] –њ–Њ–Ї–∞–Ј–∞–ї–Њ: —В–Њ—З–љ–Њ—Б—В—М –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П —В–Њ–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Т–У–Ф —А–∞–Ј–љ—Л–Љ–Є —Б–њ–Њ—Б–Њ–±–∞–Љ–Є –Њ—В —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–µ –Ј–∞–≤–Є—Б–Є—В. –Я—А–Є —Н—В–Њ–Љ —Г—А–Њ–≤–µ–љ—М –Є—Б—В–Є–љ–љ–Њ–≥–Њ –Т–У–Ф —Н—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–Є –≥—А–∞–Љ–Њ—В–љ–Њ –Ї–Њ–љ—В—А–Њ–ї–Є—А–Њ–≤–∞–ї–Є —З–µ—А–µ–Ј –Є–≥–ї—Г –≤ –њ–µ—А–µ–і–љ–µ–є –Ї–∞–Љ–µ—А–µ –≥–ї–∞–Ј–∞. –Ш —Н—В–Њ—В —А–µ–Ј—Г–ї—М—В–∞—В –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ј–∞–Ї–Њ–љ–∞–Љ –Љ–µ—Е–∞–љ–Є–Ї–Є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –ї—О–±–Њ–µ —Б–Є–ї–Њ–≤–Њ–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є–µ –љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Г —Б–Љ–Њ–ґ–µ—В —Б–Љ–µ—Б—В–Є—В—М –≤–љ—Г—В—А—М –≥–ї–∞–Ј–∞ —В–Њ–ї—М–Ї–Њ —В–Њ—В –Њ–±—К–µ–Љ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–є –ґ–Є–і–Ї–Њ—Б—В–Є, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–Ј–≤–Њ–ї–Є—В —Б–і–µ–ї–∞—В—М –њ–Њ–і–∞—В–ї–Є–≤–Њ—Б—В—М —Б–Ї–ї–µ—А—Л. –Ґ–Њ –µ—Б—В—М –≥–Њ–≤–Њ—А–Є—В—М –Њ –≤–ї–Є—П–љ–Є–Є —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –љ–∞ —В–Њ—З–љ–Њ—Б—В—М –Є–Ј–Љ–µ—А–µ–љ–Є—П –Т–У–Ф –±–µ–Ј —Г—З–µ—В–∞ —В–µ–Ї—Г—Й–µ–є —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л –Є –њ–Њ–≥—А–µ—И–љ–Њ—Б—В–µ–є –Є—Е –Є–Ј–Љ–µ—А–µ–љ–Є–є –љ–µ–Ї–Њ—А—А–µ–Ї—В–љ–Њ.
–Р–≤—В–Њ—А—Л —Б—В–∞—В—М–Є —В–∞–Ї–ґ–µ –њ–Њ–ї–∞–≥–∞—О—В, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Т–У–Ф —Б–µ–≥–Њ–і–љ—П —П–≤–ї—П–µ—В—Б—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –Ю–£–У. –°–µ–≥–Њ–і–љ—П –њ—А–Є—Е–Њ–і–Є—В—Б—П –≤ —Н—В–Њ–Љ —Б–Є–ї—М–љ–Њ —Б–Њ–Љ–љ–µ–≤–∞—В—М—Б—П. –£–ґ–µ —Б—В–∞–ї–Њ —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є –љ–∞–Є–±–Њ–ї–µ–µ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ—Л–є –њ—Г—В—М –±–Њ—А—М–±—Л —Б –Ю–£–У вАФ —Н—В–Њ —А–∞–Ј—А–∞–±–Њ—В–Ї–∞ —Б–њ–Њ—Б–Њ–±–Њ–≤ —Б–љ–Є–ґ–µ–љ–Є—П —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ –µ–µ —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є (—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є) –і–ї—П –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–∞ –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ—Л—Е —Б—В—А—Г–Ї—В—Г—А, –∞ —В–∞–Ї–ґ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —Б–Ї–ї–Њ–љ–љ–Њ—Б—В–Є –Ф–Ч–Э –Ї —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є (—Б–љ–Є–ґ–µ–љ–Є–µ –µ–≥–Њ –њ–Њ–і–∞—В–ї–Є–≤–Њ—Б—В–Є). –Ю–±–∞ —Н—В–Є—Е –њ—Г—В–Є –Љ–Њ–≥—Г—В –±—Л—В—М –Ј–∞–і–µ–є—Б—В–≤–Њ–≤–∞–љ—Л –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ.
–Т 2005 –≥. –±—Л–ї –њ—А–µ–і–ї–Њ–ґ–µ–љ –±–Є–Њ–Љ–µ—Е–∞–љ–Є–Ї–∞–Љ–Є –Є —Г—Б–њ–µ—И–љ–Њ –∞–њ—А–Њ–±–Є—А–Њ–≤–∞–љ –≤ –Ї–ї–Є–љ–Є–Ї–µ –Ь–Ю–Э–Ш–Ъ–Ш –њ–Њ–і –Њ–±—Й–Є–Љ —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–Њ–Љ –њ—А–Њ—Д–µ—Б—Б–Њ—А–∞ –Р.–Р. –†—П–±—Ж–µ–≤–Њ–є –Љ–µ—В–Њ–і —Б–љ–Є–ґ–µ–љ–Є—П —А–Є–≥–Є–і–љ–Њ—Б—В–Є —Б–Ї–ї–µ—А—Л –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –ї–∞–Ј–µ—А–љ–Њ–є –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–µ–є —Б–Ї–ї–µ—А—Н–Ї—В–Њ–Љ–Є–Є –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–љ–Њ–≥–Њ, —Б–∞–Љ–Њ–≥–Њ –ґ–µ—Б—В–Ї–Њ–≥–Њ —Б–ї–Њ—П —Б–Ї–ї–µ—А—Л [35, 36]. –Э–Њ, –±–µ–Ј—Г—Б–ї–Њ–≤–љ–Њ, –і–ї—П –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б–ї—Г—З–∞–µ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Б–Њ–Ј–і–∞—В—М –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–µ —В–µ—Е–љ–Њ–ї–Њ–≥–Є–Є –њ–Њ —Г–Љ–µ–љ—М—И–µ–љ–Є—О –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–є —Б–Ї–ї–Њ–љ–љ–Њ—Б—В–Є –Ф–Ч–Э –Ї —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є [37]. –Ю–і–Є–љ –Є–Ј —В–∞–Ї–Є—Е —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е —Б–њ–Њ—Б–Њ–±–Њ–≤ –њ—А–µ–і–ї–Њ–ґ–Є–ї–Є –µ—Й–µ –≤ 1996 –≥. –±–Є–Њ–Є–љ–ґ–µ–љ–µ—А—Л [38]. –≠—В–Њ —Б–њ–Њ—Б–Њ–± –Ј–∞–Ї–∞—З–Є–≤–∞–љ–Є—П –Є–љ–µ—А—В–љ–Њ–≥–Њ –±–Є–Њ–њ–Њ–ї–Є–Љ–µ—А–∞ –≤ —Б—В—А—Г–Ї—В—Г—А—Л –Ф–Ч–Э, –Ї–Њ–≥–і–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ф–Ч–Э –њ—А–Њ—В–Є–≤–Њ—Б—В–Њ—П—В—М —Н–Ї—Б–Ї–∞–≤–∞—Ж–Є–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В.
–Я–Њ—Б–ї–µ–і–љ–µ–µ, —З—В–Њ —Е–Њ—З–µ—В—Б—П —Б–Ї–∞–Ј–∞—В—М –њ–Њ –њ–Њ–≤–Њ–і—Г —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є, вАФ ¬Ђ–љ–∞—Г–Ї–Њ–Њ–±—А–∞–Ј–љ–Њ–µ¬ї –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –∞–≤—В–Њ—А–∞–Љ–Є ¬Ђ—Б—А–µ–і–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ –±–Њ–ї—М–љ–Є—Ж–µ¬ї. –≠—В–∞ —П–≤–љ–∞—П –Њ—И–Є–±–Ї–∞ –≤—Л—В–µ–Ї–∞–µ—В –Є–Ј-–Ј–∞ –љ–µ–њ–Њ–љ–Є–Љ–∞–љ–Є—П –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —Б—В–∞—А–µ–љ–Є—П –њ—А–Є –Ю–£–У. –Я–Њ—Б–Ї–Њ–ї—М–Ї—Г –њ—А–Њ—Ж–µ—Б—Б—Л —Б—В–∞—А–µ–љ–Є—П –њ—А–Є –Т–Ю–У –Є –Ю–£–У –љ–∞–њ—А—П–Љ—Г—О —Б–≤—П–Ј–∞–љ—Л —Б –њ–µ—А–Є–Њ–і–∞–Љ–Є –ґ–Є–Ј–љ–Є —З–µ–ї–Њ–≤–µ–Ї–∞, –≥—А—Г–њ–њ—Л –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –і–Њ–ї–ґ–љ—Л —Б—А–∞–≤–љ–Є–≤–∞—В—М—Б—П —В–Њ–ї—М–Ї–Њ –≤–љ—Г—В—А–Є –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –Є–љ—В–µ—А–≤–∞–ї–Њ–≤ –ґ–Є–Ј–љ–Є, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ—Л—Е –Т—Б–µ–Љ–Є—А–љ–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–µ–є –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Т–Ю–У –Є –Ю–£–У –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–Њ–і–Є—В—М —В–Њ–ї—М–Ї–Њ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –і–Є–∞–њ–∞–Ј–Њ–љ–∞—Е –љ–Њ—А–Љ—Л –Т–У–Ф –њ–Њ –Р.–Я. –Э–µ—Б—В–µ—А–Њ–≤—Г [25] –Є–ї–Є –≤ –љ–µ–і–∞–≤–љ–Њ –≤—Л—П–≤–ї–µ–љ–љ—Л—Е –≤–њ–µ—А–≤—Л–µ –≤ –Љ–Є—А–Њ–≤–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ —И–µ—Б—В–Є –Ј–Њ–љ–∞—Е —Г—А–Њ–≤–љ—П –Т–У–Ф, –∞–і–µ–Ї–≤–∞—В–љ—Л—Е —А–Є–≥–Є–і–љ–Њ—Б—В–Є –≥–ї–∞–Ј–∞ [6, 21].
–Т –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Љ—Л –њ–Њ–ґ–µ–ї–∞–µ–Љ —Г–і–∞—З–Є –∞–≤—В–Њ—А–∞–Љ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ–Љ–Њ–є —Б—В–∞—В—М–Є –≤ –њ–Њ–ї—Г—З–µ–љ–Є–Є —Б–ї–µ–і—Г—О—Й–µ–≥–Њ –≥—А–∞–љ—В–∞ –і–ї—П –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є—П –Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –≤ –Ї–Њ—В–Њ—А—Л—Е –Њ–љ–Є, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, —Б–Љ–Њ–≥—Г—В —Г—З–µ—Б—В—М —Е–Њ—В—П –±—Л —З–∞—Б—В—М –љ–∞—И–Є—Е –±–ї–∞–≥–Њ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е –Ј–∞–Љ–µ—З–∞–љ–Є–є –њ–Њ —Б—Г—Й–µ—Б—В–≤—Г.
–°–≤–µ–і–µ–љ–Є—П –Њ–± –∞–≤—В–Њ—А–∞—Е:
–Ъ–Њ—И–Є—Ж –Ш–≤–∞–љ –Э–Є–Ї–Њ–ї–∞–µ–≤–Є—З вАФ –Є–љ–ґ–µ–љ–µ—А-–Љ–µ—Е–∞–љ–Є–Ї, –±–Є–Њ–Љ–µ—Е–∞–љ–Є–Ї, –≥–µ–љ–µ—А–∞–ї—М–љ—Л–є –і–Є—А–µ–Ї—В–Њ—А –Ю–Ю–Ю ¬Ђ–Я–Є—В–µ—А–Ї–Њ–Љ-–°–µ—В–Є / –Ь–° –Ъ–Њ–љ—Б—Г–ї—М—В–∞—Ж–Є–Њ–љ–љ–∞—П –≥—А—Г–њ–њ–∞¬ї; 194223, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –Ъ—Г—А—З–∞—В–Њ–≤–∞, –і. 1; ORCID iD 0000-0002-7920-9469.
–°–≤–µ—В–ї–Њ–≤–∞ –Ю–ї—М–≥–∞ –Т–∞–ї–µ–љ—В–Є–љ–Њ–≤–љ–∞ вАФ –і.–Љ.–љ., –і–Њ—Ж–µ–љ—В, –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є —Б –Ї–ї–Є–љ–Є–Ї–Њ–є –Є–Љ. –њ—А–Њ—Д–µ—Б—Б–Њ—А–∞ –Ѓ.–°. –Р—Б—В–∞—Е–Њ–≤–∞ –§–У–С–Ю–£ –Т–Ю –Я–°–Я–±–У–Ь–£ –Є–Љ. –∞–Ї–∞–і. –Ш.–Я. –Я–∞–≤–ї–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 197022, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –Ы—М–≤–∞ –Ґ–Њ–ї—Б—В–Њ–≥–Њ, –і. 6вАУ8; –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –§–У–С–Ю–£ –Т–Ю –°–Ч–У–Ь–£ –Є–Љ. –Ш.–Ш. –Ь–µ—З–љ–Є–Ї–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 191015, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –Ъ–Є—А–Њ—З–љ–∞—П, –і. 41; ORCID iD 0000-0001-7777-1901.
–†—П–±—Ж–µ–≤–∞ –Р–ї–ї–∞ –Р–ї–µ–Ї—Б–µ–µ–≤–љ–∞ вАФ –і.–Љ.–љ., –њ—А–Њ—Д–µ—Б—Б–Њ—А, –Ј–∞—Б–ї—Г–ґ–µ–љ–љ—Л–є –≤—А–∞—З –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є, –≥–ї–∞–≤–љ—Л–є –≤–љ–µ—И—В–∞—В–љ—Л–є —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В-–Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥ –¶–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ —Д–µ–і–µ—А–∞–ї—М–љ–Њ–≥–Њ –Њ–Ї—А—Г–≥–∞ –†–§, –њ—А–Њ—Д–µ—Б—Б–Њ—А –Ї–∞—Д–µ–і—А—Л –≥–ї–∞–Ј–љ—Л—Е –±–Њ–ї–µ–Ј–љ–µ–є –§–У–С–Э–£ ¬Ђ–Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Э–Ш–Ш –Њ–±—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –Ј–і–Њ—А–Њ–≤—М—П –Є–Љ–µ–љ–Є –Э.–Р. –°–µ–Љ–∞—И–Ї–Њ¬ї; 105064, –†–Њ—Б—Б–Є—П, –≥. –Ь–Њ—Б–Ї–≤–∞, —Г–ї. –Т–Њ—А–Њ–љ—Ж–Њ–≤–Њ –Я–Њ–ї–µ, –і. 12, —Б—В—А. 1; ORCID iD 0000-0002-1104-4047.
–У—Г—Б–µ–≤–∞ –Ь–∞—А–Є–љ–∞ –У–µ–љ–љ–∞–і—М–µ–≤–љ–∞ вАФ –≤—А–∞—З-–Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥ –≤—Л—Б—И–µ–є –Ї–≤–∞–ї–Є—Д–Є–Ї–∞—Ж–Є–Њ–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –ї–µ—З–µ–±–љ–Њ-–і–Є–∞–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Ж–µ–љ—В—А–∞ –Љ–µ–і–Є–Ї–Њ-—Б–∞–љ–Є—В–∞—А–љ–Њ–є —З–∞—Б—В–Є –У–£–Я ¬Ђ–Т–Њ–і–Њ–Ї–∞–љ–∞–ї –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥–∞¬ї; 196084, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Є–є –њ—А., –і. 103, –Ї–Њ—А–њ. 2; ORCID iD 0009-0007-5808-1340.
–≠–≥–µ–Љ–±–µ—А–і–Є–µ–≤ –Ь–∞–Ї—Б–∞—В –С–∞–Ј–∞—А–Ї—Г–ї–Њ–≤–Є—З вАФ –Ї.–Љ.–љ., –Ј–∞—Б–ї—Г–ґ–µ–љ–љ—Л–є –≤—А–∞—З –†–µ—Б–њ—Г–±–ї–Є–Ї–Є –Ъ—Л—А–≥—Л–Ј—Б—В–∞–љ, –Ј–∞–≤–µ–і—Г—О—Й–Є–є –≥–ї–∞–Ј–љ—Л–Љ –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ –І—Г–є—Б–Ї–Њ–є –Њ–±–ї–∞—Б—В–љ–Њ–є –Њ–±—К–µ–і–Є–љ–µ–љ–љ–Њ–є –±–Њ–ї—М–љ–Є—Ж—Л; 720051, –†–µ—Б–њ—Г–±–ї–Є–Ї–∞ –Ъ—Л—А–≥—Л–Ј—Б—В–∞–љ, –≥. –С–Є—И–Ї–µ–Ї, —Г–ї. –°–∞—А–∞—В–Њ–≤—Б–Ї–∞—П, –і. 10/3; ORCID iD 0009-0007-8333-6149.
–С–∞–Ї—И–Є–љ—Б–Ї–Є–є –Я–µ—В—А –Я–µ—В—А–Њ–≤–Є—З вАФ –і.–Љ.–љ., –Ј–∞–≤–µ–і—Г—О—Й–Є–є –Њ—В–і–µ–ї–µ–љ–Є–µ–Љ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є–Є –У–С–£–Ч –Ь–Ю ¬Ђ–Т–†–Ъ–С¬ї; 142700, –†–Њ—Б—Б–Є—П, –≥. –Т–Є–і–љ–Њ–µ, —Г–ї. –Ч–∞–≤–Њ–і—Б–Ї–∞—П, –і. 15; ORCID iD 0009-0005-1982-2279.
–Ч–∞—Б–µ–µ–≤–∞ –Ь–∞—А–Є–љ–∞ –Т–∞—Б–Є–ї—М–µ–≤–љ–∞ вАФ –Ї.–Љ.–љ., —Б—В–∞—А—И–Є–є –ї–∞–±–Њ—А–∞–љ—В –Ї–∞—Д–µ–і—А—Л —Б–Ї–Њ—А–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –њ–Њ–Љ–Њ—Й–Є –Є —Е–Є—А—Г—А–≥–Є–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –§–У–С–Ю–£ –Т–Ю –Я–°–Я–±–У–Ь–£ –Є–Љ. –∞–Ї–∞–і. –Ш.–Я. –Я–∞–≤–ї–Њ–≤–∞ –Ь–Є–љ–Ј–і—А–∞–≤–∞ –†–Њ—Б—Б–Є–Є; 197022, –†–Њ—Б—Б–Є—П, –≥. –°–∞–љ–Ї—В-–Я–µ—В–µ—А–±—Г—А–≥, —Г–ї. –Ы—М–≤–∞ –Ґ–Њ–ї—Б—В–Њ–≥–Њ, –і. 6вАУ8; ORCID iD 0009-0005-3279-0099.
–Ъ–Њ–љ—В–∞–Ї—В–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П: –Ъ–Њ—И–Є—Ж –Ш–≤–∞–љ –Э–Є–Ї–Њ–ї–∞–µ–≤–Є—З, e-mail: petercomink@bk.ru.
–Я—А–Њ–Ј—А–∞—З–љ–Њ—Б—В—М —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –і–µ—П—В–µ–ї—М–љ–Њ—Б—В–Є: –љ–Є–Ї—В–Њ –Є–Ј –∞–≤—В–Њ—А–Њ–≤ –љ–µ –Є–Љ–µ–µ—В —Д–Є–љ–∞–љ—Б–Њ–≤–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –Љ–∞—В–µ—А–Є–∞–ї–∞—Е –Є–ї–Є –Љ–µ—В–Њ–і–∞—Е.
–Ъ–Њ–љ—Д–ї–Є–Ї—В –Є–љ—В–µ—А–µ—Б–Њ–≤ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В.
–°—В–∞—В—М—П –њ–Њ—Б—В—Г–њ–Є–ї–∞ 21.08.2022.
–Я–Њ—Б—В—Г–њ–Є–ї–∞ –њ–Њ—Б–ї–µ —А–µ—Ж–µ–љ–Ј–Є—А–Њ–≤–∞–љ–Є—П 13.09.2022.
–Я—А–Є–љ—П—В–∞ –≤ –њ–µ—З–∞—В—М 06.10.2022.
About the authors:
Ivan N. Koshits вАФ mechanical engineer, biomechanist, General Director of LLC вАЬPitercom-Networks/MS Consulting GroupвАЭ; 1, Kurchatov str., St. Petersburg, 194223, Russian Federation, ORCID iD 0000-0002-7920-9469.
Olga V. Svetlova вАФ Dr. Sc. (Med.), Associate Professor, professor of the Professor Yu.S. Astakhov Department of Ophthalmology with the Clinic, I.P. Pavlov First Saint-Petersburg State Medical University; 6-8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; professor of the Department of Ophthalmology, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-7777-1901.
Alla A. Ryabtseva вАФ Dr. Sc. (Med.), Professor, Honored Doctor of the Russian Federation, chief freelance ophthalmologist of the Central Federal District of Russian Federation, professor of the Department of Eye Diseases, N.A. Semashko National Research Institute of Public Health; 12-1, Vorontsovo Pole str., Moscow, 105064, Russian Federation; ORCID iD 0000-0002-1104-4047.
Marina G. Guseva вАФ ophthalmologist, Medical and Diagnostic Center of the Primary Healthcare Unit of the Vodokanal of St. Petersburg; 103 bldg. 2, Moskovsky av., St. Petersburg, 196084, Russian Federation; ORCID iD 0009-0007-5808-1340.
Maksat B. Egemberdiev вАФ C. Sc. (Med.), Honored Doctor of the Republic of Kyrgyzstan, Head of the Eye Department of the Chui Regional United Hospital; 10/3, Saratovskaya str., Bishkek, 720051, Republic of Kyrgyzstan; ORCID iD 0009-0007-8333-6149.
Petr P. Bakshinsky вАФ Dr. Sc. (Med.), Head of the Department of Ophthalmology, Vidnoe District Clinical Hospital; 15, Zavodskaya str., Vidnoye, 142700, Russian Federation; ORCID iD 0009-0005-1982-2279.
Marina V. Zaseeva вАФ C. Sc. (Med.), senior laboratory assistant of the Department of Emergency Medical Care and Surgery of Injuries, I.P. Pavlov First Saint-Petersburg State Medical University; 6-8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0009-0005-3279-0099.
Contact information: Koshits Ivan Nikolaevich, e-mail: petercomink@bk.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 21.08.2022.
Revised 13.09.2022.
Accepted 06.10.2022.












