Введение
Достижение целевого ВГД с помощью монокомпонентной или комбинированной терапии аналогами простагландина, β-адреноблокаторами, ингибиторами карбоангидразы, а также адреномиметиками является первым, основным и, в идеале, единственным этапом лечения глаукомы. Недостаточный эффект консервативного и лазерного методов служит показанием к применению хирургических приемов нормализации офтальмотонуса [1–3]. Закономерно возникает вопрос об ожидаемом гипотензивном эффекте вмешательства после многолетней фармакологической нагрузки, а иногда и предшествующих операций по поводу глаукомы [2–4].
В связи с этим целью нашего исследования стал анализ гипотензивного эффекта синустрабекулэктомии (СТЭ), выполняемой в рамках «каскадного» алгоритма лечения глаукомы.
Материал и методы
В проспективном интервенционном одноцентровом когортном открытом исследовании приняли участие 443 последовательно включенных пациента (168 мужчин и 275 женщин), находившихся в 2016–2020 гг. на лечении в СПб ГБУЗ «ГМПБ № 2» (Санкт-Петербург, Россия) с различными клинико-патогенетическими формами некомпенсированной первичной открытоугольной глаукомы (ПОУГ) [4]. Профиль пациентов, составивших исследуемую группу, представлен в одной из наших предыдущих статей [5].
Все участники исследования подписали информированное согласие на обследование и хирургическое лечение.
Критериями включения явились возраст пациента старше 35 лет, наличие любой стадии некомпенсированной ПОУГ (в том числе ранее оперированной), требующей хирургического лечения.
Учитывая то, что современные технологии факоэмульсификации через чисто роговичный разрез не затрудняют последующую хирургическую нормализацию офтальмотонуса [2], артифакическую глаукому мы рассматривали как первичную.
Критерием невключения служила первичная закрытоугольная глаукома и вторичная глаукома, критерием исключения являлась неспособность пациентов соблюдать требования протокола исследования на протяжении минимум 6 мес.
В качестве гипотензивной операции использовалась СТЭ в модификациях, повышающих ее эффективность и безопасность [7–11].
Послеоперационное наблюдение осуществлялось на протяжении 6–24 мес. через каждые полгода. Контрольное обследование включало в себя визометрию, тонометрию по Маклакову, кинетическую периметрию по Гольдману, офтальмобиомикроскопию с использованием высокодиоптрийных асферических линз. Результаты гипотензивной операции оценивали по принятым офтальмологическим сообществом критериям «полного успеха» и «частичного успеха», а также «частичной неудачи» и «полной неудачи» [5, 12, 13].
Статистический анализ полученных данных проведен с помощью программ Microsoft Exсel и SPSS. Нормальность распределения в исследуемой группе оценена с использованием критерия Шапиро — Уилка. Данные, имеющие ненормальное распределение, представлены в виде Me [Q1; Q3] и Xmin–Xmax — границы вариации. При сравнении нескольких выборок отличающихся от нормального распределения параметров использовали ранговый аналог дисперсионного анализа Н-критерий Краскела — Уоллиса, для сравнения независимых выборок — U-критерий Манна — Уитни, а для зависимых переменных — критерий Уилкоксона. Для проверки нулевой гипотезы использовали двусторонние критерии. Различия считали статистически значимыми при уровне значимости p≤0,05.
Результаты и обсуждение
В результате хирургического лечения пациентов (по данным последнего контрольного осмотра 443 человек) «полный успех» достигнут в 305 (68,9%) случаях, «частичный успех» — в 118 (26,6%), «полная неудача» отмечена в 20 (4,5%) случаях, что соотносится с показателями, достигнутыми С.Ю. Петровым и соавт. [14].
Чаще всего «полный успех» сопутствовал лечению ПОУГ (305; 69,0%), в том числе псевдоэксфолиативной (121/184 (65,8%)). Более низким данный показатель оказался среди пациентов с артифакической (37/66 (56,0%)) и простой первичной ранее оперированной (12/25 (48,0%)) глаукомой.
По вероятности достижения «частичного успеха» лидирующее положение заняла подгруппа пациентов с псевдоэксфолиативной (55/184 (29,9%)), артифакической (17/66 (25,7%)) и простой первичной ранее оперированной (7/25 (28,0%)) глаукомой.
«Полная неудача» лечения в большинстве случаев ассоциировалась с артифакической (12/66 (18,3%)) и первичной простой ранее оперированной глаукомой (6/25 (24,0%)). Во всех 20 случаях причиной неэффективности хирургического лечения явилась утрата фильтрации.
Через 6 мес. после операции ВГД у пациентов, независимо от исхода операции, снижалось статистически значимо (р=0,0001) (табл. 1).

Медиана ВГД пациентов группы в целом через 12 и 24 мес. после операции, независимо от ее исхода, составила те же 16,00 мм рт. ст. (в обоих случаях р=0,0001), что свидетельствовало о сохранении существенного снижения офтальмотонуса и наличии значимого гипотензивного эффекта у пациентов группы в целом на протяжении 2 лет наблюдения (см. табл. 1).
В течение первых 6 мес. после успешной СТЭ медиана давления статистически значимо снизилась (р=0,0001) (табл. 2).
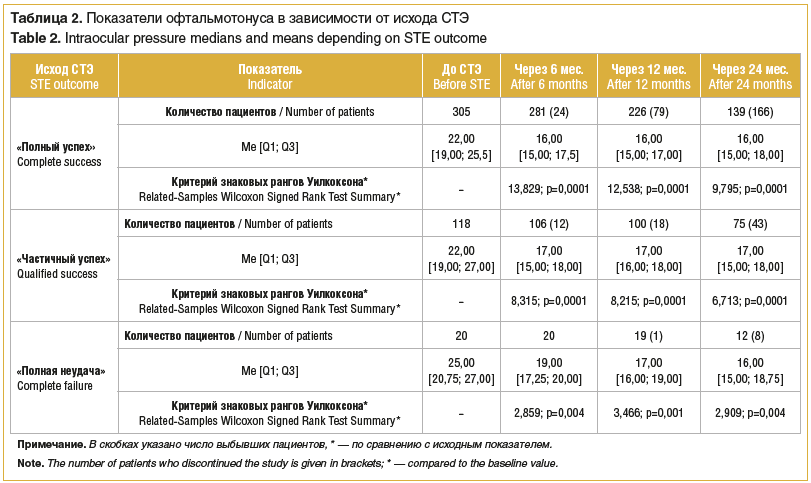
Через 12 и 24 мес. после операции сохранялось статистически значимое снижение ВГД (р=0,0001) по сравнению с исходным (см. табл. 2).
В 118 (26,6%) случаях «частичного успеха» СТЭ для нормализации ВГД потребовалось возобновление инстилляций аналогов простагландина, β-адреноблокаторов и ингибиторов карбоангидразы в различных комбинациях. В течение первых 6 мес. после операции ВГД у этих пациентов снизилось статистически значимо по сравнению с исходным (р=0,0001) (см. табл. 2). Через 12 и 24 мес. после операции медиана ВГД также была статистически значимо ниже исходной (р=0,0001 в обоих случаях).
Таким образом, хирургическое лечение привело к нормализации ВГД у 305/443 (68,9%) пациентов исследуемой группы, а в сочетании с послеоперационной гипотензивной терапией — у 423/443 (95,5%). При простой ПОУГ этот показатель составил 397/416 (95,4%), при псевдоэксфолиативной — 176/184 (95,6%). Ранее перенесенные вмешательства по поводу глаукомы уменьшили это значение до 19/25 (76,0%).
Офтальмотонус у пациентов, чье лечение окончилось «полной неудачей», характеризовался наиболее высокими абсолютными значениями как до, так и спустя 6 мес. после операции. Тем не менее ВГД снизилось статистически значимо по сравнению с исходным (р=0,004). Утрата фильтрации, наступившая к концу 1-го года наблюдения, сопровождалась еще большим снижением медианы ВГД (р=0,001). При регистрации операции как неудачной после 2 лет наблюдения снижение ВГД по сравнению с исходным было статистически значимым (р=0,004).
Сравнение подгрупп «полного успеха» и «частичного успеха», а также «полной неудачи» по уровню офтальмотонуса до операции не выявило статистически значимых различий во всех трех парах (критерий Краскела — Уоллиса для независимых выборок равен 4,213, значимость — 0,122). В связи с этим попарное сравнение подгрупп не проводилось. Однако, как уже упоминалось, исходный уровень офтальмотонуса у пациентов, впоследствии составивших подгруппу «полной неудачи», был самым высоким.
Сопоставление ВГД в подгруппах «полного успеха» и «частичного успеха», а также «полной неудачи» через 6 мес. после операции выявило статистически значимые различия (критерий Краскела — Уоллиса для независимых выборок 29,191; р=0,0001). Попарное сравнение подгрупп «полного успеха» и «частичного успеха», «полного успеха» и «полной неудачи», а также «частичного успеха» и «полной неудачи» определило U-критерий Манна — Уитни равным 38,147, 132,654 и 94,507, его значимость с поправкой Бонферрони — 0,0012, 0,0001 и 0,003 соответственно.
Сопоставление ВГД в подгруппах «полного успеха» и «частичного успеха», а также «полной неудачи» через 1 год после операции выявило статистически значимые различия (критерий Краскела — Уоллиса 17,563; р=0,0001). При попарном сравнении подгрупп «полного успеха» и «частичного успеха», «полного успеха» и «полной неудачи», а также «частичного успеха» и «полной неудачи» критерий U-критерий Манна — Уитни оказался равным 46,055, 50,582 и 4,527, его значимость с поправкой Бонферрони — 0,0001, 0,095 и 1,000 соответственно.
Сопоставление ВГД в подгруппах «полного успеха» и «частичного успеха», а также «полной неудачи» через 2 года после операции выявило статистически незначимые различия (критерий Краскела — Уоллиса 1,817; р=0,403). В связи с этим попарное сравнение подгрупп не проводилось.
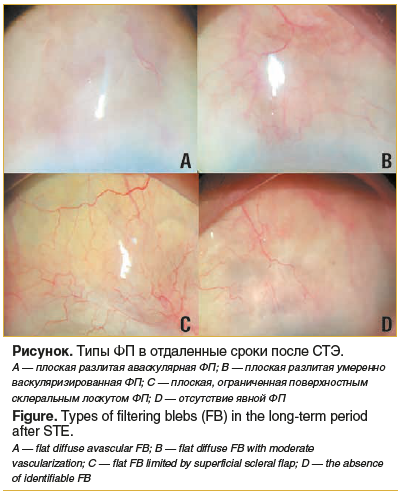
В отдаленном послеоперационном периоде у 257 (58%) человек в зоне гипотензивного вмешательства сформировалась плоская разлитая аваскулярная фильтрационная подушка (ФП), представленная на рисунке А. Второе место по частоте встречаемости заняла представленная на рисунке B плоская разлитая умеренно васкуляризированная ФП (143 (32,3%) пациента), третье (20 (4,5%) пациентов) — плоская ограниченная поверхностным склеральным лоскутом ФП (см. рисунок, С). Следует отметить, что у 23 (5,2%) прооперированных пациентов было зафиксировано отсутствие явной ФП (см. рисунок, D).
К хирургической нормализации ВГД при глаукоме, как правило, прибегают, исчерпав возможности консервативного и лазерного лечения. В редких ситуациях (впервые выявленная далеко зашедшая стадия болезни, высокие исходные цифры ВГД, не позволяющие рассчитывать на медикаментозное снижение офтальмотонуса, а также низкая приверженность лечению) СТЭ становится первым этапом лечения глаукомы [2, 4, 6, 15]. Очевидно, что эффективность конъюнктивальной хирургии в этих клинических ситуациях может существенно разниться.
Действительно, если вероятность успеха СТЭ у пациента с практически интактной глазной поверхностью достигает 90% [17], то 3-летнее комбинированное лечение глаукомы консервантными β-адреноблокаторами, холино- и адреномиметиками снижает вероятность успеха практически вдвое — до 45% [16–18]. Продление терапии до 6 лет в 5 раз повышает риск утраты фильтрации по сравнению с пациентами, у которых длительность консервативного лечения составила в среднем 2 мес. [19]. Свой негативный вклад вносит неизбежная послеоперационная утрата фильтрации, ежегодно увеличивающая на 10% удельный вес пациентов с «полной неудачей» хирургического лечения [20].
Анализ публикаций последних лет продемонстрировал сохранение этих тенденций. Так, из 57 пациентов, получавших до СТЭ максимальную гипотензивную терапию, через 1 год после операции «полный успех» сохранился лишь у 27 (47,0%), «частичный успех» — у 12 (21,0%), «полная неудача» по причине утраты фильтрации отмечалась в 18 (32,0%) случаях [21]. Каждый 4-й британский пациент, перенесший СТЭ с использованием митомицина С по поводу впервые выявленной далеко зашедшей стадии глаукомы, был вынужден возобновить гипотензивную терапию в течение 24 мес. после операции [15].
На этом фоне полученные нами (А.В. Антонова, В.П. Николаенко) результаты хирургического лечения пациентов после 3–6 и более лет комбинированной терапии глаукомы являются весьма репрезентативными и наглядно демонстрируют очевидный гипотензивный потенциал СТЭ, сохраняющийся даже в нынешних условиях интенсивного фармакологического воздействия на глазную поверхность.
Для достижения подобных результатов необходимо учитывать особенности взаимоотношения основных гипотензивных молекул с глазной поверхностью, не выходить за пределы безопасной для покровных тканей глаза длительности 3-компонентной (!) терапии, а также осуществлять тщательное периоперационное сопровождение конъюнктивальной хирургии глаукомы [22]. Принципиально важную роль играет оценка морфологии ФП на протяжении первых 3 мес. послеоперационного периода, сопровождающихся ремоделяцией и инволюцией новообразованной соединительной ткани в зоне вмешательства, чреватой утратой фильтрации. Более подробному изложению перечисленных выше условий успеха СТЭ будет посвящена одна из наших ближайших публикаций.
Следует отметить, что в силу юридических, финансовых и организационных сложностей конъюнктивальная хирургия глаукомы осуществлялась без периоперационного использования 5-фторурацила и митомицина С, что тем не менее позволило обеспечить эффективную субконъюнктивальную фильтрацию в подавляющем большинстве случаев. Достигнутые результаты хирургического лечения иллюстрируют сопоставимую с применением антиметаболитов эффективность использовавшегося нами алгоритма послеоперационного ведения пациентов. Он включает модуляцию ранозаживления комбинацией топических глюкокортикоидов и нестероидных противовоспалительных препаратов, транспальпебральный массаж глазного яблока, при необходимости лазерный лизис склеральных нейлоновых швов и субконъюнктивальный нидлинг.
Планировавшаяся нами в 2016 г. 5-летняя длительность наблюдения за оперированными пациентами в итоге сократилась до 2 лет в связи с 4-кратным на протяжении 2020–2022 гг. изменением профиля учреждения на инфекционный стационар для лечения пациентов с COVID-19. Справедливости ради следует отметить, что аналогичное по тематике британское исследование также ограничилось 24-месячным наблюдением за прооперированными, тем не менее оказавшимся достаточным для получения ответов на поставленные перед исследователями вопросы [15].
В нашу группу вошло относительно небольшое количество (25) ранее оперированных по поводу глаукомы пациентов, что объясняется разочаровывающими результатами повторных СТЭ. В связи с этим предпринимавшиеся на начальных этапах попытки нормализации офтальмотонуса путем реопераций фильтрующего типа были прекращены, безоговорочно уступив место имплантации клапана Ахмеда.
Установлено, что исходный уровень офтальмотонуса не коррелирует с результатами СТЭ и, соответственно, не может выступать в роли фактора, прогнозирующего исход вмешательства. Можно лишь говорить о тенденции к более высоким цифрам давления среди пациентов, в последующем сформировавших подгруппу «полной неудачи».
Статистически значимое снижение ВГД по сравнению с исходным уровнем было достигнуто у всех (даже составивших подгруппу «полной неудачи») пациентов во всех трех (6, 12 и 24 мес.) контрольных точках исследования. Но наиболее выраженным и стабильным снижением офтальмотонуса на протяжении 2 лет наблюдения сопровождался «полный успех» СТЭ, что может быть объяснено только одним обстоятельством — наилучшим среди 3 подгрупп исходным состоянием глазной поверхности и, как итог, формированием оптимальной — обширной разлитой — ФП.
Сравнительный анализ снижения ВГД (в зависимости от квалифицированного как «полный успех» и «частичный успех», а также «полная неудача» результата операции) продемонстрировал значимое преимущество пациентов с «полным успехом» в течение 1 года после вмешательства. Спустя 2 года после трабекулэктомии эти различия теряют значимый характер, но, в отличие от пациентов с «полным успехом», пациентам в подгруппе «частичного успеха» для поддержания нормального офтальмотонуса требуется возобновление консервативного лечения.
Заключение
Трехкомпонентная терапия глаукомы на протяжении 3–6 лет не препятствует дальнейшей хирургической нормализации ВГД и может считаться безопасной для планируемой СТЭ. Статистически значимое снижение ВГД по сравнению с исходным уровнем было достигнуто у всех, даже относящихся к подгруппе «полной неудачи», пациентов во всех трех (6, 12 и 24 мес.) контрольных точках исследования. Наиболее выраженным и стабильным снижением ВГД на протяжении 24 мес. наблюдения проявлялся «полный успех» СТЭ. Дооперационный уровень ВГД не коррелирует с результатами трабекулэктомии и не может выступать в роли фактора, прогнозирующего ее успех или неудачу.
Сведения об авторах:
Антонова Анастасия Валерьевна — ассистент кафедры оториноларингологии и офтальмологии СПбГУ; 199034, г. Санкт-Петербург, Университетская наб., д. 7/9; врач-офтальмолог СПб ГБУЗ «ГМПБ № 2»; 194354, Россия, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0002-2639-2765.
Николаенко Вадим Петрович — д.м.н., профессор кафедры оториноларингологии и офтальмологии СПбГУ; 199034, г. Санкт-Петербург, Университетская наб., д. 7/9; заместитель главного врача по офтальмологии СПб ГБУЗ «ГМПБ № 2»; 194354, Россия, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000- 0002-6393-1289.
Бржеский Владимир Всеволодович — д.м.н., профессор, заведующий кафедрой офтальмологии ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000- 0001-7361-0270.
Вукс Александр Янович — главный специалист научно-организационного отделения ФГБУ «НМИЦ ПН им. В.М. Бехтерева» Минздрава России; 192019, Россия, г. Санкт-Петербург, ул. Бехтерева, д. 3; ORCID iD 0000-0002-6700-0609.
Контактная информация: Анастасия Валерьевна Антонова, e-mail: dr.antonova.av@gmail.com.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 28.11.2022.
Поступила после рецензирования 20.12.2022.
Принята в печать 19.01.2023.
About the authors:
Anastasiya V. Antonova — assistant of the Department of Otorhinolaryngology and Ophthalmology, St. Petersburg State University; 7/9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; ophthalmologist of City Multidisciplinary Hospital No. 2; 5, Uchebnyy lane, St. Petersburg, 194354, Russian Federation; ORCID iD 0000-0002-2639-2765.
Vadim P. Nikolaenko — Dr. Sc. (Med.), Professor of the Department of Otorhinolaryngology and Ophthalmology, St. Petersburg State University; 7/9, Universitetskaya emb., St. Petersburg, 199034, Russian Federation; Head of the Department of Ophthalmology City Multidisciplinary Hospital No. 2; 5, Uchebnyy lane, St. Petersburg, 194354, Russian Federation; ORCID iD 0000- 0002-6393-1289.
Vladimir V. Brzhesky — Dr. Sc. (Med.), Professor, Head of the Department of Ophthalmology, St. Petersburg State Pediatric Medical University, 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000- 0001-7361-0270.
Aleksandr Ya. Vuks — Chief Specialist of the Research and Organizational Department, V.M. Bekhterev National Medical Research Center of Psychiatrics and Neurology; 3, Bekhterev str., St. Petersburg, 192019, Russian Federation; ORCID iD 0000-0002-6700-0609.
Contact information: Anastasiya V. Antonova, e-mail: dr.antonova.av@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 28.11.2022.
Revised 20.12.2022.
Accepted 19.01.2023.












