Введение
Хроническое неспецифическое воспаление является патогенетической основой многих коморбидных заболеваний, сопровождающих старение (ишемическая болезнь сердца, хроническая ишемия мозга, сахарный диабет, остеоартрит, опухолевые заболевания). Поэтому комплексное терапевтическое воздействие на хроническое воспаление дает положительные клинические результаты при самых разных сочетаниях патологий.
Например, лечение остеоартрита (ОА) неразрывно связано с долговременной терапией хондропротекторами глюкозамина сульфатом (ГС) и хондроитина сульфатом (ХС). Глюкозамина сульфат (M01AX05 глюкозамин) — хондропротектор, проявляющий противовоспалительные эффекты, связанные с ингибированием транскрипционного фактора NF-kB [1]. Кроме того, ГС противодействует развитию саркопении [2], проявляет антиаллергическое [3], нейропротекторное и антипролиферативное [4] действие. Соответственно, использование ГС у пациентов с ОА в сочетании, например, с саркопенией или с опухолевыми заболеваниями не будет по меньшей мере способствовать прогрессированию этих коморбидных патологий. Более того, когортное исследование показало, что прием стандартизированного микрокристаллического ГС (мГС) и ХС вместе или по отдельности способствует снижению риска колоректального рака в среднем на 21% (относительный риск 0,79; 95% ДИ 0,63–1,00) [5].
Разносторонние эффекты мГС (хондропротекторный, противовоспалительный, антипролиферативный) обусловливают актуальность постгеномных исследований препарата, которые позволяют оценить весь комплекс его воздействия на клетки человека. В рамках постгеномного подхода эффективность и безопасность лекарств изучаются в контексте воздействия на геном (совокупность всех генов), транскриптом (совокупность всех мРНК), протеом (совокупность всех белков организма), метаболом (совокупность всех метаболитов организма) и реактом (совокупность всех химических реакций организма). Эффекты ГС на транскриптом фибробластов человека [6], протеом [7] и реактом человека [8] были исследованы методом хемоинформационного анализа.
Особой частью протеома является кином, т. е. совокупность всех ферментов-киназ, которые таргетно фосфорилируют остатки серина, треонина или тирозина в определенных сигнальных белках. В киноме человека представлено 518 киназ. Важность кинома в современной фармакологии обусловлена тем, что киназы непосредственно участвуют в поддержании процессов внутриклеточной передачи сигнала от рецепторов, расположенных на клеточной мембране. Нарушения активности киназ вносят существенный вклад в патогенез хронической патологии (прежде всего системного воспаления и опухолевых заболеваний).
Многие из киназ человека являются таргетными белками для рапамицина и новейших противоопухолевых препаратов (иматиниб, сорафениб, гефитиниб, эрлотиниб и др.). За последние 20 лет именно кином человека стал основным объектом выбора таргетных белков для дизайна перспективных лекарств. К настоящему времени 37 ингибиторов киназ являются известными препаратами и более 250 молекул-кандидатов проходят клиническое тестирование.
Известные ингибиторы киназ существенно различаются по селективности взаимодействия с киномом человека, что обусловливает широкий спектр побочных эффектов уже существующих ингибиторов киназ (прежде всего, гепато- и кардиотоксичность). Поэтому любое лекарство крайне важно характеризовать с точки зрения его воздействия на кином человека, что позволяет получить более объективную картину действия исследуемой молекулы.
Информация о киноме человека, накопленная в Proteomics DB [9] и в других протеомных базах данных, весьма обширна. Современные методы прикладной математики в применении к информации о киноме позволяют осуществлять достоверное и верифицируемое прогнозирование эффектов различных молекул на кином человека. На основании теории анализа размеченных графов, теории метрического анализа данных, комбинаторной теории разрешимости [10] и топологической теории анализа плохо формализованных задач [11, 12] нами разработаны уникальные методы хемопротеомики (прогнозирования эффектов молекул-лигандов на протеом человека) и хемокиномики (прогнозирование эффектов молекул на активность киназ, являющихся таргетными белками перспективных лекарств) [12–16].
В настоящей работе представлены результаты хемокиномного анализа дозозависимых эффектов ингибирования мГС на 297 киназ из кинома человека. Для каждой из киназ были получены кривые ингибирования в координатах активность — концентрация, константы ингибирования EC50, степень снижения активности каждой из киназ при фиксированной концентрации молекул. Получены кривые дозозависимого изменения уровней провоспалительного цитокина ФНО-α и противовоспалительного интерлейкина-10 (ИЛ-10).
Материал и методы
Результаты киномных экспериментов в базе данных Proteomics DB представлены в виде таблиц, в столбцах которых приведены киназы человека, а в строках — соответствующие молекулы, активность которых была исследована относительно изучаемого набора киназ. В таблице приведены изменения активности киназ при воздействии молекулы мГС.
Каждой такой «таблице хемокиномного эксперимента» соответствует (1) метод определения активности киназы и (2) фиксированная концентрация воздействующих молекул (1, 3, 10, 100, 1000 нмоль/л и др.). Таким образом, при заданном методе измерения активности киназ (колориметрия, радиоактивные метки, протеомная технология Kinobead+MS и др.) и концентрации тестируемого вещества каждый столбец такой таблицы соответствует химической реакции «Субстратi → Продуктi», в результате которой субстрат i-ой киназы преобразуется в другую молекулу.
Следовательно, данные, содержащиеся в таком столбце таблицы T киномного эксперимента (которая включает информацию об изменении активности N киназ при воздействии n молекул), могут рассматриваться как описание определенного элемента реактома (совокупности всех химических реакций в организме человека). Соответственно, становится возможным применение теории хемографов [13], методологии хемоинформационного [14] и хемореактомного анализа [15, 16] для осуществления хемокиномного моделирования.
Данные, представленные в столбцах gi, обрабатываются методами хемоинформационного анализа, основанными на комбинаторной теории разрешимости и метрическом анализе данных [12–16]. В применении к анализу хемографов практически важны теорема о полноте кортежей инвариантов произвольного хемографа и теорема соответствия критерия полноты инварианта критерию разрешимости/регулярности [10], на основании которых становятся возможными определение и настройка (т. е. машинное обучение) метрик (функций расстояния) между хемографами.
В целом на первом этапе хемокиномного анализа для i-ой киназы, описываемой столбцом gi таблицы T, проводилось обучение алгоритмов для вычисления химических расстояний dx. Алгоритм обучения (модель обучения) выбирался из заданного набора моделей (см. пятый этап ниже).
На втором этапе для исследуемой молекулы X рассчитывали расстояния dx(X, Xij). Затем для каждой j-ой молекулы по формуле ΔXj = d -1(dΔ, Δij) вычисляли оценки искомого изменения активности, а точность вычисления ΔX — как стандартное отклонение φ^(x)A. Представленные далее в таблицах и рисунках оценки изменений активности различных констант были получены как математическое ожидание и дисперсия соответствующей эмпирической функции распределения.
На третьем этапе для исследуемой молекулы со структурой X для каждой киназы вычисляли оценки ΔX(cm) при различных концентрациях cm исследуемой молекулы, т. е. строили кривые ингибирования. Графики в координатах {(ΔX(cm), cm)} анализировали методами регрессионного анализа и выявляли достоверные дозозависимые тренды изменения активности в зависимости от cm. Отбирались только те кривые ΔX(cm), которые описаны достоверными трендами (P<0,05 по критерию Колмогорова — Смирнова) во всем диапазоне исследуемых концентраций (1…30 000 нмоль/л).
На четвертом этапе на основе кривых ингибирования мГС производили расчет констант ингибирования EC50 для каждой из киназ. Для каждой кривой {(ΔX(cm), cm)} определяли значения b (плато подгонки кривой снизу, условно — минимальное значение активности) и t (максимальная остаточная привязка активности сверху, условно — максимальное значение активности) [17]. Затем значение EC50 как точки перегиба кривой {(ΔX(cm), cm)} определяли посредством регрессионного анализа формулы:
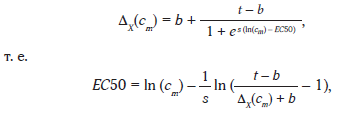 ,
,
где s — наклон касательной к кривой в точке перегиба (которая соответствует значению константы EC50). Значения s и EC50 находили посредством линейной регрессии в координатах ![]() .
.
На пятом этапе процедура, описанная как этапы 1–4, повторялась для каждой модели обучения из заданного набора моделей: нейронные сети различных архитектур (двухслойные сети, многослойные персептроны, сети радиальных базисных функций), машины поддерживающих векторов, метод ближайшего соседа, решающие деревья/списки, методы голосования, метод логических правил. Всего было использовано 8 моделей, так что для каждой киназы были получены 8 кривых ингибирования и, соответственно, до 8 оценок значения констант ингибирования ЕС50 (может быть меньше 8, в зависимости от статистической достоверности трендов, полученных на третьем этапе).
На шестом этапе проводилось усреднение результатов, полученных для разных моделей. В результате для исследуемой молекулы со структурой X вычислялись ЕС50у (единая оценка значения ЕС50) и σ(ЕС50у) (значение стандартного отклонения ЕС50у).
На седьмом этапе осуществляли расчеты ранга релевантности (качества) полученных оценок констант ЕС50 для каждой из киназ. Для этого сначала проводили «прямые» теоретические расчеты константы EC50 для молекулы X методом хемоинформационного анализа [12–14] с получением значения EC50т. Затем ранг релевантности rri(X) прогноза активности молекулы со структурой X по отношению к i-ой киназе рассчитывали по формуле:
![]() .
.
Значение rri(X) оценивает соответствие независимо полученных оценок значений констант EC50т и ЕС50у и качество полученной оценки значений константы ЕС50у. Более низкие значения ранга rri(X) соответствуют более высокому качеству оценки ЕС50у, полученной для ингибирования i-ой киназы молекулой X (в данном эксперименте — молекулой мГС, действующим началом препарата глюкозамина).
Результаты исследования
Хемокиномный анализ воздействия молекулы ГС на активность 297 киназ человека показал, что мГС может существенно ингибировать активность 31 из 297 киназ (константы ингибирования в субмикромолярном диапазоне). В таблице 1 суммированы основные результаты. Киназы упорядочены по возрастанию значений ранга релевантности rri, который оценивает ранг качества полученных оценок (см. Материал и методы). ЕС50у — оценка ЕС50, усредненная по 8 моделям. Расшифровки клинической значимости ингибирования каждой из киназ представлены в таблице 2.

Препарат глюкозамина мГС показал уникальный профиль воздействия на киназы, отличный от профилей уже известных ингибиторов киназ. В частности, ингибируя активность циклинзависимых киназ 4, 6 и др., мГС тормозит пролиферацию, а ингибирование молекулой ГС киназ CHEK1, Src и PRKCD стимулирует апоптоз опухолевых клеток. Суммированные в таблице 1 киназы, ингибируемые молекулой ГС, могут быть подразделены по направлению активности на 5 основных групп:
регулировка дифференцировки, пролиферации, миграции опухолевых клеток (киназы FLT3, RET, FGFR1, TNIK, TNK2, PTK6, TGFBR2);
поддержка цикла клеточного деления (киназы CDK4, AURKA, AURKB, MNAT1, CDK3, CDK13, CDK6, PLK4, CCNT1, CCNH);
адгезия и инвазия опухолевых клеток (киназы PKN2, DDR1, EPHA5);
активация путей выживания клеток (киназы MAP2K2, PAK4, CHEK1, PRKCD, SRC, CDK9);
противовоспалительное действие, ингибирование сигналов в каскаде NF-κB (киназы MAP3K3, PDPK1, IKBKE, MAPKAPK2, CDK9, EGFR).
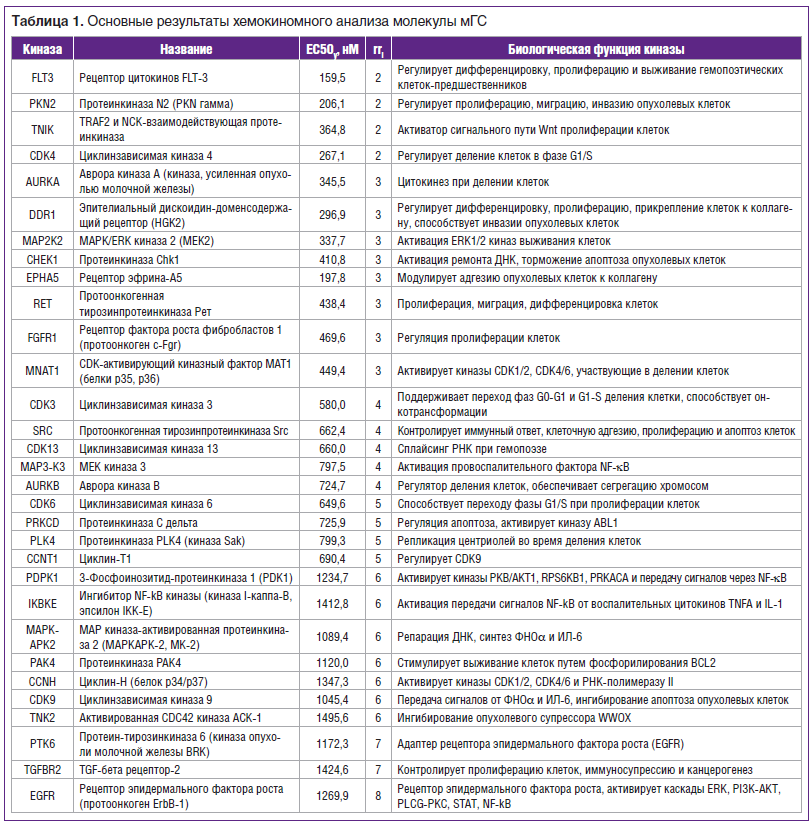
Результаты с наилучшим качеством (со значениями ранга релевантности, равными 2…3) перечислены в верхней части таблицы 1. Например, киназа FLT3 (EC50=159,5 нМ для ГС, рис. 1) является рецептором цитокина, регулирует дифференцировку, пролиферацию и выживание гемопоэтических клеток-предшественников. Киназа FLT3 способствует активации белка mTOR, ингибирование которого, как известно, характеризуется геропротекторным эффектом. Мутации гена киназы FLT3, которые повышают активность FLT3, способствуют пролиферации клеток, устойчивости к апоптозу и ассоциированы с развитием лейкемии [18, 19]. Ингибиторы FLT3 сунитиниб (3,99 нМ), сорафениб, мидостаурин, лестауртиниб и тандутиниб уже используются при лечении острого миелоидного лейкоза; ингибиторы квизартиниб, креноланиб, гилтеритиниб (12,9 нМ) проходят клинические испытания [20].
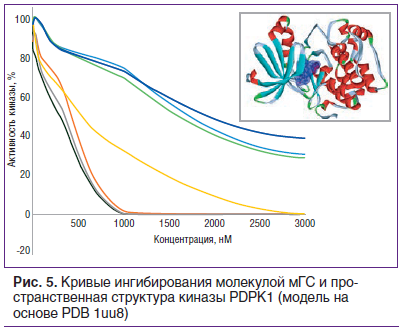
На рисунке 1 приведены кривые ингибирования киназы FLT3 молекулой мГС, полученные для разных моделей (см. Методы) и пространственная структура киназы (модель на основе PDB 4rt7). На рисунках 1–7 цвет кривой обозначает используемые модели машинного обучения для оценки результатов: черная линия — метод «двухслойные нейронные сети», оранжевый — «многослойные персептроны», серый — нейронные сети радиальных базисных функций, желтый — метод «машины поддерживающих векторов», синий — метод «ближайшего соседа», зеленый — метод «решающие деревья/списки», голубой — методы голосования, темно-оранжевый — метод логических правил. Синим выделена потенциальная область связывания ГС.
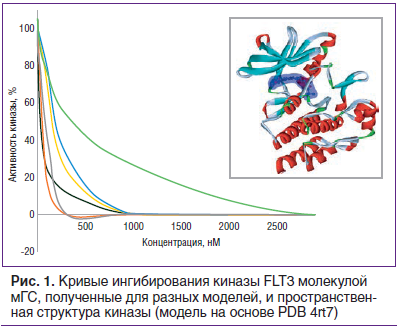
Киназа CDK4 (EC50=267,09 нМ для ГС, рис. 2) так же как и другие циклинзависимые киназы (CDK), регулирует деление клеток в фазе G1/S. Комплексы циклин-D-CDK4 интегрируют эффекты митогенных и антимитогенных сигналов [21]. Ингибиторы киназ CDK4/6, используемые в настоящее время для лечения метастатического рака молочной железы — абемациклиб (96,55 нМ), регорафениб (112,3 нМ) и др и используются для лечения гормон-рецептор-положительных HER2-отрицательных метастазирующих опухолей молочной железы [22].
Аврора киназа А AURKA (EC50=345,52 нМ для ГС, рис. 3) связывается с центросомой и микротрубочками веретена и имеет большое значение для цитокинеза во время деления клеток. Активирует CDK1 и p53-зависимый каскад онкогенной трансформации клеток [23–25]. Ингибирование авроры киназы А молекулами алисертиба (15,2 нМ) и данусертиба (30,7 нМ) перспективно для лечения гематологических опухолевых заболеваний [26].

Киназа DDR1 (EC50=296,88 нМ для ГС) регулирует дифференцировку, выживание, пролиферацию клеток и прикрепление клеток к коллагену внеклеточного матрикса. Повышая уровни матричных металлопротеиназ MMP2, MMP7 и MMP9, киназа DDR1 способствует инвазии опухолевых клеток [27, 28], повышению выживаемости опухолевых клеток даже при использовании генотоксических лекарственных средств. Молекулы известных лекарств голватиниба (7,91 нМ), понатиниба (28,98 нМ), иматиниба (34,61 нМ) являются ингибиторами DDR1 [29].
Киназа FGFR1 (EC50=469,61 нМ для ГС, рис. 4), являясь рецептором фактора роста фибробластов, участвует в регуляции пролиферативных процессов, дифференцировке и передаче сигналов по каскадам выживания клетки RAS, ERK1/2 (MAPK1/3), AKT1 [30]. Ингибиторы киназы FGFR1 инфигратиниб, данусертиниб (110 нМ) и довитиниб (329 нМ) могут использоваться для лечения холангиокарциномы и солидных опухолей [31].

В таблице 2 суммированы показания к назначению ингибиторов каждой из киназ, приведенных в таблице 1, которые ингибируются молекулой мГС в соответствии с результатами хемокиномного анализа. Ингибиторы этих киназ используются в комбинированной противоопухолевой терапии лейкоза, рака молочной железы, толстого кишечника, меланомы, немелкоклеточного рака легких. Кроме того, ингибирование данной выборки киназ способствует снижению избыточного ангиогенеза, преодолению метастазирования и резистентности к химиотерапии. Ингибирование некоторых из этих киназ способствует снижению хронического воспаления.
Хемокиномный анализ указал на ингибирование киназ MAP3K3, PDPK1, IKBKE как новые механизмы ингибирования фактора NF-kB посредством мГС.
Киназа MAP3K3 (EC50=797,5 нМ для ГС) стимулирует активацию провоспалительного фактора NF-κB [32]. Ингибиторы MAP3K3 траметиниб и кобиметиниб применяются для лечения меланомы и немелкоклеточного рака легкого [33].
Киназа PDPK1 (EC50=1234,7 нМ для ГС, рис. 5) активирует киназы PKB/AKT1, рибосомные протеинкиназы RPS6KB1 и RPS6KA, цАМФ-зависимую протеинкиназу PRKACA, протеинкиназы PRKCD и PRKCZ, передачу сигналов через NF-κB, также контролируя пролиферацию клеток [34, 35]. Инактивация киназы PDPK1 в эксперименте на мышах способствовала повышению противоопухолевого иммунитета [36].
Киназа IKBKE (EC50=1412,8 нМ для мГС препарата глюкозамина) является ингибитором киназы NF-κB, вовлечена в процесс активации передачи сигналов через NF-κB от воспалительных цитокинов ФНО-α и ИЛ-1 и защищает клетки от апоптоза, вызванного повреждением ДНК [37]. Ингибирование киназы IKBKE исследуется как метод воздействия на патогенез хронического неспецифического воспаления [38] (нинтеданиб — 278 нМ, момелотиниб — 321 нМ), ассоциированного в т. ч. и с повышенным риском опухолевых заболеваний.
Киназа EGFR (EC50=1269,9 нМ для ГС, рис. 6) — рецептор эпидермального фактора роста, известный также как протоонкоген ErbB-1. Киназа EGFR активирует сигнальные каскады выживания клетки (ERK, PI3K-AKT, PLCG-PKC) и провоспалительные сигнальные каскады (STAT, NF-κB) [39]. Ингибиторы EGFR (афатиниб — 3,0 нМ, нератиниб — 42 нМ, лапатиниб — 64,5 нМ, гефитиниб — 521 нМ и др.) используются для лечения немелкоклеточного рака легкого, молочной железы, поджелудочной железы и толстого кишечника [40].


В результате хемокиномного анализа также были получены кривые дозозависимого изменения уровней провоспалительного цитокина ФНОα и противовоспалительного ИЛ-10 (рис. 7). Интересно отметить, что 7 из 8 использованных моделей показали одинаковый качественный вид кривой для ФНОα — минимум при 1000 нМ (1 мкМ) ГС с последующим постепенным нарастанием. Заметим, что концентрация в 1 мкМ соответствует приему внутрь ГС в количестве 5 мкмоль (приблизительно 1400 мг), что соответствует стандартной суточной дозировке при приеме ГС взрослыми. Можно предположить, что известная из клинической практики доза ГС 1500–2000 мг/сут является оптимальной с точки зрения снижения уровней провоспалительного цитокина ФНОα (т. к. более высокие дозы потенциально могут соответствовать снижению эффекта ГС на уровни ФНОα).
Заключение
Лечение пациентов, страдающих одновременно и опухолевыми заболеваниями, и остеоартритом, требует взвешенного выбора фармацевтических средств и их комбинаций. Во-первых, такая комбинированная терапия должна приносить максимальный терапевтический эффект. Во-вторых, долговременная терапия должна быть максимально безопасна. Для выбора эффективных и безопасных комбинаций препаратов необходимо помнить о том, что взаимосвязи между ОА и опухолевыми заболеваниями обусловлены, прежде всего, неспецифическим хроническим воспалением.
В терапии ОА используются средства, проявляющие противовоспалительное действие: гормональные препараты, нестероидные противовоспалительные препараты (НПВП) и SYSADOA (хондропротекторы). Однако использование гормональных препаратов для лечения ОА может быть противопоказано при опухолевых заболеваниях, а использование НПВП может усиливать кардио- и нейротоксичность химиотерапии. В то же время хондропротектор ГС отличается низкой токсичностью и проявляет самостоятельное противовоспалительное действие, связанное с ингибированием фактора транскрипции NF-κB.
Ингибирование NF-κB — далеко не единственный молекулярный механизм действия ГС, важный для лечения ОА, коморбидного опухолевым заболеваниям. Представленные в работе результаты дозозависимого хемокиномного анализа молекулы мГС показывают, что мГС может существенно ингибировать активность 31 из 297 киназ. Препарат мГС показал уникальный профиль воздействия на киназы, отличный от профилей известных ингибиторов киназ, которые, как правило, относятся к высокоэффективным, но дорогостоящим противоопухолевым препаратам. В частности, ингибируя активность циклинзависимых киназ, мГС тормозит пролиферацию, а ингибирование молекулой ГС киназ CHEK1, Src и PRKCD стимулирует апоптоз опухолевых клеток. Таргетное ингибирование 31 из 297 киназ человека ГС целесообразно в рамках комбинированной противоопухолевой терапии лейкоза, рака молочной железы, толстого кишечника, меланомы, немелкоклеточного рака легких. В случае рака толстого кишечника данное заключение подтверждается результатами цитированного ранее когортного исследования [5]. Ингибирование установленной выборки киназ также способствует снижению избыточного ангиогенеза, преодолению метастазирования и резистентности к химиотерапии.
Для воздействия ГС на кином человека необходимо использование его высокоочищенных форм (микрокристаллическая субстанция ГС в составе препарата Сустагард® артро). Наличие в препаратах ГС посторонних примесей (особенно белкового происхождения) будет провоцировать провоспалительные реакции и препятствовать развитию противоопухолевого эффекта ГС. Воспалительные клетки (лимфоциты, гранулоциты, макрофаги, тучные клетки) и медиаторы воспаления являются ключевыми компонентами микроокружения опухоли, способствующими ее росту [41].
Работа выполнена при поддержке грантов №19-07-00356, 17-07-00935, 17-07-01419, 16-29-12936 РФФИ.












