Отдельной стороной вопроса является учащение случаев возникновения гнойных воспалений околоносовых пазух, которые можно связать с увеличением необоснованного применения современных антибактериальных препаратов, что приводит к росту количества полирезистентных штаммов микроорганизмов, а также значительному угнетению клеточных и гуморальных факторов резистентности организма. Нерациональное назначение антибиотиков обуславливает формирование лекарственной устойчивости микроорганизмов и селекцию вирулентных штаммов микроорганизмов, борьба с которыми чрезвычайно сложна.
Кроме того, острый синусит отличается выраженной тенденцией к затяжному, рецидивирующему течению и хронизации патологического процесса в околоносовых пазухах. Примерно у 10–15% больных синусит, возникший на фоне острой респираторной инфекции, принимает хроническое течение, которое характеризуется стойкими морфологическими изменениями слизистой оболочки пазухи. Поэтому своевременная и рациональная антибиотикотерапия является исключительно важным фактором, лимитирующим как появление осложнений, так и хронизацию процесса.
В этой связи выбор антибактериального препарата, который обладает бактерицидным эффектом, вызывающим эрадикацию возбудителя, является залогом предотвращения хронизации процесса. К сожалению, несмотря на широкий арсенал современных антибактериальных препаратов, оказывающих желаемый бактерицидный эффект, до настоящего времени врачи–терапевты, курирующие пациентов с патологией ЛОР–органов в условиях поликлиники, зачастую назначают препараты в заниженных дозировках, выбирая антибиотики без учета представлений о характере микрофлоры и условий течения гнойно–воспалительного процесса в структурах верхних дыхательных путей и уха.
Так, за период с 2008 по 2011 г. нами обследовано 124 пациента, находившихся на стационарном лечении в ЛОР–отделениях ГКБ №1 им. Н.И. Пирогова с диагнозом «хронический гайморит односторонней или двусторонней локализации». Все обследованные пациенты страдали верхнечелюстным синуситом, который первоначально развился на фоне острой респираторной вирусной инфекции c периодическим обострением процесса 3–4 раза в год и был подтвержден данными компьютерной томографии околоносовых пазух.
Анализ догоспитальной терапии показал, что у всех пациентов основу терапии составили пероральные антибактериальные препараты. Причем на начальном этапе заболевания, а именно при возникновении острого воспалительного процесса в верхнечелюстной пазухе на фоне острой респираторной вирусной инфекции первичное назначение антибактериального препарата, дозы и кратности его введения в 81% случаев осуществляли врачи–терапевты. При этом только у 19 пациентов (15,3%) выбор антибактериального препарата базировался на результатах микробиологического исследования содержимого пазухи с постановкой теста на антибиотикочувствительность, у 105 больных (84,7%) микробиологическое исследование не проводилось.
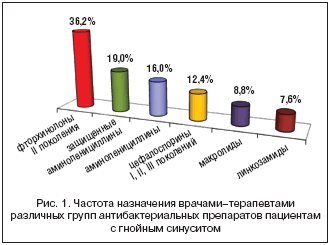
Что касается групп антибактериальных препаратов, назначенных врачом–терапевтом на догоспитальном этапе, то чаще всего это были фторхинолоны II поколения – ципрофлоксацин (45 пациентов, 36,2%), применение которого в ЛОР–практике не рекомендовано в связи с низкой активностью против S. pneumoniae; при этом защищенные аминопенициллины (амоксициллин/клавуланат) оказались лишь на второй позиции (24 пациента, 19%); на третьем месте – традиционные аминопенициллины (20 пациентов, 16%), на четвертом – макролиды (15 пациентов, 12,4%), на пятом – цефалоспорины I–III поколений (цефиксим, цефтибутен, цефазолин, цефуроксим) (4, 3,2 и 1,6% соответственно). На последнем месте оказались линкозамиды – они были назначены 9 пациентам (7,6%) (рис. 1).
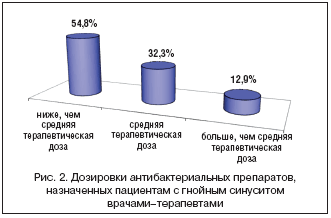
При выборе дозы препаратов в большинстве случаев – у 68 пациентов (54,8%) антибиотик назначали в дозе ниже, чем средняя терапевтическая (рис. 2).
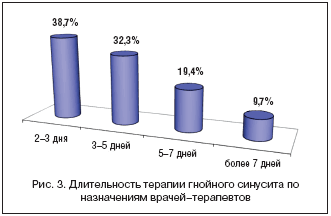
При этом большая часть пациентов (48 человек, 38,7%) принимали антибактериальный препарат 2–3 суток, а 40 (32,3%) – на протяжении 3–5 суток. Необходимо отметить, что большинство пациентов заканчивали прием препарата самостоятельно, после наступления относительного клинического улучшения (рис. 3).
Таким образом, предшествующая терапия более чем у 80% пациентов на амбулаторном этапе была нерациональной, зачастую необоснованной. Антибактериальные препараты назначались пациентам в недостаточных дозировках, без соблюдения кратности введения препарата.
Между тем, по данным компьютерной томографии околоносовых пазух, у 38 пациентов (30,6%) имелись диффузно–пролиферативные изменения слизистой оболочки верхнечелюстной пазухи, в связи с чем данным пациентам была выполнена радикальная операция на верхнечелюстной пазухе по Колдуэллу–Люку со вскрытием клеток решетчатого лабиринта и наложением искусственного соустья с нижним носовым ходом. У оставшихся 86 пациентов (69,4%) характер изменений слизистой оболочки верхнечелюстной пазухи, по данным компьютерной томографии, носил ограниченный характер, в связи с чем этим больным была проведена эндоназальная риноантростомия с ревизией пазухи. Всем больным интраоперационно выполняли забор биопсийного материала для проведения патоморфологического исследования. Содержимое пазухи, полученное в результате оперативных вмешательств, подвергалось микробиологическому исследованию.
По результатам проведенного патоморфологического исследования нам удалось выявить, что у 93 (75%) пациентов изменения слизистой оболочки носили преимущественно пролиферативный характер, т.е. на фоне существующего хронического воспаления слизистой оболочки верхнечелюстной пазухи наблюдались кисты, выстланные уплощенным реснитчатым эпителием, местами без эпителиальной выстилки – у 8 (6,3%) пациентов. У 10 (8,1%) пациентов в слизистой оболочке одновременно присутствовали кисты и полипы, еще у 10 (8,1%) – наблюдалась метаплазия реснитчатого эпителия по типу многослойного плоского. Также нами была зафиксированы 10 пациентов (8,1%), у которых на фоне метаплазии реснитчатого эпителия в многослойный плоский сформировались очаги дисплазии I–II степеней. У 55 больных из обследованных нами в гистологических срезах имелась полипозная трансформация слизистой оболочки.
У 31 (25%) пациента гистологическая картина слизистой оболочки характеризовалась признаками экссудативного воспаления.
По результатам микробиологического исследования были выделены следующие микроорганизмы: S. aureus – в 31% случаев, энтеробактерии – в 27,3%, Streptococcus spp. – в 15,3%, Neisseria spp. – в 11,3%, H. influenzae – в 3,4% случаев, P. aeruginosa – в 7,3%. Среди прочих микроорганизмов, на долю которых пришлось 2,7%, наиболее часто встречались облигатные анаэробы: бактероиды, пептококки, пептострептококки, фузобактерии. Грибы рода Candida выделены в 1,7% случаев.
Сопоставляя спектр микробной флоры и патоморфологические изменения слизистой оболочки верхнечелюстной пазухи у обследованных больных, нам удалось выявить определенную взаимосвязь морфологических изменений слизистой с биологическими свойствами колонизирующих ее микроорганизмов. По нашим данным, ведущими представителями микрофлоры, обусловливающими хронизацию процесса, являются грамположительные микроорганизмы, а именно бактерии рода стафилококков. Основными факторами их патогенности являются: факторы адгезии – белки–адгезины и компоненты клеточной стенки, факторы инвазии – большое число ферментов (гиалуронидаза, лецитиназа, фибринолизин и др.), обусловливающих разрушение элементов соединительной ткани и распространение возбудителя с активным вовлечением в процесс интактных участков в очаге поражения, а также факторы защиты от фагоцитов – микрокапсула, компоненты клеточной стенки, плазмокоагулаза, блокирующие фагоцитарные реакции и обусловливающие длительную персистенцию микроорганизмов в условиях хронизации процесса.
Помимо этого, золотистый стафилококк выделяет большое количество экзотоксических субстанций: гемолизины, которые вызывают лизис эритроцитов, дезактивируют медиаторы воспаления, способствуя длительному течению воспалительного процесса, и лейкоцидин, что приводит к лизису лейкоцитов в очаге воспаления. Эксфолиативный токсин, обусловливающий поражение эпидермиса, в том числе барабанной перепонки, влечет за собой появление холестеатомного процесса и наличие стойкой перфорации.
Необходимо отметить, что именно при поражениях стафилококковой этиологии отмечалось вялотекущее хроническое воспаление в ткани слизистой оболочки пораженного органа с формированием таких патоморфологических изменений, как истончение и частичная деструкции реснитчатого эпителия, активная гнойно–воспалительная инфильтрация стромы слизистой оболочки с преобладанием в клеточном составе лимфоцитов, плазмоцитов и сегментоядерных нейтрофилов, а также формирование очагов грануляционной ткани разной степени зрелости. Наличие S. aureus в ассоциации, особенно в сочетании с облигатными анаэробами, вызывало наиболее выраженные деструктивные изменения, зачастую некротического характера. По нашим наблюдениям, хронические формы инфекций, вызванные стафилококками, имеют тенденцию к длительному течению и при этом плохо поддаются консервативной терапии. Специфичность вышеперечисленных изменений обусловлена в первую очередь биологическими свойствами возбудителя.
Бактериальная микрофлора, представленная микроорганизмами грамотрицательного спектра, способна синтезировать экзотоксины, которые приводят к нарушению синтеза белка в клетках, расположенных в очаге поражения, и оказывают иммуносупрессивное действие, способствующее длительному течению заболевания. Цитотоксины, вызывающие цитотоксическое действие в очаге поражения, обусловливают развитие гнойно–воспалительного процесса, а также стимулируют образование грануляций. Эндотоксины оказывают общетоксическое действие. Гемолизины стимулируют гемолиз эритроцитов и некротические изменения. Все эти особенности грамнегативной флоры, преобладающей у больных с продуктивной формой воспаления, стимулировали образование в слизистой оболочке таких процессов, как кистозная трансформация, наличие одновременно полипов и кист, а также более серьезных изменений, связанных с замещением одного вида эпителия другим. Так, в нашем исследовании на фоне вялотекущего воспаления мерцательный эпителий метаплазировался по типу многослойного плоского эпителия, а в ряде случаев метаплазия сопровождалась признаками дисплазии I и II степеней.
Таким образом, характер течения воспалительного процесса в очаге воспаления связан с биологическими свойствами микробных возбудителей, которые обусловливают местную и общую интоксикацию, сопровождающие воспалительные реакции и переход острого воспаления в хроническое.
Результаты проведенного нами исследования свидетельствуют о том, что неадекватная антибактериальная терапия воспалительного процесса в верхнечелюстной пазухе на догоспитальном этапе ведет к длительной персистенции микробного агента внутри полости пазухи и способствует стойким морфологическим преобразованиям слизистой оболочки в основном по продуктивному типу. Характерными типами патоморфологической трансформации слизистой оболочки в данном случае явились: полипы и полиповидные образования слизистой оболочки, кисты, а также метаплазия реснитчатого эпителия в многослойный плоский, местами с участками дисплазии I–II степеней тяжести. Формирование тех или иных видов патоморфологических изменений слизистой оболочки верхнечелюстной пазухи происходит под действием превалирующей микрофлоры и обусловлено преимущественно ее биологическими свойствами. Указанные патоморфологические изменения слизистой оболочки не могут быть устранены консервативными методами лечения и требуют хирургического вмешательства.
Исходя из вышеизложенного препаратами выбора в условиях гнойно–воспалительного процесса в околоносовых пазухах должны, несомненно, являться защищенные аминопенициллины.
Аминопенициллины характеризуются широким спектром противомикробного действия. Активны в отношении тех микробов, на которые действуют природные пенициллины. Аминопенициллины высокоактивны в отношении некоторых грамотрицательных бактерий, главным образом кишечной группы: кишечной палочки, протея, сальмонелл, шигелл, а также гемофильной палочки. Важным недостатком классических аминопенициллинов является отсутствие активности в отношении штаммов, продуцирующих β–лактамазы. Выраженной способностью к продукции β–лактамаз, в частности, обладают грамотрицательные H. influeпzae, M. catarrhalis, P. aerugiпosa, причем последняя зачастую ассоциируется с заболеваниями уха, горла, носа нозокомиального происхождения.
Отдельным аспектом проблемы приобретенной резистентности к β–лактамным препаратам является способность штаммов семейства Enterobacteriaceae (E. coli, К. рneumoniae и др.) госпитального происхождения к продукции β–лактамаз расширенного спектра действия (ESBL). В настоящее время приобретенной резистентностью к природным пенициллинам обладает – в зависимости от региона – до 90% штаммов S. aureus, причем у части из них (PRSA) резистентность обусловлена детерминированной плазмидными генами способностью к продукции β–лактамаз, а у метициллинорезистентных стафилококков (MRSA) – наличием атипичного пенициллинсвязывающего белка. Активность β–лактамаз различного типа эффективно подавляется их ингибиторами – клавулановой кислотой, сульбактамом, тазобактамом, с успехом использующимися при конструировании так называемых ингибиторзащищенных β–лактамных антибактериальных препаратов.
Неуклонный рост приобретенной резистентности S. pneumoniae к β–лактамам представляет собой серьезную проблему для многих стран мира, в том числе и России, но при этом отмечается абсолютная чувствительность S. pneumoniae к ингибиторзащищенным аминопенициллинам и цефалоспоринам.
Преодолеть β–лактамазную активность бактерий перечисленных видов способны ингибиторзащищенные β–лактамы. В связи с широким распространением резистентных к антибактериальным препаратам микробов, вызванных продукцией ими β–лактамаз, были созданы вещества, получившие название «ингибиторы β–лактамаз». Они так же, как другие β–лактамные антибиотики, содержат в своей структуре β–лактамное кольцо, но обладают слабыми антибактериальными свойствами. Однако они имеют свойство необратимо инактивировать широкий спектр β–лактамаз, продуцируемых различными микроорганизмами (стафилококками, энтерококками, кишечной палочкой, протеем, клебсиеллой, гемофильной палочкой и др.). Это клавулановая кислота, сульбактам и тазобактам.
В связи с этим данные вещества применяются в комбинации с пенициллинами широкого спектра действия, которые связывают эти ферменты и защищают содержащиеся в составе этих препаратов пенициллины от действия β–лактамаз. В результате резистентные к ампициллину и амоксициллину штаммы микроорганизмов становятся чувствительными к комбинации этих препаратов с ингибиторами β–лактамаз.
Эти комбинированные препараты применяются для лечения инфекций ЛОР–органов, включая осложненные и внутрибольничные, особенно при высоком риске наличия возбудителей, продуцирующих β–лактамазы, а также при выраженной иммуносупрессии организма.
В настоящее время на фармацевтическом рынке имеется большое количество препаратов защищенных аминопенициллинов, включая препараты–дженерики, современные технологии изготовления которых обеспечивают равную активность и одинаковую частоту возникновения возможных побочных эффектов в сравнении с оригинальным препаратом. Таким препаратом, в частности, является Панклав. Исследование эффективности и безопасности данного препарата в терапии острого бактериального верхнечелюстного синусита проводилось на базе Московского научно–практического центра оториноларингологии Департамента здравоохранения Москвы. По результатам исследования Панклав рекомендован в качестве средства стартовой эмпирической терапии острого бактериального синусита.
Назначение защищенных пенициллинов пациентам с синуситом, в строго выдержанных терапевтических дозировках, полным курсом терапии, является основным фактором, лимитирующим хронизацию воспалительного процесса и возможность развития грозных осложнений.