–£–≤–Β–¥–Β–Ϋ–Η–Β
–£–Ψ–Ω―Ä–Ψ―¹―΄ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι ―É –¥–Β―²–Β–Ι –≤ –Ϋ–Α―¹―²–Ψ―è―â–Η–Ι –Φ–Ψ–Φ–Β–Ϋ―² ―è–≤–Μ―è―é―²―¹―è –Κ―Ä–Α–Ι–Ϋ–Β –Α–Κ―²―É–Α–Μ―¨–Ϋ―΄–Φ–Η. –ü–Α–Ϋ–¥–Β–Φ–Η―è –Ϋ–Ψ–≤–Ψ–Ι –Κ–Ψ―Ä–Ψ–Ϋ–Α–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Η, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Ψ–Ι –≤–Η―Ä―É―¹–Ψ–Φ SARS-Cov-2, –Β―â–Β ―Ä–Α–Ζ –Ω―Ä–Ψ–¥–Β–Φ–Ψ–Ϋ―¹―²―Ä–Η―Ä–Ψ–≤–Α–Μ–Α, ―΅―²–Ψ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ ―¹ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―΄–Φ –¥–Β–Ι―¹―²–≤–Η–Β–Φ –≤ –Ω–Β―Ä–≤―΄–Β 48 ―΅ –Ψ―² –Ϋ–Α―΅–Α–Μ–Α –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Η ―¹–Ϋ–Η–Ε–Α–Β―² ―²―è–Ε–Β―¹―²―¨ ―²–Β―΅–Β–Ϋ–Η―è –Η ―É–Μ―É―΅―à–Α–Β―² –Η―¹―Ö–Ψ–¥―΄ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è.
–ù–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Ω―Ä–Η ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η―è―Ö ―É –¥–Β―²–Β–Ι –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Β―²―¹―è –≤–Ψ–Ζ―Ä–Α―¹―²–Ψ–Φ –Ω–Α―Ü–Η–Β–Ϋ―²–Α, ―²―è–Ε–Β―¹―²―¨―é ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Η ―ç―²–Η–Ψ–Μ–Ψ–≥–Η–Β–Ι –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è. –ö―Ä–Ψ–Φ–Β –Ψ–±―à–Η―Ä–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –≤–Η―Ä―É―¹–Ψ–≤ –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι –Ψ―¹―²―Ä―΄―Ö ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι, –≤ ―². ―΅. ―Ä–Β―Ü–Η–¥–Η–≤–Η―Ä―É―é―â–Η―Ö, –Φ–Ψ–≥―É―² ―¹―²–Α―²―¨ –≤–Η―Ä―É―¹―΄ –≥―Ä―É–Ω–Ω―΄ –≥–Β―Ä–Ω–Β―¹–Α.
–ü–Ψ–Κ–Α–Ζ–Α–Ϋ–Α ―Ä–Ψ–Μ―¨ –Α–Κ―²–Η–≤–Ϋ―΄―Ö ―³–Ψ―Ä–Φ –≥–Β―Ä–Ω–Β―¹–≤–Η―Ä―É―¹–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι (–™–£–‰) –≤ ―Ä–Β―Ü–Η–¥–Η–≤–Η―Ä–Ψ–≤–Α–Ϋ–Η–Η –Η–Ϋ―³–Β–Κ―Ü–Η–Ι –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α ―É –¥–Β―²–Β–Ι –Η ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Η ―Ö―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ψ―΅–Α–≥–Ψ–≤ –Η–Ϋ―³–Β–Κ―Ü–Η–Η –Α–¥–Β–Ϋ–Ψ―²–Ψ–Ϋ–Ζ–Η–Μ–Μ―è―Ä–Ϋ–Ψ–Ι –Ζ–Ψ–Ϋ―΄. –ü–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –ê.–Γ. –¦–Β–≤–Η–Ϋ–Ψ–Ι –Η ―¹–Ψ–Α–≤―²., ―Ä–Β–Κ―É―Ä―Ä–Β–Ϋ―²–Ϋ―΄–Β ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è ―É –¥–Β―²–Β–Ι –Ψ―² 1 –≥–Ψ–¥–Α –¥–Ψ 6 –Μ–Β―² –≤ 75% ―¹–Μ―É―΅–Α–Β–≤ –Α―¹―¹–Ψ―Ü–Η–Η―Ä–Ψ–≤–Α–Ϋ―΄ ―¹ –™–£–‰ [1]. –ù–Α–Η–±–Ψ–Μ–Β–Β ―΅–Α―¹―²–Ψ –Ψ–±–Ϋ–Α―Ä―É–Ε–Η–≤–Α―é―²―¹―è –Α–Κ―²–Η–≤–Ϋ―΄–Β ―³–Ψ―Ä–Φ―΄ –Η–Ϋ―³–Β–Κ―Ü–Η–Η, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Ψ–Ι –≤–Η―Ä―É―¹–Ψ–Φ –≥–Β―Ä–Ω–Β―¹–Α ―΅–Β–Μ–Ψ–≤–Β–Κ–Α (–£–™–ß) 6–ê/–£, –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Ψ ―Ä–Β–Ε–Β βÄî –≤–Η―Ä―É―¹–Ψ–Φ –≠–Ω―à―²–Β–Ι–Ϋ–Α βÄî –ë–Α―Ä―Ä (–£–≠–ë) –Η ―Ü–Η―²–Ψ–Φ–Β–≥–Α–Μ–Ψ–≤–Η―Ä―É―¹–Ψ–Φ (–Π–€–£) [2]. –ü―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ϋ―΄–Β ―Ä–Α–Ϋ–Β–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η, ―΅―²–Ψ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Β–Ε–Β–Φ–Β―¹―è―΅–Ϋ―΄–Φ–Η ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Φ–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η –Φ–Α―Ä–Κ–Β―Ä―΄ –™–£–‰ –Ψ–±–Ϋ–Α―Ä―É–Ε–Η–≤–Α―é―²―¹―è –≤ 91% ―¹–Μ―É―΅–Α–Β–≤. –ü―Ä–Η ―ç―²–Ψ–Φ, –Ω–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –Ϋ–Α―à–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, –≤ –≥―Ä―É–Ω–Ω–Β –¥–Β―²–Β–Ι ―¹ –Β–Ε–Β–Φ–Β―¹―è―΅–Ϋ―΄–Φ–Η ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Φ–Η –Η–Ϋ―³–Β–Κ―Ü–Η―è–Φ–Η –¥–Ψ–Μ―è –Α–Κ―²–Η–≤–Ϋ―΄―Ö ―³–Ψ―Ä–Φ ―¹–Ψ―¹―²–Α–≤–Μ―è–Β―² –Ψ–Κ–Ψ–Μ–Ψ 40%, ―΅―²–Ψ –Β―â–Β ―Ä–Α–Ζ –Ω–Ψ–¥―΅–Β―Ä–Κ–Η–≤–Α–Β―² –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²―¨ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–≥–Ψ –Ω–Ψ–¥―Ö–Ψ–¥–Α –Κ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Β ―ç―²–Η–Ψ–Μ–Ψ–≥–Η–Η ―Ä–Β–Κ―É―Ä―Ä–Β–Ϋ―²–Ϋ―΄―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η–Ι –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α [3].
–£ –Ω–Ψ―¹–Μ–Β–¥–Ϋ–Η–Β –≥–Ψ–¥―΄ ―¹―²–Α–Ϋ–Ψ–≤–Η―²―¹―è –Α–Κ―²―É–Α–Μ―¨–Ϋ–Ψ–Ι –Ω―Ä–Ψ–±–Μ–Β–Φ–Α ―¹–Ψ―΅–Β―²–Α–Ϋ–Ϋ―΄―Ö –™–£–‰. –ù–Α–Μ–Η―΅–Η–Β ―¹―Ä–Α–Ζ―É –Ϋ–Β―¹–Κ–Ψ–Μ―¨–Κ–Η―Ö –≥–Β―Ä–Ω–Β―¹–≤–Η―Ä―É―¹–Ψ–≤ –≤ –Α–Κ―²–Η–≤–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ–Β –≤ –Ψ―¹―²―Ä–Ψ–Ι ―³–Α–Ζ–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è –Φ–Β–Ϋ―è–Β―² –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ―É―é –Κ–Α―Ä―²–Η–Ϋ―É –Η –Ζ–Α―²―Ä―É–¥–Ϋ―è–Β―² –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―É―é –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ―É ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è.
–£ ―Ä–Α–±–Ψ―²–Β –ù.–™. –·―Ä–Ψ―¹–Μ–Α–≤―Ü–Β–≤–Ψ–Ι [4] –Ω―Ä–Ψ–¥–Β–Φ–Ψ–Ϋ―¹―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Ψ, ―΅―²–Ψ –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―è –î–ù–ö –£–™–ß-6 –≤ –Μ–Β–Ι–Κ–Ψ―Ü–Η―²–Α―Ö –Ω–Β―Ä–Η―³–Β―Ä–Η―΅–Β―¹–Κ–Ψ–Ι –Κ―Ä–Ψ–≤–Η –Η –Ω–Μ–Α–Ζ–Φ–Β –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ω–Ψ―΅―²–Η –≤ 3 ―Ä–Α–Ζ–Α –Ϋ–Η–Ε–Β –Ω―Ä–Η ―¹–Φ–Β―à–Α–Ϋ–Ϋ–Ψ–Ι –™–£–‰, ―΅–Β–Φ –Ω―Ä–Η –Φ–Ψ–Ϋ–Ψ–Η–Ϋ―³–Β–Κ―Ü–Η–Η –£–™–ß-6 (5,9Ο½104 –Η 2Ο½104 ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ). –ë–Ψ–Μ–Β–Β ―Ä–Α–Ϋ–Ϋ–Η–Β ―Ä–Α–±–Ψ―²―΄ –¥–Β–Φ–Ψ–Ϋ―¹―²―Ä–Η―Ä–Ψ–≤–Α–Μ–Η ―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²―¨ –£–™–ß-6 –Κ –Α–Κ―²–Η–≤–Α―Ü–Η–Η ―Ä–Β–Ω–Μ–Η–Κ–Α―Ü–Η–Η –£–≠–ë –Η–Ζ –Μ–Α―²–Β–Ϋ―²–Ϋ–Ψ–≥–Ψ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è –Ω―Ä–Η ―¹–Ψ―΅–Β―²–Α–Ϋ–Ϋ–Ψ–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Η [5, 6]. –£ ―¹–≤–Ψ―é –Ψ―΅–Β―Ä–Β–¥―¨, –Ω―Ä–Η―¹―É―²―¹―²–≤–Η–Β –≥–Β–Ϋ–Ψ–Φ–Α –£–≠–ë –¥–Β–Μ–Α–Μ–Ψ –£-–Κ–Μ–Β―²–Κ–Η –±–Ψ–Μ–Β–Β –≤–Ψ―¹–Ω―Ä–Η–Η–Φ―΅–Η–≤―΄–Φ–Η –Κ –Η–Ϋ―³–Β–Κ―Ü–Η–Η –£–™–ß-6 [7]. –Γ–Ψ―΅–Β―²–Α–Ϋ–Η–Β –Η–Ϋ―³–Β–Κ―Ü–Η–Η –£–™–ß-6 –Η –£–≠–ë –Ζ–Α―²―Ä―É–¥–Ϋ―è–Μ–Ψ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ―É –Α–Κ―²–Η–≤–Ϋ―΄―Ö ―³–Ψ―Ä–Φ –™–£–‰ ―É –±–Β―Ä–Β–Φ–Β–Ϋ–Ϋ―΄―Ö –Ε–Β–Ϋ―â–Η–Ϋ [8] –Η ―É –¥–Β―²–Β–Ι –Ω–Ψ―¹–Μ–Β ―²―Ä–Α–Ϋ―¹–Ω–Μ–Α–Ϋ―²–Α―Ü–Η–Η –Ω–Β―΅–Β–Ϋ–Η –Η –Ω–Ψ―΅–Β–Κ [9].
–û–¥–Ϋ–Η–Φ –Η–Ζ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –Η–Ζ―É―΅–Β–Ϋ–Ϋ―΄―Ö –≤–Ψ –≤―¹–Β–Φ –Φ–Η―Ä–Β –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ ―è–≤–Μ―è–Β―²―¹―è –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ [10, 11]. –ü―Ä–Β–Ω–Α―Ä–Α―² –Φ–Ψ–Ε–Β―² –≤–Μ–Η―è―²―¨ –Ϋ–Α ―É―Ä–Ψ–≤–Ϋ–Η –≤–Η―Ä―É―¹–Ϋ–Ψ–Ι –†–ù–ö, –Α–Κ―²–Η–≤–Β–Ϋ –≤ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η –≤–Η―Ä―É―¹–Α –Ω―Ä–Ψ―¹―²–Ψ–≥–Ψ –≥–Β―Ä–Ω–Β―¹–Α (–£–ü–™), –≤–Η―Ä―É―¹–Α –Ω–Α–Ω–Η–Μ–Μ–Ψ–Φ―΄ ―΅–Β–Μ–Ψ–≤–Β–Κ–Α, –≤–Η―Ä―É―¹–Α –Η–Φ–Φ―É–Ϋ–Ψ–¥–Β―³–Η―Ü–Η―²–Α ―΅–Β–Μ–Ψ–≤–Β–Κ–Α, –≤–Η―Ä―É―¹–Ψ–≤ –≥―Ä–Η–Ω–Ω–Α –Η –Ψ―¹―²―Ä―΄―Ö ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι, –Π–€–£-–Η–Ϋ―³–Β–Κ―Ü–Η–Η –Η –£–≠–ë [12].
–‰–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ (―¹–Η–Ϋ―²–Β―²–Η―΅–Β―¹–Κ–Ψ–Β ―¹–Ψ–Β–¥–Η–Ϋ–Β–Ϋ–Η–Β –Ω–Α―Ä–Α–Α–Φ–Η–Ϋ–Ψ–±–Β–Ϋ–Ζ–Ψ–Α―²–Α N-N-–¥–Η–Φ–Β―²–Η–Μ–Α–Φ–Η–Ϋ–Ψ-2-–Ω―Ä–Ψ–Ω–Α–Ϋ–Ψ–Μ–Α ―¹ –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –≤ –Φ–Ψ–Μ―è―Ä–Ϋ–Ψ–Φ ―¹–Ψ–Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η 3:1) ―à–Η―Ä–Ψ–Κ–Ψ –Η―¹–Ω–Ψ–Μ―¨–Ζ―É–Β―²―¹―è ―¹ 1971 –≥. –≤ –Κ–Α―΅–Β―¹―²–≤–Β –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–≥–Ψ ―¹―Ä–Β–¥―¹―²–≤–Α, –≤–Μ–Η―è–Β―² –Ϋ–Α –Η–Φ–Φ―É–Ϋ–Ϋ―É―é ―¹–Η―¹―²–Β–Φ―É, ―É―¹–Η–Μ–Η–≤–Α―è –Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―Ü–Η―é –Δ-–Μ–Η–Φ―³–Ψ―Ü–Η―²–Ψ–≤ –Η –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Β―¹―²–Β―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –Κ–Μ–Β―²–Ψ–Κ-–Κ–Η–Μ–Μ–Β―Ä–Ψ–≤, –Ω–Ψ–≤―΄―à–Α―è ―É―Ä–Ψ–≤–Ϋ–Η ―Ü–Η―²–Ψ–Κ–Η–Ϋ–Ψ–≤ [12βÄ™15].
–£ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―΄–Β ―ç―³―³–Β–Κ―²―΄ –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α –Ψ–±―ä―è―¹–Ϋ―è―é―² ―²―Ä–Β–Φ―è –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ–Α–Φ–Η:
–‰–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ ―¹–≤―è–Ζ―΄–≤–Α–Β―²―¹―è ―¹–Ψ ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η–Φ–Η ―Ä–Β―Ü–Β–Ω―²–Ψ―Ä–Α–Φ–Η –Κ–Μ–Β―²–Ψ―΅–Ϋ–Ψ–Ι –Φ–Β–Φ–±―Ä–Α–Ϋ―΄ –Μ–Η–Φ―³–Ψ―Ü–Η―²–Ψ–≤ –Η–Μ–Η –Ω―Ä–Ψ–Ϋ–Η–Κ–Α–Β―² –≤ –Κ–Μ–Β―²–Κ―É –Η –Ψ–Κ–Α–Ζ―΄–≤–Α–Β―² –Ω―Ä―è–Φ–Ψ–Β –≤–Μ–Η―è–Ϋ–Η–Β –Ϋ–Α –Ω–Β―Ä–Β–¥–Α―΅―É ―¹–Η–≥–Ϋ–Α–Μ–Ψ–≤, –Κ–Ψ―²–Ψ―Ä―΄–Β ―É–≤–Β–Μ–Η―΅–Η–≤–Α―é―² ―è–¥–Β―Ä–Ϋ–Ψ-―Ü–Η―²–Ψ–Ω–Μ–Α–Ζ–Φ–Α―²–Η―΅–Β―¹–Κ–Η–Ι ―²―Ä–Α–Ϋ―¹–Ω–Ψ―Ä―² –Η ―¹–Η–Ϋ―²–Β–Ζ –†–ù–ö –≤ –Μ–Η–Φ―³–Ψ―Ü–Η―²–Α―Ö. –≠―²–Ψ –Ω―Ä–Η–≤–Ψ–¥–Η―² –Κ ―¹―²–Η–Φ―É–Μ―è―Ü–Η–Η, ―¹–Ψ–Ζ―Ä–Β–≤–Α–Ϋ–Η―é –Η ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Η―Ä–Ψ–≤–Α–Ϋ–Η―é –Η–Ϋ―³–Η―Ü–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –≤–Η―Ä―É―¹–Ψ–Φ –Μ–Η–Φ―³–Ψ―Ü–Η―²–Ψ–≤ [16].
–‰–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ –Ω–Ψ–¥–Α–≤–Μ―è–Β―² ―¹–Η–Ϋ―²–Β–Ζ –†–ù–ö –≤–Η―Ä―É―¹–Α. –≠―²–Ψ―² –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Η–≤–Α–Β―² –Ω―Ä–Β–Ψ–±–Μ–Α–¥–Α–Ϋ–Η–Β –Φ–†–ù–ö –Ϋ–Α–¥ –†–ù–ö –≤ –Κ–Μ–Β―²–Κ–Α―Ö –Ψ―Ä–≥–Α–Ϋ–Η–Ζ–Φ–Α-―Ö–Ψ–Ζ―è–Η–Ϋ–Α, ―΅―²–Ψ ―¹–Ϋ–Η–Ε–Α–Β―² ―¹–Ω–Ψ―¹–Ψ–±–Ϋ–Ψ―¹―²―¨ –≤–Η―Ä―É―¹–Α –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä–Ψ–≤–Α―²―¨ ―¹–Η–Ϋ―²–Β–Ζ –±–Β–Μ–Κ–Α [17].
–‰–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ ―É―¹–Η–Μ–Η–≤–Α–Β―² –¥–Β–Ι―¹―²–≤–Η–Β ―ç–Ϋ–¥–Ψ–≥–Β–Ϋ–Ϋ–Ψ–≥–Ψ Έ≥-–‰–Λ–ù, ―΅―²–Ψ ―è–≤–Μ―è–Β―²―¹―è –Ψ–¥–Ϋ–Η–Φ –Η–Ζ –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ψ–≤ ―¹―²–Η–Φ―É–Μ–Η―Ä―É―é―â–Β–≥–Ψ –≤–Ψ–Ζ–¥–Β–Ι―¹―²–≤–Η―è –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –Ϋ–Α –Κ–Μ–Β―²–Ψ―΅–Ϋ―΄–Ι –Η–Φ–Φ―É–Ϋ–Ϋ―΄–Ι –Ψ―²–≤–Β―². –ü―Ä–Β–Ω–Α―Ä–Α―² ―¹–Ω–Ψ―¹–Ψ–±–Β–Ϋ –Ω–Ψ–≤―΄―à–Α―²―¨ ―É―Ä–Ψ–≤–Ϋ–Η –‰–¦-2 –Η Έ≥-–‰–Λ–ù, ―¹–Ϋ–Η–Ε–Α―²―¨ ―É―Ä–Ψ–≤–Β–Ϋ―¨ –‰–¦-10, ―¹―²–Η–Φ―É–Μ–Η―Ä–Ψ–≤–Α―²―¨ ―¹–Ψ–Ζ―Ä–Β–≤–Α–Ϋ–Η–Β –Η –¥–Η―³―³–Β―Ä–Β–Ϋ―Ü–Η―Ä–Ψ–≤–Κ―É –Δ-–Μ–Η–Φ―³–Ψ―Ü–Η―²–Ψ–≤, –Α ―²–Α–Κ–Ε–Β ―É―¹–Η–Μ–Η–≤–Α―²―¨ –Α–Κ―²–Η–≤–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Β –Μ–Η–Φ―³–Ψ–Ω―Ä–Ψ–Μ–Η―³–Β―Ä–Α―²–Η–≤–Ϋ―΄–Β ―Ä–Β–Α–Κ―Ü–Η–Η [15].
–£ 2020 –≥. –€. Votava –Η J. Beran –Ω―Ä–Β–¥–Μ–Ψ–Ε–Η–Μ–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ –≤ –Κ–Α―΅–Β―¹―²–≤–Β –Ϋ–Β―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Η–Φ–Φ―É–Ϋ–Ψ―¹―²–Η–Φ―É–Μ―è―²–Ψ―Ä–Α –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –Η–Ϋ―³–Β–Κ―Ü–Η–Η, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Ψ–Ι –≤–Η―Ä―É―¹–Ψ–Φ SARS-CoV-2 [18]. –û–¥–Ϋ–Α–Κ–Ψ –Ψ–Ω–Η―¹–Α–Ϋ–Η―è –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –Ω–Ψ –Η–Ζ―É―΅–Β–Ϋ–Η―é –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α –≤ –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Η SARS-Cov-2 in vitro –Η–Μ–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι –≤ –¥–Ψ―¹―²―É–Ω–Ϋ–Ψ–Ι –Μ–Η―²–Β―Ä–Α―²―É―Ä–Β –Ω–Ψ–Κ–Α –Ϋ–Β –≤―¹―²―Ä–Β―΅–Α–Μ–Ψ―¹―¨.
–£ 2016 –≥. J. Beran et al. –Ψ–Ω―É–±–Μ–Η–Κ–Ψ–≤–Α–Μ–Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ –Ω–Μ–Α―Ü–Β–±–Ψ-–Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä―É–Β–Φ–Ψ–≥–Ψ –¥–≤–Ψ–Ι–Ϋ–Ψ–≥–Ψ ―¹–Μ–Β–Ω–Ψ–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è IV ―³–Α–Ζ―΄, –≥–¥–Β –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ―΄ ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Η –±–Β–Ζ–Ψ–Ω–Α―¹–Ϋ–Ψ―¹―²―¨ –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α –Ω―Ä–Η –Ψ―¹―²―Ä–Ψ–Ι ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–Ι –≤–Η―Ä―É―¹–Ϋ–Ψ–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Η (–û–†–£–‰). –£ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –±―΄–Μ–Ψ –≤–Κ–Μ―é―΅–Β–Ϋ–Ψ 463 –≤–Ζ―Ä–Ψ―¹–Μ―΄―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ–Ϋ–Ψ–Ι –û–†–£–‰, –Η–Ζ –Ϋ–Η―Ö 231 –Ω–Ψ–Μ―É―΅–Α–Μ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹, 232 –Ω–Ψ–Μ―É―΅–Α–Μ–Η –Ω–Μ–Α―Ü–Β–±–Ψ. –£ –Η―¹―¹–Μ–Β–¥―É–Β–Φ–Ψ–Ι –≥―Ä―É–Ω–Ω–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―É–Μ―É―΅―à–Α–Μ–Ψ―¹―¨ –±―΄―¹―²―Ä–Β–Β, ―΅–Β–Φ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Μ–Α―Ü–Β–±–Ψ, ―¹―Ä–Β–¥–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Φ–Ψ–Μ–Ψ–Ε–Β 50 –Μ–Β―² –±–Β–Ζ –Ψ–Ε–Η―Ä–Β–Ϋ–Η―è ―¹―Ä–Ψ–Κ–Η –Κ―É–Ω–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –≥―Ä–Η–Ω–Ω–Ψ–Ω–Ψ–¥–Ψ–±–Ϋ―΄―Ö ―¹–Η–Φ–Ω―²–Ψ–Φ–Ψ–≤ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―¹–Ψ–Κ―Ä–Α―â–Α–Μ–Η―¹―¨. –û―²–Φ–Β―΅–Β–Ϋ–Α ―Ö–Ψ―Ä–Ψ―à–Α―è –Ω–Β―Ä–Β–Ϋ–Ψ―¹–Η–Φ–Ψ―¹―²―¨ –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α [19].
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –≤ –Μ―é–±–Ψ–Ι ―ç–Ω–Η–¥–Β–Φ–Η―΅–Β―¹–Κ–Η–Ι ―¹–Β–Ζ–Ψ–Ϋ ―¹―É―â–Β―¹―²–≤―É–Β―² –Ω―Ä–Ψ–±–Μ–Β–Φ–Α –≤―΄–±–Ψ―Ä–Α ―²–Α–Κ―²–Η–Κ–Η –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―É –¥–Β―²–Β–Ι ―¹ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Φ–Η –Η–Ϋ―³–Β–Κ―Ü–Η―è–Φ–Η, –≤ ―². ―΅. ―Ä–Β―Ü–Η–¥–Η–≤–Η―Ä―É―é―â–Η–Φ–Η. –£ ―ç―²–Η–Ψ–Μ–Ψ–≥–Η–Η ―ç―²–Η―Ö ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Ι –Η–≥―Ä–Α―é―² ―Ä–Ψ–Μ―¨ –Α–Κ―²–Η–≤–Ϋ―΄–Β ―³–Ψ―Ä–Φ―΄ –™–£–‰, –≤–Κ–Μ―é―΅–Α―è ―¹–Ψ―΅–Β―²–Α–Ϋ–Ϋ―΄–Β, –≤ ―¹–≤―è–Ζ–Η ―¹ ―ç―²–Η–Φ –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ ―¹ –¥–Ψ–Κ–Α–Ζ–Α–Ϋ–Ϋ―΄–Φ ―à–Η―Ä–Ψ–Κ–Η–Φ ―¹–Ω–Β–Κ―²―Ä–Ψ–Φ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è.
–Π–Β–Μ―¨ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è: –Ψ―Ü–Β–Ϋ–Κ–Α ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö ―¹―Ö–Β–Φ ―²–Β―Ä–Α–Ω–Η–Η ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α (–ù–Ψ―Ä–Φ–Ψ–Φ–Β–¥¬°) ―É –¥–Β―²–Β–Ι ―¹ –Β–Ε–Β–Φ–Β―¹―è―΅–Ϋ―΄–Φ–Η –Η–Ϋ―³–Β–Κ―Ü–Η―è–Φ–Η –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –Ϋ–Α ―³–Ψ–Ϋ–Β ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Η –™–£–‰, –≤ ―². ―΅. ―¹–Ψ―΅–Β―²–Α–Ϋ–Ϋ―΄―Ö ―³–Ψ―Ä–Φ.
–€–Α―²–Β―Ä–Η–Α–Μ –Η –Φ–Β―²–Ψ–¥―΄
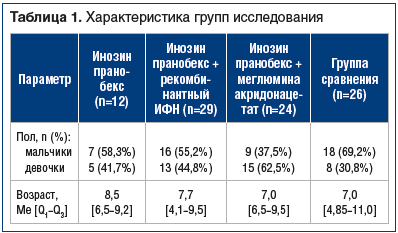
–û–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ 91 ―Ä–Β–±–Β–Ϋ–Ψ–Κ –≤ –≤–Ψ–Ζ―Ä–Α―¹―²–Β –Ψ―² 3 –¥–Ψ 17 –Μ–Β―² (―¹―Ä–Β–¥–Ϋ–Η–Ι –≤–Ψ–Ζ―Ä–Α―¹―² 6,9¬±0,42 –≥–Ψ–¥–Α), –Ϋ–Α–±–Μ―é–¥–Α–≤―à–Η–Ι―¹―è –Α–Φ–±―É–Μ–Α―²–Ψ―Ä–Ϋ–Ψ ―¹ –Ε–Α–Μ–Ψ–±–Α–Φ–Η –Ϋ–Α –Β–Ε–Β–Φ–Β―¹―è―΅–Ϋ―΄–Β –Η–Ϋ―³–Β–Κ―Ü–Η–Η –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ ―²―Ä–Α–Κ―²–Α –≤ ―²–Β―΅–Β–Ϋ–Η–Β –Ω―Ä–Β–¥―΄–¥―É―â–Η―Ö 3 –Φ–Β―¹. –Η –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ–Ψ –Ω–Ψ–¥―²–≤–Β―Ä–Ε–¥–Β–Ϋ–Ϋ―΄–Φ–Η –Α–Κ―²–Η–≤–Ϋ―΄–Φ–Η ―³–Ψ―Ä–Φ–Α–Φ–Η –™–£–‰, –≤ ―². ―΅. ―¹–Ψ―΅–Β―²–Α–Ϋ–Ϋ―΄―Ö ―³–Ψ―Ä–Φ.
–ü–Α―Ü–Η–Β–Ϋ―²―΄ –±―΄–Μ–Η ―Ä–Α–Ζ–¥–Β–Μ–Β–Ϋ―΄ –Ϋ–Α 4 –≥―Ä―É–Ω–Ω―΄ –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² ―¹–Ω–Ψ―¹–Ψ–±–Α –Μ–Β―΅–Β–Ϋ–Η―è. –£ 1-–Ι –≥―Ä―É–Ω–Ω–Β 12 –¥–Β―²–Β–Ι –Ω–Ψ–Μ―É―΅–Α–Μ–Η –Μ–Β―΅–Β–Ϋ–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–Φ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ –Ω–Ψ ―¹―Ö–Β–Φ–Β: –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ 10 –¥–Ϋ–Β–Ι, –Ζ–Α―²–Β–Φ 10 –¥–Ϋ–Β–Ι –Ω–Β―Ä–Β―Ä―΄–≤, –Ζ–Α―²–Β–Φ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ 10 –¥–Ϋ–Β–Ι. –£–Ψ 2-–Ι –≥―Ä―É–Ω–Ω–Β 29 –¥–Β―²–Β–Ι –Ω–Ψ–Μ―É―΅–Α–Μ–Η –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ 10 –¥–Ϋ–Β–Ι, –Ζ–Α―²–Β–Φ ―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α–Ϋ―²–Ϋ―΄–Ι –‰–Λ–ù-Έ±2b –≤ ―³–Ψ―Ä–Φ–Β ―Ä–Β–Κ―²–Α–Μ―¨–Ϋ―΄―Ö ―¹―É–Ω–Ω–Ψ–Ζ–Η―²–Ψ―Ä–Η–Β–≤ 10 –¥–Ϋ–Β–Ι, –Ζ–Α―²–Β–Φ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ 10 –¥–Ϋ–Β–Ι. –‰ –≤ 3-–Ι –≥―Ä―É–Ω–Ω–Β 24 –¥–Β―²―è–Φ –±―΄–Μ–Α –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Α ―²–Β―Ä–Α–Ω–Η―è –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Ψ–Φ 10 –¥–Ϋ–Β–Ι, –Ζ–Α―²–Β–Φ –Φ–Β–≥–Μ―É–Φ–Η–Ϋ–Α –Α–Κ―Ä–Η–¥–Ψ–Ϋ–Α―Ü–Β―²–Α―²–Ψ–Φ –Ω–Ψ ―¹―Ö–Β–Φ–Β –Ϋ–Α 1, 2, 4, 6, 8, 11, 14, 17, 20-–Β, 23-–Η ―¹―É―²–Κ–Η. –™―Ä―É–Ω–Ω―É ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è ―¹–Ψ―¹―²–Α–≤–Η–Μ–Η 26 –¥–Β―²–Β–Ι, –Κ–Ψ―²–Ψ―Ä―΄–Φ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Α―¹―¨ –Φ–Β―¹―²–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è –≤–Ψ―¹–Ω–Α–Μ–Η―²–Β–Μ―¨–Ϋ―΄―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι –≤ ―Ä–Ψ―²–Ψ–≥–Μ–Ψ―²–Κ–Β –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄–Φ–Η ―¹―Ä–Β–¥―¹―²–≤–Α–Φ–Η ―Ä–Α―¹―²–Η―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ–Η―¹―Ö–Ψ–Ε–¥–Β–Ϋ–Η―è. –î–Ψ–Ζ–Α –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α –≤ ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Η–Η ―¹ –Η–Ϋ―¹―²―Ä―É–Κ―Ü–Η–Β–Ι –Ω―Ä–Ψ–Η–Ζ–≤–Ψ–¥–Η―²–Β–Μ―è ―¹–Ψ―¹―²–Α–≤–Μ―è–Μ–Α 50βÄ™75 –Φ–≥/–Κ–≥/―¹―É―², ―Ä–Α–Ζ–¥–Β–Μ–Β–Ϋ–Ϋ―΄―Ö –Ϋ–Α 3βÄ™4 –Ω―Ä–Η–Β–Φ–Α. –™―Ä―É–Ω–Ω―΄ –±―΄–Μ–Η ―¹–Ψ–Ω–Ψ―¹―²–Α–≤–Η–Φ―΄ –Ω–Ψ –≤–Ψ–Ζ―Ä–Α―¹―²―É –Η –≥–Β–Ϋ–¥–Β―Ä–Ϋ―΄–Φ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Α–Φ (―²–Α–±–Μ. 1).
–£―¹–Β–Φ –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ψ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ–Ψ–Β –Κ–Μ–Η–Ϋ–Η–Κ–Ψ-–Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –¥–Ψ –Ϋ–Α―΅–Α–Μ–Α ―²–Β―Ä–Α–Ω–Η–Η, –Α ―²–Α–Κ–Ε–Β –Ω–Ψ―¹–Μ–Β –Ζ–Α–≤–Β―Ä―à–Β–Ϋ–Η―è –Μ–Β―΅–Β–Ϋ–Η―è. –î–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Α –™–£–‰ –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Α―¹―¨ –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Η–Η –Κ–Ψ―¹–≤–Β–Ϋ–Ϋ―΄―Ö –Η –Ω―Ä―è–Φ―΄―Ö –¥–Α–Ϋ–Ϋ―΄―Ö.
–€–Β―²–Ψ–¥–Ψ–Φ –ü–Π–† ―¹ –≥–Η–±―Ä–Η–¥–Η–Ζ–Α―Ü–Η–Ψ–Ϋ–Ϋ–Ψ-―³–Μ―É–Ψ―Ä–Β―¹―Ü–Β–Ϋ―²–Ϋ–Ψ–Ι –¥–Β―²–Β–Κ―Ü–Η–Β–Ι ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤ –Α–Ϋ–Α–Μ–Η–Ζ–Α –≤ ―Ä–Β–Ε–Η–Φ–Β ―Ä–Β–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η –≤ –Ψ–±―Ä–Α–Ζ―Ü–Α―Ö –Ω–Β―Ä–Η―³–Β―Ä–Η―΅–Β―¹–Κ–Ψ–Ι –Κ―Ä–Ψ–≤–Η, –Φ–Α–Ζ–Κ–Α―Ö –Η–Ζ ―Ä–Ψ―²–Ψ–≥–Μ–Ψ―²–Κ–Η –≤―΄―è–≤–Μ―è–Μ–Η –Η –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Β–Ϋ–Ϋ–Ψ –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Η –î–ù–ö –£–™–ß 5 ―²–Η–Ω–Α, –£–™–ß 6 ―²–Η–Ω–Α, –£–™–ß 4 ―²–Η–Ω–Α. –ü–Π–†-–Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η –Ω―Ä–Η –Ω–Ψ–Φ–Ψ―â–Η –Ϋ–Α–±–Ψ―Ä–Ψ–≤ ―Ä–Β–Α–≥–Β–Ϋ―²–Ψ–≤, ―Ä–Α–Ζ―Ä–Α–±–Ψ―²–Α–Ϋ–Ϋ―΄―Ö –≤ –Λ–ë–Θ–ù –Π–ù–‰–‰ –≠–Ω–Η–¥–Β–Φ–Η–Ψ–Μ–Ψ–≥–Η–Η –†–Ψ―¹–Ω–Ψ―²―Ä–Β–±–Ϋ–Α–¥–Ζ–Ψ―Ä–Α.
–ö―Ä–Ψ–≤―¨ –Η –Φ–Α–Ζ–Κ–Η –Η–Ζ ―Ä–Ψ―²–Ψ–≥–Μ–Ψ―²–Κ–Η –Ω―Ä–Ψ–≤–Β―Ä―è–Μ–Η –Ϋ–Α –Ϋ–Α–Μ–Η―΅–Η–Β –Α–Ϋ―²–Η–≥–Β–Ϋ–Ψ–≤ –≤–Η―Ä―É―¹–Α. –ë―΄―¹―²―Ä―΄–Φ –Κ―É–Μ―¨―²―É―Ä–Α–Μ―¨–Ϋ―΄–Φ –Φ–Β―²–Ψ–¥–Ψ–Φ (vero, u937) –≤―΄―è–≤–Μ―è–Μ–Η ―Ä–Α–Ϋ–Ϋ–Η–Β –Α–Ϋ―²–Η–≥–Β–Ϋ―΄ –£–™–ß-6 –≤ ―¹―΄–≤–Ψ―Ä–Ψ―²–Κ–Β –Κ―Ä–Ψ–≤–Η, –Κ–Μ–Β―²–Κ–Α―Ö –Κ―Ä–Ψ–≤–Η, –Φ–Α–Ζ–Κ–Β –Η–Ζ ―Ä–Ψ―²–Ψ–≥–Μ–Ψ―²–Κ–Η. –€–Β―²–Ψ–¥–Ψ–Φ –Ϋ–Β–Ω―Ä―è–Φ–Ψ–Ι ―Ä–Β–Α–Κ―Ü–Η–Η –Η–Φ–Φ―É–Ϋ–Ψ―³–Μ―é–Ψ―Ä–Β―¹―Ü–Β–Ϋ―Ü–Η–Η (―ç–Κ―¹–Ω–Β―Ä–Η–Φ–Β–Ϋ―²–Α–Μ―¨–Ϋ―΄–Β ―²–Β―¹―²-―¹–Η―¹―²–Β–Φ―΄, ―¹–Ψ–Ζ–¥–Α–Ϋ–Ϋ―΄–Β –≤ –Λ–™–ë–Θ –ù–‰–Π–≠–€ –Η–Φ. –ù.–Λ. –™–Α–Φ–Α–Μ–Β–Η –€–Η–Ϋ–Ζ–¥―Ä–Α–≤–Α –†–Ψ―¹―¹–Η–Η) –≤―΄―è–≤–Μ―è–Μ–Η –Ω–Ψ–Ζ–¥–Ϋ–Η–Β –Α–Ϋ―²–Η–≥–Β–Ϋ―΄ –£–™–ß-6 –≤ ―¹―΄–≤–Ψ―Ä–Ψ―²–Κ–Β –Κ―Ä–Ψ–≤–Η, –Κ–Μ–Β―²–Κ–Α―Ö –Κ―Ä–Ψ–≤–Η, –Φ–Α–Ζ–Κ–Β –Η–Ζ ―Ä–Ψ―²–Ψ–≥–Μ–Ψ―²–Κ–Η.
–€–Β―²–Ψ–¥–Ψ–Φ –Η–Φ–Φ―É–Ϋ–Ψ―³–Β―Ä–Φ–Β–Ϋ―²–Ϋ–Ψ–≥–Ψ –Α–Ϋ–Α–Μ–Η–Ζ–Α –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Η –≤–Η―Ä―É―¹―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η–Β Ig–€ –Η IgG –Κ –±–Β–Μ–Κ–Α–Φ –£–ü–™-1, –£–≠–ë, –Π–€–£ ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é –Ϋ–Α–±–Ψ―Ä–Ψ–≤ ―³–Η―Ä–Φ―΄ ¬Ϊ–£–Β–Κ―²–Ψ―Ä-–ë–Β―¹―²¬Μ (–†–Ψ―¹―¹–Η―è). –£―΄―è–≤–Μ–Β–Ϋ–Η–Β ―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η―Ö IgG –Κ –Α–Ϋ―²–Η–≥–Β–Ϋ–Α–Φ –£–™–ß-6 –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Η –Φ–Β―²–Ψ–¥–Ψ–Φ –Η–Φ–Φ―É–Ϋ–Ψ―³–Β―Ä–Φ–Β–Ϋ―²–Ϋ–Ψ–≥–Ψ –Α–Ϋ–Α–Μ–Η–Ζ–Α ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ϋ–Α–±–Ψ―Ä–Α ―Ä–Β–Α–≥–Β–Ϋ―²–Ψ–≤ ¬Ϊ–£–Β–Κ―²–ΨHHV-6-IgG¬Μ (–†–Θ β³• –Λ–Γ–† 2011/09853 2166, –½–ê–û ¬Ϊ–£–Β–Κ―²–Ψ―Ä-–ë–Β―¹―²¬Μ, –†–Ψ―¹―¹–Η―è) –Ϋ–Α –Α–≤―²–Ψ–Φ–Α―²–Η―΅–Β―¹–Κ–Ψ–Φ –Η–Φ–Φ―É–Ϋ–Ψ―³–Β―Ä–Φ–Β–Ϋ―²–Ϋ–Ψ–Φ –Α–Ϋ–Α–Μ–Η–Ζ–Α―²–Ψ―Ä–Β Freedom EVOlyzer 200 (TECAN Schweiz AG, –®–≤–Β–Ι―Ü–Α―Ä–Η―è). –ö–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η―é –≤–Η―Ä―É―¹―¹–Ω–Β―Ü–Η―³–Η―΅–Β―¹–Κ–Η―Ö IgG –Ψ―Ü–Β–Ϋ–Η–≤–Α–Μ–Η –Ω–Ψ –Κ–Ψ―ç―³―³–Η―Ü–Η–Β–Ϋ―²―É –Ω–Ψ–Ζ–Η―²–Η–≤–Ϋ–Ψ―¹―²–Η: –Ω–Ψ–Μ–Ψ–Ε–Η―²–Β–Μ―¨–Ϋ―΄–Ι ―Ä–Β–Ζ―É–Μ―¨―²–Α―² βâΞ1,0; –Ω–Ψ–≥―Ä–Α–Ϋ–Η―΅–Ϋ―΄–Ι βÄî –Ψ―² βâΞ0,8 –¥–Ψ <1,0; –Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ―΄–Ι βÄî <0,80.
–û―¹―²―Ä–Α―è –Ω–Β―Ä–≤–Η―΅–Ϋ–Α―è –Η–Ϋ―³–Β–Κ―Ü–Η―è –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―Ä–Ψ–≤–Α–Μ–Α―¹―¨ –Ω―Ä–Η –Ϋ–Α–Μ–Η―΅–Η–Η –≤–Η―Ä–Β–Φ–Η–Η, –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Η ―É―Ä–Ψ–≤–Ϋ―è IgM, –Α ―²–Α–Κ–Ε–Β –Ψ―²―¹―É―²―¹―²–≤–Η–Η IgG. –†–Β–Α–Κ―²–Η–≤–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Α―è –Η–Ϋ―³–Β–Κ―Ü–Η―è –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Μ–Α―¹―¨ –Ω―Ä–Η –≤–Η―Ä–Β–Φ–Η–Η –Η –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Η ―É―Ä–Ψ–≤–Ϋ―è IgG –≤ 2,5 ―Ä–Α–Ζ–Α –Η –±–Ψ–Μ–Β–Β. –ü–Ψ–≤―΄―à–Β–Ϋ–Η–Β IgG –Η/–Η–Μ–Η –Ϋ–Α–Μ–Η―΅–Η–Β –î–ù–ö –≤–Η―Ä―É―¹–Α –≤ –Φ–Α–Ζ–Κ–Β –Η–Ζ ―Ä–Ψ―²–Ψ–≥–Μ–Ψ―²–Κ–Η –±–Β–Ζ –≤–Η―Ä–Β–Φ–Η–Η ―Ä–Α―¹―Ü–Β–Ϋ–Η–≤–Α–Μ–Ψ―¹―¨ –Κ–Α–Κ –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η–Β –Μ–Α―²–Β–Ϋ―²–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ―΄ –Η–Ϋ―³–Β–Κ―Ü–Η–Η.
–î–Μ―è –Ψ–±―ä–Β–Κ―²–Η–≤–Ϋ–Ψ–Ι –Ψ―Ü–Β–Ϋ–Κ–Η –¥–Α–Ϋ–Ϋ―΄―Ö –¥–Ψ –Η –Ω–Ψ―¹–Μ–Β –Ϋ–Α–Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è –Κ―É―Ä―¹–Α –Η―¹―¹–Μ–Β–¥―É–Β–Φ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –Ω―Ä–Η–Φ–Β–Ϋ―è–Μ–Α―¹―¨ ―¹―Ö–Β–Φ–Α ―Ä–Α–Ϋ–Ε–Η―Ä–Ψ–≤–Α–Ϋ–Η―è –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤, –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Ϋ–Α―è –≤ ―²–Α–±–Μ–Η―Ü–Β 2.

–Δ–Α–Κ–Ε–Β –Ψ―Ü–Β–Ϋ–Η–≤–Α–Μ–Η –≤–Η―Ä―É―¹–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ―É―é –Η –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Ϋ―É―é –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ―É―é ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Μ–Β―΅–Β–Ϋ–Η―è –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η–Ι –Ψ―¹―²―Ä–Ψ–≥–Ψ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è (–û–†–½): –Ω–Ψ–Μ–Ϋ–Α―è ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ βÄî –Ψ―²―¹―É―²―¹―²–≤–Η–Β –û–†–½ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 3 –Φ–Β―¹. –Ψ―² –Ϋ–Α―΅–Α–Μ–Α ―²–Β―Ä–Α–Ω–Η–Η; –Ϋ–Β–Ω–Ψ–Μ–Ϋ–Α―è ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ βÄî ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Β ―΅–Η―¹–Μ–Α –û–†–½ –Η/–Η–Μ–Η ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―²―è–Ε–Β―¹―²–Η ―²–Β―΅–Β–Ϋ–Η―è; –Ψ―²―¹―É―²―¹―²–≤–Η–Β ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η βÄî ―¹–Ψ―Ö―Ä–Α–Ϋ―è―é―â–Η–Β―¹―è –Β–Ε–Β–Φ–Β―¹―è―΅–Ϋ―΄–Β –û–†–½.
–Γ―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Α―è –Ψ–±―Ä–Α–±–Ψ―²–Κ–Α –¥–Α–Ϋ–Ϋ―΄―Ö –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Α―¹―¨ ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ Microsoft Office Excel 2016, IBM SPSS Statistics v.26. –î–Μ―è –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –Ω―Ä–Η –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–Φ ―Ä–Α―¹–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Η ―Ä–Α―¹―¹―΅–Η―²―΄–≤–Α–Μ–Η―¹―¨ ―¹―Ä–Β–¥–Ϋ–Η–Β –Α―Ä–Η―³–Φ–Β―²–Η―΅–Β―¹–Κ–Η–Β –≤–Β–Μ–Η―΅–Η–Ϋ―΄ (M¬±SD), –¥–Μ―è ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è –≤―΄–±–Ψ―Ä–Ψ–Κ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Μ―¹―è t-–Κ―Ä–Η―²–Β―Ä–Η–Ι –Γ―²―¨―é–¥–Β–Ϋ―²–Α; –Ω―Ä–Η ―Ä–Α―¹–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Η, –Ψ―²–Μ–Η―΅–Ϋ–Ψ–Φ –Ψ―² –Ϋ–Ψ―Ä–Φ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ, ―Ä–Α―¹―¹―΅–Η―²―΄–≤–Α–Μ–Η―¹―¨ –Φ–Β–¥–Η–Α–Ϋ―΄ (Me) –Η –Φ–Β–Ε–Κ–≤–Α―Ä―²–Η–Μ―¨–Ϋ―΄–Ι –Η–Ϋ―²–Β―Ä–≤–Α–Μ (Q1βÄ™Q3), –¥–Μ―è ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è ―¹–Ψ–≤–Ψ–Κ―É–Ω–Ϋ–Ψ―¹―²–Β–Ι –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Μ―¹―è U-–Κ―Ä–Η―²–Β―Ä–Η–Ι –€–Α–Ϋ–Ϋ–Α βÄî –Θ–Η―²–Ϋ–Η. –ù–Ψ–Φ–Η–Ϋ–Α–Μ―¨–Ϋ―΄–Β –¥–Α–Ϋ–Ϋ―΄–Β –Ψ–Ω–Η―¹–Α–Ϋ―΄ ―¹ ―É–Κ–Α–Ζ–Α–Ϋ–Η–Β–Φ –Α–±―¹–Ψ–Μ―é―²–Ϋ―΄―Ö –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Ι –Η –Ω―Ä–Ψ―Ü–Β–Ϋ―²–Ϋ―΄―Ö –¥–Ψ–Μ–Β–Ι. –Γ―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Β –Ϋ–Ψ–Φ–Η–Ϋ–Α–Μ―¨–Ϋ―΄―Ö –¥–Α–Ϋ–Ϋ―΄―Ö –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Ψ―¹―¨ –Ω―Ä–Η –Ω–Ψ–Φ–Ψ―â–Η –Κ―Ä–Η―²–Β―Ä–Η―è œ΅2 –ü–Η―Ä―¹–Ψ–Ϋ–Α –Η ―²–Ψ―΅–Ϋ–Ψ–≥–Ψ –Κ―Ä–Η―²–Β―Ä–Η―è –Λ–Η―à–Β―Ä–Α. –†–Α–Ζ–Μ–Η―΅–Η―è ―¹―΅–Η―²–Α–Μ–Η―¹―¨ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ―΄–Φ–Η –Ω―Ä–Η ―Ä<0,05.
–†–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è
–û―Ü–Β–Ϋ–Κ–Α –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η
–û―Ü–Β–Ϋ–Κ–Α –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―²–Β―Ä–Α–Ω–Η–Η, –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Ϋ–Α―è –Ϋ–Α –¥–Η–Ϋ–Α–Φ–Η–Κ–Β –Ζ–Β―Ä–Ϋ–Η―¹―²–Ψ―¹―²–Η –Ζ–Α–¥–Ϋ–Β–Ι ―¹―²–Β–Ϋ–Κ–Η –≥–Μ–Ψ―²–Κ–Η, –≥–Η–Ω–Β―Ä―²―Ä–Ψ―³–Η–Η –Φ–Η–Ϋ–¥–Α–Μ–Η–Ϋ, –Μ–Η–Φ―³–Α–¥–Β–Ϋ–Ψ–Ω–Α―²–Η–Η –Η –≥–Β–Ω–Α―²–Ψ–Φ–Β–≥–Α–Μ–Η–Η, –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Α –≤ ―²–Α–±–Μ–Η―Ü–Β 3.
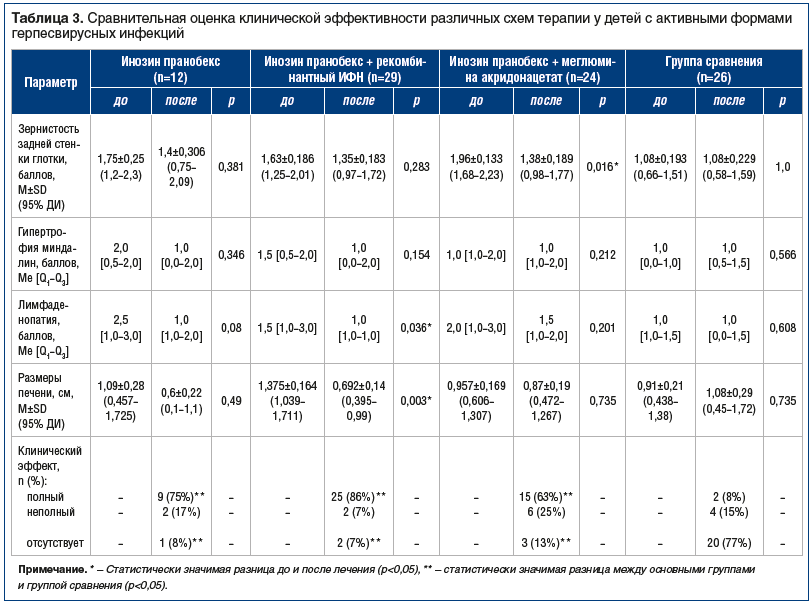
–ü―Ä–Η ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Η –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Ζ–Β―Ä–Ϋ–Η―¹―²–Ψ―¹―²–Η –Ζ–Α–¥–Ϋ–Β–Ι ―¹―²–Β–Ϋ–Κ–Η –≥–Μ–Ψ―²–Κ–Η –≤–Η–¥–Ϋ–Ψ, ―΅―²–Ψ –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ―΄–Φ –Ϋ–Α ―³–Ψ–Ϋ–Β –Ω―Ä–Ψ–≤–Ψ–¥–Η–Φ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –±―΄–Μ–Ψ –≤–Ψ―¹―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Η–Β ―¹–Μ–Η–Ζ–Η―¹―²–Ψ–Ι –Ζ–Α–¥–Ϋ–Β–Ι ―¹―²–Β–Ϋ–Κ–Η –≥–Μ–Ψ―²–Κ–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö –Κ―É―Ä―¹ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Ψ–Φ –≤ ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―¹ –Φ–Β–≥–Μ―É–Φ–Η–Ϋ–Α –Α–Κ―Ä–Β–¥–Ψ–Ϋ–Α―Ü–Β―²–Α―²–Ψ–Φ. –£–Ψ –≤―¹–Β―Ö –Η―¹―¹–Μ–Β–¥―É–Β–Φ―΄―Ö –≥―Ä―É–Ω–Ω–Α―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―Ä–Α–Ζ–Φ–Β―Ä–Α –Ϋ–Β–±–Ϋ―΄―Ö –Φ–Η–Ϋ–¥–Α–Μ–Η–Ϋ –¥–Ψ –Η –Ω–Ψ―¹–Μ–Β –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è ―²–Β―Ä–Α–Ω–Η–Η, –Α ―²–Α–Κ–Ε–Β –≤ –≥―Ä―É–Ω–Ω–Β ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è –±―΄–Μ–Η ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –Ϋ–Β–Ζ–Ϋ–Α―΅–Η–Φ―΄–Φ–Η. –ü―Ä–Η ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Η ―¹―²–Β–Ω–Β–Ϋ–Η –Μ–Η–Φ―³–Α–¥–Β–Ϋ–Ψ–Ω–Α―²–Η–Η, –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–Ι –≤ –±–Α–Μ–Μ–Α―Ö (–Κ―Ä–Η―²–Β―Ä–Η–Ι –€–Α–Ϋ–Ϋ–Α βÄî –Θ–Η―²–Ϋ–Η), –±―΄–Μ–Ψ ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ ―Ä–Α–Ζ–Μ–Η―΅–Η―è –≤ –≥―Ä―É–Ω–Ω–Α―Ö ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –Ϋ–Β–Ζ–Ϋ–Α―΅–Η–Φ―΄, –Ζ–Α –Η―¹–Κ–Μ―é―΅–Β–Ϋ–Η–Β–Φ –≥―Ä―É–Ω–Ω―΄ ―¹ ―²–Β―Ä–Α–Ω–Η–Β–Ι –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Ψ–Φ –≤ ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―¹ ―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α–Ϋ―²–Ϋ―΄–Φ –‰–Λ–ù, –≥–¥–Β –±―΄–Μ–Η –Ψ―²–Φ–Β―΅–Β–Ϋ―΄ ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –Ζ–Ϋ–Α―΅–Η–Φ―΄–Β ―Ä–Α–Ζ–Μ–Η―΅–Η―è (―Ä=0,036). –£―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Μ–Η–Φ―³–Α–¥–Β–Ϋ–Ψ–Ω–Α―²–Η–Η –±―΄–Μ–Α –≤―΄―à–Β –¥–Ψ ―²–Β―Ä–Α–Ω–Η–Η, ―΅–Β–Φ –Ω–Ψ―¹–Μ–Β ―²–Β―Ä–Α–Ω–Η–Η (1,5 –Η 1,0 –±–Α–Μ–Μ–Α ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ). –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –±―΄―¹―²―Ä–Ψ ―É–Φ–Β–Ϋ―¨―à–Β–Ϋ–Η–Β –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ―¹―²–Η –Ω–Ψ–Μ–Η–Μ–Η–Φ―³–Α–¥–Β–Ϋ–Ψ–Ω–Α―²–Η–Η –Ϋ–Α―¹―²―É–Ω–Α–Μ–Ψ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö ―²–Β―Ä–Α–Ω–Η―é –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Ψ–Φ –≤ ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―¹ ―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α–Ϋ―²–Ϋ―΄–Φ –‰–Λ–ù.
–ü―Ä–Η ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Η ―Ä–Α–Ζ–Φ–Β―Ä–Ψ–≤ –Ω–Β―΅–Β–Ϋ–Η –≤―΄―è–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ –≤ –≥―Ä―É–Ω–Ω–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η―Ö ―²–Β―Ä–Α–Ω–Η―é ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Β–Φ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ + ―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α–Ϋ―²–Ϋ―΄–Ι –‰–Λ–ù, –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨ –¥–Ψ –Η –Ω–Ψ―¹–Μ–Β ―²–Β―Ä–Α–Ω–Η–Η –Η–Φ–Β–Μ ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –Ζ–Ϋ–Α―΅–Η–Φ―΄–Β ―Ä–Α–Ζ–Μ–Η―΅–Η―è (―Ä=0,003 –Ω–Ψ t-–Κ―Ä–Η―²–Β―Ä–Η―é –Γ―²―¨―é–¥–Β–Ϋ―²–Α).
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Ι ―ç―³―³–Β–Κ―², –Ψ―Ü–Β–Ϋ–Β–Ϋ–Ϋ―΄–Ι ―¹ –Ω–Ψ–Φ–Ψ―â―¨―é ―É―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ϋ―΄―Ö –Κ―Ä–Η―²–Β―Ä–Η–Β–≤ (―¹–Φ. ―²–Α–±–Μ. 2), –±―΄–Μ –¥–Ψ―¹―²–Η–≥–Ϋ―É―² ―É –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Α –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Κ–Ψ―²–Ψ―Ä―΄–Β –Ω–Ψ–Μ―É―΅–Α–Μ–Η –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―É―é ―²–Β―Ä–Α–Ω–Η―é. –ù–Α–Η–±–Ψ–Μ―¨―à–Α―è –¥–Ψ–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Ω–Ψ–Μ–Ϋ―΄–Φ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Φ ―ç―³―³–Β–Κ―²–Ψ–Φ, ―². –Β. –Ψ―²―¹―É―²―¹―²–≤–Η–Β–Φ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι –≤ ―²–Β―΅–Β–Ϋ–Η–Β 3 –Φ–Β―¹. –Ψ―² –Ϋ–Α―΅–Α–Μ–Α –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è, –±―΄–Μ–Α –≤ –≥―Ä―É–Ω–Ω–Β ―²–Β―Ä–Α–Ω–Η–Η –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Ψ–Φ –≤ ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―¹ ―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α–Ϋ―²–Ϋ―΄–Φ –‰–Λ–ù βÄî 86%, –≤ –≥―Ä―É–Ω–Ω–Β –Φ–Ψ–Ϋ–Ψ―²–Β―Ä–Α–Ω–Η–Η –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Ψ–Φ –Ω–Ψ–Μ–Ϋ―΄–Ι –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Ι ―ç―³―³–Β–Κ―² –¥–Ψ―¹―²–Η–≥–Ϋ―É―² ―É 75% –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –≤ –≥―Ä―É–Ω–Ω–Β ―²–Β―Ä–Α–Ω–Η–Η –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Ψ–Φ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Ψ–Φ –≤ ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―¹ –Φ–Β–≥–Μ―é–Φ–Η–Ϋ–Α –Α–Κ―Ä–Η–¥–Ψ–Ϋ–Α―Ü–Β―²–Α―²–Ψ–Φ βÄî ―É 63%, –Α –≤ –≥―Ä―É–Ω–Ω–Β ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è, –Ϋ–Β –Ω–Ψ–Μ―É―΅–Α–≤―à–Β–Ι ―ç―²–Η–Ψ―²―Ä–Ψ–Ω–Ϋ―É―é ―²–Β―Ä–Α–Ω–Η―é, βÄî ―²–Ψ–Μ―¨–Κ–Ψ –≤ 8% ―¹–Μ―É―΅–Α–Β–≤. –†–Α–Ζ–Μ–Η―΅–Η―è –Φ–Β–Ε–¥―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ–Η, –Ω–Ψ–Μ―É―΅–Α–≤―à–Η–Φ–Η ―²–Β―Ä–Α–Ω–Η―é, –Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α–Φ–Η –≥―Ä―É–Ω–Ω―΄ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ―΄.
–û―Ü–Β–Ϋ–Κ–Α –≤–Η―Ä―É―¹–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η
–Γ―²―Ä―É–Κ―²―É―Ä–Α –™–£–‰ –¥–Ψ –Η –Ω–Ψ―¹–Μ–Β –Μ–Β―΅–Β–Ϋ–Η―è –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Α –Ϋ–Α ―Ä–Η―¹―É–Ϋ–Κ–Β 1. –Γ―É–Φ–Φ–Α―Ä–Ϋ–Ψ –¥–Ψ –Ϋ–Α―΅–Α–Μ–Α ―²–Β―Ä–Α–Ω–Η–Η ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η―è, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Α―è –£–™–ß-6–ê/–£, –±―΄–Μ–Α –Ζ–Α―³–Η–Κ―¹–Η―Ä–Ψ–≤–Α–Ϋ–Α ―É 85,8% –¥–Β―²–Β–Ι, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Α―è –£–≠–ë βÄî ―É 35,6%, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Α―è –Π–€–£ βÄî ―É 7,5%, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ–Α―è –£–ü–™-1 βÄî ―É 16%. –î–Ψ ―²–Β―Ä–Α–Ω–Η–Η –Φ–Ψ–Ϋ–Ψ–Η–Ϋ―³–Β–Κ―Ü–Η–Η –±―΄–Μ–Η –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η―Ä–Ψ–≤–Α–Ϋ―΄ –±–Ψ–Μ–Β–Β ―΅–Β–Φ –≤ –Ω–Ψ–Μ–Ψ–≤–Η–Ϋ–Β ―¹–Μ―É―΅–Α–Β–≤, ―¹–Ψ―΅–Β―²–Α–Ϋ–Ϋ―΄–Β –™–£–‰ βÄî ―É 41% –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤, –Η–Ζ –Ϋ–Η―Ö –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―΅–Α―¹―²–Ψ –≤―΄―è–≤–Μ―è–Μ―¹―è –Φ–Η–Κ―¹―² –£–™–ß-6–ê/–£ + –£–≠–ë βÄî –≤ 23% ―¹–Μ―É―΅–Α–Β–≤. –ü–Ψ―¹–Μ–Β –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Μ–Β―΅–Β–Ϋ–Η―è ―É 63% –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Η–Φ–Β–Μ–Α –Φ–Β―¹―²–Ψ –Μ–Α―²–Β–Ϋ―²–Ϋ–Α―è –Η–Ϋ―³–Β–Κ―Ü–Η―è –£–™–ß-6–ê/–£, –¥–Ψ–Μ―è –Φ–Η–Κ―¹―²-–Η–Ϋ―³–Β–Κ―Ü–Η–Ι ―¹–Ψ―¹―²–Α–≤–Η–Μ–Α 8%.
–£–Η―Ä―É―¹–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Α―è ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Ψ―Ü–Β–Ϋ–Η–≤–Α–Μ–Α―¹―¨ –Ω–Ψ –¥–Ψ–Μ–Β –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Α–Κ―²–Η–≤–Ϋ―΄–Φ–Η ―³–Ψ―Ä–Φ–Α–Φ–Η –™–£–‰ –≤ –≥―Ä―É–Ω–Ω–Α―Ö –¥–Ψ –Η –Ω–Ψ―¹–Μ–Β –Μ–Β―΅–Β–Ϋ–Η―è. –î–Ψ–Μ―è –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Α–Κ―²–Η–≤–Ϋ–Ψ–Ι –Η–Ϋ―³–Β–Κ―Ü–Η–Β–Ι –£–™–ß-6–ê/–£ –Ω–Ψ―¹–Μ–Β –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η (65 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤) ―¹–Ψ―¹―²–Α–≤–Η–Μ–Α 35,4% (23 –Ω–Α―Ü–Η–Β–Ϋ―²–Α), –Α –≤ –≥―Ä―É–Ω–Ω–Β ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è (26 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤) ―ç―²–Ψ―² –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨ –±―΄–Μ ―Ä–Α–≤–Β–Ϋ 69,2% (18 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤). –ü―Ä–Η ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η–Η ―΅–Α―¹―²–Ψ―²―΄ ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Η –£–™–ß-6 –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –Ϋ–Α–Μ–Η―΅–Η―è ―ç―²–Η–Ψ―²―Ä–Ψ–Ω–Ϋ–Ψ–≥–Ψ –Μ–Β―΅–Β–Ϋ–Η―è –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–Φ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ (–≤ –≤–Η–¥–Β –Φ–Ψ–Ϋ–Ψ―²–Β―Ä–Α–Ω–Η–Η –Η –≤ ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―¹ –¥―Ä―É–≥–Η–Φ–Η –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―΄–Φ–Η ―¹―Ä–Β–¥―¹―²–≤–Α–Φ–Η) –±―΄–Μ–Η –≤―΄―è–≤–Μ–Β–Ϋ―΄ ―¹―²–Α―²–Η―¹―²–Η―΅–Β―¹–Κ–Η –Ζ–Ϋ–Α―΅–Η–Φ―΄–Β ―Ä–Α–Ζ–Μ–Η―΅–Η―è (p<0,01). –Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―ç―²–Η–Ψ―²―Ä–Ψ–Ω–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―É–Φ–Β–Ϋ―¨―à–Α–Β―² ―à–Α–Ϋ―¹―΄ ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Η –™–£–‰ –≤ 4,11 ―Ä–Α–Ζ–Α (95% –î–‰ 0,092βÄ™0,646). –€–Β–Ε–¥―É ―¹–Ψ–Ω–Ψ―¹―²–Α–≤–Μ―è–Β–Φ―΄–Φ–Η –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Α–Φ–Η –Ψ―²–Φ–Β―΅–Α–Μ–Α―¹―¨ ―¹―Ä–Β–¥–Ϋ―è―è ―¹–≤―è–Ζ―¨ (V=0,307).
–½–Α–Κ–Μ―é―΅–Β–Ϋ–Η–Β
–£–Ψ–Ω―Ä–Ψ―¹―΄ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –¥–Β―²–Β–Ι ―¹ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Φ–Η –Η–Ϋ―³–Β–Κ―Ü–Η―è–Φ–Η –¥–Ψ –Ϋ–Α―¹―²–Ψ―è―â–Β–≥–Ψ –Φ–Ψ–Φ–Β–Ϋ―²–Α –Ψ―¹―²–Α―é―²―¹―è –¥–Η―¹–Κ―É―¹―¹–Η–Ψ–Ϋ–Ϋ―΄–Φ–Η [20]. –Θ–Ζ–Κ–Η–Ι ―¹–Ω–Β–Κ―²―Ä –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è ―Ö–Η–Φ–Η–Ψ–Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –Η –Ψ―²―¹―É―²―¹―²–≤–Η–Β –¥–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –±–Α–Ζ―΄ –≤ –Ζ–Α―Ä―É–±–Β–Ε–Ϋ―΄―Ö ―¹―²―Ä–Α–Ϋ–Α―Ö –Ψ–≥―Ä–Α–Ϋ–Η―΅–Η–≤–Α―é―² –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―ç―²–Η―Ö –Μ–Β–Κ–Α―Ä―¹―²–≤–Β–Ϋ–Ϋ―΄―Ö ―¹―Ä–Β–¥―¹―²–≤ –≤ –¥–Β―²―¹–Κ–Ψ–Ι –Ω―Ä–Α–Κ―²–Η–Κ–Β [21]. –ü―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―΄–Β ―¹–≤–Ψ–Ι―¹―²–≤–Α –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α –Η–Ζ―É―΅–Α―é―²―¹―è ―¹ ―¹–Β―Ä–Β–¥–Η–Ϋ―΄ –Ξ–Ξ –≤. –≤ ―¹―²―Ä–Α–Ϋ–Α―Ö –ï–≤―Ä–Ψ–Ω―΄ –Η –Γ–®–ê [1, 3, 4, 6]. –ù–Α ―¹–Β–≥–Ψ–¥–Ϋ―è―à–Ϋ–Η–Ι –¥–Β–Ϋ―¨ –±–Μ–Α–≥–Ψ–¥–Α―Ä―è –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è–Φ in vitro –Ψ–±―ä―è―¹–Ϋ–Β–Ϋ―΄ –Β–≥–Ψ –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ―΄ –¥–Β–Ι―¹―²–≤–Η―è –Η –Ω―Ä–Ψ–¥–Β–Φ–Ψ–Ϋ―¹―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Α –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Α―è ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –≤ ―Ö–Ψ–¥–Β ―Ä–Α–Ϋ–¥–Ψ–Φ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι, –≤ ―². ―΅. –Ω–Μ–Α―Ü–Β–±–Ψ-–Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Η―Ä―É–Β–Φ―΄―Ö [9].
–î–Ψ–Κ–Α–Ζ–Α–Ϋ–Ϋ―΄–Ι ―³–Α–Κ―² –Ω―Ä―è–Φ–Ψ–≥–Ψ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–≥–Ψ –¥–Β–Ι―¹―²–≤–Η―è –Κ–Α–Κ –Ϋ–Α ―¹–Β–Ζ–Ψ–Ϋ–Ϋ―΄–Β ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β –≤–Η―Ä―É―¹―΄, ―²–Α–Κ –Η –Ϋ–Α –≥–Β―Ä–Ω–Β―¹–≤–Η―Ä―É―¹―΄ –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨ –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ ―É –¥–Β―²–Β–Ι ―¹ ―Ä–Β―Ü–Η–¥–Η–≤–Η―Ä―É―é―â–Η–Φ–Η ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Φ–Η –Η–Ϋ―³–Β–Κ―Ü–Η―è–Φ–Η, ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄–Φ–Η ―¹ ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Β–Ι –≥–Β―Ä–Ω–Β―¹–≤–Η―Ä―É―¹–Ψ–≤. –î–Μ―è –Μ–Β―΅–Β–Ϋ–Η―è –™–£–‰ –≤ –†–Ψ―¹―¹–Η–Ι―¹–Κ–Ψ–Ι –Λ–Β–¥–Β―Ä–Α―Ü–Η–Η, –Κ―Ä–Ψ–Φ–Β –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α, –Ζ–Α―Ä–Β–≥–Η―¹―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ―΄ –Η –¥―Ä―É–≥–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²―΄, –Η–Φ–Β―é―â–Η–Β –Ψ–Ω–Ψ―¹―Ä–Β–¥–Ψ–≤–Α–Ϋ–Ϋ―É―é –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ―É―é –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨: ―Ä–Β–Κ–Ψ–Φ–±–Η–Ϋ–Α–Ϋ―²–Ϋ―΄–Ι –‰–Λ–ù-Έ±2b, –Φ–Β–≥–Μ―É–Φ–Η–Ϋ–Α –Α–Κ―Ä–Η–¥–Ψ–Ϋ–Α―Ü–Β―²–Α―² –Η ―²–Η–Μ–Ψ―Ä–Ψ–Ϋ. –†–Α–Ϋ–Β–Β –±―΄–Μ–Η –Ψ–Ω–Η―¹–Α–Ϋ―΄ ―¹―Ö–Β–Φ―΄ –Ω–Ψ―¹–Μ–Β–¥–Ψ–≤–Α―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ ―¹ –Ω―Ä–Ψ―²–Η–≤–Ψ–≤–Η―Ä―É―¹–Ϋ–Ψ–Ι –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨―é –≤ ―²–Β―Ä–Α–Ω–Η–Η –™–£–‰ ―É –¥–Β―²–Β–Ι [19].
–£―¹–Β –Ω―Ä–Ψ–Α–Ϋ–Α–Μ–Η–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ―΄–Β –≤ –Ϋ–Α―à–Β–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η ―¹―Ö–Β–Φ―΄ –Μ–Β―΅–Β–Ϋ–Η―è –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η –±–Ψ–Μ―¨―à―É―é –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ―É―é –Η –≤–Η―Ä―É―¹–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ―É―é ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Ω–Ψ ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―é ―¹ –Ϋ–Β–Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β–Φ ―ç―²–Η–Ψ―²―Ä–Ψ–Ω–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –≤ –≥―Ä―É–Ω–Ω–Β ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è. –ü–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ, ―΅―²–Ψ –Ϋ–Α ―³–Ψ–Ϋ–Β ―²–Β―Ä–Α–Ω–Η–Η ―¹ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ –±–Ψ–Μ–Β–Β ―΅–Β–Φ ―É 75% –¥–Β―²–Β–Ι, –≤–Κ–Μ―é―΅–Β–Ϋ–Ϋ―΄―Ö –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β, –Ψ―²–Φ–Β―΅–Α–Μ–Ψ―¹―¨ ―¹―²–Ψ–Ι–Κ–Ψ–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Β ―É–Μ―É―΅―à–Β–Ϋ–Η–Β –Η ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –≥–Β―Ä–Ω–Β―¹–≤–Η―Ä―É―¹–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι, ―΅―²–Ψ –±―΄–Μ–Ψ –¥–Ψ―¹―²–Ψ–≤–Β―Ä–Ϋ–Ψ ―΅–Α―â–Β, ―΅–Β–Φ –≤ –≥―Ä―É–Ω–Ω–Β ―¹―Ä–Α–≤–Ϋ–Β–Ϋ–Η―è. –ü―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –Η–Ϋ–Ψ–Ζ–Η–Ϋ –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹ ―É –¥–Β―²–Β–Ι ―¹ ―Ä–Β–Κ―É―Ä―Ä–Β–Ϋ―²–Ϋ―΄–Φ–Η ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄–Φ–Η –Η–Ϋ―³–Β–Κ―Ü–Η―è–Φ–Η –≤ –≤–Ψ–Ζ―Ä–Α―¹―²–Β 3 –≥–Ψ–¥–Α –Η ―¹―²–Α―Ä―à–Β ―¹–Ϋ–Η–Ε–Α–Μ–Ψ ―Ä–Η―¹–Κ ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Η –£–™–ß-6 –≤ 4,11 ―Ä–Α–Ζ–Α. –ü–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄–Β –¥–Α–Ϋ–Ϋ―΄–Β –Ω–Ψ–Ζ–≤–Ψ–Μ―è―é―² ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Ψ–≤–Α―²―¨ –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Β –Η–Ϋ–Ψ–Ζ–Η–Ϋ–Α –Ω―Ä–Α–Ϋ–Ψ–±–Β–Κ―¹–Α (–ù–Ψ―Ä–Φ–Ψ–Φ–Β–¥¬°) –≤ ―²–Β―Ä–Α–Ω–Η–Η ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Η–Ϋ―³–Β–Κ―Ü–Η–Ι ―É –¥–Β―²–Β–Ι –Κ–Α–Κ –≤ –Ψ―¹―²―Ä―΄–Ι –Ω–Β―Ä–Η–Ψ–¥ ―Ä–Β―¹–Ω–Η―Ä–Α―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è, ―²–Α–Κ –Η –Ω―Ä–Η ―Ä–Β–Α–Κ―²–Η–≤–Α―Ü–Η–Η –™–£–‰.
–ë–Μ–Α–≥–Ψ–¥–Α―Ä–Ϋ–Ψ―¹―²―¨
–†–Β–¥–Α–Κ―Ü–Η―è –±–Μ–Α–≥–Ψ–¥–Α―Ä–Η―² –ê–û ¬Ϊ–£–Α–Μ–Β–Ϋ―²–Α –Λ–Α―Ä–Φ¬Μ –Ζ–Α –Ψ–Κ–Α–Ζ–Α–Ϋ–Ϋ―É―é –Ω–Ψ–Φ–Ψ―â―¨ –≤ ―²–Β―Ö–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι ―Ä–Β–¥–Α–Κ―²―É―Ä–Β –Ϋ–Α―¹―²–Ψ―è―â–Β–Ι –Ω―É–±–Μ–Η–Κ–Α―Ü–Η–Η.








.gif)



