АД – самое раннее и частое клиническое проявление атопии у детей, представляет собой хроническое, генетически обусловленное, аллергическое воспаление кожи (в основе которого лежат иммунные механизмы формирования), клинически характеризующееся зудом, возрастной морфологией высыпаний, локализацией и склонностью к рецидивирующему течению. Появляясь в раннем возрасте, АД быстро принимает хроническое рецидивирующее течение, вызывает страдания ребенка, значительно нарушает качество жизни больного и его семьи. Дискомфорт, связанный с кожным зудом, приводит к выраженным нарушениям сна, повседневной деятельности, социальных взаимоотношений. Кроме того, АД является первым проявлением аллергического марша и значимым фактором риска развития аллергического ринита и бронхиальной астмы у детей, поскольку эпикутанная сенсибилизация, формирующаяся при АД, сопровождается не только локальным воспалением кожи, но и системным иммунным ответом с вовлечением в процесс различных отделов респираторного тракта [1–3]. Поэтому своевременная диагностика АД и его патогенетическое лечение на ранних стадиях могут не только уменьшить степень тяжести обострения, но и модифицировать его развитие и предупредить аллергический марш атопических болезней.
По данным эпидемиологических исследований, в разных странах АД страдают от 10 до 20% детей [4]. Распространенность заболевания возросла за последние 3 десятилетия и составляет в развитых странах, по мнению разных авторов, 10–15% у детей в возрасте до 5 лет и 15–20% у школьников [5–9]. Причины увеличения заболеваемости неизвестны. В некоторых сельскохозяйственных регионах Китая, Восточной Европы и Африки заболеваемость остается на прежнем уровне [10–12].
По современным представлениям АД – мультифакториальное заболевание, формирование которого тесно связано с генетическими дефектами иммунного ответа и отрицательным влиянием неблагоприятных факторов внешней среды. Причем сочетанное действие этих факторов определяет темпы развития АД, особенно у детей раннего возраста [13].
Ведущим фактором риска развития АД у детей является прежде всего наследственная предрасположенность к аллергии (82% наблюдений), которая проявляется изменениями системных механизмов наследования, связанными как с особенностями генетически запрограммированного иммунного ответа на антиген, так и с нарушениями генетического контроля продукции цитокинов, особенно интерлейкина (ИЛ) -4, что сопровождается повышением продукции иммуноглобулина (Ig) класса Е, специфической реакцией на определенный аллерген и генерализованной гиперчувствительностью [14].
Установлено, что АД развивается у 81% детей, если больны оба родителя, у 59% – если болен только один из них, а другой имеет аллергическую патологию дыхательных путей, и у 56% – если болен только один из родителей [15].
В реализации наследственной предрасположенности особую роль играет высокий уровень антигенной нагрузки на плод (57%), связанной с патологическим течением беременности и родов, нарушениями питания матери во время беременности и лактации, курением, поздним прикладыванием к груди, ранним началом искусственного вскармливания, а также с ранним введением прикорма и продуктов, не соответствующих возрасту ребенка [14, 16]. Несомненна роль таких факторов, как частые вирусные и паразитарные инфекции и наличие очагов хронической инфекции у детей (56%) [16]. Доказана значимость нарушений функционального состояния центральной и вегетативной нервной системы, которые контролируют активацию иммунокомпетентных клеток и механизмы зуда посредством специфических нейропептидов. Установлено значение аутоаллергенов, освобождающихся из воспалительно-измененных тканей, особенно при расчесывании, которые поддерживают иммунный ответ, первично вызванный аллергенами окружающей среды.
К существенным факторам риска АД относятся нарушения экологии, среды обитания и микроокружения ребенка, которые могут усиливаться при следовании современным стандартам жизни [1, 17]. Большое значение имеют также органическая и функциональная патологии различных органов и систем ЖКТ: ферментопатии, хеликобактерная инфекция, нарушения микробиоценоза кишечника. Возникающие при этом нарушения вызывают повреждения пищеварительного барьера слизистой оболочки ЖКТ, что сопровождается снижением активности факторов неспецифической защиты, уменьшением продукции секреторного IgA, способствует повышенному накоплению гистамина, кининов, провоспалительных цитокинов, приводит к увеличению проницаемости слизистой оболочки для аллергенов и их усиленному всасыванию. Это является одним из значимых пусковых механизмов сенсибилизации и реализации аллергического воспаления в коже [15, 17].
В последние годы особое внимание уделяется дисбиозу кишечника как фактору формирования АД, т. к. нормальная микрофлора кишечника играет важнейшую роль в становлении иммунной системы ребенка и обладает протективным действием в формировании атопии. Показано, что ранние нарушения микрофлоры кишечника у младенцев вызывают дефицит специфических микробных штаммов, обеспечивавших в норме защиту от избыточной антигенной сенсибилизации, путем повышенной продукции таких цитокинов, как ИЛ-10 и трансформирующий фактор роста-β [18].
Ведущими причинно-значимыми аллергенами при АД считаются пищевые аллергены, особенно у детей первого года жизни (99% случаев). По существу, пищевая аллергия – это стартовая сенсибилизация, на фоне которой путем перекрестных реакций формируется гиперчувствительность к другим аллергенам. Частыми пищевыми аллергенами, по нашим данным, являются белки коровьего молока (84%), куриное яйцо (91%), рыба (52%), глютен (40%), говядина (36%), бананы (32%), злаковые (27%), соя (26%) [15]. Однако доминирующая роль пищевой аллергии постепенно уменьшается с ростом ребенка, но увеличивается значимость аэроаллергенов, прежде всего бытовых (38%), эпидермальных (35%), пыльцевых (32%), бактериальных (20%) и грибковых (15%) аллергенов [1, 19].
Среди бактериальных аллергенов при АД установлена значимая роль золотистого стафилококка, который в 80–90% случаев является основным микроорганизмом, колонизирующим пораженные участки кожи и выделяющим экзотоксины со свойствами суперантигенов, которые ингибируют апоптоз и стимулируют пролиферацию Т-лимфоцитов, что ускоряет хронизацию аллергического воспаления кожи [20]. Эндогенная бактериальная сенсибилизация (20%), связанная с наличием у детей очагов хронической инфекции, способствует гиперпродукции IgE и является причиной тяжелого течения АД [19]. В развитии и поддержании патологического процесса в коже активное участие принимают различного рода грибы, особенно дрожжеподобные, являющиеся частью нормальной микрофлоры кожи, но при АД у детей они становятся выраженными патогенами. Уровень поражения кожи дрожжеподобными грибами при АД значительно выше при диффузном поражении, при этом отмечают особую роль липофильных дрожжеподобных грибов Malassezia furfur и Candida albicans (у 49% больных АД) [19, 20].
В основе патогенеза АД лежат генетически детерминированные особенности иммунного ответа. К числу наиболее значимых иммунологических нарушений при АД относят дисбаланс Т-хелперов 1 и 2, повышенную дегрануляцию тучных клеток и измененную антигенпрезентирующую активность клеток Лангерганса [21]. Для больных, страдающих АД, характерен целый спектр иммунологических феноменов: увеличение экспрессии ряда цитокинов и хемокинов; повышение уровня общего IgE в плазме; высокая экспрессия высокоаффинных рецепторов к IgE (FcεRI) на эпидермальных дендритных клетках; увеличение спонтанного высвобождения гистамина базофилами, экспрессии рецепторов к ИЛ (sИЛ-2); повышение концентрации эозинофильного катионного протеина в плазме и эозинофильного протеина X в моче и т. д. При этом надо подчеркнуть, что до настоящего времени отсутствует иммунологический или биохимический маркер АД, что и обусловливает значительные сложности в постановке диагноза.
Диагностика АД основывается преимущественно на клинических данных. Объективных диагностических тестов, позволяющих подтвердить диагноз, в настоящее время не существует. Обследование включает тщательный сбор анамнеза, оценку распространенности и тяжести кожного процесса, степени психологической и социальной дезадаптации и влияния заболевания пациента на его семью.
Диагностические критерии. Впервые диагностические критерии АД были разработаны в 1980 г. (Hanifin, Rajka); согласно им для диагностики АД необходимо наличие как минимум 3-х из 4-х основных критериев и 3-х из 23-х дополнительных. В дальнейшем диагностические критерии неоднократно пересматривались, и в 2003 г. Американской академией дерматологии на Согласительной конференции по АД у детей были предложены следующие критерии [10].
Основные (должны присутствовать):
- зуд;
- экзема (острая, подострая, хроническая):
- с типичными морфологическими элементами и локализацией, характерной для определенного возраста (лицо, шея и разгибательные поверхности у детей первого года жизни и старшего возраста; сгибательные поверхности, пах и подмышечные области – для всех возрастных групп);
- с хроническим или рецидивирующим течением.
Второстепенные (наблюдаются в большинстве случаев, необходимы для постановки диагноза):
- дебют в раннем возрасте;
- наличие атопии:
- отягощенный семейный анамнез по атопии или наличие атопических болезней у пациента;
- наличие специфических IgE-антител;
- ксероз.
Дополнительные (помогают заподозрить АД, но являются неспецифическими и не могут быть использованы для установления диагноза в научных или эпидемиологических исследованиях):
- атипичный сосудистый ответ (в т. ч. бледность лица, белый дермографизм);
- фолликулярный кератоз, усиление кожного рисунка ладоней, ихтиоз;
- изменения со стороны глаз, периорбитальной области;
- другие очаговые изменения (в т. ч. периоральный, периаурикулярный дерматит);
- лихенификация, пруриго [10].
Клиника АД у детей проявляется зудом кожи, возрастной морфологией высыпаний (папулы, везикулы, экссудация, лихеноидные папулы, экскориации), типичной локализацией, возрастной стадийностью и хроническим течением. Обычно манифестация АД происходит на первом году жизни. В своем развитии болезнь проходит 3 стадии, которые могут быть разделены периодами ремиссии или переходить одна в другую [1, 20].
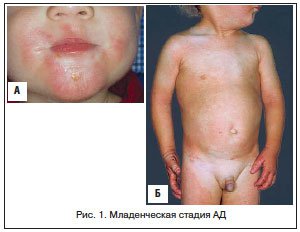
Младенческая стадия АД (рис. 1) развивается у детей в возрасте до 2 лет и в 70% случаев характеризуется наличием выраженной экссудации и мокнутия с развитием острого воспаления кожи в виде эритемы, отека, высыпаний в виде папул и микровезикул (так называемая экссудативная форма). Эти проявления локализованы чаще всего на лице или имеют распространенный характер с поражением кожи туловища и конечностей. Для 30% больных характерны гиперемия, инфильтрация и легкое шелушение кожи без экссудации – это проявления эритемато-сквамозной формы АД.
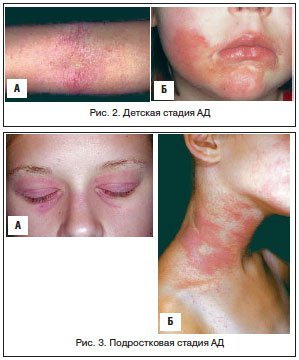
Детская стадия АД (рис. 2) выявляется у детей от 2 до 13 лет и проявляется складчатым характером поражения кожи, ее утолщением, гиперкератозом, наличием эритематозных папул. Затем формируются лихеноидные папулы и очаги лихенификации с типичной локализацией в складках кожи, характеризующие лихеноидную форму АД. У 52% детей в этой стадии АД характерно поражение лица (атопическое лицо), проявляющееся гиперпигментацией, шелушением кожи век, вычесыванием бровей, явлениями хейлита.
Подростковая стадия АД (рис. 3) у детей старше 13 лет характеризуется резко выраженной лихенизацией, сухостью и шелушением, преимущественными поражениями кожи лица, верхней части туловища и непрерывно рецидивирующим течением [20].
По распространенности различают: ограниченный АД – с локализацией преимущественно на лице и площадью поражения кожи не более 5%; распространенный АД – с площадью поражения 5–50%; диффузный АД – с обширным поражением кожи более 50% [20].
По степени тяжести АД выделяются следующие варианты течения:
- легкое: ограниченное поражение кожи (площадь поражения – не более 5%), слабый зуд, не нарушающий сон больного, и невыраженные симптомы поражения кожи (небольшая гиперемия или экссудация, единичные папулы и везикулы), редкие обострения 1–2 р./год;
- среднетяжелое: распространенное поражение кожных покровов (площадь поражения – от 5 до 50%), умеренный или сильный зуд кожи, нарушающий сон ребенка, воспалительная реакция кожи (значительная гиперемия, экссудация или лихенизация, множественные расчесы) и наличие обострений 3–4 р./год;
- тяжелое: диффузное поражение кожи (площадь поражения – более 50%), зуд сильный, мучительный, с частыми пароксизмами, резко нарушающий сон и качество жизни ребенка, выраженная гиперемия, экссудация или лихенизация, множественные расчесы, трещины, эрозии, непрерывно рецидивирующее течение.
Выделяют также 3 фазы течения АД: острое, подострое и хроническое течение.
Лечение АД у детей является одной из сложных задач для врача-педиатра, терапия должна быть патогенетической, комплексной и направленной на ограничение и уменьшение воспалительного процесса в коже [1, 19].
Основные направления лечения АД:
1. Элиминация причинно-значимых аллергенов: в современных условиях преимущественно с помощью энтеросорбции и назначения гипоаллергенной диетотерапии.
2. Системная фармакотерапия с использованием антигистаминных препаратов и блокаторов медиаторов аллергической реакции.
3. Дифференцированная коррекция сопутствующей патологии (лечение патологии органов пищеварения, метаболитная и антиоксидантная терапия, нормализация функциональных нарушений нервной системы, санация очагов хронической инфекции).
4. Иммунотерапия.
5. Наружная терапия.
Применение антагонистов Н1-рецепторов в качестве базисных препаратов для лечения АД обосновано важнейшей ролью гистамина в механизме кожного зуда при АД, который приводит к повреждению кожи, образованию эрозий, экскориаций, корок, лихенификации, рубцов, гипер- и гипопигментации и, как следствие, к увеличению высвобождения медиаторов воспаления, которые, в свою очередь, усиливают зуд (формируется зудо-чесоточный цикл). Зуд приводит к нарушению сна и развитию невротического состояния, в значительной степени влияет на качество жизни пациентов и определяет степень тяжести и течение АД.
В механизме зуда при АД принимает участие довольно широкий спектр химических посредников. Экспрессия большого количества высокоаффинных рецепторов на нервных волокнах к различным медиаторам воспаления объясняет возможность развития чувства зуда вследствие даже минимального воздействия различных провоцирующих факторов на кожу больных АД, таких как физическая нагрузка, колебания температуры, шерстяная или синтетическая одежда, жесткая вода при приеме душа и др. Современное представление о зуде включает 2 важных положения. Во-первых, не существует универсального периферического медиатора зуда. В зависимости от природы заболевания в процесс вовлекается набор разнообразных посредников. Во-вторых, разные медиаторы клеток кожи способны активировать и сенсибилизировать нервные окончания, участвующие в формировании зуда, и даже модулировать их рост [22].
Известно, что некоторые медиаторы, такие как нейропептиды, протеазы, цитокины, участвуют в развитии зуда, либо непосредственно связываясь с рецепторами зуда, либо опосредованно вызывая высвобождение гистамина.
Есть основание считать, что роль ацетилхолина (АЦХ) в развитии кожного зуда при АД явно недооценена. Еще в 1962 г. Scott показал, что биоптаты, полученные из поверхностных участков кожи больных АД, содержат АЦХ в высоких концентрациях [23]. Содержание АЦХ в коже больных намного превышает таковое в коже здоровых лиц. Повышенный уровень АЦХ в коже больных АД сохраняется даже в период ремиссии заболевания, причем следует иметь в виду, что АЦХ быстро разрушается ацетилхолинэстеразой. Grando et al. (1993) установили, что АЦХ может синтезироваться и выделяться в человеческих кератиноцитах in vitro и выполнять функцию узколокальной (за счет быстрого разрушения) клеточной сигнальной молекулы, регулирующей пролиферацию, клеточную адгезию, десмосомальные клеточные контакты и, тем самым, барьерную функцию кожи и активность экскреторных желез [24]. АЦХ также может вызывать зуд за счет непосредственного связывания с рецепторами зуда [25].
Несмотря на важную роль АЦХ в развитии кожного зуда, гистамин остается важным медиатором аллергического воспаления и участвует в патогенезе АД. Поэтому и в настоящее время антигистаминные препараты в качестве средств, уменьшающих зуд при АД, рекомендованы в современных протоколах лечения АД. Имеются сведения, свидетельствующие о целесообразности применения в качестве противозудных средств Н1-блокаторов I поколения, которые, обладая антихолинергическими свойствами, способны воздействовать на различные рецепторы, помимо гистаминовых, и подавлять высвобождение других медиаторов, участвующих в механизме зуда.
Гистамин – важнейший медиатор различных физиологических и патологических процессов в организме, был химически синтезирован в 1907 г. Впоследствии его выделили из тканей животных и человека. Еще позднее были определены его функции: желудочная секреция, нейромедиаторная функция в ЦНС, аллергические реакции, воспаление и др. Спустя почти 30 лет, в 1936 г., были созданы первые вещества, обладающие антигистаминной активностью.
В 1960-е гг. доказана гетерогенность рецепторов в организме к гистамину и выделены 3 их подтипа: Н1, Н2 и Н3, различающиеся по строению, локализации и физиологическим эффектам, возникающим при их активации и блокаде. С этого времени начался активный период синтеза и клинического тестирования разнообразных антигистаминных препаратов.
Многочисленные исследования показали, что гистамин, воздействуя на рецепторы респираторной системы, глаз и кожи, вызывает характерные симптомы аллергии, а антигистаминные препараты, селективно блокирующие Н1-тип рецепторов, способны их предотвращать и купировать.
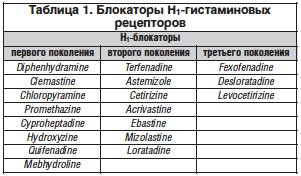
В настоящее время известно более 150 препаратов – антагонистов Н1-гистаминовых рецепторов. Все их можно разделить на 3 группы: Н1-блокаторы первого поколения, характеризующиеся низкой селективностью и продолжительностью действия 4–12 ч; Н1-блокаторы второго поколения, обладающие высокой селективностью и продолжительностью действия 18–24 ч, подвергающиеся метаболизму в организме человека; Н1-блокаторы третьего поколения, являющиеся конечными метаболитами, обладающими высокой селективностью действия и продолжительностью действия 24 ч (табл. 1).
Блокаторы Н1-рецепторов были открыты в Институте Пастера в 1937 г. D. Bovet и A. Staub, а первый антигистаминный препарат фенбензамин создан в 1942 г. В 1957 г. за создание препаратов этой группы Daniel Bovet был удостоен Нобелевской премии.
Блокаторы Н1-гистаминовых рецепторов снижают реакцию организма на гистамин, снимают обусловленный им спазм гладкой мускулатуры, уменьшают проницаемость капилляров и отек тканей, устраняют гипотензивный эффект, вызванный гистамином, и другие его эффекты. Классическими показаниями для назначения антигистаминных средств являются аллергический ринит и конъюнктивит, крапивница и отек Квинке, АД. В современной литературе все чаще описываются наблюдения успешного применения антигистаминных препаратов при бронхиальной астме.
Несмотря на хорошо известные нежелательные эффекты Н1-блокаторов первого поколения (кратковременность действия, многократность приема в сутки, кокаиноподобное местноанестезирующее, хинидиноподобное, седативное действие, стимуляция аппетита, дисфункция ЖКТ, нарушения зрения, мочеиспускания, тахифилаксия и др.), они занимают прочные позиции в аллергологической практике. Это связано, во-первых, с богатым опытом использования этих средств, во-вторых, с наличием побочных эффектов, которые в определенной клинической ситуации могут оказаться желательными (в частности, наличие антисеротониновой активности, местноанестезирующего или седативного действия), в-третьих, с более низкой стоимостью в сравнении с препаратами второго и третьего поколений. Наличие инъекционных лекарственных форм Н1-блокаторов первого поколения делает их незаменимыми в острых и неотложных ситуациях.
Антигистаминные препараты блокируют действие гистамина на Н1-рецепторы по механизму конкурентного ингибирования, причем их сродство к этим рецепторам значительно ниже, чем у гистамина. Поэтому данные лекарственные средства не способны вытеснить гистамин, связанный с рецептором, они только блокируют незанятые или высвобождаемые рецепторы. Соответственно, Н1-блокаторы наиболее эффективны для предупреждения аллергических реакций немедленного типа, а в случае развившейся реакции предупреждают выброс новых порций гистамина.
Одним из наиболее распространенных, эффективных и безопасных антигистаминных препаратов первого поколения является хлоропирамин (Супрастин) – классический препарат из группы этилендиаминовых. Он обладает значительной антигистаминной активностью, периферическим антихолинергическим и умеренным спазмолитическим действием. Супрастин устраняет все симптомы аллергии: предупреждает развитие и облегчает течение аллергических реакций, оказывает седативное и выраженное противозудное действие. Эффективен в большинстве случаев для лечения сезонного и круглогодичного аллергического риноконъюнктивита, отека Квинке, крапивницы, АД, экземы, зуда различной этиологии; в парентеральной форме – для лечения острых аллергических состояний, требующих неотложной помощи. Хлоропирамин (Супрастин) предусматривает широкий диапазон используемых терапевтических доз, не накапливается в сыворотке крови, поэтому не вызывает передозировку при длительном применении. Для Супрастина характерны быстрое наступление эффекта и кратковременность (в т. ч. и побочного) действия. При этом Супрастин может комбинироваться с неседативными Н1-блокаторами с целью увеличения продолжительности противоаллергического действия. Супрастин в настоящее время является одним из самых популярных антигистаминных препаратов в России. Это объективно связано с доказанной высокой эффективностью, управляемостью его клинического эффекта, наличием различных лекарственных форм, в т. ч. и инъекционных, и невысокой стоимостью.
Наличие седативного эффекта делает его незаменимым в некоторых клинических ситуациях, например, при АД, сопровождающемся изнурительным кожным зудом, усиливающимся в ночное время и существенно нарушающим сон. Седативное действие Супрастина расценивается пациентами не как побочное, а как лечебное – препарат уменьшает зуд при кожных аллергических реакциях и способствует нормализации нарушенного сна.
Существование инъекционной формы препарата позволяет включать его в дезинтоксикационные схемы у больных с тяжелыми формами АД. Может вводиться парентерально – в/м, в острых тяжелых случаях – в/в (под контролем врача), что особенно важно в лечении детей, пациентов с тяжелыми и распространенными формами аллергодерматозов и имеющих сопутствующую патологию ЖКТ.
Таким образом, к преимуществам Супрастина как одного из самых популярных антигистаминных препаратов первого поколения относятся: длительный (более 40 лет) опыт применения, хорошая изученность, существование 2-х лекарственных форм (таблеток и раствора для инъекций), незаменимость при острых аллергических состояниях, при проведении премедикации, в хирургической практике. Супрастин быстро и эффективно купирует симптомы заболевания, а также выраженные проявления кожного зуда. Богатый врачебный опыт применения Супрастина позволяет рассматривать его как жизненно необходимый препарат в перечне лекарственных средств, используемых для лечения больных аллергическими заболеваниями.











