Введение
Остеоартрит (ОА) коленных суставов является одним из наиболее распространенных заболеваний опорно-двигательного аппарата, приводящих к снижению качества и продолжительности жизни пациентов. Успехи в лечении ОА (особенно на поздних стадиях заболевания) остаются скромными, несмотря на большое число медикаментозных и немедикаментозных методов лечения, имеющихся в арсенале современного врача. Ведущие группы и общества по изучению ОА (OARSI, ESCEO и др.) не достигли единства мнений в понимании ряда подходов к лечению ОА [1, 2]. Тактика ведения пациентов с ОА, разработанная различными экспертными группами, довольно сильно различается — нет общего понимания места противовоспалительных и медленнодействующих симптом-модифицирующих препаратов в лечении пациентов и того, какие препараты являются предпочтительными [1–4]. В то же время имеется единство представлений экспертов об ОА как о дегенеративно-дистрофическом заболевании с элементами «малого» воспаления, в патогенезе которого дегенеративно-дистрофические и воспалительные процессы протекают стадийно, усугубляя друг друга [5–7].
Традиционно для оценки стадийности ОА и разработки тактики ведения пациента с ОА главенствующее место отводится определению состояния суставной щели и хряща (структурные изменения), которые позволяют зафиксировать состояние сустава в текущей временной точке [7]. Вместе с тем современные лекарственные препараты и немедикаментозные методы лечения практически неспособны оказывать клинически значимое воздействие на структурные изменения сустава и последствия его ремоделирования, т. к. методы восстановления структуры хряща и суставной щели еще не разработаны [6, 8]. Оценка структурных изменений в реальной клинической практике необходима для понимания степени выраженности ремоделирования сустава, имеющегося у пациента на момент курации, и формирования представлений о возможностях нехирургических и хирургических методов лечения ОА. В то же время возможности влияния на воспаление при ОА довольно велики, что определяется наличием большого перечня противовоспалительных лекарственных препаратов, предназначенных для системного, топического и локального применения при ОА. Постоянно увеличивается понимание того, что воспаление играет значимую роль в патогенезе ОА, современные рекомендации рассматривают возможность длительной противовоспалительной терапии с применением нестероидных противовоспалительных препаратов (НПВП) при ОА, если польза для пациента превышает риск [3, 9].
Воспаление может быть выявлено клинически, лабораторно и с помощью визуализирующих методик (ультразвуковое исследование, магнитно-резонансная томография — МРТ), а его клиническое значение при ОА трудно недооценить — воспаление является основой таких клинических проявлений ОА, как боль, скованность, припухлость, местная гипертермия сустава и нарушение его функции, определяя последующее прогрессирование повреждения хряща, субхондральной кости, менисков и связочного аппарата сустава [10–12]. Не исключено, что единообразие подходов к пациентам с разной выраженностью воспаления в суставе и разными фенотипами ОА может снижать эффективность лечения ОА. В этой связи представляет интерес изучение взаимосвязей воспалительных изменений при ОА коленного сустава, выявляемых при помощи МРТ, с клиническими проявлениями ОА, а также оценка возможностей терапевтического воздействия на них.
Цель исследования: установить наличие взаимосвязей между интенсивностью боли при ОА коленных суставов и воспалительными изменениями коленных суставов, выявляемыми при помощи МРТ, с оценкой изменений в динамике на фоне лечения НПВП.
Материал и методы
Исследуемая популяция
В исследование включили 46 пациентов с первичным ОА коленных суставов. Рентгенологическая стадия ОА коленных суставов включенных в исследование пациентов — II или III по Kellgren и Lawrence [13]. Интенсивность болевого синдрома в индексном коленном суставе должна была составлять 4,0 и более балла согласно числовой рейтинговой шкале (ЧРШ) на момент начала исследования. Все пациенты имели выполненную в течение 1 мес. до визита МРТ индексного коленного сустава или выполнили ее в течение 7 дней после первого визита. Критерии исключения: I или IV стадия ОА; другие ревматические заболевания; заболевания, ассоциирующиеся с развитием вторичного остеоартрита (ревматоидный артрит, спондилоартриты и др.); другие причины боли в коленном суставе (аваскулярные некрозы костей, значимые травмы суставов в анамнезе и др.); наличие операций на коленном суставе в анамнезе; инфекционные заболевания; онкологические заболевания; хронические заболевания в стадии обострения; наличие противопоказаний к приему НПВП; противопоказания к выполнению МРТ (клаустрофобия, наличие металлических предметов в организме, кардиовертеров-дефибрилляторов и др.); беременность.
Методы оценки
Все пациенты заполняли вопросник для расчета индекса WOMAC (the Western Ontario and McMaster Universities Osteoarthritis Index — индекс выраженности остеоартроза университетов Западного Онтарио и МакМастера) и оценивали интенсивность боли в коленных суставах согласно ЧРШ, где оценка в 0 баллов соответствовала отсутствию боли в коленном суставе, а 10 баллов — максимальной выраженности боли в коленном суставе [14].
Обязательным требованием было выполнение исследования на МРТ-томографе мощностью 1,5 тесла, в Т1-взвешенной последовательности и в режиме STIR, при необходимости — в T2-взвешенной последовательности в режиме жироподавления и с контрастным усилением гадолинием. При оценке результатов МРТ учитывали наличие или отсутствие очагов субхондрального отека костного мозга (СОКМ, субхондральный остеит), за который принимали участок интенсивного (сопоставимого по яркости со спинномозговой жидкостью) МР-сигнала в режиме STIR, расположенного субхондрально в области, соответствующей хрящевой поверхности бедренной или большеберцовой кости индексного коленного сустава, оценивали размер очагов СОКМ (более 1,0 см или 1,0 см и менее в максимальном размере). Также учитывали наличие или отсутствие синовита/теносиновита в индексном суставе без их количественной оценки.
Индексным считали коленный сустав, болевой синдром в котором составлял 4,0 и более балла и для которого выполнена МРТ. При одинаковой боли в обоих коленных суставах индексным считали сустав с более выраженными изменениями при рентгенографии коленных суставов (по мнению исследователя). При равенстве всех условий выбора индексный сустав выбирали методом рандомизации (метод конвертов).
Через 3 мес. от начала лечения (±10 дней) МРТ повторно выполняли пациентам с подтвержденным при исходной оценке СОКМ.
Статистический анализ
Статистическую обработку осуществляли с применением пакета прикладных программ Microsoft Office Exсel, 2007 (Microsoft Corp., США), SPSS 17. Характер распределения признака определяли методом подсчета критерия Шапиро — Уилка. Для описания признаков использовали среднее значение признака и среднее квадратическое отклонение (при нормальном распределении), медиану и квартили (при распределении, отличном от нормального). Для оценки взаимосвязи между признаками использовался коэффициент корреляция Спирмена. Для оценки различия двух зависимых выборок с распределением, отличным от нормального, использовали критерий Вилкоксона. При сравнении качественных признаков применяли критерий χ2 или выполняли анализ ANOVA. Различия считали достоверными при p≤0,05.
Этические аспекты
Все пациенты подписывали форму добровольного информированного согласия на участие в исследовании. Данные вносили в базу данных в обезличенном виде, не позволяющем идентифицировать пациента как личность.
Лечение пациентам назначал лечащий врач, в ходе исследования изменения лечения не проводилось.
Исследование одобрено комитетом по этике СПб ГБУЗ «КРБ № 25» и ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России.
Результаты исследования
Исходно в исследование включили 46 пациентов, повторное клиническое обследование выполнили 39 пациентов (с 7 пациентами утерян контакт), повторно МРТ выполнили 33 пациента. Суммарно проанализировали 79 МРТ (оценку производил специалист по лучевой диагностике). Демографические характеристики пациентов, интенсивность боли в коленном суставе и средние значения индекса WOMAC представлены в таблице 1.

Всем пациентам в ходе первого визита лечащим врачом назначены НПВП (табл. 2).
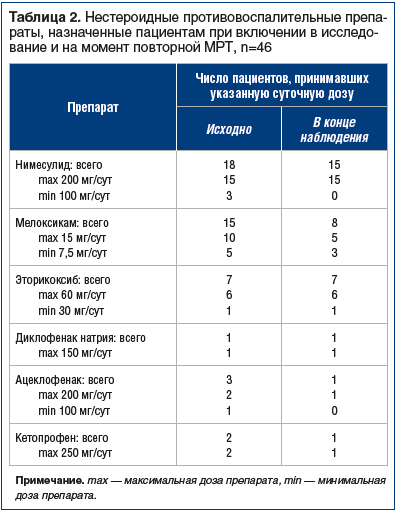
По данным исследования, исходно у большинства пациентов наблюдались признаки воспалительных изменений коленных суставов, которые впоследствии уменьшились на фоне лечения НПВП (табл. 3).

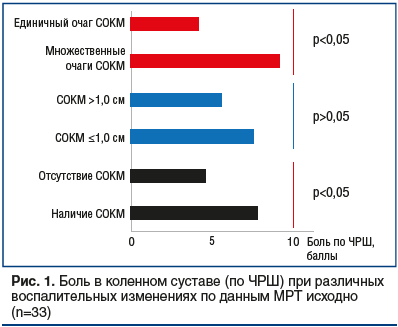
При сравнении исходной интенсивности болевого синдрома в индексном коленном суставе установили наличие более выраженного болевого синдрома у пациентов с множественными очагами СОКМ по сравнению с болевым синдромом у пациентов, имевших единичный воспалительный очаг (рис. 1). Показано увеличение болевого синдрома у пациентов с наличием СОКМ по сравнению с лицами, не имевшими СОКМ (см. рис. 1). Наличие и отсутствие синовита и теносиновита, так же как и размер очагов СОКМ, на интенсивность боли не влияли.
Пример среза МРТ с достоверными признаками ОА и воспалительных изменений представлен на рисунке 2.

В динамике у 39 пациентов, посетивших центр через 3 мес. после лечения НПВП, отмечена достоверная положительная динамика по всем составляющим индекса WOMAC: суммарный индекс снизился до 24,12±11,1 у. е., компоненты шкалы боли индекса WOMAC — до 8,12±3,5 у. е., шкалы скованности — до 2,34±1,2 у. е., физического функционирования — до 25,2±3,3 у. е. (p<0,05).
После 3-месячного применения НПВП пациентам, исходно имевшим СОКМ (n=33), была выполнена повторная МРТ, по результатам которой значимо уменьшилось число пациентов с наличием СОКМ, в то время как число пациентов с синовитом и теносиновитом изменилось незначительно (табл. 3). Следует отметить и значимое уменьшение воспалительных очагов в размерах. Также отметили уменьшение числа пациентов с множественными очагами СОКМ (см. табл. 3). У пациентов с разрешением СОКМ имело место более выраженное уменьшение боли в соответствующем коленном суставе по сравнению с пациентами, у которых очаги воспаления в субхондральной кости сохранились. Из 26 пациентов с исчезновением СОКМ у 15 пациентов боль купировалась полностью, у 6 составила менее 4,0 балла по ЧРШ и у 5 превышала 4,0 балла по ЧРШ. Среди пациентов, у которых СОКМ сохранялся, у 1 пациента болевой синдром не превышал 4,0 балла по ЧРШ, у 6 — значение составило более 4,0 балла.
При оценке степени снижения суммарного индекса WOMAC и интенсивности боли в индексном коленном суставе, согласно ЧРШ, установили, что степень снижения была больше у пациентов, исходно имевших признаки воспаления субхондральной кости, по сравнению с ациентами, не имевшими субхондрального остеита перед началом лечения (p<0,05 для всех сравнений).
Обсуждение
Проблема ОА является одной из самых актуальных проблем современной ревматологии — наблюдается постоянное увеличение числа пациентов с ОА, что может быть связано с изменением продолжительности жизни, характера питания и двигательного режима современного человека [1–4]. У многих пациентов с ОА формируются выраженные структурные изменения суставов, что определяет необходимость в ортопедической или оперативной коррекции, а также снижает качество жизни больных [4, 6]. Рекомендации по коррекции образа жизни при ОА хорошо известны, и придерживаться их советуют всем пациентам с ОА. В то же время проблемы лекарственной терапии ОА нельзя считать решенными, т. к. нет четкого понимания того, кто из пациентов нуждается в лечении НПВП, а кто должен получать медленнодействующие симптом-модифицирующие препараты или их комбинацию с НПВП [1, 2]. Изменение понимания сути ОА и выделение так называемого «воспалительного» фенотипа ОА могут быть существенным подспорьем в решении указанной проблемы [3, 6, 8, 9]. Можно предположить, что максимально эффективными лекарственными препаратами при наличии активного воспалительного компонента ОА являются НПВП [3, 6]. В представленной нами работе наиболее часто применяемым НПВП, в т. ч. в долгосрочной перспективе, явился нимесулид (Найз®, ООО «Др. Редди’с Лабораторис»), что может объясняться высокой эффективностью и безопасностью препарата, основанной на достаточной доказательной базе [4, 15–17]. Пациенты, получавшие НПВП в ходе выполненного нами исследования, не только продемонстрировали выраженный клинический ответ на лечение, но и показали уменьшение субхондрального воспаления кости при их применении в течение 3 мес. Следует отметить, что в условиях выраженного дегенеративно-дистрофического поражения суставов не всегда легко клинически выделить воспалительную составляющую боли. В этой связи представляется перспективным дополнить клиническое обследование пациента с ОА ультразвуковым или магнитно-резонансным обследованием. МРТ при ОА обладает рядом преимуществ, среди которых основным для ревматолога является способность метода определять наличие субхондрального поражения кости, которое, по данным некоторых исследователей, в наибольшей степени определяет клиническую симптоматику у пациентов с ОА и в перспективе приводит к перестройке субхондральной кости с изменением формы пораженного сустава [8, 10–12]. Так, в метаанализе, выполненном D.J. Hunter et al., показано, что именно наличие субхондральных изменений кости при МРТ в наибольшей степени ассоциируется с болевым синдромом при ОА (по данным 21 исследования), а изменения костного мозга встречались в 77% случаев при наличии боли в суставах и в 30% случаев при отсутствии боли (различия статистически значимы) [8]. При этом взаимосвязей между выраженностью болей и размером очагов в костном мозге авторы метаанализа не нашли. Этот факт отличает полученные нами результаты от результатов метаанализа. Одновременно D.J. Hunter et al. отмечают, что работ, посвященных оценке воспалительных изменений при МРТ, немного — гораздо большее внимание исследователи уделяют оценке структурных изменений при ОА. Важным является и тот факт, что появление воспалительных очагов кости (особенно нескольких) является предиктором усиления боли при ОА. В то же время нарастающее уменьшение толщины хряща не является предвестником усиления боли при ОА, хотя малая толщина хряща взаимосвязана с наличием болевого синдрома при ОА. Поэтому представляется перспективным изучение воспалительного компонента ОА, т. к. в настоящий момент имеется достаточно препаратов, способных уменьшать его выраженность, а число НПВП, применение которых может быть рекомендовано пациентам с ОА, постоянно увеличивается [18, 19].
В представленной нами работе показано, что воспалительные изменения коленного сустава при ОА, сопровождаемом интенсивным болевым синдромом, встречаются у подавляющего большинства пациентов. Вместе с тем с болью в первую очередь ассоциируется наличие субхондрального остеита, а не наличие синовита или теносиновита, которые, возможно, имеют вторичный компенсаторный характер. Также нами показано, что в динамике на фоне длительного приема НПВП (например, Найз®, ООО «Др. Редди’с Лабораторис», и другие препараты с преимущественным влиянием на циклооксигеназу 2 типа (ЦОГ-2)) наблюдается исчезновение участков субхондрального остеита либо уменьшение их размера или численности, что сопровождается уменьшением болевого синдрома в суставе. Так как большинство применяемых препаратов оказывает преимущественное влияние на ЦОГ-2, остается неизвестным, обладают ли неселективные ингибиторы ЦОГ-2 таким же влиянием на боль и воспаление субхондральной кости, как и применявшиеся в нашем исследовании препараты. Интересен тот факт, что уменьшение боли при ОА на фоне приема НПВП в большей степени выражено у пациентов, имеющих признаки воспаления субхондральной кости по данным МРТ, что объяснимо наличием субстрата для воздействия НПВП — воспаления. Мы не исключаем, что на фоне лечения НПВП имело место уменьшение выраженности синовита, но т. к. мы лишь фиксировали наличие синовита, в задачи исследования не входила оценка его выраженности и динамики. По данным литературы, наличие 2–3 МР-степеней выраженности синовита, но не наличие исходного синовита, ассоциируется с усилением болевого синдрома [5, 7, 8, 12].
В свете выявленных изменений следует отметить, что в работе А.Е. Каратеева с соавт. уже в 2017 г. было отмечено, что применение НПВП в долгосрочной перспективе при ОА имеет ряд преимуществ перед их краткосрочным приемом [3]. Поэтому особенно важны вопросы безопасности, весьма актуальные в популяции пациентов с ОА, поскольку данное заболевание часто встречается у пожилых людей. В этой связи назначение длительной терапии НПВП пациентам с ОА следует проводить в первую очередь с применением средств с преимущественно селективным воздействием на ЦОГ-2 и дополнительными механизмами противовоспалительного действия, способными усилить эффект, связанный с блокадой каскада арахидоновой кислоты. Таким образом, использование в нашем исследовании препарата Найз® представляется обоснованным с учетом высокой желудочно-кишечной, сердечно-сосудистой, почечной безопасности препарата [4, 15–17]. Вследствие небольшого размера выборки сравнительный анализ влияния отдельных НПВП на воспалительные изменения при ОА не проводился [4].
Следует отметить тот факт, что отсутствие воспалительных изменений субхондральной кости при ОА коленного сустава в нашем исследовании явилось предиктором более слабого ответа на назначение НПВП, а сохранение указанных воспалительных изменений у части пациентов ассоциировалось с сохранением болевого синдрома. Для таких пациентов следует обсудить возможность локальной терапии глюкокортикоидами или других способов локальной терапии. Также представляется перспективным изучение тактики замены НПВП у пациентов с неполным ответом на первый назначенный препарат из указанной группы.
В цели и задачи настоящей работы не входил анализ выраженности и взаимосвязей структурных изменений на течение ОА, как и изучение симптом-модифицирующей и немедикаментозной терапии. Следует отметить, что указанные проблемы хорошо изучены и тактика их применения отражена в опубликованной в 2019 г. резолюции экспертов [6].
Выводы
Пациенты с ОА коленного сустава и выраженным болевым синдромом имеют воспалительные изменения субхондральной кости в 75% случаев по данным МРТ. Синовиты встречаются практически у всех указанных пациентов.
При ОА наличие субхондрально расположенных воспалительных очагов, но не синовита, ассоциируется с увеличением боли в коленном суставе и хорошим ответом на НПВП с преимущественным воздействием на ЦОГ-2, действие которых проявляется как клинически (уменьшение боли), так и визуально (исчезновение или уменьшение субхондрально расположенного остеита). Выраженность влияния на субхондральный остеит неселективных в отношении ЦОГ-2 НПВП нуждается в уточнении.
Благодарность
Редакция благодарит компанию ООО «Др. Редди’с Лабораторис» за оказанную помощь в технической редактуре настоящей публикации.








.gif)



