–Ф–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –њ—А–Њ–Є–Ј–Њ—И–µ–і—И–Є–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–µ—Б—П—В–Є–ї–µ—В–Є—П –•–• –≤. –Є –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–Є–µ—Б—П –≤ –•–•I –≤., —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е – –Ј–∞–Љ–µ—В–љ–Њ–µ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є, –њ—А–Є–≤–µ–ї–Є –Ї —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–Љ—Г –њ–Њ–≤—Л—И–µ–љ–Є—О –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –і–Њ–ї–Є –ї–Є—Ж —Б—В–∞—А—И–Є—Е –≤–Њ–Ј—А–∞—Б—В–Њ–≤. –°–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ –і–Њ–Ї–ї–∞–і–∞ «–Э–∞—А–Њ–і–Њ–љ–∞—Б–µ–ї–µ–љ–Є–µ –Љ–Є—А–∞–2007», –њ–Њ–і–≥–Њ—В–Њ–≤–ї–µ–љ–љ–Њ–≥–Њ –§–Њ–љ–і–Њ–Љ –Ю–Ю–Э –≤ –Њ–±–ї–∞—Б—В–Є –љ–∞—А–Њ–і–Њ–љ–∞—Б–µ–ї–µ–љ–Є—П –Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ –≤ –Є—О–љ–µ 2007 –≥., –≤ —Б—В—А—Г–Ї—В—Г—А–µ –љ–∞—Б–µ–ї–µ–љ–Є—П –Ч–µ–Љ–ї–Є, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–µ–≥–Њ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П 6,6 –Љ–ї—А–і., —З–Є—Б–ї–Њ –ї–Є—Ж –≤ –≤–Њ–Ј—А–∞—Б—В–µ —Б—В–∞—А—И–µ 60 –ї–µ—В —Б–Њ—Б—В–∞–≤–ї—П–µ—В –±–Њ–ї–µ–µ 705 –Љ–ї–љ. —Б –Њ—В—З–µ—В–ї–Є–≤–Њ–є —В–µ–љ–і–µ–љ—Ж–Є–µ–є –Ї —Г–≤–µ–ї–Є—З–µ–љ–Є—О –≤ –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ–—А–∞–Ј–≤–Є—В—Л—Е —Б—В—А–∞–љ–∞—Е. –Т –†–Њ—Б—Б–Є–Є –і–Њ–ї—П –ї—О–і–µ–є –њ–Њ–ґ–Є–ї–Њ–≥–Њ (60–75 –ї–µ—В) –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ (75–85 –ї–µ—В) –≤–Њ–Ј—А–∞—Б—В–∞ –±–ї–Є–Ј–Ї–∞ –Ї –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –і–ї—П –Ч–∞–њ–∞–і–љ–Њ–є –Х–≤—А–Њ–њ—Л –Є –°–®–Р –Є —Б—Г–Љ–Љ–∞—А–љ–Њ —Б–Њ—Б—В–∞–≤–ї—П–µ—В –Њ–Ї–Њ–ї–Њ 30 –Љ–ї–љ., —З—В–Њ –њ—А–µ–≤—Л—И–∞–µ—В 20% –≤—Б–µ–≥–Њ –љ–∞—Б–µ–ї–µ–љ–Є—П —Б—В—А–∞–љ—Л. –Ш–Ј—Г—З–µ–љ–Є–µ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–∞ –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ —Н—В–∞ –≥—А—Г–њ–њ–∞ —П–≤–ї—П–µ—В—Б—П –Ї—А–∞–є–љ–µ –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ–є –њ–Њ —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–Љ—Г, –њ—Б–Є—Е–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ—Г –Є –Љ–µ–љ—В–∞–ї—М–љ–Њ–Љ—Г —Б—В–∞—В—Г—Б—Г. –Я–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –њ–µ—А–Є–Њ–і–Њ–≤ –Т–Ю–Ч (1973) –ґ–µ–љ—Й–Є–љ—Л –≤ –≤–Њ–Ј—А–∞—Б—В–µ 55–74 –ї–µ—В –Є –Љ—Г–ґ—З–Є–љ—Л – 60–74 –ї–µ—В —Б—З–Є—В–∞—О—В—Б—П –њ–Њ–ґ–Є–ї—Л–Љ–Є, 75–89 –ї–µ—В – —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, 90 –Є –±–Њ–ї–µ–µ –ї–µ—В – –і–Њ–ї–≥–Њ–ґ–Є—В–µ–ї—П–Љ–Є. –° —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –≤–Њ–Ј—А–∞—Б—В–∞ —З–µ–ї–Њ–≤–µ–Ї–∞ —Б—В—А—Г–Ї—В—Г—А–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –Љ–µ–љ—П–µ—В—Б—П –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —Г–Љ–µ–љ—М—И–µ–љ–Є—П —З–Є—Б–ї–∞ –Њ—Б—В—А—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є —Г–≤–µ–ї–Є—З–µ–љ–Є—П —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ—Б—В–Є –Є –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є –±–Њ–ї–µ–Ј–љ—П–Љ–Є, —Б–≤—П–Ј–∞–љ–љ—Л–Љ–Є —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤. –°–Њ—Б—В–Њ—П–љ–Є–µ –Ј–і–Њ—А–Њ–≤—М—П –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П –≤—Л—Б–Њ–Ї–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—П –њ–∞—В–Њ–ї–Њ–≥–Є–Є –љ–∞ —Д–Њ–љ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л—Е –≤–Њ–Ј—А–∞—Б—В–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–∞—Е –Є —Б–Є—Б—В–µ–Љ–∞—Е (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ–Њ—З–µ–Ї, —Б–µ—А–і—Ж–∞, –Ц–Ъ–Ґ, –ґ–µ–ї–µ–Ј –≤–љ—Г—В—А–µ–љ–љ–µ–є —Б–µ–Ї—А–µ—Ж–Є–Є –Є –і—А.). –Ф–ї—П –њ–Њ–ґ–Є–ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –≤—Л—Б–Њ–Ї–∞—П –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –≤ —Ж–µ–ї–Њ–Љ, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А–Њ–є –ї–Є–і–Є—А—Г—О—В —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –Є –Њ–љ–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –±–Њ–ї–µ–Ј–љ–Є –Њ–њ–Њ—А–љ–Њ––і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј (–Ю–Я). –Т —Б–≤—П–Ј–Є —Б –≤—Л—Б–Њ–Ї–Њ–є –Љ–µ–і–Є–Ї–Њ–—Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –Ј–љ–∞—З–Є–Љ–Њ—Б—В—М—О –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ 10–15 –ї–µ—В –≤—Б–µ–Љ—Г –Ї—А—Г–≥—Г –≤–Њ–њ—А–Њ—Б–Њ–≤, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Ю–Я (—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П, –њ–∞—В–Њ–≥–µ–љ–µ–Ј, –Ї–ї–Є–љ–Є–Ї–∞, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞, –ї–µ—З–µ–љ–Є–µ, –Љ–µ–і–Є–Ї–Њ–—Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ –Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л –Є –і—А.), —Г–і–µ–ї—П–µ—В—Б—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ. –Ъ–∞–ґ–і—Л–є –Є–Ј —Н—В–Є—Е –≤–Њ–њ—А–Њ—Б–Њ–≤ –≤–∞–ґ–µ–љ, –Є –±–µ–Ј –љ–Є—Е –љ–µ –Љ–Њ–ґ–µ—В –Њ–±—Б—Г–ґ–і–∞—В—М—Б—П –њ—А–Њ–±–ї–µ–Љ–∞ –Ю–Я. –Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О —Н—В–Њ–≥–Њ —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Ї–µ–ї–µ—В–∞, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–µ–µ—Б—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–Є–Љ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Љ–∞—Б—Б—Л –Ї–Њ—Б—В–Є –≤ –µ–і–Є–љ–Є—Ж–µ –Њ–±—К–µ–Љ–∞ –Є –љ–∞—А—Г—И–µ–љ–Є–µ–Љ –Љ–Є–Ї—А–Њ–∞—А—Е–Є—В–µ–Ї—В–Њ–љ–Є–Ї–Є –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —П–≤–ї—П–µ—В—Б—П —Б–Ї—Г–і–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–∞, —З—В–Њ –Њ–±—Г—Б–ї–Њ–≤–ї–Є–≤–∞–µ—В –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ–Љ—Г –љ–∞–ї–Є—З–Є—О –Ю–Я –Ї–∞–Ї —Б–∞–Љ–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —В–∞–Ї –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е —А–∞–±–Њ—В–љ–Є–Ї–Њ–≤. –Ш—Б—Е–Њ–і—Л –Ю–Я – —Г–≤–µ–ї–Є—З–µ–љ–Є–µ —Е—А—Г–њ–Ї–Њ—Б—В–Є –Ї–Њ—Б—В–µ–є –Є –Є—Е –њ–µ—А–µ–ї–Њ–Љ—Л –љ–µ—А–µ–і–Ї–Њ —П–≤–ї—П—О—В—Б—П –Њ—Б–љ–Њ–≤–Њ–є –і–ї—П –њ–Њ—Б—В–∞–љ–Њ–≤–Ї–Є –њ–Њ—Б—В–—Д–∞–Ї—В—Г–Љ –і–Є–∞–≥–љ–Њ–Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є.
–Ю—Б–љ–Њ–≤–љ—Л–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –Ю–Я, –њ–∞–і–µ–љ–Є–є
–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ
–Ъ—А–Є–≤–∞—П —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ –њ–Њ–њ—Г–ї—П—Ж–Є–Є –Є–Љ–µ–µ—В –±–Є–Љ–Њ–і–∞–ї—М–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А —Б –њ–Є–Ї–∞–Љ–Є –≤ –і–µ—В—Б–Ї–Њ–—О–љ–Њ—И–µ—Б–Ї–Њ–Љ –Є –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ (—А–Є—Б. 1). –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –њ–µ—А–µ–ї–Њ–Љ—Л, —Д–Њ—А–Љ–Є—А—Г—О—Й–Є–µ —А–∞–љ–љ–Є–є –њ–Є–Ї, –љ–µ —Б–≤—П–Ј–∞–љ—Л —Б –Ю–Я. –Ю–љ–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є –Ї–Њ—Б—В–µ–є —З–µ—А–µ–њ–∞ —Г –Љ–ї–∞–і–µ–љ—Ж–µ–≤, —В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–Љ–Є –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є –Ї–Њ—Б—В–µ–є –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є (–њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –і–Є–∞—Д–Є–Ј–Њ–≤ –і–ї–Є–љ–љ—Л—Е —В—А—Г–±—З–∞—В—Л—Е –Ї–Њ—Б—В–µ–є, –Ї–Є—Б—В–µ–є –Є –њ–∞–ї—М—Ж–µ–≤ —А—Г–Ї) —Г –њ–Њ–і—А–Њ—Б—В–Ї–Њ–≤ (5–14 –ї–µ—В) –Є –Љ–Њ–ї–Њ–і—Л—Е –≤–Ј—А–Њ—Б–ї—Л—Е (–≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Љ—Г–ґ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞) –≤ —Б–≤—П–Ј–Є —Б –≤—Л—Б–Њ–Ї–Њ–є —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О (–Є–≥—А—Л, –Ј–∞–љ—П—В–Є—П —Б–њ–Њ—А—В–Њ–Љ –Є –і—А.). –Я–Њ–Ј–і–љ–Є–є –њ–Є–Ї —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –љ–∞—З–Є–љ–∞—О—Й–Є–є—Б—П —Г –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 55–64 –≥–Њ–і–∞ –Є —Г –Љ—Г–ґ—З–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 65–74 –≥–Њ–і–∞, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є —В–µ–ї –њ–Њ–Ј–≤–Њ–љ–Ї–Њ–≤, –∞ —В–∞–Ї–ґ–µ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–Љ–Є –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–Љ–Є –њ–µ—А–µ–ї–Њ–Љ–∞–Љ–Є – –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є, –і–Є—Б—В–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –њ—А–µ–і–њ–ї–µ—З—М—П (–њ–µ—А–µ–ї–Њ–Љ –Ъ–Њ–ї–ї–Є—Б–∞), –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —А–µ–ґ–µ – –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –Њ—В–і–µ–ї–∞ –њ–ї–µ—З–µ–≤–Њ–є –Ї–Њ—Б—В–Є –Є –Ї–Њ—Б—В–µ–є —В–∞–Ј–∞ –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–є. –Ф–∞–љ–љ—Л–є –њ–Є–Ї —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –і–Њ –љ–µ–і–∞–≤–љ–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є —Б–≤—П–Ј—Л–≤–∞–ї–Є —Б –Ю–Я. –° —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ–Њ–Ј–Є—Ж–Є–є —Н—В–Є –њ–µ—А–µ–ї–Њ–Љ—Л —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—В—Б—П: 1) –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ–Є —З–∞—Б—В–Њ—В—Л, –Ї–Њ—В–Њ—А–∞—П –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ; 2) –њ–Њ–ї–Њ–≤—Л–Љ–Є —А–∞–Ј–ї–Є—З–Є—П–Љ–Є – –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ –Њ–љ–Є –љ–∞–±–ї—О–і–∞—О—В—Б—П —Г –ґ–µ–љ—Й–Є–љ (–≤ 2 –Є –±–Њ–ї–µ–µ —А–∞–Ј —З–∞—Й–µ), –Є –ї–Є—И—М –≤ –≤–Њ–Ј—А–∞—Б—В–µ 85–90 –ї–µ—В —З–∞—Б—В–Њ—В–∞ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г –Њ–±–Њ–Є—Е –њ–Њ–ї–Њ–≤ —Б–±–ї–Є–ґ–∞–µ—В—Б—П; 3) –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М—О –Њ—В –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є/—Г–Љ–µ—А–µ–љ–љ–Њ–є —В—А–∞–≤–Љ—Л —В–µ—Е —Г—З–∞—Б—В–Ї–Њ–≤ —Б–Ї–µ–ї–µ—В–∞, –Ї–Њ—В–Њ—А—Л–µ —Б–Њ–і–µ—А–ґ–∞—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–Њ–ї—М—И–Є–µ –Њ–±—К–µ–Љ—Л —В—А–∞–±–µ–Ї—Г–ї—П—А–љ–Њ–є –Ї–Њ—Б—В–Є.
–Ъ–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –Ю–Я —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –≤ –≤–Њ–Ј—А–∞—Б—В–µ 60–70 –ї–µ—В, –Є –±–Њ–ї–µ–µ 80% –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г –ґ–µ–љ—Й–Є–љ. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Њ—Б–љ–Њ–≤–љ—Л–Љ –Ї–Њ–љ—В–Є–љ–≥–µ–љ—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Н—В–Є–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ–Љ —П–≤–ї—П—О—В—Б—П –ї–Є—Ж–∞: –∞) –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞; –±) –њ—А–µ–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –ґ–µ–љ—Б–Ї–Њ–≥–Њ –њ–Њ–ї–∞, —З—В–Њ –Њ—В—А–∞–ґ–∞–µ—В –µ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Г—О —Б–≤—П–Ј—М –Ї–∞–Ї —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ, —В–∞–Ї –Є —Б –њ–Њ–ї–Њ–Љ. –Т –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ –Ю–Я –≤—Б—В—А–µ—З–∞–µ—В—Б—П –≤ –≤–Є–і–µ —А—П–і–∞ —В–Є–њ–Њ–≤ –Є —Д–Њ—А–Љ. –° —Г—З–µ—В–Њ–Љ —Н—В–Є–Њ–ї–Њ–≥–Є–Є –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ —А–∞–Ј–ї–Є—З–∞—О—В –њ–µ—А–≤–Є—З–љ—Л–є –Є –≤—В–Њ—А–Є—З–љ—Л–є –Ю–Я. –Я–µ—А–≤–Є—З–љ—Л–є –Ю–Я –Њ–±—К–µ–і–Є–љ—П–µ—В –і–≤–µ –љ–∞–Є–±–Њ–ї–µ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–µ —Д–Њ—А–Љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П – –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Л–є –Ю–Я –Є —Б–µ–љ–Є–ї—М–љ—Л–є –Ю–Я, —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є–µ –і–Њ 85% –≤—Б–µ—Е –µ–≥–Њ —Б–ї—Г—З–∞–µ–≤. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Ї –њ–µ—А–≤–Є—З–љ–Њ–Љ—Г –Њ—В–љ–Њ—Б—П—В —Б—А–∞–≤–љ–Є—В–µ–ї—М–љ–Њ —А–µ–і–Ї–Є–µ —Б–ї—Г—З–∞–Є –Є–і–Є–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Ю–Я (–Ю–Я —Г –Љ—Г–ґ—З–Є–љ, –Ю–Я –љ–µ—П—Б–љ–Њ–є —Н—В–Є–Њ–ї–Њ–≥–Є–Є —Г –≤–Ј—А–Њ—Б–ї—Л—Е), –∞ —В–∞–Ї–ґ–µ —О–≤–µ–љ–Є–ї—М–љ—Л–є –Ю–Я. –≠—В–Є–Њ–ї–Њ–≥–Є—П –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ю–Я –Њ—Б—В–∞–µ—В—Б—П –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ—П—Б–љ–Њ–є –Є —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і–Љ–µ—В–Њ–Љ –Є–љ—В–µ–љ—Б–Є–≤–љ—Л—Е, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е, –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –І—В–Њ –Ї–∞—Б–∞–µ—В—Б—П –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –Ю–Я, —В–Њ –њ—А–Є—З–Є–љ—Л –µ–≥–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є –Њ—Б–љ–Њ–≤–љ—Л–µ –Ј–≤–µ–љ—М—П –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –±–Њ–ї–µ–µ —П—Б–љ—Л, —В.–Ї. –µ–≥–Њ –≤–∞—А–Є–∞–љ—В—Л –Є —Д–Њ—А–Љ—Л –≤–Њ –Љ–љ–Њ–≥–Њ–Љ —Б–≤—П–Ј–∞–љ—Л —Б –Ї–Њ–љ–Ї—А–µ—В–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, –њ–∞—В–Њ–ї–Њ–≥–Є–µ–є –Ц–Ъ–Ґ, –њ–Њ—З–µ–Ї, —Б–Є—Б—В–µ–Љ—Л –Ї—А–Њ–≤–Є, —П—В—А–Њ–≥–µ–љ–љ—Л–Љ–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П–Љ–Є (–њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ–Є–і–љ—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –њ—А–Њ—В–Є–≤–Њ—Н–њ–Є–ї–µ–њ—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і—Б—В–≤ –Є –і—А.).
–Ъ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –±–Њ–ї—М–љ—Л—Е –Ю–Я, –Њ—В–љ–Њ—Б—П—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –љ–∞ —Д–Њ–љ–µ —Н–љ–і–Њ–Ї—А–Є–љ–љ–Њ––Є–Љ–Љ—Г–љ–љ–Њ–є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Є –Њ–±—Й–µ–є –Љ—Л—И–µ—З–љ–Њ–є –Љ–∞—Б—Б—Л (—Б–∞—А–Ї–Њ–њ–µ–љ–Є—П) –Є –љ–∞–ї–Є—З–Є–µ —Б–ї–∞–±–Њ—Б—В–Є –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л—Е –Љ—Л—И—Ж (—Б–Є–љ–і—А–Њ–Љ —Б–ї–∞–±–Њ—Б—В–Є), —Б–љ–Є–ґ–µ–љ–Є–µ –Ј—А–µ–љ–Є—П (—Б–љ–Є–ґ–µ–љ–Є–µ –Њ—Б—В—А–Њ—В—Л –Є —Б—Г–ґ–µ–љ–Є–µ –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П) –Є –∞–і–µ–Ї–≤–∞—В–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –≤–µ—Б—В–Є–±—Г–ї—П—А–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, —З—В–Њ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –њ–∞–і–µ–љ–Є–є –Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е —Н—В–Є–Љ —В—А–∞–≤–Љ –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ (—В–∞–±–ї. 1, —Б—Е–µ–Љ–∞ 1). –Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –±–Њ–ї–µ–µ —З–µ–Љ —Г 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Я –Є–Љ–µ–µ—В—Б—П —Б–∞—А–Ї–Њ–њ–µ–љ–Є—П, –њ—А–Є–Љ–µ—А–љ–Њ 25% –Є–Ј –љ–Є—Е —Б—В—А–∞–і–∞—О—В –њ–Њ—Б—В—Г—А–∞–ї—М–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–µ–є, –∞ —Г –њ–Њ–і–∞–≤–ї—П—О—Й–µ–≥–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –Њ—Б–ї–∞–±–ї–µ–љ–Њ –Ј—А–µ–љ–Є–µ –Є —З–∞—Б—В–Є—З–љ–Њ –љ–∞—А—Г—И–µ–љ–∞ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Ї –њ–µ—А–µ–і–≤–Є–ґ–µ–љ–Є—О.
–Ю—Б–Њ–±–µ–љ–љ–Њ –≤–µ–ї–Є–Ї–∞ —А–Њ–ї—М –њ–∞–і–µ–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –≤–љ—Г—В—А–µ–љ–љ–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Є –Њ–њ–Њ—А–љ–Њ––і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞ (–Љ—Л—И—Ж—Л, –Ї–Њ—Б—В–Є, —З—Г–≤—Б—В–≤–Њ —А–∞–≤–љ–Њ–≤–µ—Б–Є—П, –њ—А–Њ–њ—А–Є–Њ—Ж–µ–њ—В–Є–≤–љ—Л–µ —А–µ—Д–ї–µ–Ї—Б—Л –Є –і—А.). –Ш–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ—Е–Њ–і–Ї–Є –њ–Њ—П–≤–ї—П—О—В—Б—П —Г 50% –њ–Њ–ґ–Є–ї—Л—Е –Є —Г 100% —Б—В–∞—А—Л—Е –ї—О–і–µ–є. –Ю–љ–Є –њ—А–Њ—П–≤–ї—П—О—В—Б—П —Г–Ї–Њ—А–Њ—З–µ–љ–Є–µ–Љ —И–∞–≥–∞, –≤—Л—Б–Њ—В—Л –њ–Њ–і—К–µ–Љ–∞ —Б—В–Њ–њ—Л (—Г–≥–Њ–ї –њ–Њ–і—К–µ–Љ–∞ —Б—В–Њ–њ—Л —Г —Б—В–∞—А–Є–Ї–Њ–≤ –±–ї–Є–Ј–Њ–Ї –Ї 10° –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В 30° —Г –ї—О–і–µ–є –Љ–Њ–ї–Њ–і–Њ–≥–Њ –Є —Б—А–µ–і–љ–µ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞). –£–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П —А–∞—Б–Ї–∞—З–Є–≤–∞–љ–Є–µ –њ—А–Є —Е–Њ–і—М–±–µ –Є —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –≥–ї—Г–±–Є–љ–∞ –≤–Њ—Б–њ—А–Є—П—В–Є—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В–Є (—Г–Љ–µ–љ—М—И–µ–љ–Є–µ —В–∞–Ї—В–Є–ї—М–љ–Њ–є –Є –≥–ї—Г–±–Њ–Ї–Њ–є –Љ—Л—И–µ—З–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б—В–Њ–њ). –°–љ–Є–ґ–∞–µ—В—Б—П —Б–Ї–Њ—А–Њ—Б—В—М —Е–Њ–і—М–±—Л –Є –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є—П –і–≤–Є–ґ–µ–љ–Є–є, –њ–Њ–≤—Л—И–∞–µ—В—Б—П –≤—А–µ–Љ—П —А–µ–∞–Ї—Ж–Є–Є, –љ–∞–±–ї—О–і–∞–µ—В—Б—П –Ј–∞–Љ–µ—В–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –Љ—Л—И–µ—З–љ–Њ–є —Б–Є–ї—Л –Є –≤—Л–љ–Њ—Б–ї–Є–≤–Њ—Б—В–Є (—Б–Є–љ–і—А–Њ–Љ —Г—В–Њ–Љ–ї–µ–љ–Є—П), –њ—А–µ–≤–∞–ї–Є—А—Г–µ—В —З—Г–≤—Б—В–≤–Њ —Г—Б—В–∞–ї–Њ—Б—В–Є (—Б—Е–µ–Љ–∞ 2).
–Т —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В —Б–∞—А–Ї–Њ–њ–µ–љ–Є—П, –±–Њ–ї–Є –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є —Б–љ–Є–ґ–µ–љ–Є–µ –Є—Е –њ–Њ–і–≤–Є–ґ–љ–Њ—Б—В–Є. –Т–Њ–Ј—А–∞—Б—В–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Д–Є–Ј–Є—З–µ—Б–Ї–Њ–є —А–∞–±–Њ—В–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Є –≤—Л–љ–Њ—Б–ї–Є–≤–Њ—Б—В–Є, –ї—О–±—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–Є –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –њ—А–Є–≤–Њ–і—П—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–≥–Њ —Б—В–µ—А–µ–Њ—В–Є–њ–∞. –Я–Њ—Е–Њ–і–Ї–∞ —Г —Б—В–∞—А–Є–Ї–Њ–≤ —Б—В–∞–љ–Њ–≤–Є—В—Б—П —И–∞—А–Ї–∞—О—Й–µ–є, –љ–µ—Г–≤–µ—А–µ–љ–љ–Њ–є, –Њ–љ–Є —Б —В—А—Г–і–Њ–Љ –њ—А–µ–Њ–і–Њ–ї–µ–≤–∞—О—В –і–∞–ґ–µ –љ–µ–±–Њ–ї—М—И–Є–µ –њ—А–µ–њ—П—В—Б—В–≤–Є—П, —З—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–∞–ї–Є—З–Є–Є –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–µ–љ–љ–Њ––і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є –і–µ–Ј–∞–і–∞–њ—В–∞—Ж–Є–Є. –£ –Љ–љ–Њ–≥–Є—Е –Є–Ј –њ–µ—А–µ–љ–µ—Б—И–Є—Е –њ–∞–і–µ–љ–Є—П –њ–Њ—П–≤–ї—П–µ—В—Б—П —Б—В—А–∞—Е –Є—Е –њ–Њ–≤—В–Њ—А–µ–љ–Є—П. –Я–Њ —Н—В–Њ–є –њ—А–Є—З–Є–љ–µ –Њ–љ–Є –µ—Й–µ –±–Њ–ї—М—И–µ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—В —Д–Є–Ј–Є—З–µ—Б–Ї—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М (–≤ —В–Њ–Љ —З–Є—Б–ї–µ –Ј–∞–љ—П—В–Є—П —Д–Є–Ј–Ї—Г–ї—М—В—Г—А–Њ–є, –њ—А–Њ–≥—Г–ї–Ї–Є –Є –і—А.) —З—В–Њ, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –њ–Њ–≤—В–Њ—А–љ—Л—Е –њ–∞–і–µ–љ–Є–є.
–Я—А–Є —А–∞—Б—Б–Љ–Њ—В—А–µ–љ–Є–Є —Б–≤—П–Ј–µ–є –њ–∞–і–µ–љ–Є—П –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г –њ–Њ–ґ–Є–ї—Л—Е –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В –Є —Г—З–µ—В –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—П –њ–∞–і–µ–љ–Є—П. –Х—Б–ї–Є –ї–Є—Ж–∞ –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –њ–∞–і–∞—О—В –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є—О –≤–њ–µ—А–µ–і, —В–Њ –ї–Є—Ж–∞ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є —Б—В–∞—А–Є–Ї–Є –Њ–±—Л—З–љ–Њ –њ–∞–і–∞—О—В –љ–∞–±–Њ–Ї. –Ґ–∞–Ї–Њ–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ –њ–∞–і–µ–љ–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ –њ—А–Є–ї–Њ–ґ–µ–љ–Є–µ–Љ —Б–Є–ї—Л —Г–і–∞—А–∞ –Њ –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –љ–∞ –Њ–±–ї–∞—Б—В—М —В–∞–Ј–∞/—В–∞–Ј–Њ–±–µ–і—А–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞/—И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є/–±–µ–і—А–µ–љ–љ—Г—О –Ї–Њ—Б—В—М. –Э–∞ —Д–Њ–љ–µ –љ–µ—А–µ–і–Ї–Њ –љ–∞–±–ї—О–і–∞–µ–Љ—Л—Е –≤ –њ–Њ–ґ–Є–ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є —Б–љ–Є–ґ–µ–љ–Є—П –Љ–∞—Б—Б—Л —В–µ–ї–∞, –њ–µ—А–µ—А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–Њ–і–Ї–Њ–ґ–љ–Њ–≥–Њ –ґ–Є—А–∞ –Њ—В –±–µ–і–µ—А –≤ –і—А—Г–≥–Є–µ –Њ–±–ї–∞—Б—В–Є, –∞ —В–∞–Ї–ґ–µ —Б–∞—А–Ї–Њ–њ–µ–љ–Є–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П –µ—Б—В–µ—Б—В–≤–µ–љ–љ–∞—П –Љ–µ—Е–∞–љ–Є—З–µ—Б–Ї–∞—П –Ј–∞—Й–Є—В–∞ –±–µ–і—А–µ–љ–љ–Њ–є –Њ–±–ї–∞—Б—В–Є, —З—В–Њ –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–∞ —И–µ–є–Ї–Є –±–µ–і—А–∞.
–Т –Њ—Б–љ–Њ–≤–µ –њ–∞–і–µ–љ–Є–є —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–Њ–≤ –Љ–Њ–≥—Г—В –ї–µ–ґ–∞—В—М –≤–љ—Г—В—А–µ–љ–љ–Є–µ –њ—А–Є—З–Є–љ—Л (–≤–Њ–Ј—А–∞—Б—В–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П —Б–Є—Б—В–µ–Љ, –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є—Е —А–∞–≤–љ–Њ–≤–µ—Б–Є–µ —В–µ–ї–∞, —Б–Є–љ–і—А–Њ–Љ —Б–ї–∞–±–Њ—Б—В–Є, —А—П–і –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є – –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е, –њ—А–Є–µ–Љ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤) –Є –≤–љ–µ—И–љ–Є–µ –њ—А–Є—З–Є–љ—Л (–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–∞—П –Њ—Б–≤–µ—Й–µ–љ–љ–Њ—Б—В—М, –Ї—А—Г—В—Л–µ –ї–µ—Б—В–љ–Є—Ж—Л –Є –і—А.). –Т –Њ—В–ї–Є—З–Є–µ –Њ—В –ї–Є—Ж –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –ї–Є—И—М 14–15% –њ–∞–і–µ–љ–Є–є —Г –њ–Њ–ґ–Є–ї—Л—Е –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –Є—Б–Ї–ї—О—З–Є—В–µ–ї—М–љ–Њ –≤–љ–µ—И–љ–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є, –љ–∞–њ—А–Є–Љ–µ—А, –њ–∞–і–µ–љ–Є—П –љ–∞ –Њ–±–ї–µ–і–µ–љ–µ–≤—И–µ–Љ —В—А–Њ—В—Г–∞—А–µ. –Т –Њ—Б—В–∞–ї—М–љ—Л—Е —Б–ї—Г—З–∞—П—Е –њ–∞–і–µ–љ–Є—П —Б–≤—П–Ј–∞–љ—Л —Б –≤–љ—Г—В—А–µ–љ–љ–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є –Є –њ—А–Њ–Є—Б—Е–Њ–і—П—В –і–Њ–Љ–∞ –ї–Є–±–Њ –≤ –±–Њ–ї—М–љ–Є—З–љ–Њ–є –њ–∞–ї–∞—В–µ. –†–Є—Б–Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–∞–і–µ–љ–Є–є –Є –Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤—Л—И–µ —Г –±–Њ–ї—М–љ—Л—Е, –љ–∞—Е–Њ–і–Є–≤—И–Є—Е—Б—П –і–ї–Є—В–µ–ї—М–љ–Њ–µ –≤—А–µ–Љ—П –љ–∞ –њ–Њ—Б—В–µ–ї—М–љ–Њ–Љ —А–µ–ґ–Є–Љ–µ. –Ф–ї–Є—В–µ–ї—М–љ–∞—П –Є–Љ–Љ–Њ–±–Є–ї–Є–Ј–∞—Ж–Є—П —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ю–Я, –Љ—Л—И–µ—З–љ–Њ–є —Б–ї–∞–±–Њ—Б—В—М—О, –љ–µ—А–µ–і–Ї–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–љ–Њ–є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –Є–Ј–Њ–ї—П—Ж–Є–µ–є –Є —А–∞–Ј–≤–Є—В–Є–µ–Љ –і–µ–њ—А–µ—Б—Б–Є–Є.
–Ш–Ј–Љ–µ–љ–µ–љ–Є–µ –њ–Њ—Е–Њ–і–Ї–Є —Г –њ–Њ–ґ–Є–ї—Л—Е –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞–µ—В –Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О –њ–∞–і–µ–љ–Є–є. –° –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —Е–Њ–і—М–±–∞ —Б—В–∞–љ–Њ–≤–Є—В—Б—П –±–Њ–ї–µ–µ –Љ–µ–і–ї–µ–љ–љ–Њ–є, —Г–Ї–Њ—А–∞—З–Є–≤–∞–µ—В—Б—П —И–∞–≥, —Г–Љ–µ–љ—М—И–∞–µ—В—Б—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –њ–µ—А–Є–Њ–і–∞ –Њ—В—В–∞–ї–Ї–Є–≤–∞–љ–Є—П –Њ—В –Њ–њ–Њ—А—Л, —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ–µ—А–Є–Њ–і –Њ–њ–Њ—А—Л –љ–∞ –Њ–±–µ –љ–Њ–≥–Є. –Я–∞–і–µ–љ–Є—П —Г –њ–Њ–ґ–Є–ї—Л—Е –ґ–µ–љ—Й–Є–љ –≤—Б—В—А–µ—З–∞—О—В—Б—П —З–∞—Й–µ, —З–µ–Љ —Г –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ, —З—В–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ –њ–Њ–ї–Њ–≤—Л–Љ–Є –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—П–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є —Е–Њ–і—М–±—Л –њ—А–Є —Б—В–∞—А–µ–љ–Є–Є. –£ –ґ–µ–љ—Й–Є–љ —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —В–µ–љ–і–µ–љ—Ж–Є—П –Ї —Е–Њ–і—М–±–µ –≤–њ–µ—А–µ–≤–∞–ї–Ї—Г, —Б –±–ї–Є–Ј–Ї–Њ—А–∞—Б–њ–Њ–ї–Њ–ґ–µ–љ–љ—Л–Љ–Є –љ–Њ–≥–∞–Љ–Є; —Г –Љ—Г–ґ—З–Є–љ —З–∞—Й–µ –≤—Б—В—А–µ—З–∞–µ—В—Б—П —Д–ї–µ–Ї—Б–Њ—А–љ–∞—П –њ–Њ–Ј–∞, —В–µ–љ–і–µ–љ—Ж–Є—П –Ї –њ–Њ—Е–Њ–і–Ї–µ –Љ–µ–ї–Ї–Є–Љ–Є —И–∞–ґ–Ї–∞–Љ–Є, —Б —И–Є—А–Њ–Ї–Њ —А–∞—Б—Б—В–∞–≤–ї–µ–љ–љ—Л–Љ–Є –љ–Њ–≥–∞–Љ–Є. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П —Г –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –±–Њ–ї—М—И–Њ–є —З–∞—Б—В–Є –њ–Њ–ґ–Є–ї—Л—Е (–і–Њ 20%) –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є —П–≤–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є —Е–Њ–і—М–±—Л –љ–µ –≤—Л—П–≤–ї—П–µ—В—Б—П. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ –љ–∞—А—Г—И–µ–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–Є—П —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–Њ–≤ —Б–≤—П–Ј–∞–љ—Л –љ–µ —Б—В–Њ–ї—М–Ї–Њ —Б–Њ —Б—В–∞—А–µ–љ–Є–µ–Љ, —Б–Ї–Њ–ї—М–Ї–Њ —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –љ–µ —П—А–Ї–Њ –њ—А–Њ—П–≤–ї—П—О—Й–Є–Љ–Є—Б—П (–Љ–Є–µ–ї–Њ–њ–∞—В–Є–Є —А–∞–Ј–ї–Є—З–љ–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, –љ–∞—З–∞–ї—М–љ—Л–µ —Б—В–∞–і–Є–Є –±–Њ–ї–µ–Ј–љ–Є –Я–∞—А–Ї–Є–љ—Б–Њ–љ–∞, –љ–Њ—А–Љ–Њ—В–µ–љ–Ј–Є–≤–љ–∞—П –≥–Є–і—А–Њ—Ж–µ—Д–∞–ї–Є—П –Є –і—А.). –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ –љ–∞—А—Г—И–µ–љ–Є–є —Е–Њ–і—М–±—Л —П–≤–ї—П–µ—В—Б—П –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–Љ –њ—А–Њ–≥–љ–Њ—Б—В–Є—З–µ—Б–Ї–Є–Љ –њ—А–Є–Ј–љ–∞–Ї–Њ–Љ –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –і–µ–Љ–µ–љ—Ж–Є–Є (–Њ—Б–Њ–±–µ–љ–љ–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –і–µ–Љ–µ–љ—Ж–Є–Є).
–Я–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –њ–Њ–Ј—Л –Є —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –Ј–∞–≤–Є—Б—П—В –Њ—В —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ–Љ–њ–ї–µ–Ї—Б–∞ —Б–Є—Б—В–µ–Љ: —Б–µ–љ—Б–Њ—А–љ–Њ–є, –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є, –Ї–Њ—Б—В–љ–Њ––Љ—Л—И–µ—З–љ–Њ–є. –°—В–∞—А–µ–љ–Є–µ –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г –њ–Њ–ґ–Є–ї—Л—Е –Љ–Њ–≥—Г—В –≤–Њ–≤–ї–µ–Ї–∞—В—М –ї—О–±–Њ–є –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В –Є–Ј –њ–µ—А–µ—З–Є—Б–ї–µ–љ–љ—Л—Е –≤—Л—И–µ, –Є –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є—П –і–µ–є—Б—В–≤—Г—О—Й–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤ —З–∞—Б—В–Њ —Б—Г–Љ–Љ–Є—А—Г–µ—В—Б—П. –Ю–і–љ–∞–Ї–Њ –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –Љ–Њ–ґ–љ–Њ –≤—Л–і–µ–ї–Є—В—М –≤–µ–і—Г—Й–Є–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є —Д–∞–Ї—В–Њ—А, –љ–∞ —Г—Б—В—А–∞–љ–µ–љ–Є–µ –Ї–Њ—В–Њ—А–Њ–≥–Њ –Є –і–Њ–ї–ґ–љ–Њ –±—Л—В—М –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –ї–µ—З–µ–љ–Є–µ [3].
–°–µ–љ—Б–Њ—А–љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П –њ–Њ—Б—В—Г–њ–∞–µ—В –њ–Њ –њ—А–Њ–њ—А–Є–Њ—Ж–µ–њ—В–Є–≤–љ—Л–Љ, –Ј—А–Є—В–µ–ї—М–љ—Л–Љ –Є –≤–µ—Б—В–Є–±—Г–ї—П—А–љ—Л–Љ –њ—Г—В—П–Љ. –≠—В–Є —Б–Є—Б—В–µ–Љ—Л –Њ—З–µ–љ—М –њ–ї–∞—Б—В–Є—З–љ—Л, –Є –њ—А–Є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –Њ–і–љ–Њ–є –Є–Ј –љ–Є—Е –і–≤–µ –і—А—Г–≥–Є–µ –±–µ—А—Г—В –љ–∞ —Б–µ–±—П —Д—Г–љ–Ї—Ж–Є—О –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ–Њ–є. –Ю–і–љ–∞–Ї–Њ –≤ —Б–ї—Г—З–∞–µ —Б—В—А–∞–і–∞–љ–Є—П (–њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П) –і–≤—Г—Е —Б–Є—Б—В–µ–Љ –љ–∞ –і–Њ–ї—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А—Г—О—Й–µ–є –њ—А–Є—Е–Њ–і–Є—В—Б—П –≤—Б—П –љ–∞–≥—А—Г–Ј–Ї–∞ –њ–Њ –Њ–±–µ—Б–њ–µ—З–µ–љ–Є—О –∞—Д—Д–µ—А–µ–љ—В–∞—Ж–Є–Є, –Є –≤ —Б–ї—Г—З–∞–µ –µ–µ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –≤–Њ–Ј–љ–Є–Ї–∞—О—В –љ–∞—А—Г—И–µ–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –Є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–∞–і–µ–љ–Є–є. –° –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –Њ—В–Љ–µ—З–∞–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–Є—Б–ї–∞ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –≥–ї—Г–±–Њ–Ї–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–µ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–µ–≤–Љ–∞—В–Њ–Є–і–љ—Л–Љ –∞—А—В—А–Є—В–Њ–Љ –Є —И–µ–є–љ—Л–Љ —Б–њ–Њ–љ–і–Є–ї–µ–Ј–Њ–Љ. –≠—В–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –∞—Д—Д–µ—А–µ–љ—В–∞—Ж–Є–Є –Њ—В —Б–њ–Є–љ–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –≤ –≤—Л—И–µ–ї–µ–ґ–∞—Й–Є–µ –Њ—В–і–µ–ї—Л –¶–Э–°. –Я—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П, —З—В–Њ —Г —З–∞—Б—В–Є –±–Њ–ї—М–љ—Л—Е –њ–Њ–і–Њ–±–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ–њ—А–Є–Њ—Ж–µ–њ—Ж–Є–Є –њ—А–Є–≤–Њ–і–Є—В –Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Ї–∞—А—В–Є–љ–µ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–є –≤–µ—А—В–µ–±—А–Њ––±–∞–Ј–Є–ї—П—А–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є, —Е–Њ—В—П –љ–∞ —Б–∞–Љ–Њ–Љ –і–µ–ї–µ –і–Є—Б–≥–µ–Љ–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –≤ –≤–µ—А—В–µ–±—А–Њ––±–∞–Ј–Є–ї—П—А–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–є —А–Њ–ї–Є –≤ –≥–µ–љ–µ–Ј–µ –њ–Њ–і–Њ–±–љ—Л—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤ –љ–µ –Є–≥—А–∞—О—В. –Я—А–Є—З–Є–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є –Љ—Л—И–µ—З–љ–Њ–є —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В–Є –Љ–Њ–ґ–µ—В –±—Л—В—М –Љ–Є–∞—Б—В–µ–љ–Є—П, —З–∞—Б—В–Њ—В–∞ –≤—Б—В—А–µ—З–∞–µ–Љ–Њ—Б—В–Є –Ї–Њ—В–Њ—А–Њ–є —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–Њ–≤ —З–∞—Б—В–Њ –љ–µ–і–Њ–Њ—Ж–µ–љ–Є–≤–∞–µ—В—Б—П. –Э–µ—А–µ–і–Ї–Њ –њ—А–Є—З–Є–љ–Њ–є –њ–∞–і–µ–љ–Є–є —П–≤–ї—П–µ—В—Б—П –∞–ї–Ї–Њ–≥–Њ–ї–Є–Ј–Љ –Є–ї–Є –±—Л—В–Њ–≤–Њ–µ –Ј–ї–Њ—Г–њ–Њ—В—А–µ–±–ї–µ–љ–Є–µ –∞–ї–Ї–Њ–≥–Њ–ї–µ–Љ, –Њ—Б–Њ–±–µ–љ–љ–Њ —Г –ї–Є—Ж —Б –і–µ–њ—А–µ—Б—Б–Є–µ–є –Є–ї–Є –ґ–Є–≤—Г—Й–Є—Е –≤ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–є —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–є –Є–Ј–Њ–ї—П—Ж–Є–Є. –†–Є—Б–Ї –њ–∞–і–µ–љ–Є–є –љ–∞ —Д–Њ–љ–µ –і–∞–ґ–µ –љ–µ–±–Њ–ї—М—И–Є—Е –і–Њ–Ј –∞–ї–Ї–Њ–≥–Њ–ї—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В—М –Ї –∞–ї–Ї–Њ–≥–Њ–ї—О —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —Б–љ–Є–ґ–∞–µ—В—Б—П.
–Т–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –њ–∞–і–µ–љ–Є–є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —З–Є—Б–ї–∞ —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞: —Г –ї–Є—Ж –±–µ–Ј —Д–∞–Ї—В–Њ—А–Њ–≤ –њ–∞–і–µ–љ–Є—П –≤—Б—В—А–µ—З–∞—О—В—Б—П –≤ 8% —Б–ї—Г—З–∞–µ–≤, –∞ —Г –ї–Є—Ж, –Є–Љ–µ—О—Й–Є—Е 4 —Д–∞–Ї—В–Њ—А–∞ —А–Є—Б–Ї–∞ –Є –±–Њ–ї–µ–µ – –≤ 78%. –Ы–Є—И—М –≤ –љ–µ–±–Њ–ї—М—И–Њ–Љ –њ—А–Њ—Ж–µ–љ—В–µ —Б–ї—Г—З–∞–µ–≤ –њ–∞–і–µ–љ–Є—П –≤–Њ–Ј–љ–Є–Ї–∞—О—В –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Њ–і–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞, —Г –±–Њ–ї—М—И–Є–љ—Б—В–≤–∞ –њ–Њ–ґ–Є–ї—Л—Е –±–Њ–ї—М–љ—Л—Е –Є–Љ–µ–µ—В—Б—П –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є—Е –Ї –њ–∞–і–µ–љ–Є—П–Љ —Д–∞–Ї—В–Њ—А–Њ–≤, –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ —Г—Б–Є–ї–Є–≤–∞—О—Й–Є—Е –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –Ї–∞–ґ–і–Њ–≥–Њ –Є–Ј –љ–Є—Е. –°–ї–µ–і—Г–µ—В –њ–Њ–і—З–µ—А–Ї–љ—Г—В—М, —З—В–Њ —А–Є—Б–Ї –њ–∞–і–µ–љ–Є–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –њ—А–Є –Њ—Б—В—А–Њ–Љ —А–∞–Ј–≤–Є—В–Є–Є –Є–ї–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є –њ—А–Њ—В–µ–Ї–∞—О—Й–Є—Е —Б–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Ъ –≤–љ–µ—И–љ–Є–Љ —Д–∞–Ї—В–Њ—А–∞–Љ, –≤–µ–і—Г—Й–Є–Љ –Ї –њ–∞–і–µ–љ–Є—П–Љ, –Њ—В–љ–Њ—Б—П—В—Б—П –њ–ї–Њ—Е–∞—П –Њ—Б–≤–µ—Й–µ–љ–љ–Њ—Б—В—М –њ–Њ–Љ–µ—Й–µ–љ–Є–є, –љ–µ—А–Њ–≤–љ–∞—П –Є–ї–Є —Б–Ї–Њ–ї—М–Ј–Ї–∞—П –њ–Њ–≤–µ—А—Е–љ–Њ—Б—В—М –њ–Њ–ї–∞, –љ–µ—Г–і–Њ–±–љ–∞—П –Њ–±—Г–≤—М –Є –і—А. –Я–∞–і–µ–љ–Є—П —З–∞—Й–µ –њ—А–Њ–Є—Б—Е–Њ–і—П—В –њ—А–Є —Б–њ—Г—Б–Ї–µ –њ–Њ –ї–µ—Б—В–љ–Є—Ж–µ, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –≤—Б—В–∞–≤–∞–љ–Є–Є —Б –Ї—А–µ—Б–ї–∞/—Б—В—Г–ї–∞ –ї–Є–±–Њ —Б –њ–Њ—Б—В–µ–ї–Є. –°–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –њ–∞–і–µ–љ–Є—П–Љ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –≤–љ–Є–Љ–∞—В–µ–ї—М–љ—Л–є —Г—Е–Њ–і –Ј–∞ –±–Њ–ї—М–љ—Л–Љ–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –Є–Љ–µ—О—Й–Є–Љ–Є –Љ–љ–µ—Б—В–Є–Ї–Њ––Є–љ—В–µ–ї–ї–µ–Ї—В—Г–∞–ї—М–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П. –†–Є—Б–Ї –њ–∞–і–µ–љ–Є–є –≤–Њ–Ј—А–∞—Б—В–∞–µ—В –≤ –њ–µ—А–≤—Л–µ –і–љ–Є –њ–Њ—Б–ї–µ –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є –Є–ї–Є —Б—А–∞–Ј—Г –њ–Њ—Б–ї–µ –Њ—В–Љ–µ–љ—Л –њ–Њ—Б—В–µ–ї—М–љ–Њ–≥–Њ —А–µ–ґ–Є–Љ–∞.
–°—А–µ–і–Є –њ—А–Є—З–Є–љ –њ–∞–і–µ–љ–Є–є —Г –њ–Њ–ґ–Є–ї—Л—Е –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–µ –Љ–µ—Б—В–Њ –Ј–∞–љ–Є–Љ–∞—О—В –Є —А–∞–Ј–ї–Є—З–љ—Л–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–µ—Б—П —Б–Є–љ–Ї–Њ–њ–∞–ї—М–љ—Л–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є (–Њ–±–Љ–Њ—А–Њ—З–љ–Њ–µ —Б–Њ—Б—В–Њ—П–љ–Є–µ). –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –±—Л—Б—В—А–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ–Њ—В–µ—А–Є —Б–Њ–Ј–љ–∞–љ–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П –∞—А–Є—В–Љ–Є–є, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ—А–Є —Н–њ–Є–ї–µ–њ—Б–Є–Є –±—Л—Б—В—А–Њ–µ —А–∞–Ј–≤–Є—В–Є–µ –њ–Њ—В–µ—А–Є —Б–Њ–Ј–љ–∞–љ–Є—П —Б–Љ–µ–љ—П–µ—В—Б—П –Љ–µ–і–ї–µ–љ–љ—Л–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ. –Ф–ї—П –≤–∞–Ј–Њ–њ—А–µ—Б—Б–Њ—А–љ—Л—Е —Б–Є–љ–Ї–Њ–њ–∞–ї—М–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –±—Л—Б—В—А–Њ–µ –љ–∞—З–∞–ї–Њ —Б –њ—А–Њ–і—А–Њ–Љ–∞–ї—М–љ—Л–Љ–Є —П–≤–ї–µ–љ–Є—П–Љ–Є (–љ–µ—А–µ–і–Ї–Њ –љ–∞ —Д–Њ–љ–µ —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б—В—А–µ—Б—Б–∞) —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ –±—Л—Б—В—А—Л–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ. –Ґ—Й–∞—В–µ–ї—М–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –≤—Л—П–≤–Є—В—М –Њ—А—В–Њ—Б—В–∞—В–Є—З–µ—Б–Ї—Г—О –≥–Є–њ–Њ—В–µ–љ–Ј–Є—О –њ–Њ—З—В–Є —Г 30% –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞. –Я—А–Є —Н—В–Њ–Љ —Г –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —З–∞—Б—В–Є —Н—В–Є—Е –±–Њ–ї—М–љ—Л—Е –љ–µ –Њ—В–Љ–µ—З–∞–µ—В—Б—П –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є—П, –љ–Є –Ї–∞–Ї–Є—Е––ї–Є–±–Њ –Ј—А–Є—В–µ–ї—М–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –њ—А–Є –≤—Б—В–∞–≤–∞–љ–Є–Є. –Я—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ–Є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–≥—Г—В —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—В—М—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ —Б–Є–љ–Ї–Њ–њ–∞–ї—М–љ—Л—Е —Б–Њ—Б—В–Њ—П–љ–Є–є, –Љ–Њ–≥—Г—В —П–≤–Є—В—М—Б—П –Ї–∞—И–µ–ї—М, —З–Є—Е–∞–љ–Є–µ, —А–µ–Ј–Ї–Њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є—П —В–µ–ї–∞ (–≤—Б—В–∞–≤–∞–љ–Є–µ).
–Я—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ–Є –Ї –љ–∞—А—Г—И–µ–љ–Є—О –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є–Њ–љ–љ–Њ–є –Є –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–є —Д–∞–Ї—В–Њ—А–∞–Љ–Є, –њ–Њ–≤—Л—И–∞—О—Й–Є–Љ–Є —А–Є—Б–Ї –њ–∞–і–µ–љ–Є–є –Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Я, —П–≤–ї—П—О—В—Б—П –Є –љ–µ–Ї–Њ—В–Њ—А—Л–µ –Є–Ј –љ–∞–Ј–љ–∞—З–∞–µ–Љ—Л—Е –Є–Љ –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ (–њ–Њ–ї–Є—Д–∞—А–Љ–∞—Ж–Є—П –Є–ї–Є –њ–Њ–ї–Є–њ—А–∞–≥–Љ–∞–Ј–Є—П) –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤ (—В–∞–±–ї. 2), –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Є–Ј –≥—А—Г–њ–њ —Б–љ–Њ—В–≤–Њ—А–љ—Л—Е, –∞–љ—В–Є–і–µ–њ—А–µ—Б—Б–∞–љ—В–Њ–≤, –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л—Е –Є –і—А., —З—В–Њ –Љ–Њ–ґ–µ—В —Г–≤–µ–ї–Є—З–Є–≤–∞—В—М —А–Є—Б–Ї –њ–∞–і–µ–љ–Є–є –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 40%. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –љ–∞–ї–Є—З–Є–µ —П—В—А–Њ–≥–µ–љ–љ—Л—Е –њ—А–Њ–±–ї–µ–Љ, —В.–µ. —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–Љ–Є –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П–Љ–Є, —П–≤–ї—П–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –і–ї—П –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М—О. –Я–Њ–ї–Є–њ—А–∞–≥–Љ–∞—Ж–Є—П –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В —Б–Њ–±–Њ–є –≤–µ—Б—М–Љ–∞ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–µ –Є —В—А—Г–і–љ–Њ —Г–њ—А–∞–≤–ї—П–µ–Љ–Њ–µ —П–≤–ї–µ–љ–Є–µ, —Б–≤—П–Ј–∞–љ–љ–Њ–µ –љ–µ —В–Њ–ї—М–Ї–Њ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –љ–∞–Ј–љ–∞—З–∞–µ–Љ–Њ–є –≤—А–∞—З–Њ–Љ —В–µ—А–∞–њ–Є–µ–є, –љ–Њ –Є —Б —Б–∞–Љ–Њ–ї–µ—З–µ–љ–Є–µ–Љ, —Б –і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М—О –љ–µ—А–µ—Ж–µ–њ—В—Г—А–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ (—В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л—Е, –Ю–Ґ–°––Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–≤).
–≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П –Є –Љ–µ–і–Є–Ї–Њ–—Б–Њ—Ж–Є–∞–ї—М–љ–∞—П —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –њ–∞–і–µ–љ–Є–є —Г –њ–Њ–ґ–Є–ї—Л—Е
–Т –†–Њ—Б—Б–Є–Є –≤ –Њ–±—Й–µ–є —Б—В—А—Г–Ї—В—Г—А–µ –њ—А–Є—З–Є–љ —Б–Љ–µ—А—В–љ–Њ—Б—В–Є –љ–µ—Б—З–∞—Б—В–љ—Л–µ —Б—В—Г—З–∞–Є –Є —В—А–∞–≤–Љ—Л –Ј–∞–љ–Є–Љ–∞—О—В, –љ–∞—З–Є–љ–∞—П —Б –Ї–Њ–љ—Ж–∞ 80–—Е –≥–≥. –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞, –≤—В–Њ—А–Њ–µ –Љ–µ—Б—В–Њ –њ–Њ—Б–ї–µ —Б–µ—А–і–µ—З–љ–Њ–—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Ъ —Б–Њ–ґ–∞–ї–µ–љ–Є—О, –≤ –Њ—Д–Є—Ж–Є–∞–ї—М–љ–Њ–є —Б—В–∞—В–Є—Б—В–Є–Ї–µ –љ–µ —А–∞—Б–Ї—А—Л–≤–∞–µ—В—Б—П –Љ–µ—Б—В–Њ –њ–∞–і–µ–љ–Є–є –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є, —В—А–∞–≤–Љ–∞—В–Є–Ј–Љ–∞, –Є–љ–≤–∞–ї–Є–і–Є–Ј–∞—Ж–Є–Є –Є —Б–Љ–µ—А—В–љ–Њ—Б—В–Є. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Ј–∞ —А—Г–±–µ–ґ–Њ–Љ —В–∞–Ї–∞—П —Б—В–∞—В–Є—Б—В–Є–Ї–∞ –Є –∞–љ–∞–ї–Є–Ј –≤–µ–і—Г—В—Б—П. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ —Б—В—А—Г–Ї—В—Г—А–µ –Љ–Є–љ–Є—Б—В–µ—А—Б—В–≤–∞ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –°–®–Р –Є–Љ–µ–µ—В—Б—П –¶–µ–љ—В—А –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –Ј–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М—О –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є, –Ї–Њ—В–Њ—А—Л–є —Г–і–µ–ї—П–µ—В —Б–µ—А—М–µ–Ј–љ–Њ–µ –≤–љ–Є–Љ–∞–љ–Є–µ –њ—А–Њ–±–ї–µ–Љ–µ –њ–∞–і–µ–љ–Є–є. –Ґ–∞–Ї, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, –њ–Њ –і–∞–љ–љ—Л–Љ —Н—В–Њ–≥–Њ –¶–µ–љ—В—А–∞, —Б—А–µ–і–Є –њ–Њ–њ—Г–ї—П—Ж–Є–Є –°–®–Р –±–Њ–ї–µ–µ 1/3 –ї—О–і–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 65 –ї–µ—В –Є —Б—В–∞—А—И–µ –њ–µ—А–µ–љ–Њ—Б—П—В –њ–∞–і–µ–љ–Є–µ –љ–µ –Љ–µ–љ–µ–µ –Њ–і–љ–Њ–≥–Њ —А–∞–Ј–∞ –≤ –≥–Њ–і, –∞ —Б–∞–Љ–Є –њ–∞–і–µ–љ–Є—П —П–≤–ї—П—О—В—Б—П –≤–µ–і—Г—Й–µ–є –њ—А–Є—З–Є–љ–Њ–є —В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Б–Љ–µ—А—В–µ–є –Є –љ–µ—Д–∞—В–∞–ї—М–љ—Л—Е —В—А–∞–≤–Љ, —В—А–µ–±—Г—О—Й–Є—Е –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–∞—Ж–Є–Є. –Т 2005 –≥–Њ–і—Г 15800 —Б—В–∞—А–Є–Ї–Њ–≤ —Г–Љ–µ—А–ї–Є –≤ —Б–≤—П–Ј–Є —Б —В—А–∞–≤–Љ–∞–Љ–Є, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ–Є –њ—А–Є –љ–µ–њ—А–µ–і–љ–∞–Љ–µ—А–µ–љ–љ—Л—Е –њ–∞–і–µ–љ–Є—П—Е; 1,8 –Љ–ї–љ. –ї–Є—Ж –≤ –≤–Њ–Ј—А–∞—Б—В–µ 65 –ї–µ—В –Є —Б—В–∞—А—И–µ –Є–Ј––Ј–∞ –њ–∞–і–µ–љ–Є–є –Њ–±—А–∞—В–Є–ї–Є—Б—М –≤ –Њ—В–і–µ–ї–µ–љ–Є—П —Б–Ї–Њ—А–Њ–є –њ–Њ–Љ–Њ—Й–Є; 433000 – –±—Л–ї–Є –≥–Њ—Б–њ–Є—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л –≤ —В—А–∞–≤–Љ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Њ—В–і–µ–ї–µ–љ–Є—П. –Я—А–Њ–≤–µ–і–µ–љ–љ—Л–є –∞–љ–∞–ї–Є–Ј –њ–Њ–Ј–≤–Њ–ї–Є–ї —Б–і–µ–ї–∞—В—М –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ —Б–≤—П–Ј–∞–љ–љ–∞—П —Б –њ–∞–і–µ–љ–Є—П–Љ–Є —Б–Љ–µ—А—В–љ–Њ—Б—В—М —Б—А–µ–і–Є —Б—В–∞—А–Є–Ї–Њ–≤ –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–µ–µ –і–µ—Б—П—В–Є–ї–µ–љ–Є–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ –≤—Л—А–Њ—Б–ї–∞. –Ф–Њ 30% –ї–Є—Ж, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –њ–∞–і–µ–љ–Є—П, –Є–Љ–µ—О—В —В—П–ґ–µ–ї—Л–µ —В—А–∞–≤–Љ–∞—В–Є—З–µ—Б–Ї–Є–µ –њ–Њ—А–∞–ґ–µ–љ–Є—П, –≤ —В–Њ–Љ —З–Є—Б–ї–µ —Б—Г–±–і—Г—А–∞–ї—М–љ—Л–µ –≥–µ–Љ–∞—В–Њ–Љ—Л, –њ–µ—А–µ–ї–Њ–Љ—Л —И–µ–є–Ї–Є –±–µ–і—А–∞ –Є —В—А–∞–≤–Љ—Л –≥–Њ–ї–Њ–≤—Л. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –ї—О–±–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є —Б–≤—П–Ј–∞–љ—Л —Б –њ–∞–і–µ–љ–Є—П–Љ–Є. –Ф–ї—П –Љ—Г–ґ—З–Є–љ —А–Є—Б–Ї –Ј–∞–Ї–∞–љ—З–Є–≤–∞—О—Й–Є—Е—Б—П —Б–Љ–µ—А—В—М—О (—Д–∞—В–∞–ї—М–љ—Л—Е) –њ–∞–і–µ–љ–Є–є –љ–∞ 49% –≤—Л—И–µ, —З–µ–Љ —Г –ґ–µ–љ—Й–Є–љ. –Т 2000 –≥–Њ–і—Г –≤ –°–®–Р –Њ–±—Й–Є–µ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є–µ –Ј–∞—В—А–∞—В—Л, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –ї–µ—З–µ–љ–Є–µ–Љ —Д–∞—В–∞–ї—М–љ—Л—Е –њ–∞–і–µ–љ–Є–є, —Б–Њ—Б—В–∞–≤–Є–ї–Є 179 –Љ–ї–љ. –і–Њ–ї–ї., –∞ –љ–∞ –ї–µ—З–µ–љ–Є–µ –љ–µ—Д–∞—В–∞–ї—М–љ—Л—Е –њ–∞–і–µ–љ–Є–є –±–Њ–ї–µ–µ 19 –Љ–ї—А–і. –і–Њ–ї–ї. –Я–Њ –і–∞–љ–љ—Л–Љ –Т–Ю–Ч (2004), –і–Њ 30% –ї—О–і–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ —Б—В–∞—А—И–µ 65 –ї–µ—В –Є 50% – –≤ –≤–Њ–Ј—А–∞—Б—В–µ 80 –ї–µ—В –Є —Б—В–∞—А—И–µ, –њ–Њ –Ї—А–∞–є–љ–µ–є –Љ–µ–љ–µ–µ, 1 —А–∞–Ј –≤ –≥–Њ–і –њ–µ—А–µ–љ–Њ—Б—П—В –њ–∞–і–µ–љ–Є–µ, 30% –Ї–Њ—В–Њ—А—Л—Е —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—В—Б—П —Б–µ—А—М–µ–Ј–љ—Л–Љ–Є —В—А–∞–≤–Љ–∞–Љ–Є (–њ–µ—А–µ–ї–Њ–Љ—Л, —В—А–∞–≤–Љ—Л –≥–Њ–ї–Њ–≤—Л –Є –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–∞, —Б–Њ—В—А—П—Б–µ–љ–Є–µ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞, –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Љ—П–≥–Ї–Є—Е —В–Ї–∞–љ–µ–є –Є –і—А.). –Я—А–Є —Н—В–Њ–Љ –њ—А–Є–Љ–µ—А–љ–Њ —Г –њ–Њ–ї–Њ–≤–Є–љ—Л –Є–Ј –љ–Є—Е –њ–∞–і–µ–љ–Є—П –Њ—В–Љ–µ—З–∞—О—В—Б—П –±–Њ–ї–µ–µ 1 —А–∞–Ј–∞ –≤ –≥–Њ–і. –°—А–µ–і–Є –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В—Л—Е –њ—А–Є—З–Є–љ –њ–∞–і–µ–љ–Є–є –Њ—В–Љ–µ—З–µ–љ—Л: –љ–µ—Б—З–∞—Б—В–љ—Л–µ —Б–ї—Г—З–∞–Є, —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –≤–љ–µ—И–љ–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є (—Б–Ї–Њ–ї—М–Ј–Ї–∞—П, –љ–µ—А–Њ–≤–љ–∞—П, —Б –њ—А–µ–њ—П—В—Б—В–≤–Є—П–Љ–Є –і–Њ—А–Њ–≥–∞) – 31% —Б–ї—Г—З–∞–µ–≤, —Б –≤–љ—Г—В—А–µ–љ–љ–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є: –Љ—Л—И–µ—З–љ–∞—П —Б–ї–∞–±–Њ—Б—В—М –Є –љ–∞—А—Г—И–µ–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–Є—П – –≤ 27%, –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є—П – –≤ 13% —Б–ї—Г—З–∞–µ–≤, –∞—А—В—А–Њ–Ј—Л —Б—Г—Б—В–∞–≤–Њ–≤ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є – –≤ 11%, –і–µ–њ—А–µ—Б—Б–Є–Є – –≤ 3%, –љ–∞—А—Г—И–µ–љ–Є—П –Ј—А–µ–љ–Є—П – –≤ 2% –Є –і—А. –†–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤—Б–ї–µ–і—Б—В–≤–Є–µ –њ–∞–і–µ–љ–Є–є –Њ—Б–Њ–±–µ–љ–љ–Њ –Ј–љ–∞—З–Є—В–µ–ї–µ–љ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –Є–Љ–µ—О—В—Б—П –љ–∞—А—Г—И–µ–љ–Є—П –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є (–њ–∞—А–µ–Ј—Л, –∞—В–∞–Ї—Б–Є—П) –њ–Њ—Б–ї–µ –њ–µ—А–µ–љ–µ—Б–µ–љ–љ–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞. –£ –ї–Є—Ж, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –њ–∞–і–µ–љ–Є—П, –≤ 5% —Б–ї—Г—З–∞–µ–≤ –љ–∞–±–ї—О–і–∞—О—В—Б—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є–µ –њ–µ—А–µ–ї–Њ–Љ—Л –Є –≤ 1% —Б–ї—Г—З–∞–µ–≤ – –њ–µ—А–µ–ї–Њ–Љ—Л —И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є. –°–Њ–≥–ї–∞—Б–љ–Њ –Є–Љ–µ—О—Й–Є–Љ—Б—П –і–∞–љ–љ—Л–Љ –±–Њ–ї–µ–µ 90% –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є —Б–≤—П–Ј–∞–љ–Њ —Б –њ–∞–і–µ–љ–Є—П–Љ–Є.
–†–Њ–ї—М D––і–µ—Д–Є—Ж–Є—В–∞ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –њ–∞–і–µ–љ–Є–є
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –і–≤–∞ –і–µ—Б—П—В–Є–ї–µ—В–Є—П —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–ї–Є—Б—М —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –≤–Є—В–∞–Љ–Є–љ–µ D3 (—Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї–µ) –љ–µ –Ї–∞–Ї, —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ, –≤–Є—В–∞–Љ–Є–љ–µ –≤ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–Љ –њ–Њ–љ–Є–Љ–∞–љ–Є–Є —Н—В–Њ–≥–Њ —В–µ—А–Љ–Є–љ–∞, –∞ –Ї–∞–Ї –Њ —Б—В–µ—А–Њ–Є–і–љ–Њ–Љ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ–Њ–Љ –њ—А–µ–≥–Њ—А–Љ–Њ–љ–µ, –њ—А–µ–≤—А–∞—Й–∞—О—Й–µ–Љ—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤ –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В – D––≥–Њ—А–Љ–Њ–љ, –Њ–±–ї–∞–і–∞—О—Й–Є–є –љ–∞—А—П–і—Г —Б –Љ–Њ—Й–љ—Л–Љ —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –Њ–±–Љ–µ–љ –Ї–∞–ї—М—Ж–Є—П —А—П–і–Њ–Љ –і—А—Г–≥–Є—Е –≤–∞–ґ–љ—Л—Е –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Д—Г–љ–Ї—Ж–Є–є.
–Т –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤–Є—В–∞–Љ–Є–љ D3 –Њ–±—А–∞–Ј—Г–µ—В—Б—П –Є–Ј –љ–∞—Е–Њ–і—П—Й–µ–≥–Њ—Б—П –≤ –Ї–Њ–ґ–µ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–∞ (–њ—А–Њ–≤–Є—В–∞–Љ–Є–љ–∞ D3) – 7––і–µ–≥–Є–і—А–Њ—Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –Ї–Њ—А–Њ—В–Ї–Њ–≤–Њ–ї–љ–Њ–≤–Њ–≥–Њ —Г–ї—М—В—А–∞—Д–Є–Њ–ї–µ—В–Њ–≤–Њ–≥–Њ –Њ–±–ї—Г—З–µ–љ–Є—П. –Т–Є—В–∞–Љ–Є–љ D3, –њ–Њ—Б—В—Г–њ–∞—О—Й–Є–є –≤ –љ–µ–±–Њ–ї—М—И–Є—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞—Е —Б –њ–Є—Й–µ–є –Є–ї–Є –Њ–±—А–∞–Ј—Г—О—Й–Є–є—Б—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ —Н–љ–і–Њ–≥–µ–љ–љ–Њ–≥–Њ —Б–Є–љ—В–µ–Ј–∞, –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –і–≤—Г—Е –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –≤ –њ–µ—З–µ–љ–Є –Є –њ–Њ—З–Ї–∞—Е –њ—А–µ–≤—А–∞—Й–∞–µ—В—Б—П –≤ –∞–Ї—В–Є–≤–љ—Г—О –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Г—О —Д–Њ—А–Љ—Г – 1a,25––і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ D3 (–љ–∞–Ј—Л–≤–∞–µ–Љ—Л–є —В–∞–Ї–ґ–µ D––≥–Њ—А–Љ–Њ–љ–Њ–Љ, –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–Њ–Љ –Є–ї–Є 1a,25(–Ю–Э)2 D3).
D––≥–Њ—А–Љ–Њ–љ –≤–Љ–µ—Б—В–µ —Б –њ–∞—А–∞—В–Є—А–µ–Њ–Є–і–љ—Л–Љ –≥–Њ—А–Љ–Њ–љ–Њ–Љ –Є –Ї–∞–ї—М—Ж–Є—В–Њ–љ–Є–љ–Њ–Љ —В—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –Њ–±—К–µ–і–Є–љ—П—О—В –≤ –≥—А—Г–њ–њ—Г –Ї–∞–ї—М—Ж–Є–є–—А–µ–≥—Г–ї–Є—А—Г—О—Й–Є—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, —Д—Г–љ–Ї—Ж–Є–µ–є –Ї–Њ—В–Њ—А—Л—Е —П–≤–ї—П–µ—В—Б—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–µ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Ї–∞–ї—М—Ж–Є—П –Ј–∞ —Б—З–µ—В –Ї–∞–Ї –њ—А—П–Љ–Њ–≥–Њ, —В–∞–Ї –Є –Њ–њ–Њ—Б—А–µ–і–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Њ—А–≥–∞–љ—Л––Љ–Є—И–µ–љ–Є. –Ъ—А–Њ–Љ–µ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞, 1a,25––і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ D3 –≤–Њ–Ј–і–µ–є—Б—В–≤—Г–µ—В —В–∞–Ї–ґ–µ –љ–∞ —А—П–і —Б–Є—Б—В–µ–Љ –Њ—А–≥–∞–љ–Є–Ј–Љ–∞, —В–∞–Ї–Є—Е –Ї–∞–Ї –Є–Љ–Љ—Г–љ–љ–∞—П –Є –Ї—А–Њ–≤–µ—В–≤–Њ—А–љ–∞—П, —А–µ–≥—Г–ї–Є—А—Г–µ—В —А–Њ—Б—В –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г –Ї–ї–µ—В–Њ–Ї –Є –і—А.
–Ь–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П 1a,25––і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ–∞ D3 –∞–љ–∞–ї–Њ–≥–Є—З–µ–љ –і—А—Г–≥–Є–Љ —Б—В–µ—А–Њ–Є–і–љ—Л–Љ –≥–Њ—А–Љ–Њ–љ–∞–Љ –Є –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤–Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є –≤ —В–Ї–∞–љ—П—Е —Б–Њ —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–Љ–Є —А–µ—Ж–µ–њ—В–Њ—А–∞–Љ–Є, –њ–Њ–ї—Г—З–Є–≤—И–Є–Љ–Є –љ–∞–Ј–≤–∞–љ–Є–µ –≤–Є—В–∞–Љ–Є–љ D–—А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ (–†–ТD, –Є–ї–Є –≤ –∞–љ–≥–ї–Є–є—Б–Ї–Њ–є —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є – VDR). –≠—В–Є —А–µ—Ж–µ–њ—В–Њ—А—Л —И–Є—А–Њ–Ї–Њ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ –Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л, –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ, –≤ 35 –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е, –њ—А–Є—З–µ–Љ –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Є—Е –Њ—А–≥–∞–љ–∞—Е––Љ–Є—И–µ–љ—П—Е –і–ї—П –≤–Є—В–∞–Љ–Є–љ–∞ D (–Ї–Є—И–µ—З–љ–Є–Ї–µ, –њ–Њ—З–Ї–∞—Е –Є –Ї–Њ—Б—В—П—Е), –љ–Њ –Є –≤ –Љ–Њ–Ј–≥–µ, —Б–µ—А–і—Ж–µ, —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж–∞—Е, –њ–Њ–і–ґ–µ–ї—Г–і–Њ—З–љ–Њ–є, –њ–∞—А–∞—Й–Є—В–Њ–≤–Є–і–љ—Л—Е –Є –њ—А–µ–і—Б—В–∞—В–µ–ї—М–љ–Њ–є –ґ–µ–ї–µ–Ј–∞—Е, –Ї–Є—И–µ—З–љ–Є–Ї–µ, –Њ—А–≥–∞–љ–∞—Е –≤—Л–і–µ–ї–Є—В–µ–ї—М–љ–Њ–є –Є —А–µ–њ—А–Њ–і—Г–Ї—В–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є—Е –Њ—А–≥–∞–љ–∞—Е –Є —В–Ї–∞–љ—П—Е, —З—В–Њ —П–≤–ї—П–µ—В—Б—П –µ—Й–µ –Њ–і–љ–Є–Љ –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–Њ–Љ —В–Њ–≥–Њ, —З—В–Њ 1a,25––і–Є–≥–Є–і—А–Њ–Ї—Б–Є–≤–Є—В–∞–Љ–Є–љ D3 —П–≤–ї—П–µ—В—Б—П —В–Є–њ–Є—З–љ—Л–Љ –≥–Њ—А–Љ–Њ–љ–Њ–Љ, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є–Љ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —А–µ–≥—Г–ї—П—В–Њ—А–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є.
–Ю–і–љ–Њ–є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е –Є –љ–∞–Є–±–Њ–ї–µ–µ –њ–Њ–і—А–Њ–±–љ–Њ –Є–Ј—Г—З–µ–љ–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є –≤–Є—В–∞–Љ–Є–љ–∞ D –Є D––≥–Њ—А–Љ–Њ–љ–∞ —П–≤–ї—П–µ—В—Б—П —Г—З–∞—Б—В–Є–µ –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞: –Ј–∞ —Б—З–µ—В –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є—П —Б –†–ТD –≤ –Ї–ї–µ—В–Ї–∞—Е –Њ—А–≥–∞–љ–Њ–≤––Љ–Є—И–µ–љ–µ–є D––≥–Њ—А–Љ–Њ–љ –≤—Л–Ј—Л–≤–∞–µ—В —Б–Є–љ—В–µ–Ј –Ї–∞–ї—М—Ж–Є–є–—Б–≤—П–Ј—Л–≤–∞—О—Й–Є—Е –±–µ–ї–Ї–Њ–≤, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П—О—Й–Є—Е –∞–±—Б–Њ—А–±—Ж–Є—О –Ї–∞–ї—М—Ж–Є—П –≤ –Ц–Ъ–Ґ, –µ–≥–Њ —А–µ–∞–±—Б–Њ—А–±—Ж–Є—О –≤ –њ–Њ—З–Ї–∞—Е, —Д–Є–Ї—Б–∞—Ж–Є—О –≤ —Б–Ї–µ–ї–µ—В–µ.
D––≥–Њ—А–Љ–Њ–љ, –≤ –і–Њ–њ–Њ–ї–љ–µ–љ–Є–µ –Ї —Г—З–∞—Б—В–Є—О –≤ –њ–Њ–і–і–µ—А–ґ–∞–љ–Є–Є –Ї–∞–ї—М—Ж–Є–µ–≤–Њ–≥–Њ –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј–∞, —А–∞–Ј–≤–Є—В–Є—О —Б–Ї–µ–ї–µ—В–∞ –Є –њ—А–Њ—Ж–µ—Б—Б–∞—Е –Ї–Њ—Б—В–љ–Њ–≥–Њ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П, –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є–µ –Є –љ–∞ —Д—Г–љ–Ї—Ж–Є–Є —Б–Ї–µ–ї–µ—В–љ—Л—Е (—Б–Є–љ. –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л—Е –Є–ї–Є –њ–Њ–њ–µ—А–µ—З–љ–Њ––њ–Њ–ї–Њ—Б–∞—В—Л—Е) –Љ—Л—И—Ж, –≤ –Ї–Њ—В–Њ—А—Л—Е –Є–Љ–µ—О—В—Б—П —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Є–µ –†–ТD.
–Х—Й–µ –≤ —Б–µ—А–µ–і–Є–љ–µ 70–—Е –≥–Њ–і–Њ–≤ XX –≤–µ–Ї–∞ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤–Є—В–∞–Љ–Є–љ D –Є –µ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –Њ–Ї–∞–Ј—Л–≤–∞—О—В —Б—В–Є–Љ—Г–ї–Є—А—Г—О—Й–µ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж. –Т –і–∞–ї—М–љ–µ–є—И–µ–Љ –†–ТD –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –≤ –Љ—Л—И—Ж–∞—Е –ґ–Є–≤–Њ—В–љ—Л—Е –Є –ї—О–і–µ–є. –У–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї–Є —Г—Б—В–∞–љ–Њ–≤–Є—В—М, —З—В–Њ —Г–і–∞–ї–µ–љ–Є–µ –≥–µ–љ–∞, –Ї–Њ–і–Є—А—Г—О—Й–µ–≥–Њ —Н–Ї—Б–њ—А–µ—Б—Б–Є—О –±–µ–ї–Ї–Њ–≤ –†–ТD —Г –ґ–Є–≤–Њ—В–љ—Л—Е («–љ–Њ–Ї–∞—Г—В–Є—А–Њ–≤–∞–љ–љ—Л–µ» –њ–Њ —Н—В–Њ–Љ—Г –≥–µ–љ—Г –ґ–Є–≤–Њ—В–љ—Л–µ), —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —А–∞–Ј–≤–Є—В–Є–µ–Љ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е (—Г–Ї–Њ—А–Њ—З–µ–љ–љ—Л—Е –Є —А–∞–Ј–ї–Є—З–љ—Л—Е –њ–Њ —А–∞–Ј–Љ–µ—А–∞–Љ) –Љ—Л—И–µ—З–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –њ—А–Є —Б–Њ—Е—А–∞–љ–µ–љ–Є–Є –≤ —Ж–µ–ї–Њ–Љ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Љ–Є–Њ—Ж–Є—В–Њ–≤. –Я—А–Є —Н—В–Њ–Љ —Г «–љ–Њ–Ї–∞—Г—В–Є—А–Њ–≤–∞–љ–љ—Л—Е» –ґ–Є–≤–Њ—В–љ—Л—Е –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–µ –љ–∞—А—Г—И–µ–љ–Є—П –≤ –Љ—Л—И—Ж–∞—Е: –≥–Є–њ–Њ–Ї–∞–ї—М—Ж–Є–µ–Љ–Є—П, –≥–Є–њ–Њ—Д–Њ—Б—Д–∞—В–µ–Љ–Є—П, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–µ—Б—П –љ–µ–Њ–±—Л—З–љ–Њ –≤—Л—Б–Њ–Ї–Њ–є –Є –њ–µ—А—Б–Є—Б—В–Є—А—Г—О—Й–µ–є –њ—А–Њ–і—Г–Ї—Ж–Є–µ–є –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–љ—Л—Е –Љ—Л—И–µ—З–љ—Л—Е –±–µ–ї–Ї–Њ–≤, —В–∞–Ї–Є—Е –Ї–∞–Ї myf5, –Љ–Є–Њ–≥–µ–љ–Є–љ, –Х2–Р, –Є–Ј–Њ—Д–Њ—А–Љ—Л –ї–µ–≥–Ї–Є—Е —Ж–µ–њ–µ–є –Љ–Є–Њ–Ј–Є–љ–∞ –Є –і—А. –Ю—Б–Њ–±–µ–љ–љ–Њ –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–ї–Є –і–∞–љ–љ—Л–µ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ –Њ—А—В–Њ–њ–µ–і–Є—З–µ—Б–Ї–Њ–є –Ї–ї–Є–љ–Ї–µ –С–∞–Ј–µ–ї—М—Б–Ї–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ (–®–≤–µ–є—Ж–∞—А–Є—П), –Њ —В–Њ–Љ, —З—В–Њ –≤ –Љ—Л—И–µ—З–љ–Њ–є —В–Ї–∞–љ–Є –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–∞—Е –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ —З–Є—Б–ї–∞ –†–ТD (—А–Є—Б. 2).
–Я–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П—З–Љ D––≥–Њ—А–Љ–Њ–љ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –Ј–∞—Е–≤–∞—В (–Є–љ—Д–ї—О–Ї—Б) –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л–Љ–Є –Љ—Л—И—Ж–∞–Љ–Є –°–∞2+ –Ј–∞ —Б—З–µ—В —П–і–µ—А–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞, 2–—Д–∞–Ј–љ–Њ–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –і–Є–∞—Ж–Є–ї–≥–ї–Є—Ж–µ—А–Є–љ–∞ (–Ф–Р–У), –њ—А–Є—З–µ–Љ –≤—В–Њ—А–∞—П —Д–∞–Ј–∞ —Н—В–Њ–≥–Њ –њ—А–Њ—Ж–µ—Б—Б–∞ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–∞ –Њ—В –≥–Є–і—А–Њ–ї–Є–Ј–∞ —Д–Њ—Б—Д–Њ–Є–љ–Њ–Ј–Є—В–Є–і–∞ –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ —Д–Њ—Б—Д–Њ–ї–Є–њ–∞–Ј—Л –°. –Ю–љ —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –≥–Є–і—А–Њ–ї–Є–Ј —Д–Њ—Б—Д–Њ—Б—Д–∞—В–Є–і–Є–ї—Е–Њ–ї–Є–љ–∞ –≤ —В–Ї–∞–љ—П—Е –Љ–ї–µ–Ї–Њ–њ–Є—В–∞—О—Й–Є—Е –Ј–∞ —Б—З–µ—В –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г–µ–Љ–Њ–≥–Њ —Д–Њ—Б—Д–∞–ї–Є–њ–∞–Ј–Њ–є D –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞, –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Г—З–∞—Б—В–≤—Г—О—В –Є–Њ–љ—Л –°–∞2+, –∞ —В–∞–Ї–ґ–µ –њ—А–Њ—В–µ–Є–љ–Ї–Є–љ–∞–Ј–∞ –° –Є G––±–µ–ї–Ї–Є.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–µ–є—Б—В–≤–Є—П 1,25(–Ю–Э)D3 –≤ —Б–Ї–µ–ї–µ—В–љ–Њ–є –Љ—Л—И—Ж–µ –±—Л–ї–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –і–µ—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ D––≥–Њ—А–Љ–Њ–љ –Љ–Њ–і—Г–ї–Є—А—Г–µ—В –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–ї–µ—В–Ї–∞—Е —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж –Ї–∞–Ї –Ј–∞ —Б—З–µ—В –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–≥–Њ –≥–µ–љ–Њ–Љ–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –Ї–Њ—В–Њ—А–Њ–µ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ –Ї–Њ–љ—В—А–Њ–ї–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –≥–µ–љ–Њ–≤, —В–∞–Ї –Є –њ—А–Є —Г—З–∞—Б—В–Є–Є –љ–µ–≥–µ–љ–Њ–Љ–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞, –≤–Ї–ї—О—З–∞—О—Й–µ–≥–Њ –њ—А—П–Љ—Л–µ –Љ–µ–Љ–±—А–∞–љ–љ—Л–µ —Н—Д—Д–µ–Ї—В—Л –≥–Њ—А–Љ–Њ–љ–∞, –Љ–µ–і–Є–Є—А—Г—О—Й–µ–≥–Њ —А–∞–Ј–ї–Є—З–љ—Л–µ —Б–Є–≥–љ–∞–ї—М–љ—Л–µ —Б–Є—Б—В–µ–Љ—Л. –≠—В–Њ—В —Б—В–µ—А–Њ–Є–і –±—Л—Б—В—А–Њ –Љ–Њ–і—Г–ї–Є—А—Г–µ—В –Є–љ—Д–ї—О–Ї—Б –°–∞2+ –Ј–∞ —Б—З–µ—В –Љ–µ–і–Є–Є—А—Г–µ–Љ–Њ–є G––±–µ–ї–Ї–∞–Љ–Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Д–Њ—Б—Д–Њ–ї–Є–њ–∞–Ј—Л –° –Є –∞–і–µ–љ–Є–ї–∞—В—Ж–Є–Ї–ї–∞–Ј—Л, –≤–µ–і—Г—Й–µ–є –Ї –∞–Ї—В–Є–≤–∞—Ж–Є–Є —Д–Њ—Б—Д–Њ–Ї–Є–љ–∞–Ј –° –Є –Р, –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О –°–∞2+ –Є–Ј –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л—Е –і–µ–њ–Њ(—Ж–Є—Б—В–µ—А–љ) –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –њ–Њ—В–µ–љ—Ж–Є–∞–ї––Ј–∞–≤–Є—Б–Є–Љ—Л—Е –°–∞2+ –Ї–∞–љ–∞–ї–Њ–≤ L–—В–Є–њ–∞.
–£—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ —В–∞–Ї–ґ–µ, —З—В–Њ –±—Л—Б—В—А–Њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –≤–Њ –≤—Е–Њ–і–µ –Љ–µ—З–µ–љ–Њ–≥–Њ 45–°–∞2+, –≤—Л–Ј—Л–≤–∞–µ–Љ–Њ–µ 1,25(–Ю–Э)D3 –≤ –Љ—Л—И—Ж–∞—Е –Є –≤ –Ї—Г–ї—М—В—Г—А–µ –Љ–Є–Њ–±–ї–∞—Б—В–Њ–≤, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–∞—А–∞–ї–ї–µ–ї—М–љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –±–µ–ї–Ї–∞ –Ї–∞–ї—М–Љ–Њ–і—Г–ї–Є–љ–∞ (–Ъ–Ь), —Б–≤—П–Ј–∞–љ–љ–Њ–≥–Њ —Б –Љ–µ–Љ–±—А–∞–љ–∞–Љ–Є –њ—А–Є –Њ–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –Ъ–Ь –≤ —Ж–Є—В–Њ–Ј–Њ–ї–µ –±–µ–Ј –Є–Ј–Љ–µ–љ–µ–љ–Є–є –µ–≥–Њ –Њ–±—Й–µ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –≤ –Ї–ї–µ—В–Ї–µ. D––≥–Њ—А–Љ–Њ–љ –±—Л—Б—В—А–Њ –Є–Ј–Љ–µ–љ—П–µ—В –≥–Њ–Љ–µ–Њ—Б—В–∞–Ј –Ї–∞–ї—М—Ж–Є—П –≤ –Ї–ї–µ—В–Ї–∞—Е —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж –Ј–∞ —Б—З–µ—В —Б–і–≤–Є–≥–∞ —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –њ–µ—А–µ–і–∞—В–Њ—З–љ–Њ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞, –Ї–Њ—В–Њ—А—Л–є —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –≤—Л—Б–≤–Њ–±–Њ–ґ–і–µ–љ–Є—О –°–∞2+ –Є–Ј –і–µ–њ–Њ –Є –≤—Е–Њ–і—Г –Є–Ј–≤–љ–µ –≤ –Ї–ї–µ—В–Ї—Г —З–µ—А–µ–Ј –њ–Њ—В–µ–љ—Ж–Є–∞–ї––Ј–∞–≤–Є—Б–Є–Љ—Л–µ L––Ї–∞–љ–∞–ї—Л –Є –і–µ–њ–Њ––Њ–њ–µ—А–Є—А—Г–µ–Љ—Л–µ –°–∞2+––Ї–∞–љ–∞–ї—Л.
–Х—Й–µ –Њ–і–љ–Є–Љ —Е–∞—А–∞–Ї—В–µ—А–љ—Л–Љ –і–ї—П D––≥–Њ—А–Љ–Њ–љ–∞ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ —Н—Д—Д–µ–Ї—В–Њ–Љ —П–≤–ї—П–µ—В—Б—П –≤–ї–Є—П–љ–Є–µ –љ–∞ –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї—Г –Ї–ї–µ—В–Њ–Ї. –Ю–љ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Ї–ї–µ—В–Њ–Ї —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж –Є —Б–≤—П–Ј–∞–љ —Б –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ –±–µ–ї–Њ–Ї Raf–1. –≠—В–Њ—В –±–µ–ї–Њ–Ї, –Њ—В–Ї—А—Л—В—Л–є –Ї–∞–Ї –њ–µ—А–≤—Л–є —З–ї–µ–љ —Б–µ–Љ–µ–є—Б—В–≤–∞ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Є—Е —Б–µ—А–Є–љ/—В—А–µ–Њ–љ–Є–љ–Њ–≤—Л—Е –Ї–Є–љ–∞–Ј, –Є–≥—А–∞–µ—В –≤–µ–і—Г—Й—Г—О —А–Њ–ї—М –≤ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–ї–∞—Б—Б–Є—З–µ—Б–Ї–Њ–≥–Њ —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Є–≥–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–∞—Б–Ї–∞–і–∞, –Ї–Њ—В–Њ—А—Л–є —Г—З–∞—Б—В–≤—Г–µ—В –≤ —А–µ–≥—Г–ї—П—Ж–Є–Є –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Є –∞–њ–Њ–њ—В–Њ–Ј–∞. –Р–Ї—В–Є–≤–∞—Ж–Є—П Raf–1, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ –∞–Ї—В–Є–≤–∞—Ж–Є–Є —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –њ—А–Њ—В–µ–Є–љ–—В–Є—А–Њ–Ј–Є–љ––Ї–Є–љ–∞–Ј—Л, –Љ–µ–і–Є–Є—А—Г–µ—В—Б—П Ras––У–Ґ–§–—Б–≤—П–Ј—Л–≤–∞—О—Й–Є–Љ–Є –±–µ–ї–Ї–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л –і–ї—П —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є Raf–1 –Ї–Є–љ–∞–Ј—Л. –Ч–∞—В–µ–Љ Raf–1 —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А—Г–µ—В –Є –∞–Ї—В–Є–≤–Є—А—Г–µ—В –Ї–Є–љ–∞–Ј—Г –Љ–Є—В–Њ–≥–µ–љ––∞–Ї—В–Є–≤–Є—А—Г–µ–Љ–Њ–є –њ—А–Њ—В–µ–Є–љ––Ї–Є–љ–∞–Ј—Л, –Є–Ј–≤–µ—Б—В–љ–Њ–є –њ–Њ–і –љ–∞–Ј–≤–∞–љ–Є–µ–Љ MEK (mitogen–activated protein kinasa (MAPK), –Ј–∞–њ—Г—Б–Ї–∞—О—Й–µ–є –Ї–∞—Б–Ї–∞–і –њ—А–Њ—В–µ–Є–љ––Ї–Є–љ–∞–Ј—Л, —З—В–Њ –≤–µ–і–µ—В –Ї —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є—О –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –≤–љ–µ–Ї–ї–µ—В–Њ—З–љ–Њ–≥–Њ —Б–Є–≥–љ–∞–ї–—А–µ–≥—Г–ї–Є—А—Г–µ–Љ–Њ–≥–Њ –±–µ–ї–Ї–∞ (–Ь–Р–†) – –Ї–Є–љ–∞–Ј—Л (–Ь–Р–†–Ъ), —Б—Г—Й–µ—Б—В–≤—Г—О—Й–µ–є –≤ 2–—Е –Є–Ј–Њ—Д–Њ—А–Љ–∞—Е: ERK1 –Є ERK2. –Т —Б–≤—П–Ј–Є —Б –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –Ь–Р–† –Ї–Є–љ–∞–Ј–∞ (–Ь–Р–†–Ъ) –њ–µ—А–µ–Љ–µ—Й–∞–µ—В—Б—П –Є–Ј —Ж–Є—В–Њ–њ–ї–∞–Ј–Љ—Л –≤ —П–і—А–Њ, –≥–і–µ –Њ–љ–∞ —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А—Г–µ—В —Д–∞–Ї—В–Њ—А—Л —В—А–∞–љ—Б–Ї—А–Є–њ—Ж–Є–Є –Є —В–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ –Ј–∞–њ—Г—Б–Ї–∞–µ—В –њ—А–Њ—Ж–µ—Б—Б—Л –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є–ї–Є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є —А–∞–Ј–љ—Л—Е —В–Є–њ–Њ–≤ –Ї–ї–µ—В–Њ–Ї. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ 1?,25(OH)2D3 –≤ –Ї–ї–µ—В–Ї–∞—Е––Љ–Є—И–µ–љ—П—Е – –Љ–Є–Њ–±–ї–∞—Б—В–∞—Е (—Н–Љ–±—А–Є–Њ–љ–∞–ї—М–љ—Л—Е –Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е —Ж—Л–њ–ї–µ–љ–Ї–∞) –≤—Л–Ј—Л–≤–∞–µ—В –∞–Ї—В–Є–≤–∞—Ж–Є—О Raf–1 —З–µ—А–µ–Ј Ras –Є —Д–Њ—Б—Д–Њ–Ї–Є–љ–∞–Ј–∞ –°–∞––Ј–∞–≤–Є—Б–Є–Љ–Њ–≥–Њ —Б–µ—А–Є–љ–Њ–≤–Њ–≥–Њ —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –Є —З—В–Њ —Г–Ї–∞–Ј–∞–љ–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ –Є–≥—А–∞–µ—В —Ж–µ–љ—В—А–∞–ї—М–љ—Г—О —А–Њ–ї—М –≤ —Б—В–Є–Љ—Г–ї—П—Ж–Є–Є –≥–Њ—А–Љ–Њ–љ–Њ–Љ –Ь–Р–†–Ъ–—Б–Є–≥–љ–∞–ї—М–љ—Л—Е –њ—Г—В–µ–є, –Ј–∞–њ—Г—Б–Ї–∞—О—Й–Є—Е –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є—О –Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, D––≥–Њ—А–Љ–Њ–љ –Є–≥—А–∞–µ—В –≤–∞–ґ–љ—Г—О —А–Њ–ї—М –Ї–∞–Ї –≤ –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–µ –Є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Ї–ї–µ—В–Њ–Ї —Б–Ї–µ–ї–µ—В–љ—Л—Е –Љ—Л—И—Ж, —В–∞–Ї –Є –≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –°–∞2+––Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤, —П–≤–ї—П—О—Й–Є—Е—Б—П –Њ–і–љ–Є–Љ–Є –Є–Ј —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –Љ—Л—И–µ—З–љ–Њ–≥–Њ —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П.
–Э–∞—А—Г—И–µ–љ–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Є –Є—Е –і–µ—Д–Є—Ж–Є—В —П–≤–ї—П—О—В—Б—П –≤–∞–ґ–љ—Л–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є –Љ–љ–Њ–≥–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є —З–µ–ї–Њ–≤–µ–Ї–∞. –Ф–µ—Д–Є—Ж–Є—В –Њ–і–љ–Њ–≥–Њ –Є–Ј –љ–Є—Е – D––≥–Њ—А–Љ–Њ–љ–∞ (—З–∞—Й–µ –Њ–±–Њ–Ј–љ–∞—З–∞–µ–Љ–Њ–≥–Њ –Ї–∞–Ї –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D) —В–∞–Ї–ґ–µ –Є–Љ–µ–µ—В –љ–µ–≥–∞—В–Є–≤–љ—Л–µ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П –Є –ї–µ–ґ–Є—В –≤ –Њ—Б–љ–Њ–≤–µ —А—П–і–∞ –≤–Є–і–Њ–≤ –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Б–Њ—Б—В–Њ—П–љ–Є–є –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Э–Є–ґ–µ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –Ї–∞–Ї —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D, —В–∞–Ї –Є –µ–≥–Њ —А–Њ–ї—М –≤ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–Є –Є —А–∞–Ј–≤–Є—В–Є–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є.
–Т —Д–Є–Ј–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е —Г—Б–ї–Њ–≤–Є—П—Е –њ–Њ—В—А–µ–±–љ–Њ—Б—В—М –≤ –≤–Є—В–∞–Љ–Є–љ–µ D –≤–∞—А–Є–Є—А—Г–µ—В –Њ—В 200 –Ь–Х (—Г –≤–Ј—А–Њ—Б–ї—Л—Е) –і–Њ 400 –Ь–Х (—Г –і–µ—В–µ–є) –≤ —Б—Г—В–Ї–Є. –°—З–Є—В–∞–µ—В—Б—П, —З—В–Њ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–µ (–≤ —В–µ—З–µ–љ–Є–µ 10–30 –Љ–Є–љ) —Б–Њ–ї–љ–µ—З–љ–Њ–µ –Њ–±–ї—Г—З–µ–љ–Є–µ –ї–Є—Ж–∞ –Є –Њ—В–Ї—А—Л—В—Л—Е —А—Г–Ї —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ –њ—А–Є–µ–Љ—Г –њ—А–Є–Љ–µ—А–љ–Њ 200 –Ь–Х –≤–Є—В–∞–Љ–Є–љ–∞ D, —В–Њ–≥–і–∞ –Ї–∞–Ї –њ–Њ–≤—В–Њ—А–љ–Њ–µ –њ—А–µ–±—Л–≤–∞–љ–Є–µ –љ–∞ —Б–Њ–ї–љ—Ж–µ –≤ –Њ–±–љ–∞–ґ–µ–љ–љ–Њ–Љ –≤–Є–і–µ —Б –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ —Г–Љ–µ—А–µ–љ–љ–Њ–є –Ї–Њ–ґ–љ–Њ–є —Н—А–Є—В–µ–Љ—Л –≤—Л–Ј—Л–≤–∞–µ—В –њ–Њ–≤—Л—И–µ–љ–Є–µ —Г—А–Њ–≤–љ—П 25–Ю–ЭD –≤—Л—И–µ –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–≥–Њ –њ—А–Є –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ–Љ –µ–≥–Њ –≤–≤–µ–і–µ–љ–Є–Є –≤ –і–Њ–Ј–µ 10000 –Ь–Х (250 –Љ–Ї–≥) –≤ —Б—Г—В–Ї–Є.
–Ф–µ—Д–Є—Ж–Є—В D––≥–Њ—А–Љ–Њ–љ–∞ —З–∞—Й–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ D––≥–Є–њ–Њ–≤–Є—В–∞–Љ–Є–љ–Њ–Ј–Њ–Љ –ї–Є–±–Њ D––≤–Є—В–∞–Љ–Є–љ–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О. –Т –Њ—В–ї–Є—З–Є–µ, –љ–∞–њ—А–Є–Љ–µ—А, –Њ—В –і—А–∞–Љ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–љ–Є–ґ–µ–љ–Є—П —Г—А–Њ–≤–љ—П —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –≤ –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–µ, —Н—В–Є–Љ —В–µ—А–Љ–Є–љ–Њ–Љ –Њ–±–Њ–Ј–љ–∞—З–∞—О—В, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤ –Њ—А–≥–∞–љ–Є–Ј–Љ–µ 25–Ю–ЭD –Є 1a,25(–Ю–Э)2 D3 –Є –љ–∞—А—Г—И–µ–љ–Є—П –µ–≥–Њ —А–µ—Ж–µ–њ—Ж–Є–Є. D––і–µ—Д–Є—Ж–Є—В –Є–≥—А–∞–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –љ–µ —В–Њ–ї—М–Ї–Њ –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –Ю–Я (–Є–љ–≤–Њ–ї—О—Ж–Є–Њ–љ–љ—Л—Е —В–Є–њ–Њ–≤ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ (–Ю–Я) – –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ–Њ–≥–Њ –Є —Б–µ–љ–Є–ї—М–љ–Њ–≥–Њ, —О–≤–µ–љ–Є–ї—М–љ–Њ–≥–Њ –Ю–Я), —В–∞–Ї –Є –≤—В–Њ—А–Є—З–љ—Л—Е —Д–Њ—А–Љ —Н—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (—Б—В–µ—А–Њ–Є–і–љ–Њ–≥–Њ –Ю–Я –Є –і—А.), –∞ —В–∞–Ї–ґ–µ –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е –≤–Є–і–Њ–≤ —Б–Ї–µ–ї–µ—В–љ–Њ–є –Є –≤–љ–µ—Б–Ї–µ–ї–µ—В–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є.
–†–∞–Ј–ї–Є—З–∞—О—В –і–≤–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е —В–Є–њ–∞ –і–µ—Д–Є—Ж–Є—В–∞ D––≥–Њ—А–Љ–Њ–љ–∞, –Є–љ–Њ–≥–і–∞ –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–≥–Њ —В–∞–Ї–ґ–µ «—Б–Є–љ–і—А–Њ–Љ–Њ–Љ D––љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є». –Я–µ—А–≤—Л–є –Є–Ј –љ–Є—Е –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М—О –≤–Є—В–∞–Љ–Є–љ–∞ D3 – –њ—А–Є—А–Њ–і–љ–Њ–є –њ—А–Њ–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —Д–Њ—А–Љ—Л, –Є–Ј –Ї–Њ—В–Њ—А–Њ–є –Њ–±—А–∞–Ј—Г–µ—В—Б—П –∞–Ї—В–Є–≤–љ—Л–є(–µ) –Љ–µ—В–∞–±–Њ–ї–Є—В(—Л) (1a,25(–Ю–Э)2 D3). –≠—В–Њ—В —В–Є–њ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D —Б–≤—П–Ј—Л–≤–∞—О—В —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ–Є –њ—А–µ–±—Л–≤–∞–љ–Є–µ–Љ –љ–∞ —Б–Њ–ї–љ—Ж–µ –Є –µ–≥–Њ –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ–Љ —Б –њ–Є—Й–µ–є, –∞ —В–∞–Ї–ґ–µ –њ–Њ—Б—В–Њ—П–љ–љ—Л–Љ –љ–Њ—И–µ–љ–Є–µ–Љ –Ј–∞–Ї—А—Л–≤–∞—О—Й–µ–є —В–µ–ї–Њ –Њ–і–µ–ґ–і—Л, —З—В–Њ —Б–љ–Є–ґ–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Є—А–Њ–і–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ –≤ –Ї–Њ–ґ–µ –Є –≤–µ–і–µ—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Г—А–Њ–≤–љ—П 25–Ю–ЭD –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є. –Я–Њ–і–Њ–±–љ–∞—П —Б–Є—В—Г–∞—Ж–Є—П —А–∞–љ–µ–µ –љ–∞–±–ї—О–і–∞–ї–∞—Б—М –≥–ї–∞–≤–љ—Л–Љ –Њ–±—А–∞–Ј–Њ–Љ —Г –і–µ—В–µ–є –Є –њ–Њ —Б—Г—В–Є —П–≤–ї—П–ї–∞—Б—М —Б–Є–љ–Њ–љ–Є–Љ–Њ–Љ —А–∞—Е–Є—В–∞. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –≤ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –Є–љ–і—Г—Б—В—А–Є–∞–ї—М–љ—Л—Е —Б—В—А–∞–љ –Љ–Є—А–∞ –≤ —Б–≤—П–Ј–Є —Б –Є—Б–Ї—Г—Б—Б—В–≤–µ–љ–љ—Л–Љ –Њ–±–Њ–≥–∞—Й–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—В–Њ–≤ –і–µ—В—Б–Ї–Њ–≥–Њ –њ–Є—В–∞–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –і–µ—Д–Є—Ж–Є—В/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–і–љ–µ–≥–Њ –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ —А–µ–і–Ї–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Г –і–µ—В–µ–є. –Ю–і–љ–∞–Ї–Њ –Є–Ј––Ј–∞ –Є–Ј–Љ–µ–љ–Є–≤—И–µ–є—Б—П –≤–Њ –≤—В–Њ—А–Њ–є –њ–Њ–ї–Њ–≤–Є–љ–µ –•–• –≤–µ–Ї–∞ –і–µ–Љ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–Є –њ–Њ–і–Њ–±–љ—Л–є –і–µ—Д–Є—Ж–Є—В –љ–µ—А–µ–і–Ї–Њ –Є–Љ–µ–µ—В –Љ–µ—Б—В–Њ —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, –Њ—Б–Њ–±–µ–љ–љ–Њ –њ—А–Њ–ґ–Є–≤–∞—О—Й–Є—Е –≤ —Б—В—А–∞–љ–∞—Е –Є –љ–∞ —В–µ—А—А–Є—В–Њ—А–Є—П—Е —Б –љ–Є–Ј–Ї–Њ–є –µ—Б—В–µ—Б—В–≤–µ–љ–љ–Њ–є –Є–љ—Б–Њ–ї—П—Ж–Є–µ–є, –Є–Љ–µ—О—Й–Є—Е –љ–µ–њ–Њ–ї–љ–Њ—Ж–µ–љ–љ—Л–є –Є–ї–Є –љ–µ—Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ—Л–є –њ–Є—Й–µ–≤–Њ–є —А–∞—Ж–Є–Њ–љ –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Г—О –і–≤–Є–≥–∞—В–µ–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М. –Я–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —Г –ї—О–і–µ–є –≤ –≤–Њ–Ј—А–∞—Б—В–µ 65 –ї–µ—В –Є —Б—В–∞—А—И–µ –љ–∞–±–ї—О–і–∞–µ—В—Б—П 4––Ї—А–∞—В–љ–Њ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Њ–±—А–∞–Ј–Њ–≤—Л–≤–∞—В—М –≤–Є—В–∞–Љ–Є–љ D –≤ –Ї–Њ–ґ–µ. –Т —Б–≤—П–Ј–Є —Б —В–µ–Љ, —З—В–Њ 25–Ю–ЭD —П–≤–ї—П–µ—В—Б—П —Б—Г–±—Б—В—А–∞—В–Њ–Љ –і–ї—П —Д–µ—А–Љ–µ–љ—В–∞ 1a––≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л, –∞ —Б–Ї–Њ—А–Њ—Б—В—М –µ–≥–Њ –њ—А–µ–≤—А–∞—Й–µ–љ–Є—П –≤ –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В –њ—А–Њ–њ–Њ—А—Ж–Є–Њ–љ–∞–ї—М–љ–∞ —Г—А–Њ–≤–љ—О —Б—Г–±—Б—В—А–∞—В–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, —Б–љ–Є–ґ–µ–љ–Є–µ —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –љ–Є–ґ–µ 30 –љ–≥/–Љ–ї –љ–∞—А—Г—И–∞–µ—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –∞–і–µ–Ї–≤–∞—В–љ—Л—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤ 1a,25(–Ю–Э)2 D3 [Ooms et al., 1995]. –Ш–Љ–µ–љ–љ–Њ —В–∞–Ї–Њ–є —Г—А–Њ–≤–µ–љ—М —Б–љ–Є–ґ–µ–љ–Є—П 25–Ю–ЭD –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Г 36% –Љ—Г–ґ—З–Є–љ –Є 47% –ґ–µ–љ—Й–Є–љ –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (Euronut Seneca Program), –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤ 11 —Б—В—А–∞–љ–∞—Е –Ч–∞–њ–∞–і–љ–Њ–є –Х–≤—А–Њ–њ—Л. –Ш —Е–Њ—В—П –љ–Є–ґ–љ–Є–є –њ—А–µ–і–µ–ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є 25–Ю–ЭD –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є, –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–є –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П 1a,25(–Ю–Э)2 D3 –љ–µ –Є–Ј–≤–µ—Б—В–µ–љ, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –µ–≥–Њ –њ–Њ—А–Њ–≥–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П—О—В –Њ—В 12 –і–Њ 15 –љ–≥/–Љ–ї (30–35 –љ–Љ–Њ–ї/–ї).
–Ф–µ—Д–Є—Ж–Є—В 25–Ю–ЭD —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—О—В –≤ —В–µ—Б–љ–Њ–є —Б–≤—П–Ј–Є —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–є –њ–Њ—З–µ–Ї –Є –≤–Њ–Ј—А–∞—Б—В–Њ–Љ, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –ї–µ—В, –њ—А–Њ–ґ–Є—В—Л—Е –њ–Њ—Б–ї–µ –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П –Љ–µ–љ–Њ–њ–∞—Г–Ј—Л. –Я—А–Є —Н—В–Њ–Љ –Њ—В–Љ–µ—З–µ–љ—Л –Ї–∞–Ї –≥–µ–Њ–≥—А–∞—Д–Є—З–µ—Б–Ї–Є–µ –Є –≤–Њ–Ј—А–∞—Б—В–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –≤ —Г—А–Њ–≤–љ–µ —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П, —В–∞–Ї –Є –µ–≥–Њ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В—М –Њ—В –≤—А–µ–Љ–µ–љ–Є –≥–Њ–і–∞, —В.–µ. –Њ—В —Г—А–Њ–≤–љ—П —Б–Њ–ї–љ–µ—З–љ–Њ–є –Є–љ—Б–Њ–ї—П—Ж–Є–Є/–Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ —Б–Њ–ї–љ–µ—З–љ—Л—Е –і–љ–µ–є, —З—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–љ–Є–Љ–∞—В—М –≤–Њ –≤–љ–Є–Љ–∞–љ–Є–µ –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г—О—Й–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є –∞–љ–∞–ї–Є–Ј–µ –њ–Њ–ї—Г—З–∞–µ–Љ—Л—Е –і–∞–љ–љ—Л—Е.
–Ф–µ—Д–Є—Ж–Є—В 25–Ю–ЭD –≤—Л—П–≤–ї–µ–љ —В–∞–Ї–ґ–µ –Є –њ—А–Є —Б–Є–љ–і—А–Њ–Љ–µ –Љ–∞–ї—М–∞–±—Б–Њ—А–±—Ж–Є–Є, –±–Њ–ї–µ–Ј–љ–Є –Ъ—А–Њ–љ–∞, —Б–Њ—Б—В–Њ—П–љ–Є—П—Е –њ–Њ—Б–ї–µ —Б—Г–±—В–Њ—В–∞–ї—М–љ–Њ–є –≥–∞—Б—В—А—Н–Ї—В–Њ–Љ–Є–Є –Є–ї–Є –Њ–±—Е–Њ–і–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є—П—Е –љ–∞ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Б–µ–Ї—А–µ—Ж–Є–Є –њ–∞–љ–Ї—А–µ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Б–Њ–Ї–∞, —Ж–Є—А—А–Њ–Ј–µ –њ–µ—З–µ–љ–Є, –≤—А–Њ–ґ–і–µ–љ–љ–Њ–є –∞—В—А–µ–Ј–Є–Є –ґ–µ–ї—З–љ–Њ–≥–Њ –њ—А–Њ—В–Њ–Ї–∞, –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –њ—А–Њ—В–Є–≤–Њ—Б—Г–і–Њ—А–Њ–ґ–љ—Л—Е (–∞–љ—В–Є—Н–њ–Є–ї–µ–њ—В–Є—З–µ—Б–Ї–Є—Е) —Б—А–µ–і—Б—В–≤, –љ–µ—Д—А–Њ–Ј–∞—Е.
–Ф—А—Г–≥–Њ–є —В–Є–њ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ –≤—Б–µ–≥–і–∞ –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є–Є D––≥–Њ—А–Љ–Њ–љ–∞ –≤ –њ–Њ—З–Ї–∞—Е (–њ—А–Є —Н—В–Њ–Љ —В–Є–њ–µ –і–µ—Д–Є—Ж–Є—В–∞ –Љ–Њ–ґ–µ—В –љ–∞–±–ї—О–і–∞—В—М—Б—П –Ї–∞–Ї –љ–Њ—А–Љ–∞–ї—М–љ—Л–є, —В–∞–Ї –Є –і–∞–ґ–µ —Б–ї–µ–≥–Ї–∞ –њ–Њ–≤—Л—И–µ–љ–љ—Л–є —Г—А–Њ–≤–µ–љ—М —Б–∞–Љ–Њ–≥–Њ D––≥–Њ—А–Љ–Њ–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є), –љ–Њ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –µ–≥–Њ —А–µ—Ж–µ–њ—Ж–Є–Є –≤ —В–Ї–∞–љ—П—Е (—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В—М –Ї –≥–Њ—А–Љ–Њ–љ—Г), —З—В–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї —Д—Г–љ–Ї—Ж–Є—П –≤–Њ–Ј—А–∞—Б—В–∞. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Б–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П 1a,25(–Ю–Э)2 D3 –≤ –њ–ї–∞–Ј–Љ–µ –њ—А–Є —Б—В–∞—А–µ–љ–Є–Є, –Њ—Б–Њ–±–µ–љ–љ–Њ –≤ –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ–µ —Б—В–∞—А—И–µ 65 –ї–µ—В, –Њ—В–Љ–µ—З–∞–µ—В—Б—П –Љ–љ–Њ–≥–Є–Љ–Є –∞–≤—В–Њ—А–∞–Љ–Є. –°–љ–Є–ґ–µ–љ–Є–µ –њ–Њ—З–µ—З–љ–Њ–є –њ—А–Њ–і—Г–Ї—Ж–Є–Є 1a,25(–Ю–Э)2 D3 –љ–µ—А–µ–і–Ї–Њ –љ–∞–±–ї—О–і–∞–µ—В—Б—П –њ—А–Є –Ю–Я, –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П—Е –њ–Њ—З–µ–Ї (–њ–Њ—З–µ—З–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –Є –і—А.), —Г –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ (>65 –ї–µ—В), –њ—А–Є –і–µ—Д–Є—Ж–Є—В–µ –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤, –≥–Є–њ–Њ—Д–Њ—Б—Д–∞—В–µ–Љ–Є—З–µ—Б–Ї–Њ–є –Њ—Б—В–µ–Њ–Љ–∞–ї—П—Ж–Є–Є –Њ–њ—Г—Е–Њ–ї–µ–≤–Њ–≥–Њ –≥–µ–љ–µ–Ј–∞, –Я–Ґ–У––і–µ—Д–Є—Ж–Є—В–љ–Њ–Љ –≥–Є–њ–Њ–њ–∞—А–∞—В–Є—А–µ–Њ–Ј–µ, –Я–Ґ–У–—А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ–Љ –≥–Є–њ–Њ–њ–∞—А–∞—В–Є—А–µ–Њ–Ј–µ, —Б–∞—Е–∞—А–љ–Њ–Љ –і–Є–∞–±–µ—В–µ, –њ–Њ–і –≤–ї–Є—П–љ–Є–µ–Љ –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і–Њ–≤ –Є –і—А. –†–∞–Ј–≤–Є—В–Є–µ —А–µ–Ј–Є—Б—В–µ–љ—В–љ–Њ—Б—В–Є –Ї 1a,25(–Ю–Э)2 D3 –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–Њ, –Ї–∞–Ї –њ–Њ–ї–∞–≥–∞—О—В, —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –†–ТD –≤ —В–Ї–∞–љ—П—Е––Љ–Є—И–µ–љ—П—Е (–њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є –њ–Њ—З–Ї–∞—Е). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —Н–Ї—Б–њ—А–µ—Б—Б–Є–Є –†–ТD –≤ –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л—Е –Љ—Л—И—Ж–∞—Е —Г –њ–Њ–ґ–Є–ї—Л—Е [Bischoff–Ferrari et al., 2004]. –Ю–±–∞ –≤–∞—А–Є–∞–љ—В–∞ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D —П–≤–ї—П—О—В—Б—П —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ–Є –Ј–≤–µ–љ—М—П–Љ–Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Њ—Б–љ–Њ–≤–љ—Л—Е —В–Є–њ–Њ–≤ –Є —Д–Њ—А–Љ –Ю–Я.
–Э–∞–Є–±–Њ–ї–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Г—О —А–Њ–ї—М –љ–∞—А—Г—И–µ–љ–Є—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –Є —А–µ—Ж–µ–њ—Ж–Є–Є D––≥–Њ—А–Љ–Њ–љ–∞ –Є–≥—А–∞—О—В –њ—А–Є –Њ—Б–љ–Њ–≤–љ–Њ–є –Є–љ–≤–Њ–ї—О—Ж–Є–Њ–љ–љ–Њ–є —Д–Њ—А–Љ–µ –Ю–Я – —Б–µ–љ–Є–ї—М–љ–Њ–Љ –Ю–Я. –Ф–∞–љ–љ—Л–є —В–Є–њ –Ю–Я —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–Њ–Є—Е –њ–Њ–ї–Њ–≤ —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В—Б—П —А–∞–Ј–Њ–±—Й–µ–љ–Є–µ–Љ –Є—Б—Е–Њ–і–љ–Њ —В–µ—Б–љ–Њ —Б–≤—П–Ј–∞–љ–љ—Л—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П (—Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –љ–Њ–≤–Њ–є –Ї–Њ—Б—В–Є –љ–∞ —Д–Њ–љ–µ –њ–Њ–≤—Л—И–µ–љ–Є—П –µ–µ —А–µ–Ј–Њ—А–±—Ж–Є–Є). –°—А–µ–і–Є –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ —Г–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П, –љ–∞—А—П–і—Г —Б–Њ —Б–љ–Є–ґ–µ–љ–Є–µ–Љ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –њ–Њ–ї–Њ–≤—Л—Е –≥–Њ—А–Љ–Њ–љ–Њ–≤ (—Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –Є —В–µ—Б—В–Њ—Б—В–µ—А–Њ–љ–∞), —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ–Њ–є —Б–Њ–Љ–∞—В–Њ–њ–∞—Г–Ј—Л (–і–µ—Д–Є—Ж–Є—В–∞ –≤—Л—А–∞–±–Њ—В–Ї–Є –≥–Њ—А–Љ–Њ–љ–∞ —А–Њ—Б—В–∞ –Є –Є–љ—Б—Г–ї–Є–љ–Њ–њ–Њ–і–Њ–±–љ–Њ–≥–Њ —Д–∞–Ї—В–Њ—А–∞ —А–Њ—Б—В–∞, –Ш–Я–§–†), –≤–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ—О—В –њ–µ—А–≤–Є—З–љ—Л–є –Є –≤—В–Њ—А–Є—З–љ—Л–є –і–µ—Д–Є—Ж–Є—В—Л D––≥–Њ—А–Љ–Њ–љ–∞, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ —А—П–і–Њ–Љ –њ—А–Є—З–Є–љ. –°—А–µ–і–Є –љ–Є—Е —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –ї–Є—Ж –њ–Њ–ґ–Є–ї–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞ –Є –Є—Е –њ—А–µ–±—Л–≤–∞–љ–Є—П –љ–∞ —Б–Њ–ї–љ—Ж–µ, —Б–љ–Є–ґ–µ–љ–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П D––≥–Њ—А–Љ–Њ–љ–∞ –≤ –њ–Њ—З–Ї–∞—Е –Є –Ї–Њ—Б—В—П—Е –Є–Ј––Ј–∞ —Б–љ–Є–ґ–µ–љ–Є—П –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є 1a––≥–Є–і—А–Њ–Ї—Б–Є–ї–∞–Ј—Л (–≤ –≤–Њ–Ј—А–∞—Б—В–µ 70 –ї–µ—В —Н—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –і–Њ—Б—В–Є–≥–∞–µ—В 50%), —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤ –Њ—А–≥–∞–љ–∞—Е––Љ–Є—И–µ–љ—П—Е –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –†–ТD –Є –Є—Е —Б—А–Њ–і—Б—В–≤–∞ –Ї –ї–Є–≥–∞–љ–і—Г. –£–Ї–∞–Ј–∞–љ–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤–µ–і—Г—В –Ї —Б–љ–Є–ґ–µ–љ–Є—О –∞–±—Б–Њ—А–±—Ж–Є–Є –°–∞2+ –≤ –Ї–Є—И–µ—З–љ–Є–Ї–µ –Є –њ–Њ–≤—Л—И–µ–љ–Є—О –µ–≥–Њ –≤—Л–Љ—Л–≤–∞–љ–Є—П –Є–Ј –Ї–Њ—Б—В–µ–є –і–ї—П –њ–Њ–і–і–µ—А–ґ–∞–љ–Є—П —Б—В–∞–±–Є–ї—М–љ–Њ—Б—В–Є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є, —З—В–Њ —А–µ–∞–ї–Є–Ј—Г–µ—В—Б—П –Ј–∞ —Б—З–µ—В —А–∞–Ј–≤–Є—В–Є—П –≤—В–Њ—А–Є—З–љ–Њ–≥–Њ –≥–Є–њ–µ—А–њ–∞—А–∞—В–Є—А–µ–Њ–Ј–∞, —Г—Б–Є–ї–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ –Я–Ґ–У –Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ–Њ–є —Н—В–Є–Љ –∞–Ї—В–Є–≤–∞—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–∞ —А–µ–Ј–Њ—А–±—Ж–Є–Є –Є –Ю–Я. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –і–µ—Д–Є—Ж–Є—В D––≥–Њ—А–Љ–Њ–љ–∞ –≤–µ–і–µ—В –Ї –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—О —Б–Є–љ—В–µ–Ј–∞ –±–µ–ї–Ї–Њ–≤ –Љ–∞—В—А–Є–Ї—Б–∞ –Ї–Њ—Б—В–Є –Є–Ј––Ј–∞ —Б–љ–Є–ґ–µ–љ–Є—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П, –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–Ї–Є –Є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Њ—Б—В–µ–Њ–±–ї–∞—Б—В–Њ–≤, —Б–Є–љ—В–µ–Ј–∞ —Н—В–Є–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є —Ж–Є—В–Њ–Ї–Є–љ–Њ–≤, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ —Б–Њ–њ—А—П–ґ–µ–љ–Є–Є –Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ —А–µ–Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є—П, —З—В–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –љ–µ–±–ї–∞–≥–Њ–њ—А–Є—П—В–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Љ–∞—Б—Б—Г –Є –Ї–∞—З–µ—Б—В–≤–Њ –Ї–Њ—Б—В–Є. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М –Є —В–Њ, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є D––≥–Њ—А–Љ–Њ–љ–∞ –≤–µ–і–µ—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–≤–љ–Є—П –љ–µ—А–≤–љ–Њ––Љ—Л—И–µ—З–љ–Њ–≥–Њ –∞–њ–њ–∞—А–∞—В–∞, —В.–Ї. –њ—А–Њ–≤–µ–і–µ–љ–Є–µ –љ–µ—А–≤–љ—Л—Е –Є–Љ–њ—Г–ї—М—Б–Њ–≤ —Б –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е –љ–µ—А–≤–Њ–≤ –љ–∞ –њ–Њ–њ–µ—А–µ—З–љ–Њ––њ–Њ–ї–Њ—Б–∞—В—Г—О –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Г –Є —Б–Њ–Ї—А–∞—В–Є–Љ–Њ—Б—В—М –њ–Њ—Б–ї–µ–і–љ–Є–є —П–≤–ї—П—О—В—Б—П –°–∞––Ј–∞–≤–Є—Б–Є–Љ—Л–Љ–Є –њ—А–Њ—Ж–µ—Б—Б–∞–Љ–Є. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є –і–µ—Д–Є—Ж–Є—В/–љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –≤–Є—В–∞–Љ–Є–љ–∞ D –≤–љ–Њ—Б–Є—В —Б–≤–Њ–є –≤–Ї–ї–∞–і –≤ –љ–∞—А—Г—И–µ–љ–Є—П –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞—А—Г—И–µ–љ–Є—П –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є–Є –і–≤–Є–ґ–µ–љ–Є–є –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –њ–∞–і–µ–љ–Є–є, —Б –Ї–Њ—В–Њ—А—Л–Љ–Є —Б–≤—П–Ј–∞–љ–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б–ї—Г—З–∞–µ–≤ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –њ—А–Є —Б–µ–љ–Є–ї—М–љ–Њ–Љ –Ю–Я.
–Я—А–Њ–±–ї–µ–Љ–∞ –њ–∞–і–µ–љ–Є–є
–Є –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D
–Я–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ –Њ–і–љ–Њ–є –Є–Ј –≤–∞–ґ–љ—Л—Е –Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л—Е –њ—А–Є—З–Є–љ —Б–∞—А–Ї–Њ–њ–µ–љ–Є–Є –≤ –≥–µ—А–Є–∞—В—А–Є—З–µ—Б–Ї–Њ–є –њ–Њ–њ—Г–ї—П—Ж–Є–Є —П–≤–ї—П–µ—В—Б—П –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–є—Б—П –Љ—Л—И–µ—З–љ–Њ–є —Б–ї–∞–±–Њ—Б—В—М—О. –†–∞–Ј–≤–Є—В–Є–µ –і–µ—Д–Є—Ж–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —Б–≤—П–Ј–∞–љ–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Б–Њ —Б–ї–µ–і—Г—О—Й–Є–Љ–Є –њ—А–Є—З–Є–љ–∞–Љ–Є:
– –љ–µ—Б–±–∞–ї–∞–љ—Б–Є—А–Њ–≤–∞–љ–љ–Њ–µ –њ–Є—В–∞–љ–Є–µ –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –≤ –њ–Є—Й–µ–≤—Л—Е –њ—А–Њ–і—Г–Ї—В–Њ–≤ —Б –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ —Б–Њ–і–µ—А–ґ–∞–љ–Є–µ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D,
– —А–µ–і–Ї–Њ–µ –Є –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–µ –њ—А–µ–±—Л–≤–∞–љ–Є–µ –љ–∞ —Б–Њ–ї–љ—Ж–µ,
– —Г—В–Њ–љ—М—И–µ–љ–Є–µ –Ї–Њ–ґ–Є (—Б–љ–Є–ґ–µ–љ–Є–µ —В–Њ–ї—Й–Є–љ—Л –і–µ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —Б–ї–Њ—П – –Љ–µ—Б—В–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –≤–Є—В–∞–Љ–Є–љ–∞ D),
– –љ–∞—А—Г—И–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –≥–Є–і—А–Њ–Ї—Б–Є–ї–Є—А–Њ–≤–∞–љ–Є—П –њ—А–µ–≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ—Л—Е —Д–Њ—А–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D –≤ –њ–µ—З–µ–љ–Є –Є –њ–Њ—З–Ї–∞—Е,
– –љ–∞—А—Г—И–µ–љ–Є–µ —А–µ—Ж–µ–њ—Ж–Є–Є 1,25(–Ю–Э)2D3 –≤ —В–Ї–∞–љ—П—Е.
–Ю —И–Є—А–Њ–Ї–Њ–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–Є D––і–µ—Д–Є—Ж–Є—В–∞ —Г –њ–Њ–ґ–Є–ї—Л—Е —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В, –≤ —З–∞—Б—В–љ–Њ—Б—В–Є, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є 824 –ї–Є—Ж –≤ –≤–Њ–Ј—А–∞—Б—В–µ 70 –ї–µ—В –Є —Б—В–∞—А—И–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–≥–Њ –≤ 11 —Б—В—А–∞–љ–∞—Е –Ч–∞–њ–∞–і–љ–Њ–є –Х–≤—А–Њ–њ—Л: —Г 36% –Љ—Г–ґ—З–Є–љ –Є —Г 47% –ґ–µ–љ—Й–Є–љ –≤ –Ј–Є–Љ–љ–µ–µ –≤—А–µ–Љ—П –≥–Њ–і–∞ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П 25(–Ю–Э)D3 –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є —Б–Њ—Б—В–∞–≤–ї—П–ї–∞ <30 –љ–Љ–Њ–ї/–ї. –Т–∞–ґ–љ–Њ –Њ—В–Љ–µ—В–Є—В—М –Є —В–Њ, —З—В–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –Ї –≤–Є—В–∞–Љ–Є–љ—Г D (–†–ТD) –≤ —П–і—А–∞—Е –Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —А–µ–Ј–Ї–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Є –Є–Љ–Љ—Г–љ–Њ–≥–Є—Б—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±–Є–Њ–њ—Б–Є–є–љ—Л—Е –Њ–±—А–∞–Ј—Ж–Њ–≤ m. gluteus medius, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Њ—В –ґ–µ–љ—Й–Є–љ (n=20, —Б—А. –≤–Њ–Ј—А–∞—Б—В 71,6 –≥–Њ–і–∞) –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є —Е–Є—А—Г—А–≥–Є—З–µ—Б–Ї–Є—Е –Њ–њ–µ—А–∞—Ж–Є–є —В–Њ—В–∞–ї—М–љ–Њ–є –∞—А—В—А–Њ–њ–ї–∞—Б—В–Є–Ї–Є —И–µ–є–Ї–Є –±–µ–і—А–µ–љ–љ–Њ–є –Ї–Њ—Б—В–Є, –Є –±–Є–Њ–њ—В–∞—В–Њ–≤ m. transversospinalis –Њ—В 12 –ґ–µ–љ—Й–Є–љ (—Б—А. –≤–Њ–Ј—А–∞—Б—В 55,2 –ї–µ—В) –њ—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ –њ–Њ–Ј–≤–Њ–љ–Њ—З–љ–Є–Ї–µ –±—Л–ї–Њ –≤—Л—П–≤–ї–µ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–µ –≤ –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —Б–љ–Є–ґ–µ–љ–Є–µ —З–Є—Б–ї–∞ –†–ТD –≤ –Њ–±–µ–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –Љ—Л—И—Ж–∞—Е (r=0,5, p=0,004, —А–Є—Б. 2). –Я—А–Є —Н—В–Њ–Љ –љ–µ –±—Л–ї–Њ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ —Б–Є–ї—М–љ–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Н–Ї—Б–њ—А–µ—Б—Б–Є–µ–є –†–ТD –Є —Г—А–Њ–≤–љ—П–Љ–Є 25–Ю–ЭD –Є 1,25(–Ю–Э)2D3 –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –Љ—Г–ї—М—В–Є–≤–∞—А–Є–∞–љ—В–љ—Л–є –∞–љ–∞–ї–Є–Ј —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ј–≤–Њ–ї–Є–ї –∞–≤—В–Њ—А–∞–Љ —Б–і–µ–ї–∞—В—М –≤—Л–≤–Њ–і –Њ —В–Њ–Љ, —З—В–Њ –њ–Њ–ґ–Є–ї–Њ–є –≤–Њ–Ј—А–∞—Б—В —П–≤–ї—П–µ—В—Б—П –≤–∞–ґ–љ—Л–Љ –њ—А–µ–і—Б–Ї–∞–Ј–∞—В–µ–ї—М–љ—Л–Љ —Д–∞–Ї—В–Њ—А–Њ–Љ –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–Є—Б–ї–∞ –†–ТD –Є —Г—А–Њ–≤–љ–µ–Љ 25(–Ю–Э)D3.
–Э–µ—Б–Њ–Љ–љ–µ–љ–љ—Л–є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є–є –Є–љ—В–µ—А–µ—Б –њ—А–µ–і—Б—В–∞–≤–ї—П—О—В –і–∞–љ–љ—Л–µ –Њ –≤—Л—Б–Њ–Ї–Њ–є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–Њ–є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г —Г—А–Њ–≤–љ–µ–Љ D––≥–Њ—А–Љ–Њ–љ–∞ –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –Є –Ї–ї–Є—А–µ–љ—Б–Њ–Љ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞. –Ь—Л—И–µ—З–љ–∞—П —Б–ї–∞–±–Њ—Б—В—М, —Б–≤—П–Ј–∞–љ–љ–∞—П —Б –і–µ—Д–Є—Ж–Є—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D, –Њ–±—Л—З–љ–Њ –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –≤ –≥—А—Г–њ–њ–∞—Е –њ—А–Њ–Ї—Б–Є–Љ–∞–ї—М–љ—Л—Е –Љ—Л—И—Ж –Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —З—Г–≤—Б—В–≤–Њ–Љ —В—П–ґ–µ—Б—В–Є –Є–ї–Є –±–Њ–ї—П–Љ–Є –≤ –љ–Њ–≥–∞—Е, –±—Л—Б—В—А–Њ–є —Г—В–Њ–Љ–ї—П–µ–Љ–Њ—Б—В—М—О, –Ј–∞—В—А—Г–і–љ–µ–љ–Є—П–Љ–Є –њ—А–Є –њ–Њ–і—К–µ–Љ–µ –њ–Њ –ї–µ—Б—В–љ–Є—Ж–µ –Є –≤—Б—В–∞–≤–∞–љ–Є–Є —Б–Њ —Б—В—Г–ї–∞. –Я—А–Є —Н—В–Њ–Љ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Ј–∞—В—А–∞–≥–Є–≤–∞—О—В –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ –≥—А—Г–њ–њ—Л –Љ—Л—И—Ж –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л—Е –Ј–∞ –≤–µ—А—В–Є–Ї–∞–ї—М–љ–Њ–µ –њ–Њ–ї–Њ–ґ–µ–љ–Є–µ —В–µ–ї–∞ –Є —Е–Њ–і—М–±—Г. –£–Ї–∞–Ј–∞–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П, –і–Њ—Б—В–Є–≥–∞—О—Й–Є–µ —Г—А–Њ–≤–љ—П –Њ—В—З–µ—В–ї–Є–≤–Њ–є –Љ–Є–Њ–њ–∞—В–Є–Є, –Љ–Њ–≥—Г—В —З–∞—Б—В–Є—З–љ–Њ —Г—Б—В—А–∞–љ—П—В—М—Б—П –њ—А–Є –љ–Њ—А–Љ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ–Є—В–∞–љ–Є—П, –њ—А–µ–±—Л–≤–∞–љ–Є–Є –љ–∞ —Б–Њ–ї–љ—Ж–µ –Є –њ—А–Є–µ–Љ–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D [Graafmans et al., 1996, Mowe et al., 1999; Glerup et al., 2000; Pfeifer et al., 2002; Janssen et al., 2002].
–Э–∞—А—П–і—Г —Б –≥–µ–љ–Њ–Љ–љ—Л–Љ–Є –Є –љ–µ–≥–µ–љ–Њ–Љ–љ—Л–Љ–Є –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞–Љ–Є, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–Љ–Є –њ–Њ—Б—В—Г–њ–ї–µ–љ–Є–µ –Є–Њ–љ–Њ–≤ –°–∞2+ –≤ —Б–Ї–µ–ї–µ—В–љ—Г—О –Љ—Л—И—Ж—Г –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–µ –і–ї—П —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –µ–µ —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є, –Ј–∞–≤–Є—Б–Є–Љ—Л–µ –Њ—В –≥–µ–љ–Њ—В–Є–њ–∞ –†–ТD –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –≤–љ–Њ—Б—П—В –Ј–∞–Љ–µ—В–љ—Л–є –≤–Ї–ї–∞–і –≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є—О —Н—Д—Д–µ–Ї—В–Њ–≤ 1,25(–Ю–Э)2D3. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –њ—А–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ–Њ–ґ–Є–ї—Л—Е –ґ–µ–љ—Й–Є–љ––±–ї–Є–Ј–љ–µ—Ж–Њ–≤ 2 –≥–Њ–Љ–Њ–Ј–Є–≥–Њ—В–љ—Л—Е —В–Є–њ–Њ–≤ –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —А–∞–Ј–ї–Є—З–Є—П –љ–∞ 23% –≤ —Б–Є–ї–µ —З–µ—В—Л—А–µ—Е–≥–ї–∞–≤–Њ–є –Љ—Л—И—Ж—Л –Є –љ–∞ 7% —Б–Є–ї—Л —Б–ґ–∞—В–Є—П –Ї–Є—Б—В–µ–є —А—Г–Ї. –Ш–Љ–µ—О—В—Б—П –Є –і—А—Г–≥–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —Г–Ї–∞–Ј—Л–≤–∞—О—Й–Є–µ –љ–∞ —Б–≤—П–Ј—М –Љ–µ–ґ–і—Г –њ–Њ–ї–Є–Љ–Њ—А—Д–Є–Ј–Љ–Њ–Љ –†–ТD –Є —Б–Њ—Б—В–Њ—П–љ–Є–µ–Љ –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л.
–°–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –њ—А–Є –і–µ—Д–Є—Ж–Є—В–µ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–∞–±–ї—О–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ —Б–Є–ї—Л –Љ—Л—И—Ж, —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є –Ї —А–∞–Ј–≥–Є–±–∞–љ–Є—О –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є –≤ –Ї–Њ–ї–µ–љ–љ–Њ–Љ —Б—Г—Б—В–∞–≤–µ, –њ—А–Њ—Е–Њ–і–Є–Љ–Њ–≥–Њ —А–∞—Б—Б—В–Њ—П–љ–Є—П –Є —Б–Ї–Њ—А–Њ—Б—В–Є —Е–Њ–і—М–±—Л.
–Э–µ—Б–Љ–Њ—В—А—П –љ–∞ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–µ, –≤—Л–њ–Њ–ї–љ–µ–љ–љ—Л–µ —Б —А–∞–Ј–љ–Њ–є –≥–ї—Г–±–Є–љ–Њ–є –Є –њ—А–Є —Г—З–∞—Б—В–Є–Є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —А–∞–Ј–ї–Є—З–∞—О—Й–Є—Е—Б—П –њ–Њ —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –≥—А—Г–њ–њ –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є, –Њ–Ї–Њ–љ—З–∞—В–µ–ї—М–љ–Њ–є —П—Б–љ–Њ—Б—В–Є –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Љ–µ–і–Є–Ї–∞–Љ–µ–љ—В–Њ–Ј–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –Љ—Л—И–µ—З–љ—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л—Е –і–µ—Д–Є—Ж–Є—В–Њ–Љ –≤–Є—В–∞–Љ–Є–љ–∞ D, –њ–Њ–Ї–∞ –љ–µ –Є–Љ–µ–µ—В—Б—П. –Т –Њ–і–љ–Є—Е —Б–ї—Г—З–∞—П—Е –њ–Њ–ї—Г—З–µ–љ—Л –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D, –њ—А–Њ—П–≤–ї—П—О—Й–Є–µ—Б—П –≤ —Г–Љ–µ–љ—М—И–µ–љ–Є–Є —Б–ї—Г—З–∞–µ–≤ –њ–∞–і–µ–љ–Є–є –Є —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б —Н—В–Є–Љ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Ш–Љ–µ—О—В—Б—П –Є –љ–∞–±–ї—О–і–µ–љ–Є—П –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –≤–ї–Є—П–љ–Є–µ–Љ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Љ—Л—И–µ—З–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є –љ–µ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞–µ—В –њ–∞–і–µ–љ–Є—П —Г –њ–Њ–ґ–Є–ї—Л—Е. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –≤ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б —Г—З–∞—Б—В–Є–µ–Љ 378 –њ–Њ–ґ–Є–ї—Л—Е –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –µ–ґ–µ–і–љ–µ–≤–љ—Л–є –њ—А–Є–µ–Љ –∞–љ–∞–ї–Њ–≥–∞ D––≥–Њ—А–Љ–Њ–љ–∞ – –њ—А–µ–њ–∞—А–∞—В–∞ –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ –≤ –і–Њ–Ј–µ 1 –Љ–Ї–≥/—Б—Г—В. –≤ —В–µ—З–µ–љ–Є–µ 36 –љ–µ–і –≤–µ–і–µ—В –Ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –Ї–∞–Ї –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ–∞–і–µ–љ–Є–є, —В–∞–Ї –Є —З–Є—Б–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ–љ–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М [Dukas et al., 2005]. –Я–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –њ–Њ–і–Њ–±–љ—Л–µ –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Њ—В—А–∞–ґ–∞—О—В —А–∞–Ј–ї–Є—З–Є—П –≤ –Љ–µ—В–Њ–і–Є–Ї–∞—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —З–Є—Б–ї–µ–љ–љ–Њ—Б—В–Є –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –љ–Є—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤–ї–Є—П–љ–Є–µ –≤—А–µ–Љ–µ–љ–Є –≤—А–µ–Љ–µ–љ–Є –≥–Њ–і–∞ –Є –і—А. –С–Њ–ї–µ–µ –Њ–і–љ–Њ—А–Њ–і–љ—Л–µ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ–Њ–ї—Г—З–µ–љ—Л –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D. –Ю–і–љ–∞–Ї–Њ –Є —Б—А–µ–і–Є –љ–Є—Е –Є–Љ–µ—О—В—Б—П —Б–≤–µ–і–µ–љ–Є—П –Њ –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —В–µ—А–∞–њ–Є–Є.
–Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ —Б—А–µ–і–Є —Г–Ї–∞–Ј–∞–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –Є–Љ–µ—О—В—Б—П —В–∞–Ї–Є–µ, –Ї–Њ—В–Њ—А—Л–µ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М, –Ї–∞–Ї –≤–µ—Б—М–Љ–∞ —Б–µ—А—М–µ–Ј–љ—Л–µ, –і–∞—О—Й–Є–µ –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ –≤–Њ–Ј–Љ–Њ–ґ–љ—Г—О –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Њ–±—К–µ–Ї—В–Є–≤–Є–Ј–∞—Ж–Є—О —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤. –Ъ –љ–Є–Љ –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М –Њ—В–љ–Њ—Б–Є—В—Б—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ STOP/IT (Sites Testing Osteoporosis Prevention and Intervention Treatments), –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –љ–∞ –±–∞–Ј–µ –Ъ—А–µ–є—В–Њ–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —Г–љ–Є–≤–µ—А—Б–Є—В–µ—В–∞ (–≥. –Ю–Љ–∞—Е–∞, –°–®–Р), –≤ –Ї–Њ—В–Њ—А–Њ–Љ —Г—З–∞—Б—В–≤–Њ–≤–∞–ї–Њ 489 –ґ–µ–љ—Й–Є–љ —Б –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Л–Љ –Ю–Я. –Т —Н—В–Њ–Љ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Б—А–∞–≤–љ–Є–≤–∞–ї–Є —В—А–Є –Љ–µ—В–Њ–і–∞ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є: (1) –Ј–∞–Љ–µ—Б—В–Є—В–µ–ї—М–љ–∞—П –≥–Њ—А–Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Ї–Њ–љ—К—О–≥–Є—А–Њ–≤–∞–љ–љ—Л—Е —Н—Б—В—А–Њ–≥–µ–љ–Њ–≤ –≤ —Б–Њ—З–µ—В–∞–љ–Є–Є —Б –Љ–µ–і—А–Њ–Ї—Б–Є–њ—А–Њ–≥–µ—Б—В–µ—А–Њ–љ–∞ –∞—Ж–µ—В–∞—В–Њ–Љ, (2) –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D – D––≥–Њ—А–Љ–Њ–љ–∞ (–Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞) –Є (3) —Б–Њ—З–µ—В–∞–љ–Є–µ –Њ–±–Њ–Є—Е –≤–Є–і–Њ–≤ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є.
–Т —Е–Њ–і–µ –њ–µ—А–≤–Њ–є —Д–∞–Ј—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М—О 5 –ї–µ—В –±—Л–ї–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Њ 8000 –ґ–µ–љ—Й–Є–љ –≤ –≤–Њ–Ј—А–∞—Б—В–µ 67–77 –ї–µ—В (—Б—А. 71 –≥–Њ–і), –Є–Ј –Ї–Њ—В–Њ—А—Л—Е 489 –±—Л–ї–Є —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ –≤–Ї–ї—О—З–µ–љ—Л –≤ —В—А–Є –≥—А—Г–њ–њ—Л. –Т —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –Ї—А–Є—В–µ—А–Є—П–Љ–Є –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Ї–Є –љ–µ –Є–Љ–µ–ї–Є —В—П–ґ–µ–ї—Л—Е —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є. –Я–µ—А–Є–Њ–і –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–Є–ї 3 –≥–Њ–і–∞. –Ф–ї—П –Њ—Ж–µ–љ–Ї–Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Н—Д—Д–µ–Ї—В–∞ –≤ —А–∞–Љ–Ї–∞—Е –≤—В–Њ—А–Њ–є —Д–∞–Ј—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –њ–Њ–≤—В–Њ—А–љ–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —З–µ—А–µ–Ј 2 –≥–Њ–і–∞ –њ–Њ—Б–ї–µ –њ—А–µ–Ї—А–∞—Й–µ–љ–Є—П —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є. –Я—А–Њ—В–Њ–Ї–Њ–ї–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ—А–µ–і—Г—Б–Љ–∞—В—А–Є–≤–∞–ї–∞—Б—М –Њ—Ж–µ–љ–Ї–∞ —З–∞—Б—В–Њ—В—Л –њ–Њ—П–≤–ї–µ–љ–Є—П –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —Б –њ–Њ–Љ–Њ—Й—М—О —А–µ–љ—В–≥–µ–љ–Њ–≤—Б–Ї–Њ–≥–Њ –Љ–µ—В–Њ–і–∞. –Т —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Ї–Є –њ–Њ–ї—Г—З–∞–ї–Є —Б –њ–Є—Й–µ–є –њ–Њ 700 –Љ–≥ –Ї–∞–ї—М—Ж–Є—П –≤ —Б—Г—В–Ї–Є; –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ –њ—А–µ–њ–∞—А–∞—В—Л –Ї–∞–ї—М—Ж–Є—П –љ–µ –љ–∞–Ј–љ–∞—З–∞–ї–Є—Б—М.
–Т –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П –±—Л–ї–Њ –Њ—В–Љ–µ—З–µ–љ–Њ –њ–Њ–≤—Л—И–µ–љ–Є–µ –Ь–Я–Ъ–Ґ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ч–У–Ґ. –Т –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞–≤—И–µ–є –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, —В–∞–Ї–ґ–µ –љ–∞–±–ї—О–і–∞–ї—Б—П –њ—А–Є—А–Њ—Б—В —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П, –≤—Л—А–∞–ґ–µ–љ–љ—Л–є, –Њ–і–љ–∞–Ї–Њ, –≤ –Љ–µ–љ—М—И–µ–є —Б—В–µ–њ–µ–љ–Є, —З–µ–Љ –≤ –≥—А—Г–њ–њ–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Ч–У–Ґ + –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї). –Т –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ –љ–∞–±–ї—О–і–∞–ї–Њ—Б—М —Б–љ–Є–ґ–µ–љ–Є–µ –Ь–Я–Ъ–Ґ –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Є—Б—Е–Њ–і–љ—Л–Љ —Г—А–Њ–≤–љ–µ–Љ.
–Т —А–µ–Ј—Г–ї—М—В–∞—В–µ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, —З–∞—Б—В–Њ—В–∞ –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±—Л–ї–∞ –≤ 2 —А–∞–Ј–∞ –љ–Є–ґ–µ, —З–µ–Љ –≤ –≥—А—Г–њ–њ–∞—Е –Ч–У–Ґ –Є –њ–ї–∞—Ж–µ–±–Њ. –Т–ї–Є—П–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –љ–∞ —З–∞—Б—В–Њ—В—Г –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –љ–µ –њ—А–µ–≤—Л—И–∞–ї–Њ –∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є —Н—Д—Д–µ–Ї—В –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–Њ–Љ. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ч–У–Ґ –љ–µ –≤–µ–ї–Њ –Ї —Б–љ–Є–ґ–µ–љ–Є—О —З–∞—Б—В–Њ—В—Л –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–є, –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞, –њ—А–Є—А–Њ—Б—В –Ь–Я–Ъ–Ґ. –Ш–Ј —Н—В–Є—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –∞–≤—В–Њ—А–∞–Љ–Є –±—Л–ї —Б–і–µ–ї–∞–љ—Л –і–≤–∞ –≤–µ—Б—М–Љ–∞ –≤–∞–ґ–љ—Л—Е –Є —Б–≤—П–Ј–∞–љ–љ—Л—Е –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є –≤—Л–≤–Њ–і–∞: 1) –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –љ–Њ–≤—Л—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤; 2) –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –±–Њ–ї—М—И–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Є–Љ–µ–µ—В —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–∞ –Ї–Њ—Б—В–љ–Њ–є —В–Ї–∞–љ–Є, —З–µ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ь–Я–Ъ–Ґ.
–Т–∞–ґ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –≤ –Ї–Њ–љ—В–µ–Ї—Б—В–µ –і–∞–љ–љ–Њ–≥–Њ —А–∞–Ј–і–µ–ї–∞ –Є–Љ–µ–µ—В –Є –µ—Й–µ –Њ–і–Є–љ –∞—Б–њ–µ–Ї—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П STOP/IT, —Б–≤—П–Ј–∞–љ–љ—Л–є —Б –≤–ї–Є—П–љ–Є–µ–Љ —А–∞–Ј–љ—Л—Е –≤–Є–і–Њ–≤ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –љ–∞ —З–∞—Б—В–Њ—В—Г –њ–∞–і–µ–љ–Є–є, —Б –Ї–Њ—В–Њ—А—Л–Љ–Є —Б–≤—П–Ј–∞–љ–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ. –Ъ–∞–Ї –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, –Є—Б—Е–Њ–і–љ–Њ –њ–∞–і–µ–љ–Є—П –±—Л–ї–Є —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ—Л–Љ —П–≤–ї–µ–љ–Є–µ–Љ –≤–Њ –≤—Б–µ—Е –≥—А—Г–њ–њ–∞—Е –њ–∞—Ж–Є–µ–љ—В–Њ–Ї: –њ–Њ –Љ–µ–љ—М—И–µ–є –Љ–µ—А–µ 50% –≤–Ї–ї—О—З–µ–љ–љ—Л—Е –≤ –љ–µ–≥–Њ –±–Њ–ї—М–љ—Л—Е –њ–∞–і–∞–ї–Є —Е–Њ—В—П –±—Л 1 —А–∞–Ј –Ј–∞ 3 –≥–Њ–і–∞. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤ –≥—А—Г–њ–њ–∞—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ч–У–Ґ –Є –њ–ї–∞—Ж–µ–±–Њ, —З–∞—Б—В–Њ—В–∞ –њ–∞–і–µ–љ–Є–є –±—Л–ї–∞ –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є, —В–Њ–≥–і–∞ –Ї–∞–Ї –≤ –≥—А—Г–њ–њ–µ, –њ–Њ–ї—Г—З–∞–≤—И–µ–є –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –±—Л–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ. –Я–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–ї–∞—Ж–µ–±–Њ —З–∞—Б—В–Њ—В–∞ –њ–∞–і–µ–љ–Є–є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї, –±—Л–ї–∞ –љ–∞ 15% –љ–Є–ґ–µ, –∞ –≤ –њ–µ—А–µ—Б—З–µ—В–µ –љ–∞ 1 —З–µ–ї–Њ–≤–µ–Ї–∞ – –љ–∞ 30% –љ–Є–ґ–µ. –≠—В–Њ—В —А–µ–Ј—Г–ї—М—В–∞—В –Њ–Ї–∞–Ј–∞–ї—Б—П –љ–µ–Њ–ґ–Є–і–∞–љ–љ—Л–Љ, –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –њ–Њ—В–Њ–Љ—Г, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –љ–µ –±—Л–ї –≤—Л—П–≤–ї–µ–љ —Б–µ—А—М–µ–Ј–љ—Л–є –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D: —Г—А–Њ–≤–µ–љ—М 25–Ю–ЭD –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ —Б–Њ—Б—В–∞–≤–ї—П–ї –≤ —Б—А–µ–і–љ–µ–Љ –Њ–Ї–Њ–ї–Њ 30 –љ–≥/–Љ–ї (75 –љ–Љ–Њ–ї—М/–ї).
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ —П–≤–ї—П–µ—В—Б—П —Б–ї–µ–і—Б—В–≤–Є–µ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞, –Ї–Њ—В–Њ—А—Л–є –љ–µ —В–Њ–ї—М–Ї–Њ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ –Ї–∞—З–µ—Б—В–≤–Њ –Ї–Њ—Б—В–Є, –љ–Њ –Є —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Я—А–Є —Н—В–Њ–Љ –∞–≤—В–Њ—А—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–і–µ–ї–∞–ї–Є –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –Њ —В–Њ–Љ, —З—В–Њ —Н—В–Њ—В –њ—А–µ–њ–∞—А–∞—В –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D —Г –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –њ–Њ—Б—В–Љ–µ–љ–Њ–њ–∞—Г–Ј–∞–ї—М–љ—Л–Љ –Ю–Я —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –Љ—Л—И–µ—З–љ—Г—О —Б–Є–ї—Г, —Г–ї—Г—З—И–∞–µ—В –љ–µ–є—А–Њ––Љ—Л—И–µ—З–љ—Г—О –Ї–Њ–Њ—А–і–Є–љ–∞—Ж–Є—О –Є –±–∞–ї–∞–љ—Б —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є—П —Б–≥–Є–±–∞—В–µ–ї–µ–є–—А–∞–Ј–≥–Є–±–∞—В–µ–ї–µ–є, –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—П, –њ–Њ––≤–Є–і–Є–Љ–Њ–Љ—Г, –љ–µ —В–Њ–ї—М–Ї–Њ –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ –љ–∞ —Б–Ї–µ–ї–µ—В–љ—Г—О –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Г, –љ–Њ –Є, –≤–µ—А–Њ—П—В–љ–Њ, –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –і–≤–Є–≥–∞—В–µ–ї—М–љ—Л—Е —Д—Г–љ–Ї—Ж–Є–є, —В.–Ї. –≤ –¶–Э–° –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л –†–ТD. –С—Л–ї–Њ —Б–і–µ–ї–∞–љ–Њ, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –Є–Љ–µ—О—Й–µ–µ –њ—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ, –Ї–Њ—В–Њ—А–Њ–µ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —А–∞–Ј–і–µ–ї—П–µ—В—Б—П –≤–µ–і—Г—Й–Є–Љ–Є —Б–њ–µ—Ж–Є–∞–ї–Є—Б—В–∞–Љ–Є –њ–Њ –Ю–Я, –Њ —В–Њ–Љ, —З—В–Њ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–∞—П —В–Њ–ї—М–Ї–Њ –љ–∞ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ь–Я–Ъ–Ґ, –љ–µ —Б–љ–Є–ґ–∞–µ—В –≤ –і–Њ–ї–ґ–љ–Њ–є —Б—В–µ–њ–µ–љ–Є —А–Є—Б–Ї –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤, —В–∞–Ї –Ї–∞–Ї –љ–µ —Г–Љ–µ–љ—М—И–∞–µ—В —З–∞—Б—В–Њ—В—Г –њ–∞–і–µ–љ–Є–є.
–£–±–µ–і–Є—В–µ–ї—М–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–Љ –≤–ї–Є—П–љ–Є–Є –і—А—Г–≥–Њ–≥–Њ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –Є–Ј –≥—А—Г–њ–њ—Л –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D – –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ –љ–∞ —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ—Л—Е –Љ—Л—И—Ж –Є —З–∞—Б—В–Њ—В—Г –њ–∞–і–µ–љ–Є–є –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –≤ –і–≤–Њ–є–љ–Њ–Љ —Б–ї–µ–њ–Њ–Љ –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Њ–±–Њ–µ–≥–Њ –њ–Њ–ї–∞ (–≤–Њ–Ј—А–∞—Б—В 65 –ї–µ—В –Є —Б—В–∞—А—И–µ) —Б–Њ —Б–љ–Є–ґ–µ–љ–љ—Л–Љ –Ї–ї–Є—А–µ–љ—Б–Њ–Љ –Ї—А–µ–∞—В–Є–љ–Є–љ–∞. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ 1 –Љ–Ї–≥ –≤ —В–µ—З–µ–љ–Є–µ 36 –љ–µ–і–µ–ї—М —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –њ–∞–і–µ–љ–Є–є –љ–∞ 71% –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –≥—А—Г–њ–њ–Њ–є –њ–ї–∞—Ж–µ–±–Њ (—А=0,019) (—А–Є—Б. 3). –Я—А–Є —Н—В–Њ–Љ –Ј–∞–Љ–µ—В–љ–Њ —Б–љ–Є–ґ–∞–ї–Є—Б—М –љ–µ —В–Њ–ї—М–Ї–Њ —З–∞—Б—В–Њ—В–∞ –њ–∞–і–µ–љ–Є–є, –љ–Њ –Є —З–Є—Б–ї–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –Њ–љ–Є –љ–∞–±–ї—О–і–∞–ї–Є—Б—М –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –Њ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–Є –њ–∞–і–µ–љ–Є–є –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞ – –њ—А–µ–њ–∞—А–∞—В–∞, —Г–ґ–µ –±–Њ–ї–µ–µ 15 –ї–µ—В —И–Є—А–Њ–Ї–Њ –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ–Њ–≥–Њ –≤ –љ–∞—И–µ–є —Б—В—А–∞–љ–µ (–Р–ї—М—Д–∞–D3––Ґ–µ–≤–∞®) –і–ї—П –ї–µ—З–µ–љ–Є—П –≤—Б–µ—Е —В–Є–њ–Њ–≤ –Є —Д–Њ—А–Љ –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞ –Є –љ–µ–Ї–Њ—В–Њ—А—Л—Е –і—А—Г–≥–Є—Е –Ї–∞–ї—М—Ж–Є–є––Ј–∞–≤–Є—Б–Є–Љ—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –і–Њ–њ–Њ–ї–љ—П–µ—В –µ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї—Г –Є —Б–Њ–Ј–і–∞–µ—В –њ—А–µ–і–њ–Њ—Б—Л–ї–Ї–Є –і–ї—П —А–∞—Б—И–Є—А–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О.
–Я—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –њ–∞–і–µ–љ–Є–є —П–≤–ї—П–µ—В—Б—П –љ–Њ–≤—Л–Љ –∞—Б–њ–µ–Ї—В–Њ–Љ –≤ —Б—В—А–∞—В–µ–≥–Є–Є –ї–µ—З–µ–љ–Є—П –Ю–Я, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–Љ –љ–∞ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї—Г –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Ю –≤—Л—Б–Њ–Ї–Њ–є –Ј–∞–Є–љ—В–µ—А–µ—Б–Њ–≤–∞–љ–љ–Њ—Б—В–Є –≤ –Є–Ј—Г—З–µ–љ–Є–Є –њ—А–Њ–±–ї–µ–Љ—Л –њ–∞–і–µ–љ–Є–є –≤ —Ж–µ–ї–Њ–Љ, —А–∞—Б–Ї—А—Л—В–Є–Є –Є—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –Є —А–∞–Ј—А–∞–±–Њ—В–Ї–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е –Љ–µ—А –Ј–∞—П–≤–Є–ї –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Є–љ—Б—В–Є—В—Г—В –Ј–і–Њ—А–Њ–≤—М—П –°–®–Р.
–Я—А–Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–Є —Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –і–∞–љ–љ–Њ–є –њ—А–Њ–±–ї–µ–Љ–Њ–є –Є –≤–Є—В–∞–Љ–Є–љ–Њ–Љ D –≤ –Ј–∞–Ї–ї—О—З–µ–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –µ—Й–µ —А–∞–Ј –Њ—В–Љ–µ—В–Є—В—М –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –Љ–Њ–Љ–µ–љ—В–Њ–≤. –Т–Њ––њ–µ—А–≤—Л—Е, —Б—В–∞–ї–Њ –Њ—З–µ–≤–Є–і–љ—Л–Љ, —З—В–Њ —Г–ґ–µ —Г–Љ–µ—А–µ–љ–љ—Л–є –і–µ—Д–Є—Ж–Є—В –≤–Є—В–∞–Љ–Є–љ–∞ D —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–µ–≥–∞—В–Є–≤–љ—Л–Љ–Є –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ–Є –љ–µ —В–Њ–ї—М–Ї–Њ –≤ –Ї–Њ—Б—В–љ–Њ–є —Б–Є—Б—В–µ–Љ–µ, –љ–Њ –Є –≤ —Д—Г–љ–Ї—Ж–Є–Њ–љ–Є—А–Њ–≤–∞–љ–Є–Є –њ—А–Њ–Є–Ј–≤–Њ–ї—М–љ–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л. –Т–Њ––≤—В–Њ—А—Л—Е, —Г –њ–Њ–ґ–Є–ї—Л—Е –ї—О–і–µ–є —Г–Ї–∞–Ј–∞–љ–љ—Л–є –і–µ—Д–Є—Ж–Є—В —П–≤–ї—П–µ—В—Б—П –Ї–∞–Ї —Д–∞–Ї—В–Њ—А–Њ–Љ/–Ј–≤–µ–љ–Њ–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–∞ –Ю–Я, —В–∞–Ї –Є –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞–µ—В –Ї –љ–∞—А—Г—И–µ–љ–Є—О –і–≤–Є–≥–∞—В–µ–ї—М–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –Є –њ–Њ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –њ–∞–і–µ–љ–Є–є – –љ–µ–њ–Њ—Б—А–µ–і—Б—В–≤–µ–љ–љ–Њ–є –њ—А–Є—З–Є–љ—Л –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –Т–—В—А–µ—В—М–Є—Е, –≤ —Б–≤—П–Ј–Є —Б —Г–ґ–µ –Њ—В–Љ–µ—З–µ–љ–љ—Л–Љ–Є –≤—Л—И–µ —Г–Љ–µ–љ—М—И–µ–љ–Є–µ–Љ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –†–ТD –Є —А–µ—Ж–µ–њ—Ж–Є–Є 1,25(–Ю–Э)2D3 –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –Ю–Я –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–µ—А–µ–ї–Њ–Љ–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ –≤–Є—В–∞–Љ–Є–љ–∞ D (–Ї–∞–ї—М—Ж–Є—В—А–Є–Њ–ї–∞, –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї–∞).
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –љ–µ–∞–Ї—В–Є–≤–љ–Њ–≥–Њ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D –љ–µ —Г–Љ–µ–љ—М—И–∞–µ—В —З–∞—Б—В–Њ—В—Г –њ–∞–і–µ–љ–Є–є, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ —Б–љ–Є–ґ–∞–µ—В—Б—П —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Њ—А–≥–∞–љ–Є–Ј–Љ–∞ –Ї –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—О D––≥–Њ—А–Љ–Њ–љ–∞ (1,25(–Ю–Э)2D3) –≤ –њ–Њ—З–Ї–∞—Е. –Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е Chapuy et al. (1997), Pfeiffer et al. (2002), Bischoff et al. (2003) –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D –њ–∞—Ж–Є–µ–љ—В–∞–Љ —Б —Г—А–Њ–≤–љ–µ–Љ 25–Ю–ЭD –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–Є–ґ–µ 10 –љ–≥/–Љ–ї —Б–њ–Њ—Б–Њ–±–љ–Њ –Ј–∞–Љ–µ—В–љ–Њ –њ–Њ–≤—Л—Б–Є—В—М —Н—В–Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М, –љ–Њ –љ–µ —Г—А–Њ–≤–µ–љ—М 1,25(–Ю–Э)2D3. –Т —З–∞—Б—В–љ–Њ—Б—В–Є, –≤ —А–∞–±–Њ—В–µ Bischoff et al. (2003) –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Е–Њ–ї–µ–Ї–∞–ї—М—Ж–Є—Д–µ—А–Њ–ї–∞ –≤ –µ–ґ–µ–і–љ–µ–≤–љ–Њ–є –і–Њ–Ј–µ 800 –Ь–Х –≤ —В–µ—З–µ–љ–Є–µ 12 –љ–µ–і —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —Б—А–µ–і–љ–Є—Е –Ј–љ–∞—З–µ–љ–Є–є 25–Ю–ЭD –≤ —Б—Л–≤–Њ—А–Њ—В–Ї–µ –Ї—А–Њ–≤–Є –љ–∞ 71%, —В–Њ–≥–і–∞ –Ї–∞–Ї –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П 1,25(–Ю–Э)2D3 –њ–Њ–≤—Л—И–∞–ї–∞—Б—М –ї–Є—И—М –љ–∞ 8%. –Р–љ–∞–ї–Є–Ј —Н—В–Є—Е –і–∞–љ–љ—Л—Е —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —Б —Ж–µ–ї—М—О –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–∞–і–µ–љ–Є–є –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –≤–Є—В–∞–Љ–Є–љ–∞ D (–Р–ї—М—Д–∞ D3––Ґ–µ–≤–∞), –Ї–Њ—В–Њ—А—Л–µ –љ–µ –љ—Г–ґ–і–∞—О—В—Б—П (–≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –љ–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Є—В–∞–Љ–Є–љ–∞ D) –≤ –±–Є–Њ—В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –≤ –њ–Њ—З–Ї–∞—Е –і–ї—П –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є—П –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ–Њ–є —Д–Њ—А–Љ—Л – D––≥–Њ—А–Љ–Њ–љ–∞.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П –Њ –њ—А–Њ–±–ї–µ–Љ–µ –њ–∞–і–µ–љ–Є–є –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ –Њ—В–≤–Њ–і—П—В –≤–∞–ґ–љ–Њ–µ –Љ–µ—Б—В–Њ –≤–Є—В–∞–Љ–Є–љ—Г D –≤ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞—Е, –ї–µ–ґ–∞—Й–Є—Е –≤ –Є—Е –Њ—Б–љ–Њ–≤–µ, –∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –Є—Е –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є, —Б–љ–Є–ґ–∞—О—Й–µ–є —А–Є—Б–Ї –њ–µ—А–µ–ї–Њ–Љ–Њ–≤.



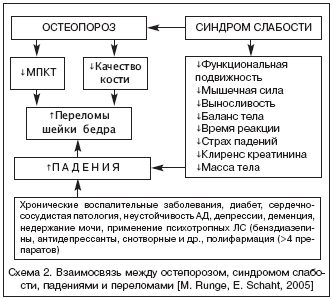



–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. –Ф–∞–Љ–±–∞—Е–µ—А –Ь., –®–∞—Е—В –Х. – –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Є –∞–Ї—В–Є–≤–љ—Л–µ –Љ–µ—В–∞–±–Њ–ї–Є—В—Л –≤–Є—В–∞–Љ–Є–љ–∞ D: –Љ—Л—Б–ї–Є, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є—Е–Њ–і—П—В –≤ –≥–Њ–ї–Њ–≤—Г. EULAR Publishers, Basle, 1996, –њ–µ—А.—Б –∞–љ–≥–ї. –Х.–•–∞–љ—Г–Ї–Њ–≤–Њ–є, S.Y.S. Publishing, Moscow, 1996, 140–°.
2. –Ф–∞–Љ—Г–ї–Є–љ –Ш.–Т. –Я–∞–і–µ–љ–Є—П –≤ –њ–Њ–ґ–Є–ї–Њ–Љ –Є —Б—В–∞—А—З–µ—Б–Ї–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–µ. //Consilium Medicum. – 2003.– 3 (4). – –°.67–82.
3. –Ф–∞–Љ—Г–ї–Є–љ –Ш.–Ф., –Ц—Г—З–µ–љ–Ї–Њ –Ґ.–Ф., –Ы–µ–≤–Є–љ –Ю.–°. –Э–∞—А—Г—И–µ–љ–Є—П —А–∞–≤–љ–Њ–≤–µ—Б–Є—П –Є –њ–Њ—Е–Њ–і–Ї–Є —Г –њ–Њ–ґ–Є–ї—Л—Е. –Ф–Њ—Б—В–Є–ґ–µ–љ–Є—П –≤ –љ–µ–є—А–Њ–≥–µ—А–Є–∞—В—А–Є–Є. –Я–Њ–і —А–µ–і.–Э.–Э.–ѓ—Е–љ–Њ, –Ш.–Т.–Ф–∞–Љ—Г–ї–Є–љ–∞. –Ь.:–Ь–Ь–Р, 1995—О–1.–—Б.71–97.
4. –Ь–∞—А–Њ–≤–∞ –Х.–Ш., –†–Њ–і–Є–Њ–љ–Њ–≤–∞ –°.–°., –†–Њ–ґ–Є–љ—Б–Ї–∞—П –Ы.–ѓ., –®–≤–∞—А—Ж –У.–ѓ.– –Р–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї (–Р–ї—М—Д–∞ –D3) –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞. –Я–Њ–і —А–µ–і.–Ы.–С.–Ы–∞–Ј–µ–±–љ–Є–Ї–∞. –Ь–µ—В–Њ–і–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є, –Ь.1998, 34–°.
5. –Э–∞—Б–Њ–љ–Њ–≤ –Х.–Ы. –Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј: —Б—В–∞–љ–і–∞—А—В—Л –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П. //Consilium medicum. –2001.–вДЦ9.––°.416–420.
6. –®–≤–∞—А—Ж –У.–ѓ. –Т–Є—В–∞–Љ–Є–љ –Ф, –Ф––≥–Њ—А–Љ–Њ–љ –Є –∞–ї—М—Д–∞–Ї–∞–ї—М—Ж–Є–і–Њ–ї: –Љ–Њ–ї–µ–Ї—Г–ї—П—А–љ–Њ––±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л. //–Ю—Б—В–µ–Њ–њ–Њ—А–Њ–Ј –Є –Њ—Б—В–µ–Њ–њ–∞—В–Є–Є. – 1998.– вДЦ3.––°.2–7.
7. –®–≤–∞—А—Ж –У.–ѓ. – –§–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є—П –Њ—Б—В–µ–Њ–њ–Њ—А–Њ–Ј–∞., –Ь.: 2002.– –Ь–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–µ –Є–љ—Д–Њ—А–Љ–∞—Ж–Є–Њ–љ–љ–Њ–µ –∞–≥–µ–љ—Б—В–≤–Њ – 368—Б.
8. –®–≤–∞—А—Ж –У.–ѓ. –Т–Є—В–∞–Љ–Є–љ D –Є D––≥–Њ—А–Љ–Њ–љ. – –Ь.: –Р–љ–∞—Е–∞—А—Б–Є—Б, 2005. – 152—Б.
9. Bell A.J., Talbot–Stern J.K., Henessy A. Characteristics and outcomes of older patients presenting to the emergency department after fall: a retrospective analysis. //Med J.Australia. –2000.–173(4). – p.176–177.
10. Bischoff–Ferrari H.A., Dawson–Hughes B., Willett W. et al. Effect of vitamin D on Falls. A meta–analysis. //JAMA.–2004. – 291. – p.1999–2006.
11. Bischoff–Ferrari H., Borchers M., Gudat F. et al. Vitamin D receptor expression in human muscle tissue decreases with age. //J.Bone Miner.Res – 2004. – 19.–p.265–269.
12. de Boland AR, Boland RL Rapid changes in skeletal muscle calcium uptake induced in vitro by 1,25–dihydroxyvitamn D3 are suppressed by calcium chanel blockers.//Endocrinology, – 1987.–Vol.120. – P.1858–1864.
13. Buitrago C.G., Pardo V., de Boland A.R., Boland R. Activation of RAF–1 through Ras and protein kinase C? mediates 1?,25(OH)2 –Vitamin D3 regulation of the mitogen–activated protein kinase pathway in muscle cells. // J.Biol.Chem. – 2003. – Vol.278.N4. – P.2199–2205.
14. Chapuy M.–C., Meunier P.J.– Vitamin D Insufficiency in Adults and in Elderly. In: Vitamin D., Feldman D., Glorieux F.H., Pike J.W. (Eds.) Academic Press., San Diego., 1997, P.679–694.
15. Degens H. Age–related skeletal muscle dysfunction:causes and mechanisms. //J.Musculoskelet Neuronal Interact.–2007.–7(3). – p.246–252.
16. De Luka H.F. – Historical Overview. In: Vitamin D., Feldman D., Glorieux F.H., Pike J.W. (Eds.) Academic Press., San Diego., 1997, P.3–11.
17. DeLuka H.F., Cantorna M.T. Vitamin D, Its role and uses in immunology.//FASEB J.–2001.–15.–p.2579–2585.
18. Dukas L., Schacht E., Mazor Z., Stahelin H. Treatment with Alfacalcidol in erderly reople significantly decreases the high risk of falls associated with low creatinine clearance of <65 ml.min.//Osteoporosis Int.–2005.–16(2).–p.198–203.
19. Dukas L., Bischoff H.A., Lindpaintner L.S. et al. Alfacalcidol reduses the number of fallers in community–dwelling elderly population with a minimum calcium intake of more than 500 mg daily.//J.Am.Geriatr.Soc.–2005.–52.– p.230–236.
20. Endo I., Inoue D., Mitsui T. Et al. Deletion of Vitamin D receptor gene in mice results in abnormal skeletal muscle development with deregulated expression of myoregulatory transcription factors. //Endocrinology.–2003.–144.–p.5138–5144.
21. Henry H.L. – The 25–Hydroxyvitamin D 1a–Hydroxylase. In: Vitamin D., Feldman D., Glorieux F.H., Pike J.W. (Eds.) Academic Press., San Diego., 1997, P.57–68.
22. Holick M.F. – McCollum Award Lecture 1994. Vitamin D – New horizons for the 21th century.// Am.J.Clin Nutr., 1994, Vol.60, P.619–630.
23. Gallagher J.C., Fowler S.E., Detter J.R., Sherman S.S. Combination treatment with estrogen and calcitriol in the prevention of age–related bone–loss.//J.Clin Endocrinol.Metab. – 2001. – 86.–p/3618–3628.
24. Gallagher J.C. The effect of calcitriol on falls and fractures and physical performance tests.//J.Steroid.Biochem.Mol.Biol.–2004.–89–90.–p.497–501.
25. Geusens P., Dequeker J., Nijs J. et al. – Prevention and treatment of osteopenia in ovarieectomized rat:effect of combined therapy with estrogens, 1–alphavitamin D, and prednosone //Calcif.Tissue Int.– 1991.–48.–p.127–137.
26. Facchinetti M.M., R.Boland, de Boland A.R. Calcitriol transmembrane signaling: regulation of rat muscle phospholipase D –∞ctivity. // J.Lipid Res. – 1998. – Vol.39. – P. 197–204
27. Janssen H.C., Samson M.M., Verhaar H.J. Vitamin D deficiency, muscle function, and falls in elderly people. //Am.J.Clin.Nutr.–2002.–75(4). – p.611–615.
28. Melton L., Joseph I. –≠–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—П –њ–µ—А–µ–ї–Њ–Љ–Њ–≤. –°–њ–±.: –Ш–Ј–і––≤–Њ –С–Є–љ–Њ–Љ, –Э–µ–≤—Б–Ї–Є–є –і–Є–∞–ї–µ–Ї—В – 2000.
29. Norman A.W., Henry H.L.– Vitamin D: Metabolism and Mechanism of action., in Primer on the metabolic bone diseases and disorders of mineral metabolism, 2nd ed., Ed.M.J.Favus, Raven Press, N.–Y.,1993.
30. Pfeifer M., Beregow B., Minne H. Vitamin D and muscle function. //Osteoporosis Int. – 2002. – 13(3). – p.187–194.
31. Pike J.W. – The Vitamin D Receptor and Its Gene. In: Vitamin D., Feldman D., Glorieux F.H., Pike J.W. (Eds.) Academic Press., San Diego., 1997, P.105–125.
32. Reginster J.Y, Kuntz D., Verdicht W. et al. – Profilactic Use of Alfacalcidol in Corticosreroid–induced Osteoporosis.// Bone, 1997, Vol.20 (4S):P.9S.
33. Ringe J.D.– Vitamin D deficiency and osteopathies. //Osteoporosis Int., 1998, Vol.8, Suppl.2, S.35–S.39.
34. Ringe J.D.– Prevention of corticoid–induced osteoporosis (CIO) by alfacalcidol in Europe.// In: New Aspects of Alfacalcidol and D–Hormone Analogs. Abstract book–Satellite Symp., World Congress on Osteoporosis, Chicago, 2000, P.16–17.
35. Schacht E., Richy F., Reginster J–Y. The therapeutic effects of alfacalcidol on bone strength, muscle metabolism and prevention of falls and fractures. //J.Muscoloskelet Neuronal Interact.–2005.–5(3).–p.273–284.
36. Simpson R.U., Thomas G.A., Arnold A.J. Identification of 1,25–dihydroxyvitamin D3 receptors and activities in muscle. //J.Biol.Chem. – 1985.–260(15). – p.8882–8891.
37. Stevens J.A. Falls among older adults – risk factors and prevention strategies. NCOA Falls Free: Promoting a National Falls Prevention Action Plan. Washington (DC), The National Council of Aging, 2005.
38. Stevens J.A., Corso P.S., Finkelstein E.A., Miller T.R. The cost of fatal and nonfatal falls among older adults. //Injury Prevention. – 2006. – 12. – p.290–295.
39. Vazquez G., de Boland A.R., Boland R. Involvement of calmodulin in 1?,25–dihydroxyvitamin D3 stimulation of store–operated Ca2+ influx in skeletal muscle cells // J.Biol.Chem. – 2000.–Vol.275. N21. – P.16134 – 16138.
40. Venning G. Recent developments in vitamin D deficiency and muscle weakness among elderly people.//BMJ.–2005.–33–p.524–526.
41. Vitamin D., Eds. D.Feldman, F.H.Glorieux, J.W.Pike., Academic Press, San Diego (California), 1997, 1285P.
42. Zamboni M., Zoico E., Tosoni P. et al. Relation between vitamin D, physical performace, and disability in elderly persons. //J.Gerontol.–2002.–57.–M7–M11/












