–Ф–∞–≤–љ–Њ –Њ—В–Љ–µ—З–µ–љ–Њ, —З—В–Њ –±–Њ–ї—М—И–Є–љ—Б—В–≤–Њ —Б—А–µ–і—Б—В–≤, –Ї–Њ—В–Њ—А—Л–µ —Е–Њ—А–Њ—И–Њ –і–µ–є—Б—В–≤—Г—О—В –њ—А–Є –ї–µ—З–µ–љ–Є–Є –Њ—Б—В—А–Њ–є –±–Њ–ї–Є, –љ–µ—Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –Є–ї–Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л –њ—А–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є. –•—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –Њ—Б—В—А–Њ–є –љ–µ —В–Њ–ї—М–Ї–Њ —Б–≤–Њ–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В—М—О, –љ–Њ –Є –њ–∞—В–Њ–≥–µ–љ–µ–Ј–Њ–Љ, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–Љ–Є –њ—А–Њ—П–≤–ї–µ–љ–Є—П–Љ–Є, –ї–µ—З–µ–љ–Є–µ–Љ –Є –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ [2]. –Х—Б–ї–Є –Њ—Б—В—А–∞—П –±–Њ–ї—М –Є–Љ–µ–µ—В —Б–Є–≥–љ–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, —В–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М —Г—В—А–∞—З–Є–≤–∞–µ—В —Н—В–Њ –Ј–љ–∞—З–µ–љ–Є–µ –Є –њ–µ—А–µ—Е–Њ–і–Є—В –≤ –Є–љ—Г—О –Ї–∞—В–µ–≥–Њ—А–Є—О. –Ю–љ–∞ –Ї–∞–Ї –±—Л –Њ—В—А—Л–≤–∞–µ—В—Б—П –Њ—В –Ї–Њ–љ–Ї—А–µ—В–љ—Л—Е –Љ–µ—Б—В–љ—Л—Е –њ–∞—В–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Є –љ–∞—З–Є–љ–∞–µ—В —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞—В—М –њ–Њ —Б–≤–Њ–Є–Љ –Ј–∞–Ї–Њ–љ–Њ–Љ–µ—А–љ–Њ—Б—В—П–Љ. –Т –≥–µ–љ–µ–Ј–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –±–Њ–ї—М—И—Г—О —А–Њ–ї—М –Є–≥—А–∞—О—В –њ—Б–Є—Е–Њ—Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ –Є –Ї–Њ–≥–љ–Є—В–Є–≤–љ–Њ-–њ–Њ–≤–µ–і–µ–љ—З–µ—Б–Ї–Є–µ –∞—Б–њ–µ–Ї—В—Л. –Х—Б–ї–Є –Њ—Б—В—А–∞—П –±–Њ–ї—М —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞–µ—В—Б—П –Ї–∞–Ї —Б–Є–Љ–њ—В–Њ–Љ, —В–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М –њ—А–Є–Њ–±—А–µ—В–∞–µ—В —З–µ—А—В—Л —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ–Њ–є –±–Њ–ї–µ–Ј–љ–Є, –Ї–Њ—В–Њ—А–∞—П –њ—А–Њ—П–≤–ї—П–µ—В—Б—П –љ–µ —В–Њ–ї—М–Ї–Њ –±–Њ–ї—М—О, –љ–Њ –Є –≤–µ–≥–µ—В–∞—В–Є–≤–љ—Л–Љ–Є, —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ—Л–Љ–Є –Є –і—А—Г–≥–Є–Љ–Є –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є, —Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–Є–µ–Љ –љ–µ–∞–і–∞–њ—В–Є–≤–љ–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ –њ–Њ–≤–µ–і–µ–љ–Є—П.
–°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ –њ–∞—В–Њ–≥–µ–љ–µ–Ј —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є вАТ —Н—В–Њ —Б–ї–Њ–ґ–љ–∞—П –Љ–љ–Њ–≥–Њ—Г—А–Њ–≤–љ–µ–≤–∞—П —Б–Є—Б—В–µ–Љ–∞, –≤ –Ї–Њ—В–Њ—А–Њ–є —Г—З–∞—Б—В–≤—Г—О—В –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є–Є, –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–љ—Л–µ –∞–Ї—В–Є–≤–∞—Ж–Є–µ–є –±–Њ–ї–µ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤ –љ–∞ –њ–µ—А–Є—Д–µ—А–Є–Є –Ј–∞ —Б—З–µ—В –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П. –Я—А–Є –њ—А–Њ–і–Њ–ї–ґ–∞—О—Й–µ–є—Б—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є–Є –≤–Ї–ї—О—З–∞—О—В—Б—П —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л: —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –±–Њ–ї–µ–≤—Л–µ –љ–µ–є—А–Њ–љ—Л —Б—В–∞–љ–Њ–≤—П—В—Б—П –≥–Є–њ–µ—А–≤–Њ–Ј–±—Г–і–Є–Љ—Л–Љ–Є, —Б–љ–Є–ґ–∞–µ—В—Б—П –њ–Њ—А–Њ–≥ –Є—Е –∞–Ї—В–Є–≤–∞—Ж–Є–Є, –Њ–љ–Є –љ–∞—З–Є–љ–∞—О—В –≤–Њ—Б–њ—А–Є–љ–Є–Љ–∞—В—М –љ–µ–±–Њ–ї–µ–≤—Л–µ —Б—В–Є–Љ—Г–ї—Л –Ї–∞–Ї –±–Њ–ї—М (–∞–ї–ї–Њ–і–Є–љ–Є—П), —Б–∞–Љ–Є –≥–µ–љ–µ—А–Є—А–Њ–≤–∞—В—М –±–Њ–ї–µ–≤—Л–µ –Є–Љ–њ—Г–ї—М—Б—Л (–≤—В–Њ—А–Є—З–љ–∞—П –≥–Є–њ–µ—А–∞–ї–≥–µ–Ј–Є—П) вАТ —Н—В–Њ —П–≤–ї–µ–љ–Є–µ –љ–∞–Ј—Л–≤–∞—О—В —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є–µ–є (–¶–°). –Ґ–∞–Ї–ґ–µ —Б–љ–Є–ґ–∞–µ—В—Б—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л—Е —Б–Є—Б—В–µ–Љ, —З–µ–Љ—Г —Б–њ–Њ—Б–Њ–±—Б—В–≤—Г–µ—В –Ї–∞–Ї –¶–°, —В–∞–Ї –Є –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –њ—Б–Є—Е–Њ—Б–Њ—Ж–Є–∞–ї—М–љ—Л–µ —Д–∞–Ї—В–Њ—А—Л (—В—А–µ–≤–Њ–≥–∞, —Б—В—А–∞—Е, –љ–µ–≤–µ—А–љ—Л–µ –Ї–Њ–њ–Є–љ–≥-—Б—В—А–∞—В–µ–≥–Є–Є –Є –і—А.).
–Ш—Б—В–Њ—З–љ–Є–Ї–Є –±–Њ–ї–Є –њ—А–Є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ—Л —А–µ–≤–Љ–∞—В–Њ–ї–Њ–≥–∞–Љ–Є: –Є–Љ–Є —П–≤–ї—П—О—В—Б—П —Б—В—А—Г–Ї—В—Г—А–љ—Л–µ –Є –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П, –≤–Њ–Ј–љ–Є–Ї–∞—О—Й–Є–µ –≤ –Ї–Њ—Б—В–Є, —Б–Є–љ–Њ–≤–Є–Є, –њ–µ—А–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л—Е —В–Ї–∞–љ—П—Е, –Љ—Л—И—Ж–∞—Е. –°–∞–Љ —Е—А—П—Й вАТ —Н—В–Њ –∞–≤–∞—Б–Ї—Г–ї—П—А–љ–∞—П –Є –љ–µ–Є–љ–љ–µ—А–≤–Є—А—Г–µ–Љ–∞—П —В–Ї–∞–љ—М, –љ–µ —П–≤–ї—П—О—Й–∞—П—Б—П –Є—Б—В–Њ—З–љ–Є–Ї–Њ–Љ –±–Њ–ї–Є. –Я—А–Є –Ю–Р –Є—Б—В–Њ—З–љ–Є–Ї–Є –±–Њ–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –љ–µ—Е—А—П—Й–µ–≤—Л–Љ–Є —Б—В—А—Г–Ї—В—Г—А–∞–Љ–Є —Б—Г—Б—В–∞–≤–∞, –≤–Ї–ї—О—З–∞—О—Й–Є–Љ–Є —Б–Є–љ–Њ–≤–Є–∞–ї—М–љ—Г—О –Њ–±–Њ–ї–Њ—З–Ї—Г, –Ї–Њ—Б—В—М –Є –њ–µ—А–Є–∞—А—В–Є–Ї—Г–ї—П—А–љ—Л–µ —В–Ї–∞–љ–Є [3].
–Т–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ —Б—В–Є–Љ—Г–ї—Л –Є–љ–Є—Ж–Є–Є—А—Г—О—В –Ї–∞—Б–Ї–∞–і –±–Є–Њ—Е–Є–Љ–Є—З–µ—Б–Ї–Є—Е —Б–Њ–±—Л—В–Є–є: –≤—Л–і–µ–ї–µ–љ–Є–µ SP, –±—А–∞–і–Є–Ї–Є–љ–Є–љ–∞, —Д–∞–Ї—В–Њ—А–∞ –љ–µ–Ї—А–Њ–Ј–∞ –Њ–њ—Г—Е–Њ–ї–Є ќ±, –Є–љ—В–µ—А–ї–µ–є–Ї–Є–љ–Њ–≤, —Е–µ–Љ–Њ–Ї–Є–љ–Њ–≤, —Д–∞–Ї—В–Њ—А–∞ —А–Њ—Б—В–∞ –љ–µ—А–≤–Њ–≤, —Б–Є–Љ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –∞–Љ–Є–љ–Њ–≤, –ї–µ–є–Ї–Њ—В—А–Є–µ–љ–Њ–≤ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–Њ–≤ –Є –і—А. –≠—В–Њ—В –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б –Є–љ–і—Г—Ж–Є—А—Г–µ—В –≥–Є–њ–µ—А–∞–ї–≥–µ–Ј–Є—О –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А–Њ–≤. –°–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є–є –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –∞–љ–≥–Є–Њ–≥–µ–љ–µ–Ј —Б—В–Є–Љ—Г–ї–Є—А—Г–µ—В –њ—А–Њ—А–∞—Б—В–∞–љ–Є–µ –љ–Њ–≤—Л—Е —Б–µ–љ—Б–Њ—А–љ—Л—Е –≤–Њ–ї–Њ–Ї–Њ–љ –≤ —В–Ї–∞–љ–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –Є –Љ–Њ–ґ–µ—В —Б–њ–Њ—Б–Њ–±—Б—В–≤–Њ–≤–∞—В—М —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –±–Њ–ї–Є –і–∞–ґ–µ –њ–Њ—Б–ї–µ —Б—В–Є—Е–∞–љ–Є—П –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [4]. –Ш—В–∞–Ї, –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є–Є –њ—А–Є –Ю–Р —Е–Њ—А–Њ—И–Њ –Є–Ј—Г—З–µ–љ—Л –Є –Є–Ј–≤–µ—Б—В–љ—Л.
–Ю–і–љ–∞–Ї–Њ —Е—А–Њ–љ–Є—З–µ—Б–Ї–∞—П –±–Њ–ї—М вАУ —Н—В–Њ –њ—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –¶–Э–°: –≤ –µ–µ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Г—З–∞—Б—В–≤—Г—О—В —В–∞–Ї–Є–µ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л, –Ї–∞–Ї –¶–° –Є —Б–љ–Є–ґ–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –љ–Є—Б—Е–Њ–і—П—Й–Є—Е –∞–љ—В–Є–љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л—Е —Б–Є—Б—В–µ–Љ –Є–ї–Є –і–µ–Ј–Є–љ–≥–Є–±–Є—Ж–Є—П.
–Я—А–Њ—Ж–µ—Б—Б—Л, –њ—А–Њ–Є—Б—Е–Њ–і—П—Й–Є–µ –≤ –¶–Э–° –њ—А–Є –Ю–Р, –≤ –љ–∞—Б—В–Њ—П—Й–Є–є –Љ–Њ–Љ–µ–љ—В –Љ–µ–љ–µ–µ –Є–Ј–≤–µ—Б—В–љ—Л. –Ю–і–љ–∞–Ї–Њ –Є–Љ–µ—О—Й–Є–µ—Б—П –і–∞–љ–љ—Л–µ –њ—А–Њ—П—Б–љ—П—О—В —А–Њ–ї—М —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤. –Я—А–µ–ґ–і–µ –≤—Б–µ–≥–Њ, –Є–Ј—Г—З–µ–љ–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–Є –Ю–Р –≤—Л—П–≤–Є–ї–Њ —А—П–і –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–є: –Њ—В—Б—Г—В—Б—В–≤—Г—О—В –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –Љ–µ–ґ–і—Г —Б—В–µ–њ–µ–љ—М—О —Б—В—А—Г–Ї—В—Г—А–љ—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –≤ –Њ–±–ї–∞—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –Є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О –±–Њ–ї–Є; —Г 40% –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є–Љ–µ—О—Й–Є—Е –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —Б—Г—Б—В–∞–≤–∞—Е –Є –Њ–Ї—А—Г–ґ–∞—О—Й–Є—Е —В–Ї–∞–љ—П—Е, –±–Њ–ї—М –≤–Њ–≤—Б–µ –Њ—В—Б—Г—В—Б—В–≤—Г–µ—В [5], –∞ –і–Њ 44% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ—Б–ї–µ –∞–і–µ–Ї–≤–∞—В–љ–Њ –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–≥–Њ —Н–љ–і–Њ–њ—А–Њ—В–µ–Ј–Є—А–Њ–≤–∞–љ–Є—П –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –Є—Б–њ—Л—В—Л–≤–∞—В—М –±–Њ–ї—М [6].
–Э–∞ —Б–µ–≥–Њ–і–љ—П—И–љ–Є–є –Љ–Њ–Љ–µ–љ—В –њ—А–Њ–≤–µ–і–µ–љ—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –Њ–Ї–Њ–ї–Њ —В—А–µ—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞ –Є–Љ–µ—О—В –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є: –Њ–љ–µ–Љ–µ–љ–Є–µ, –ґ–ґ–µ–љ–Є–µ, –∞–ї–ї–Њ–і–Є–љ–Є—О, –њ—А–Њ—Б—В—А–µ–ї—Л, —Б—А–∞–≤–љ–Є–Љ—Л–µ —Б —Г–і–∞—А–Њ–Љ —В–Њ–Ї–∞, –Є –і—А. [7вАТ9].
–Ю—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ –њ—А–Є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М –љ–∞–ї–Є—З–Є–µ–Љ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –¶–° —Г —А—П–і–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –Я—А–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ—А–Њ—Ж–µ—Б—Б–Њ–≤ –Ї–Њ–љ—В—А–Њ–ї—П –Є –Љ–Њ–і—Г–ї—П—Ж–Є–Є –±–Њ–ї–Є, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—О —А—П–і–∞ —Б–µ–љ—Б–Њ—А–љ—Л—Е –њ—А–Њ—П–≤–ї–µ–љ–Є–є, –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—Й–Є—Е—Б—П —Б —В–Є–њ–Є—З–љ–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–µ–є: –ї–Њ–Ї–∞–ї—М–љ–Њ–є –Є –Њ—В—А–∞–ґ–µ–љ–љ–Њ–є –≥–Є–њ–µ—А–∞–ї–≥–µ–Ј–Є–Є, –∞–ї–ї–Њ–і–Є–љ–Є–Є, –і–Є–Ј–µ—Б—В–µ–Ј–Є–Є –Є –≥–Є–њ–µ—Б—В–µ–Ј–Є–Є. –Ъ–∞—Б–Ї–∞–і –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —Г—Б–Є–ї–Є–≤–∞–µ—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Є—Е –љ–Њ—Ж–Є—Ж–µ–њ—В–Њ—А–Њ–≤, —Н—В–Њ —П–≤–ї–µ–љ–Є–µ –љ–Њ—Б–Є—В –љ–∞–Ј–≤–∞–љ–Є–µ –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є–Є. –Ф–ї–Є—В–µ–ї—М–љ–Њ —Б—Г—Й–µ—Б—В–≤—Г—П, –Њ–љ–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї —Б–њ–Њ–љ—В–∞–љ–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –љ–Њ—Ж–Є—Ж–њ–µ—В–Є–≤–љ—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤ –Є –і–µ–Ј–Є–љ–≥–Є–±–Є—Ж–Є–Є, —В. –µ. –¶–° –Є —Е—А–Њ–љ–Є–Ј–∞—Ж–Є–Є –њ—А–Њ—Ж–µ—Б—Б–∞ [10]. –§—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –Ь–†–Ґ –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –њ–Њ–Ї–∞–Ј–∞–ї–∞, —З—В–Њ –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ –Њ–±–ї–∞—Б—В–µ–є –≤ –≥–Њ–ї–Њ–≤–љ–Њ–Љ –Љ–Њ–Ј–≥–µ —Г—З–∞—Б—В–≤—Г—О—В –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –њ—А–Є –Ю–Р: —Б—В–≤–Њ–ї –Љ–Њ–Ј–≥–∞, –њ–µ—А–µ–і–љ—П—П –њ–Њ—П—Б–љ–∞—П –Ј–Њ–љ–∞, –њ—А–∞–≤–∞—П –і–Њ—А–Ј–Њ–ї–∞—В–µ—А–∞–ї—М–љ–∞—П –њ—А–µ—Д—А–Њ–љ—В–∞–ї—М–љ–∞—П –Ї–Њ—А–∞, –ї–µ–≤–∞—П —Б—А–µ–і–љ—П—П —Д—А–Њ–љ—В–∞–ї—М–љ–∞—П –Є–Ј–≤–Є–ї–Є–љ–∞ –Є –ї–µ–≤–∞—П –ї–∞—В–µ—А–∞–ї—М–љ–∞—П –Ј–∞—В—Л–ї–Њ—З–љ–∞—П –Њ–±–ї–∞—Б—В—М [11]. –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, —Б–µ–љ—Б–Є—В–Є–Ј–∞—Ж–Є—П —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л—Е –љ–µ–є—А–Њ–љ–Њ–≤ –Љ–Њ–ґ–µ—В –±—Л—В—М –њ—А–Є—З–Є–љ–Њ–є —А–∞–Ј–љ–Є—Ж—Л –Љ–µ–ґ–і—Г —Б—В–µ–њ–µ–љ—М—О –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П —Б—Г—Б—В–∞–≤–∞ –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М—О –±–Њ–ї–Є.
–Ф–ї—П —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –њ—А–Є –Ю–Р –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –Є—Б–њ–Њ–ї—М–Ј—Г—О—В –љ–µ—Б—В–µ—А–Њ–Є–і–љ—Л–µ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (–Э–Я–Т–Я), –Њ–і–љ–∞–Ї–Њ –Њ—В 27% –і–Њ 61% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ—А–Њ–і–Њ–ї–ґ–∞—О—В –Є—Б–њ—Л—В—Л–≤–∞—В—М —Е—А–Њ–љ–Є—З–µ—Б–Ї—Г—О –±–Њ–ї—М –Є –љ–µ —Г–і–Њ–≤–ї–µ—В–≤–Њ—А–µ–љ—Л –ї–µ—З–µ–љ–Є–µ–Љ [12].
–°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –ї–µ—З–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є, –њ—А–Є –љ–∞–ї–Є—З–Є–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –Є–ї–Є –≤ —В–µ—Е —Б–ї—Г—З–∞—П—Е, –Ї–Њ–≥–і–∞ –Є–Љ–µ—О—В—Б—П –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є, —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, –∞ –Є–Љ–µ–љ–љ–Њ –њ—А–µ–≥–∞–±–∞–ї–Є–љ–∞ –Є–Ј –≥—А—Г–њ–њ—Л –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В–Њ–≤.
–¶–µ–ї—М –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П: –Њ—Ж–µ–љ–Є—В—М —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–≥–∞–±–∞–ї–Є–љ–∞ –≤ —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Г –±–Њ–ї—М–љ—Л—Е –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Т –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –њ—А–Є–љ—П–ї–Є —Г—З–∞—Б—В–Є–µ 60 –њ–∞—Ж–Є–µ–љ—В–Њ–Ї —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –ґ–Є—В–µ–ї—М–љ–Є—Ж—Л –Ь–Њ—Б–Ї–≤—Л –Є –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–є –Њ–±–ї–∞—Б—В–Є, –Њ–љ–Є –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ –і–≤–µ –≥—А—Г–њ–њ—Л. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –Є—Е —Б–Њ—Б—В–∞–≤–Є–ї 59,82¬±4,46 –≥–Њ–і–∞ (–Њ—В 49 –ї–µ—В –і–Њ 65 –ї–µ—В). –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –љ–µ –≤—Л—П–≤–Є–ї–Њ –њ–Њ—А–∞–ґ–µ–љ–Є—П –њ–µ—А–Є—Д–µ—А–Є—З–µ—Б–Ї–Њ–є —Б–Њ–Љ–∞—В–Њ—Б–µ–љ—Б–Њ—А–љ–Њ–є –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –Є —Ж–µ–љ—В—А–∞–ї—М–љ—Л—Е –µ–µ –Њ—В–і–µ–ї–Њ–≤, —Б–њ–Њ—Б–Њ–±–љ–Њ–≥–Њ –Њ–±—К—П—Б–љ–Є—В—М –њ–Њ—П–≤–ї–µ–љ–Є–µ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є—Е –±–Њ–ї–µ–≤—Л—Е —Д–µ–љ–Њ–Љ–µ–љ–Њ–≤. –Ъ–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–Є –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Є –Є—Б—Е–Њ–і–љ—Л–µ –і–∞–љ–љ—Л–µ –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 1.
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ:
вАҐ –њ–µ—А–≤–Є—З–љ—Л–є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї—А–Є—В–µ—А–Є—П–Љ –Р–†–Р;
вАҐ –ґ–µ–љ—Й–Є–љ—Л –≤–Њ–Ј—А–∞—Б—В–∞ 45вАТ65 –ї–µ—В;
вАҐ –ґ–Є—В–µ–ї—М–љ–Є—Ж—Л –Ь–Њ—Б–Ї–≤—Л –Є –Ь–Њ—Б–Ї–Њ–≤—Б–Ї–Њ–є –Њ–±–ї–∞—Б—В–Є;
вАҐ –±–Њ–ї—М –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞ –њ–Њ –Њ–њ—А–Њ—Б–љ–Є–Ї—Г DN4;
вАҐ –њ–Њ–і–њ–Є—Б–∞–љ–љ–Њ–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–µ —Б–Њ–≥–ї–∞—Б–Є–µ.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П:
вАҐ –љ–∞–ї–Є—З–Є–µ —Б–Њ–њ—Г—В—Б—В–≤—Г—О—Й–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞—О—Й–Є—Е—Б—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–Љ –±–Њ–ї–µ–≤—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ, –љ–µ —Б–≤—П–Ј–∞–љ–љ—Л–Љ —Б –Ю–Р (–Ї–Њ—А–µ—И–Ї–Њ–≤—Л–є —Б–Є–љ–і—А–Њ–Љ, –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П –Є–ї–Є –∞–ї–Ї–Њ–≥–Њ–ї—М–љ–∞—П –њ–Њ–ї–Є–љ–µ–є—А–Њ–њ–∞—В–Є—П –Є –і—А.);
вАҐ –љ–∞–ї–Є—З–Є–µ –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, –Ј–∞—В—А—Г–і–љ—П—О—Й–Є—Е –∞–і–µ–Ї–≤–∞—В–љ—Г—О –Њ—Ж–µ–љ–Ї—Г –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞, —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–≥–Њ —Б–Њ—Б—В–Њ—П–љ–Є—П –Є –Ј–∞–њ–Њ–ї–љ–µ–љ–Є–µ –Њ–њ—А–Њ—Б–љ–Є–Ї–Њ–≤;
вАҐ –њ–∞—Ж–Є–µ–љ—В—Л, –Є–Љ–µ—О—Й–Є–µ –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –њ—А–µ–≥–∞–±–∞–ї–Є–љ–∞;
вАҐ —Е–Њ–љ–і—А–Њ–њ—А–Њ—В–µ–Ї—В–Є–≤–љ–∞—П —В–µ—А–∞–њ–Є—П, –њ—А–Є–љ–Є–Љ–∞–µ–Љ–∞—П –њ–∞—Ж–Є–µ–љ—В–Њ–Љ –љ–µ –Љ–µ–љ–µ–µ —З–µ–Љ –Ј–∞ 3 –Љ–µ—Б. –і–Њ –љ–∞—З–∞–ї–∞ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П;
вАҐ –љ–µ–њ–Њ–і–њ–Є—Б–∞–љ–Є–µ –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П.
–Я–Њ—Б–ї–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –Є –њ–Њ–і–њ–Є—Б–∞–љ–Є—П –Є–љ—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ —Б–Њ–≥–ї–∞—Б–Є—П –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В–Ї–Є –±—Л–ї–Є —А–∞–Ј–і–µ–ї–µ–љ—Л –љ–∞ –і–≤–µ –≥—А—Г–њ–њ—Л –њ–Њ 30 —З–µ–ї–Њ–≤–µ–Ї. –У—А—Г–њ–њ—Л –±—Л–ї–Є —Б—Д–Њ—А–Љ–Є—А–Њ–≤–∞–љ—Л –љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –њ–Њ—А—П–і–Ї–Њ–≤–Њ–≥–Њ –љ–Њ–Љ–µ—А–∞: –љ–µ—З–µ—В–љ—Л–µ –љ–Њ–Љ–µ—А–∞ –Њ–±—А–∞–Ј–Њ–≤–∞–ї–Є –≥—А—Г–њ–њ—Г I, —З–µ—В–љ—Л–µ вАУ –≥—А—Г–њ–њ—Г II. –У—А—Г–њ–њ–∞ I –њ–Њ–ї—Г—З–∞–ї–∞ —В–µ—А–∞–њ–Є—О –Э–Я–Т–Я –∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї (100 –Љ–≥ 2 —А./—Б—Г—В вАУ 42 –і–љ—П) + –њ—А–µ–≥–∞–±–∞–ї–Є–љ (75 –Љ–≥ 2 —А./—Б—Г—В вАТ 14 –і–љ–µ–є, 150 –Љ–≥ 2 —А./—Б—Г—В вАУ 28 –і–µ–љ—М), –≥—А—Г–њ–њ–∞ II –њ–Њ–ї—Г—З–∞–ї–∞ —В–Њ–ї—М–Ї–Њ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –Э–Я–Т–Я –∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї–Њ–Љ (100 –Љ–≥ 2 —А/—Б—Г—В вАТ 42 –і–љ—П).
–Ф–Є–Ј–∞–є–љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –≤–Ї–ї—О—З–∞–ї —В—А–Є –≤–Є–Ј–Є—В–∞: –≤–Є–Ј–Є—В 1 (–≤–Ї–ї—О—З–µ–љ–Є–µ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, –Ї–ї–Є–љ–Є–Ї–Њ-–љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ, —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Є–љ–і–µ–Ї—Б WOMAC, –Њ—Ж–µ–љ–Ї–∞ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –њ—А–Є –і–≤–Є–ґ–µ–љ–Є–Є, –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–∞ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є (–Њ–њ—А–Њ—Б–љ–Є–Ї DN4 –Є Pain DETECT), –Њ—Ж–µ–љ–Ї–∞ —Н–Љ–Њ—Ж–Є–Њ–љ–∞–ї—М–љ–Њ-–∞—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є —Б—Д–µ—А—Л (–Њ–њ—А–Њ—Б–љ–Є–Ї HADS), –Њ—Ж–µ–љ–Ї–∞ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –њ–Њ –Т–Р–® –≤ –њ–Њ–Ї–Њ–µ, –Њ—Ж–µ–љ–Ї–∞ –Ї–∞—З–µ—Б—В–≤–∞ –ґ–Є–Ј–љ–Є (–Њ–њ—А–Њ—Б–љ–Є–Ї EQ-5D), –≤–Є–Ј–Є—В 2 –љ–∞ 14-–є –і–µ–љ—М (—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Є–љ–і–µ–Ї—Б WOMAC, –Њ—Ж–µ–љ–Ї–∞ –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–Є –≤ –і–≤–Є–ґ–µ–љ–Є–Є), –≤–Є–Ј–Є—В 3 –љ–∞ 42-–є –і–µ–љ—М (–∞–љ–∞–ї–Њ–≥–Є—З–љ—Л–є –≤–Є–Ј–Є—В—Г 1).
–†–µ–Ј—Г–ї—М—В–∞—В—Л
–Ю—Б–љ–Њ–≤–љ—Л–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –њ—А–Є –≤–Ї–ї—О—З–µ–љ–Є–Є –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–Љ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–µ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ (–Э–Ъ–С) –њ–Њ –і–∞–љ–љ—Л–Љ –Њ–њ—А–Њ—Б–љ–Є–Ї–Њ–≤ DN4 –Є Pain DETECT (5,97¬±1,24 vs 5,35¬±0,93, p<0,04) –Є (17,93¬±3,87 vs 15,03¬±5,26, p<0,02), —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ, –±–Њ–ї—М—И–µ–є –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (12,97¬±4,86 vs 9,74¬±6,26, p<0,02) –≤ –≥—А—Г–њ–њ–µ I. –Ґ–∞–Ї–ґ–µ –і–ї—П –љ–Є—Е –±—Л–ї–∞ —Е–∞—А–∞–Ї—В–µ—А–љ–∞ –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ–∞—П —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М –њ–Њ –Є–љ–і–µ–Ї—Б—Г WOMAC (1295,67¬±370,41 vs 874,90¬±261,56, p<0,05). –°–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ, –њ—Г—В–µ–Љ —Б–ї—Г—З–∞–є–љ–Њ–є —А–∞–љ–і–Њ–Љ–Є–Ј–∞—Ж–Є–Є –≤ –≥—А—Г–њ–њ–µ I –Њ–Ї–∞–Ј–∞–ї–Є—Б—М –њ–∞—Ж–Є–µ–љ—В–Ї–Є —Б –±–Њ–ї–µ–µ —В—П–ґ–µ–ї—Л–Љ –Є –і–ї–Є—В–µ–ї—М–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –Э–Ъ–С, –Њ–і–љ–∞–Ї–Њ —А–µ–љ—В–≥–µ–љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –≤ —Б—Г—Б—В–∞–≤–∞—Е, –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В—М –±–Њ–ї–Є –њ–Њ –Т–Р–® (–Ї–∞–Ї –≤ –њ–Њ–Ї–Њ–µ, —В–∞–Ї –Є –≤ –і–≤–Є–ґ–µ–љ–Є–Є), –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є, –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —В—А–µ–≤–Њ–≥–Є –Є –і–µ–њ—А–µ—Б—Б–Є–Є –њ–Њ –≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–є —И–Ї–∞–ї–µ –±—Л–ї–Є –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ–Є –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е.–Ю—Ж–µ–љ–Ї–∞ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –±–Њ–ї–Є –њ–Њ –Њ–њ—А–Њ—Б–љ–Є–Ї—Г DN4 –њ–Њ–Ї–∞–Ј–∞–ї–∞ –≤ –њ—А–Њ—Ж–µ–љ—В–љ–Њ–Љ —Б–Њ–Њ—В–љ–Њ—И–µ–љ–Є–Є –±–Њ–ї—М—И—Г—О –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Г—О –і–Є–љ–∞–Љ–Є–Ї—Г –≤ –≥—А—Г–њ–њ–µ I —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Э–Я–Т–Я + –њ—А–µ–≥–∞–±–∞–ї–Є–љ) –њ–Њ —Б–ї–µ–і—Г—О—Й–Є–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ: –ґ–ґ–µ–љ–Є–µ, –њ—А–Њ—Б—В—А–µ–ї—Л ¬Ђ–Ї–∞–Ї —Г–і–∞—А–Њ–Љ —В–Њ–Ї–∞¬ї, –њ–Њ–ї–Ј–∞–љ–Є–µ –Љ—Г—А–∞—И–µ–Ї, –њ–Њ–Ї–∞–ї—Л–≤–∞–љ–Є–µ, –Њ–љ–µ–Љ–µ–љ–Є–µ, –њ–Њ–љ–Є–ґ–µ–љ–љ–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –Ї –њ—А–Є–Ї–Њ—Б–љ–Њ–≤–µ–љ–Є—О –Є –њ–Њ–Ї–∞–ї—Л–≤–∞–љ–Є—О, –∞–ї–ї–Њ–і–Є–љ–Є—П (—В–∞–±–ї. 2).

–Я–Њ–ї—Г—З–µ–љ–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –≥–Њ–≤–Њ—А–Є—В—М –Њ –љ–∞–ї–Є—З–Є–Є –¶–° —Г —А—П–і–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Р–Ю –Ї–Њ–ї–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞, –њ–Њ—Б–Ї–Њ–ї—М–Ї—Г –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–∞—П —В–µ—А–∞–њ–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–∞—П –љ–∞ —Ж–µ–љ—В—А–∞–ї—М–љ—Л–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л –±–Њ–ї–Є, –Њ–Ї–∞–Ј–∞–ї–∞ –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –Ї–∞—З–µ—Б—В–≤–µ–љ–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –±–Њ–ї–Є вАТ —Г–Љ–µ–љ—М—И–µ–љ–Є—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –ґ–ґ–µ–љ–Є—П, –њ—А–Њ—Б—В—А–µ–ї–Њ–≤, –Њ–љ–µ–Љ–µ–љ–Є—П, –њ–Њ–љ–Є–ґ–µ–љ–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Ї —Е–Њ–ї–Њ–і—Г –Є –њ—А–Є–Ї–Њ—Б–љ–Њ–≤–µ–љ–Є—О, –∞–ї–ї–Њ–і–Є–љ–Є–Є (–≥–ї–∞–≤–љ–Њ–≥–Њ –Љ–∞—А–Ї–µ—А–∞ –¶–°).
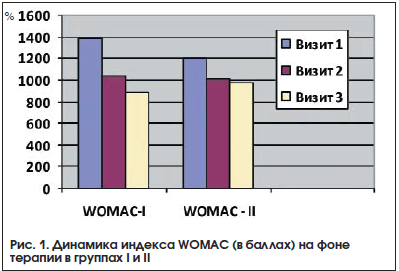
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є (–Є–љ–і–µ–Ї—Б WOMAC) –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞ –љ–∞ —Д–Њ–љ–µ —В–µ—А–∞–њ–Є–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ –љ–∞ —А–Є—Б—Г–љ–Ї–µ 1. –Ш–Ј–Љ–µ–љ–µ–љ–Є–µ –Є–љ–і–µ–Ї—Б–∞ –≤ –≥—А—Г–њ–њ–µ I –≤ —Е–Њ–і–µ —В—А–µ—Е –≤–Є–Ј–Є—В–Њ–≤ –љ–Њ—Б–Є–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А: 1385,30¬±365,83 vs 1034,70¬±402,37 vs 886,64¬±456,31 –љ–∞ —В—А–µ—Е –≤–Є–Ј–Є—В–∞—Е —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ (p=0,01). –£–ї—Г—З—И–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б–Њ—Б—В–∞–≤–Є–ї–Њ 35%. –Т –≥—А—Г–њ–њ–µ II –Є–љ–і–µ–Ї—Б WOMAC –Є–Ј–Љ–µ–љ–Є–ї—Б—П: 1206,04¬±358,72 vs 1016,45¬±428,52 vs 976,55¬±408,02, –Њ–і–љ–∞–Ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –±—Л–ї–Њ –Љ–µ–ґ–і—Г 1-–Љ –Є 2-–Љ –≤–Є–Ј–Є—В–∞–Љ–Є (p=0,002) –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В 2-–≥–Њ –Є 3-–≥–Њ –≤–Є–Ј–Є—В–Њ–≤ (—А=0,49). –£–ї—Г—З—И–µ–љ–Є–µ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 19%.
–Ф–Є–љ–∞–Љ–Є–Ї–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Є–љ—В–µ–љ—Б–Є–≤–љ–Њ—Б—В–Є –±–Њ–ї–µ–≤—Л—Е –Њ—Й—Г—Й–µ–љ–Є–є –њ–Њ –Т–Р–® (—И–Ї–∞–ї–∞ –Њ—В 0вАУ100 –Љ–Љ) –њ—А–Є –і–≤–Є–ґ–µ–љ–Є–Є –≤ –Њ–±–ї–∞—Б—В–Є –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –±—Л–ї–∞ –Є–і–µ–љ—В–Є—З–љ–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П–Љ –Є–љ–і–µ–Ї—Б–∞ WOMAC. –Я–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е: –≤ –≥—А—Г–њ–њ–µ I (61,60¬±14,91 vs 45,34¬±16,14 vs 36,24¬±18,09) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Љ–µ–ґ–і—Г –≤–Є–Ј–Є—В–∞–Љ–Є (p=0,01); –≤ –≥—А—Г–њ–њ–µ II (56,07¬±22,58 vs 44,86¬±18,68 vs 41,96¬±24,04) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–≥–Њ —Г–ї—Г—З—И–µ–љ–Є—П –Љ–µ–ґ–і—Г 2-–Љ –Є 3-–Љ –≤–Є–Ј–Є—В–∞–Љ–Є –љ–µ –њ—А–Њ–Є–Ј–Њ—И–ї–Њ (—А=0,41) (—А–Є—Б. 2).

–Ф–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є WOMAC –Є –Т–Р–® –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є —В–µ—А–∞–њ–Є–Є (–≤–Є–Ј–Є—В—Л 1вАУ3) —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –і–µ–є—Б—В–≤–Є–Є –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –≤–Ї–ї—О—З–∞—О—Й–µ–≥–Њ –њ—А–µ–≥–∞–±–∞–ї–Є–љ, –≤ –Њ—В–ї–Є—З–Є–Є –Њ—В –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –±–Њ–ї–µ–µ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ —Н—Д—Д–µ–Ї—В–∞ –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є –Э–Я–Т–Я.
–Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Э–Ъ–С –Њ—Ж–µ–љ–Є–≤–∞–ї–Є—Б—М –і–Њ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є (–≤–Є–Ј–Є—В 1) –Є —З–µ—А–µ–Ј 42 –і–љ—П (–≤–Є–Ј–Є—В 3). –Ґ–µ—А–∞–њ–Є—П –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е –Є–Љ–µ–ї–∞ –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ —Б–Њ–≥–ї–∞—Б–љ–Њ –Њ–њ—А–Њ—Б–љ–Є–Ї–∞–Љ DN4 –Є Pain DETECT. –Ю–і–љ–∞–Ї–Њ —Б–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ, —З—В–Њ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–љ–∞—П —В–µ—А–∞–њ–Є—П —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –њ—А–µ–≥–∞–±–∞–ї–Є–љ–∞ –њ–Њ–Ї–∞–Ј–∞–ї–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є–µ –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л–є –њ–Њ–ї–Њ–ґ–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В –љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є (—В–∞–±–ї. 3).

–Ч–∞ –≤—А–µ–Љ—П –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Г 20% (6 —З–µ–ї–Њ–≤–µ–Ї) –≥—А—Г–њ–њ—Л I –Њ—В–Љ–µ—З–∞–ї–Є—Б—М –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є—П –Є–ї–Є –Њ—Й—Г—Й–µ–љ–Є–µ ¬Ђ–њ—М—П–љ–Њ–є –≥–Њ–ї–Њ–≤—Л¬ї –≤ –њ–µ—А–≤—Л–µ 3вАТ5 —Б—Г—В –Њ—В –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–Є–Љ —Б–∞–Љ–Њ—Б—В–Њ—П—В–µ–ї—М–љ—Л–Љ –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є–µ–Љ; –і–Є—Б–Ї–Њ–Љ—Д–Њ—А—В –Є –±–Њ–ї–Є –≤ —Н–њ–Є–≥–∞—Б—В—А–∞–ї—М–љ–Њ–є –Њ–±–ї–∞—Б—В–Є –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –≤ –Њ–±–µ–Є—Е –≥—А—Г–њ–њ–∞—Е: –≤ –≥—А—Г–њ–њ–µ I вАТ —Г 20% (6 —З–µ–ї–Њ–≤–µ–Ї), –≤ –≥—А—Г–њ–њ–µ II вАТ 24% (7 —З–µ–ї–Њ–≤–µ–Ї), –Њ–і–љ–∞–Ї–Њ –і–Њ–±–∞–≤–ї–µ–љ–Є–µ –Њ–Љ–µ–њ—А–∞–Ј–Њ–ї–∞ –Ї –Њ—Б–љ–Њ–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є –Ї—Г–њ–Є—А–Њ–≤–∞–ї–Є –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П. –Ю–і–љ–∞ –њ–∞—Ж–Є–µ–љ—В–Ї–∞ –Є–Ј –≥—А—Г–њ–њ—Л II –±—Л–ї–∞ –Є—Б–Ї–ї—О—З–µ–љ–∞ –Є–Ј –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ—Б–ї–µ 2-–≥–Њ –≤–Є–Ј–Є—В–∞ –Є–Ј-–Ј–∞ –њ–Њ–і–Њ–Ј—А–µ–љ–Є—П –љ–∞ –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞ (–≤ —Б–њ–µ—Ж–Є–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–Љ –Њ—В–і–µ–ї–µ–љ–Є–Є –і–Є–∞–≥–љ–Њ–Ј –љ–µ –њ–Њ–і—В–≤–µ—А–і–Є–ї—Б—П).
–Ю–±—Б—Г–ґ–і–µ–љ–Є–µ
–Я—А–Є –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є —В–µ—А–∞–њ–Є–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±–Њ–ї–µ–≤–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ —Б–ї–µ–і—Г–µ—В —Г—З–Є—В—Л–≤–∞—В—М –µ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л. –Ґ–∞–Ї, –њ—А–Є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є –Љ–µ—Е–∞–љ–Є–Ј–Љ —П–≤–ї—П–µ—В—Б—П –Њ—З–µ–≤–Є–і–љ—Л–Љ –Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ –Є –і–µ–≥–µ–љ–µ—А–∞—В–Є–≤–љ—Л–Љ –њ—А–Њ—Ж–µ—Б—Б–Њ–Љ –≤ –Њ–±–ї–∞—Б—В–Є –њ–Њ—А–∞–ґ–µ–љ–љ–Њ–≥–Њ —Б—Г—Б—В–∞–≤–∞. –Т –љ–µ–і–∞–≤–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Х.–§. –Ґ—Г—А–Њ–≤—Б–Ї–Њ–є –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ —З–µ—А—В—Л –њ—А–Є –Њ—В—Б—Г—В—Б—В–≤–Є–Є –Ї–∞–Ї–Є—Е-–ї–Є–±–Њ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л –±—Л–ї–Є –Њ–±–љ–∞—А—Г–ґ–µ–љ—Л —Г 37% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ [13]. –≠—В–Є –і–∞–љ–љ—Л–µ –њ–Њ–і—В–≤–µ—А–ґ–і–∞—О—В—Б—П —В–∞–Ї–ґ–µ —А—П–і–Њ–Љ –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є.–Я–Њ–Ї–∞–Ј–∞–љ–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –і—Г–ї–Њ–Ї—Б–µ—В–Є–љ–∞ —Г 30% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ [14], –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ —А–Њ–ї—М —Б—Г–њ—А–∞—Б–њ–Є–љ–∞–ї—М–љ—Л—Е –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–≤ –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є –њ—А–Є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ —Б –њ–Њ–Љ–Њ—Й—М—О —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –Ь–†–Ґ [11]. –°—Г–Љ–Љ–Є—А—Г—П —Н—В–Є –і–∞–љ–љ—Л–µ, –Љ–Њ–ґ–љ–Њ –њ–Њ–ї–∞–≥–∞—В—М, —З—В–Њ –≤ —А—П–і–µ —Б–ї—Г—З–∞–µ–≤ –±–Њ–ї—М –њ—А–Є –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –љ–Њ—Б–Є—В —Б–Љ–µ—И–∞–љ–љ—Л–є —Е–∞—А–∞–Ї—В–µ—А: –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є –Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є –Є –Њ—Б–љ–Њ–≤–љ—Л–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ, –њ–Њ–і–і–µ—А–ґ–Є–≤–∞—О—Й–Є–Љ –≤ —Н—В–Є—Е —Б–ї—Г—З–∞—П—Е –±–Њ–ї—М –≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–Љ —Б–Њ—Б—В–Њ—П–љ–Є–Є, —П–≤–ї—П–µ—В—Б—П –¶–°. –Э–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Є–µ —З–µ—А—В—Л –Є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ—Г—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Э–Я–Т–Я –Љ–Њ–ґ–љ–Њ –Њ–±—К—П—Б–љ–Є—В—М –Є–Љ–µ–љ–љ–Њ –¶–° –Ї–∞–Ї –≤–µ–і—Г—Й–Є–Љ –Љ–µ—Е–∞–љ–Є–Ј–Љ–Њ–Љ.
–Э–∞–њ—А–∞–≤–ї–µ–љ–љ–∞—П —В–µ—А–∞–њ–Є—П —П–≤–ї—П–µ—В—Б—П –Ј–∞–ї–Њ–≥–Њ–Љ —Г—Б–њ–µ—Е–∞ –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є. –Т —Б–≤—П–Ј–Є —Б —Н—В–Є–Љ –љ–∞–Љ–Є –±—Л–ї–Њ –њ—А–Њ–≤–µ–і–µ–љ–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї + –њ—А–µ–≥–∞–±–∞–ї–Є–љ) –Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–Є (–∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї), –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ –Њ–±–∞ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞ вАТ –љ–Њ—Ж–Є—Ж–µ–њ—В–Є–≤–љ—Л–є –Є –і–Є—Б—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л–є. –Ю—В–±–Њ—А –њ–∞—Ж–Є–µ–љ—В–Њ–Ї –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–ї–Є —Б –њ–Њ–Љ–Њ—Й—М—О –Њ–њ—А–Њ—Б–љ–Є–Ї–∞ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–є –±–Њ–ї–Є DN4. –≠—В–Њ—В –Њ–њ—А–Њ—Б–љ–Є–Ї –≤—Л—П–≤–ї—П–µ—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤, –Њ–і–љ–∞–Ї–Њ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–є –Њ—Б–Љ–Њ—В—А –љ–µ –≤—Л—П–≤–ї–Є–ї –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –њ–Њ—А–∞–ґ–µ–љ–Є—П –љ–µ—А–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л, –њ–Њ—Н—В–Њ–Љ—Г —Н—В–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –±—Л–ї–Є —А–∞—Б—Ж–µ–љ–µ–љ—Л –≤ –Ї–∞—З–µ—Б—В–≤–µ –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –¶–° –Ї–∞–Ї –≤–µ–і—Г—Й–µ–≥–Њ –Љ–µ—Е–∞–љ–Є–Ј–Љ–∞. –Я—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞–ї–Њ, —З—В–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П, –≤ —Б–Њ—Б—В–∞–≤ –Ї–Њ—В–Њ—А–Њ–є –≤—Е–Њ–і–Є–ї –Э–Я–Т–Я (–∞—Ж–µ–Ї–ї–Њ—Д–µ–љ–∞–Ї) –Є –∞–љ—В–Є–Ї–Њ–љ–≤—Г–ї—М—Б–∞–љ—В (–њ—А–µ–≥–∞–±–∞–ї–Є–љ), –±—Л–ї–∞ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–є –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –¶–° —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –Є –і–µ–є—Б—В–≤–Њ–≤–∞–ї–∞ –±–Њ–ї–µ–µ –і–ї–Є—В–µ–ї—М–љ–Њ вАУ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –Ї—Г—А—Б–∞ (42 –і–љ—П) —В–µ—А–∞–њ–Є–Є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї—П–µ—В —Б—Д–Њ—А–Љ—Г–ї–Є—А–Њ–≤–∞—В—М —Б–ї–µ–і—Г—О—Й–Є–µ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –і–ї—П –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤:
вАҐ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ю–Р –Ї–Њ–ї–µ–љ–љ—Л—Е —Б—Г—Б—В–∞–≤–Њ–≤ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –і–Њ –љ–∞—З–∞–ї–∞ —В–µ—А–∞–њ–Є–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞—В—М –љ–∞ –љ–∞–ї–Є—З–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –¶–° —Б –њ–Њ–Љ–Њ—Й—М—О –Њ–њ—А–Њ—Б–љ–Є–Ї–Њ–≤ –љ–µ–є—А–Њ–њ–∞—В–Є—З–µ—Б–Ї–Њ–є –±–Њ–ї–Є (DN4);
вАҐ –њ—А–Є –Њ—Ж–µ–љ–Ї–µ >4 –±–∞–ї–ї–Њ–≤ –њ–Њ –Њ–њ—А–Њ—Б–љ–Є–Ї—Г DN4 —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є, –≤–Ї–ї—О—З–∞—О—Й–µ–є –Э–Я–Т–Я –Є –њ—А–µ–≥–∞–±–∞–ї–Є–љ –≤ –і–Њ–Ј–µ 150вАУ300 –Љ–≥/—Б—Г—В –і–ї—П –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П –±–Њ–ї–Є.












