Введение
Гиперактивный мочевой пузырь (ГАМП) — это симптомокомплекс, сопровождающийся ургентностью, никтурией (более 2 раз за ночь) с недержанием мочи или без такового и учащенным мочеиспусканием (более 8 раз в течение дня), при отсутствии доказанной инфекции мочевых путей или другой очевидной патологии нижнего отдела мочевых путей (НМП) [1–3]. Синдром ГАМП крайне негативно влияет на качество жизни пациентов [1–7].В 2018 г. в мире насчитывалось 546 млн человек с ГАМП, что составило 20,1% населения [8]. Его симптомы отмечаются у 17% взрослого населения Европы [9]. В США распространенность ГАМП составляет 17% среди женщин в целом, увеличиваясь с возрастом: среди лиц старше 65 лет он выявляется более чем у 30% [10]. В странах Азии распространенность ГАМП еще более высока [7]. Однозначных данных о распространенности ГАМП в России нет, однако принято считать, что она аналогична таковой в европейских странах [1, 2].
Имеется отчетливая тенденция к росту заболеваемости ГАМП. За последние 10 лет количество подобных пациентов в странах Азии и Южной Америки увеличилось на 22%, в Северной Америке — на 18%, а в странах Африки — на 31% [5]. В Канаде количество пациентов, принимающих средства для терапии ГАМП, увеличилось в 1,6 раза с мая 2010 г. по апрель 2015 г. (с 924 до 1475 пациентов на 10 000) [11]. К сожалению, многие пациенты не получают адекватного лечения и профессиональной помощи.
Этиология и патогенез ГАМП
До сих пор не существует единой теории этиопатогенеза ГАМП, но установлено, что в основе его развития лежат не только нейрогенные факторы [1–5, 12].Снижение центрального ингибирующего влияния на рефлекс мочеиспускания, сопровождающее ГАМП, наблюдается при нарушениях кровоснабжения головного мозга, травмах спинного и головного мозга, рассеянном склерозе, болезни Паркинсона. Если имеется частичная денервация мочевого пузыря и сенситизация периферических афферентных окончаний (сахарный диабет, ишемия мочевого пузыря, в т. ч. вызванная атеросклерозом сосудов), может развиваться спонтанная генерация потенциала действия в мочевом пузыре, что сопровождается микросокращениями мышечных клеток детрузора и повышением внутрипузырного давления. К аномальным сокращениям мышечных клеток стенки мочевого пузыря может приводить и изменение чувствительности и взаимодействия эндотелия мочевого пузыря и миоцитов [2, 3, 8, 12].
К факторам риска развития ГАМП относятся возраст, курение, ожирение, потребление газированных и содержащих кофеин напитков, снижение потребления овощей, фруктов и хлеба, сахарный диабет, инфекции мочевых путей, запоры, снижение физической активности [1, 3, 6, 13, 14]. У женщин в перименопаузе одним из важнейших факторов риска является снижение уровня эстрогенов. Кроме того, если у женщины имеется опущение стенок влагалища и органов малого таза, то даже небольшое растяжение тканей (связок и фасций), которое наблюдается при этом, активирует рецепторы растяжения, что может включить рефлекс мочеиспускания [1, 6, 15–18].
Перед началом лечения необходимо исключить органические причины симптоматики, а также обязательно оценить вероятность таких причин учащенного мочеиспускания, как применение препаратов для лечения сердечной недостаточности, заболеваний почек [1–4]. При наличии инфекции мочевыводящих путей, которая может усугублять клиническую картину, требуется провести соответствующую антибактериальную терапию [1–3].
Принципы лечения ГАМП
Синдром ГАМП лечится консервативными методами. Основными целями фармакологической терапии ГАМП являются облегчение симптомов и улучшение качества жизни. Главная задача лечения — восстановить утраченный контроль над накопительной способностью мочевого пузыря [1–5, 12, 15].
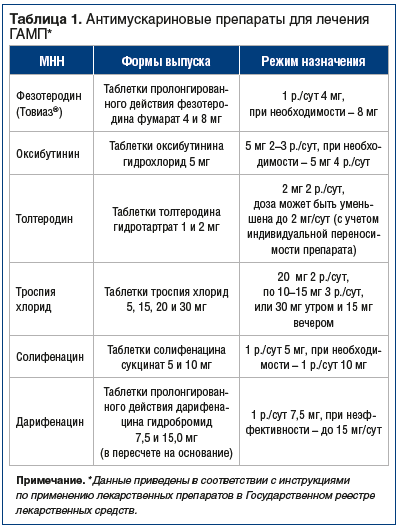
Основой лечения ГАМП и ургентного недержания мочи в настоящее время являются антимускариновые (антихолинергические) препараты [1–3, 9, 19].
М-холинергические рецепторы располагаются преимущественно в области тела мочевого пузыря и отвечают за сокращение детрузора и расслабление сфинктера, который дополнительно имеет соматический контроль. В мочевом пузыре находятся мускариновые М2- (80%) и М3- (20%) подтипы холинорецепторов. Несмотря на то, что рецепторов М3 меньше, они считаются более важными для сокращения детрузора мочевого пузыря [2, 12].
Подтип M2 также вносит свой вклад в регуляцию сокращения детрузора, значимость которого изменяется при различных заболеваниях, также он сильнее всего экспрессируется в уротелии мочевого пузыря человека. Активация M2-холинорецепторов повышает сократительный ответ на активацию M3-рецепторов, поскольку эффекты стимуляции этих рецепторов реализуются с участием разных систем вторичных мессенджеров (рис. 1). При воздействии ацетилхолина (АЦХ) на M2- и М3-рецепторы через G-белки активируется фосфолипаза С (ФЛ C). При стимуляции M2-холинорецептора это приводит к подавлению аденилатциклазы, что сопровождается снижением концентрации циклического аденозинмонофосфата (цАМФ). При стимуляции М3-холинорецептора образуются инозитол-3-фосфат и диацилглицерол. Инозитол-3-фосфат открывает кальциевые каналы в эндоплазматическом ретикулуме, что вызывает увеличение концентрации ионов Cа2+. Диацилглицерол совместно с ионами Са2+ активирует протеинкиназу С. Блокада M2- и М3-холинорецепторов приводит к расслаблению миоцитов. Кроме того,
активация M2-рецепторов блокирует расслабление детрузора, опосредованное симпатическими β-адренорецепторами [4, 12, 20].
![Рис. 1. Механизм действия антимускариновых препаратов на мочевой пузырь [12]. Рис. 1. Механизм действия антимускариновых препаратов на мочевой пузырь [12].](/upload/medialibrary/7ec/42-1.png)
М-холинолитики блокируют мускариновые рецепторы, тормозя связывание АЦХ с рецепторами миоцитов мочевого пузыря и предотвращая тем самым сокращение мышечных волокон его стенки.
Терапевтический эффект М-холинолитиков при синдроме ГАМП достигается через несколько недель, что необходимо учитывать при оценке эффективности препаратов [3, 4]. В то же время в целях оценки эффективности и безопасности применения М-холинолитических препаратов рекомендуется ранняя оценка (в первые 30 дней приема) состояния принимающих их пациентов с ургентным недержанием мочи (уровень доказательности А) [1, 3].
Все М-холинолитики, используемые в настоящее время (табл. 1) для лечения ГАМП, более активны, чем плацебо [21, 22]. На фоне их применения увеличиваются интервалы между мочеиспусканиями, исчезают или ослабевают императивные позывы, устраняется недержание мочи. Назначение антимускариновых препаратов позволяет снизить выраженность симптомов ГАМП на 70–80% [20, 21].
При сравнительной оценке эффективности влияния различных антимускариновых препаратов на симптомы НМП (в общей сложности 26 775 пациентов, из которых 10 386 (38,8%) получали терапию не менее 1 года) было обнаружено, что наилучшие показатели эффективности наблюдались при приеме фезотеродина, чуть хуже — солифенацина, значительно хуже — толтеродина, при этом продленная форма толтеродина была несколько лучше, чем толтеродин короткого действия [22].
Интересным дополнительным преимуществом назначения антимускариновых средств может быть влияние лекарств на риск развития рака легких и рака толстой кишки. В исследовании, проведенном в Швеции, было показано, что на фоне лечения оксибутинином, солифенацином, дарифенацином, фезотеродином или толтеродином имелась обратная корреляция между применением антимускариновых препаратов и развитием рака толстой кишки или рака легких [9].
Для повышения эффективности лечения пациентов с ГАМП рекомендуется использовать поведенческую терапию, модификацию питьевого режима [2, 3]. Так, кофеинсодержащие жидкости (кофе, чай, кока-кола и др.) не только обладают слабым диуретическим действием, но и учащают мочеиспускание. Прием подобных напитков должен быть ограничен [3, 14].
Терапия антимускариновыми препаратами обычно хорошо переносится. В анализе S.M. Vouri et al. было установлено, что значительно более высокий риск отказа от лечения наблюдается, если пациент принимает оксибутинин немедленного высвобождения, по сравнению с риском у тех, кто принимает пролонгированные формы оксибутинина, толтеродин, троспиум, дарифенацин, солифенацин и фезотеродин (p<0,001) [23].
Наиболее частыми нежелательными эффектами антимускариновой терапии при ГАМП являются сухость слизистых оболочек и запоры.
Метаанализ (102 исследования, 19 434 пациента) показал, что риск запора принимающих антимускариновые препараты выше, чем у принимающих плацебо (отношение шансов (ОШ) 2,18; 95% доверительный интервал (ДИ): 1,82–2,60). Худшие показатели были в группах, получавших троспия хлорид (ОШ 2,93; 95% ДИ: 2,00–4,28) и солифенацин (ОШ 3,02; 95% ДИ: 2,37–3,84) [24].
Желание уменьшить риск возникновения сухости во рту и других типичных нежелательных эффектов антимускариновой терапии привело к разработке веществ, действующих только на М3-холинорецепторы, — селективных М3-холиноблокаторов (дарифенацин, солифенацин). Как было показано в недавнем сравнительном рандомизированном исследовании (Cetinel, 2019), единственный побочный эффект, более характерный для неселективных препаратов (фезотеродин, толтеродин, троспия хлорид, пропиверина гидрохлорид (не зарегистрирован в РФ)), чем для селективных, — увеличение частоты сердечных сокращений, которое было более выражено у пациентов, получавших троспия хлорид, толтеродина тартрат, фезотеродина фумарат и пропиверина гидрохлорид (p<0,001, 0,003, 0,011 и 0,37 соответственно). Частота других побочных эффектов при приеме неселективных антимускариновых препаратов не отличалась от таковой при приеме селективных [19].
Изучение влияния М-холинолитиков на риски сердечно-сосудистых событий показало, что среди 72 917 применявших препараты для лечения ГАМП (средний возраст
66 лет; 60% женщин) в пересчете на 1000 человеко-лет был выше риск острого инфаркта миокарда (2,7 (2,5–2,9)), инсульта (1,3 (1,2–1,5)), нежелательных кардиологических событий (7,8 (7,5–8,1)), сердечно-сосудистой смертности (4,8 (4,5–5,0)) [25]. Риск сердечно-сосудистых событий или смертности среди потребителей различных антимускариновых средств, по мнению авторов, оставался одинаковым. Анализируя результаты данного исследования, следует отметить, что ГАМП может сочетаться с повышением риска сердечно-сосудистых событий. Кроме того, в работах этих авторов используются данные лечения пациентов в Дании, Швеции, Великобритании, где наиболее широко используются солифенацин и толтеродин [26]. Сравнительно малая группа пациентов получала фезотеродин, более современный препарат, продемонстрировавший в клинических исследованиях достаточно высокий уровень сердечно-сосудистой безопасности [27, 28].
Если первые препараты для лечения ГАМП ассоциировались с повышением риска когнитивных расстройств, то троспия хлорид и фезотеродин безопасны и не ухудшают показатели высшей нервной деятельности [1–3, 28, 29].
Как следует из приведенных данных, оптимальное сочетание клинической эффективности и безопасности наблюдается при применении фезотеродина.
Фезотеродин
Фезотеродин — конкурентный специфический антагонист мускариновых рецепторов как М2-, так и М3-подтипа. На фоне его применения у пациентов с ГАМП снижается число мочеиспусканий и эпизодов императивного недержания мочи, увеличивается средний объем мочи при мочеиспускании [27–30]. Препарат применяют для симптоматической терапии синдрома ГАМП. Фезотеродин быстро и интенсивно гидролизуется неспецифическими эстеразами плазмы крови до 5-гидроксиметил толтеродина (5-ГMT) — основного фармакологически активного метаболита, определяющего антимускариновую активность препарата [30].Прием пищи не оказывает клинически значимого влияния на фармакокинетику фезотеродина, препарат можно назначать вне зависимости от приема пищи. Таблетки следует принимать внутрь, проглатывая целиком, запивая жидкостью [27, 30]. Рекомендуемая начальная доза — 4 мг 1 р./сут, но она может быть увеличена до 8 мг/сут. Препарат эффективен вне зависимости от пола и возраста пациента. Благодаря пролонгированной форме выпуска максимальная концентрация 5-ГМТ наблюдается через 5 ч после приема препарата, а фармакокинетический профиль имеет сглаженную форму, что обеспечивает хорошую переносимость и низкую вероятность нежелательных явлений. При многократном применении кумуляция 5-ГMT не наблюдается. Полный терапевтический эффект развивается в период между 2–8 нед. регулярного приема препарата [26–30].
Препарат не имеет ограничений к применению, связанных с заболеваниями центральной нервной системы, поскольку практически не проникает через гематоэнцефалический барьер (ГЭБ). 5-ГМТ обладает ограниченной способностью преодолевать ГЭБ и, являясь субстратом P-гликопротеина, быстро выводится из мозга. В результате при применении фезотеродина отсутствует риск ухудшения когнитивной деятельности, включая память, что делает применение препарата предпочтительным у пожилых пациентов [29, 30]. Фезотеродин является единственным антихолинергическим препаратом, одобренным для лечения ГАМП у пожилых пациентов (оценка B — полезный по классификации FORTA) [31].
Также допускается применение фезотеродина (в отличие от остальных препаратов группы) у пациентов с тахиаритмиями (препарат не влияет на длительность интервала QT, а вероятность тахикардии при его приеме менее 1%). Закрытоугольная глаукома является противопоказанием для приема фезотеродина (в отличие от большинства препаратов группы) только при отсутствии контроля за ее течением [30].
При применении фезотеродина, так же как и других препаратов группы, необходимо учитывать, что активный метаболит подвергается превращениям с участием цитохрома CYP3A4. Это может иметь значение, если пациент одновременно принимает фезотеродин и сильные ингибиторы изофермента CYP3A4: атазанавир, кларитромицин, индинавир, итраконазол, кетоконазол, саквинавир, ритонавир. В такой ситуации доза фезотеродина не должна превышать 4 мг [30, 32]. Прием совместно с фезотеродином сильных индукторов изофермента CYP3A4 (карбамазепин, рифампицин, фенобарбитал, фенитоин, препараты зверобоя продырявленного) не рекомендуется, т. к. это может снижать эффективность лечения ГАМП [30].
Фармакологические свойства фезотеродина, подтвержденные клиническими исследованиями, обеспечивают ряд преимуществ для пациентов: высокая эффективность лечения ГАМП, оптимальная фармакокинетика и удобный режим применения, эффективность вне зависимости от пола и возраста пациента, относительно хорошая переносимость, в т. ч. у пожилых и ослабленных пациентов, отсутствие влияния на когнитивные функции. В то же время для многих пациентов определяющей является финансовая доступность препарата.
Экономические аспекты лечения ГАМП
Стоимость антимускариновых препаратов составляет лишь часть затрат, связанных с лечением ГАМП, которое сопровождается достаточно высокими расходами. В частности, пациент может испытывать потребность в средствах гигиены, ухода; многим пациенткам необходимо назначение эстрогенов. Если пациент при длительном течении заболевания не получал адекватного лечения, то ухудшается качество жизни, что может сопровождаться изменениями психоэмоционального статуса, требующими медицинской коррекции. В исследовании терапии пациентов с ГАМП в Испании изучались экономические аспекты использования антимускариновых препаратов [32]. Было установлено, что по сравнению с солифенацином и толтеродином фезотеродин был наиболее выгоден в качестве первой линии терапии ГАМП. При этом экономия средств была достигнута благодаря значительно меньшему количеству посещений врача, меньшему использованию гигроскопичных средств, а также снижению цены сопутствующего лечения. Эти данные косвенно подтверждают большую эффективность фезотеродина при ГАМП.К сожалению, оценить полную стоимость лечения ГАМП затруднительно. Кроме того, в России большинство пациентов покупают антимускариновые средства за свой счет, поэтому для них определяющей является стоимость препарата.
Для того чтобы оценить доступность лекарственной помощи пациентам, были проанализированы данные сайта apteka.ru (дата обращения: 20.03.2019).
Цены упаковки препаратов, стоимость 1 таблетки и стоимость 1 дня лечения приведены в таблице 2. Общая стоимость лечения зависит от индивидуально подобранной дозы, что также необходимо учитывать. Так, стоимость лечения пациента фезотеродином (Товиаз®) не только не выше, но, как правило, ниже, чем при использовании других антимускариновых средств. При использовании препарата в дозе 4 мг сутки лечения обойдутся в 23,11 руб., а при использовании 8 мг — в 31,67 руб.












