–Ґ—А–∞–і–Є—Ж–Є–Њ–љ–љ–Њ –≤ –њ—А–Њ–≥—А–∞–Љ–Љ–µ –ї–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—В–Њ—А—Л (–Љ–—Е–Њ–ї–Є–љ–Њ–ї–Є—В–Є–Ї–Є, β2––∞–≥–Њ–љ–Є—Б—В—Л) –Є –≥–ї—О–Ї–Њ–Ї–Њ—А—В–Є–Ї–Њ—Б—В–µ—А–Њ–Є–і—Л (–У–Ъ–°), –Њ–±–ї–∞–і–∞—О—Й–Є–µ —Г–љ–Є–≤–µ—А—Б–∞–ї—М–љ–Њ–є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О. –Э–Њ–≤—Л–µ —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ—Л –њ–Њ—П–≤–ї–µ–љ–Є–µ–Љ –љ–∞ —Д–∞—А–Љ–∞—Ж–µ–≤—В–Є—З–µ—Б–Ї–Њ–Љ —А—Л–љ–Ї–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –њ–Њ–і–∞–≤–ї—П—В—М —Б–њ–µ—Ж–Є—Д–Є—З–µ—Б–Ї–Њ–µ –≤–Њ—Б–њ–∞–ї–µ–љ–Є–µ –њ—А–Є –•–Ю–С–Ы. –Т 2010 –≥. –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М –љ–Њ–≤–Њ–≥–Њ –Ї–ї–∞—Б—Б–∞ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В (–Ф–∞–Ї—Б–∞—Б®) –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –≤ —Б—В—А–∞–љ–∞—Е –Х–≤—А–Њ—Б–Њ—О–Ј–∞ –Є –Ъ–∞–љ–∞–і—Л. –Т –Љ–∞—А—В–µ 2011 –≥. –µ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –і–ї—П –ї–µ—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –•–Ю–С–Ы –Њ–і–Њ–±—А–µ–љ–Њ –£–њ—А–∞–≤–ї–µ–љ–Є–µ–Љ –њ–Њ –Ї–Њ–љ—В—А–Њ–ї—О –Ј–∞ –њ–Є—Й–µ–≤—Л–Љ–Є –њ—А–Њ–і—Г–Ї—В–∞–Љ–Є –Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л–Љ–Є –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –°–®–Р (Food and Drug Administration (FDA)), –≤ —Б–µ–љ—В—П–±—А–µ —В–Њ–≥–Њ –ґ–µ –≥–Њ–і–∞ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В –Ј–∞—А–µ–≥–Є—Б—В—А–Є—А–Њ–≤–∞–љ –≤ –†–Њ—Б—Б–Є–є—Б–Ї–Њ–є –§–µ–і–µ—А–∞—Ж–Є–Є.
–Ь–µ—Е–∞–љ–Є–Ј–Љ –і–µ–є—Б—В–≤–Є—П
–°–Њ–≥–ї–∞—Б–љ–Њ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–Љ –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П–Љ –Ї–ї—О—З–µ–≤—Г—О —А–Њ–ї—М –≤ –њ–∞—В–Њ–≥–µ–љ–µ–Ј–µ –•–Ю–С–Ы –Є–≥—А–∞–µ—В –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є –њ—А–Њ—Ж–µ—Б—Б, –≤ —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –Ї–Њ—В–Њ—А–Њ–≥–Њ —Г—З–∞—Б—В–≤—Г–µ—В –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є —Д–Њ—Б—Д–Њ–і–Є—Н—Б—В–µ—А–∞–Ј–∞ 4––≥–Њ —В–Є–њ–∞ (–§–Ф–≠4) – —Д–µ—А–Љ–µ–љ—В, —А–µ–≥—Г–ї–Є—А—Г—О—Й–Є–є –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–і–µ–љ–Њ–Ј–Є–љ–Љ–Њ–љ–Њ—Д–Њ—Б—Д–∞—В–∞ (—Ж–Р–Ь–§). –¶–Є–Ї–ї–Є—З–µ—Б–Ї–Є–є –љ—Г–Ї–ї–µ–Њ—В–Є–і —П–≤–ї—П–µ—В—Б—П –≤—В–Њ—А–Є—З–љ—Л–Љ –≤–љ—Г—В—А–Є–Ї–ї–µ—В–Њ—З–љ—Л–Љ –њ–Њ—Б—А–µ–і–љ–Є–Ї–Њ–Љ –њ—А–Є –Њ—Б—Г—Й–µ—Б—В–≤–ї–µ–љ–Є–Є —Н—Д—Д–µ–Ї—В–Њ–≤ –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Є –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ—Л—Е —Б–Њ–µ–і–Є–љ–µ–љ–Є–є, –љ–µ –њ—А–Њ–љ–Є–Ї–∞—О—Й–Є—Е –≤–љ—Г—В—А—М –Ї–ї–µ—В–Ї–Є. –Я–Њ–і –і–µ–є—Б—В–≤–Є–µ–Љ –њ–Њ—Б–ї–µ–і–љ–Є—Е –≤ –Ї–ї–µ—В–Ї–∞—Е –∞–Ї—В–Є–≤–Є—А—Г—О—В—Б—П –Љ–µ–Љ–±—А–∞–љ–љ—Л–µ –∞–і–µ–љ–Є–ї–∞—В—Ж–Є–Ї–ї–∞–Ј—Л (–Р–¶), –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г—О—Й–Є–µ –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ —Ж–Р–Ь–§ –Є–Ј –∞–і–µ–љ–Њ–Ј–Є–љ—В—А–Є—Д–Њ—Б—Д–∞—В–∞ (–Р–Ґ–§), –≤ —А–µ–Ј—Г–ї—М—В–∞—В–µ —З–µ–≥–Њ –њ—А–Њ–Є—Б—Е–Њ–і–Є—В –љ–∞–Ї–Њ–њ–ї–µ–љ–Є–µ —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞. –Х–≥–Њ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –њ—А–Є —Н—В–Њ–Љ –Љ–љ–Њ–≥–Њ–Ї—А–∞—В–љ–Њ –њ—А–µ–≤—Л—И–∞–µ—В –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –і–µ–є—Б—В–≤—Г—О—Й–µ–є –љ–∞ –Ї–ї–µ—В–Ї—Г –±–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є –∞–Ї—В–Є–≤–љ–Њ–є —Б—Г–±—Б—В–∞–љ—Ж–Є–Є. –Т –Њ—Б–љ–Њ–≤–µ –і–µ–є—Б—В–≤–Є—П —Ж–Р–Ь–§ –ї–µ–ґ–Є—В —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Њ–≤–∞—В—М —Б –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ—А–Њ—В–µ–Є–љ–Ї–Є–љ–∞–Ј–Њ–є –Р (–Я–Ъ –Р).
–°–≤—П–Ј—Л–≤–∞–љ–Є–µ —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞ —Б —А–µ–≥—Г–ї—П—В–Њ—А–љ–Њ–є —Б—Г–±—К–µ–і–Є–љ–Є—Ж–µ–є —Д–µ—А–Љ–µ–љ—В–∞ –њ—А–Є–≤–Њ–і–Є—В –Ї –µ–≥–Њ –і–Є—Б—Б–Њ—Ж–Є–∞—Ж–Є–Є –Є –∞–Ї—В–Є–≤–∞—Ж–Є–Є –Ї–∞—В–∞–ї–Є—В–Є—З–µ—Б–Ї–Њ–є —Б—Г–±—К–µ–і–Є–љ–Є—Ж—Л, –Ї–Њ—В–Њ—А–∞—П, –Њ—Б–≤–Њ–±–Њ–і–Є–≤—И–Є—Б—М –Њ—В —А–µ–≥—Г–ї—П—В–Њ—А–љ–Њ–є —З–∞—Б—В–Є, –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В —Д–Њ—Б—Д–Њ—А–Є–ї–Є—А–Њ–≤–∞–љ–Є–µ —Н—Д—Д–µ–Ї—В–Њ—А–љ—Л—Е –±–µ–ї–Ї–Њ–≤ [4]. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –Љ–Њ–і–Є—Д–Є–Ї–∞—Ж–Є–Є –±–µ–ї–Ї–Њ–≤—Л—Е –Љ–Њ–ї–µ–Ї—Г–ї —П–≤–ї—П–µ—В—Б—П, —Б—А–µ–і–Є –њ—А–Њ—З–µ–≥–Њ, –Є —Б–љ–Є–ґ–µ–љ–Є–µ –њ—А–Њ–і—Г–Ї—Ж–Є–Є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤, –Ј–∞–Љ–µ–і–ї–µ–љ–Є–µ –Ї–ї–µ—В–Њ—З–љ–Њ–є –њ—А–Њ–ї–Є—Д–µ—А–∞—Ж–Є–Є –Є –∞–њ–Њ–њ—В–Њ–Ј–∞ –Є, –Ї–∞–Ї —Б–ї–µ–і—Б—В–≤–Є–µ, —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П (—А–Є—Б. 1).
–Ф–µ–є—Б—В–≤–Є–µ —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞ –Њ–≥—А–∞–љ–Є—З–µ–љ–Њ –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О —Д–Њ—Б—Д–Њ–і–Є—Н—Б—В–µ—А–∞–Ј—Л (–§–Ф–≠). –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј–≤–µ—Б—В–љ–Њ 11 –Є–Ј–Њ—Д–Њ—А–Љ –і–∞–љ–љ–Њ–≥–Њ —Д–µ—А–Љ–µ–љ—В–∞, –Ї–∞—В–∞–ї–Є–Ј–Є—А—Г—О—Й–µ–≥–Њ —А–∞—Б—Й–µ–њ–ї–µ–љ–Є–µ —Ж–Р–Ь–§ –Є –і—А—Г–≥–Њ–≥–Њ —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞ – –≥—Г–∞–љ–Є–љ–Љ–Њ–љ–Њ—Д–Њ—Б—Д–∞—В–∞ (—Ж–У–Ь–§), —Н—Д—Д–µ–Ї—В—Л –Ї–Њ—В–Њ—А–Њ–≥–Њ –Ј–∞—З–∞—Б—В—Г—О –њ—А–Њ—В–Є–≤–Њ–њ–Њ–ї–Њ–ґ–љ—Л —Н—Д—Д–µ–Ї—В–∞–Љ —Ж–Р–Ь–§ [6]. –§–Ф–≠ 4, 7 –Є 8––≥–Њ —В–Є–њ–Њ–≤ –Њ–±–ї–∞–і–∞—О—В —В—А–Њ–њ–љ–Њ—Б—В—М—О –Ї —Ж–Р–Ь–§, 5, 6 –Є 9––≥–Њ —В–Є–њ–Њ–≤ – –Ї —Ж–У–Ь–§. –§–µ—А–Љ–µ–љ—В—Л 1–3––≥–Њ –Є 10–11––≥–Њ —В–Є–њ–Њ–≤ –≤–Њ–Ј–і–µ–є—Б—В–≤—Г—О—В –љ–∞ –Њ–±–∞ —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є—Е –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞. –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Њ—В–і–µ–ї—М–љ—Л—Е —В–Є–њ–Њ–≤ –§–Ф–≠ –≤ –Ї–ї–µ—В–Ї–∞—Е —А–∞–Ј–ї–Є—З–љ—Л—Е –Њ—А–≥–∞–љ–Њ–≤ –Є —В–Ї–∞–љ–µ–є —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Њ—В–ї–Є—З–∞–µ—В—Б—П. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–µ–Њ–±–ї–∞–і–∞—О—Й–µ–є –Є–Ј–Њ—Д–Њ—А–Љ–Њ–є —Д–µ—А–Љ–µ–љ—В–∞, —Н–Ї—Б–њ—А–µ—Б—Б–Є—А—Г–µ–Љ–Њ–є –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–Љ–Є –Є –Є–Љ–Љ—Г–љ–љ—Л–Љ–Є –Ї–ї–µ—В–Ї–∞–Љ–Є, –Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ—Л–Љ–Є –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Є –•–Ю–С–Ы, —П–≤–ї—П–µ—В—Б—П –§–Ф–≠4. –Ф–∞–љ–љ—Л–є —В–Є–њ —Д–µ—А–Љ–µ–љ—В–∞, –≤ —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М, –Є–Љ–µ–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –њ–Њ–і—В–Є–њ–Њ–≤. –Ф–µ–є—Б—В–≤–Є–µ –≤—Б–µ—Е –њ–Њ–і—В–Є–њ–Њ–≤ —Н–љ–Ј–Є–Љ–∞ –љ–∞–њ—А–∞–≤–ї–µ–љ–Њ –љ–∞ –∞–Ї—В–Є–≤–∞—Ж–Є—О –≥–Є–і—А–Њ–ї–Є–Ј–∞ —Ж–Р–Ь–§ –Є –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –µ–≥–Њ –љ–µ–∞–Ї—В–Є–≤–љ–Њ–є —Д–Њ—А–Љ—Л – –∞–і–µ–љ–Њ–Ј–Є–љ–Љ–Њ–љ–Њ—Д–Њ—Б—Д–∞—В–∞ (–Р–Ь–§). –£–Љ–µ–љ—М—И–µ–љ–Є–µ –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Њ–≥–Њ –љ—Г–Ї–ї–µ–Њ—В–Є–і–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ –Ї–ї–µ—В–Њ–Ї, –≤ —В–Њ–Љ —З–Є—Б–ї–µ –љ–µ–є—В—А–Њ—Д–Є–ї–Њ–≤, –Ґ––ї–Є–Љ—Д–Њ—Ж–Є—В–Њ–≤ (CD8+) –Є –Љ–∞–Ї—А–Њ—Д–∞–≥–Њ–≤. –Т—Л—Б–≤–Њ–±–Њ–ґ–і–∞—П —А–∞–Ј–ї–Є—З–љ—Л–µ –Љ–µ–і–Є–∞—В–Њ—А—Л, —Н—В–Є –Ї–ї–µ—В–Ї–Є –Ј–∞–њ—Г—Б–Ї–∞—О—В –Ї–∞—Б–Ї–∞–і –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, –њ—А–Є–≤–Њ–і—П—Й–Є—Е –Ї –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—О –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є —А–∞–Ј–≤–Є—В–Є—О —Б–Є—Б—В–µ–Љ–љ–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П [7]. –Я–Њ–і–∞–≤–ї–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –§–Ф–≠4, –љ–∞–њ—А–Њ—В–Є–≤, –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–∞–Ї–Њ–њ–ї–µ–љ–Є—О –≤ –Ї–ї–µ—В–Ї–∞—Е —Ж–Р–Ь–§ –Є —А–µ–∞–ї–Є–Ј–∞—Ж–Є–Є –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤ –≥–Њ—А–Љ–Њ–љ–Њ–≤ –Є –Љ–µ–і–Є–∞—В–Њ—А–Њ–≤, –њ–Њ—Б—А–µ–і–љ–Є–Ї–Њ–Љ –Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г–ґ–Є—В —Ж–Є–Ї–ї–Є—З–µ—Б–Ї–Є–є –љ—Г–Ї–ї–µ–Њ—В–Є–і (—В–∞–±–ї. 1).
–£–Љ–µ–љ—М—И–µ–љ–Є–µ –њ—А–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї, –љ–∞–±–ї—О–і–∞–µ–Љ–Њ–µ –њ—А–Є –њ–Њ–і–∞–≤–ї–µ–љ–Є–Є –§–Ф–≠4, –Њ–њ—А–µ–і–µ–ї–Є–ї–Њ –Њ—Б–Њ–±—Л–є –Є–љ—В–µ—А–µ—Б –Ї –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—П–Љ —Д–∞—А–Љ–∞–Ї–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є—П —Д–µ—А–Љ–µ–љ—В–∞ –Ї–∞–Ї –Ї —Б–њ–Њ—Б–Њ–±—Г –≤–ї–Є—П–љ–Є—П –љ–∞ –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Є –•–Ю–С–Ы. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –Є–Ј–≤–µ—Б—В–µ–љ —А—П–і –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —Б–њ–Њ—Б–Њ–±–љ—Л—Е –±–ї–Њ–Ї–Є—А–Њ–≤–∞—В—М –і–µ–є—Б—В–≤–Є–µ –§–Ф–≠. –Ю–і–љ–Є, –љ–µ —П–≤–ї—П—П—Б—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ–Є, –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤—Г—О—В —Б —А–∞–Ј–ї–Є—З–љ—Л–Љ–Є —В–Є–њ–∞–Љ–Є —Д–µ—А–Љ–µ–љ—В–∞ (—В–µ–Њ—Д–Є–ї–ї–Є–љ), –і—А—Г–≥–Є–µ, –Њ–±–ї–∞–і–∞—П –≤—Л—Б–Њ–Ї–Њ–є —Б–µ–ї–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О, –њ–Њ–і–∞–≤–ї—П—О—В –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –Њ–і–љ–Њ–є –Є–Ј–Њ—Д–Њ—А–Љ—Л —Н–љ–Ј–Є–Љ–∞ (–Є–љ–≥–Є–±–Є—В–Њ—А –§–Ф–≠3 – –Љ–Є–ї—А–Є–љ–Њ–љ, –§–Ф–≠5 – –Є–ї–і–µ–љ–∞—Д–Є–ї). –Ф–µ–є—Б—В–≤–Є–µ —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞, —П–≤–ї—П—О—Й–µ–≥–Њ—Б—П –љ–µ—Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –≤—Б–µ—Е —В–Є–њ–Њ–≤ –§–Ф–≠ –Є, –Ї—А–Њ–Љ–µ —В–Њ–≥–Њ, –∞–љ—В–∞–≥–Њ–љ–Є—Б—В–Њ–Љ –∞–і–µ–љ–Њ–Ј–Є–љ–Њ–≤—Л—Е —А–µ—Ж–µ–њ—В–Њ—А–Њ–≤, —Б–Њ–њ—А—П–ґ–µ–љ–Њ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ –±–Њ–ї—М—И–Њ–≥–Њ —З–Є—Б–ї–∞ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л—Е —Н—Д—Д–µ–Ї—В–Њ–≤, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е —Б–ї–µ–і—Г–µ—В —Г–њ–Њ–Љ—П–љ—Г—В—М –≤–ї–Є—П–љ–Є–µ –љ–∞ —Б–Њ–Ї—А–∞—В–Є—В–µ–ї—М–љ—Г—О –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≥–ї–∞–і–Ї–Њ–є –Љ—Г—Б–Ї—Г–ї–∞—В—Г—А—Л, –Љ—Г–Ї–Њ—Ж–Є–ї–Є–∞—А–љ—Л–є –Ї–ї–Є—А–µ–љ—Б, —В–Њ–љ—Г—Б –Ї—А–Њ–≤–µ–љ–Њ—Б–љ—Л—Е —Б–Њ—Б—Г–і–Њ–≤, —З–∞—Б—В–Њ—В—Г –Є —Б–Є–ї—Г —Б–µ—А–і–µ—З–љ—Л—Е —Б–Њ–Ї—А–∞—Й–µ–љ–Є–є, –Ї–Є—Б–ї–Њ—В–љ–Њ—Б—В—М –ґ–µ–ї—Г–і–Њ—З–љ–Њ–≥–Њ —Б–Њ–і–µ—А–ґ–Є–Љ–Њ–≥–Њ –Є —В.–і. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞ –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –§–Ф–≠4, –∞ –Ј–љ–∞—З–Є—В –Є –µ–≥–Њ –њ—А–Њ—В–Є–≤–Њ–≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–є —Н—Д—Д–µ–Ї—В, –≤—Л—А–∞–ґ–µ–љ—Л –≤ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ —А–∞–Ј–≤–Є—В–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –Є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–є. –Т–∞–ґ–љ—Л–Љ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ–Љ, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞—О—Й–Є–Љ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Є–µ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —В–µ–Њ—Д–Є–ї–ї–Є–љ–∞ –њ—А–Є –•–Ю–С–Ы, —П–≤–ї—П–µ—В—Б—П —Б–љ–Є–ґ–µ–љ–Є–µ –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —Г –Ї—Г—А–Є–ї—М—Й–Є–Ї–Њ–≤.
–Я–µ—А–≤—Л–Љ —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–Љ –§–Ф–≠4 —Б—В–∞–ї —Ж–Є–ї–Њ–Љ–Є–ї–∞—Б—В, —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л–Љ –љ–µ–і–Њ—Б—В–∞—В–Ї–Њ–Љ –Ї–Њ—В–Њ—А–Њ–≥–Њ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–∞—П –∞–Ї—В–Є–≤–љ–Њ—Б—В—М –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є D––њ–Њ–і—В–Є–њ–∞ —Д–µ—А–Љ–µ–љ—В–∞. –Т–Њ–Ј–і–µ–є—Б—В–≤–Є–µ —Ж–Є–ї–Њ–Љ–Є–ї–∞—Б—В–∞ –љ–∞ –§–Ф–≠4D, –њ—А–Є—Б—Г—В—Б—В–≤—Г—О—Й—Г—О –≤ –њ–∞—А–Є–µ—В–∞–ї—М–љ—Л—Е –Ї–ї–µ—В–Ї–∞—Е —Б–ї–Є–Ј–Є—Б—В–Њ–є –ґ–µ–ї—Г–і–Ї–∞ –Є –Ї–ї–µ—В–Ї–∞—Е —А–≤–Њ—В–љ—Л—Е —Ж–µ–љ—В—А–Њ–≤, –Њ–±—Г—Б–ї–Њ–≤–Є–ї–Њ —З–∞—Б—В–Њ–µ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ —В–Њ—И–љ–Њ—В—Л –Є —А–≤–Њ—В—Л, –∞—Б—Б–Њ—Ж–Є–Є—А—Г—О—Й–Є—Е—Б—П —Б –њ—А–Є–µ–Љ–Њ–Љ –њ—А–µ–њ–∞—А–∞—В–∞, —З—В–Њ –њ–Њ—Б–ї—Г–ґ–Є–ї–Њ –њ—А–Є—З–Є–љ–Њ–є –і–ї—П –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –µ–≥–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П. –Э–Њ–≤—Л–є –њ—А–µ–і—Б—В–∞–≤–Є—В–µ–ї—М —Б–µ–ї–µ–Ї—В–Є–≤–љ—Л—Е –Є–љ–≥–Є–±–Є—В–Њ—А–Њ–≤ –§–Ф–≠4, —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В, –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В —Б–≤–Њ–µ–≥–Њ –њ—А–µ–і—И–µ—Б—В–≤–µ–љ–љ–Є–Ї–∞ –њ–Њ —Б–Є–ї–µ –≤–Њ–Ј–і–µ–є—Б—В–≤–Є—П –љ–∞ —Д–µ—А–Љ–µ–љ—В –Є, –≤ –Њ—В–ї–Є—З–Є–µ –Њ—В –љ–µ–≥–Њ, –Њ–±–ї–∞–і–∞–µ—В –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В—М—О –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –≤—Б–µ—Е –њ–Њ–і—В–Є–њ–Њ–≤ —Н–љ–Ј–Є–Љ–∞. –†–µ–Ј—Г–ї—М—В–∞—В–Њ–Љ –і–µ–є—Б—В–≤–Є—П —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ —П–≤–ї—П–µ—В—Б—П —Г–Љ–µ–љ—М—И–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –Ї–ї–µ—В–Њ–Ї, —Г—З–∞—Б—В–≤—Г—О—Й–Є—Е –≤ —А–∞–Ј–≤–Є—В–Є–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Є –•–Ю–С–Ы. –Я–Њ–і–∞–≤–ї–µ–љ–Є–µ –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є –§–Ф–≠4 –≥–ї–∞–і–Ї–Њ–Љ—Л—И–µ—З–љ—Л—Е –Ї–ї–µ—В–Њ–Ї –±—А–Њ–љ—Е–Њ–≤, –Ї–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—Ж–Є–µ–є, –≤ —Б–≤—П–Ј–Є —Б —З–µ–Љ –њ—А–µ–њ–∞—А–∞—В –љ–µ –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –і–ї—П –Ї—Г–њ–Є—А–Њ–≤–∞–љ–Є—П –±—А–Њ–љ—Е–Њ—Б–њ–∞–Ј–Љ–∞.
–§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є–Ї–∞
–≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –≤ –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ–∞ –Є—Е —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ—А–Њ—Д–Є–ї–µ–Љ. –С–ї–∞–≥–Њ–њ—А–Є—П—В–љ—Л–µ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –Њ–њ—А–µ–і–µ–ї—П—О—В –µ–≥–Њ –њ—А–Є–≤–ї–µ–Ї–∞—В–µ–ї—М–љ–Њ—Б—В—М –і–ї—П –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П. –Я—А–µ–њ–∞—А–∞—В –±—Л—Б—В—А–Њ –Є –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –њ–Њ–ї–љ–Њ (–±–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М —Б–Њ—Б—В–∞–≤–ї—П–µ—В 80%) –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –ґ–µ–ї—Г–і–Њ—З–љ–Њ––Ї–Є—И–µ—З–љ–Њ–Љ —В—А–∞–Ї—В–µ. –Ь–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –і–Њ—Б—В–Є–≥–∞–µ—В—Б—П —З–µ—А–µ–Ј 0,5–2 —З –њ–Њ—Б–ї–µ –њ—А–Є–µ–Љ–∞ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞. –Я–Њ–і–≤–µ—А–≥–∞—П—Б—М –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ—Г —Д–µ—А–Љ–µ–љ—В–∞–Љ–Є —Б–Є—Б—В–µ–Љ—Л —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –†450 (CYP 3A4 –Є 1A2), –Є–љ–≥–Є–±–Є—В–Њ—А –§–Ф–≠4 –Њ–±—А–∞–Ј—Г–µ—В –∞–Ї—В–Є–≤–љ—Л–є –Љ–µ—В–∞–±–Њ–ї–Є—В – N––Њ–Ї—Б–Є–і —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞, –њ—А–µ–≤–Њ—Б—Е–Њ–і—П—Й–Є–є –њ–Њ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–Љ –њ–∞—А–∞–Љ–µ—В—А–∞–Љ –Є—Б—Е–Њ–і–љ—Г—О –Љ–Њ–ї–µ–Ї—Г–ї—Г (—В–∞–±–ї. 2). –Ю–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ N––Њ–Ї—Б–Є–і —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ—А–Є –њ–Њ–Љ–Њ—Й–Є –Є–Ј–Њ—Д–µ—А–Љ–µ–љ—В–Њ–≤ CYP3A4 –Є 2C19. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –≤ —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–є –і–Њ–Ј–µ, –Ї–∞–Ї —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –љ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є–Љ—Л–Љ –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–µ–Љ —Д–µ—А–Љ–µ–љ—В–∞—В–Є–≤–љ–Њ–є —Б–Є—Б—В–µ–Љ—Л. –Ф–ї–Є—В–µ–ї—М–љ—Л–є –њ–µ—А–Є–Њ–і –њ–Њ–ї—Г–≤—Л–≤–µ–і–µ–љ–Є—П –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 –Є –µ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞ –њ–Њ–Ј–≤–Њ–ї—П—О—В –≤–≤–Њ–і–Є—В—М –њ—А–µ–њ–∞—А–∞—В 1 —А–∞–Ј/—Б—Г—В. –≠–ї–Є–Љ–Є–љ–∞—Ж–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –њ–Њ—З–Ї–∞–Љ–Є (70%) –≤ –≤–Є–і–µ –љ–µ–∞–Ї—В–Є–≤–љ—Л—Е –Љ–µ—В–∞–±–Њ–ї–Є—В–Њ–≤ [9].
–°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Г—З–∞—Б—В–Є–µ –≤ –Љ–µ—В–∞–±–Њ–ї–Є–Ј–Љ–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ —Д–µ—А–Љ–µ–љ—В–Њ–≤ —Б–Є—Б—В–µ–Љ—Л —Ж–Є—В–Њ—Е—А–Њ–Љ–∞ –†450 –Њ–њ—А–µ–і–µ–ї—П–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–є —Б —В–∞–Ї–Є–Љ–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –Є–љ–і—Г–Ї—В–Њ—А–∞–Љ–Є –њ–µ—З–µ–љ–Њ—З–љ—Л—Е —Д–µ—А–Љ–µ–љ—В–Њ–≤, –Ї–∞–Ї —А–Є—Д–∞–Љ–њ–Є—Ж–Є–љ, —Д–µ–љ–Њ–±–∞—А–±–Є—В–∞–ї –Є –Ї–∞—А–±–∞–Љ–∞–Ј–µ–њ–Є–љ, –∞ —В–∞–Ї–ґ–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞–Љ–Є CYP 3A4 –Є 1A2 —Н–љ–Њ–Ї—Б–∞—Ж–Є–љ–Њ–Љ –Є —Ж–Є–Љ–µ—В–Є–і–Є–љ–Њ–Љ. –Т —В–Њ –ґ–µ –≤—А–µ–Љ—П –љ–µ –њ–Њ–ї—Г—З–µ–љ–Њ –і–∞–љ–љ—Л—Е –Њ –≤–Ј–∞–Є–Љ–Њ–і–µ–є—Б—В–≤–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ —Б –≤–∞—А—Д–∞—А–Є–љ–Њ–Љ, –і–Є–≥–Њ–Ї—Б–Є–љ–Њ–Љ, —В–µ–Њ—Д–Є–ї–ї–Є–љ–Њ–Љ, –Љ–Є–і–∞–Ј–Њ–ї–∞–Љ–Њ–Љ, –∞–љ—В–∞—Ж–Є–і–∞–Љ–Є. –Э–∞–ї–Є—З–Є–µ –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –њ–µ—З–µ–љ–Њ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є (–Ї–ї–∞—Б—Б—Л –Т –Є –° –њ–Њ Child–Pugh) —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –Ј–љ–∞—З–Є–Љ—Л–Љ –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ Cmax –Є AUC0–∞ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 –Є —Б–ї—Г–ґ–Є—В –њ—А–Њ—В–Є–≤–Њ–њ–Њ–Ї–∞–Ј–∞–љ–Є–µ–Љ –і–ї—П –µ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П. –Ю–і–љ–Њ–≤—А–µ–Љ–µ–љ–љ—Л–є –њ—А–Є–µ–Љ –њ–Є—Й–Є, —Б–љ–Є–ґ–∞—П –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Г—О —Б—Л–≤–Њ—А–Њ—В–Њ—З–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞, —В–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В –≤–ї–Є—П–љ–Є—П –љ–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –µ–≥–Њ –∞–Ї—В–Є–≤–љ–Њ–≥–Њ –Љ–µ—В–∞–±–Њ–ї–Є—В–∞. –Ъ—Г—А–µ–љ–Є–µ —В–∞–Ї–ґ–µ –љ–µ –≤–ї–Є—П–µ—В –љ–∞ —Д–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–є –њ—А–Њ—Д–Є–ї—М –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 –Є –љ–µ —Б–љ–Є–ґ–∞–µ—В –µ–≥–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М [11].
–Ъ–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М
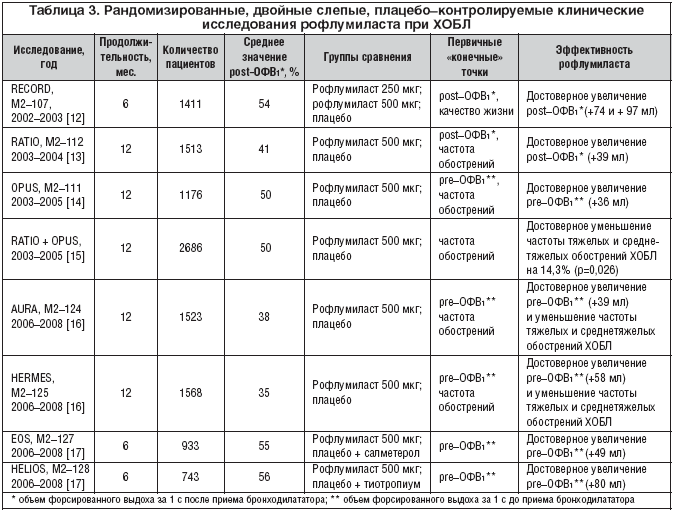
–Ф–Њ–Ї–∞–Ј–∞—В–µ–ї—М—Б—В–≤–∞ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –≤ –ї–µ—З–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е –•–Ю–С–Ы –њ–Њ–ї—Г—З–µ–љ—Л –≤ —Е–Њ–і–µ –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л—Е –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –†–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 3.
–Р–љ–∞–ї–Є–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –Њ–±—К–µ–Љ–∞ —Д–Њ—А—Б–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –≤—Л–і–Њ—Е–∞ –Ј–∞ 1 —Б (–Ю–§–Т1) –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А –§–Ф–≠4 –≤ —А–∞–Љ–Ї–∞—Е –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Є–Љ–µ–ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –љ–∞—А—Г—И–µ–љ–Є—П –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є (–Ю–§–Т1<60% –Њ—В –і–Њ–ї–ґ–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є). –Ф–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ —Г–ї—Г—З—И–µ–љ–Є–µ –≤–µ–љ—В–Є–ї—П—Ж–Є–Њ–љ–љ–Њ–є —Д—Г–љ–Ї—Ж–Є–Є –ї–µ–≥–Ї–Є—Е –Њ—В–Љ–µ—З–∞–ї–Њ—Б—М —З–µ—А–µ–Ј 4 –љ–µ–і. –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –Є —Б–Њ—Е—А–∞–љ—П–ї–Њ—Б—М –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–≥–Њ –ї–µ—З–µ–±–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞. –°–Њ–≥–ї–∞—Б–љ–Њ –Є–Љ–µ—О—Й–Є–Љ—Б—П –і–∞–љ–љ—Л–Љ —Б—В–µ–њ–µ–љ—М –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –Њ–±—Б—В—А—Г–Ї—Ж–Є–Є –Ї–Њ—А—А–µ–ї–Є—А—Г–µ—В —Б –≤—Л—А–∞–ґ–µ–љ–љ–Њ—Б—В—М—О –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –≤ –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В—П—Е, —З—В–Њ –њ–Њ–Ј–≤–Њ–ї—П–µ—В –Њ–±—К—П—Б–љ–Є—В—М —Г–≤–µ–ї–Є—З–µ–љ–Є–µ –Ю–§–Т1 –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞, –љ–µ —П–≤–ї—П—О—Й–µ–≥–Њ—Б—П –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї–Њ–Љ.
–Ю—Б–Њ–±–Њ–≥–Њ –≤–љ–Є–Љ–∞–љ–Є—П –Ј–∞—Б–ї—Г–ґ–Є–≤–∞–µ—В –≤–ї–Є—П–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 –љ–∞ —З–∞—Б—В–Њ—В—Г –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ъ–∞–Ї –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–µ–і–∞–≤–љ–Њ –њ—А–Њ–≤–µ–і–µ–љ–љ—Л–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, –Є–Љ–µ–љ–љ–Њ —З–∞—Б—В–Њ—В–∞ –Њ–±–Њ—Б—В—А–µ–љ–Є–є —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Є–Љ –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –≤–∞–ґ–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –Њ–њ—А–µ–і–µ–ї—П—О—Й–Є—Е –Ї–∞—З–µ—Б—В–≤–Њ –ґ–Є–Ј–љ–Є –±–Њ–ї—М–љ—Л—Е –•–Ю–С–Ы, —В–µ–Љ–њ—Л –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Є —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Є–µ –њ–Њ—В–µ—А–Є [18,19]. –°–Њ–≥–ї–∞—Б–љ–Њ –Љ–љ–µ–љ–Є—О –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ—Л—Е —Н–Ї—Б–њ–µ—А—В–Њ–≤, –Њ—В—А–∞–ґ–µ–љ–љ–Њ–Љ—Г –љ–∞ —Б—В—А–∞–љ–Є—Ж–∞—Е –У–ї–Њ–±–∞–ї—М–љ–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є –њ–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–µ, –ї–µ—З–µ–љ–Є—О –Є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –•–Ю–С–Ы (Global Initiative for Chronic Obstructive Lung Disease (GOLD)), —Б–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –Є —В—П–ґ–µ—Б—В–Є –Њ–±–Њ—Б—В—А–µ–љ–Є–є —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –Њ—Б–љ–Њ–≤–љ—Л—Е —Ж–µ–ї–µ–є –ї–µ—З–µ–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [20].
–Я—А–Є –Њ–±—К–µ–і–Є–љ–µ–љ–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є RATIO –Є OPUS, –±—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–µ—В —З–∞—Б—В–Њ—В—Г —В—П–ґ–µ–ї—Л—Е –Є —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ. –Э–∞–Є–±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –њ—А–µ–њ–∞—А–∞—В–∞ –Њ–Ї–∞–Ј–∞–ї—Б—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Ї–∞—А—В–Є–љ–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Ї–Њ—В–Њ—А—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є–Ј–Њ–≤–∞–ї–∞—Б—М –љ–∞–ї–Є—З–Є–µ–Љ —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞. –Я—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 —Г –і–∞–љ–љ–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Б–љ–Є–Ј–Є—В—М —З–∞—Б—В–Њ—В—Г –Њ–±–Њ—Б—В—А–µ–љ–Є–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –љ–∞ 26,2%, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Н–Љ—Д–Є–Ј–µ–Љ–Њ–є –Є –±–µ–Ј —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞ – –ї–Є—И—М –љ–∞ 1,1% [15]. –С–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –±—Л–ї–Њ –Є —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Є–љ–≥–∞–ї—П—Ж–Є–Њ–љ–љ—Л–µ –У–Ъ–° (–Ш–У–Ъ–°). –°–љ–Є–ґ–µ–љ–Є–µ —З–∞—Б—В–Њ—В—Л –Њ–±–Њ—Б—В—А–µ–љ–Є–є —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е –Ш–У–Ъ–° (–≤ —Б—Г—В–Њ—З–љ–Њ–є –і–Њ–Ј–µ, —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В–љ–Њ–є ≤ 2000 –Љ–Ї–≥ –±–µ–Ї–ї–Њ–Љ–µ—В–∞–Ј–Њ–љ–∞), –Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Є—Е –љ–µ –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е, —Б–Њ—Б—В–∞–≤–Є–ї–Њ 18,8 –Є 7,7% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ [15].
–Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –≤ —Е–Њ–і–µ 52––љ–µ–і–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –њ—А–µ–њ–∞—А–∞—В–∞, –±—Л–ї–∞ –≤—Л—П–≤–ї–µ–љ–∞ –Ї–Њ—А—А–µ–ї—П—Ж–Є—П –Љ–µ–ґ–і—Г —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л –Њ–±–Њ—Б—В—А–µ–љ–Є–є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–µ–Љ–∞ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ–Љ –Њ–±–Њ—Б—В—А–µ–љ–Є–є –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤. –С—Л–ї–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Њ, —З—В–Њ –љ–∞–ї–Є—З–Є–µ —З–∞—Б—В—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы (2 –Є –±–Њ–ї–µ–µ –≤ —В–µ—З–µ–љ–Є–µ –њ—А–µ–і—И–µ—Б—В–≤—Г—О—Й–Є—Е 12 –Љ–µ—Б.) –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –±–Њ–ї—М—И–µ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М—О –њ—А–µ–њ–∞—А–∞—В–∞ (—А–Є—Б. 2).
–Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 –≤ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї–∞–Љ–Є, –Ї–∞–Ї —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ–Њ–≤—Л—И–∞–µ—В —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М —В–µ—А–∞–њ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ґ–∞–Ї, –і–Њ–±–∞–≤–ї–µ–љ–Є–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ (500 –Љ–Ї–≥ 1 —А–∞–Ј/—Б—Г—В.) –Ї —В–Є–Њ—В—А–Њ–њ–Є—Г–Љ—Г –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ–Њ–≤—Л—Б–Є—В—М –њ—А–µ–±—А–Њ–љ—Е–Њ–і–Є–ї–∞—В–∞—Ж–Є–Њ–љ–љ—Л–є –Ю–§–Т1 –њ–Њ —Б—А–∞–≤–љ–µ–љ–Є—О —Б –њ–ї–∞—Ж–µ–±–Њ [17]. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ—А–Є–љ–Є–Љ–∞–≤—И–Є—Е β2––∞–≥–Њ–љ–Є—Б—В—Л –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П, —В–∞–Ї–ґ–µ —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–ї–Њ—Б—М –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–ї—Г—З—И–µ–љ–Є–µ–Љ –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –њ—А–Њ—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є —Б–љ–Є–ґ–µ–љ–Є–µ–Љ —З–∞—Б—В–Њ—В—Л —В—П–ґ–µ–ї—Л—Е –Є —Б—А–µ–і–љ–µ—В—П–ґ–µ–ї—Л—Е –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы (—А–Є—Б. 3).
–Я—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є
–Т 2011 –≥. –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –і–∞–љ–љ—Л–µ –Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –≤ —Е–Њ–і–µ –∞–љ–∞–ї–Є–Ј–∞ 14 –њ–ї–∞—Ж–µ–±–Њ––Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (—В–∞–±–ї. 4). –°–Њ–≥–ї–∞—Б–љ–Њ –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –і–∞–љ–љ—Л–Љ, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Є–µ–Љ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 –∞—Б—Б–Њ—Ж–Є–Є—А—Г–µ—В—Б—П —Б –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є–µ–Љ –і–Є–∞—А–µ–Є –Є —В–Њ—И–љ–Њ—В—Л (10,1 –Є 5,2% —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –Љ–Њ–ґ–µ—В –±—Л—В—М —Б–≤—П–Ј–∞–љ–Њ —Б —А–∞–Ј–≤–Є—В–Є–µ–Љ —В–∞–Ї–Є—Е –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є, –Ї–∞–Ї –≥–Њ–ї–Њ–≤–Њ–Ї—А—Г–ґ–µ–љ–Є–µ, –≥–Њ–ї–Њ–≤–љ–∞—П –±–Њ–ї—М, –±–µ—Б—Б–Њ–љ–љ–Є—Ж–∞, –њ–Њ–≤—Л—И–µ–љ–Є–µ–Љ —А–Є—Б–Ї–∞ –њ—Б–Є—Е–Є—З–µ—Б–Ї–Є—Е —А–∞—Б—Б—В—А–Њ–є—Б—В–≤. –Э–µ –њ–Њ–ї—Г—З–µ–љ–Њ –і–∞–љ–љ—Л—Е –Њ –≤–ї–Є—П–љ–Є–Є –њ—А–µ–њ–∞—А–∞—В–∞ –љ–∞ —З–∞—Б—В–Њ—В—Г –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –Є–љ—Д–µ–Ї—Ж–Є–є –і—Л—Е–∞—В–µ–ї—М–љ—Л—Е –њ—Г—В–µ–є. –°–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л–µ —П–≤–ї–µ–љ–Є—П (–Э–ѓ), —Б–≤—П–Ј–∞–љ–љ—Л–µ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞, –≤–Њ–Ј–љ–Є–Ї–∞—О—В, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ –њ–µ—А–≤—Л–µ –љ–µ–і–µ–ї–Є –ї–µ—З–µ–љ–Є—П –Є –≤ –і–∞–ї—М–љ–µ–є—И–µ–Љ —А–∞–Ј—А–µ—И–∞—О—В—Б—П, –љ–µ —В—А–µ–±—Г—П –Њ—В–Љ–µ–љ—Л –њ—А–µ–њ–∞—А–∞—В–∞ [11].
–Т —Е–Њ–і–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –±—Л–ї –≤—Л—П–≤–ї–µ–љ –і–Њ—Б—В–∞—В–Њ—З–љ–Њ –љ–µ–Њ–ґ–Є–і–∞–љ–љ—Л–є —Н—Д—Д–µ–Ї—В –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 – —Б–љ–Є–ґ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –љ–∞–±–ї—О–і–∞—О—Й–µ–µ—Б—П, –Ї–∞–Ї –њ—А–∞–≤–Є–ї–Њ, –≤ —В–µ—З–µ–љ–Є–µ –њ–µ—А–≤—Л—Е 6 –Љ–µ—Б. –ї–µ—З–µ–љ–Є—П. –Ґ–∞–Ї, —Б–Њ–≥–ї–∞—Б–љ–Њ –і–∞–љ–љ—Л–Љ, –њ–Њ–ї—Г—З–µ–љ–љ—Л–Љ –≤ —Е–Њ–і–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є AURA –Є HERMES, –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В, –і–∞–љ–љ—Л–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Г–Љ–µ–љ—М—И–Є–ї—Б—П –≤ —Б—А–µ–і–љ–µ–Љ –љ–∞ 2,1 –Ї–≥ [16]. –Э–∞–Є–±–Њ–ї—М—И–∞—П –њ–Њ—В–µ—А—П –Љ–∞—Б—Б—Л —В–µ–ї–∞ –Њ—В–Љ–µ—З–∞–ї–∞—Б—М —Б—А–µ–і–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Б—В—А–∞–і–∞–≤—И–Є—Е –Њ–ґ–Є—А–µ–љ–Є–µ–Љ (–Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞ >30 –Ї–≥/–Љ2) (—А–Є—Б. 4).
–≠—В–Њ—В —Н—Д—Д–µ–Ї—В –Њ–±—Г—Б–ї–Њ–≤–ї–µ–љ, –≤ –Њ—Б–љ–Њ–≤–љ–Њ–Љ, –њ—А—П–Љ—Л–Љ –ї–Є–њ–Њ–ї–Є—В–Є—З–µ—Б–Ї–Є–Љ –і–µ–є—Б—В–≤–Є–µ–Љ –њ—А–µ–њ–∞—А–∞—В–∞. –Я—А–µ–Ї—А–∞—Й–µ–љ–Є–µ –њ—А–Є–µ–Љ–∞ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞, —Б–Њ–≥–ї–∞—Б–љ–Њ –Є–Љ–µ—О—Й–Є–Љ—Б—П –і–∞–љ–љ—Л–Љ, —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ –Є—Б—Е–Њ–і–љ–Њ–є –Љ–∞—Б—Б—Л —В–µ–ї–∞.
–Ф–Њ–Ј–Є—А–Њ–≤–Ї–∞ –Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ
–†–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В –љ–∞–Ј–љ–∞—З–∞–µ—В—Б—П –≤–Ј—А–Њ—Б–ї—Л–Љ –≤–љ—Г—В—А—М –њ–Њ 500 –Љ–Ї–≥ 1 —А–∞–Ј/—Б—Г—В., –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –њ—А–Є–µ–Љ–∞ –њ–Є—Й–Є. –£ –њ–Њ–ґ–Є–ї—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –љ–∞–ї–Є—З–Є–Є –њ–Њ—З–µ—З–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В–Є –Ї–Њ—А—А–µ–Ї—Ж–Є—О –і–Њ–Ј—Л –њ—А–µ–њ–∞—А–∞—В–∞ –њ—А–Њ–≤–Њ–і–Є—В—М –љ–µ —В—А–µ–±—Г–µ—В—Б—П.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Я–Њ—П–≤–ї–µ–љ–Є–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –≤ –∞—А—Б–µ–љ–∞–ї–µ —Б—А–µ–і—Б—В–≤, –Є—Б–њ–Њ–ї—М–Ј—Г—О—Й–Є—Е—Б—П –і–ї—П –ї–µ—З–µ–љ–Є—П –•–Ю–С–Ы, —А–∞—Б—И–Є—А—П–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є —Д–∞—А–Љ–∞–Ї–Њ—В–µ—А–∞–њ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –њ–Њ–Ј–≤–Њ–ї—П—П –≤–Њ–Ј–і–µ–є—Б—В–≤–Њ–≤–∞—В—М –љ–∞ –µ–≥–Њ –њ–∞—В–Њ–≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є–µ –Љ–µ—Е–∞–љ–Є–Ј–Љ—Л. –Ъ–∞–Ї —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –Є–љ–≥–Є–±–Є—В–Њ—А–∞ –§–Ф–≠4 –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ—А–∞–≤–і–∞–љ–љ–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Б–Є–Љ–њ—В–Њ–Љ–∞–Љ–Є —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –±—А–Њ–љ—Е–Є—В–∞, —В—П–ґ–µ–ї–Њ–є –±—А–Њ–љ—Е–Є–∞–ї—М–љ–Њ–є –Њ–±—Б—В—А—Г–Ї—Ж–Є–µ–є (–Ю–§–Т1<50%) –Є —З–∞—Б—В—Л–Љ–Є –Њ–±–Њ—Б—В—А–µ–љ–Є—П–Љ–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П (≥2/12 –Љ–µ—Б.). –°–Њ–≥–ї–∞—Б–љ–Њ —Б—Г—Й–µ—Б—В–≤—Г—О—Й–Є–Љ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П–Љ –њ–Њ –ї–µ—З–µ–љ–Є—О –•–Ю–С–Ы, –њ—А–µ–њ–∞—А–∞—В –Љ–Њ–ґ–µ—В –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М—Б—П –≤ –Ї–∞—З–µ—Б—В–≤–µ —Б—А–µ–і—Б—В–≤–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Г –љ–∞–Є–±–Њ–ї–µ–µ —В—П–ґ–µ–ї–Њ–є –Ї–∞—В–µ–≥–Њ—А–Є–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (–≥—А—Г–њ–њ–∞ D) [20].
![–†–Є—Б. 1. –†–Њ–ї—М —Д–Њ—Б—Д–Њ–і–Є—Н—Б—В–µ—А–∞–Ј—Л 4 –≤ —А–∞–Ј–≤–Є—В–Є–Є –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П –њ—А–Є –•–Ю–С–Ы [5]](/data/articles/Image/t20/n26/1339-1.gif)
![–Ґ–∞–±–ї–Є—Ж–∞ 1. –≠—Д—Д–µ–Ї—В—Л, —А–∞–Ј–≤–Є–≤–∞—О—Й–Є–µ—Б—П –њ—А–Є –Є–љ–≥–Є–±–Є—А–Њ–≤–∞–љ–Є–Є –§–Ф–≠4 [8]](/data/articles/Image/t20/n26/1339-2.gif)
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –§–∞—А–Љ–∞–Ї–Њ–Ї–Є–љ–µ—В–Є—З–µ—Б–Ї–Є–µ —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –Є NвАУ–Њ–Ї—Б–Є–і —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ [10]](/data/articles/Image/t20/n26/1339-3.gif)
![–†–Є—Б. 2. –Т–ї–Є—П–љ–Є–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –љ–∞ —З–∞—Б—В–Њ—В—Г –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы [21]](/data/articles/Image/t20/n26/1339-4.gif)
![–†–Є—Б. 3. –Т–ї–Є—П–љ–Є–µ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є (—А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В –Є –±—А–Њ–љ—Е–Њ–ї–Є—В–Є–Ї–Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–µ–є—Б—В–≤–Є—П) –љ–∞ —З–∞—Б—В–Њ—В—Г –Њ–±–Њ—Б—В—А–µ–љ–Є–є –•–Ю–С–Ы [11]](/data/articles/Image/t20/n26/1339-6.gif)
![–†–Є—Б. 4. –Ш–Ј–Љ–µ–љ–µ–љ–Є–µ –Љ–∞—Б—Б—Л —В–µ–ї–∞ –њ—А–Є –њ—А–Є–µ–Љ–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ [16] (–Ш–Ь–Ґ вАУ –Є–љ–і–µ–Ї—Б –Љ–∞—Б—Б—Л —В–µ–ї–∞)](/data/articles/Image/t20/n26/1339-7.gif)
![–Ґ–∞–±–ї–Є—Ж–∞ 4. –І–∞—Б—В–Њ—В–∞ –≤–Њ–Ј–љ–Є–Ї–љ–Њ–≤–µ–љ–Є—П –љ–µ–ґ–µ–ї–∞—В–µ–ї—М–љ—Л—Е —А–µ–∞–Ї—Ж–Є–є –њ—А–Є –њ—А–Є–µ–Љ–µ —А–Њ—Д–ї—Г–Љ–Є–ї–∞—Б—В–∞ –≤ —Е–Њ–і–µ –њ–ї–∞—Ж–µ–±–ЊвАУ –Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, % [11]](/data/articles/Image/t20/n26/1339-8.gif)
–Ы–Є—В–µ—А–∞—В—Г—А–∞
1. Atsou K., Chouaid C., Hejblum G. Variability of the chronic obstructive pulmonary disease key epidemiological data in Europe: systematic review // BMC Medicine. 2011. Vol. 9. –†. 7.
2. Menezes A.M., Perez–Padilla R., Jardim J.R., et al. Chronic obstructive pulmonary disease in five Latin American cities (the PLATINO study): A prevalence study // Lancet. 2005. Vol. 366. –†. 1875–1881.
3. World Health Organisation Website. Chronic Obstructive Pulmonary Disease http://www.who.int./ respiratory/copd.
4. Houslay MD: Underpinning compartmentalised cAMP signalling through targeted cAMP breakdown // Trends Biochem Sci. 2010. Vol. 35. –†. 91–100.
5. Rabe KF. Roflumilast for the treatment of chronic obstructive pulmonary disease // Expert Rev Respir Med. 2010. Vol. 4 (5). –†. 543–555.
6. Jeon Y., Heo Y., Kim C. et al. Phosphodiesterase: overview of protein structures, potential therapeutic applications and recent progress in drug development // Cell. Mol. Life Sci. 2005. Vol. 62 (11). –†. 1198–1220.
7. Barnes P.J., Hansel T.T. Prospects for new drugs for chronic obstructive pulmonary disease // Lancet. 2004. Vol. 364. –†. 985–996.
8. Page C.P., Spina D. Selective PDE inhibitors as novel treatments for respiratory diseases // Curr Opin Pharmacol. 2012. Vol. 12. –†. 275–286.
9. Tenor H.H.A., Beume R., Lahu G., Zech K., Bethke T. Pharmacology, clinical efficacy and tolerability of phosphodiesterase–4 inhibitors: impact of human pharmacokinetics. In: Francis SH et al. (eds). In “Phosphodiesterases as drug targets, handbook of experimental pharmacology 204”. Berlin Heidelberg: Springer–Verlag, 2011.
10. Taegtmeyera –Р.–Т., Leuppib J.D., Kullak–Ublicka G.A. Roflumilast – a phosphodiesterase–4 inhibitor licensed for add–on therapy in severe COPD // Swiss Med Wkly. 2012. Vol. 142: w13628.
11. Rabe K.F. Update on roflumilast, a phosphodiesterase 4 inhibitor for the treatment of chronic obstructive pulmonary disease // Br J Pharmacol. 2011. Vol. 163 (1). –†. 53–67.
12. Rabe K.F., Bateman E.D., O’Donnell D. et al. Roflumilast – an oral antiinflammatory treatment for chronic obstructive pulmonary disease: a randomised controlled trial // Lancet. 2005. Vol. 366. –†. 563–571.
13. Calverley P.M., Sanchez–Toril F., McIvor A. et al. Effect of 1–year treatment with roflumilast in severe chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 2007. Vol. 176 (2). –†. 154–161.
14. FDA. Centre for Drug Evaluation and Research. Application number 022522Orig1s000. Medical Review(s). Available at http://wwwaccessdatafdagov/drugsatfda_docs/nda/2011/022522Orig1s000MedRpdf.
15. Rennard SI, Calverley PM, Goehring UM, et al. Reduction of exacerbations by the PDE4 inhibitor roflumilast – the importance of defining different subsets of patients with COPD // Respir Res. 2011. Vol. 12. –†. 18.
16. Calverley P.M., Rabe K.F., Goehring U.M. et al. Roflumilast in symptomatic chronic obstructive pulmonary disease: two randomised clinical trials // Lancet. 2009. Vol. 374. –†. 685–694.
17. Fabbri L.M., Calverley P.M., Izquierdo–Alonso J.L. et al. Roflumilast in moderate–to–severe chronic obstructive pulmonary disease treated with longacting bronchodilators: two randomised clinical trials // Lancet. 2009. Vol. 374. –†. 695–703.
18. Hurst J.R., Vestbo J., Anzueto A. et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease // N Engl J Med. 2010. Vol. 363. –†. 1128–1138.
19. Soler–Cataluna J.J. Martinez–Garcia M.A., Serra P.C. Frequent exacerbations contribute to the mortality of COPD // Thorax. 2005. Vol. 64. –†. 925–931.
20. Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD) 2011. Available from: http://www.goldcopd.org/.
21. Bateman E., Calverley P.M., Fabbri L.M. et al. Efficacy of roflumilast in patients with a history of frequent exacerbations: Pooled data from pivotal 12'mont studies. European Respiratory Society Annual Congress 2010. Barcelona, 2010. P. 4003.








.gif)



