Менее чем за 20 лет число больных СД в мире увеличилось в 6 раз. Согласно прогнозам экспертов, при сохранении таких темпов роста к 2030 г. численность больных СД на планете будет составлять более 380 млн человек.
Большая социальная значимость СД состоит в том, что он приводит к ранней инвалидизации и летальности в связи с поздними сосудистыми осложнениями диабета, в числе которых микроангиопатии (ретинопатия и нефропатия), макроангиопатии (инфаркт миокарда, инсульт, гангрена нижних конечностей), нейропатии. Риск развития ишемической болезни сердца и инфаркта миокарда возрастает более чем в 2 раза, патологии почек – в 17 раз, гангрены нижних конечностей – в 20 раз, гипертонической болезни – более чем в 3 раза. Более 40% всех не обусловленных травмой ампутаций нижних конечностей проводится в связи с синдромом диабетической стопы и гангреной нижних конечностей [4]. Дистальная полинейропатия и автономная нейропатия являются причинами низкого качества жизни, нарушения трудоспособности и инвалидизации у большого количества больных СД, поэтому крайне важно вовремя диагностировать нейропатию и принять соответствующие меры лечения.
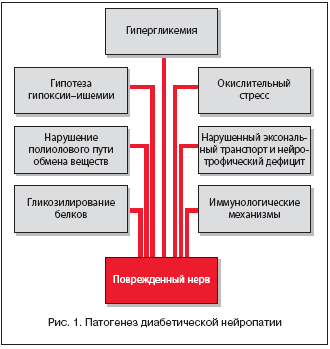
В настоящее время обсуждается комплекс частично связанных между собой различных патофизиологических и патобиохимических механизмов, которые имеют значение в патогенезе диабетической нейропатии (рис. 1). Они приводят к метаболическим или сосудистым изменениям, которые первоначально проявляются обратимыми функциональными повреждениями нервов, а впоследствии – серьезными морфологическими дефектами вплоть до необратимых изменений.
Не подлежит сомнению, что в патогенезе диабетической полинейропатии (ДПН) первостепенное значение имеет гипергликемия, которая способна повреждать как сами нервы, так и эндонейральные кровеносные сосуды. Повышенное содержание глюкозы выявляется не только в крови, но и в поврежденных органах–мишенях, например в нервных клетках. Так как глюкоза способна проникать в нервную клетку независимо от инсулина, она может не в полной мере включаться в процесс гликолиза, следствием чего является активация полиолового пути обмена веществ. В результате повышения активности ключевого фермента альдозоредуктазы образуется повышенное количество сорбитола. Он медленно диффундирует из нервных клеток или окисляется сорбитолдегидрогеназой с образованием фруктозы. Именно внутриклеточное накопление сорбитола является причиной различных повреждений нервов. Так, при активации полиолового пути обмена веществ происходит истощение запасов «вторичного мессенджера» миоинозитола. Кроме того, обсуждается возможность нарушения образования оксида азота (NO) как одного из патогенных последствий накопления сорбитола.
Следующим важным моментом в патогенезе ДПН является накопление в тканях свободных радикалов, значение которых заключается в их повышенной способности к химическим реакциям. Из–за взаимодействия с ненасыщенными соединениями они нарушают структуру ферментных белков, липидов клеточных мембран и ДНК. При экспериментально воспроизведенной диабетической нейропатии седалищных нервов установлены повышенные концентрации малонового диальдегида, являющегося маркером окислительного стресса. Кроме того, повышенный оксидативный стресс рассматривается как причина дегенерации аксонов. Атрофия нервных волокон и дегенерация аксонов при ДПН сопровождаются эндоневральными микрососудистыми изменениями, что составляет основу гипотезы гипоксии–ишемии. Исходные предпосылки заключаются в том, что первоначальное нарушение кровоснабжения происходит в области микрососудистого русла. Оно обусловливает развитие гипоксии и влечет за собой атрофию нервных волокон.
Важную роль в патогенезе ДПН играет неферментное гликозилирование. В процессе реакции Майлларда (Maillard) между молекулами различных сахаров (включая глюкозу) и аминогруппами белков, липидов и ДНК происходит образование обратимых Шиффовых оснований. Из них образуются продукты Амадори (Amadori) и далее, пройдя серию химических превращений, дают конечные продукты ускоренного гликозилирования (advanced glycosylation end products – AGE–продукты). Они могут образовываться на промежуточной ступени реактивных дикарбониловых соединений в процессе окисления углеводов. AGE–продукты – класс чрезвычайно гетерогенных веществ, которые обладают характерной флюоресценцией. In vivo до настоящего времени лишь незначительную часть таких соединений смогли идентифицировать с помощью определения их химической структуры. Некоторые AGE–продукты являются субстанциями, обладающими повышенной способностью к химическим реакциям. С помощью внутримолекулярных и межмолекулярных поперечных связей они вызывают необратимые изменения структур, в т.ч. белков, и приводят к нарушениям их функций. В результате присоединения к рецепторным белкам образуются RAGEs–продукты (receptor agglutinat glucosulation), которые вызывают ухудшение различных клеточных функций, в том числе экспрессию генов и внутриклеточную сигнальную трансдукцию [13].
Вследствие гликозилирования базальных мембран кровеносных сосудов развиваются функциональные сосудистые нарушения (ретинопатия, нефропатия) [19].
Гликозилирование может происходить на миелиновых оболочках нервов, и, возможно, таким образом способствовать функциональным нарушениям нейронов, которые встречаются при СД.
Проницаемость барьера кровь–нерв для гликозилированного альбумина, который образуется у пациентов с диабетической нейропатией, может быть повышенной. Гликозилированные макромолекулы, повышенные концентрации которых отмечаются в эндоневрии, способны посредством прямого токсического эффекта, осмотических изменений или иммунологических механизмов приводить к возникновению нейропатии. Процессу гликозилирования подвергаются также белки цитоскелета в периферических нервах, что приводит к нарушению аксонального транспорта.
Важная роль в патогенезе ДПН также отводится эндогенному фактору роста нервной ткани (ФРН) [8]. Этот нейротрофический белок синтезируется в различных тканях, воспринимается через специфические рецепторы в нервных волокнах и переносится посредством ретроградного транспорта в перикарион нервной клетки. ФРН имеет ключевое значение для роста и функции нейронов.
Представленные патогенетические модели указывают на то, что развитие ДПН является следствием многофакторных событий, в которых центральную роль играет глюкозотоксичность.
Наиболее перспективными направлениями в лечении ДПН следует считать применение средств, действие которых затрагивает и патогенетические механизмы, и клинические проявления поздних осложнений СД. Посколь¬ку подобной направленностью действия обладают нейротропные витамины группы B в высоких дозах, то препаратами выбора можно считать именно их [11]. Но водорастворимые формы витамина В1 в используемых дозах малоэффективны, так как обладают низкой биодоступностью. Драже Мильгамма® композитум содержит уни¬кальное липофильное вещество бенфотиамин, обладающее тиаминоподобной активностью и практически 100% биодоступностью (100 мг) и пиридоксин (100 мг).
Бенфотиамин в отличие от водорастворимых форм витамина В1 в 10 раз быстрее накапливается в тканях, и почти 100% дозы переходит в активную форму. Бенфотиамин – это жирорастворимое пролекарство. После всасывания он превращается в биологически активную коферментную форму тиаминдифосфат (ТДФ). В форме кофермента бенфотиамин является незаменимым в углеводном обмене и обеспечивает энергоснабжение нервных клеток. Так как нервные клетки получают энергию преимущественно в результате окисления углеводов, они особенно восприимчивы к нарушениям углеводного обмена. По этой причине бенфотиамин можно смело назвать «защитником нервов».
В многочисленных клинических исследованиях было установлено, что после приема бенфотиамина концентрации тиамина и ТДФ в крови, эритроцитах и спинномозговой жидкости достигают высоких значений. Высокие концентрации активного вещества, которые необходимы для оказания фармакологического действия, достижимы только при пероральном приеме липофильного бенфотиамина.
В рамках клинического исследования 35 больных СД 1–го и 2–го типов с симптоматичной дистально симметричной полинейропатией в течение 90 суток получали бенфотиамин–содержащий комбинированный препарат.
На 0–е, 7–е, 45–е и 90–е сутки с помощью определения а–ЭТК (коэффициент активации эритроцитарной транскетолазы) у пациентов оценивался тиаминовый статус. Значения а–ЭТК более 1,22 рассматриваются как пограничный уровень недостаточного обеспечения тиамином. При первом измерении не было выявлено никаких признаков тиаминового дефицита. У пациентов, получавших бенфотиамин, уже через неделю было выявлено 8– и 25–кратное повышение уровня содержания тиамина в гемолизате или плазме (p ≤0,05) – показатели вследствие более низких значений а–ЭТК (табл. 1). Была достигнута оптимизация обеспечения тиамином в течение всего срока исследования, в то время как при назначении плацебо уже на 7–й день наблюдалось ухудшение тиаминового статуса (p ≤0,05). Согласно полученным результатам, несмотря на начальные «нормальные» показатели крови, назначение бенфотиамина больным СД позволяет достигать у них значительного улучшения тиаминового статуса [15]. Фармакодинамический эффект или клиническая эффективность бенфотиамина подтверждались в этом исследовании улучшением скорости проведения по нерву.
Эффективность бенфотиамина при ДПН подтвержде¬на в плацебо–контролируемых двойных слепых исследованиях.
В исследовании Ледерманна (Ledermann) у 20 пациентов с ДПН применялся бенфотиамин в ежедневной дозе 320 мг (в сочетании с витамином В6 и витамином В12) или плацебо [10]. В качестве изучаемых па¬раметров использовались субъективные критерии (показатель невропатии по Katzenwadel) и объективные величины (измерение вибрационного порога с помощью калиброванного камертона).
В ходе терапии уже через 3 недели наступало значительное улучшение показателей нейропатии, которое фиксировалось с помощью шкалы нейропатических нарушений (р<0,01) и вибрационных ощущений (р<0,01). Отмечено уменьшение болевых ощущений (р<0,01) и расстройств чувствительности (р<0,05). Предпочтение как врачами, так и пациентами отдавалось в равной степени те¬рапии с использованием Мильгамма® композитум (р<0,015). При этом никаких нежелатель¬ных действий препарата не наблюдалось.
В исследовании Штраке (Stracke) эффективность бенфотиамина подтверждена также с помощью оценки объективного параметра – скорости проведения импульса по нерву [16]. У 24 больных диабетом 1–го и 2–го типов с симптоматической ДПН более 3 мес. применялись драже Мильгамма® композитум. В течение первых 2 недель пациенты получали 320 мг бенфотиамина в сутки, затем вплоть до 12 недели – ежедневно по 120 мг. Через 3 мес. скорость проведения по нерву в N. peroneus в группе с активным лечением значительно улучшилась (р<0,006), а в группе плацебо, напротив, ухудшилась. В N. medianus было зарегистрировано сходное действие, однако оно не было статистически достоверным. Параллельно с данными резуль¬татами отмечались положительные тенденции при определении вибрационного порога, которые улучшились примерно на 30%. В противоположность этому вибрационные ощущения в группе плацебо ухудшились примерно на 32%.
В исследовании BEDIP (BEnfotiamine in the treatment of Diabetic Polyneuropathy) 40 пациентам с диабетом 1–го или 2–го типа и полинейропатией назначалось по 400 мг бенфотиамина в сутки или плацебо сроком более 3 недель [12,13]. Балльная оценка по показателю нейропатии (по Katzenwadel) изначаль¬но была повышена, кроме того, отмечались нарушения вибрационного порога. В процессе лечения бенфотиамином балльная оценка по невропатической шкале существен¬но улучшалась. Отчетливых измене-ний в вибрационных ощущениях не происходило, однако наблюдалось значительное уменьшение боли. Побочных эффектов, связанных с применением бенфотиамина, зафиксировано не было. Уровень HbAlc и профиль сахара в крови оставались постоянными на протяжении всего периода исследования. Это иссле-дование подтвердило результаты двух ранее проведенных рандомизированных контролируемых исследований и отчетливо продемонстрировало дополнитель¬ный благоприятный эффект бенфотиамина у пациентов с ДПН.
Наряду с описанными выше эффектами бенфотиамину и пиридоксину может быть свойственно также антиноцицептивное действие. Такие исследования в большинстве случаев проводились в сочетании с цианокобаламином. Возможными точками приложения действия являлись непосредственно болевые рецепторы, чувствительность которых варьирует в результате влияния различных тканевых гормонов (например, брадикинина) и нейропептидов. Сенсибилизация болевых рецепторов проявляется, например, как воспалительная гипералгезия (повышенная болевая чувствительность). И здесь возможна взаимосвязь, так как недостаток тиамина и пиридоксина сопровождается симптомами воспаления кожи и слизистых оболочек. Наряду с этим в стволе головного мозга имеются несколько областей, которые через нисходящие пути в спинном мозге осуществляют тормозящее влияние на вторичный нейрон и таким образом вызывают притупление болевой чувствительности. Вероятно, медиатором в данном случае выступает серотонин. В то время как пиридоксальфосфат участвует в синтезе серотонина в качестве кофермента, тиамин выполняет важную функцию при его депонировании и транспорте. Именно здесь, возможно, находится точка реализации анальгетического действия фармакологических доз тиамина и пиридоксина.
Следует также подчеркнуть влияние высоких доз нейротропных витаминов группы B на регенерацию поврежденных нервов. При экспериментальном аллергическом неврите в первую очередь нарушается миелиновый обмен. В этом случае происходит активация фосфолипазы–A, следствием чего является чрезмерный гидролиз эфиров жирных кислот, а также оказание влияния на жидкую субстанцию миелиновых оболочек. Одновременно происходит активация ацилтрансферазы.
Одновременное применение нейротропных витаминов группы В при использовании данной модели сопровождается более поздним и ослабленным проявлением неврологической симптоматики, причем результаты указывают на то, что при этом стимулируется «восстановительный механизм» [17]. В экспериментальных исследованиях пришли к заключению, что способствующие регенерации свойства бенфотиамина, пиридоксина и цианокобаламина основаны на фармакологических эффектах, характерных для высоких доз этих витаминов, и не зависящих от их дефицита. Возможно, бенфотиамин посредством усиления энергообеспечения в форме АТФ поддерживает аксоплазматический транспорт, в то время как пиридоксин участвует в синтезе транспортных белков, а цианокобаламин обеспечивает доставку жирных кислот для клеточных мембран и миелиновой оболочки [14].
Результаты самых новых исследований подтверждают, что ТДФ, а также витамин В6 могут предотвращать образование конечных продуктов ускоренного гликозилирования белков (AGE–продуктов), которое представляет собой важный патогенетически активный механизм токсичности глюкозы при СД и ДПН [5,6].
В исследованиях после инкубации клеточных культур с высокими концентрациями глюкозы (28 ммоль/л) наблюдались уменьшенная клеточная пролиферация и увеличенное образование лактата по сравнению с физиологическими концентрациями глюкозы (5,6 ммоль/л). В этих исследованиях использовались клетки сетчатки быков (BREC – bovine retinacels) и клетки эндотелия пупочной вены человека (HUVEC – human umbilikal vein endothelial). Патологические изменения при глюкозной нагрузке предотвращались в клеточных культурах путем дополнительного введения тиамина (150 ммоль/л). В то время как при концентрации глюкозы 28 ммоль/л образовывалось повышенное количество AGE–продуктов (p ≤0,05), в клеточных культурах с добавлением тиамина происходило лишь минимальное повышение их содержания. Не отмечалось существенных различий содержания AGE–продуктов в клеточных культурах при концентрации глюкозы 5,6 ммоль/л с тиамином и без него. Авторы объясняют ингибирование образования AGE–продуктов как результат стимуляции тиамином – посредником окислительного расщепления глюкозы в пентозо–фосфатном и цитратном циклах [9].
В экспериментальных исследованиях изучалось влияние бенфотиамина на развитие ретинопатии, нефропатии и дисфункции сосудистого эндотелия. Международным исследовательским группам в настоящее время удалось экспериментально подтвердить терапевтическое значение бенфотиамина для лечения соответствующих заболеваний. В основе обоих заболеваний лежит общий патогенетический механизм, который был исследован международной рабочей группой Хаммеса [7].
Бенфотиамин
при диабетической ретинопатии
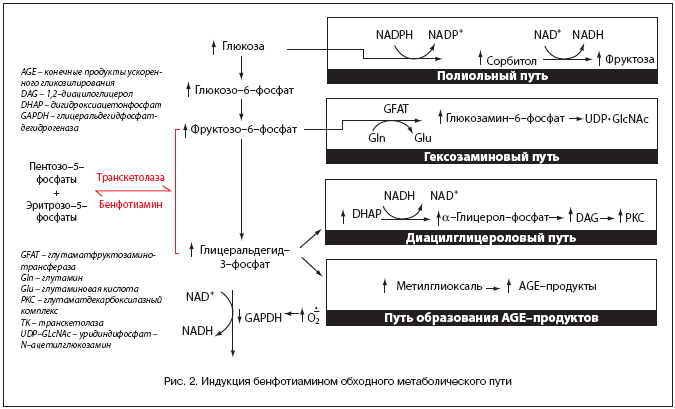
Бенфотиамин блокирует патобиохимические механизмы окисления глюкозы. Это осуществляется за счет активации фермента транскетолазы, активность которого у больного сахарным диабетом снижена.
Активность транскетолазы под влиянием бенфотиамина увеличивается на 400% и, таким образом, устраняется «задержка утилизации». В результате происходит нормализация метаболизма глюкозы (рис. 2).
В экспериментальных исследованиях показано, что бенфотиамин:
• активизирует транскетолазу в клетках эндотелия, в сетчатке у больных СД;
• предотвращает гипергликемические расстройства in vitro;
• препятствует действию неблагоприятных механизмов в сетчатке при СД.
Бенфотиамин
при диабетической нефропатии
Нефропатия у больных СД 1–го и 2–го типа приводит не только к почечной недостаточности с такими последствиями, как диализ или пересадка почки, но и к повышению риска сердечно–сосудистых заболеваний и летального исхода. Первыми признаками этого являются длительная гиперфильтрация и микроальбуминурия. Адекватный контроль и нормализация глюкозы в крови может снижать этот риск, однако полностью устранить его не удается. Вследствие повышения концентрации глюкозы в клетках почечного эндотелия и перицитах происходит активация вышеописанных неблагоприятных механизмов [2,3]. Для проверки того, способно ли переключение обмена веществ на пентозо–фосфатный путь привести к улучшению функции почек, рабочая группа Торнелли провела исследование влияния тиамина и бенфотиамина на возникновение диабетической нефропатии [1].
В экспериментальных исследованиях были получены следующие результаты:
• применение тиамина и бенфотиамина не оказывало влияния на уровень глюкозы в крови;
• частота развития микроальбуминурии, протеинурии уменьшалась на 70–80% независимо от дозы;
• бенфотиамин был способен предотвратить гиперфильтрацию, которая является ранним признаком нефропатии;
• повышалась гломерулярная активность и экспрессия транскетолазы;
• уменьшалась выраженность окислительного стресса, которая определялась по концентрации тиолов в белках плазмы.
Таким образом, было показано, что бенфотиамин в составе Мильгаммы® композитум представляет собой эффективное средство, способное предотвращать развитие диабетической нефропатии на самых ранних стадиях и, возможно, препятствовать прогрессированию заболевания.
Рекомендованный курс лечения состоит из 10 внутримышечных инъекций препарата Мильгамма, который содержит высокие дозы нейротропных витаминов группы В – по 100 мг тиамина и пиридоксина и 1000 мкг цианокобаламина. Наличие в составе 20 мг лидокаина и малый объем раствора в ампуле (2 мл), делают инъекции практически безболезненными. Далее рекомендуется пероральный прием драже Мильгамма® композитум по 1 драже 3 раза/сут. в течение 2 мес. для усиления и пролонгации лечебного эффекта. Профилактические курсы Мильгаммы® композитум следует повторять каждые 6 мес.

Литература
1. Babaei–Jadidi, R., Karachalias, N., Ahmed, N., Battah, S., Thornalley, P.J.: Prevention of Incipient Diabetic Nephropathy by High–Dose Thiamine and Benfotiamine.Diabetes 52(2003) 2110–2119
2. Beltramo, E., Berrone, E., Buttiglieri, S., Porta, M.:Thiami–ne and benfotiamine prevent increased apoptosis in endothelial cells and pericytes cultured in high glucose. Diabetes Metab. Res. Rev. 20 (2004) 330–336
3. Beltramo, E., Pomero, F., Allione, A., Alu, F. D., Ponte, E., Porta, M.: Pericyte adhesion is impaired on extracellular matrix produced by endothelial cells in high hexose concentrations. Diabetologia 45 (2002) 416–419
4. Benbow SJ, Wallymahmed ME, MacFarime IA. Diabetic peripheral neuropathy and quality of life. QJ Med 1998;91:733–37.
5. Brownlee, M.: PNP – Neuropathien im Dialog 8, 2 (2003) 2 (Editorial)
6. Brownlee, M.:Nature 414,6865 (2001) 813–820
7. Hammes H.P. et al.: Benfotiamine blocks three major pathways of hyperglycemic damage and prevents experimental diabetic retinopathy. Nature Medicine, Vol. 9, No.: 3 (2003) 294–299
8. Hellweg, R., Wohrle, M., Hartung, H. D.: J. Neurosci. Res. 26/2(1990) 258–267
9. La Selva, M., Beltramo, E., Pagnozzi, F., Bena, E., Molinatti, P. A., Porta, M.: Diabetologia 39 (1996) 1263–1268
10. Ledermann, H., Wiedey, K.D.:Therapiewoche 39 (1989) 1445–1449
11. Pomero F, Molinar MA, La Selva M, et al. Benfotiamine is similar to thiamine in correcting endothelial cell defects induced by high glucose. Acta Diabetol 2001;38:135–8.
12. Rabinowe, S. L.: Diabetes Metab. Res. 6 (1990) 169–188
13. Rashi, G.: Kidney Int. 66,3 (2004) 1099–1 106
14. Reiners, K. –H.: Statement anlasslich des Fachkongresses «Benfotiamin in der Behandlung von systemischen Nervenerkrankungen», Leipzig (2003)
15. Schwieger, G.: In: Zollner, N. et al. (Hrsg.): Klinische Bedeutung von Vitamin B1, B6, Bl2 in der Schmerztherapie.Steinkopff Verlag, Darmstadt (1988) 169–181
16. Stracke, H., Lindemann, A., Federlin,K.:Exp.Clin.Endocrinol. Diabetes 104(1996) 311–316
17. Woelk, H.: Fortschritte der Medizin 100 (1982) 1709–1714
18. Wolf, M.: Dissertation, Giepen (1995).
19. Ziegler, D., Gries, F. A.: Nervenheilkunde 12 (1993) 405–410








.gif)



