Введение
Общий уровень заболеваемости соматическими расстройствами у больных шизофренией, как известно, выше, чем в целом в популяции. Большинство больных шизофренией умирает от типичных для общей популяции соматических заболеваний (сердечно–сосудистые болезни, заболевания дыхательной, пищеварительной и мочеполовой систем). Высокая распространенность ожирения, курения и употребления алкоголя у больных шизофренией способствует тому, что продолжительность жизни в этой группе на 20% меньше, чем в популяции [Dixon L. et al., 1999]. Коморбидными с шизофренией считаются дислипидемия, рак, сахарный диабет 2 типа и сердечно–сосудистые заболевания. Факторы риска развития сердечно–сосудистых заболеваний у больных шизофренией в сравнении с общей популяцией суммированы в таблице 1. Смерть вследствие сердечно–сосудистых заболеваний у больных шизофренией стоит на первом месте и встречается в 2 раза чаще, чем в общей популяции. Наличие соматических заболеваний значительно осложняет проведение адекватной психофармакотерапии.
Другим препятствием для эффективного и длительного применения нейролептиков является развитие побочных явлений, которые ухудшают клинический исход и в большом проценте случаев приводят к нарушению режима приема терапии. В течение многих лет основное внимание как исследователей, так и практических врачей было сфокусировано на экстрапирамидных побочных симптомах (ЭПС) антипсихотиков. Дистония, паркинсонизм, акатизия, поздняя дискинезия и другие ЭПС встречаются у 50–70% пациентов, принимающих классические нейролептики [Kane J.M., 1996]. Введение в клиническую практику атипичных антипсихотиков связано с низкой частотой развития ЭПС при их использовании. Однако антипсихотики, как типичные, так и атипичные, могут вызывать и другие побочные явления, некоторые из которых существенно снижают качество жизни больных. В частности, некоторые атипичные антипсихотики при меньшей выраженности ЭПС чаще способствуют развитию седации, ортостатической гипотензии, нарушению сердечного ритма и увеличению массы тела. Отказ от лечения вследствие набора веса является основной причиной рецидива и повторных госпитализаций [Weiden P.J. et al., 2004].
В результате все более широкого распространения нового поколения антипсихотиков увеличение веса при длительной терапии становится превалирующим побочным эффектом. Однако часто увеличение веса игнорируется практическими врачами, так как по сравнению с другими побочными симптомами традиционных нейролептиков данное явление кажется неспецифическим и «нормальным». Основанием для такого подхода служит широкая распространенность ожирения в общей популяции. Например, в США каждый второй взрослый (это 97 миллионов человек!) страдает избыточным весом или ожирением [Yanovski J.A., Yanovski S.Z., 1999]. Хорошо известно, что избыточная масса тела существенно повышает риск заболеваемости по следующим категориям: гипертензия, дислипидемия, сахарный диабет 2 типа, сердечно–сосудистые болезни, инсульт, желчекаменная болезнь, остеоартриты, ночное апноэ и респираторные болезни, а также рак эндометрия, молочной железы, простаты и толстого кишечника. В частности, риск развития диабета 2 типа при ожирении повышается на 60%. Повышенная масса тела связана также с общей заболеваемостью и может способствовать определенной стигматизации и дискриминации человека в обществе. Ожирение и избыточный вес считаются мультифакторными заболеваниями, связанными с влиянием окружающей среды, наследственностью, психологическими и физиологическими факторами.
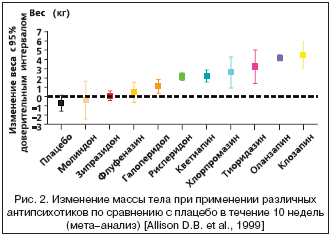
Для сравнительной оценки веса тела в настоящее время часто используется так называемый индекс массы тела (body mass index – BMI). Формула расчета достаточно проста, что позволяет применять его в широкой клинической практике. Вес тела в килограммах делится на рост в метрах в квадрате. По данным ВОЗ, избыточным вес считается при BMI≥25 кг/м2, а при BMI ≥30 кг/м2 диагностируется ожирение. Уровень смертности при развитии ожирения резко возрастает [Allison D.B. et al., 1999; Willett W.C. et al., 1999], особенно при висцеральном (абдоминальном) типе [Durazo–Arvizu R.A. et al., 1998]. Абдоминальный тип ожирения, который определяется по увеличению объема талии и сопровождается повышением уровня триглицеридов в крови, в настоящее время является основным критерием метаболического синдрома (МС) (табл. 2).
Все антипсихотики могут вызывать увеличение веса в той или иной степени. Под фармакогенным увеличением веса принято понимать побочный эффект препарата в виде повышения массы тела более 5–7% в период его применения, приводящий к отказу от режима приема терапии и/или различным медицинским проблемам. Европейская федерация ассоциаций семей, имеющих психически больных родственников (European Federation of Associasions of Families of Mental Ill People – EUFAMI) проводила исследование по оценке пациентами проводимой им антипсихотической терапии [EUFAMI, 2001]. Всего был опрошен 441 пациент из Великобритании, Италии, Испании и Германии. 91% респондентов сообщили о наличии побочных явлений, которые мешают им в обычной жизни. 60% этих пациентов страдали от увеличения веса. Из этих 60% больше половины (54%) считали увеличение веса наиболее трудным для коррекции побочным явлением.
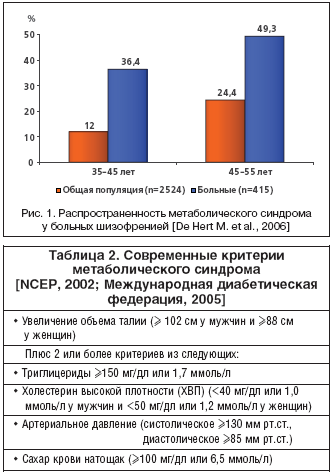
Помимо увеличения веса, прием антипсихотиков может вызывать развитие и других нарушений, входящих в структуру МС. Кроме ожирения, к ним относятся резистентность к инсулину и дислипидемия. МС у больных шизофренией встречается в 2 раза чаще, чем в общей популяции (рис. 1). Сравнение частоты фоновых проявлений метаболического синдрома у 1460 больных шизофренией в исследовании CATIE со стандартизированной по возрасту, полу и этнической принадлежностью выборки населения США показало существенные различия по всем параметрам (табл. 3). Похожесть коморбидных заболеваний и проявлений МС до настоящего времени является предметом обсуждения. Однако работы последнего времени все чаще обнаруживают причинно–следственную связь между применением атипичных антипсихотиков и МС. Настоящий обзор посвящен анализу различных сторон данной проблемы.
Увеличение веса
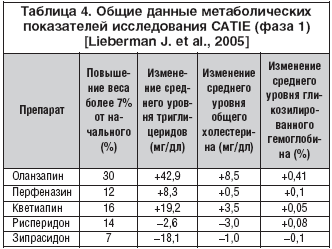
Повышение веса, связанное с применением классических нейролептиков, было описано вскоре после их появления в клинической практике [Planansky K., Heilizer F., 1959; Klett C., Caffey E., 1960]. При этом увеличение массы тела не зависело от лекарственной формы препарата и наблюдалось как при использовании таблетированных, так и пролонгированных форм нейролептиков [Johnson D.A., Breen M., 1979; Ganguli R., 1999]. Проблема, однако, не привлекала пристального внимания исследователей, так как была скрыта фасадом большого числа других, более очевидных побочных эффектов, прежде всего в неврологической сфере. Новый интерес к проблеме был связан с появлением клозапина и других атипичных антипсихотиков. Allison D.B. et al. (1999) провели мета–анализ 81 исследования по оценке влияния классических (хлорпромазин, галоперидол, флуфеназин, трифлуоперазин, перфеназин, молиндон, тиоридазин) и атипичных антипсихотиков (клозапин, оланзапин, рисперидон, зипразидон) на массу тела (рис. 2). Анализ проводился через 10 недель терапии. Прием практически всех нейролептиков сопровождался повышением веса. Среднее увеличение веса при применении атипичных антипсихотиков было выше, чем у классических нейролептиков. Атипичные антипсихотики в значительной степени различались между собой по возможности вызывать повышение массы тела. Наиболее выраженная прибавка веса отмечалась при применении клозапина и оланзапина.
Многие исследователи сообщали об увеличении веса при лечении клозапином [Lamberti J.S. et al., 1992; Leadbetter R. et al., 1992; Umbricht D.S. et al., 1994; Bustillo J.R., et al., 1996; Bai Y.M. et al., 1999]. В двух исследованиях была обнаружена корреляция между увеличением веса и клиническим эффектом [Lamberti J.S. et al., 1992; Leadbetter R. et al., 1992]. Другим авторам не удалось выявить различий по частоте данного побочного симптома между группой респондеров и нон–респондеров [Umbricht D.S. et al., 1994], более чем у 10% больных в этом ретроспективном анализе в течение года терапии прибавка в весе составила более 60%. В исследовании Hammer M. c соавт. (1995) у 37,5% больных набор веса в течение первых 12 недель терапии клозапином превышал 10% по отношению к фоновым показателям. Максимальная прибавка веса на клозапине составила 9,2 кг, а при применении галоперидола – 40 кг. В нескольких работах было показано, что увеличение веса при длительном лечении клозапином происходит постоянно, во всяком случае в течение первого года терапии [Eaton W.W. et al., 1992; Umricht D.S.G. et al., 1994; Wirshing D.A. et al., 1999]. В 5–летнем натуралистическом исследовании Henderson D.C. et al. (2000) с 6–месячным интервалом измеряли вес и лабораторные показатели у 82 амбулаторных больных шизофренией и шизоаффективным психозом, получавших клозапин. В процессе лечения статистически значимое нарастание массы тела продолжалось до 46 месяца терапии. При этом увеличение веса коррелировало с увеличением в плазме крови уровня холестерина и триглицеридов. В другом исследовании у 93 терапевтически резистентных больных шизофренией измеряли вес ежемесячно на протяжении 4 месяцев приема клозапина [Hong C.J. et al., 2001]. Среднее увеличение массы тела составило 2,4 кг. Однако индивидуальные изменения массы тела находились в диапазоне от –17,5 кг до +12,9 кг. Таким образом, пациенты с более низким начальным индексом массы тела (BMI) демонстрировали большее увеличение веса к концу исследования.
Появление других атипичных антипсихотиков продемонстрировало, что увеличение веса (как побочный симптом) присуще почти всему классу новых препаратов.
По сравнению с традиционными нейролептиками (галоперидол, перфеназин) рисперидон вызывал увеличение веса в 2 раза чаще [Clause A. et al., 1992; Hoyberg O.J. et al., 1993; Emsley R.A., 1999]. В большом сравнительном исследовании различных дозировок препарата, включавшем 1362 пациента, рисперидон по сравнению с галоперидолом значительно больше повышал вес больных при использовании всех дозировок (4, 8 и 12 мг) [Peuskens J., 1995]. Мета–анализ 11 ранних двойных слепых исследований показал, что в среднем за 8–12 недель терапии рисперидоном увеличение веса составляет 2–3 кг [Song F., 1997]. Ретроспективная оценка 39 взрослых пациентов с психической задержкой, которые принимали рисперидон в реабилитационном центре, показала, что у 37 из 39 пациентов отмечалось увеличение веса (в среднем на 8,3 кг за 2 года терапии) [Cohen S. et al., 2001]. В другой работе сравнивались две группы подростков. Одна группа из 37 больных в течение 6 месяцев принимала в стационаре рисперидон, другая из 33 пациентов – классические нейролептики [Martin A. et al., 2000]. К концу исследования в группе рисперидона наблюдалось большее увеличение веса (p<0,001). При этом статистической значимости увеличение веса достигало уже в течение первых 2 месяцев лечения. В среднем масса тела повышалась на 1,2 кг в месяц. Клинически значимое увеличение массы тела (т.е. более 7% от начального веса) отмечалось у 78% пациентов в группе рисперидона и у 24% в контрольной группе. Доза рисперидона и сопутствующая терапия не коррелировали с риском увеличения массы тела.
Изучение другого атипичного антипсихотика – оланзапина также подтвердило частое повышение веса в процессе лечения. При анализе ряда двойных слепых плацебо–контролируемых исследований выяснилось, что оланзапин значительно чаще вызывает прибавку веса, чем галоперидол или плацебо [Beasley C.M. et al., 1996]. Уже через 6 недель терапии среднее увеличение массы тела на оланзапине составило 4,1 кг по сравнению с 2,3 кг в группе галоперидола [Tollefson G.D. et al., 1997]. Эти результаты были получены при обобщении данных нескольких двойных слепых исследований, насчитывающих 1996 пациентов. В небольшом исследовании Gupta et al. (1999) средний набор веса через 7 месяцев терапии оланзапином составил 10 кг. В двойном слепом сравнительном исследовании оланзапин повышал массу тела в 2 раза больше, чем рисперидон [Conley R.R., Mahmoud R.A., 2001]. При этом набор веса не зависит от применяемой дозы и сохраняется в течение всего периода применения оланзапина [Beasley C.M. et al., 1997; Wirshing D.A., 2004]. В некоторых исследованиях показано, что набор веса при приеме препарата продолжается до 30 недель терапии и возможно далее, в то время как при приеме рисперидона через 8 недель масса тела обычно стабилизируется [Wirshing R.A. et al., 1999]. В проспективном натуралистическом исследовании сравнивали 2967 амбулаторных больных, принимавших оланзапин, и 821 больных, принимавших другие антипсихотики [Gomez J.C. et al., 2000]. Сонливость и увеличение массы тела статистически значимо чаще встречались в группе оланзапина, чем в контрольной группе. В другой работе 573 пациента принимали оланзапин в течение 39 недель и более, в то время как 103 пациента принимали галоперидол [Kinon B.J. et al., 2001]. В группе оланзапина отмечалось значимо большее увеличение массы тела (в среднем на 6,26 кг), чем в группе галоперидола (в среднем на 0,69 кг) после 1,15 года лечения. При этом у пациентов с избыточной массой тела в начале терапии наблюдалась меньшая прибавка веса. Отсутствовала корреляция между дозой препарата и увеличением веса. В двойном слепом исследовании оланзапина при мании 150 больных с диагнозом биполярное расстройство рандомизированно получали оланзапин от 5 до 20 мг/сут. (n=55) или плацебо (n=60) в течение 4 недель [Tohen M. et al., 2000]. В группе оланзапина отмечалось значимо большее увеличение массы тела, чем в группе плацебо (2,1±2,8 кг и 0,45±2,3 кг соответственно). В 3–месячном открытом исследовании оланзапина в дозе 5 мг/сут. у 23 больных с обсессивно–компульсивным расстройством, резистентных к серотонинергическим антидепрессантам, наиболее частыми побочными симптомами были увеличение веса и седация [Bogetto F. et al., 2000].
Значительно реже повышение массы тела встречается при применении еще одного атипичного антипсихотика – кветиапина. Хотя в первичном мета–анализе Allison D.B. с соавт. (1999) кветиапин отсутствовал, данные многочисленных двойных слепых исследований по среднему набору веса в течение 10 недель терапии позволяют поместить этот препарат в этой шкале рядом с рисперидоном (рис. 2) [Borison R.L. et al., 1996; Arvanitis L.A., Miller B.G., 1997; Small Y.G. et al., 1997]. Так, в 6–недельном двойном слепом плацебо–контролированном исследовании у 109 больных шизофренией при применении кветиапина увеличение веса более 7% от изначального отмечалось у 25% пациентов по сравнению с 1% в группе плацебо, соответственно средняя прибавка веса к концу курса терапии составила 5,5 кг и 0,5 кг [Borison R.L. et al., 1996]. Среднее увеличение веса в исследовании Arvanitis L.A., Miller B.G. (1997), включавшем 360 больных, для дозы 75 мг было 0,9 кг, для дозы 150 мг – 2,9 кг, 300 мг – 2,0 кг, 600 мг – 2,6 кг, 750 мг – 2,3 кг, по сравнению с 0,3 кг в группе галоперидола (12 мг/сут.) и снижением веса на 0,8 кг в группе плацебо. В исследовании Small J.G. с соавт. (1997) увеличение массы тела более 7% при дозе кветиапина 750 мг/сут. наблюдалось у 25% больных, а при дозе 250 мг/сут. – у 16% и в 5% случаев – при применении плацебо. Длительные исследования показывают, что у большинства больных при лечении кветиапином набор веса прекращается после 8 недель терапии, и среднее увеличение веса через год составляет около 2 кг [Rak I.W. et al., 2000; Brecher M. et al., 2000; Jones A.M. et al. 2000].
Контролируемые исследования зипрасидона показали, что препарат связан с минимальным набором веса у большинства пациентов. В регистрационных исследованиях увеличение веса более 7% отмечалось у 9% больных, а среднее увеличение веса при дозе 80 мг/сут. составило около 1 кг через 6 недель терапии [Keck P. et al., 1998; Daniel D.G. et al., 1999]. В длительных исследованиях через год терапии при использовании любых дозировок зипрасидона происходило снижение массы тела в среднем на 3 кг [Arato M. et al., 2002; Daniel D.G., 2003].
Другим препаратом, практически не влияющим на вес больных, является арипипразол. По данным краткосрочных регистрационных исследований, включавших около 500 больных, только 8% пациентов набрали вес более 7% от изначального, а среднее увеличение массы тела при применении всех дозировок составило 0,71 кг и значимо не отличалось от группы галоперидола [Marder S. et al., 2003]. В длительных исследованиях арипипразол приводил к некоторому снижению веса [Pigott T.A. et al., 2003; Kasper S. et al., 2003]. В прямых сравнительных исследованиях с оланзапином препарат вызывал клинически значимое повышение веса (более 7%) в 4 раза реже [Cornblatt B. et al., 2002; Mc Quade R.D. et al., 2004]. Более того, при переводе на арипипразол с других антипсихотиков (оланзапин, рисперидон, галоперидол и тиоризадин) больные теряли в весе [Casey D.E. et al., 2003].
Для более точного представления о сравнительной степени увеличения веса при лечении различными атипичными антипсихотиками проводились прямые сравнительные исследования. В двойном слепом исследовании 377 больных шизофренией и шизоаффективным расстройством рандомизированно на протяжении 8 недель назначался рисперидон (2–6 мг) или оланзапин (5–20 мг) [Conley R.R., Mahmoud R., 2001]. Значимое увеличение массы тела (более 7% от начальной) было обнаружено у 27% больных в группе оланзапина и у 12% в группе рисперидона. В другом ретроспективном исследовании сравнивались две группы по 50 пациентов, принимавших оланзапин или рисперидон [Ganguli R. et al., 2001]. Через 4 месяца в группе оланзапина отмечалось статистически значимое увеличение массы тела (p<0,001). Среднее увеличение веса в группе оланзапина составило 2 кг, в то время как в группе рисперидона изменения веса не отмечалось. В ретроспективном исследовании 50 пациентов с биполярным расстройством 1 типа сравнивали рисперидон, оланзапин и клозапин [Guille C. et al., 2000]. Оланзапин и клозапин показали значимо большее увеличение веса по сравнению с рисперидоном. В другой работе оланзапин вызывал большее увеличение веса, чем рисперидон, как у взрослых (3,3±0,4 кг), так и у пожилых (1,4±0,5 кг) по сравнению с рисперидоном (1,6±0,3 и 0,6±0,2 кг соответственно) [Gharabawi M.G. et al., 2002]. При ретроспективном изучении больных моложе 60 лет, принимавших оланзапин или рисперидон в течение года, в группе оланзапина (n=37) индекс массы тела (BMI) увеличился на 2,55 кг/м2, вес – на 7,9 кг (p≤0,001). Также отмечалось повышение триглицеридов (p=0,002), холестерина (p≤0,001) и глюкозы (p=0,009). В группе рисперидона (n=39) отмечалось увеличение BMI на 1,55 кг/м2 и массы тела – на 4,9 кг (p≤0,001), а также триглицеридов (p=0,047). Разница между группами не была статистически значима. Применение солей лития или вальпроатов коррелировало с большим увеличением массы тела в обеих группах (p=0,015 для рисперидона и p≤0,001 для оланзапина) [Meyer J.M., 2002]. При сравнении 97 амбулаторных подростков, из которых 75 получали рисперидон, 25 кветиапин и 16 оланзапин, значимым считалось увеличение массы тела на 4,5 кг и больше [Grcevich S. et al., 2000]. Средняя продолжительность лечения составила 408,3 дня для рисперидона (средняя доза – 2,6 мг), 170,6 дней для оланзапина (средняя доза 13,3 мг) и 119,8 дней для кветиапина (средняя доза 210,3 мг). Через 3 месяца лечения значимое увеличение веса наблюдалось в группе рисперидона у 34% больных, в группе оланзапина – у 71% и в группе кветиапина – у 15% пациентов. Среднее увеличение веса составило 3,9 кг для рисперидона, 6,6 кг для оланзапина и 3,3 кг для кветиапина соответственно.
Анализ влияния на массу тела атипичных и классических антипсихотиков по сравнению с пациентами, не принимавшими нейролептиков, провели Simpson M.M. et al. (2001). Применение атипичных антипсихотиков (оланзапина, клозапина и рисперидона) (n=130) вызывало статистически значимое увеличение веса по сравнению с группой, не принимавшей антипсихотики (n=65) (p=0,031). Отсутствовала статистическая разница увеличения веса между группой типичных (хлорпромазин, галоперидол, перфеназин, пимозид, трифлуоперазин) (n=51) и атипичных антипсихотиков, а также между группой, не принимавшей нейролептиков, и группой, принимавшей типичные антипсихотики. В группе оланзапина (n=45) отмечалось статистически более выраженное увеличение веса по сравнению с клозапином (n=47) и рисперидоном (n=36) (p=0,001). Отсутствовала разница в увеличении веса между больными без ожирения (BMI≤29,9 кг/м2) и больными с ожирением (BMI≥30 кг/м2). Большая длительность болезни коррелировала с меньшим увеличением веса (p=0,009). Больные с диагнозом шизоаффективного расстройства показали меньшее увеличение веса тела по сравнению с больными шизофренией (p=0,042).
Czobor P. et al. (2002) при сравнении клозапина, оланзапина, рисперидона и галоперидола получили относительное увеличение массы тела в группе клозапина – 6,3% (4,2±4,7 кг), в группе оланзапина – 7,1% (5,4±4,6 кг), в группе рисперидона – 2,8% (2,3±2,8 кг) и в группе галоперидола – 0,3% (0,2±0,2 кг) после 14 недель лечения. Статистически значимым было увеличение индекса массы тела в группах клозапина и оланзапина по сравнению с галоперидолом. Значимая корреляция отмечалась между увеличением массы тела и клиническим эффектом (в целом по PANSS и по всем трем подшкалам) для оланзапина (p<0,0003) и (в целом по PANSS и по шкале общей психопатологии) для клозапина (p<0,02), но не для рисперидона и галоперидола, т.е. у больных с наибольшим увеличением веса происходило и большая редукция клинических симптомов. Возраст, продолжительность болезни, доза препарата и седация при лечении не были связаны с увеличением веса. Низкий показатель индекса массы тела на момент начала лечения был статистически связан с увеличением массы тела в последующем. Пациенты с меньшим индексом массы тела в начале лечения более склонны к увеличению веса на фоне приема антипсихотиков. Некоторые группы больных, такие как подростки, пациенты с психической задержкой или с биполярным расстройством, возможно, более чувствительны к увеличению веса, вызванному антипсихотиками. Возможно, что полипрагмазия также способствует увеличению веса у психически больных. Например, сочетанное применение солей лития или вальпроатов с атипичными антипсихотиками коррелирует с большим увеличением массы тела [Meyer J.M., 2002]. Однако, для подтверждения этих данных требуются дальнейшие систематические исследования.
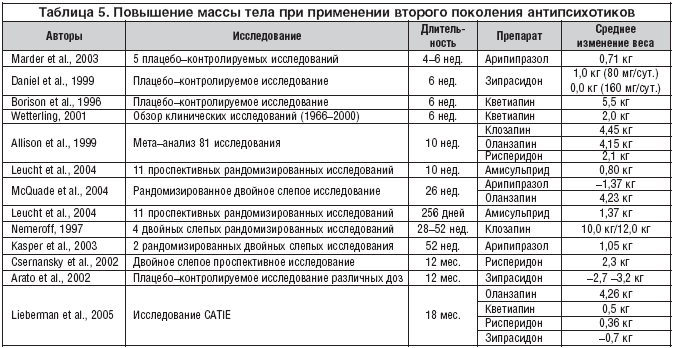
В широкомасштабном и независимом от спонсорства фармацевтических компаний исследовании CATIE [Lieberman J.A. et al., 2005] среднее увеличение веса к окончанию терапии было максимальным в группе оланзапина (4,26 кг), причем уже через 1 месяц лечения прибавка составила 0,9 кг. Динамика метаболических показателей в данном исследовании показана в таблице 4. Обобщающие сравнительные данные по повышению веса атипичными антипсихотиками в рандомизированных клинических исследованиях с различной длительностью представлены в таблице 5 и на рисунке 3 [мета–анализ Leucht S. et al., 2004], из которых следует, что в наибольшей степени массу тела повышают 2 препарата – клозапин и оланзапин, в меньшей степени – рисперидон и кветиапин, а зипразидон, арипипразол и амисульприд практически не влияют на этот показатель.
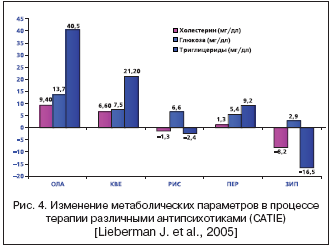
Следует отметить, что повышение веса часто сопровождается нарушением липидного обмена. Дислипидемия является основным фактором риска развития сердечно–сосудистых заболеваний и часто сопровождается диабетом 2 типа. Изучение частоты дислипидемии у 606 стационарных больных, принимавших атипичные антипсихотики, обнаружило ее признаки у 66–68% больных [Paton C. Et al., 2004]. Анализ публикаций с описанием отдельных наблюдений и серий случаев показал, что наиболее часто липидный обмен нарушают клозапин, оланзапин и кветиапин [Meyer J.M., Koro C.E., 2004]. По данным ретроспективного анализа историй болезни 19600 больных шизофренией в Великобритании, риск развития дислипидемии было в 3 раза выше при лечении оланзапином по сравнению с традиционными нейролептиками [Koro C.E. et al., 2002]. В отношении рисперидона достоверных различий обнаружено не было. В исследовании CATIE [Lieberman J. et al., 2005] наибольшие изменения метаболических параметров были связаны с применением оланзапина (общий холестерин по сравнению с фоновыми показателями вырос на 0,2 ммоль/л, а триглицериды – на 0,5 ммоль/л), а наименьшее снижение показателей – с применением зипрасидона (рис. 4). Аналогичные данные были получены при длительном сравнительном исследовании оланзапина и арипипразола: при применении оланзапина количество липидов в крови было в несколько раз выше [Pigott T.A. et al., 2003].
Нарушение метаболизма глюкозы
Многие препараты могут вызывать нарушение метаболизма глюкозы: центральные α–блокаторы, β–блокаторы, кортикостероиды, циклоспорины, фенитоин, тиазидные диуретики, оральные контрацептивы, содержащие норгестрол, и другие лекарственные вещества [Keskiner A. et al., 1973; Pandit M.K., 1993]. Глюкокортикостероиды вызывают не только нарушение утилизации глюкозы, но и резистентность к инсулину [O’Byrne S., Feely J., 1990]. Вальпроаты индуцируют развитие МС, характеризующегося ожирением, гиперинсулинемией, нарушениями метаболизма липидов, поликистозом яичников и гиперандрогенизмом у женщин, больных эпилепсией [Isojarvi J.I. et al., 1996].
По данным ВОЗ, на рубеже веков в мире диабетом страдало 150 млн. человек, а к 2025 году эта цифра должна удвоиться [WHO, 2002]. Причем около 80% этих людей имеют диабет 2 типа, тесно связанный с развитием ожирения, масштабы нарастания которогоa:2:{s:4:"TEXT";s:82680:" в западной популяции приближаются к эпидемии. В общей популяции в США сахарный диабет встречается у 1,2% населения в возрасте от 18 до 44 лет и у 6,3% – в возрасте от 45 до 64 лет [Lindenmayer J–P. et al., 2001], чаще у женщин, афроамериканцев, испаноговорящих и индейцев. Lawrence J.M. et al. (2001), проводя скрининг 2481 больных старше 45 лет с различной непсихической патологией без диагноза диабета, выявили сахарный диабет у 0,2% больных. В группе больных с факторами риска (гипертензия, ожирение или наличие диабета у родственников) диагноз диабета был установлен у 2,8% больных.
Нарушения в регуляции глюкозы были отмечены у больных шизофренией задолго до введения в практику антипсихотической терапии. Как известно, в отличие от диабета 1 типа, который обусловлен деструкцией β–клеток и ведет к абсолютной инсулиновой недостаточности, при диабете 2 типа отмечается относительный дефицит инсулина, который может колебаться в широких пределах – от инсулинорезистентности до разнообразных дефектов секреции инсулина. Сахарный диабет 2 типа чаще начинается в возрасте старше 40 лет. Более высокий риск сахарного диабета 2 типа при шизофрении описывался в литературе с 1926 года [Kasanin J., 1926], то есть еще до появления нейролептиков, в том числе отмечались нарушения теста толерантности к глюкозе [Braceland F.J. et al., 1945].
В настоящее время заболеваемость сахарным диабетом 2 типа у больных шизофренией существенно выросла и в конце ХХ века оценивалась в 14,9%, т.е. примерно в 2 раза выше, чем в общей популяции [Dixon L. et al., 2000; Casey D.E., 2005]. При этом сахарный диабет чаще встречается у женщин, афроамериканцев и других этнических групп, что совпадает с результатами, полученными для общей популяции. Большинство из этих больных принимали классические нейролептики. Японское исследование приводит цифру распространенности сахарного диабета среди больных шизофренией в 8,8% по сравнению с 5% в контрольной группе [Tabata H. et al., 1987]. Распространенность сахарного диабета 2 типа зависит от возраста больных шизофренией. Если в группе от 50 до 59 лет сахарный диабет был диагностирован у 12,9%, то в группе от 60 до 69 лет – уже у 18,9% больных [Mukherjee S. et al., 1996]. Распространенность диабета у больных шизофренией по сравнению с общей популяцией в США по различным возрастным группам представлена на рисунке 5. Видно, что в любых возрастных категориях, включая подростковый возраст, частота развития диабета при шизофрении в среднем в 4–6 раз выше, чем в популяции. Вклад в этот процесс широкого распространения антипсихотической фармакотерапии недостаточно ясен.
Термин фенотиазиновый диабет хорошо известен клиницистам. Первые сообщения о способности фенотиазинов вызывать сахарный диабет появились в 1956 году [Thonnard–Neumann E., 1956]. После введения фенотиазинов в клиническую практику частота сахарного диабета 2 типа у больных шизофренией возросла с 4,2% в 1956 году [Thonnard–Neumann E., 1956] до 17,2% в 1968 [Thonnard–Neumann E., 1968]. Разные исследователи приводят цифры распространенности сахарного диабета у больных шизофренией от 11% [Waitzkin L., 1966] до 18% [Thonnard–Neumann E., 1968].
Первые публикации клинических случаев, сообщавшие о развитии кетоацидоза на фоне приема атипичных антипсихотиков, касались применения клозапина [Brandt G.T. et al., 1994]. Hagg S. et al. (1998) показали, что у 12% больных, длительно принимавших клозапин, развился сахарный диабет 2 типа. При этом еще у 10% отмечались нарушения толерантности к глюкозе по сравнению с 6 и 3% соответственно для пациентов, принимавших классические депо–нейролептики. Полученная разница не была статистически значимой. В течение 5–летнего натуралистического изучения применения клозапина у 30 (36,6%) из 82 пациентов развился сахарный диабет [Henderson D.C. et al., 2000]. Развитие сахарного диабета не коррелировало с индексом массы тела или увеличением веса. То есть у части больных сахарный диабет развивался при отсутствии изменения массы тела. Однако увеличение веса в этом исследовании коррелировало с увеличением уровня триглицеридов, а развитие сахарного диабета – с увеличением уровня триглицеридов.
В работе Melkersson K.I. et al. (2000) 14 больных длительно принимали оланзапин. У 12 из 14 отмечалось увеличение веса от 1 до 10 кг (в среднем 2,2 кг) за 5 месяцев лечения. В дальнейшем у 3 пациентов развился сахарный диабет. По другим данным, только у 5,5% из 55 резистентных пациентов в процессе лечения оланзапином было обнаружено увеличение уровня глюкозы [Lindenmayer J.P. et al., 2001], что не превышает общий уровень в популяции (6–8%). Увеличение веса в процессе лечения оланзапином в этом исследовании (3,2 кг) не коррелировало с уровнем глюкозы.
Повышение риска развития диабета при первичном применении клозапина и оланзапина было выявлено в исследовании Jin H. с соавт. (2002), которые обнаружили соответственно 20 и 19 таких случаев, в то время как при применении рисперидона и кветиапина было выявлено только по 3 случая. Причем половина всех случаев первичного диабета не сопровождалась увеличением веса. Анализ влияния длительности терапии и временной связи между назначением или отменой препарата и проявлениями диабета также позволяют считать, что риск развития диабета выше при применении клозапина и оланзапина. Например, в проспективном исследовании через 2,5 месяца лечения клозапином у 55% больных было выявлено снижение толерантности к глюкозе, не связанное с чувствительностью к инсулину [Howes O.D. et al., 2004]. Аналогичные данные были получены при изучении оланзапина: 47% всех случаев первичного диабета были выявлены в первые 3 месяца лечения и 70% – в первые 6 месяцев. Кроме того, почти у 80% больных гликемический контроль улучшился после отмены препарата [Koller E.A., Doraiswamy P.M., 2002].
В последнее время появились публикации, описывающие летальные случаи от гипергликемии, развившейся на фоне лечения оланзапином [Meatherall R., Younes J., 2002]. В частности, Koller E.A. и Doraiswamy P.M. (2002) выявили 237 случаев гипрегликемии во время лечения оланзапином, из них 188 впервые выявленных. 73% случаев гипергликемии выявлены в течение первых 6 месяцев после начала терапии оланзапином. После отмены или снижения дозы оланзапина у 78% пациентов отмечалась нормализация уровня глюкозы. Больные с выраженной гипергликемией (700 мг/дл и выше) чаще принимали литий по сравнению с больными с менее выраженной гипергликемией (p=0,06). При анализе летальных исходов было выявлено, что все больные имели множество других серьезных заболеваний, что затрудняет оценку первичной роли гипергликемии в причине смерти.
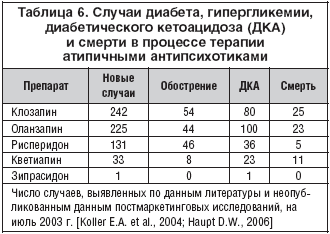
Случаи впервые выявленного диабета, обострений существующего диабета, диабетического кетоацидоза и смерти в прочесе терапии различными атипичными антипсихотиками представлены в таблице 6. Несмотря на то, что эти данные опираются в основном на опубликованные отдельные клинические наблюдения и серии случаев и, строго говоря, не являются доказательными (поскольку получены не в контролируемых и не в когортных эпидемиологических исследованиях), значительное увеличение числа первичного диабета и кетоацидоза, а также летальных исходов только при применении клозапина и оланзапина не может не настораживать.
Несмотря на широкий резонанс, вызванный последними публикациями клинических случаев летальных исходов гипергликемии на фоне приема оланзапина и клозапина, данные фармакоэпидемиологических исследований по изучению сравнительной способности антипсихотических препаратов вызывать гипергликемию не столь убедительны.
Так, при ретроспективной оценке базы данных, состоящей из результатов обследования 38632 больных, Sernyak M.J. et al. (2002) выявили, что сахарный диабет 2 типа статистически достоверно чаще регистрировался в группе, принимавшей атипичные антипсихотики (n=22648, 58,5%), по сравнению с больными, принимавшими классические нейролептики (n=15984, 41,1%), только в группе моложе 40 лет (8,75% по сравнению с 6,43%, соответственно, p=0,007). В старшей возрастной категории и в целом по группам статистически достоверной разницы не отмечалось.
Сходные результаты были получены и другими исследователями при изучении базы данных в Великобритании, включающей 21145 больных шизофренией. Применение оланзапина статистически достоверно повышало риск развития диабета (p=0,002) по сравнению со здоровыми людьми в 6 раз. Применение типичных нейролептиков (хлорпромазина, флупентиксола, флуфеназина, галоперидола, перициазина, перфеназина, тиоридазина, сульпирида, трифлуоперазина и зуклопентиксола) также повышало риск заболевания диабетом (р=0,013). Для рисперидона отмечалась тенденция к повышению риска, которая не достигала статистической значимости (p=0,16) [Koro C.E. et al., 2002].
С другой стороны, Gianfrancesco F. et al. (2002), проводя изучение базы данных, включающей 7933 больных с различными психозами, обнаружили более высокий риск развития сахарного диабета у пациентов, длительно (12 месяцев) принимавших клозапин и оланзапин, по сравнению с рисперидоном и классическими нейролептиками. При этом по сравнению с нелечившимися больными риск развития гипергликемии при применении клозапина был выше в 7 раз, а при применении оланзапина в 3 раза. Другие исследователи на основании изучения базы данных, включавшей 33945 больных, выявили более высокий риск развития сахарного диабета при применении оланзапина по сравнению с рисперидоном только для женщин [Caro J. et al., 2000].
Независимое слепое контролируемое исследование CATIE [Lieberman J. et al., 2005] в целом подтвердило данные клинических наблюдений. Наибольший прирост содержания сахара в крови отмечался в группе оланзапина (0,8 ммоль/л), в меньшей степени при приеме кветиапина (0,4 ммоль/л), рисперидона (0,4 ммоль/л) и зипрасидона (0,2 ммоль/л) (рис. 4). Вместе с тем необходимо отметить, что исследование CATIE не было предназначено специально для изучения метаболизма глюкозы и имело ряд методических недостатков, способных исказить общий результат. В частности, у многих больных сахар крови определялся не натощак, и больные с имеющимся диабетом не выделялись из общей выборки.
Данных по оценке риска развития диабета при применении других атипичных антипсихотиков, таких как амисульприд и арипипразол, пока недостаточно, хотя, по результатам предварительных и регистрационных исследований, он должен быть минимален.
По всей вероятности, различия во влиянии атипичных антипсихотиков на отдельные показатели МС связаны с особенностями рецепторного профиля каждого препарата и, соответственно, с разными механизмами развития побочных эффектов.
Механизмы метаболических
нарушений при применении
антипсихотиков
Вес тела зависит от баланса между поступлением и расходом энергии. Когда у человека наблюдается положительный энергетический баланс, тогда вес тела увеличивается. Работы по изучению наследственности показали, что 70% массы тела генетически детерминированы, хотя окружающая среда также может играть свою роль [Yanovski J.A., Yanovski S.Z., 1999]. Большинство работ, описывающих механизмы повышения веса, вызванного антипсихотиками, придают особое значение увеличению поступления энергии, т.е. повышению аппетита.
Гипоталамус является основной нейроморфологической структурой, ответственной за регуляцию веса. Ожирение может быть связано с повышением уровня андрогенов у женщин и снижением уровня андрогенов у мужчин. Данные изменения гормонального статуса снижают чувствительность нейронов насыщения в гипоталамусе. Кроме того, повышение уровня пролактина может прямо способствовать увеличению веса тела за счет снижения чувствительности к инсулину или же опосредованно за счет дальнейшего нарушения уровня андрогенов и эстрогенов [Baptista T., 1999].
Серотонин является хорошо известным фактором насыщения. Абсолютное или относительное увеличение серотонина в центральных структурах угнетает пищевой рефлекс, в то время как антагонисты серотонина стимулируют поступление энергии [Meguid M.M. et al., 2000]. Блокада 5–HT2С рецепторов считается ответственной за увеличение массы тела, вызванное трициклическими антидепрессантами и атипичными антипсихотиками. Препараты типа галоперидола (бутирофеноны, бензамиды), которые практически не влияют на массу веса, минимально взаимодействуют с этим типом серотониновых рецепторов. Однако до сих пор не удалось выявить корреляции между повышением веса, вызванного клозапином, оланзапином, рисперидоном или галоперидолом, и их аффинитетом к 5–HT2С рецепторам [Wirshing D.A. et al., 1999]. Более того, зипрасидон, который клинически вызывает минимальное увеличение веса, in vivo показывает высокое сродство к 5–HT2С рецепторам.
Хорошо известно, что средства с высокой антигистаминовой активностью (дифенилгидрамин, хлорпромазин, миртазапин и некоторые другие препараты) способствуют повышению веса тела [McIntyre R.S. et al., 2001]. Существуют прямые корреляции между степенью блокады гистаминовых рецепторов антипсихотиками и массой тела. Препараты с высоким аффинитетом к H1–рецепторам (клозапин и оланзапин) вызывают максимальное увеличение веса, наименьшую прибавку дают галоперидол, зипрасидон, сертиндол и арипипразол, т.е. препараты с низким сродством к гистаминовым рецепторам первого типа.
Существуют и другие биологические механизмы, формирующие пищевое поведение. В частности, средства, которые стимулируют активность ГАМК–ергических процессов (вальпроаты), способствуют развитию ожирения [Ketter T.A. et al., 1999]. Фактор некроза опухолей (tumor necrosis factor α – TNF–α) играет критическую роль в различных метаболических и иммунных процессах, а также в пищевом поведении. Кроме того, он влияет на метаболизм глюкозы, белков и жиров [Bullo–Bonet M. et al., 1999]. TNF–α, возможно, ответственен за повышение веса, вызываемого амитриптилином и другими антидепрессантами [McIntyre R.S. et al., 2001]. Клозапин и оланзапин также повышают уровень TNF–α, интерлейкина 2 и лептина [Melkersson K.I. et al., 2000; Pollmaches T. Et al., 2000; McIntyre R.S. et al., 2001]. Несмотря на высокий уровень лептина, больные, принимающие оланзапин, продолжают набирать вес, что позволяет предположить, что каким–то образом нарушается обратная связь между выработкой лептина и нейропептида Y или (что более вероятно) препарат оказывает влияние не на орексигенные регуляторы, а на само пищевое поведение.
Возможно, существует и генетическая предрасположенность к увеличению веса при проведении антипсихотической терапии. Например, у больных, склонных к увеличению веса при лечении клозапином, генетический анализ показал различие по генам рецепторов 5–HT2С, адренергических рецепторов типа β3 и α1а и TNF–α по сравнению с больными, вес которых при приеме клозапина не изменялся [Basile V.S. et al., 2001]. Предполагается, что генетический полиморфизм по рецепторам 5–НТ2С и лептина играет важную роль в развитии набора веса при лечении атипичными антипсихотиками [Reynolds G.P. et al., 2002; Zhang Z.J. et al., 2003 и др.].
Несколько гипотез постулируют нарушение регуляции глюкозы у больных шизофренией, независимое от применения атипичных антипсихотиков. Даже до нейролептической эры у больных шизофренией нередко находили задержку возвращения глюкозы крови к нормальному уровню после в/в введения раствора декстрозы [Meduna L.J. et al., 1942]. Кроме того, описывалась и повышенная толерантность к инсулину [Marinow A., 1967]. Не исключено что атипичные антипсихотики способствуют развитию гипергликемии посредством формирования резистентности к инсулину. Wirshing D.A. et al. (1998) предположили, что влияние клозапина и оланзапина на серотонин может частично объяснять развитие резистентности к инсулину. Например, известно, что оланзапин и клозапин вызывают статистически достоверное нарушение теста толерантности к глюкозе у больных шизофренией без диабета по сравнению с группой контроля и группой типичных нейролептиков [Newcomer J.W. et al., 2002].
При этом разные подтипы серотониновых рецепторов оказывают разнонаправленное влияние на уровень глюкозы в плазме крови. Если блокада 5–HT2С рецепторов играет важную роль в механизме увеличения веса атипичными антипсихотиками и опосредованно может способствовать развитию резистентности к инсулину за счет увеличения жировой ткани, то блокада 5–HT1A рецепторов снижает уровень инсулина и, следовательно, вызывает гипергликемию. Блокада 5–HT2А рецепторов, по–видимому, наоборот снижает уровень глюкозы крови, т.к. известно, что агонисты 5–HT2А рецепторов вызывают гипергликемию [Wozniak K.M., Linnoila M., 1991]. Следовательно, сложно предсказать исход одновременной блокады 5–HT1A и 5–HT2А рецепторов, связанной с применением атипичных антипсихотиков. Поэтому любая связь между аффинитетом атипичных антипсихотиков к серотониновым рецепторам и гипергликемией, по–видимому, является спекулятивной.
Другим механизмом увеличения веса тела являются развитие гипергликемии за счет нарушения регуляции глюкозы и инсулина, а также нарушения в липидном обмене [Wirshing D.A. et al., 1999, Melkersson K.I. et al., 2000]. Некоторые атипичные антипсихотики стимулируют аппетит, способствуют увеличению приема пищи и таким образом вызывают увеличение массы тела. Рост массы тела может являться одним из потенциальных механизмов развития сахарного диабета за счет увеличения жировой ткани, что, в свою очередь, ведет к резистентности к инсулину, интолерантности к глюкозе, а впоследствии – к развитию сахарного диабета. Подсчитано, что с каждым килограммом лишнего веса риск развития сахарного диабета 2 типа увеличивается на 4,5% [Wirshing D.A. et al., 1998]. Снижение эффективности инсулина может происходить из–за уменьшения чувствительности инсулиновых рецепторов, или из–за изменения влияния инсулина на механизм транспорта глюкозы. Влияние различных атипичных антипсихотиков на функцию инсулярных β–клеток поджелудочной железы неоднозначно [Melkersson K. et al., 2001; Best L. et al., 2005]. Некоторые экспериментальные работы обнаружили развитие инсулинорезистентности и дисфункции β–клеток, сопровождающихся набором веса, при введении оланзапина, но не рисперидона [Ader M. et al., 2005]. В другом исследовании было показано, что увеличение инсулинорезистентности у крыс при введении оланзапина и клозапина (но не зипрасидона) развивается до увеличения массы тела. Таким образом, они могут быть связаны с другим, самостоятельным механизмом [Houseknecht K.L., et al., 2005].
Обсуждение
Шизофрения вследствие различных причин, включая особый образ жизни и наследственную предрасположенность к развитию соматических расстройств, является фактором риска по развитию метаболических нарушений, в том числе сахарного диабета 2 типа. Было установлено, что среди впервые выявленных больных шизофренией, никогда не принимавших антипсихотики, у 15% обнаруживались нарушения толерантности к глюкозе. Различия с контрольной группой были статистически достоверны (p<0,05). Кроме того, у больных с первым эпизодом наблюдались более высокий уровень инсулина (статистически достоверно при сравнении с контрольной группой, p<0,05), большая резистентность к инсулину (p<0,01) и повышенный уровень кортизола (p<0,005) [Thakore J.H., Ryan M.C.M., 2002]. Необходимо обратить внимание на повышенный уровень кортизола при шизофрении, так как данный гормон может нарушать распределение жира. Хотя уровень ожирения у больных шизофренией и не отличается от общей популяции, именно количество висцерального жира связывают с развитием МС. Уровень висцерального жира у больных шизофренией, никогда не принимавших антипсихотики, в 3,4 раза превышал уровень висцерального (абдоминального) жира у лиц контрольной группы (p<0,005). По–видимому, высокий уровень висцерального (абдоминального) жира может быть проявлением самой болезни, так как в другой публикации та же группа авторов не обнаружила разницы между больными, никогда не принимавшими антипсихотики, и пациентами, которым на момент обследования терапия была отменена (p<0,76) [Thakore J.H. et al., 2002].
По мнению Lindenmayer J–P. et al. (2001), факторами риска развития сахарного диабета во время приема антипсихотиков являются диагноз шизофрении, избыточный вес до начала лечения (BMI> 30 кг/м2) и увеличение веса более чем на 10% во время приема препарата. Нарушения регуляции глюкозы, гипертензия (>140/90 мм рт.ст.) и наличие сахарного диабета у родственников также увеличивают риск развития сахарного диабета 2 типа. С другой стороны, проводя анализ клинических случаев, характеризующихся развитием сахарного диабета во время лечения антипсихотиками, Mir S. и Taylor D. (2001) у 2/3 больных не обнаружили признаков гипергликемии в анамнезе, у половины больных отсутствовали случаи гипергликемии среди родственников. Таким образом, отсутствие гипергликемии в анамнезе или среди родственников не застраховывает от развития индуцированного антипсихотиками сахарного диабета. Отчетливые корреляции существуют только между пожилым возрастом больного и высоким риском развития диабета как в общей популяции [Haffner S.M., 1998], так и среди больных шизофренией [Dixon L. et al., 2000]. Другими словами, до сих пор остается неясным, связан ли высокий риск развития сахарного диабета при шизофрении с эндогенными факторами (в том числе и генетической предрасположенностью) или с экзогенным влиянием (лечение и др.).
Помимо сахарного диабета, больные шизофренией более склонны по сравнению с общей популяцией к развитию ожирения, в том числе за счет получаемой ими длительной антипсихотической терапии [Allison D.B. et al., 1999]. Увеличение веса может влиять на самооценку и приводить к большему дискомфорту, чем седация или сексуальная дисфункция. Негативная оценка ожирения среди окружающих и у самого больного препятствует реинтеграции в общество. Отрицательное отношение к ожирению может вести к социальному снижению в таких областях как занятость, образование и семейная жизнь [Green A.I. et al., 2000]. Вместе с серьезными медицинскими проблемами, вызываемыми увеличением веса, нарушение социальной адаптации требует пристального внимания со стороны врача. Некоторые исследователи считают, что седативный эффект антипсихотиков ответственен за снижение физической активности, которое и ведет к уменьшению утилизации калорий [Wick J.Y., 1998]. Способствовать развитию ожирения могут также следующие факторы: снижение физической активности, в том числе вследствие длительной госпитализации или вынужденного пребывания дома, негативная симптоматика, изменение социального и экономического статуса и др. Все это свидетельствует о том, что ожирение у больных шизофренией является мультифакторным феноменом.
Большинство исследований показывает, что антипсихотики способствуют развитию ожирения за счет увеличения аппетита. Потенциальные механизмы увеличения веса включают в себя антигистаминовый эффект, седацию и, как следствие – снижение физической активности, антагонизм к серотонину и влияние на уровень TNF–α и лептина в плазме [Henderson D.C., 2001], а также, возможно, гиперпролактинемию и другие гормональные нарушения, включая прямое угнетающее воздействие на инсулярный аппарат поджелудочной железы.
Таким образом, среди основных факторов, способствующих увеличению веса при лечении атипичными антипсихотиками, можно выделить: 1) биологические и генетические факторы (особенности печеночного метаболизма и предрасположенность к диабету); 2) клинико–демографические факторы (женский пол, молодой возраст и низкий вес до начала терапии); 3) факторы окружающей среды (отсутствие привычки к физическим упражнениям, бытовой стресс, питание с преобладанием жирной пищи, изменение социального и экономического статуса).
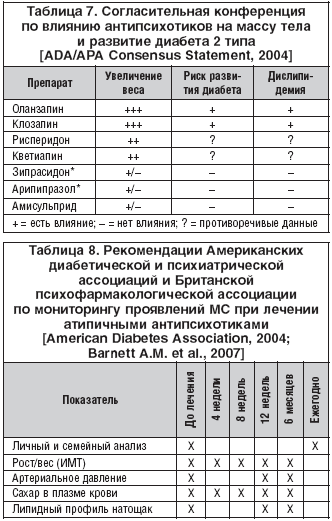
Хотя эффекты второго поколения антипсихотиков на массу тела, содержание сахара в крови и липидный профиль существенно различаются по отдельным препаратам, имеющиеся научные и клинические доказательства, а также мнения экспертов свидетельствуют, что наиболее часто метаболические нарушения, включая диабет 2 типа и МС в целом, встречаются при применении клозапина и оланзапина. В меньшей степени их вызывают рисперидон и кветиапин и значительно реже – зипрасидон, арипипразол и амисульприд, которые практически не влияют на обмен веществ и лишь у некоторых больных могут приводить к умеренному набору веса (табл. 7).
Исходя из этих данных с целью ранней диагностики и профилактики развития МС профессиональные экспертные организации рекомендуют проводить скрининг предрасположенных больных и тщательный мониторинг проявлений МС на всем протяжении лечения атипичными антипсихотиками (табл. 8). Между тем при осуществлении интегративного подхода к длительной терапии больных шизофрении именно на врача–психиатра ложится ответственность за выявление коморбидных соматических заболеваний; регулярное обследование соматического состояния больных, включая мониторинг веса, объема талии, ЭКГ, определение липидного профиля и глюкозы в крови; специальный (прицельный) опрос больных и их родственников о соматических симптомах возможных побочных эффектов антипсихотиков; проведение психообразовательных программ; взаимодействие с терапевтами; и главное – за адекватный (с учетом полученной информации о соматическом состоянии больного) выбор антипсихотической фармакотерапии.
Диета, физическая активность и поведенческая терапия являются основными способами борьбы с увеличением веса, вызванным нейролептиками [Yanovski J.A., Yanovski S.Z., 1999]. Появились работы и о возможности фармакологического вмешательства в этих случаях. Например, избирательные антагонисты гистаминовых рецепторов 2 типа могут применяться для коррекции индуцированного антипсихотиками увеличения веса тела. В частности, низатидин показал способность уменьшать вызванное оланзапином увеличение веса [Sacchetti E. et al., 2000]. Агонисты дофамина (амантадин) также способны противодействовать повышению веса тела, вызванному оланзапином [Floris M., et al., 2001].
Метаболические нарушения могут быть минимизированы оптимизацией терапевтической стратегии, включающей подбор препарата, медленную титрацию либо снижение дозы [Keks N.A., 1996]. Кроме того, всем больным, принимающим атипичные антипсихотики, рекомендуется мониторинг уровня глюкозы каждые 3–4 месяца на протяжении первого года терапии. Особое внимание следует уделять пациентам из группы риска, к которым, по мнению Американской ассоциации диабета, относятся больные с уровнем глюкозы крови натощак ≥6,1 ммоль/л, но ≤7,0 ммоль/л, с отягощенной наследственностью по диабету, ожирением, гипертензией (≥140/90 мм рт.ст.), высоким уровнем триглицеридов (≥2,8 ммоль/л), наличием диабета во время беременности или поликистоза яичников.
Таким образом, с появлением нового поколения антипсихотических препаратов изменились наши представления о структуре и клинической значимости побочных эффектов. Нейролептический паркинсонизм и другие экстрапирамидные побочные явления, которые считались неотъемлемыми проявлениями лечебного процесса, встречаются все реже. Практические врачи стали чаще обращать внимание на случаи развития метаболических нарушений и некоторые другие нежелательные явления (сердечно–сосудистые, сексуальной сферы и т.д.). Риск возникновения МС во время проведения антипсихотической терапии требует повышенной ответственности со стороны врача, особенно при длительной противорецидивной терапии. Многие из возможных осложнений легче предупредить, чем бороться с их проявлениями. Этим определяется необходимость проведения мониторинга веса тела, уровня глюкозы и триглицеридов в крови, своевременное выявление факторов риска и быстрая коррекция терапии в случае выявления неблагоприятных тенденций.




Литература:
1. Ader M., Kim S.P., Catalano K.J. et al. Metabolic dysregulation with atypical antipsychotics occurs in the absence of underlying disease: a placebo–controlled study of olanzapine and risperidone in dogs //Diabetes, 2005, Vol.54, p.862–871.
2. Allison D.B., Fontaine K.R., Manson J.E. et al. Annual deaths attributable to obesity in the United States. // JAMA, 1999, vol. 282, p. 1530–1538.
3. Allison D.B., Mentore J.L., Heo M. et al. Antipsychotic–induced weight gain: a comprehensive research synthesis. // Am. J. Psychiatry, 1999, vol. 156, p. 1686–1696.
4. American Diabetes Association; American Psychiatric Association; American Association of Clinical Endocrinologists; North American Association for the Study of Obesity/ Consensus development conference on antipsychotic drugs and obesity and diabetes /Diabetes Care, 2004, Vol.27, p.596–601.
5. Arato M., O’Connor R., Meltzer H.Y. A 1–year, double–blind, placebo–controlled trial of ziprasidone 40, 80 and 160 mg/day in chronic schizophrenia: the Ziprasidone Extended Use in Schizophrenia (ZEUS) study //Int. Clin. Psychopharmacol., 2002, Vol.17, p.207–215.
6. Aronne L.J. Epidemiology, morbidity, and treatment of overweight and obesity. // J. Clin. Psychiatry, 2001, vol. 62, suppl. 23, p. 13–22.
7. Arvanitis L.A., Miller B.G. Multiple fixed doses of “Seroquel” (quetiapine) in patients with acute exacerbation of schizophrenia: a comparison with haloperidol and placebo //Biol. Psychiatry, 1997, Vol.42, p.233–246.
8. Bai Y.M., Lin C.C., Chen J.Y. et al. Weight gain among patients on clozapine. // Psychiatr. Serv., 1999, vol. 50, p. 704–705.
9. Baptista T. Body weight induced by antipsychotic drugs: mechanisms and management. // Acta Psychiatr. Scand., 1999, vol. 100, p. 3–16.
10. Basile V.S., Masellis M., McIntyre R.S. et al. Genetic dissection of atypical antipsychotic–induced weigt gain: novel preliminary data on the pharmacogenetic puzzle. // J.Clin.Psychiatry, 2001, vol. 62, suppl. 23, p. 45–66.
11. Beasley C.V.Jr., Hamilton S.H., Crawford A.M. et al. Olanzapine versus haloperidol: acute phase results of the international double–blind olanzapine trial //Eur. Neuropsychopharmacol., 1997, Vol.7, p.125–137.
12. Beasley C.V.Jr., Sanger T., Satterlee W. Et al. Olanzapine versus placebo: results of a double–blind, fixed–dose olanzapine trial //Psychopharmacology (Berl), 1996, Vol.124, p.159–167.
13. Best L., Yates A.P., Reynolds G.P. Actions of antipsychotic drugs on pancreatic ?–cell function: contrasting effects of clozapine and haloperidol //J.Psychopharm., 2005, Vol.19, p.597–601.
14. Bogetto F., Bellino S., Vaschetto P. et al. Olanzapine augmentation of fluvoxamine–refractory obsessive–compulsive disorder (OCD): a 12–week open trail. // Psychiatry Res., 2000, vol. 96, p. 91–98.
15. Borison R.L., Arvanitis L.A., Miller B.G. ICI 204,636, an atypical antipsychotic: efficacy and safety in a multicenter, placebo–controlled trial in patients with schizophrenia //J. Clin. Psychopharmacol., 1996, Vol.16, p.158–169.
16. Braceland F.J., Meduna L.J., Vaichulis J.A. Delayed action of insulin in schizophrenia. // Am. J. Psychiatry, 1945, vol. 102, p. 108–110.
17. Brandt G.T., Norwood A.E., Ursano R.J. Diabetic ketoacidosis associated with clozapine treatment. // Am. J. Psychiatry, 1995, vol. 151, p. 1520–1521.
18. Brecher M., Rak I.W., Westhead E.K. et al. The long–term effect of quetiapine (‘Seroquel’) monotherapy on weight in patients with schizophrenia. // Int. J. Psychiatry Clin. Pract, 2000, vol. 4, p. 287–292.
19. Bullo–Bonet M., Garcia–Lorda P., Lopez–Soriano F.J. et al. Tumor necrosis factor, a key role in obesity? // FEBS Lett, 1999, vol 451, p. 215–219.
20. Bustillo J.R. Buchanan R.W., Irish D. et al. Differential effect of clozapine on weight: a controlled study. // Am. J. Psychiatry, 1996, vol. 153, p. 817–819.
21. Caro J., Ward A., Levinton C. et al. The risk of developing diabetes in users of atypical antipsychotics. Presented at the 39th Annual Meeting of the American College of Neuropsychopharmacology, December 10–14, 2000, San Juan, Puerto Rico.
22. Casey D.E. Metabolic issues and cardiovascular disease in patients with psychiatric disorders //Am J. Med., 2005, Vol.118 (suppl. 2), S.15–22.
23. Casey D.E., Carson W.H., Saha A.R. et al. Switching patients to aripiprazole from other antipsychotic agents: a multicenter randomized study //Psychopharmacology (Berl.), 2003, Vol.166, p.391–399.
24. Casey D.E., Haupt D.W., Newcomer J.W. et al. Antipsychotic–induced weight gain and metabolic abnormalities: implications for increased mortality in patients with schizophrenia //J. Clin. Psychiatry, 2004, Vol.65, p.4–18.
25. Claus A., Bollen J., De Cuyper H. et al. Risperidone versus haloperidol in the treatment of chronic schizophrenic inpatients: a multicentre double–blind comparative study //Acta Psychiatr. Scand., 1992, Vol.85., p.295–305.
26. Cohen S., Glazewski R., Khan S. et al. Weight gain with risperidone among patients with mental retardation: effect of calorie restriction. // J. Clin. Psychiatry, 2001, vol. 62, p. 114–116.
27. Conley R.R., Mahmoud R. A randomized double–blind study of risperidone and olanzapine in the treatment of schizophrenia or schizoaffective disorder. // Am. J. Psychiatry, 2001, vol. 158, p. 765–774.
28. Cornblatt B., Kern R.S., Carson W.H. et al. Neurocognitive effects of aripiprazole versus olanzapine in stable psychosis [abstract] //Int. J. Neuropsychopharmacol., 2002, Vol.5 (suppl.1), S.185.
29. Czobor P., Volavka J., Sheitman B. et al. Antipsychotic–induced weight gain and therapeutic response: a differential association. // J. Clin. Psychopharmacol, 2002, vol. 22, p. 244–251.
30. Daniel D.G., Tolerability of ziprasidone: an expanding perspective //J. Clin. Psychiatry, 2003, Vol.64 (suppl. 19), p.40–49.
31. Daniel D.G., Zimbroff D.L., Potkin S.G. et al. Ziprasidone 80 mg/day and 160 mg/day in the exacerbation of schizophrenia and schizoaffective disorder: a 6–week placebo–controlled trial /Ziprasidone Study Group //Neuropsychopharmacology, 1999, Vol.20, p.491–505.
32. Dixon L., Postrado L., Delahanty J et al. The association of medical comorbidity in schizophrenia with poor physical and mental health. // J. Nerv. Ment. Dis., 1999, vol. 187, p. 496–502.
33. Dixon L., Weiden P., Delahanty J et al. Prevalence and correlates of diabetes in national schizophrenia samples. // Schizophr. Bull., 2000, vol. 26, p. 903–912.
34. Durano–Arvizu R.A., McGee D.L., Cooper R.S. et al. Mortality and optimal body mass index in a sample of the US population. // Am. J. Epidemiol., 1998, vol. 147, p. 739–749.
35. Eaton W.W., Mortensen P.B., Herman H. et al. Long–term course of hospitalization for schizophrenia, pt. 1: risk for rehospitalization //Schizophr. Bull., 1992, Vol.18, p.217–228.
36. Emsley R.A. Risperidone in the treatment of first–episode psychotic patients: a double–blind multicenter study /Risperidone Working Group //Schizophr. Bull., 1999, Vol.25, p.721–729.
37. EUFAMI survey data. Available at : www.eufami.org. Accessed June 16, 2001.
38. Floris M., Lejeune J., Deberdt W. Effect of amantadine on weight gain during olanzapine treatment. // Eur. Neuropsychopharmacol., 2001, vol. 11, p. 181–182.
39. Ganguli R. Weight g








.gif)



