Введение
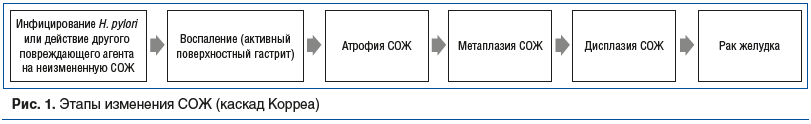
Инфекция Helicobacter pylori и ассоциированные с ней заболевания верхних отделов желудочно-кишечного тракта (ЖКТ) являются важной проблемой гастроэнтерологии. Стандартная антихеликобактерная терапия позволяет избавить организм от возбудителя заболеваний, но, к сожалению, в ряде случаев не гарантирует быстрый регресс воспалительных изменений в слизистой оболочке желудка (СОЖ) и полное купирование симптомов желудочной диспепсии. Сохранение воспаления в СОЖ после эрадикации микроорганизма означает и сохранение риска повреждения СОЖ [1]. Такой феномен обозначают терминами «постэрадикационный синдром» или «постэрадикационный гастрит», а также «экс-хеликобактерный гастрит» [2, 3]. В основе развития данного патологического состояния лежат несколько факторов. Воспалительная инфильтрация нейтрофильными гранулоцитами СОЖ связана с продукцией активных форм кислорода и последующим развитием окислительного стресса, что в итоге приводит как к прямому, так и к опосредованному действием цитокинов повреждению СОЖ. Подобная воспалительная инфильтрация может рассматриваться как фактор риска развития эрозивно-язвенных изменений в СОЖ, а также формирования атрофии СОЖ [3, 4]. Атрофия же в последующем может трансформироваться в кишечную метаплазию, дисплазию и неоплазию СОЖ (рис. 1) [5]. Длительное воздействие активных форм кислорода приводит к необратимым повреждениям ДНК, накапливающимся с течением времени, что также является основой для развития рака желудка [6].
Кроме того, у части пациентов постэрадикационный гастрит может быть связан не только с оксидативным стрессом, но и с изменением микробиоты желудка и контаминацией СОЖ другими микроорганизмами, например Staphylococcus aureus, Klebsiella pneumoniae, Proteus mirabilis, Enterobacter cloacae, Citrobacter freundii, что является дополнительным фактором поддержания воспаления [7, 8]. Так, в исследовании Е.И. Ермоленко и соавт. [9] бактерии родов Proteus, Klebsiella и Enterobacter определялись только в образцах, взятых у пациентов, инфицированных H. pylori, и не определялись в биоптатах H. pylori-негативных больных, а представительство энтерококков и лактобацилл в желудке H. pylori-позитивных пациентов было снижено, что говорит о более выраженных изменениях микробиоты желудка на фоне персистенции возбудителя в СОЖ.
Постэрадикационный гастрит и атрофия СОЖ
Вышеуказанные патологические процессы, запускаемые на ранних стадиях развития гастрита, существенно замедляют редукцию хронического воспаления в СОЖ больных хроническим гастритом. По данным М.А. Ливзан и соавт. [10], через 1 год после проведения стандартной эрадикационной терапии полная редукция воспалительных изменений СОЖ при гистологическом исследовании гастробиоптатов отмечена лишь у 13,2% пролеченных, у 58,6% пациентов наблюдался частичный регресс воспалительных изменений, а у 28,2% больных сохранялась выраженность воспалительных изменений. В работе K. Uno et al. [11] также показано, что увеличивается число спорадических случаев первичного/метахронного гастрита, возникающих после успешной эрадикации возбудителя. Кроме того, при атрофическом гастрите индекс апоптоза мононуклеарных клеток собственной пластинки остается неизменным, что свидетельствует о длительном течении воспалительных процессов в желудке и сохранении апоптотических процессов в желудочном эпителии, которые приводят к прогрессированию атрофии СОЖ [2]. Помимо риска медленного регресса воспаления после проведенной антихеликобактерной терапии, существует риск сохранения и прогрессирования атрофических изменений СОЖ. Согласно постулатам VI Маастрихтского консенсуса после успешной эрадикации H. pylori пациенты с высокой стадией (OLGA/OLGIM III–IV) гастрита и/или обширной атрофией, установленной эндоскопически, остаются подверженными риску развития рака желудка [12]. С другой стороны, эрадикация H. pylori может обратить вспять атрофию СОЖ и, в некоторой степени, кишечную метаплазию и остановить прогрессирование от хронического атрофического гастрита до опухолевых поражений у подгруппы пациентов, а терапия наиболее эффективна для профилактики рака желудка до развития тяжелого хронического атрофического гастрита [12]. Эти постулаты свидетельствуют о том, что атрофия СОЖ может и должна лечиться, что важно для профилактики и лечения постэрадикационного гастрита и профилактики рака желудка. К сожалению, только эрадикационная терапия не является достаточным и исчерпывающим методом лечения хронического гастрита. Лечение H. pylori-ассоциированных заболеваний требует комплексного терапевтического воздействия, включающего коррекцию оксидативных нарушений, снижение выраженности воспалительного процесса и редукцию атрофического процесса.
Сложности и варианты постэрадикационной терапии
В настоящее время существуют определенные сложности лечения постэрадикационных состояний и изменений СОЖ, поскольку, в отличие от четко прописанных и утвержденных схем антихеликобактерной терапии, клинические стандарты ведения пациента в ранний пост-эрадикационный период не разработаны. В различных исследованиях оценивается эффективность использования пробиотиков, препаратов висмута, цитопротекторов совместно со стандартными схемами эрадикации, а также после окончания их применения. Крайне актуальным является использование препаратов с комплексным противовоспалительным и регенераторным механизмом действия в постэрадикационном периоде, особенно у пациентов с хроническим атрофическим гастритом.
Включение пробиотиков в схемы эрадикационной терапии способствует повышению эффективности эрадикации, снижению частоты и тяжести побочных эффектов антибиотиков и увеличению приверженности пациентов лечению. Потенциальные механизмы действия пробиотиков против H. pylori включают не только коррекцию кишечной микробиоты, но и иммунологические эффекты (повышение гуморального и клеточного иммунитета, снижение окислительного стресса), прямые антагонистические эффекты против H. pylori (колонизационная резистентность и синтез бактериоцинов) и стимуляцию местной иммунологической защиты (укрепление защитного барьера и уменьшение воспаления СОЖ) [13].
Применение висмута трикалия дицитрата обусловлено растущей устойчивостью H. pylori к кларитромицину. Препараты висмута все чаще включаются в схемы лечения первой линии для повышения терапевтической эффективности. Отмечают отсутствие первичной и вторичной резистентности H. pylori к этим препаратам, а также снижение риска развития побочных эффектов, вызванных антибиотиками, таких как диарея и дисбиоз кишечника [14]. Препараты висмута защищают клетки СОЖ от повреждающего действия продуктов воспаления, предотвращая прогрессирование гастрита, в том числе постэрадикационного [15]. Важным положительным эффектом препаратов висмута является подавление процессов перекисного окисления липидов с одновременной защитой ДНК, т. е. препараты висмута можно рассматривать как «ловушки» свободных радикалов [16].
В качестве примера цитопротектора можно привести ребамипид, который обеспечивает защиту слизистой оболочки ЖКТ, стимулируя синтез простагландинов и ингибируя продукты перекисного окисления, провоспалительные цитокины и хемокины. Препарат улучшает кровоснабжение СОЖ, повышает синтез гликопротеинов и бикарбонатов, усиливает пролиферацию эпителиальных клеток желудка [17, 18]. Еще в 1998 г. было показано, что ребамипид уменьшает адгезию H. pylori к эпителиальным клеткам желудка в культуре клеток [19], и дальнейшие исследования подтверждают антихеликобактерное действие препарата [20–22]. Для того, чтобы добиться существенного регресса морфологических признаков гастрита со снижением инфильтрации нейтрофилами и моноцитами на фоне H. pylori и/или после эрадикации инфекции, необходимо длительное (6–12 мес.) лечение ребамипидом [23, 24].
Новые возможности терапевтической коррекции постэрадикационного гастрита
Высокую эффективность в отношении обеспечения регресса воспалительных и атрофических изменений СОЖ показал альфа-глутамил-триптофан (Регастим Гастро). Регенераторная и противовоспалительная эффективность данного дипептида была обоснована в экспериментах H. Ohashi et al. [25], показавших его способность активировать mGlu-R-Ia и mGlu-R-III (метаботропные глутаматные рецепторы), которые, в свою очередь, запускают внутриклеточный регуляторный каскад, что позволяет ускорить пролиферацию и дифференцировку различных клеток. Кроме того, отмечена способность альфа-глутамил-триптофана ускорять восстановление структуры межклеточного матрикса за счет модуляции активности матриксных металлопротеиназ [26]. В опытах на лабораторных животных показано, что профилактическое введение альфа-глутамил-триптофана значимо снижало риски возникновения язвенных поражений ЖКТ, вызванных индометацином, с уменьшением площади изъязвления СОЖ в 5 раз; уменьшало количество и площадь язвенных поражений желудка, вызванных стрессом, до 2,6 раза; способствовало снижению в сыворотке крови концентрации конечного продукта оксидативного стресса — малонового диальдегида в 2,1 раза и повышению активности супероксиддисмутазы в 1,6 раза по сравнению с показателями контрольной группы [27]. Применение альфа-глутамил-триптофана у лиц, подверженных воздействию неблагоприятных факторов химической природы, приводило к достоверному снижению заболеваемости органов пищеварения в 2,3 раза — с 152,4 до 66,7‰. При этом снижение уровня заболеваемости желудочно-кишечной патологией сохранялось у обследованных в течение 1 года [28].
По данным двойного слепого рандомизированного плацебо-контролируемого многоцентрового исследования, этот препарат обладает мощным противовоспалительным и регенераторным действием. При оценке динамики эндоскопических показателей на фоне применения альфа-глутамил-триптофана (Регастим Гастро) было обнаружено статистически значимое снижение выраженности отека СОЖ более чем на 20% (р<0,01), общей суммы признаков острого воспалительного процесса (толщина складок, гиперемия, отек СОЖ; выраженность эрозивного процесса) (р<0,01) при сравнении с показателями исходного состояния [29]. При анализе исходов воспалительного процесса (улучшение, отсутствие динамики, ухудшение) выявлено статистически значимое (χ2=4,35; р=0,038) снижение частоты исходов с негативной динамикой патологического процесса в группе пациентов, принимающих Регастим Гастро (6,9%), по сравнению с группой плацебо (27,6%) [30]. Статистически значимое уменьшение количества клеток воспалительной инфильтрации в группе исследования было отмечено для параметров как острого воспаления (нейтрофильная инфильтрация), так и хронического воспаления (лимфоплазмоцитарная инфильтрация) [29].
Помимо мощного противовоспалительного действия у альфа-глутамил-триптофана ранее был выявлен и регенераторный эффект [31], который проявлялся в увеличении количества желез на 1 мм2 СОЖ в группе пациентов, принимающих альфа-глутамил-триптофан, по сравнению с исходными данными и при межгрупповом сравнении. На фоне терапии в группе пациентов, принимавших альфа-глутамил-триптофан (Регастим Гастро), отмечалось увеличение числа желез на 1 мм2 СОЖ на 26% (р<0,05), тогда как в группе плацебо — снижение числа желез на 1 мм2 СОЖ на 22,9% (р<0,05). Это может свидетельствовать о прогрессивном течении атрофического процесса, несмотря на проведение антихеликобактерной терапии в группе плацебо. При сравнении результатов лечения между группами выявлено, что после приема альфа-глутамил-триптофана число желез на 1 мм2 СОЖ было статистически значимо больше в группе исследуемого препарата по сравнению с группой плацебо (р<0,05). Сочетание двух позитивных эффектов — противовоспалительного и регенераторного позволяет рассматривать альфа-глутамил-триптофан как средство, способствующее уменьшению проявлений постэрадикационного воспаления СОЖ и ее атрофии, т. е. обладающее антиканцерогенной активностью.
Для выявления взаимосвязи эндоскопической картины воспалительного процесса с гистологическими параметрами воспаления был проведен корреляционный анализ между показателями воспалительного процесса, выраженного в условных единицах по данным фиброгастродуоденоскопии (ФГДС), и данными морфометрии по количеству клеток воспаления на 1 мм2 СОЖ: выявлены статистически значимые (р<0,05) корреляции между эндоскопическими и морфометрическими данными. Наиболее выражены были корреляционные связи между количеством эозинофильных гранулоцитов и наличием гиперемии (r=0,272195, p<0,05) и эрозий (r=0,295834, p<0,05) СОЖ, а также лимфоцитов и наличием гиперемии СОЖ (r=0,252885, p<0,05) [31]. Следует отметить, что регресс воспаления СОЖ происходит и на фоне использования стандартной эрадикационной терапии [32, 33], поэтому все пациенты, в том числе получавшие плацебо, на первом этапе терапии находились под воздействием фактора, способного повлиять на выраженность воспалительного процесса. Следовательно, более значимая редукция воспалительного процесса на фоне приема альфа-глутамил-триптофана (Регастим Гастро) позволяет рассматривать его как средство, способствующее повышению качества и эффективности эрадикационной терапии, а также уменьшающее частоту встречаемости и выраженность постэрадикационного гастрита.
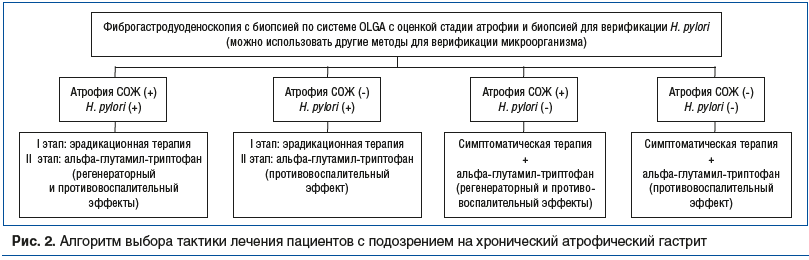
Основываясь на имеющихся данных, в качестве практической рекомендации для широкой медицинской практики можно предложить алгоритм выбора тактики лечения пациентов с подозрением на хронический атрофический гастрит (рис. 2).
Заключение
Повышение эффективности противовоспалительной терапии при хронических гастритах, в том числе ассоциированных с H. pylori, имеет существенную клиническую значимость. Для профилактики и лечения постэрадикационного гастрита и профилактики рака желудка крайне важно включать в схемы комплексной терапии инфекции H. pylori средства с мощным регенераторным и противовоспалительным эффектом. Согласно данным ФГДС и морфометрии, альфа-глутамил-триптофан (Регастим Гастро) способствует статистически значимому уменьшению выраженности воспалительного процесса в СОЖ у больных хроническим атрофическим гастритом, а также обладает регенераторным эффектом, что позволит максимально быстро и в полной мере купировать проявления воспаления СОЖ и закрепить противовоспалительный эффект антихеликобактерной терапии. В контексте имеющихся данных назначение данного препарата можно рассматривать как способ профилактики постэрадикационного гастрита и повышения эффективности терапии этой категории больных.
Конфликт интересов
Успенский Ю.П., Барышникова Н.В., Фоминых Ю.А. декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи; Петленко С.В., Краснов А.А., Апрятина В.А. работают по совместительству в АО МБНПК «Цитомед». При подготовке рукописи авторы сохранили независимость мнений.








.gif)



