
–£–≤–Β–¥–Β–Ϋ–Η–Β
–ü–Α―Ü–Η–Β–Ϋ―²―΄ ―¹ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è–Φ–Η –Ω–Β―΅–Β–Ϋ–Η –Η–Φ–Β―é―² –≤―΄―¹–Ψ–Κ–Η–Ι ―Ä–Η―¹–Κ ―Ä–Α–Ζ–≤–Η―²–Η―è –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Ι –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α. –½–Α―΅–Α―¹―²―É―é –Ψ―à–Η–±–Ψ―΅–Ϋ–Ψ ―¹―΅–Η―²–Α–Β―²―¹―è, ―΅―²–Ψ –Ω–Α―Ü–Η–Β–Ϋ―²―΄ ―¹ ―Ü–Η―Ä―Ä–Ψ–Ζ–Ψ–Φ –Ω–Β―΅–Β–Ϋ–Η (–Π–ü) –Ζ–Α―â–Η―â–Β–Ϋ―΄ –Ψ―² ―Ä–Α–Ζ–≤–Η―²–Η―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Ψ–≤ –¥–Β―³–Η―Ü–Η―²–Ψ–Φ ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ ―¹–≤–Β―Ä―²―΄–≤–Α–Ϋ–Η―è –Κ―Ä–Ψ–≤–Η, –Ψ–¥–Ϋ–Α–Κ–Ψ, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –Ω―Ä–Β–¥―Ä–Α―¹–Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Κ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è–Φ, ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü –Φ–Ψ–≥―É―² –≤–Ψ–Ζ–Ϋ–Η–Κ–Α―²―¨ ―²―Ä–Ψ–Φ–±–Ψ―²–Η―΅–Β―¹–Κ–Η–Β ―è–≤–Μ–Β–Ϋ–Η―è [1, 2]. –ü–Ψ–¥–±–Ψ―Ä –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü –Η ―Ä–Α–Ζ–Ϋ–Ψ–Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Ϋ―΄–Φ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è–Φ–Η –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α –Ω―Ä–Β–¥―¹―²–Α–≤–Μ―è–Β―² ―²―Ä―É–¥–Ϋ–Ψ―¹―²–Η –Η ―²―Ä–Β–±―É–Β―² –Ϋ–Β–Ω―Ä–Β―Ä―΄–≤–Ϋ–Ψ–≥–Ψ –Η ―²―â–Α―²–Β–Μ―¨–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ϋ–Η―²–Ψ―Ä–Η–Ϋ–≥–Α. –ü―Ä–Β–¥―¹―²–Α–≤–Η–Φ ―¹–Ψ–±―¹―²–≤–Β–Ϋ–Ϋ–Ψ–Β –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Β –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η–Β ―É―¹–Ω–Β―à–Ϋ–Ψ–≥–Ψ –Ω–Ψ–¥–±–Ψ―Ä–Α –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Π–ü, ―¹–Ψ―¹―²–Ψ―è–≤―à–Η–Φ―¹―è –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η–Β–Φ –Η ―²―Ä–Ψ–Φ–±–Ψ―ç–Φ–±–Ψ–Μ–Η–Β–Ι –Μ–Β–≥–Ψ―΅–Ϋ–Ψ–Ι –Α―Ä―²–Β―Ä–Η–Η (–Δ–≠–¦–ê).
–ö–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Β –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η–Β
–ü–Α―Ü–Η–Β–Ϋ―² –î., 46 –Μ–Β―², ―Ä–Ψ―¹―² 175 ―¹–Φ, –Φ–Α―¹―¹–Α ―²–Β–Μ–Α 70 –Κ–≥, –Ω–Ψ―¹―²―É–Ω–Η–Μ –≤ –Ψ―²–¥–Β–Μ–Β–Ϋ–Η–Β ―Ä–Β–Α–Ϋ–Η–Φ–Α―Ü–Η–Η –Η –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η (–û–†–‰–Δ) –Η–Ζ –Ω―Ä–Η–Β–Φ–Ϋ–Ψ–≥–Ψ –Ψ―²–¥–Β–Μ–Β–Ϋ–Η―è –Ω–Ψ –Κ–Α–Ϋ–Α–Μ―É ―¹–Κ–Ψ―Ä–Ψ–Ι –Φ–Β–¥–Η―Ü–Η–Ϋ―¹–Κ–Ψ–Ι –Ω–Ψ–Φ–Ψ―â–Η, –Φ–Η–Ϋ―É―è –Ω―Ä–Η–Β–Φ–Ϋ–Ψ–Β –Ψ―²–¥–Β–Μ–Β–Ϋ–Η–Β, –≤ ―¹–≤―è–Ζ–Η ―¹ ―Ä–Α–Ζ–≤–Η―²–Η–Β–Φ –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η. –‰–Ζ –Α–Ϋ–Α–Φ–Ϋ–Β–Ζ–Α –±―΄–Μ–Ψ –Η–Ζ–≤–Β―¹―²–Ϋ–Ψ, ―΅―²–Ψ –Ω–Α―Ü–Η–Β–Ϋ―², –Φ–Ϋ–Ψ–≥–Η–Β –≥–Ψ–¥―΄ –Ζ–Μ–Ψ―É–Ω–Ψ―²―Ä–Β–±–Μ―è–≤―à–Η–Ι –Α–Μ–Κ–Ψ–≥–Ψ–Μ–Β–Φ, –±–Ψ–Μ–Β–Ϋ –≤ ―²–Β―΅–Β–Ϋ–Η–Β 3 –¥–Ϋ–Β–Ι, –Κ–Ψ–≥–¥–Α –Ω–Ψ―è–≤–Η–Μ―¹―è ―¹―²―É–Μ ―΅–Β―Ä–Ϋ–Ψ–≥–Ψ ―Ü–≤–Β―²–Α. –£ –Α–Ϋ–Α–Φ–Ϋ–Β–Ζ–Β: ―Ü–Β―Ä–Β–±―Ä–Ψ–≤–Α―¹–Κ―É–Μ―è―Ä–Ϋ–Α―è –±–Ψ–Μ–Β–Ζ–Ϋ―¨ (–Π–£–ë), –Ζ–Α–Κ―Ä―΄―²–Α―è ―΅–Β―Ä–Β–Ω–Ϋ–Ψ-–Φ–Ψ–Ζ–≥–Ψ–≤–Α―è ―²―Ä–Α–≤–Φ–Α (–½–ß–€–Δ), ―É―à–Η–± –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α (–Θ–™–€), –≤–Ϋ―É―²―Ä–Η–Φ–Ψ–Ζ–≥–Ψ–≤–Α―è –≥–Β–Φ–Α―²–Ψ–Φ–Α –Μ–Ψ–±–Ϋ–Ψ–Ι –¥–Ψ–Μ–Η, ―²―Ä–Α–≤–Φ–Α―²–Η―΅–Β―¹–Κ–Ψ–Β ―¹―É–±–Α―Ä–Α―Ö–Ϋ–Ψ–Η–¥–Α–Μ―¨–Ϋ–Ψ–Β –Κ―Ä–Ψ–≤–Ψ–Η–Ζ–Μ–Η―è–Ϋ–Η–Β (–Γ–ê–ö), –¥–Β–Κ–Ψ–Φ–Ω―Ä–Β―¹―¹–Η–≤–Ϋ–Α―è ―²―Ä–Β–Ω–Α–Ϋ–Α―Ü–Η―è ―΅–Β―Ä–Β–Ω–Α, ―É–¥–Α–Μ–Β–Ϋ–Η–Β –≥–Β–Φ–Α―²–Ψ–Φ―΄ –≤ 2019 –≥. –ü―Ä–Η –Ω–Ψ―¹―²―É–Ω–Μ–Β–Ϋ–Η–Η –Ω–Α―Ü–Η–Β–Ϋ―² –±―΄–Μ –≤–Ψ–Ζ–±―É–Ε–¥–Β–Ϋ, –Κ―Ä–Η―²–Η–Κ–Α –Κ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―é –Ψ―²―¹―É―²―¹―²–≤–Ψ–≤–Α–Μ–Α. –ü―Ä–Η –Ψ―¹–Φ–Ψ―²―Ä–Β –Ψ–±―Ä–Α―â–Α–Μ–Η –Ϋ–Α ―¹–Β–±―è –≤–Ϋ–Η–Φ–Α–Ϋ–Η–Β –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–Ι –¥―΄―Ö–Α―²–Β–Μ―¨–Ϋ–Ψ–Ι –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η, –≤–Κ–Μ―é―΅–Α―è –¥–Η―³―³―É–Ζ–Ϋ―΄–Ι ―Ü–Η–Α–Ϋ–Ψ–Ζ, –Η –Η–Κ―²–Β―Ä–Η―΅–Ϋ–Ψ―¹―²―¨ ―¹–Κ–Μ–Β―Ä. –ù–Α –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Η–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–Ι –Κ–Α―Ä―²–Η–Ϋ―΄ –Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Ψ–≤ –Ω–Α―Ä–Ϋ―΄―Ö –Ω―Ä–Ψ–± –≥–Α–Ζ–Ψ–≤–Ψ–≥–Ψ ―¹–Ψ―¹―²–Α–≤–Α –Κ―Ä–Ψ–≤–Η (–Α―Ä―²–Β―Ä–Η―è/–≤–Β–Ϋ–Α) –Ω–Α―Ü–Η–Β–Ϋ―² –±―΄–Μ –Ω–Β―Ä–Β–≤–Β–¥–Β–Ϋ –Ϋ–Α –Η―¹–Κ―É―¹―¹―²–≤–Β–Ϋ–Ϋ―É―é –≤–Β–Ϋ―²–Η–Μ―è―Ü–Η―é –Μ–Β–≥–Κ–Η―Ö.
–ù–Β―¹―²–Α–±–Η–Μ―¨–Ϋ–Ψ―¹―²―¨ –≥–Β–Φ–Ψ–¥–Η–Ϋ–Α–Φ–Η–Κ–Η –Ω–Ψ―²―Ä–Β–±–Ψ–≤–Α–Μ–Α –≤–≤–Β–¥–Β–Ϋ–Η―è –Η–Ϋ–Ψ―²―Ä–Ψ–Ω–Ϋ―΄―Ö –Η –≤–Α–Ζ–Ψ–Ω―Ä–Β―¹―¹–Ψ―Ä–Ϋ―΄―Ö –Ω―Ä–Β–Ω–Α―Ä–Α―²–Ψ–≤ –Η –Η–Ϋ―³―É–Ζ–Η–Ψ–Ϋ–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η.
–ü―Ä–Η –Ω–Ψ―¹―²―É–Ω–Μ–Β–Ϋ–Η–Η –≤ –û–†–‰–Δ –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ―΄ ―¹–Μ–Β–¥―É―é―â–Η–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è.
–Θ–Μ―¨―²―Ä–Α–Ζ–≤―É–Κ–Ψ–≤–Α―è –¥–Ψ–Ω–Ω–Μ–Β―Ä–Ψ–≥―Ä–Α―³–Η―è (–Θ–½–î–™) –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι: –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –Ψ–Κ–Κ–Μ―é–Ζ–Η―Ä―É―é―â–Β–≥–Ψ ―³–Β–Φ–Ψ―Ä–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α ―¹–Μ–Β–≤–Α.
–Θ–½–‰ –Ω–Μ–Β–≤―Ä–Α–Μ―¨–Ϋ–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η: –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –≥–Η–¥―Ä–Ψ–Ω–Β―Ä–Η–Κ–Α―Ä–¥–Α, –Ε–Η–¥–Κ–Ψ―¹―²―¨ –≤ –Ω–Μ–Β–≤―Ä–Α–Μ―¨–Ϋ―΄―Ö –Ω–Ψ–Μ–Ψ―¹―²―è―Ö –Ψ―²―¹―É―²―¹―²–≤―É–Β―².
–≠–Ζ–Ψ―³–Α–≥–Ψ–≥–Α―¹―²―Ä–Ψ–¥―É–Ψ–¥–Β–Ϋ–Ψ―¹–Κ–Ψ–Ω–Η―è (–≠–™–î–Γ): ―³–Η–±―Ä–Η–Ϋ–Ψ–Ζ–Ϋ–Ψ-―ç―Ä–Ψ–Ζ–Η–≤–Ϋ―΄–Ι ―ç–Ζ–Ψ―³–Α–≥–Η―² ―¹ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Α–Φ–Η ―¹–Ψ―¹―²–Ψ―è–≤―à–Β–≥–Ψ―¹―è –Κ―Ä–Ψ–≤–Ψ-―²–Β―΅–Β–Ϋ–Η―è.
–Θ–½–‰ –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –±―Ä―é―à–Ϋ–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η: –Ω–Β―΅–Β–Ϋ―¨: –Κ–Ψ―¹–Ψ–Ι –≤–Β―Ä―²–Η–Κ–Α–Μ―¨–Ϋ―΄–Ι ―Ä–Α–Ζ–Φ–Β―Ä –Ω―Ä–Α–≤–Ψ–Ι –¥–Ψ–Μ–Η –Φ–Β–Ϋ–Β–Β 150 –Φ–Φ, ―²–Ψ–Μ―â–Η–Ϋ–Α –Μ–Β–≤–Ψ–Ι –¥–Ψ–Μ–Η –Φ–Β–Ϋ–Β–Β 70 –Φ–Φ. –ü–Α―Ä–Β–Ϋ―Ö–Η–Φ–Α –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–Ι ―ç―Ö–Ψ–≥–Β–Ϋ–Ϋ–Ψ―¹―²–Η. –ü–Ψ–¥–Ε–Β–Μ―É–¥–Ψ―΅–Ϋ–Α―è –Ε–Β–Μ–Β–Ζ–Α –Ψ–±―΄―΅–Ϋ–Ψ–Ι ―³–Ψ―Ä–Φ―΄, –Ω–Α―Ä–Β–Ϋ―Ö–Η–Φ–Α –≥–Ψ–Φ–Ψ–≥–Β–Ϋ–Ϋ–Α―è, –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–Ι ―ç―Ö–Ψ–≥–Β–Ϋ–Ϋ–Ψ―¹―²–Η, –Κ–Ψ–Ϋ―²―É―Ä―΄ ―΅–Β―²–Κ–Η–Β, ―Ä–Ψ–≤–Ϋ―΄–Β. –Γ–Β–Μ–Β–Ζ–Β–Ϋ–Κ–Α ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Α: –Κ–Ψ–Ϋ―²―É―Ä―΄ –Ϋ–Β―΅–Β―²–Κ–Η–Β, –Ω–Α―Ä–Β–Ϋ―Ö–Η–Φ–Α –≥–Ψ–Φ–Ψ–≥–Β–Ϋ–Ϋ–Α―è.
–û–±–Ζ–Ψ―Ä–Ϋ―΄–Ι ―¹–Ϋ–Η–Φ–Ψ–Κ –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –±―Ä―é―à–Ϋ–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η –Η –Φ–Α–Μ–Ψ–≥–Ψ ―²–Α–Ζ–Α: –¥–Α–Ϋ–Ϋ―΄–Β –Ζ–Α –Ϋ–Α–Μ–Η―΅–Η–Β ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–≥–Ψ –≥–Α–Ζ–Α –Ψ―²―¹―É―²―¹―²–≤―É―é―².
–ö–Δ –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α: –ö–Δ-–Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –Κ–Η―¹―²–Ψ–Ζ–Ϋ―΄―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι –≤ –Μ–Β–≤–Ψ–Ι –≤–Η―¹–Ψ―΅–Ϋ–Ψ–Ι –¥–Ψ–Μ–Β, ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β –Ω–Ψ―¹–Μ–Β ―²―Ä–Β–Ω–Α–Ϋ–Α―Ü–Η–Η ―΅–Β―Ä–Β–Ω–Α.
–ö–Δ –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –≥―Ä―É–¥–Ϋ–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η ―¹ –Κ–Ψ–Ϋ―²―Ä–Α―¹―²–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β–Φ: –Ψ―΅–Α–≥–Ψ–≤―΄―Ö –Η –Η–Ϋ―³–Η–Μ―¨―²―Ä–Α―²–Η–≤–Ϋ―΄―Ö –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι –≤ –Μ–Β–≥–Κ–Η―Ö –Ϋ–Β –Ψ–Ω―Ä–Β–¥–Β–Μ―è–Β―²―¹―è. –ü–Ϋ–Β–≤–Φ–Α―²–Η–Ζ–Α―Ü–Η―è –Μ–Β–≥–Ψ―΅–Ϋ–Ψ–Ι ―²–Κ–Α–Ϋ–Η –Ϋ–Β―Ä–Α–≤–Ϋ–Ψ–Φ–Β―Ä–Ϋ–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Α –≤ ―¹–Β–≥–Φ–Β–Ϋ―²–Α―Ö S6, S1, S3 ―¹–Μ–Β–≤–Α, S10 ―¹–Ω―Ä–Α–≤–Α. –£ –Ψ–±–Ψ–Η―Ö –Μ–Β–≥–Κ–Η―Ö ―¹–Ω–Α–Ι–Κ–Η. –Γ–Ω―Ä–Α–≤–Α –Β–¥–Η–Ϋ–Η―΅–Ϋ―΄–Β –±―É–Μ–Μ―΄. –¦–Β–≥–Ψ―΅–Ϋ―΄–Ι ―Ä–Η―¹―É–Ϋ–Ψ–Κ –Ω―Ä–Ψ―¹–Μ–Β–Ε–Η–≤–Α–Β―²―¹―è, –Ϋ–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ. –Γ―Ä–Β–¥–Ψ―¹―²–Β–Ϋ–Η–Β –±–Β–Ζ –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ―¹―²–Β–Ι. –Γ–Β―Ä–¥―Ü–Β –Η –Κ―Ä―É–Ω–Ϋ―΄–Β ―¹–Ψ―¹―É–¥―΄ –Ψ–±―΄―΅–Ϋ–Ψ ―Ä–Α―¹–Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ―΄, –Ϋ–Β ―Ä–Α―¹―à–Η―Ä–Β–Ϋ―΄. –£ –Ω–Ψ–Μ–Ψ―¹―²–Η –Ω–Β―Ä–Η–Κ–Α―Ä–¥–Α –≤―΄–Ω–Ψ―² 9,6 –Φ–Φ. –£ –Ω―Ä–Α–≤–Ψ–Ι –Η –Μ–Β–≥–Ψ―΅–Ϋ―΄―Ö –Α―Ä―²–Β―Ä–Η―è―Ö –≤–Η–Ζ―É–Α–Μ–Η–Ζ–Η―Ä―É―é―²―¹―è –Φ–Α―¹―¹–Η–≤–Ϋ―΄–Β –¥–Β―³–Β–Κ―²―΄ –Κ–Ψ–Ϋ―²―Ä–Α―¹―²–Η―Ä–Ψ–≤–Α–Ϋ–Η―è, ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ―è―é―â–Η–Β―¹―è –Ϋ–Α –≤―¹–Β ―¹–Β–≥–Φ–Β–Ϋ―²–Α―Ä–Ϋ―΄–Β –≤–Β―²–Κ–Η ―¹–Ω―Ä–Α–≤–Α –Η ―¹–Μ–Β–≤–Α. –û―Ü–Β–Ϋ–Κ–Α –Ω–Ψ ―à–Κ–Α–Μ–Β Miller βÄî 16 –±–Α–Μ–Μ–Ψ–≤.
–≠―Ö–Ψ–ö–™: ―Ä–Α―¹―à–Η―Ä–Β–Ϋ–Η–Β –≤―¹–Β―Ö –Κ–Α–Φ–Β―Ä ―¹–Β―Ä–¥―Ü–Α. –ü―Ä–Η–Ζ–Ϋ–Α–Κ–Η –≥–Η–Ω–Β―Ä―²―Ä–Ψ―³–Η–Η –Μ–Β–≤–Ψ–≥–Ψ –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Α. –ù–Α―Ä―É―à–Β–Ϋ–Η―è –Μ–Ψ–Κ–Α–Μ―¨–Ϋ–Ψ–Ι ―¹–Ψ–Κ―Ä–Α―²–Η–Φ–Ψ―¹―²–Η –Μ–Β–≤–Ψ–≥–Ψ –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Α. –Λ―Ä–Α–Κ―Ü–Η―è –≤―΄–±―Ä–Ψ―¹–Α –Μ–Β–≤–Ψ–≥–Ψ –Ε–Β–Μ―É–¥–Ψ―΅–Κ–Α 64%, –Κ–Ψ–Ϋ–Β―΅–Ϋ―΄–Ι –¥–Η–Α―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Η–Ι –Ψ–±―ä–Β–Φ 85 –Φ–Μ, –Κ–Ψ–Ϋ–Β―΅–Ϋ―΄–Ι ―¹–Η―¹―²–Ψ–Μ–Η―΅–Β―¹–Κ–Η–Ι –Ψ–±―ä–Β–Φ 30 –Φ–Μ. –ê―²–Β―Ä–Ψ―¹–Κ–Μ–Β―Ä–Ψ―²–Η―΅–Β―¹–Κ–Η–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –Α–Ψ―Ä―²―΄, –Α–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Κ–Μ–Α–Ω–Α–Ϋ–Α ―¹ ―³–Ψ―Ä–Φ–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β–Φ ―¹―²–Β–Ϋ–Ψ–Ζ–Α I ―¹―²–Α–¥–Η–Η –Η –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²–Η I ―¹―²–Α–¥–Η–Η. –ê―²–Β―Ä–Ψ―¹–Κ–Μ–Β―Ä–Ψ―²–Η―΅–Β―¹–Κ–Η–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è, –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ –Φ–Η―²―Ä–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Κ–Μ–Α–Ω–Α–Ϋ–Α IβÄ™II ―¹―²–Α–¥–Η–Η, ―²―Ä–Η–Κ―É―¹–Ω–Η–¥–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Κ–Μ–Α–Ω–Α–Ϋ–Α βÄî IβÄ™III ―¹―²–Α–¥–Η–Η. –ö–Ψ―¹–≤–Β–Ϋ–Ϋ―΄–Β –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –Μ–Β–≥–Ψ―΅–Ϋ–Ψ–Ι –≥–Η–Ω–Β―Ä―²–Β–Ϋ–Ζ–Η–Η 2-–Ι ―¹―²–Β–Ω–Β–Ϋ–Η (–¥–Α–≤–Μ–Β–Ϋ–Η–Β –≤ –Μ–Β–≥–Ψ―΅–Ϋ–Ψ–Ι –Α―Ä―²–Β―Ä–Η–Η 75 –Φ–Φ ―Ä―². ―¹―².).
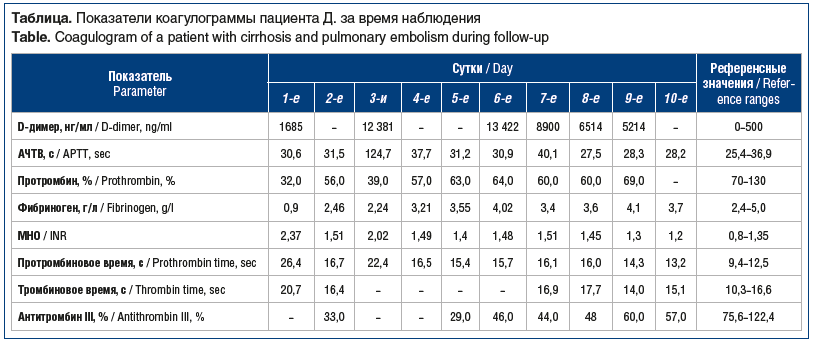
–£ –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄―Ö –Α–Ϋ–Α–Μ–Η–Ζ–Α―Ö –Ψ–±―Ä–Α―â–Α–Μ–Ψ –Ϋ–Α ―¹–Β–±―è –≤–Ϋ–Η–Φ–Α–Ϋ–Η–Β –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ―è –Ψ–±―â–Β–≥–Ψ –±–Η–Μ–Η―Ä―É–±–Η–Ϋ–Α –¥–Ψ 38,1 –Φ–Κ–Φ–Ψ–Μ―¨/–Μ, –≥–Η–Ω–Ψ–Α–Μ―¨–±―É–Φ–Η–Ϋ–Β–Φ–Η―è (28,7 –≥/–Μ), –Α–Ϋ–Β–Φ–Η―è (–≥–Β–Φ–Ψ–≥–Μ–Ψ–±–Η–Ϋ 29 –≥/–Μ), ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è –¥–Ψ 2Ο½109/–Μ. –ß―²–Ψ–±―΄ –Η―¹–Κ–Μ―é―΅–Η―²―¨ –Ψ―à–Η–±–Κ―É, ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²―΄ –±―΄–Μ–Η –Ω–Β―Ä–Β―¹―΅–Η―²–Α–Ϋ―΄ –≤―Ä―É―΅–Ϋ―É―é, ―Ä–Β–Ζ―É–Μ―¨―²–Α―² ―¹–Ψ―¹―²–Α–≤–Η–Μ 3,3Ο½109/–Μ. –£ –Κ–Ψ–Α–≥―É–Μ–Ψ–≥―Ä–Α–Φ–Φ–Β –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Ψ–Β ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ―è –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ–Α –¥–Ψ 32%, –€–ù–û 2,37, –≥–Η–Ω–Ψ―³–Η–±―Ä–Η–Ϋ–Ψ–≥–Β–Ϋ-–Β–Φ–Η―è 0,9 –≥/–Μ, –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ―è D-–¥–Η–Φ–Β―Ä–Α –¥–Ψ 1685 –Ϋ–≥/–Φ–Μ.
–ü–Β―Ä–≤–Η―΅–Ϋ–Α―è –Ψ―Ü–Β–Ϋ–Κ–Α –¥–Α–Ϋ–Ϋ―΄―Ö ―²―Ä–Ψ–Φ–±–Ψ―ç–Μ–Α―¹―²–Ψ–Φ–Β―²―Ä–Η–Η: –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ–Α―è –≥–Η–Ω–Ψ–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η―è –≤ 3 ―²–Β―¹―²–Α―Ö, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β ―¹ –Ϋ–Η–Ζ–Κ–Ψ–Ι –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²―¨―é ―³–Η–±―Ä–Η–Ϋ–Ψ–≤–Ψ–≥–Ψ ―¹–≥―É―¹―²–Κ–Α. –Γ―²–Ψ–Η―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ ―¹–Η―¹―²–Β–Φ―΄ –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α –Ω–Β―Ä–≤–Η―΅–Ϋ–Ψ –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ –¥–Ψ ―ç–Ϋ–¥–Ψ–≤–Α―¹–Κ―É–Μ―è―Ä–Ϋ―΄―Ö –≤–Φ–Β―à–Α―²–Β–Μ―¨―¹―²–≤ (―¹–Φ. ―²–Α–±–Μ–Η―Ü―É).
–Θ―΅–Η―²―΄–≤–Α―è –Ϋ–Α–Μ–Η―΅–Η–Β ―³–Μ–Ψ―²–Η―Ä―É―é―â–Β–≥–Ψ ―²―Ä–Ψ–Φ–±–Α –≤ –≤–Β–Ϋ–Α―Ö –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι –Η –Δ–≠–¦–ê, ―΅–Β―Ä–Β–Ζ 4 ―΅ –Ψ―² –Ω–Ψ―¹―²―É–Ω–Μ–Β–Ϋ–Η―è –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Α –Κ–Α–≤–Α–≥―Ä–Α―³–Η―è –Η –Η–Φ–Ω–Μ–Α–Ϋ―²–Α―Ü–Η―è –Κ–Α–≤–Α-―³–Η–Μ―¨―²―Ä–Α. –£ ―¹–≤―è–Ζ–Η ―¹ –≤―΄―Ä–Α–Ε–Β–Ϋ–Ϋ―΄–Φ–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è–Φ–Η –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α –Ψ―² –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―Ä–Β―à–Β–Ϋ–Ψ –Ψ―²–Κ–Α–Ζ–Α―²―¨―¹―è –¥–Ψ ―¹―²–Α–±–Η–Μ–Η–Ζ–Α―Ü–Η–Η –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι ―¹–≤–Β―Ä―²―΄–≤–Α―é―â–Β–Ι ―¹–Η―¹―²–Β–Φ―΄ –Κ―Ä–Ψ–≤–Η.
–û―¹–Ϋ–Ψ–≤–Ϋ–Ψ–Ι –¥–Η–Α–≥–Ϋ–Ψ–Ζ: –Φ–Α―¹―¹–Η–≤–Ϋ–Α―è –Δ–≠–¦–ê (16 –±–Α–Μ–Μ–Ψ–≤ –Ω–Ψ ―à–Κ–Α–Μ–Β Miller). –‰–Ϋ―³–Α―Ä–Κ―²-–Ω–Ϋ–Β–≤–Φ–Ψ–Ϋ–Η―è. –Δ―Ä–Ψ–Φ–±–Ψ–Ζ –Ω–Ψ–¥–Κ–Ψ–Μ–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ ―¹–Ω―Ä–Α–≤–Α, –Ψ–±―â–Β–Ι –±–Β–¥―Ä–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ ―¹–Μ–Β–≤–Α. –‰–Φ–Ω–Μ–Α–Ϋ―²–Α―Ü–Η―è –Κ–Α–≤–Α-―³–Η–Μ―¨―²―Ä–Α.
–ö–Ψ–Ϋ–Κ―É―Ä–Η―Ä―É―é―â–Η–Ι –¥–Η–Α–≥–Ϋ–Ψ–Ζ: –Α–Μ–Κ–Ψ–≥–Ψ–Μ―¨–Ϋ―΄–Ι ―Ü–Η―Ä―Ä–Ψ–Ζ –Ω–Β―΅–Β–Ϋ–Η, –Κ–Μ–Α―¹―¹ –£ –Ω–Ψ –ß–Α–Ι–Μ–¥ βÄî –ü―¨―é, 9 –±–Α–Μ–Μ–Ψ–≤. –™–Β–Ω–Α―²–Ψ―Ä–Β–Ϋ–Α–Μ―¨–Ϋ―΄–Ι ―¹–Η–Ϋ–¥―Ä–Ψ–Φ. –≠–Ϋ―Ü–Β―³–Α–Μ–Ψ–Ω–Α―²–Η―è ―¹–Φ–Β―à–Α–Ϋ–Ϋ–Ψ–≥–Ψ –≥–Β–Ϋ–Β–Ζ–Α. –Ξ―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Α―è –Α–Μ–Κ–Ψ–≥–Ψ–Μ―¨–Ϋ–Α―è –Η–Ϋ―²–Ψ–Κ―¹–Η–Κ–Α―Ü–Η―è ―¹ –Ω–Ψ–Μ–Η–Ψ―Ä–≥–Α–Ϋ–Ϋ―΄–Φ–Η –Ω―Ä–Ψ―è–≤–Μ–Β–Ϋ–Η―è–Φ–Η.
–Γ–Ψ–Ω―É―²―¹―²–≤―É―é―â–Η–Β –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è: ―³–Η–±―Ä–Η–Ϋ–Ψ–Ζ–Ϋ–Ψ-―ç―Ä–Ψ–Ζ–Η–≤–Ϋ―΄–Ι ―ç–Ζ–Ψ―³–Α–≥–Η―² ―¹ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Α–Φ–Η ―¹–Ψ―¹―²–Ψ―è–≤―à–Β–≥–Ψ―¹―è –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è. –½–ß–€–Δ. –Θ–™–€, –≤–Ϋ―É―²―Ä–Η–Φ–Ψ–Ζ–≥–Ψ–≤–Α―è –≥–Β–Φ–Α―²–Ψ–Φ–Α –Μ–Β–≤–Ψ–Ι –Μ–Ψ–±–Ϋ–Ψ–Ι –¥–Ψ–Μ–Η, ―²―Ä–Α–≤–Φ–Α―²–Η―΅–Β―¹–Κ–Ψ–Β –Γ–ê–ö –≤ 2019 –≥., –¥–Β–Κ–Ψ–Φ–Ω―Ä–Β―¹―¹–Η–Ψ–Ϋ–Ϋ–Α―è ―²―Ä–Β–Ω–Α–Ϋ–Α―Ü–Η―è ―΅–Β―Ä–Β–Ω–Α –≤ –Μ–Β–≤–Ψ–Ι –≤–Η―¹–Ψ―΅–Ϋ–Ψ-―²–Β–Φ–Β–Ϋ–Ϋ–Ψ–Ι –Ψ–±–Μ–Α―¹―²–Η ―¹ ―É–¥–Α–Μ–Β–Ϋ–Η–Β–Φ –≥–Β–Φ–Α―²–Ψ–Φ―΄. –Π–£–ë. –Ξ―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Α―è –Η―à–Β–Φ–Η―è –≥–Ψ–Μ–Ψ–≤–Ϋ–Ψ–≥–Ψ –Φ–Ψ–Ζ–≥–Α II ―¹―²–Α–¥–Η–Η, –Κ–Ψ–≥–Ϋ–Η―²–Η–≤–Ϋ―΄–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è, ―¹―²–Α―²–Ψ–¥–Η–Ϋ–Α–Φ–Η―΅–Β―¹–Κ–Η–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è, ―Ü–Β―³–Α–Μ–≥–Η―΅–Β―¹–Κ–Η–Ι ―¹–Η–Ϋ–¥―Ä–Ψ–Φ. –™–Η–Ω–Β―Ä―²–Ψ–Ϋ–Η―΅–Β―¹–Κ–Α―è –±–Ψ–Μ–Β–Ζ–Ϋ―¨ II ―¹―²–Α–¥–Η–Η, –Α―Ä―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Α―è –≥–Η–Ω–Β―Ä―²–Β–Ϋ–Ζ–Η―è 2-–Ι ―¹―²–Β–Ω–Β–Ϋ–Η, ―Ä–Η―¹–Κ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ-―¹–Ψ―¹―É–¥–Η―¹―²―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι 4. –ê–Ϋ–Β–Φ–Η―è ―²―è–Ε–Β–Μ–Ψ–Ι ―¹―²–Β–Ω–Β–Ϋ–Η ―¹–Φ–Β―à–Α–Ϋ–Ϋ–Ψ–≥–Ψ –≥–Β–Ϋ–Β–Ζ–Α, –≤―²–Ψ―Ä–Η―΅–Ϋ–Α―è ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è.
–ù–Α 4-–Β ―¹―É―²–Κ–Η –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Α –Ψ―Ü–Β–Ϋ–Κ–Α ―²―Ä–Ψ–Φ–±–Ψ–¥–Η–Ϋ–Α–Φ–Η–Κ–Η. –£―Ä–Β–Φ―è –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è ―¹–Ω–Ψ–Ϋ―²–Α–Ϋ–Ϋ―΄―Ö ―¹–≥―É―¹―²–Κ–Ψ–≤ ―¹–Ψ―¹―²–Α–≤–Η–Μ–Ψ 22 –Φ–Η–Ϋ, ―Ä–Α–Ζ–Φ–Β―Ä ―¹–≥―É―¹―²–Κ–Α ―΅–Β―Ä–Β–Ζ 30 –Φ–Η–Ϋ 1356 ―É―¹–Μ. –Β–¥., ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨ ―Ä–Ψ―¹―²–Α ―¹–≥―É―¹―²–Κ–Α 36,1, ―¹―²–Α―Ü–Η–Ψ–Ϋ–Α―Ä–Ϋ–Α―è ―¹–Κ–Ψ―Ä–Ψ―¹―²―¨ ―Ä–Ψ―¹―²–Α ―¹–≥―É―¹―²–Κ–Α 36,1.
–Γ–Κ–Ψ―Ä–Ψ―¹―²–Ϋ―΄–Β ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ–Η ―Ä–Ψ―¹―²–Α ―¹–≥―É―¹―²–Κ–Α –Ϋ–Α―Ö–Ψ–¥–Η–Μ–Η―¹―¨ –≤ –Ζ–Ψ–Ϋ–Β –≥–Η–Ω–Β―Ä–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η–Η. –Λ–Η–Κ―¹–Η―Ä―É–Β―²―¹―è –≤―Ä–Β–Φ―è –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η―è –Ψ―΅–Α–≥–Ψ–≤ ―¹–Ω–Ψ–Ϋ―²–Α–Ϋ–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η―è –≤–Ϋ–Β –Ζ–Ψ–Ϋ―΄ –Κ–Ψ–Ϋ―²–Α–Κ―²–Α ―¹ –Α–Κ―²–Η–≤–Α―²–Ψ―Ä–Ψ–Φ. –™–Η–Ω–Β―Ä–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η―è. –ù–Ψ―Ä–Φ–Ψ―³–Η–±―Ä–Η–Ϋ–Ψ–≥–Β–Ϋ–Β–Φ–Η―è. –ë―΄–Μ–Ψ ―Ä–Β―à–Β–Ϋ–Ψ –Ϋ–Α–Ζ–Ϋ–Α―΅–Η―²―¨ –Ϋ–Η–Ζ–Κ–Ψ–Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ―΄–Ι –≥–Β–Ω–Α―Ä–Η–Ϋ –≤ –¥–Ψ–Ζ–Η―Ä–Ψ–≤–Κ–Β 4000 –Α–Ϋ―²–Η-–Ξ–Α –€–ï 1 ―Ä–Α–Ζ –≤ ―¹―É―²–Κ–Η.
–ü–Ψ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α–Φ –Ψ–±―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ϋ–Α 4-–Β ―¹―É―²–Κ–Η –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η–Β –Μ–Β–≤–Ψ―¹―²–Ψ―Ä–Ψ–Ϋ–Ϋ–Β–≥–Ψ –≥–Η–¥―Ä–Ψ―²–Ψ―Ä–Α–Κ―¹–Α, –Ω―Ä–Η –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ–Ψ–Ι –Θ–½–î–™ –≤–Β–Ϋ –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι –≤―΄―è–≤–Μ–Β–Ϋ―΄ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –Ψ–Κ–Κ–Μ―é–Ζ–Η–≤–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –≥–Μ―É–±–Ψ–Κ–Η―Ö –≤–Β–Ϋ –≥–Ψ–Μ–Β–Ϋ–Η, –Ω–Ψ–¥–Κ–Ψ–Μ–Β–Ϋ–Ϋ–Ψ–Ι –Η –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²–Ϋ–Ψ–Ι –±–Β–¥―Ä–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ ―¹–Μ–Β–≤–Α, ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –Ψ–±―â–Β–Ι –±–Β–¥―Ä–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ –Μ–Β–≤–Ψ–Ι –Ϋ–Η–Ε–Ϋ–Β–Ι –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Η ―¹ –Ϋ–Α―΅–Α–Μ―¨–Ϋ–Ψ–Ι ―Ä–Β–Κ–Α–Ϋ–Α–Μ–Η–Ζ–Α―Ü–Η–Β–Ι. –ü―Ä–Η –ö–Δ –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –≥―Ä―É–¥–Ϋ–Ψ–Ι –Κ–Μ–Β―²–Κ–Η –Ϋ–Α 4-–Β ―¹―É―²–Κ–Η –Ψ―²–Φ–Β―΅–Α–Μ–Α―¹―¨ –Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ–Α―è –¥–Η–Ϋ–Α–Φ–Η–Κ–Α –≤ –≤–Η–¥–Β –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è –≤―΄–Ω–Ψ―²–Α –≤ –Ω–Μ–Β–≤―Ä–Α–Μ―¨–Ϋ–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η –Η ―É―΅–Α―¹―²–Κ–Ψ–≤ –Κ–Ψ–Ϋ―¹–Ψ–Μ–Η–¥–Α―Ü–Η–Η –≤ –Ω–Α―Ä–Β–Ϋ―Ö–Η–Φ–Β –Ψ–±–Ψ–Η―Ö –Μ–Β–≥–Κ–Η―Ö. –Γ ―É―΅–Β―²–Ψ–Φ –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤ –Ω–Ϋ–Β–≤–Φ–Ψ–Ϋ–Η–Η –Ϋ–Α―΅–Η–Ϋ–Α―è ―¹ 4-―Ö ―¹―É―²–Ψ–Κ –Ω―Ä–Β–±―΄–≤–Α–Ϋ–Η―è –≤ –û–†–‰–Δ –±―΄–Μ–Α –Ϋ–Α―΅–Α―²–Α –Α–Ϋ―²–Η–±–Α–Κ―²–Β―Ä–Η–Α–Μ―¨–Ϋ–Α―è ―²–Β―Ä–Α–Ω–Η―è ―Ü–Β―³–Α–Μ–Ψ―¹–Ω–Ψ―Ä–Η–Ϋ–Α–Φ–Η IV –Ω–Ψ–Κ–Ψ–Μ–Β–Ϋ–Η―è –≤ ―Ä–Α―¹―΅–Β―²–Ϋ–Ψ–Ι –¥–Ψ–Ζ–Β. –Γ―²–Ψ–Η―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –Μ–Η―Ö–Ψ―Ä–Α–¥–Κ–Α –Ζ–Α –Ω–Β―Ä–≤―΄–Β 4 ―¹―É―² –Ϋ–Α―Ö–Ψ–Ε–¥–Β–Ϋ–Η―è –≤ –û–†–‰–Δ –Ϋ–Β –Ϋ–Α–±–Μ―é–¥–Α–Μ–Α―¹―¨.
–ù–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―É―é –Ψ―²―Ä–Η―Ü–Α―²–Β–Μ―¨–Ϋ―É―é –¥–Η–Ϋ–Α–Φ–Η–Κ―É –Ω–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –ö–Δ, –Κ 5-–Φ ―¹―É―²–Κ–Α–Φ ―É–¥–Α–Μ–Ψ―¹―¨ –Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Η―Ä–Ψ–≤–Α―²―¨ –≥–Α–Ζ–Ψ–≤―΄–Ι ―¹–Ψ―¹―²–Α–≤ –Κ―Ä–Ψ–≤–Η, –Ω―Ä–Ψ–≤–Β―¹―²–Η –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨–Ϋ―΄–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –≥–Α–Ζ–Ψ–Ψ–±–Φ–Β–Ϋ–Α, –≤―΄–Ω–Ψ–Μ–Ϋ–Η―²―¨ ―ç–Κ―¹―²―É–±–Α―Ü–Η―é –Η –Ω–Β―Ä–Β–≤–Β―¹―²–Η –Ω–Α―Ü–Η–Β–Ϋ―²–Α –Ϋ–Α –≤―΄―¹–Ψ–Κ–Ψ–Ω–Ψ―²–Ψ―΅–Ϋ―É―é –Ψ–Κ―¹–Η–≥–Β–Ϋ–Α―Ü–Η―é. –û―Ü–Β–Ϋ–Κ–Α –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η –≤–Ψ–Μ–Β–Φ–Η–Η –Ω―Ä–Ψ–≤–Ψ–¥–Η–Μ–Α―¹―¨ ―¹ ―É―΅–Β―²–Ψ–Φ –≤―¹–Β―Ö ―²–Β―¹―²–Ψ–≤, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Θ–½-–Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―è –Ϋ–Η–Ε–Ϋ–Β–Ι –Ω–Ψ–Μ–Ψ–Ι –≤–Β–Ϋ―΄ –Η –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η―è –Η–Ϋ–≤–Α–Ζ–Η–≤–Ϋ―΄―Ö –Φ–Β―²–Ψ–¥–Ψ–≤ –Ψ―Ü–Β–Ϋ–Κ–Η –≥–Β–Φ–Ψ–¥–Η–Ϋ–Α–Φ–Η–Κ–Η.
–ù–Α 5-–Β ―¹―É―²–Κ–Η –Ω―Ä–Β–±―΄–≤–Α–Ϋ–Η―è –Ω–Α―Ü–Η–Β–Ϋ―²–Α –≤ –û–†–‰–Δ –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Α ―²―Ä–Ψ–Φ–±–Ψ―ç–Μ–Α―¹―²–Ψ–Φ–Β―²―Ä–Η―è (ROTEM). –£–Ϋ–Ψ–≤―¨ –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β –≤―Ä–Β–Φ–Β–Ϋ–Η –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η―è ―¹–≥―É―¹―²–Κ–Α –Ω–Ψ―΅―²–Η –≤ 3 ―Ä–Α–Ζ–Α –≤ ―²–Β―¹―²–Α―Ö EXTEM, INTEM, FIBTEM, –Ω―Ä–Η ―É–¥–Ψ–≤–Μ–Β―²–≤–Ψ―Ä–Η―²–Β–Μ―¨–Ϋ–Ψ–Ι –Ω–Μ–Ψ―²–Ϋ–Ψ―¹―²–Η ―³–Η–±―Ä–Η–Ϋ–Ψ–≤–Ψ–≥–Ψ ―¹–≥―É―¹―²–Κ–Α (MCF 12 –Φ–Φ), –Ω―Ä–Η –Ψ―²―¹―É―²―¹―²–≤–Η–Η –Μ–Η–Ζ–Η―¹–Α –≤ ―²–Β―΅–Β–Ϋ–Η–Β –≤―Ä–Β–Φ–Β–Ϋ–Η –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è (ML0%, –≤―Ä–Β–Φ―è –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è –Ω―Ä–Ψ–±―΄ 1 ―΅ 6 –Φ–Η–Ϋ).
–Γ ―É―΅–Β―²–Ψ–Φ –¥–Α–Ϋ–Ϋ―΄―Ö –Ζ–Α ―Ä–Β―Ü–Η–¥–Η–≤ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è –Ω–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –≠–™–î–Γ –Ψ―² –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Ϋ–Α 5βÄ™7-–Β ―¹―É―²–Κ–Η ―Ä–Β―à–Β–Ϋ–Ψ –Ψ―²–Κ–Α–Ζ–Α―²―¨―¹―è. –ù–Α 8-–Β ―¹―É―²–Κ–Η –Ω–Ψ –Θ–½–î–™ –≤–Β–Ϋ –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι –Ψ―²–Φ–Β―΅–Α–Β―²―¹―è –Ψ―²―¹―É―²―¹―²–≤–Η–Β –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α. –Θ–½–‰ –Ψ―Ä–≥–Α–Ϋ–Ψ–≤ –±―Ä―é―à–Ϋ–Ψ–Ι –Ω–Ψ–Μ–Ψ―¹―²–Η –≤ –¥–Η–Ϋ–Α–Φ–Η–Κ–Β –Ζ–Α –≤―Ä–Β–Φ―è –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è βÄî –±–Β–Ζ –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Ψ–≤ ―¹–≤–Ψ–±–Ψ–¥–Ϋ–Ψ–Ι –Ε–Η–¥–Κ–Ψ―¹―²–Η. –Δ–Β―Ä–Α–Ω–Η―è –Ϋ–Η–Ζ–Κ–Ψ–Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ―΄–Φ –≥–Β–Ω–Α―Ä–Η–Ϋ–Ψ–Φ –Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Β–Ϋ–Α –≤ –¥–Ψ–Ζ–Β 4000 –Α–Ϋ―²–Η-–Ξ–Α –€–ï 1 ―Ä–Α–Ζ –≤ ―¹―É―²–Κ–Η –Ω–Ψ–¥ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ–Β–Φ –Κ–Ψ–Α–≥―É–Μ–Ψ–≥―Ä–Α–Φ–Φ―΄ –Η ―²―Ä–Ψ–Φ–±–Ψ–¥–Η–Ϋ–Α–Φ–Η–Κ–Η.
–ù–Α 9-–Β ―¹―É―²–Κ–Η –Ω―Ä–Β–±―΄–≤–Α–Ϋ–Η―è –Ω–Α―Ü–Η–Β–Ϋ―²–Α –≤ –û–†–‰–Δ –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Α ―²―Ä–Ψ–Φ–±–Ψ―ç–Μ–Α―¹―²–Ψ–Φ–Β―²―Ä–Η―è (ROTEM): –Ϋ–Ψ―Ä–Φ–Ψ–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η―è –≤ 3 ―²–Β―¹―²–Α―Ö.
–½–Α –≤―Ä–Β–Φ―è –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è –†–ù–ö SARS-CoV-2 –Ψ–±–Ϋ–Α―Ä―É–Ε–Β–Ϋ–Ψ –Ϋ–Β –±―΄–Μ–Ψ, –Ϋ–Β –Ζ–Α―Ä–Β–≥–Η―¹―²―Ä–Η―Ä–Ψ–≤–Α–Ϋ–Ψ –Ζ–Ϋ–Α―΅–Η–Φ―΄―Ö –Κ–Ψ–Μ–Β–±–Α–Ϋ–Η–Ι –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―²―Ä–Α–Ϋ―¹–Α–Φ–Η–Ϋ–Α–Ζ (–ê–¦–Δ 58,7βÄ™123,6 –ï–¥/–Μ, –ê–Γ–Δ 32,1βÄ™223,9 –ï–¥/–Μ), ―É―Ä–Ψ–≤–Ϋ–Β–Ι –Γ-―Ä–Β–Α–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ –±–Β–Μ–Κ–Α (12,5βÄ™119,4 –Φ–≥/–Μ), –Κ―Ä–Β–Α―²–Η–Ϋ–Η–Ϋ–Α (55,1βÄ™85,4 –Φ–Κ–Φ–Ψ–Μ―¨/–Μ), –Φ–Ψ―΅–Β–≤–Η–Ϋ―΄ (6,26βÄ™10,64 –Φ–Φ–Ψ–Μ―¨/–Μ), ―â–Β–Μ–Ψ―΅–Ϋ–Ψ–Ι ―³–Ψ―¹―³–Α―²–Α–Ζ―΄ (99,0βÄ™159,1 –ï–¥/–Μ), –Ω―Ä–Ψ–Κ–Α–Μ―¨―Ü–Η―²–Ψ–Ϋ–Η–Ϋ–Α (0,24βÄ™0,53 –Ϋ–≥/–Φ–Μ) (―É–Κ–Α–Ζ–Α–Ϋ―΄ –Φ–Η–Ϋ–Η–Φ–Α–Μ―¨–Ϋ–Ψ–Β –Η –Φ–Α–Κ―¹–Η–Φ–Α–Μ―¨–Ϋ–Ψ–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η―è). –û–¥–Ϋ–Α–Κ–Ψ –Ϋ–Α –≤―¹–Β–Φ –Ω―Ä–Ψ―²―è–Ε–Β–Ϋ–Η–Η –≤―Ä–Β–Φ–Β–Ϋ–Η –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η―è ―¹–Ψ―Ö―Ä–Α–Ϋ―è–Μ–Η―¹―¨ –≥–Η–Ω–Ψ–Ω―Ä–Ψ―²–Β–Η–Ϋ–Β–Φ–Η―è –Η –≥–Η–Ω–Ψ–Α–Μ―¨–±―É–Φ–Η–Ϋ–Β–Φ–Η―è (22,9βÄ™32,0 –≥/–Μ), –≥–Η–Ω–Β―Ä–±–Η–Μ–Η―Ä―É–±–Η–Ϋ-–Β–Φ–Η―è (–Ψ–±―â–Η–Ι –±–Η–Μ–Η―Ä―É–±–Η–Ϋ 78,1 –Φ–Κ–Φ–Ψ–Μ―¨/–Μ, –Ω―Ä―è–Φ–Ψ–Ι –±–Η–Μ–Η―Ä―É–±–Η–Ϋ 39,4 –Φ–Κ–Φ–Ψ–Μ―¨/–Μ), –≥–Η–Ω–Β―Ä–Α–Φ–Η–Μ–Α–Ζ–Β–Φ–Η―è 360,8 –ï–¥/–Μ; –Α–Κ―²–Η–≤–Ϋ–Ψ―¹―²―¨ Έ≥-–≥–Μ―é―²–Α–Φ–Η–Μ―²―Ä–Α–Ϋ―¹–Ω–Β–Ω―²–Η–¥–Α–Ζ―΄ 112,4 –ï–¥/–Μ.
–ù–Α –Φ–Ψ–Φ–Β–Ϋ―² –Ω–Β―Ä–Β–≤–Ψ–¥–Α –Η–Ζ –û–†–‰–Δ ―É–¥–Α–Μ–Ψ―¹―¨ –¥–Ψ–±–Η―²―¨―¹―è –Ω–Ψ–≤―΄―à–Β–Ϋ–Η―è ―É―Ä–Ψ–≤–Ϋ―è –≥–Β–Φ–Ψ–≥–Μ–Ψ–±–Η–Ϋ–Α –¥–Ψ 73 –≥/–Μ, ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è ―¹ 2Ο½109/–Μ –±―΄–Μ–Α ―¹–Κ–Ψ―Ä―Ä–Β–Κ―²–Η―Ä–Ψ–≤–Α–Ϋ–Α –¥–Ψ 168Ο½109/–Μ, –Μ–Β–Ι–Κ–Ψ―Ü–Η―²–Ψ–Ζ –Φ–Α–Κ―¹–Η–Φ–Α–Μ―¨–Ϋ―΄–Ι ―¹–Ψ―¹―²–Α–≤–Η–Μ 12,9Ο½109/–Μ. –£ –Ψ–±―â–Β–Φ –Α–Ϋ–Α–Μ–Η–Ζ–Β –Φ–Ψ―΅–Η ―É―Ä–Ψ–±–Η–Μ–Η–Ϋ–Ψ–≥–Β–Ϋ –Ϋ–Β –Η―¹―΅–Β–Ζ –Η –Ϋ–Α 10-–Β ―¹―É―²–Κ–Η (–±–Ψ–Μ–Β–Β 140,1 –Φ–Κ–Φ–Ψ–Μ―¨/–Μ). –¦–Η―Ö–Ψ―Ä–Α–¥–Κ–Α ―¹―É–±―³–Β–±―Ä–Η–Μ―¨–Ϋ–Α―è –≤ –≤–Β―΅–Β―Ä–Ϋ–Η–Β ―΅–Α―¹―΄.
–ù–Α 10-–Β ―¹―É―²–Κ–Η –Ω–Α―Ü–Η–Β–Ϋ―² –Ω–Β―Ä–Β–≤–Β–¥–Β–Ϋ –≤ –Ω―Ä–Ψ―³–Η–Μ―¨–Ϋ–Ψ–Β –Ψ―²–¥–Β–Μ–Β–Ϋ–Η–Β ―¹–Ψ ―¹―²–Α–±–Η–Μ―¨–Ϋ―΄–Φ–Η –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―è–Φ–Η –≥–Β–Φ–Ψ–¥–Η–Ϋ–Α–Φ–Η–Κ–Η –Η –¥―΄―Ö–Α–Ϋ–Η―è, –Α ―²–Α–Κ–Ε–Β ―¹―²–Α–±–Η–Μ―¨–Ϋ―΄–Φ–Η –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄–Φ–Η –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―è–Φ–Η.
–î–Α–Ϋ–Ϋ―΄–Β –Ω–Ψ –¥–Ψ–Μ–Β–≤–Ψ–Φ―É –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤―É –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –≥–Β–Φ–Ψ–Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ψ–≤ –Ζ–Α –≤―Ä–Β–Φ―è –Ω―Ä–Β–±―΄–≤–Α–Ϋ–Η―è –Ω–Α―Ü–Η–Β–Ϋ―²–Α –î. –≤ –û–†–‰–Δ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ―΄ –Ϋ–Α ―Ä–Η―¹―É–Ϋ–Κ–Β. –Γ–Μ–Β–¥―É–Β―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –Η―Ö –Ω―Ä–Η–Φ–Β–Ϋ―è–Μ–Η –Ω–Ψ –Φ–Β―Ä–Β –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η ―²–Β―Ö –Η–Μ–Η –Η–Ϋ―΄―Ö –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –Κ―Ä–Ψ–≤–Η. –½–Α 100% –Ω―Ä–Η–Ϋ―è―²–Ψ –Ψ–±―â–Β–Β –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ –Ω–Β―Ä–Β–Μ–Η―²―΄―Ö –≥–Β–Φ–Ψ–Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Ψ–≤.
–ù–Α 13-–Β ―¹―É―²–Κ–Η –≤ –Ω―Ä–Ψ―³–Η–Μ―¨–Ϋ–Ψ–Φ –Ψ―²–¥–Β–Μ–Β–Ϋ–Η–Η –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Α –Θ–½–î–™ –≤–Β–Ϋ –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι –Η ―¹–Ϋ–Ψ–≤–Α –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ―΄ ―ç―Ö–Ψ-–Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –±–Η–Μ–Α―²–Β―Ä–Α–Μ―¨–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α: ―³–Μ–Ψ―²–Η―Ä―É―é―â–Β–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –Ω–Ψ–¥–Κ–Ψ–Μ–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ ―¹–Ω―Ä–Α–≤–Α, –Η―¹―Ö–Ψ–¥―è―â–Β–≥–Ψ –Η–Ζ –Ζ–Α–¥–Ϋ–Β–Ι –±–Ψ–Μ―¨―à–Β–±–Β―Ä―Ü–Ψ–≤–Ψ–Ι –≤–Β–Ϋ―΄, –Η –Ψ–Κ–Κ–Μ―é–Ζ–Η–≤–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –Ψ–±―â–Β–Ι, –≥–Μ―É–±–Ψ–Κ–Ψ–Ι –Η –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²–Ϋ–Ψ–Ι –±–Β–¥―Ä–Β–Ϋ–Ϋ―΄―Ö –≤–Β–Ϋ ―¹–Μ–Β–≤–Α ―¹ –Ϋ–Α―΅–Α–Μ―¨–Ϋ–Ψ–Ι ―Ä–Β–Κ–Α–Ϋ–Α–Μ–Η–Ζ–Α―Ü–Η–Β–Ι –Ϋ–Α –Ω–Ψ–≤–Β―Ä―Ö–Ϋ–Ψ―¹―²–Ϋ–Ψ–Ι –±–Β–¥―Ä–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ–Β, –Ω–Ψ–¥–Κ–Ψ–Μ–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ–Β. –ö–Α–≤–Α-―³–Η–Μ―¨―²―Ä –Ω―Ä–Ψ―Ö–Ψ–¥–Η–Φ. –ö–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ –Κ–Ψ–Α–≥―É–Μ–Ψ–≥―Ä–Α–Φ–Φ―΄: –Ϋ–Ψ―Ä–Φ–Ψ–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η―è. –ù–Α–Ζ–Ϋ–Α―΅–Β–Ϋ―΄ –Ϋ–Η–Ζ–Κ–Ψ–Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ―΄–Β –≥–Β–Ω–Α―Ä–Η–Ϋ―΄ –≤ –Μ–Β―΅–Β–±–Ϋ―΄―Ö –¥–Ψ–Ζ–Α―Ö.
–ü–Ψ –Ψ–Κ–Ψ–Ϋ―΅–Α–Ϋ–Η–Η –Μ–Β―΅–Β–Ϋ–Η―è –≤ –Ψ―²–¥–Β–Μ–Β–Ϋ–Η–Η ―¹–Ψ―¹―É–¥–Η―¹―²–Ψ–Ι ―Ö–Η―Ä―É―Ä–≥–Η–Η (5-–Β ―¹―É―²–Κ–Η) –Ω–Α―Ü–Η–Β–Ϋ―² –Ω–Β―Ä–Β–≤–Β–¥–Β–Ϋ –¥–Μ―è –Ω―Ä–Ψ–¥–Ψ–Μ–Ε–Β–Ϋ–Η―è –Μ–Β―΅–Β–Ϋ–Η―è –≤ –Ψ―²–¥–Β–Μ–Β–Ϋ–Η–Β ―²–Β―Ä–Α–Ω–Η–Η, –Ψ―²–Κ―É–¥–Α –±―΄–Μ –≤―΄–Ω–Η―¹–Α–Ϋ –Ω–Ψ–¥ –Ϋ–Α–±–Μ―é–¥–Β–Ϋ–Η–Β ―¹–Ω–Β―Ü–Η–Α–Μ–Η―¹―²–Ψ–≤ –Ω–Ψ –Φ–Β―¹―²―É –Ε–Η―²–Β–Μ―¨―¹―²–≤–Α.

–û–±―¹―É–Ε–¥–Β–Ϋ–Η–Β
–ü―Ä–Η –Π–ü ―Ä–Α–Ζ–≤–Η–≤–Α―é―²―¹―è –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è ―¹–Η―¹―²–Β–Φ―΄ –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α [1, 3, 4]. –Γ–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―¹–Η–Ϋ―²–Β–Ζ–Α –Ω―Ä–Ψ–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ―΄―Ö ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ (―³–Α–Κ―²–Ψ―Ä―΄ ―¹–≤–Β―Ä―²―΄–≤–Α–Ϋ–Η―è –Κ―Ä–Ψ–≤–Η II, V, VII, X, XI, XII –Η XIII), ―¹–Η–Ϋ―²–Β–Ζ–Α ―³–Η–±―Ä–Η–Ϋ–Ψ–≥–Β–Ϋ–Α, –Α ―²–Α–Κ–Ε–Β ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è –Α―¹―¹–Ψ―Ü–Η–Η―Ä―É―é―²―¹―è ―¹ –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Φ ―Ä–Η―¹–Κ–Ψ–Φ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η–Ι [1, 4, 5]. –Δ―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è ―è–≤–Μ―è–Β―²―¹―è ―Ä–Α―¹–Ω―Ä–Ψ―¹―²―Ä–Α–Ϋ–Β–Ϋ–Ϋ―΄–Φ –≥–Β–Φ–Α―²–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Η–Φ –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β–Φ –Ω―Ä–Η –Π–ü, –Ω―Ä–Η ―Ö―Ä–Ψ–Ϋ–Η―΅–Β―¹–Κ–Η―Ö –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è―Ö –Ω–Β―΅–Β–Ϋ–Η –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ–Β –≤―Ä–Β–Φ―è –Ψ–±―ä―è―¹–Ϋ―è–Μ–Α―¹―¨ –≥–Η–Ω–Β―Ä―¹–Ω–Μ–Β–Ϋ–Η–Ζ–Φ–Ψ–Φ –Η ―¹–Β–Κ–≤–Β―¹―²―Ä–Α―Ü–Η–Β–Ι ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–≤ –≤ ―¹–Β–Μ–Β–Ζ–Β–Ϋ–Κ–Β, –Ψ–¥–Ϋ–Α–Κ–Ψ –≤ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è ―¹―΅–Η―²–Α–Β―²―¹―è, ―΅―²–Ψ ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è ―¹–≤―è–Ζ–Α–Ϋ–Α ―¹–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ –≤―΄―Ä–Α–±–Ψ―²–Κ–Η ―²―Ä–Ψ–Φ–±–Ψ–Ω–Ψ―ç―²–Η–Ϋ–Α –Ω―Ä–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è―Ö –Ω–Β―΅–Β–Ϋ–Η –Η ―É–≥–Ϋ–Β―²–Β–Ϋ–Η–Β–Φ ―²―Ä–Ψ–Φ–±–Ψ–Ω–Ψ―ç–Ζ–Α –≤ –Κ–Ψ―¹―²–Ϋ–Ψ–Φ –Φ–Ψ–Ζ–≥–Β [5]. –Γ―²–Ψ–Ι–Κ–Α―è –¥–Η―¹―³―É–Ϋ–Κ―Ü–Η―è ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–≤ ―¹―΅–Η―²–Α–Β―²―¹―è –Ϋ–Β–Ψ―²―ä–Β–Φ–Μ–Β–Φ–Ψ–Ι ―΅–Α―¹―²―¨―é ―²–Β―΅–Β–Ϋ–Η―è –Π–ü, –Ϋ–Ψ –Ψ–Ϋ–Α –Φ–Ψ–Ε–Β―² –Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Η―Ä–Ψ–≤–Α―²―¨―¹―è ―É–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β–Φ ―¹–Η–Ϋ―²–Β–Ζ–Α ―ç–Ϋ–¥–Ψ―²–Β–Μ–Η–Β–Φ ―³–Α–Κ―²–Ψ―Ä–Α –£–Η–Μ–Μ–Β–±―Ä–Α–Ϋ–¥–Α [6].
–ù–Α―Ä―É―à–Β–Ϋ–Η―è ―¹–≤–Β―Ä―²―΄–≤–Α–Ϋ–Η―è –Κ―Ä–Ψ–≤–Η –Ϋ–Α–±–Μ―é–¥–Α―é―²―¹―è –Ω―Ä–Η –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä–Ψ–≤–Α–Ϋ–Η–Η –Π–ü –Η –≤–Κ–Μ―é―΅–Β–Ϋ―΄ –≤ –±–Ψ–Μ―¨―à–Η–Ϋ―¹―²–≤–Ψ –Ω―Ä–Ψ–≥–Ϋ–Ψ―¹―²–Η―΅–Β―¹–Κ–Η―Ö ―à–Κ–Α–Μ [3]. –Γ―²–Ψ–Η―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –Ψ–±―â–Β–Ω―Ä–Η–Ϋ―è―²–Ψ–Ι ―à–Κ–Α–Μ–Ψ–Ι –¥–Μ―è –Ψ―Ü–Β–Ϋ–Κ–Η ―Ä–Η―¹–Κ–Α –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ―¹―²–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Π–ü ―¹―΅–Η―²–Α–Β―²―¹―è ―à–Κ–Α–Μ–Α MELD, –Ψ–¥–Ϋ–Α–Κ–Ψ G. DβÄôAmico et al. [7] –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η, ―΅―²–Ψ –Ϋ–Β–Κ–Ψ―²–Ψ―Ä―΄–Β –Β–Β –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²―΄ ―²―Ä–Β–±―É―é―² –Ω–Β―Ä–Β―¹–Φ–Ψ―²―Ä–Α –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² ―²–Ψ–≥–Ψ, –±―΄–Μ–Η –Μ–Η –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ―΄ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Β ―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Η–Β –≤–Φ–Β―à–Α―²–Β–Μ―¨―¹―²–≤–Α, –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä ―²―Ä–Α–Ϋ―¹―ä―é–≥―É–Μ―è―Ä–Ϋ–Ψ–Β –≤–Ϋ―É―²―Ä–Η–Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Β –Ω–Ψ―Ä―²–Ψ―¹–Η―¹―²–Β–Φ–Ϋ–Ψ–Β ―à―É–Ϋ―²–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β (Transjugular Intrahepatic Portosystemic Shunt, TIPS).
–ö―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è –Ω―Ä–Η –Π–ü ―É―¹–Μ–Ψ–≤–Ϋ–Ψ –Φ–Ψ–Ε–Ϋ–Ψ ―Ä–Α–Ζ–¥–Β–Μ–Η―²―¨ –Ϋ–Α 2 –Κ–Α―²–Β–≥–Ψ―Ä–Η–Η: 1) –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è, –≤―΄–Ζ–≤–Α–Ϋ–Ϋ―΄–Β –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–Ι –≥–Η–Ω–Β―Ä―²–Β–Ϋ–Ζ–Η–Β–Ι, –¥–Μ―è –Κ–Ψ―²–Ψ―Ä―΄―Ö –≥–Β–Φ–Ψ―¹―²–Α―²–Η―΅–Β―¹–Κ–Η–Β –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ―΄ –Η–Φ–Β―é―² –Φ–Β–Ϋ―¨―à–Β–Β –Ζ–Ϋ–Α―΅–Β–Ϋ–Η–Β; 2) –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è –Η–Ζ ―¹–Μ–Η–Ζ–Η―¹―²―΄―Ö –Ψ–±–Ψ–Μ–Ψ―΅–Β–Κ –Η–Μ–Η –Ω―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄―Ö ―Ä–Α–Ϋ, –Κ–Ψ―²–Ψ―Ä―΄–Β –Ζ–Α―΅–Α―¹―²―É―é ―¹–≤―è–Ζ–Α–Ϋ―΄ ―¹ –Ω―Ä–Β–Ε–¥–Β–≤―Ä–Β–Φ–Β–Ϋ–Ϋ―΄–Φ ―Ä–Α―¹―²–≤–Ψ―Ä–Β–Ϋ–Η–Β–Φ ―¹–≥―É―¹―²–Κ–Α –Η–Μ–Η –≥–Η–Ω–Β―Ä―³–Η–±―Ä–Η–Ϋ–Ψ–Μ–Η–Ζ–Ψ–Φ [3]. –€–Β―Ö–Α–Ϋ–Η–Ζ–Φ –≥–Η–Ω–Β―Ä―³–Η–±―Ä–Η–Ϋ–Ψ–Μ–Η–Ζ–Α –Ψ―¹―²–Α–Β―²―¹―è –Ϋ–Β –¥–Ψ –Κ–Ψ–Ϋ―Ü–Α –Η–Ζ―É―΅–Β–Ϋ–Ϋ―΄–Φ, –Ϋ–Ψ, –Ϋ–Β―¹–Ψ–Φ–Ϋ–Β–Ϋ–Ϋ–Ψ, ―è–≤–Μ―è–Β―²―¹―è ―¹–Μ–Β–¥―¹―²–≤–Η–Β–Φ –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η–Ι –≤ ―²―Ä–Ψ–Φ–±–Ψ–Μ–Η―²–Η―΅–Β―¹–Κ–Ψ–Ι ―¹–Η―¹―²–Β–Φ–Β [8].
–Γ–Μ–Β–¥―É–Β―² –Ψ―²–Φ–Β―²–Η―²―¨, ―΅―²–Ψ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è –Η–Ζ –≤–Β―Ä―Ö–Ϋ–Η―Ö –Η –Ϋ–Η–Ε–Ϋ–Η―Ö –Ψ―²–¥–Β–Μ–Ψ–≤ –•–ö–Δ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η–Ζ―É―é―²―¹―è ―΅–Α―¹―²―΄–Φ–Η ―Ä–Β―Ü–Η–¥–Η–≤–Α–Φ–Η, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Β ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄―Ö ―²–Β―Ö–Ϋ–Η–Κ ―ç–Ϋ–¥–Ψ―¹–Κ–Ψ–Ω–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α [9].
–ü―Ä–Η –Π–ü –Ϋ–Α–±–Μ―é–¥–Α–Β―²―¹―è ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―¹–Η–Ϋ―²–Β–Ζ–Α –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ψ–≤, ―²–Α–Κ–Η―Ö –Κ–Α–Κ –Α–Ϋ―²–Η―²―Ä–Ψ–Φ–±–Η–Ϋ, –Ω―Ä–Ψ―²–Β–Η–Ϋ C, –Ω―Ä–Ψ―²–Β–Η–Ϋ S [1, 4]. –ß–Α―¹―²–Η―΅–Ϋ―΄–Ι –¥–Β―³–Η―Ü–Η―² –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ψ–≤ ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α–Β―²―¹―è ―É―¹–Η–Μ–Β–Ϋ–Η–Β–Φ –≥–Β–Ϋ–Β―Ä–Α―Ü–Η–Η ―²―Ä–Ψ–Φ–±–Η–Ϋ–Α, ―΅―²–Ψ ―¹–Ψ–≤–Φ–Β―¹―²–Ϋ–Ψ ―¹–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ ―É―Ä–Ψ–≤–Ϋ―è –Ω―Ä–Ψ―²–Β–Η–Ϋ–Α –Γ –Η –Α–Ϋ―²–Η―²―Ä–Ψ–Φ–±–Η–Ϋ–Α –≤–Β–¥–Β―² –Κ –Ω―Ä–Ψ–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Φ―É ―¹―²–Α―²―É―¹―É [1]. –ê–Ϋ–Α–Μ–Ψ–≥–Η―΅–Ϋ–Ψ –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Κ–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―Ü–Η–Η ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ ―¹ –Φ–Α–Μ―΄–Φ –Ω–Β―Ä–Η–Ψ–¥–Ψ–Φ –Ω–Ψ–Μ―É―Ä–Α―¹–Ω–Α–¥–Α (―³–Α–Κ―²–Ψ―Ä–Ψ–≤ V –Η VII, –Α –Ζ–Α―²–Β–Φ ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ II –Η X), ―΅―²–Ψ ―É―¹–Η–Μ–Η–≤–Α–Β―² ―É–¥–Μ–Η–Ϋ–Β–Ϋ–Η–Β –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ–Ψ–≤–Ψ–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η, –≤ ―²–Ψ –Ε–Β –≤―Ä–Β–Φ―è –Ω―Ä–Ψ–Η―¹―Ö–Ψ–¥–Η―² –Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Α―Ü–Η―è –Ζ–Α ―¹―΅–Β―² ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―è –≤―΄―Ä–Α–±–Ψ―²–Κ–Η –Ω–Β―΅–Β–Ϋ―¨―é –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ―΄―Ö ―³–Α–Κ―²–Ψ―Ä–Ψ–≤, –Ψ―¹–Ψ–±–Β–Ϋ–Ϋ–Ψ –Ω―Ä–Ψ―²–Β–Η–Ϋ–Α –Γ [10]. T. Sinegre et al. [11] ―É―¹―²–Α–Ϋ–Ψ–≤–Η–Μ–Η, ―΅―²–Ψ –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ―è ―³–Α–Κ―²–Ψ―Ä–Α VIII –Η ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ―è –Ω―Ä–Ψ―²–Β–Η–Ϋ–Α –Γ –Η–≥―Ä–Α―é―² –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ―É―é ―Ä–Ψ–Μ―¨ –≤ ―Ä–Α–Ζ–≤–Η―²–Η–Η –≥–Η–Ω–Β―Ä–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η–Η –Ω–Μ–Α–Ζ–Φ―΄ –Κ―Ä–Ψ–≤–Η ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü.
T. Lisman et al. [6] –Ω–Ψ–Κ–Α–Ζ–Α–Μ–Η, ―΅―²–Ψ –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Β ―É―Ä–Ψ–≤–Ϋ–Η ―³–Α–Κ―²–Ψ―Ä–Α –£–Η–Μ–Μ–Β–±―Ä–Α–Ϋ–¥–Α ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Π–ü ―¹–Ω–Ψ―¹–Ψ–±―¹―²–≤―É―é―² –Η–Ϋ–¥―É–Κ―Ü–Η–Η –Ω–Β―Ä–≤–Η―΅–Ϋ–Ψ–≥–Ψ –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―³―É–Ϋ–Κ―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ―΄―Ö ―¹–≤–Ψ–Ι―¹―²–≤. –≠―²–Ψ―² –Φ–Β―Ö–Α–Ϋ–Η–Ζ–Φ –Ω–Ψ–Ζ–≤–Ψ–Μ―è–Β―² –Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Η―Ä–Ψ–≤–Α―²―¨ –¥–Β―³–Β–Κ―²―΄ –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Α –Η ―³―É–Ϋ–Κ―Ü–Η–Η ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–≤ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü. –£―΄―¹–Ψ–Κ–Η–Β ―É―Ä–Ψ–≤–Ϋ–Η ―³–Α–Κ―²–Ψ―Ä–Α VIII –Ϋ–Β–Ζ–Α–≤–Η―¹–Η–Φ–Ψ ―¹–≤―è–Ζ–Α–Ϋ―΄ ―¹ –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Φ ―Ä–Η―¹–Κ–Ψ–Φ –≤–Ϋ–Β–Ω–Β―΅–Β–Ϋ–Ψ―΅–Ϋ–Ψ–Ι –Ψ–±―¹―²―Ä―É–Κ―Ü–Η–Η –≤–Ψ―Ä–Ψ―²–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ [12]. –½–Α–¥–Β―Ä–Ε–Κ–Α –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η―è ―²―Ä–Ψ–Φ–±–Α –Ω―Ä–Η –Π–ü –≤ –Η―²–Ψ–≥–Β –Ω―Ä–Η–≤–Ψ–¥–Η―² –Κ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η―é –Β–≥–Ψ –Ω―Ä–Ψ–Ϋ–Η―Ü–Α–Β–Φ–Ψ―¹―²–Η. –ü–Ψ–¥–Ψ–±–Ϋ―΄–Β –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –≤ ―¹–≥―É―¹―²–Κ–Α―Ö, –Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –Ψ―΅–Η―â–Β–Ϋ–Ϋ―΄–Φ ―³–Η–±―Ä–Η–Ϋ–Ψ–≥–Β–Ϋ–Ψ–Φ, –Ω―Ä–Β–¥–Ω–Ψ–Μ–Α–≥–Α―é―², ―΅―²–Ψ ―ç―²–Ψ –Φ–Ψ–Ε–Β―² ―΅–Α―¹―²–Η―΅–Ϋ–Ψ –Ψ–±―ä―è―¹–Ϋ―è―²―¨―¹―è –Φ–Ψ–¥–Η―³–Η–Κ–Α―Ü–Η–Β–Ι –Φ–Ψ–Μ–Β–Κ―É–Μ―΄. –£ ―¹–Ψ–≤–Ψ–Κ―É–Ω–Ϋ–Ψ―¹―²–Η ―ç―²–Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ ―É–Κ–Α–Ζ―΄–≤–Α―é―² –Ϋ–Α –≥–Η–Ω–Β―Ä–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η―é ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü, ―΅―²–Ψ –Φ–Ψ–Ε–Β―² –Ψ–±―ä―è―¹–Ϋ–Η―²―¨ –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Ι ―Ä–Η―¹–Κ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α [13]. –™–Η–Ω–Β―Ä–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η―è –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Φ–Ψ–Ε–Β―² –Ω―Ä–Η–≤–Ψ–¥–Η―²―¨ –Κ –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―é ―³―É–Ϋ–Κ―Ü–Η–Η –Ω–Β―΅–Β–Ϋ–Η –Ζ–Α ―¹―΅–Β―² –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –Φ–Η–Κ―Ä–Ψ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α ―¹–Ψ―¹―É–¥–Ψ–≤ [14].
–Γ―É―â–Β―¹―²–≤―É–Β―² –¥–Ψ–Κ–Α–Ζ–Α–Ϋ–Ϋ–Α―è ―¹–≤―è–Ζ―¨ –Φ–Β–Ε–¥―É –≤–Ψ―¹–Ω–Α–Μ–Β–Ϋ–Η–Β–Φ –Η ―Ä–Η―¹–Κ–Ψ–Φ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Ψ–≤: ―²–Α–Κ, –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ –Η–Ϋ―²–Β―Ä–Μ–Β–Ι–Κ–Η–Ϋ–Α 6 –Κ–Ψ―Ä―Ä–Β–Μ–Η―Ä―É–Β―² ―¹ ―Ä–Η―¹–Κ–Ψ–Φ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Ψ–≤ –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ –Η –≥–Μ―É–±–Ψ–Κ–Η―Ö –≤–Β–Ϋ –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι [15].
–ü―Ä–Η –¥–Μ–Η―²–Β–Μ―¨–Ϋ–Ψ ―²–Β–Κ―É―â–Β–Φ –Π–ü ―¹–Η―¹―²–Β–Φ–Α –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α –≤–Ψ―¹―¹―²–Α–Ϋ–Α–≤–Μ–Η–≤–Α–Β―² ―Ä–Α–≤–Ϋ–Ψ–≤–Β―¹–Η–Β, –Ϋ–Ψ, –≤ ―¹―É―â–Ϋ–Ψ―¹―²–Η, ―ç―²–Ψ―² –±–Α–Μ–Α–Ϋ―¹ ―Ö―Ä―É–Ω–Ψ–Κ –Η –Ζ–Ϋ–Α―΅–Η―²–Β–Μ―¨–Ϋ–Ψ –Ω–Ψ–¥–≤–Β―Ä–Ε–Β–Ϋ –≤–Μ–Η―è–Ϋ–Η―é ―²–Α–Κ–Η―Ö ―³–Α–Κ―²–Ψ―Ä–Ψ–≤, –Ϋ–Α–Ω―Ä–Η–Φ–Β―Ä, –Κ–Α–Κ –≤–Ψ–Μ–Β–Φ–Η―΅–Β―¹–Κ–Η–Ι ―¹―²–Α―²―É―¹, –Η–Ϋ―³–Β–Κ―Ü–Η–Η, –Ω–Ψ―΅–Β―΅–Ϋ–Α―è –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ―¹―²―¨ [3].
–ü–Α―Ü–Η–Β–Ϋ―²―΄ ―¹ –Π–ü –Ψ–¥–Ϋ–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ –Ω–Ψ–¥–≤–Β―Ä–Ε–Β–Ϋ―΄ ―Ä–Η―¹–Κ―É –Κ–Α–Κ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è, ―²–Α–Κ –Η –≤–Β–Ϋ–Ψ–Ζ–Ϋ–Ψ–Ι ―²―Ä–Ψ–Φ–±–Ψ―ç–Φ–±–Ψ–Μ–Η–Η (–£–Δ–≠) [2, 4]. –ü–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Ι ―Ä–Η―¹–Κ –£–Δ–≠ ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ –≤ ―Ä―è–¥–Β –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Ι [16βÄ™20]. –£ 2015 –≥. –±―΄–Μ–Η –Ψ–Ω―É–±–Μ–Η–Κ–Ψ–≤–Α–Ϋ―΄ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Ϋ–Α―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η―è, –Ω―Ä–Ψ–≤–Ψ–¥–Η–≤―à–Β–≥–Ψ―¹―è –≤ –î–Α–Ϋ–Η–Η. –£ –Ϋ–Β–Φ –±―΄–Μ –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ –Α–Ϋ–Α–Μ–Η–Ζ –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Α ―²―Ä–Ψ–Φ–±–Ψ―ç–Φ–±–Ψ–Μ–Η―΅–Β―¹–Κ–Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü –Η –±–Β–Ζ –Π–ü –≤ –Ω–Β―Ä–Η–Ψ–¥ ―¹ 1994 –≥. –Ω–Ψ 2011 –≥. [16]. –Θ―¹―²–Α–Ϋ–Ψ–≤–Μ–Β–Ϋ–Ψ, ―΅―²–Ψ ―Ä–Η―¹–Κ 30-–¥–Ϋ–Β–≤–Ϋ–Ψ–Ι –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ―¹―²–Η –Ψ―² ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –≥–Μ―É–±–Ψ–Κ–Η―Ö –≤–Β–Ϋ –Ϋ–Η–Ε–Ϋ–Η―Ö –Κ–Ψ–Ϋ–Β―΅–Ϋ–Ψ―¹―²–Β–Ι ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü ―¹–Ψ―¹―²–Α–≤–Η–Μ 7% (95% –î–‰ 5βÄ™10%) –Η 3% ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±–Β–Ζ –Π–ü (95% –î–‰ 2βÄ™3%); ―Ä–Η―¹–Κ 30-–¥–Ϋ–Β–≤–Ϋ–Ψ–Ι –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ―¹―²–Η –Ψ―² –Δ–≠–¦–ê ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü ―¹–Ψ―¹―²–Α–≤–Η–Μ 35% (95% –î–‰ 29βÄ™42%), ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –±–Β–Ζ –Π–ü βÄî 16% (95% –î–‰ 14βÄ™19%). –†–Η―¹–Κ ―¹–Φ–Β―Ä―²–Ϋ–Ψ―¹―²–Η, ―¹–≤―è–Ζ–Α–Ϋ–Ϋ–Ψ–Ι ―¹ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Ψ–Φ –≤–Ψ―Ä–Ψ―²–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄, ―¹–Ψ―¹―²–Α–≤–Η–Μ 19% –Η 15% ―¹–Ψ–Ψ―²–≤–Β―²―¹―²–≤–Β–Ϋ–Ϋ–Ψ. –Γ–Κ–Ψ―Ä―Ä–Β–Κ―²–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–Β 30-–¥–Ϋ–Β–≤–Ϋ–Ψ–Β –Ψ―²–Ϋ–Ψ―à–Β–Ϋ–Η–Β ―Ä–Η―¹–Κ–Ψ–≤ –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Η―¹―Ö–Ψ–¥–Α ―¹–Ψ―¹―²–Α–≤–Η–Μ–Ψ 2,17 (1,24βÄ™3,79) –¥–Μ―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –≥–Μ―É–±–Ψ–Κ–Η―Ö –≤–Β–Ϋ, 1,83 (1,30βÄ™2,56) –¥–Μ―è –Δ–≠–¦–ê –Η 1,30 (0,80βÄ™2,13) –¥–Μ―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄. –ê–≤―²–Ψ―Ä―΄ –Ω―Ä–Η―à–Μ–Η –Κ –≤―΄–≤–Ψ–¥―É, ―΅―²–Ψ –Π–ü ―è–≤–Μ―è–Β―²―¹―è –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä–Ψ–Φ –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–Ι –Κ―Ä–Α―²–Κ–Ψ―¹―Ä–Ψ―΅–Ϋ–Ψ–Ι –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ―¹―²–Η –Ω–Ψ―¹–Μ–Β –Ω–Β―Ä–Β–Ϋ–Β―¹–Β–Ϋ–Ϋ–Ψ–Ι –£–Δ–≠, –Ω―Ä–Η―΅–Β–Φ –Δ–≠–¦–ê ―è–≤–Μ―è–Β―²―¹―è –Ϋ–Α–Η–±–Ψ–Μ–Β–Β ―΅–Α―¹―²–Ψ–Ι –Ω―Ä–Η―΅–Η–Ϋ–Ψ–Ι –Μ–Β―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Η―¹―Ö–Ψ–¥–Α.
P. Jepsen et al. [21] –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η ―¹ ―É―΅–Α―¹―²–Η–Β–Φ 5854 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü ―Ä–Α–Ζ–Μ–Η―΅–Ϋ–Ψ–Ι ―ç―²–Η–Ψ–Μ–Ψ–≥–Η–Η –Ψ―Ü–Β–Ϋ–Η–Μ–Η ―Ä–Η―¹–Κ–Η –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Ψ–≤ ―Ä–Α–Ζ–Μ–Η―΅–Ϋ–Ψ–Ι –Μ–Ψ–Κ–Α–Μ–Η–Ζ–Α―Ü–Η–Η. –ü–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –≤–Κ–Μ―é―΅–Α–Μ–Η –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β –¥–Ψ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –Δ–≠ –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι, –Ψ―¹―²―Ä–Ψ–≥–Ψ –Η–Ϋ―³–Α―Ä–Κ―²–Α –Φ–Η–Ψ–Κ–Α―Ä–¥–Α (–û–‰–€), –Η―à–Β–Φ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Η–Ϋ―¹―É–Μ―¨―²–Α –Η–Μ–Η ―¹–Φ–Β―Ä―²–Η. –ë―΄–Μ–Ψ –Ψ―²–Φ–Β―΅–Β–Ϋ–Ψ, ―΅―²–Ψ ―Ä–Α–Ζ–≤–Η―²–Η–Β ―²–Β―Ä–Φ–Η–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι ―¹―²–Α–¥–Η–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è ―΅–Α―â–Β –≤―¹–Β–≥–Ψ ―¹–Ψ–Ω―Ä–Ψ–≤–Ψ–Ε–¥–Α–Μ–Ψ―¹―¨ ―Ä–Α–Ζ–≤–Η―²–Η–Β–Φ –û–‰–€, –Ϋ–Β–Ε–Β–Μ–Η –¥―Ä―É–≥–Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι.
–ß–Α―¹―²–Ψ―²–Α –≤―¹―²―Ä–Β―΅–Α–Β–Φ–Ψ―¹―²–Η ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –Π–ü, –Ω–Ψ ―Ä–Α–Ζ–Ϋ―΄–Φ –¥–Α–Ϋ–Ϋ―΄–Φ, –Κ–Ψ–Μ–Β–±–Μ–Β―²―¹―è –Ψ―² 4,6% –¥–Ψ 26%, ―΅―²–Ψ ―¹–Ψ―¹―²–Α–≤–Μ―è–Β―² –Ϋ–Α–Η–±–Ψ–Μ–Β–Β –≤―΄―¹–Ψ–Κ–Η–Β –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Η ―¹―Ä–Β–¥–Η –≤―¹–Β―Ö –Ω–Ψ―Ä–Α–Ε–Β–Ϋ–Η–Ι –Ω–Β―΅–Β–Ϋ–Η [22βÄ™25]. –Γ―΅–Η―²–Α–Β―²―¹―è, ―΅―²–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β ―¹–Κ–Ψ―Ä–Ψ―¹―²–Η –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–≥–Ψ –Κ―Ä–Ψ–≤–Ψ―²–Ψ–Κ–Α –Φ–Β–Ϋ–Β–Β 15 ―¹–Φ/―¹ ―è–≤–Μ―è–Β―²―¹―è –Ω―Ä–Β–¥–Η–Κ―²–Ψ―Ä–Ψ–Φ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –≤ ―¹–Η―¹―²–Β–Φ–Β –≤–Ψ―Ä–Ψ―²–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ [26]. –ë―΄–Μ–Η –≤―΄–¥–Β–Μ–Β–Ϋ―΄ –¥–Ψ–Ω–Ψ–Μ–Ϋ–Η―²–Β–Μ―¨–Ϋ―΄–Β ―³–Α–Κ―²–Ψ―Ä―΄ ―Ä–Η―¹–Κ–Α ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄: –Ω―Ä–Β–¥―à–Β―¹―²–≤–Ψ–≤–Α–≤―à–Α―è –¥–Β–Κ–Ψ–Φ–Ω–Β–Ϋ―¹–Α―Ü–Η―è ―Ü–Η―Ä―Ä–Ψ–Ζ–Α –Η ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è [25], –≥–Η–Ω–Ψ–Α–Μ―¨–±―É–Φ–Η–Ϋ–Β–Φ–Η―è [27], –≤–Α―Ä–Η–Κ–Ψ–Ζ–Ϋ–Ψ–Β ―Ä–Α―¹―à–Η―Ä–Β–Ϋ–Η–Β –≤–Β–Ϋ –Ω–Η―â–Β–≤–Ψ–¥–Α –Η ―ç–Κ―¹–Ω–Ψ–Ζ–Η―Ü–Η―è –Ϋ–Β―¹–Β–Μ–Β–Κ―²–Η–≤–Ϋ―΄―Ö Έ≤-–Α–¥―Ä–Β–Ϋ–Ψ–±–Μ–Ψ–Κ–Α―²–Ψ―Ä–Ψ–≤ [28], –Ϋ–Α–Μ–Η―΅–Η–Β –Κ―Ä―É–Ω–Ϋ–Ψ–Ι ―¹–Β―²–Η –Κ–Ψ–Μ–Μ–Α―²–Β―Ä–Α–Μ–Β–Ι [24].
–Δ–Α–Κ, –≤ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η F. Turon et al. [22] ―É 369 –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü ―¹―Ä–Β–¥–Η ―Ä–Η―¹–Κ–Ψ–≤ –Ω–Ψ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―é ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –±―΄–Μ–Η –≤―΄–¥–Β–Μ–Β–Ϋ―΄: –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Α―è –≥–Η–Ω–Β―Ä―²–Β–Ϋ–Ζ–Η―è –≤ –Α–Ϋ–Α–Φ–Ϋ–Β–Ζ–Β, –≤–Α―Ä–Η–Κ–Ψ–Ζ–Ϋ–Ψ–Β ―Ä–Α―¹―à–Η―Ä–Β–Ϋ–Η–Β –≤–Β–Ϋ –Ω–Η―â–Β–≤–Ψ–¥–Α, ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η―è –≤ ―¹–Ψ―΅–Β―²–Α–Ϋ–Η–Η ―¹–Ψ ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β–Φ –Κ―Ä–Ψ–≤–Ψ―²–Ψ–Κ–Α –≤ ―¹–Η―¹―²–Β–Φ–Β –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ (–Ω–Ψ–¥―΅–Β―Ä–Κ–Ϋ―É―²–Ψ, ―΅―²–Ψ –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η–Β–Φ –¥–Α–Ϋ–Ϋ―΄―Ö –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η–Ι –¥–Ψ–Μ–Ε–Β–Ϋ –Ζ–Α–Ϋ–Η–Φ–Α―²―¨―¹―è –Ψ–Ω―΄―²–Ϋ―΄–Ι ―¹–Ω–Β―Ü–Η–Α–Μ–Η―¹―²).
–Θ–≤–Β–Μ–Η―΅–Β–Ϋ–Η–Β ―Ä–Η―¹–Κ–Α –£–Δ–≠ –Ω―Ä–Η –Π–ü –Ψ–±―É―¹–Μ–Ψ–≤–Μ–Β–Ϋ–Ψ –≤–Ϋ–Β―à–Ϋ–Η–Φ–Η ―³–Α–Κ―²–Ψ―Ä–Α–Φ–Η (–Η–Φ–Φ–Ψ–±–Η–Μ–Η–Ζ–Α―Ü–Η―è, ―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Η–Β –≤–Φ–Β―à–Α―²–Β–Μ―¨―¹―²–≤–Α, –Η–Ϋ―³–Β–Κ―Ü–Η–Ψ–Ϋ–Ϋ―΄–Β –Ω―Ä–Ψ―Ü–Β―¹―¹―΄, –Κ–Ψ–Φ–Ψ―Ä–±–Η–¥–Ϋ―΄–Β ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η―è) –Η –≤–Ϋ―É―²―Ä–Β–Ϋ–Ϋ–Η–Φ–Η ―³–Α–Κ―²–Ψ―Ä–Α–Φ–Η (–Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β ―¹–Η―¹―²–Β–Φ―΄ –Κ–Ψ–Α–≥―É–Μ―è―Ü–Η–Η, –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ―΄–Ι ―É―Ä–Ψ–≤–Β–Ϋ―¨ ―ç―¹―²―Ä–Ψ–≥–Β–Ϋ–Ψ–≤) [4, 10, 29, 30]. –ö―Ä–Ψ–Φ–Β ―²–Ψ–≥–Ψ, –Ϋ–Α –≤–Β–Ϋ–Ψ–Ζ–Ϋ―΄–Ι ―¹―²–Α–Ζ –Φ–Ψ–≥―É―² –≤–Μ–Η―è―²―¨ –Η –Φ–Β―¹―²–Ϋ―΄–Β ―³–Α–Κ―²–Ψ―Ä―΄ (–Κ–Ψ–Φ–Ω―Ä–Β―¹―¹–Η―è –Ψ–Ω―É―Ö–Ψ–Μ―¨―é, –Α–±―¹―Ü–Β–¥–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β, –≥–Β–Ω–Α―²–Ψ- –Η ―¹–Ω–Μ–Β–Ϋ–Ψ–Φ–Β–≥–Α–Μ–Η―è) [16].
–ü―Ä–Ψ–±–Μ–Β–Φ―΄ –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η–Ι –Φ–Ϋ–Ψ–≥–Η–Β –≥–Ψ–¥―΄ ―è–≤–Μ―è–Μ–Η―¹―¨ –Ζ–Ϋ–Α–Κ–Ψ–≤―΄–Φ–Η –≤ –Μ–Β―΅–Β–Ϋ–Η–Η –Π–ü, –Ϋ–Ψ –Ϋ–Α ―¹–Ψ–≤―Ä–Β–Φ–Β–Ϋ–Ϋ–Ψ–Φ ―ç―²–Α–Ω–Β ―Ä–Α–Ζ–Μ–Η―΅–Ϋ―΄–Β –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β ―²–Β―¹―²―΄ –¥–Α―é―² –≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ―¹―²―¨ –≤–Ψ–≤―Ä–Β–Φ―è ―Ä–Α―¹–Ω–Ψ–Ζ–Ϋ–Α―²―¨ ―ç―²–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è –Η –Ω―Ä–Ψ–≤–Β―¹―²–Η –Η―Ö –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η―é [3].
–ü―Ä–Η –≥–Η―¹―²–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Φ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Η –Ψ–±―Ä–Α–Ζ―Ü–Ψ–≤, –Ω–Ψ–Μ―É―΅–Β–Ϋ–Ϋ―΄―Ö –≤–Ψ –≤―Ä–Β–Φ―è ―ç–Φ–±–Ψ–Μ―ç–Κ―²–Ψ–Φ–Η–Η, G. Newcomb et al. [31] –Ω–Ψ–Μ―É―΅–Η–Μ–Η –≥–Β―²–Β―Ä–Ψ–≥–Β–Ϋ–Ϋ―΄–Β ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄, ―΅―²–Ψ –Ω–Ψ–Ζ–≤–Ψ–Μ–Η–Μ–Ψ ―¹–¥–Β–Μ–Α―²―¨ –≤―΄–≤–Ψ–¥ –Ψ –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ―¹―²–Η –Ψ―Ü–Β–Ϋ–Η–≤–Α―²―¨ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Ϋ–Α –Ψ―¹–Ϋ–Ψ–≤–Β ―¹–Η―¹―²–Β–Φ–Α―²–Η―΅–Β―¹–Κ–Η―Ö ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Η―¹―²–Η–Κ –Φ–Ψ―Ä―³–Ψ–Μ–Ψ–≥–Η–Η ―¹–≥―É―¹―²–Κ–Ψ–≤.
–£ 2021 –≥. –±―΄–Μ–Η –≤―΄–Ω―É―â–Β–Ϋ―΄ –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Η–Β ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η–Η –†–Ψ―¹―¹–Η–Ι―¹–Κ–Ψ–≥–Ψ –Ψ–±―â–Β―¹―²–≤–Α –Ω–Ψ –Η–Ζ―É―΅–Β–Ϋ–Η―é –Ω–Β―΅–Β–Ϋ–Η –Η –†–Ψ―¹―¹–Η–Ι―¹–Κ–Ψ–Ι –≥–Α―¹―²―Ä–Ψ―ç–Ϋ―²–Β―Ä–Ψ–Μ–Ψ–≥–Η―΅–Β―¹–Κ–Ψ–Ι –Α―¹―¹–Ψ―Ü–Η–Α―Ü–Η–Η –Ω–Ψ –¥–Η–Α–≥–Ϋ–Ψ―¹―²–Η–Κ–Β –Η –Μ–Β―΅–Β–Ϋ–Η―é ―³–Η–±―Ä–Ψ–Ζ–Α –Η ―Ü–Η―Ä―Ä–Ψ–Ζ–Α –Ω–Β―΅–Β–Ϋ–Η –Η –Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι, ―¹–Ψ–≥–Μ–Α―¹–Ϋ–Ψ –Κ–Ψ―²–Ψ―Ä―΄–Φ ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Ψ–≤–Α–Ϋ–Ψ –≤―΄–Ω–Ψ–Μ–Ϋ–Β–Ϋ–Η–Β –Κ–Ψ–Α–≥―É–Μ–Ψ–≥―Ä–Α–Φ–Φ―΄, –≤–Κ–Μ―é―΅–Α―è –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β ―²–Α–Κ–Η―Ö –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι, –Κ–Α–Κ –€–ù–û, –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ–Ψ–≤―΄–Ι –Η–Ϋ–¥–Β–Κ―¹, ―³–Η–±―Ä–Η–Ϋ–Ψ–≥–Β–Ϋ, –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ, –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ–Ψ–≤–Ψ–Β (―²―Ä–Ψ–Φ–±–Ψ–Ω–Μ–Α―¹―²–Η–Ϋ–Ψ–≤–Ψ–Β) –≤―Ä–Β–Φ―è, D-–¥–Η–Φ–Β―Ä, –Α–Ϋ―²–Η―²―Ä–Ψ–Φ–±–Η–Ϋ III. –£ –±–Ψ–Μ―¨―à–Β–Ι ―¹―²–Β–Ω–Β–Ϋ–Η –Ω―Ä–Η –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α–Ϋ–Η–Η ―¹―²–Α–Ϋ–¥–Α―Ä―²–Ϋ―΄―Ö ―²–Β―¹―²–Ψ–≤ –≤―΄―è–≤–Μ―è―é―² –Ω―Ä–Η–Ζ–Ϋ–Α–Κ–Η –≥–Η–Ω–Ψ–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η–Η: –Ω–Ψ–≤―΄―à–Β–Ϋ–Η–Β –€–ù–û, ―¹–Ϋ–Η–Ε–Β–Ϋ–Η–Β –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ–Ψ–≤–Ψ–≥–Ψ –Η–Ϋ–¥–Β–Κ―¹–Α, ―É―Ä–Ψ–≤–Ϋ―è ―³–Η–±―Ä–Η–Ϋ–Ψ–≥–Β–Ϋ–Α. –£ ―Ä―è–¥–Β ―¹–Μ―É―΅–Α–Β–≤ –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Ψ –Η―¹―¹–Μ–Β–¥–Ψ–≤–Α–Ϋ–Η–Β ―É―Ä–Ψ–≤–Ϋ―è D-–¥–Η–Φ–Β―Ä–Α (–Η―¹–Κ–Μ―é―΅–Β–Ϋ–Η–Β –Α–Κ―²–Η–≤–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ψ–±―Ä–Α–Ζ–Ψ–≤–Α–Ϋ–Η―è –Η ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η), –Α–Κ―²–Η–≤–Η―Ä–Ψ–≤–Α–Ϋ–Ϋ–Ψ–≥–Ψ ―΅–Α―¹―²–Η―΅–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ω–Μ–Α―¹―²–Η–Ϋ–Ψ–≤–Ψ–≥–Ψ –≤―Ä–Β–Φ–Β–Ϋ–Η (–Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ ―ç―³―³–Β–Κ―²–Η–≤–Ϋ–Ψ―¹―²–Η ―²–Β―Ä–Α–Ω–Η–Η –Ϋ–Η–Ζ–Κ–Ψ–Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ―΄–Φ–Η –≥–Β–Ω–Α―Ä–Η–Ϋ–Α–Φ–Η), –Α–Ϋ―²–Η―²―Ä–Ψ–Φ–±–Η–Ϋ–Α III (–Ω―Ä–Η –¥–Β―³–Η―Ü–Η―²–Β ―³–Α–Κ―²–Ψ―Ä–Α ―ç―³―³–Β–Κ―² –Ϋ–Η–Ζ–Κ–Ψ–Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ―΄―Ö –≥–Β–Ω–Α―Ä–Η–Ϋ–Ψ–≤ –Φ–Ψ–Ε–Β―² –±―΄―²―¨ –Ϋ–Β–Ω–Ψ–Μ–Ϋ―΄–Φ –Η–Μ–Η –Ψ―²―¹―É―²―¹―²–≤–Ψ–≤–Α―²―¨ –≤–Ψ–≤―¹–Β) [32].
–ê–Φ–Β―Ä–Η–Κ–Α–Ϋ―¹–Κ–Α―è –Α―¹―¹–Ψ―Ü–Η–Α―Ü–Η―è –≥–Α―¹―²―Ä–Ψ―ç–Ϋ―²–Β―Ä–Ψ–Μ–Ψ–≥–Ψ–≤ (American Gastroenterological Association, AGA) [3] –≤ 2019 –≥. –≤―΄–Ω―É―¹―²–Η–Μ–Α ―Ä―è–¥ ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η–Ι, –Κ–Α―¹–Α―é―â–Η―Ö―¹―è –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö –Π–ü. –Γ–Ψ–≥–Μ–Α―¹–Ϋ–Ψ ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥–Α―Ü–Η―è–Φ, ―Ä–Β–≥―É–Μ―è―Ä–Ϋ–Ψ –¥–Ψ–Μ–Ε–Ϋ―΄ –≤―΄–Ω–Ψ–Μ–Ϋ―è―²―¨―¹―è –Μ–Α–±–Ψ―Ä–Α―²–Ψ―Ä–Ϋ―΄–Β ―²–Β―¹―²―΄ –Ψ―Ü–Β–Ϋ–Κ–Η ―¹–Η―¹―²–Β–Φ―΄ –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α, ―Ä–Ψ―²–Α―Ü–Η–Ψ–Ϋ–Ϋ–Α―è ―²―Ä–Ψ–Φ–±–Ψ―ç–Μ–Α―¹―²–Ψ–Φ–Β―²―Ä–Η―è (ROTEM), ―¹–Ψ–Ϋ–Ψ―Ä–Β–Ψ–Φ–Β―²―Ä–Η―è, –Ψ–Ω―Ä–Β–¥–Β–Μ–Β–Ϋ–Η–Β –≥–Β–Ϋ–Β―Ä–Α―Ü–Η–Η ―²―Ä–Ψ–Φ–±–Η–Ϋ–Α, –Ψ–¥–Ϋ–Α–Κ–Ψ ―É –≤―¹–Β―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―Ä–Β–Ζ―É–Μ―¨―²–Α―²―΄ ―ç―²–Η―Ö –Η–Ζ–Φ–Β―Ä–Β–Ϋ–Η–Ι –±―É–¥―É―² ―¹―²―Ä–Ψ–≥–Ψ –Η–Ϋ–¥–Η–≤–Η–¥―É–Α–Μ―¨–Ϋ―΄.
–≠–Κ―¹―²―Ä–Β–Ϋ–Ϋ–Α―è –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η―è ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–Ω–Β–Ϋ–Η–Η –Η –Κ–Ψ–Α–≥―É–Μ–Ψ–Ω–Α―²–Η–Η ―É –¥–Α–Ϋ–Ϋ–Ψ–Ι –≥―Ä―É–Ω–Ω―΄ –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Ϋ–Β –≤―¹–Β–≥–¥–Α –Ω–Ψ–Κ–Α–Ζ–Α–Ϋ–Α. –‰―¹–Κ–Μ―é―΅–Β–Ϋ–Η–Β ―¹–Ψ―¹―²–Α–≤–Μ―è―é―² ―¹–Η―²―É–Α―Ü–Η–Η, –Κ–Ψ–≥–¥–Α –Ω–Α―Ü–Η–Β–Ϋ―²―É –Ω–Μ–Α–Ϋ–Η―Ä―É―é―²―¹―è ―²–Ψ―Ä–Α–Κ–Ψ―Ü–Β–Ϋ―²–Β–Ζ –Η ―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Η–Β –≤–Φ–Β―à–Α―²–Β–Μ―¨―¹―²–≤–Α.
–ö–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²―΄ –Κ―Ä–Ψ–≤–Η ―¹–Μ–Β–¥―É–Β―² –Η―¹–Ω–Ψ–Μ―¨–Ζ–Ψ–≤–Α―²―¨ ―¹ –Ψ―¹―²–Ψ―Ä–Ψ–Ε–Ϋ–Ψ―¹―²―¨―é, –Ω–Ψ―¹–Κ–Ψ–Μ―¨–Κ―É –Ψ–Ϋ–Η ―É–≤–Β–Μ–Η―΅–Η–≤–Α―é―² –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ―É―é –≥–Η–Ω–Β―Ä―²–Β–Ϋ–Ζ–Η―é –Η –Ϋ–Β―¹―É―² ―Ä–Η―¹–Κ –Α–Μ–Μ–Ψ–Η–Φ–Φ―É–Ϋ–Η–Ζ–Α―Ü–Η–Η –Η –¥―Ä―É–≥–Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι, ―¹–≤―è–Ζ–Α–Ϋ–Ϋ―΄―Ö ―¹ –Ω–Β―Ä–Β–Μ–Η–≤–Α–Ϋ–Η–Β–Φ –Κ―Ä–Ψ–≤–Η, –≤ ―²–Ψ–Φ ―΅–Η―¹–Μ–Β –Η ―¹–Η–Ϋ–¥―Ä–Ψ–Φ–Α –Ψ―¹―²―Ä–Ψ–≥–Ψ –Ω–Ψ–≤―Ä–Β–Ε–¥–Β–Ϋ–Η―è –Μ–Β–≥–Κ–Η―Ö.
–ü―Ä–Η –Α–Κ―²–Η–≤–Ϋ–Ψ–Φ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η–Η –Η –Ω―Ä–Ψ―Ü–Β–¥―É―Ä–Α―Ö –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–≥–Ψ ―Ä–Η―¹–Κ–Α –Ϋ–Β–Ψ–±―Ö–Ψ–¥–Η–Φ–Ψ ―¹―²―Ä–Β–Φ–Η―²―¨―¹―è –Κ ―¹–Μ–Β–¥―É―é―â–Η–Φ –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ―è–Φ: –≥–Β–Φ–Α―²–Ψ–Κ―Ä–Η―² 25%, –Κ–Ψ–Μ–Η―΅–Β―¹―²–≤–Ψ ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–≤ >50000, ―³–Η–±―Ä–Η–Ϋ–Ψ–≥–Β–Ϋ >1,2 –≥/–Μ. –ü―Ä–Η ―ç―²–Ψ–Φ –€–ù–û –Ϋ–Β ―è–≤–Μ―è–Β―²―¹―è ―Ü–Β–Μ–Β–≤―΄–Φ –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Φ –¥–Μ―è –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η.
–ê–≥–Ψ–Ϋ–Η―¹―²―΄ ―²―Ä–Ψ–Φ–±–Ψ–Ω–Ψ―ç―²–Η–Ϋ–Α ―è–≤–Μ―è―é―²―¹―è ―Ö–Ψ―Ä–Ψ―à–Β–Ι –Α–Μ―¨―²–Β―Ä–Ϋ–Α―²–Η–≤–Ψ–Ι –Ω–Β―Ä–Β–Μ–Η–≤–Α–Ϋ–Η―é ―²―Ä–Ψ–Φ–±–Ψ―Ü–Η―²–Ψ–≤, –Ϋ–Ψ ―²―Ä–Β–±―É–Β―²―¹―è –≤―Ä–Β–Φ―è (–Ψ–Κ–Ψ–Μ–Ψ 10 ―¹―É―²) –¥–Μ―è –Ω–Ψ―è–≤–Μ–Β–Ϋ–Η―è ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Α –¥–Α–Ϋ–Ϋ―΄―Ö –Φ–Α–Ϋ–Η–Ω―É–Μ―è―Ü–Η–Ι. –ü–Β―Ä–Β–Μ–Η–≤–Α–Ϋ–Η–Β –±–Ψ–Μ―¨―à–Η―Ö –Ψ–±―ä–Β–Φ–Ψ–≤ ―¹–≤–Β–Ε–Β–Ζ–Α–Φ–Ψ―Ä–Ψ–Ε–Β–Ϋ–Ϋ–Ψ–Ι –Ω–Μ–Α–Ζ–Φ―΄ ―¹ ―Ü–Β–Μ―¨―é –Ϋ–Ψ―Ä–Φ–Α–Μ–Η–Ζ–Α―Ü–Η–Η –€–ù–û –Ϋ–Β―Ü–Β–Μ–Β―¹–Ψ–Ψ–±―Ä–Α–Ζ–Ϋ–Ψ, –Ψ–Ϋ–Ψ –Φ–Η–Ϋ–Η–Φ–Α–Μ―¨–Ϋ–Ψ –≤–Μ–Η―è–Β―² –Ϋ–Α –≥–Β–Ϋ–Β―Ä–Α―Ü–Η―é ―²―Ä–Ψ–Φ–±–Η–Ϋ–Α –Η ―É―¹–Η–Μ–Η–≤–Α–Β―² –Ω–Ψ―Ä―²–Α–Μ―¨–Ϋ―É―é –≥–Η–Ω–Β―Ä―²–Β–Ϋ–Ζ–Η―é.
–ö–Ψ–Ϋ―Ü–Β–Ϋ―²―Ä–Α―² 4-―³–Α–Κ―²–Ψ―Ä–Ϋ–Ψ–≥–Ψ –Ω―Ä–Ψ―²―Ä–Ψ–Φ–±–Η–Ϋ–Ψ–≤–Ψ–≥–Ψ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹–Α ―¹–Ψ–¥–Β―Ä–Ε–Η―² –Κ–Α–Κ –Ω―Ä–Ψ-, ―²–Α–Κ –Η –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ―΄–Β ―³–Α–Κ―²–Ψ―Ä―΄, ―΅―²–Ψ –¥–Β–Μ–Α–Β―² –Ω―Ä–Η–≤–Μ–Β–Κ–Α―²–Β–Μ―¨–Ϋ―΄–Φ –Κ–Ψ–Φ–Ω–Μ–Β–Κ―¹ –Κ–Α–Κ –Φ–Α–Μ–Ψ–Ψ–±―ä–Β–Φ–Ϋ–Ψ–Β ―²–Β―Ä–Α–Ω–Β–≤―²–Η―΅–Β―¹–Κ–Ψ–Β ―¹―Ä–Β–¥―¹―²–≤–Ψ, –Ψ–¥–Ϋ–Α–Κ–Ψ –Β–≥–Ψ –¥–Ψ–Ζ–Η―Ä–Ψ–≤–Κ–Α –Ψ―¹–Ϋ–Ψ–≤–Α–Ϋ–Α –Ϋ–Α ―É―Ä–Ψ–≤–Ϋ–Β –€–ù–û, –Α –Ψ–Ω―É–±–Μ–Η–Κ–Ψ–≤–Α–Ϋ–Ϋ―΄―Ö –¥–Α–Ϋ–Ϋ―΄―Ö –Ψ –Β–≥–Ψ –Ω―Ä–Η–Φ–Β–Ϋ–Β–Ϋ–Η–Η –Ω―Ä–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è―Ö –Ω–Β―΅–Β–Ϋ–Η –Ϋ–Β–¥–Ψ―¹―²–Α―²–Ψ―΅–Ϋ–Ψ.
–ê–Ϋ―²–Η―³–Η–±―Ä–Η–Ϋ–Ψ–Μ–Η―²–Η―΅–Β―¹–Κ–Α―è ―²–Β―Ä–Α–Ω–Η―è –Φ–Ψ–Ε–Β―² –Ω―Ä–Η–Φ–Β–Ϋ―è―²―¨―¹―è ―É –±–Ψ–Μ―¨–Ϋ―΄―Ö ―¹ –Ω–Β―Ä―¹–Η―¹―²–Η―Ä―É―é―â–Η–Φ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η–Β–Φ –Η–Ζ ―¹–Μ–Η–Ζ–Η―¹―²–Ψ–Ι –Η–Μ–Η –Φ–Β―¹―²–Α –Ω―É–Ϋ–Κ―Ü–Η–Η, –Β―¹–Μ–Η –Ω–Ψ–¥–Ψ–Ζ―Ä–Β–≤–Α–Β―²―¹―è –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Β ―Ü–Β–Μ–Ψ―¹―²–Ϋ–Ψ―¹―²–Η ―¹–≥―É―¹―²–Κ–Α. –Γ―΅–Η―²–Α–Β―²―¹―è, ―΅―²–Ψ –Η ―²―Ä–Α–Ϋ–Β–Κ―¹–Α–Φ–Ψ–≤–Α―è –Κ–Η―¹–Μ–Ψ―²–Α, –Η –Α–Φ–Η–Ϋ–Ψ–Κ–Α–Ω―Ä–Ψ–Ϋ–Ψ–≤–Α―è –Κ–Η―¹–Μ–Ψ―²–Α –Η–Ϋ–≥–Η–±–Η―Ä―É―é―² ―Ä–Α―¹―²–≤–Ψ―Ä–Β–Ϋ–Η–Β ―¹–≥―É―¹―²–Κ–Α, –Ϋ–Ψ –Ϋ–Β –≤―΄–Ζ―΄–≤–Α―é―² –≥–Η–Ω–Β―Ä–Κ–Ψ–Α–≥―É–Μ―è―Ü–Η–Η, ―Ö–Ψ―²―è –Ψ–±–Α –Ω―Ä–Β–Ω–Α―Ä–Α―²–Α –Φ–Ψ–≥―É―² ―É―¹―É–≥―É–±–Η―²―¨ ―¹–Ψ―¹―²–Ψ―è–Ϋ–Η–Β ―É–Ε–Β –Η–Φ–Β―é―â–Η―Ö―¹―è ―²―Ä–Ψ–Φ–±–Ψ–≤
–î–Β―¹–Φ–Ψ–Ω―Ä–Β―¹―¹–Η–Ϋ –≤―΄―¹–≤–Ψ–±–Ψ–Ε–¥–Α–Β―² ―³–Α–Κ―²–Ψ―Ä –£–Η–Μ–Μ–Β–±―Ä–Α–Ϋ–¥–Α –≤ –Κ–Α―΅–Β―¹―²–≤–Β ―¹–≤–Ψ–Β–≥–Ψ –Ω–Β―Ä–≤–Η―΅–Ϋ–Ψ–≥–Ψ –≥–Β–Φ–Ψ―¹―²–Α―²–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Κ–Ψ–Φ–Ω–Ψ–Ϋ–Β–Ϋ―²–Α.
–Γ–Η―¹―²–Β–Φ–Ϋ–Α―è –Η–Ϋ―³―É–Ζ–Η―è –≥–Β–Ω–Α―Ä–Η–Ϋ–Α ―Ä–Β–Κ–Ψ–Φ–Β–Ϋ–¥―É–Β―²―¹―è –Ω―Ä–Η ―¹–Η–Φ–Ω―²–Ψ–Φ–Α―²–Η―΅–Β―¹–Κ–Ψ–Φ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Β –≥–Μ―É–±–Ψ–Κ–Η―Ö –≤–Β–Ϋ –Η ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Β –≤–Ψ―Ä–Ψ―²–Ϋ–Ψ–Ι –Η –±―Ä―΄–Ε–Β–Β―΅–Ϋ―΄―Ö –≤–Β–Ϋ, –Ϋ–Ψ ―¹―É―â–Β―¹―²–≤―É―é―² –Ϋ–Β―Ä–Β―à–Β–Ϋ–Ϋ―΄–Β –≤–Ψ–Ω―Ä–Ψ―¹―΄, –Κ–Α―¹–Α―é―â–Η–Β―¹―è –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η―è –Φ–Ψ–Ϋ–Η―²–Ψ―Ä–Η–Ϋ–≥–Α.
–¦–Β―΅–Β–Ϋ–Η–Β ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α –≤–Ψ―Ä–Ψ―²–Ϋ–Ψ–Ι –Η –±―Ä―΄–Ε–Β–Β―΅–Ϋ―΄―Ö –≤–Β–Ϋ ―²―Ä–Β–±―É–Β―² –≤–Ζ–≤–Β―à–Β–Ϋ–Ϋ–Ψ–≥–Ψ –Ω–Ψ–¥―Ö–Ψ–¥–Α –Κ –≤―΄–±–Ψ―Ä―É ―Ö–Η―Ä―É―Ä–≥–Η―΅–Β―¹–Κ–Ψ–Ι ―²–Α–Κ―²–Η–Κ–Η. –Δ–Β―Ä–Α–Ω–Η―è –Ϋ–Η–Ζ–Κ–Ψ–Φ–Ψ–Μ–Β–Κ―É–Μ―è―Ä–Ϋ―΄–Φ –≥–Β–Ω–Α―Ä–Η–Ϋ–Ψ–Φ (–ù–€–™), –Α–Ϋ―²–Α–≥–Ψ–Ϋ–Η―¹―²–Α–Φ–Η –≤–Η―²–Α–Φ–Η–Ϋ–Α –ö, –Ω―Ä―è–Φ―΄–Φ–Η –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Α–Φ–Η, –Ω–Ψ –¥–Α–Ϋ–Ϋ―΄–Φ –Μ–Η―²–Β―Ä–Α―²―É―Ä―΄, ―è–≤–Μ―è–Β―²―¹―è –Ω―Ä–Β–¥–Ω–Ψ―΅―²–Η―²–Β–Μ―¨–Ϋ―΄–Φ –Φ–Β―²–Ψ–¥–Ψ–Φ –Μ–Β―΅–Β–Ϋ–Η―è.
–ü―Ä―è–Φ―΄–Β –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²―΄, ―²–Α–Κ–Η–Β –Κ–Α–Κ –Η–Ϋ–≥–Η–±–Η―²–Ψ―Ä ―³–Α–Κ―²–Ψ―Ä–Α –Ξ–Α –Η ―²―Ä–Ψ–Φ–±–Η–Ϋ–Α, ―è–≤–Μ―è―é―²―¹―è –Ψ―²–Ϋ–Ψ―¹–Η―²–Β–Μ―¨–Ϋ–Ψ –±–Β–Ζ–Ψ–Ω–Α―¹–Ϋ―΄–Φ–Η –Η ―ç―³―³–Β–Κ―²–Η–≤–Ϋ―΄–Φ–Η ―É ―¹―²–Α–±–Η–Μ―¨–Ϋ―΄―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü, –Ϋ–Ψ ―²―Ä–Β–±―É―é―² –Ω–Ψ–≤―΄―à–Β–Ϋ–Ϋ–Ψ–≥–Ψ –≤–Ϋ–Η–Φ–Α–Ϋ–Η―è –Ω―Ä–Η ―É―¹―É–≥―É–±–Μ–Β–Ϋ–Η–Η –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è.
–ù–Β ―¹―²–Ψ–Η―² –Ζ–Α–±―΄–≤–Α―²―¨, ―΅―²–Ψ –Ω–Ψ–¥–±–Ψ―Ä –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Ω―Ä–Η ―É–Ε–Β –Ω―Ä–Ψ–Η–Ζ–Ψ―à–Β–¥―à–Β–Ι –Δ–≠–¦–ê ―¹–Η–Μ―¨–Ϋ–Ψ –≤–Α―Ä―¨–Η―Ä―É–Β―² –≤ –Ζ–Α–≤–Η―¹–Η–Φ–Ψ―¹―²–Η –Ψ―² –Ψ–±―¹―²–Ψ―è―²–Β–Μ―¨―¹―²–≤, –Ω―Ä–Η –Κ–Ψ―²–Ψ―Ä―΄―Ö –Ψ–Ϋ–Α –Ω―Ä–Ψ–Η–Ζ–Ψ―à–Μ–Α [31].
–£ –Ω―Ä–Ψ―Ü–Β―¹―¹–Β –Μ–Β―΅–Β–Ϋ–Η―è –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Π–ü –Η –£–Δ–≠ ―¹―²–Α–Ϋ–Ψ–≤–Η―²―¹―è –Ψ―΅–Β–≤–Η–¥–Ϋ―΄–Φ, ―΅―²–Ψ –Ω–Α―²–Ψ–Μ–Ψ–≥–Η―è ―¹–Η―¹―²–Β–Φ―΄ –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α –Ω―Ä–Β―²–Β―Ä–Ω–Β–≤–Α–Β―² –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –≤–Φ–Β―¹―²–Β ―¹ –Ω―Ä–Ψ–≥―Ä–Β―¹―¹–Η―Ä–Ψ–≤–Α–Ϋ–Η–Β–Φ –Ζ–Α–±–Ψ–Μ–Β–≤–Α–Ϋ–Η―è [22].
–£ ―¹–Μ―É―΅–Α–Β –≤–Ψ–Ζ–Ϋ–Η–Κ–Ϋ–Ψ–≤–Β–Ϋ–Η―è –≤–Β–Ϋ–Ψ–Ζ–Ϋ–Ψ–≥–Ψ ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Α ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ ―¹ –Π–ü –Η–Ϋ–Η―Ü–Η–Α―Ü–Η―è ―¹―²–Α–Ϋ–¥–Α―Ä―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Α–Φ–Η –Φ–Ψ–Ε–Β―² –±―΄―²―¨ –Ζ–Α–¥–Β―Ä–Ε–Α–Ϋ–Α –≤ ―¹–≤―è–Ζ–Η ―¹ –≤―΄―¹–Ψ–Κ–Η–Φ ―Ä–Η―¹–Κ–Ψ–Φ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è. –£―¹–Β ―ç―²–Ψ –Κ―Ä–Α–Ι–Ϋ–Β –Ζ–Α―²―Ä―É–¥–Ϋ―è–Β―² –Ω―Ä–Ψ–≤–Β–¥–Β–Ϋ–Η–Β –Ω―Ä–Ψ―³–Η–Μ–Α–Κ―²–Η–Κ–Η ―²―Ä–Ψ–Φ–±–Ψ―ç–Φ–±–Ψ–Μ–Η―΅–Β―¹–Κ–Η―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι.
–Δ–Α–Κ–Η–Φ –Ψ–±―Ä–Α–Ζ–Ψ–Φ, –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è –Κ–Ψ–Α–≥―É–Μ―è―Ü–Η–Ψ–Ϋ–Ϋ–Ψ–≥–Ψ –Ζ–≤–Β–Ϋ–Α –Ω―Ä–Η –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è―Ö ―³―É–Ϋ–Κ―Ü–Η–Η –Ω–Β―΅–Β–Ϋ–Η, –≤ ―΅–Α―¹―²–Ϋ–Ψ―¹―²–Η –Ω―Ä–Η –Π–ü, –Φ–Ψ–≥―É―² –±―΄―²―¨ ―¹–Ψ–≤–Β―Ä―à–Β–Ϋ–Ϋ–Ψ –Ϋ–Β–Ω―Ä–Β–¥―¹–Κ–Α–Ζ―É–Β–Φ―΄, –Κ–Α–Κ –Η ―Ä–Β–Ζ―É–Μ―¨―²–Α―²–Η–≤–Ϋ–Ψ―¹―²―¨ –Η―Ö –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η–Η [3].
–½–Α–Κ–Μ―é―΅–Β–Ϋ–Η–Β
–ö ―¹–Ψ–Ε–Α–Μ–Β–Ϋ–Η―é, –Ψ–¥–Ϋ–Ψ–Ζ–Ϋ–Α―΅–Ϋ–Ψ –Ω―Ä–Β–¥―¹–Κ–Α–Ζ–Α―²―¨, –Ω–Ψ –Κ–Α–Κ–Ψ–Φ―É –Ω―É―²–Η –±―É–¥―É―² ―Ä–Α–Ζ–≤–Η–≤–Α―²―¨―¹―è ―¹–Ψ–±―΄―²–Η―è ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Π–ü, –≤ ―¹–Η–Μ―É ―Ä–Α–Ζ–Μ–Η―΅–Ϋ–Ψ–≥–Ψ ―Ö–Α―Ä–Α–Κ―²–Β―Ä–Α –≤–Ψ–Ζ–Ϋ–Η–Κ–Α―é―â–Η―Ö –Ϋ–Α―Ä―É―à–Β–Ϋ–Η–Ι –≤ ―¹–Η―¹―²–Β–Φ–Β –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α –Ϋ–Β–≤–Ψ–Ζ–Φ–Ψ–Ε–Ϋ–Ψ. –û–¥–Ϋ–Α–Κ–Ψ –¥–Ψ―¹―²―É–Ω–Ϋ―΄–Β –≤ –Ϋ–Α―¹―²–Ψ―è―â–Β–Β –≤―Ä–Β–Φ―è –Φ–Β―²–Ψ–¥―΄ –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―è –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι ―¹–≤–Β―Ä―²―΄–≤–Α―é―â–Β–Ι ―¹–Η―¹―²–Β–Φ―΄ –Κ―Ä–Ψ–≤–Η –Ω–Ψ–Ζ–≤–Ψ–Μ―è―é―² –Ψ–Ω–Β―Ä–Α―²–Η–≤–Ϋ–Ψ ―Ä–Β–Α–≥–Η―Ä–Ψ–≤–Α―²―¨ –Ϋ–Α –Η–Ζ–Φ–Β–Ϋ–Β–Ϋ–Η―è –Η –Ω―Ä–Ψ–≤–Ψ–¥–Η―²―¨ –Α–¥–Β–Κ–≤–Α―²–Ϋ―É―é –Η―Ö –Κ–Ψ―Ä―Ä–Β–Κ―Ü–Η―é, –Φ–Η–Ϋ–Η–Φ–Η–Ζ–Η―Ä―É―è ―Ä–Η―¹–Κ–Η ―Ä–Α–Ζ–≤–Η―²–Η―è ―³–Α―²–Α–Μ―¨–Ϋ―΄―Ö –Ψ―¹–Μ–Ψ–Ε–Ϋ–Β–Ϋ–Η–Ι.
–£ –¥–Α–Ϋ–Ϋ–Ψ–Ι ―Ä–Α–±–Ψ―²–Β –±―΄–Μ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ –Ω―Ä–Η–Φ–Β―Ä ―É―¹–Ω–Β―à–Ϋ–Ψ–≥–Ψ –Ω–Ψ–¥–±–Ψ―Ä–Α –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η –Η ―Ä–Α–±–Ψ―²―΄ –Φ―É–Μ―¨―²–Η–¥–Η―¹―Ü–Η–Ω–Μ–Η–Ϋ–Α―Ä–Ϋ–Ψ–Ι –±―Ä–Η–≥–Α–¥―΄, –¥–Η–Ϋ–Α–Φ–Η―΅–Β―¹–Κ–Ψ–Ι –Ψ―Ü–Β–Ϋ–Κ–Η –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α ―É –Ω–Α―Ü–Η–Β–Ϋ―²–Α ―¹ –Π–ü, ―¹–Ψ―¹―²–Ψ―è–≤―à–Η–Φ―¹―è –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η–Β–Φ, ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Ψ–Φ –Ω–Ψ–¥–Κ–Ψ–Μ–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ ―¹–Ω―Ä–Α–≤–Α –Η –Ψ–±―â–Β–Ι –±–Β–¥―Ä–Β–Ϋ–Ϋ–Ψ–Ι –≤–Β–Ϋ―΄ ―¹–Μ–Β–≤–Α –Η –Φ–Α―¹―¹–Η–≤–Ϋ–Ψ–Ι –Δ–≠–¦–ê. –½–Α―΅–Α―¹―²―É―é –Ψ―à–Η–±–Ψ―΅–Ϋ–Ψ ―¹―΅–Η―²–Α–Β―²―¹―è, ―΅―²–Ψ –Ω–Α―Ü–Η–Β–Ϋ―²―΄ ―¹ –Π–ü –Ζ–Α―â–Η―â–Β–Ϋ―΄ –Ψ―² ―Ä–Α–Ζ–≤–Η―²–Η―è ―²―Ä–Ψ–Φ–±–Ψ–Ζ–Ψ–≤ –¥–Β―³–Η―Ü–Η―²–Ψ–Φ ―³–Α–Κ―²–Ψ―Ä–Ψ–≤ ―¹–≤–Β―Ä―²―΄–≤–Α–Ϋ–Η―è –Κ―Ä–Ψ–≤–Η, –Ψ–¥–Ϋ–Α–Κ–Ψ, –Ϋ–Β―¹–Φ–Ψ―²―Ä―è –Ϋ–Α –Ω―Ä–Β–¥―Ä–Α―¹–Ω–Ψ–Μ–Ψ–Ε–Β–Ϋ–Ϋ–Ψ―¹―²―¨ –Κ –Κ―Ä–Ψ–≤–Ψ―²–Β―΅–Β–Ϋ–Η―è–Φ, ―É ―²–Α–Κ–Η―Ö –Ω–Α―Ü–Η–Β–Ϋ―²–Ψ–≤ –Φ–Ψ–≥―É―² –≤–Ψ–Ζ–Ϋ–Η–Κ–Α―²―¨ ―²―Ä–Ψ–Φ–±–Ψ―²–Η―΅–Β―¹–Κ–Η–Β ―è–≤–Μ–Β–Ϋ–Η―è. –†–Α–Ζ–Ϋ–Ψ–Ϋ–Α–Ω―Ä–Α–≤–Μ–Β–Ϋ–Ϋ―΄–Β –Ϋ–Α―Ä―É―à–Β–Ϋ–Η―è –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α –¥–Β–Μ–Α―é―² ―²―Ä―É–¥–Ϋ―΄–Φ –Ω–Ψ–¥–±–Ψ―Ä –Α–Ϋ―²–Η–Κ–Ψ–Α–≥―É–Μ―è–Ϋ―²–Ψ–≤. –ù–Β–Ψ–±―Ö–Ψ–¥–Η–Φ ―²―â–Α―²–Β–Μ―¨–Ϋ―΄–Ι –Κ–Ψ–Ϋ―²―Ä–Ψ–Μ―¨ –Ω–Ψ–Κ–Α–Ζ–Α―²–Β–Μ–Β–Ι –≥–Β–Φ–Ψ―¹―²–Α–Ζ–Α.
–Γ–≤–Β–¥–Β–Ϋ–Η―è –Ψ–± –Α–≤―²–Ψ―Ä–Α―Ö:
–ê―Ä―΄–Κ–Α–Ϋ –ù–Η–Ϋ–Α –™–Β–Ϋ–Ϋ–Α–¥―¨–Β–≤–Ϋ–Α βÄî –Κ.–Φ.–Ϋ., –≤―Ä–Α―΅ –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥-―Ä–Β–Α–Ϋ–Η–Φ–Α―²–Ψ–Μ–Ψ–≥ –Ψ―²–¥–Β–Μ–Β–Ϋ–Η―è ―Ä–Β–Α–Ϋ–Η–Φ–Α―Ü–Η–Η –Η –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―Ü–Β–Ϋ―²―Ä–Α –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η –Η ―Ä–Β–Α–Ϋ–Η–Φ–Α―Ü–Η–Η –™–ë–Θ–½ ¬Ϊ–™–ö–ë –Η–Φ. –Λ.–‰. –‰–Ϋ–Ψ–Ζ–Β–Φ―Ü–Β–≤–Α –î–½–€¬Μ; 105187, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, ―É–Μ. –Λ–Ψ―Ä―²―É–Ϋ–Α―²–Ψ–≤―¹–Κ–Α―è, –¥. 1; ORCID iD 0000-0002-8731-6168.
–®–Β―¹―²–Ψ–Ω–Α–Μ–Ψ–≤ –ê–Μ–Β–Κ―¹–Α–Ϋ–¥―Ä –ï―³–Η–Φ–Ψ–≤–Η―΅ βÄî –¥.–Φ.–Ϋ., –Ω―Ä–Ψ―³–Β―¹―¹–Ψ―Ä, –Ζ–Α―¹–Μ―É–Ε–Β–Ϋ–Ϋ―΄–Ι –≤―Ä–Α―΅ –†–Λ, –Ω―Ä–Ψ―³–Β―¹―¹–Ψ―Ä –Κ–Α―³–Β–¥―Ä―΄ –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η –Η –Ϋ–Β–Ψ―²–Μ–Ψ–Ε–Ϋ–Ψ–Ι –Φ–Β–¥–Η―Ü–Η–Ϋ―΄ –Λ–™–ë–û–Θ –î–ü–û –†–€–ê–ù–ü–û –€–Η–Ϋ-–Ζ–¥―Ä–Α–≤–Α –†–Ψ―¹―¹–Η–Η; 125993, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, ―É–Μ. –ë–Α―Ä―Ä–Η–Κ–Α–¥–Ϋ–Α―è, –¥. 2/1; –Κ–Ψ–Ϋ―¹―É–Μ―¨―²–Α–Ϋ―² –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥-―Ä–Β–Α–Ϋ–Η–Φ–Α―²–Ψ–Μ–Ψ–≥ –Λ–™–ë–Θ ¬Ϊ–™–£–ö–™ –Η–Φ. –ù.–ù. –ë―É―Ä–¥–Β–Ϋ–Κ–Ψ¬Μ; 105094, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, –™–Ψ―¹–Ω–Η―²–Α–Μ―¨–Ϋ–Α―è –Ω–Μ., –¥. 3; –≥–Μ–Α–≤–Ϋ―΄–Ι –Ϋ–Α―É―΅–Ϋ―΄–Ι ―¹–Ψ―²―Ä―É–¥–Ϋ–Η–Κ –Λ–ù–ö–Π –†–†, –≤–Η―Ü–Β-–Ω―Ä–Β–Ζ–Η–¥–Β–Ϋ―² –ù–Α―Ü–Η–Ψ–Ϋ–Α–Μ―¨–Ϋ–Ψ–Ι –Α―¹―¹–Ψ―Ü–Η–Α―Ü–Η–Η –Κ–Μ–Η–Ϋ–Η―΅–Β―¹–Κ–Ψ–≥–Ψ –Ω–Η―²–Α–Ϋ–Η―è –Η –Φ–Β―²–Α–±–Ψ–Μ–Η–Ζ–Φ–Α; 107031, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, ―É–Μ. –ü–Β―²-―Ä–Ψ–≤–Κ–Α, –¥. 25, ―¹―²―Ä. 2; ORCID iD 0000-0002-5278-7058.
–Ξ–≤–Ψ―Ä–Ψ―¹―²–Η–Ϋ–Η–Ϋ–Α –ï–Μ–Β–Ϋ–Α –ï–≥–Ψ―Ä–Ψ–≤–Ϋ–Α βÄî –Ζ–Α–≤–Β–¥―É―é―â–Α―è –Ψ―²–¥–Β–Μ–Β–Ϋ–Η–Β–Φ ―Ä–Β–Α–Ϋ–Η–Φ–Α―Ü–Η–Η –Η –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―Ü–Β–Ϋ―²―Ä–Α –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η –Η ―Ä–Β–Α–Ϋ–Η–Φ–Α―Ü–Η–Η, –≤―Ä–Α―΅ –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥-―Ä–Β–Α–Ϋ–Η–Φ–Α―²–Ψ–Μ–Ψ–≥ –™–ë–Θ–½ ¬Ϊ–™–ö–ë –Η–Φ. –Λ.–‰. –‰–Ϋ–Ψ–Ζ–Β–Φ―Ü–Β–≤–Α –î–½–€¬Μ; 105187, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, ―É–Μ. –Λ–Ψ―Ä―²―É–Ϋ–Α―²–Ψ–≤―¹–Κ–Α―è, –¥. 1; ORCID iD 0000-0002-1984-0136.
–ö–Ψ–Φ–Α―Ä–Ψ–≤–Α –¦–Ψ―Ä–Η―²―²–Α –ê–Ϋ–¥―Ä–Β–Β–≤–Ϋ–Α βÄî –≤―Ä–Α―΅ –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥-―Ä–Β–Α–Ϋ–Η–Φ–Α―²–Ψ–Μ–Ψ–≥ –Ψ―²–¥–Β–Μ–Β–Ϋ–Η―è ―Ä–Β–Α–Ϋ–Η–Φ–Α―Ü–Η–Η –Η –Η–Ϋ―²–Β–Ϋ―¹–Η–≤–Ϋ–Ψ–Ι ―²–Β―Ä–Α–Ω–Η–Η ―Ü–Β–Ϋ―²―Ä–Α –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η –Η ―Ä–Β–Α–Ϋ–Η–Φ–Α―Ü–Η–Η –™–ë–Θ–½ ¬Ϊ–™–ö–ë –Η–Φ. –Λ.–‰. –‰–Ϋ–Ψ–Ζ–Β–Φ―Ü–Β–≤–Α –î–½–€¬Μ; 105187, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, ―É–Μ. –Λ–Ψ―Ä―²―É–Ϋ–Α―²–Ψ–≤―¹–Κ–Α―è, –¥. 1; ORCID iD 0000-0002-3773-7351.
–ê–Μ–Β–Κ―¹–Β–Β–≤–Α –ê–Ϋ–Ϋ–Α –û–Μ–Β–≥–Ψ–≤–Ϋ–Α βÄî –Ψ―Ä–¥–Η–Ϋ–Α―²–Ψ―Ä –Κ–Α―³–Β–¥―Ä―΄ –Α–Ϋ–Β―¹―²–Β–Ζ–Η–Ψ–Μ–Ψ–≥–Η–Η –Η ―Ä–Β–Α–Ϋ–Η–Φ–Α―²–Ψ–Μ–Ψ–≥–Η–Η –™–ë–Θ–½ ¬Ϊ–ù–‰–‰ –Γ–ü –Η–Φ. –ù.–£. –Γ–Κ–Μ–Η―³–Ψ―¹–Ψ–≤―¹–Κ–Ψ–≥–Ψ –î–½–€¬Μ; 129090, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, –ë. –Γ―É―Ö–Α―Ä–Β–≤―¹–Κ–Α―è –Ω–Μ., –¥. 3; ORCID iD 0000-0002-6488-8040.
–ê―¹–Α―²―É―Ä―è–Ϋ –ö–Α―Ä–Β–Ϋ –Γ–Β―Ä–≥–Β–Β–≤–Η―΅ βÄî –≤―Ä–Α―΅ ―¹–Β―Ä–¥–Β―΅–Ϋ–Ψ-―¹–Ψ―¹―É–¥–Η―¹―²―΄–Ι ―Ö–Η―Ä―É―Ä–≥ –™–ë–Θ–½ ¬Ϊ–™–ö–ë –Η–Φ. –Λ.–‰. –‰–Ϋ–Ψ–Ζ–Β–Φ―Ü–Β–≤–Α –î–½–€¬Μ; 105187, –†–Ψ―¹―¹–Η―è, –≥. –€–Ψ―¹–Κ–≤–Α, ―É–Μ. –Λ–Ψ―Ä―²―É–Ϋ–Α―²–Ψ–≤―¹–Κ–Α―è, –¥. 1; ORCID iD 0000-0003-2389-058X.
–ö–Ψ–Ϋ―²–Α–Κ―²–Ϋ–Α―è –Η–Ϋ―³–Ψ―Ä–Φ–Α―Ü–Η―è: –ê―Ä―΄–Κ–Α–Ϋ –ù–Η–Ϋ–Α –™–Β–Ϋ–Ϋ–Α–¥―¨–Β–≤–Ϋ–Α, e-mail: md.panova@gmail.com.
–ü―Ä–Ψ–Ζ―Ä–Α―΅–Ϋ–Ψ―¹―²―¨ ―³–Η–Ϋ–Α–Ϋ―¹–Ψ–≤–Ψ–Ι –¥–Β―è―²–Β–Μ―¨–Ϋ–Ψ―¹―²–Η: –Ϋ–Η–Κ―²–Ψ –Η–Ζ –Α–≤―²–Ψ―Ä–Ψ–≤ –Ϋ–Β –Η–Φ–Β–Β―² ―³–Η–Ϋ–Α–Ϋ―¹–Ψ–≤–Ψ–Ι –Ζ–Α–Η–Ϋ―²–Β―Ä–Β―¹–Ψ–≤–Α–Ϋ–Ϋ–Ψ―¹―²–Η –≤ –Ω―Ä–Β–¥―¹―²–Α–≤–Μ–Β–Ϋ–Ϋ―΄―Ö –Φ–Α―²–Β―Ä–Η–Α–Μ–Α―Ö –Η–Μ–Η –Φ–Β―²–Ψ–¥–Α―Ö.
–ö–Ψ–Ϋ―³–Μ–Η–Κ―² –Η–Ϋ―²–Β―Ä–Β―¹–Ψ–≤ –Ψ―²―¹―É―²―¹―²–≤―É–Β―².
–Γ―²–Α―²―¨―è –Ω–Ψ―¹―²―É–Ω–Η–Μ–Α 01.02.2022.
–ü–Ψ―¹―²―É–Ω–Η–Μ–Α –Ω–Ψ―¹–Μ–Β ―Ä–Β―Ü–Β–Ϋ–Ζ–Η―Ä–Ψ–≤–Α–Ϋ–Η―è 25.02.2022.
–ü―Ä–Η–Ϋ―è―²–Α –≤ –Ω–Β―΅–Α―²―¨ 24.03.2022.
About the authors:
Nina G. Arykan βÄî C. Sc. (Med.), anesthesiologist and intensivist of the Intensive Care Unit of the Center of Anesthesia and Resuscitation, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0002-8731-6168.
Aleksandr E. Shestopalov βÄî Dr. Sc. (Med.), Professor, Honored Doctor of the Russian Federation, professor of the Department of Anesthesia and Emergency Medicine, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; consulting anesthesiologist and intensivist, N.N. Burdenko Main Military Clinical Hospital; 3, Gospitalnaya sq., Moscow, 105094, Russian Federation; leading researcher, Federal Scientific and Clinical Center for Resuscitation and Rehabilitation; Vice-President of the National Association of Clinical Nutrition and Metabolism; 25 build. 2, Petrovka str., Moscow, 107031, Russian Federation; ORCID iD 0000-0002-5278-7058.
Elena E. Khvorostinina βÄî Head of the Intensive Care Unit of the Center of Anesthesia and Resuscitation, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0002-1984-0136.
Loritta A. Komarova βÄî anesthesiologist and intensivist of the Intensive Care Unit of the Center of Anesthesia and Resuscitation, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0002-3773-7351.
Anna O. Alekseeva βÄî resident of the Department of Anesthesia and Resuscitation, N.V. Sklifosovskiy Research Institute for Emergency Medical Aid; 3, Bolshaya Sukharevskaya sq., Moscow, 129090, Russian Federation; ORCID iD0000-0002-6488-8040.
Karen S. Asaturyan βÄî cardiovascular surgeon, F.I. Inozemtsev City Clinical Hospital; 1, Fortunatovskaya str., Moscow, 105187, Russian Federation; ORCID iD 0000-0003-2389-058X.
Contact information: Nina G. Arykan, e-mail: md.panova@gmail.com.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 01.02.2022.
Revised 25.02.2022.
Accepted 24.03.2022.












