Актуальность
В настоящее время хронической обструктивной болезнью легких (ХОБЛ) в мире страдают около 174 млн человек, ожидается рост заболеваемости в течение следующих 25 лет в результате увеличения количества курильщиков в развивающихся странах и продолжающегося старения популяции в странах с высоким уровнем жизни [1]. Артериальной гипертензией (АГ) страдает в среднем около 30–45% взрослой популяции [2].
АГ — наиболее часто встречающееся коморбидное состояние при ХОБЛ [3, 4]. Показано, что АГ встречается более чем у 50% больных ХОБЛ. В исследовании J.M. Echave et al. изучалась частота сопутствующей патологии у больных ХОБЛ (977 человек, средний возраст — 70,1±9,8 года, 87,4% мужчин). При использовании индекса Charlson у 65,7% исследуемых выявлены коморбидные состояния, из которых 57,7% составила АГ [5, 6].
Как и АГ, ХОБЛ и нарушенная легочная функция независимо связаны с увеличением риска сердечно-сосудистых событий [7, 8]. По данным ряда исследований установлено, что снижение функции легких (уменьшение объема форсированного выдоха за первую секунду (ОФВ1)) является столь же сильным фактором риска сердечно-сосудистой смертности, как и основные факторы сердечно-сосудистого риска. В исследовании The Lung Health Study (5887 курильщиков в возрасте 35–60 лет с умеренной степенью бронхиальной обструкции) установлено, что при уменьшении ОФВ1 на 10% происходил рост показателя общей смертности на 14%, сердечно-сосудистой смертности — на 28%, риск развития ишемической болезни сердца (ИБС) увеличивался на 20% [9].
Патогенетические взаимосвязи АГ и ХОБЛ
Общими патофизиологическими механизмами развития ХОБЛ и сердечно-сосудистых заболеваний, формирования и стабилизации АГ являются:
нарушение функции автономной нервной системы с активацией симпато-адреналовой системы (САС);
активация ренин-ангиотензин-альдостероновой системы (РААС);
воспаление на легочном и системном уровнях;
дисбаланс в системе оксидант/антиоксидант с формированием оксидативного повреждения на локальном и системном уровнях;
эндотелиальное и сосудистое повреждение с повышением жесткости сосудистой стенки и ускорением процессов атерогенеза [10].
В настоящее время ХОБЛ признается системным (полиорганным) заболеванием с коморбидными сердечно-сосудистыми состояниями. Основной патогенетический механизм развития и прогрессии этой коморбидной патологии — системное воспаление и оксидативный стресс [11, 12]. Эпицентром воспаления у больных ХОБЛ являются легкие, с течением времени происходит распространение воспалительных цитокинов и оксидантов по системному кровотоку (эффект «spill over» — «перелива») с развитием системного воспаления низкой градации [12–15]. Воспалительные стимулы приводят к повреждению бронхолегочной и сердечно-сосудистой систем (снижение легочной функции, формирование эмфиземы и гиперинфляции, легочный фиброз, инициация процессов сосудистого повреждения и атерогенеза с дальнейшим развитием сердечно-сосудистых заболеваний) (рис. 1).
![Рис. 1. Потенциальные механизмы взаимосвязи ХОБЛ в сочетании с АГ с сердечно-сосудистыми заболеваниями (адапт. из [71]). Рис. 1. Потенциальные механизмы взаимосвязи ХОБЛ в сочетании с АГ с сердечно-сосудистыми заболеваниями (адапт. из [71]).](/upload/medialibrary/6ec/32-1.png)
Легочные и сердечно-сосудистые эффекты активации РААС
В последние годы был проведен целый ряд исследований, которые показали универсальный характер эффектов активации РААС при кардиореспираторной патологии с наличием как сердечно-сосудистых, так и легочных повреждающих воздействий.
Эффекты активации легочной РААС:
увеличение выработки провоспалительных цитокинов в легких с формированием локальной воспалительной реакции;
сосудистое повреждение, активация протромботического сценария с формированием легочной гипертензии;
индукция процессов ремоделирования в легких с развитием паренхиматозной деструкции и эмфиземы;
развитие легочного фиброза;
развитие дисфункции скелетных мышц на фоне системной воспалительной реакции с нарушением механики дыхания [16–24].
Все вышеописанные процессы приводят к развитию бронхиальной обструкции и редукции легочных объемов с падением легочной функции.
Таким образом, активация системы РААС, помимо сосудистых эффектов с повышением системного АД, стимулирует целый ряд органных (сердечно-сосудистых и респираторных повреждений) в результате активации оксидативного стресса, системного воспаления, эндотелиального повреждения.
Тактика антигипертензивной терапии
Тактика ведения АГ у большинства больных ХОБЛ не отличается от ведения АГ в общей популяции, но имеются некоторые специфические дополнения. Данные об исходах антигипертензивной терапии у пациентов с ХОБЛ ограничены из-за недостаточности доказательной базы по сердечно-сосудистым конечным точкам. Фактически отсутствуют рандомизированные клинические исследования (РКИ), посвященные антигипертензивной терапии этой группы больных. Рекомендации традиционно базируются на теоретических рисках антигипертензивных препаратов (АГП) у пациентов с ХОБЛ. Фармакокинетические и фармакодинамические факторы должны приниматься во внимание при выборе АГП для пациентов с ХОБЛ параллельно с учетом легочной функции и любых сопутствующих состояний. Степень легочного повреждения может влиять на пользу и риски определенных терапевтических стратегий.
Отсутствие РКИ с доказательной базой по рискам и пользе антигипертензивной терапии у больных АГ и ХОБЛ не дает оснований для создания четких клинических рекомендаций. Все консенсусы и рекомендации по назначению АГП у больных ХОБЛ основаны на небольших клинических исследованиях «случай — контроль» и согласованном мнении экспертов. Таким образом, антигипертензивная терапия должна проводиться в соответствии с существующими рекомендациями и с некоторыми минимальными ограничениями [10, 25].
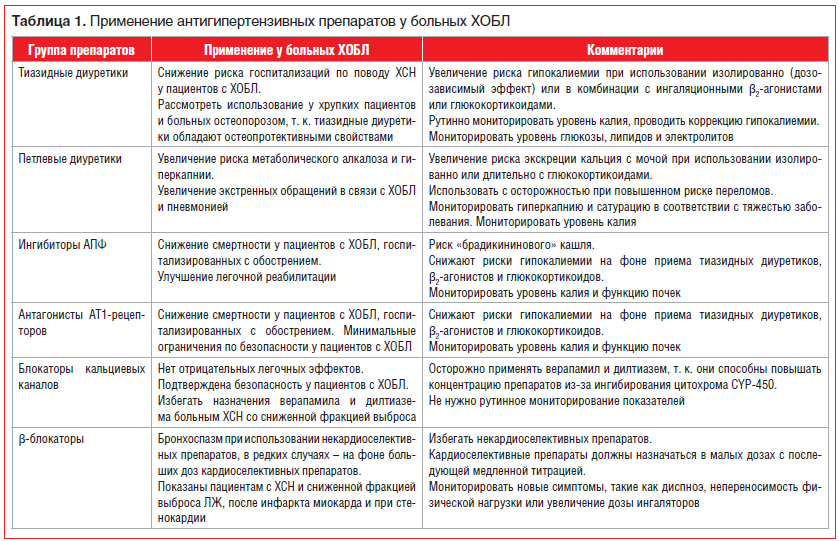
Диуретики
Ретроспективное исследование эффективности тиазидных диуретиков, использовавшихся одновременно с другими АГП у 7140 пациентов с ХОБЛ и АГ, показало отсутствие увеличения обострений ХОБЛ на фоне приема тиазидных диуретиков (в сравнении с комбинированной терапией без диуретиков) [26]. Несмотря на традиционные опасения, связанные с негативным влиянием диуретиков на мукоцилиарный клиренс, вязкость мокроты, современные данные позволяют констатировать, что применение тиазидных диуретиков не влияет негативно на респираторные функции. С другой стороны, электролитные нарушения могут встречаться на фоне использования ингаляционных β2-агонистов, которые изменяют концентрацию внутриклеточного калия, и на фоне приема глюкокортикоидов, увеличивающих почечную экскрецию калия [27, 28]. Гипокалиемия на фоне применения тиазидных диуретиков имеет дозозависимый характер и усугубляется при наращивании доз [29]. Аритмии встречаются редко, но диагностируются у ряда пациентов с гипокалиемией (уровень калия менее 3,5 ммоль/л). У пациентов с ХОБЛ должен периодически проводиться мониторинг ионограммы для выявления электролитных нарушений, особенно когда глюкокортикоиды и бронходилататоры назначаются впервые либо увеличиваются их дозы. Петлевые диуретики обладают минимальным антигипертензивным эффектом, но часто назначаются пациентам с хронической сердечной недостаточностью (ХСН) и при перегрузке объемом или у пациентов со скоростью клубочковой фильтрации (СКФ) менее 30 мл/мин [30]. Мониторинг электролитов особенно необходим у таких пациентов, т. к. гипокалиемия чаще встречается на фоне применения петлевых диуретиков, чем на фоне применения тиазидных.
Также важно учитывать, что петлевые диуретики могут приводить к метаболическому алкалозу и гиперкапнии у пациентов с ХОБЛ. По данным недавнего ретроспективного когортного исследования, существует связь новых назначений петлевых диуретиков в течение 30 дней с обращениями больных ХОБЛ за неотложной помощью или госпитализацией по поводу обострений или пневмонии [31]. В этой когорте побочные респираторные эффекты были обнаружены при приеме петлевых (но не тиазидных) диуретиков, ингибиторов ангиотензинпревращающего фермента (ИАПФ) или сартанов. И хотя в этом обсервационном исследовании другие факторы не были исключены, это, безусловно, является предупреждением о риске побочных респираторных эффектов при назначении петлевых диуретиков широкой когорте пациентов с ХОБЛ. Таким образом, ограничение использования петлевых диуретиков при ведении АГ у больных ХОБЛ и мониторирование электролитных эффектов тиазидных диуретиков представляются разумными мерами.
Ингибиторы АПФ и блокаторы АТ1-рецепторов
Хотя ИАПФ и блокаторы ангиотензиновых АТ1-рецепторов (БАР) позиционируются как препараты первой линии при ведении АГ, т. к. они ассоциируются со снижением риска сердечно-сосудистых и цереброваскулярных событий, при назначении этих препаратов пациентам с ХОБЛ должны учитываться риски и польза в отношении определенных респираторных функций [10, 25].
Теоретически положительные эффекты ИАПФ включают ослабление воспаления в системе легочной гемоциркуляции и положительное действие на газообмен, респираторное усилие и мышечную функцию. У пациентов с легочным фиброзом установлено увеличение соотношения АТ1/АТ2-рецепторов и снижение ОФВ1 [32]. Эта инверсия соотношения подтверждает патофизиологическую роль системы РААС у пациентов с аллергическим воспалением дыхательных путей и ХОБЛ [33]. Кроме того, т. к. легкие и скелетная мускулатура экспрессируют ИАПФ, система РААС вовлечена в патогенез легочных и внелегочных симптомов ХОБЛ. РААС участвует в патогенезе ХОБЛ посредством активации продукции провоспалительных цитокинов, таких как интерлейкин-6 и фактор некроза опухолей. Легочное повреждение потенциально опосредовано РААС-эффектами в отношении Т-лимфоцитов АТ1-генерированных активных форм кислорода, которые способствуют митохондриальной дисфункции и, в дальнейшем, активации оксидативного стресса и дисфункции эндотелия [34].
По данным обсервационных исследований, ИАПФ и БАР могут вызывать как сердечно-сосудистые, так и респираторные протективные эффекты у пациентов с ХОБЛ [35, 36]. В неконтролируемых исследованиях использование ИАПФ и БАР у госпитализированных пациентов с обострением ХОБЛ было связано со значительным снижением 90-дневной смертности [37], однако подтверждения этих данных в РКИ не было.
Несмотря на очевидные преимущества использования ИАПФ у больных ХОБЛ, побочные эффекты, ассоциированные с их применением, могут лимитировать их использование. Кашель — наиболее частый побочный эффект, он встречается у 5–35% пациентов на фоне терапии ИАПФ [38]. Индуцированный ИАПФ ангионевротический отек встречается в популяции редко (0,2–0,7%), но его частота растет у пожилых пациентов (старше 65 лет), курильщиков, на фоне терапии антагонистами кальция, антигистаминными препаратами или системными глюкокортикоидами [38–40]. ИАПФ-индуцированный кашель и бронхоспазм, так же как и ангионевротический отек, связаны с увеличением концентрации брадикинина и гораздо чаще встречаются у пациентов с аллергией, использующих антигистаминные и антиастматические препараты [40]. Таким образом, эффекты снижения риска сердечно-сосудистых событий и смертности на фоне терапии ИАПФ, доказанные в РКИ при ведении пациентов с АГ в общей популяции, делают оправданным применение этих препаратов у больных ХОБЛ, у которых не развиваются побочные эффекты. В отличие от тиазидных диуретиков, ИАПФ и БАР снижают риск гипокалиемии на фоне применения ингаляционных β2-агонистов. Блокаторы РААС могут быть препаратами выбора у пациентов с риском развития гипокалиемии.
β-адреноблокаторы
Современные рекомендации не позиционируют β-адреноблокаторы (БАБ) как препараты для инициальной терапии АГ в общей популяции пациентов, однако рекомендуется их преимущественное применение в особых клинических ситуациях — при симпатикотонии, ИБС, ХСН, тахиаритмии и т. д. [25]. Таким образом, назначение кардиоселективных препаратов больным ХОБЛ рекомендовано при наличии дополнительных показаний.
При использовании низких доз на старте терапии и осторожной титрации безопасность кардиоселективных β1-адреноблокаторов хорошо доказана. Применение некардиоселективных препаратов (карведилол, пропранолол) не рекомендовано при любых клинических состояниях с бронхоспастическим синдромом [29].
Несколько обсервационных исследований показали снижение риска смерти и уменьшение числа госпитализаций у пациентов с ХОБЛ и сердечно-сосудистыми заболеваниями на фоне применения как кардиоселективных, так и некардиоселективных БАБ, при отсутствии значимого влияния на функцию внешнего дыхания [41–46]. Однако в недавнем рандомизированном исследовании, включавшем больных ХОБЛ, которые не имели установленных показаний к применению БАБ, метопролол не предупреждал обострения ХОБЛ [47]. Кардиоселективные БАБ могут с успехом использоваться у пациентов, госпитализированных с обострением ХОБЛ, при наличии показаний к применению [48]. Небольшое проспективное когортное исследование показало, что использование кардиоселективных БАБ может улучшить выживаемость после аортокоронарного шунтирования (АКШ) у пациентов с ХОБЛ [49].
Также в недавнем исследовании, включавшем 6770 пациентов, которые были госпитализированы с острым инфарктом миокарда, в группе ХОБЛ (28,3% популяции исследования) было показано меньшее использование рекомендованной терапии, чем в общей популяции пациентов, такой как БАБ, чрескожные коронарные вмешательства и АКШ [50]. Отказ от рекомендованной терапии был ассоциирован с увеличением смертности.
Хотя использование кардиоселективных БАБ у пациентов с ХОБЛ в целом не ассоциировано с индуцированием бронхоспазма, наши рекомендации — использовать небольшие дозы на старте терапии у всех пациентов, с медленным темпом up-титрации, чтобы минимизировать риски гипотензии и брадикардии. Клиницисты должны быть бдительны во избежание обострения респираторных симптомов, когда терапия БАБ инициируется или дозы увеличиваются, например, при недооцененной истории астмы, сочетании астмы и ХОБЛ (астма-ХОБЛ overlap-синдром), недиагностированной обратимой бронхообструкции или повышении уровня эозинофилов в периферической крови (сопутствующая астма).
Блокаторы кальциевых каналов
Применение препаратов первого выбора в инициальной терапии АГ у общей популяции пациентов ассоциировано со снижением риска сердечно-сосудистых событий и смертности. Блокаторы кальциевых каналов (БКК) — средства первой линии для ведения АГ у больных ХОБЛ, т. к. обладают целым рядом дополнительных эффектов и преимуществ.
Плейотропные эффекты БКК:
релаксация гладких мышц в бронхиолах, профилактика бронхоспазма, индуцированного физической активностью, уменьшение неспецифической бронхореактивности;
влияние на гемодинамику малого круга — уменьшение легочной гипертензии;
вазопротективные эффекты — влияние на процессы сосудистого повреждения;
органопротективные эффекты: регресс гипертрофии левого желудочка (ЛЖ), уменьшение атеросклеротического поражения сонных, коронарных и периферических артерий [10, 25, 51, 52].
Вазопротективные, антиатеросклеротические эффекты БКК связаны с их эндотелийрегулирующими, антиоксидантными свойствами. Дигидропиридиновые БКК улучшают эндотелийзависимую вазодилатацию за счет увеличения активности NO [53, 54], обладают антиоксидантными свойствами (посредством ингибирования перекисного окисления липидов в клеточных мембранах) [55, 56]. Амлодипин улучшает функцию эндотелия за счет увеличения продолжительности полураспада NO, ингибирует пролиферацию гладкомышечных клеток, предотвращая цитокинопосредованный апоптоз, уменьшает экспрессию молекул адгезии — ICAM-1, VCAM-1 и E-селектина. Показано также усиление высвобождения брадикинина под воздействием БКК [57].
Таким образом, БКК способны блокировать ключевые повреждающие эндотелиальные стимулы, влиять на основные патогенетические механизмы сосудистого повреждения при ХОБЛ.
В ряде небольших нерандомизированных исследований установлены положительные эффекты амлодипина у пациентов с ХОБЛ и АГ: снижение артериального давления (АД), коррекция суточного профиля АД, органопротективные свойства: уменьшение гипертрофии ЛЖ, степени диастолической дисфункции, снижение альбуминурии, а также плейотропные эффекты: антиоксидантный, противовоспалительный, эндотелийрегулирующий [58, 59].
Таким образом, БКК являются препаратами выбора для пациентов с ХОБЛ и АГ.
Антигипертензивные препараты других групп
Не существует специфических противопоказаний для использования калийсберегающих диуретиков и антагонистов минералокортикоидных рецепторов, однако эти препараты не являются средствами выбора для инициальной терапии АГ. Альфа-адреноблокаторы не демонстрируют отрицательных респираторных эффектов.
Препараты центрального действия, такие как клонидин, могут увеличивать бронхиальную реактивность [60]. Использование более специфических препаратов для уменьшения центральной симпатической активности — агонистов I1-имидазолиновых рецепторов — не исследовано у пациентов с ХОБЛ и АГ. Эти препараты могут использоваться как средство второй, третьей линии в комбинированных схемах антигипертензивной терапии. Минимальная информация имеется о респираторной безопасности периферических вазодилататоров, таких как гидралазин [10].
Резюмирующая информация о применении АГП у пациентов с ХОБЛ приведена в таблице 1.
Комбинированная терапия
В рекомендациях Европейского общества кардиологов / Европейского общества по артериальной гипертензии (2018) с высоким классом и уровнем доказанности (IA) отдается предпочтение комбинированной терапии. Впервые внедрена стратегия «single pill» — терапия фиксированными комбинациями со старта большинству пациентов с АГ [25].
Исходя из существующих рекомендаций по ведению АГ и специфических патофизиологических механизмов АГ, больным ХОБЛ можно рекомендовать в качестве препаратов преимущественного выбора БКК, блокаторы РААС или комбинации БКК / блокаторы РААС. При недостаточном эффекте комбинированной антигипертензивной терапии показаны небольшие дозы тиазидных диуретиков, при наличии специфических показаний — высокоселективные β1-адреноблокаторы [10].
Безусловно, наличие коморбидных заболеваний неизбежно приводит к вынужденной полипрагмазии и, как следствие, к снижению приверженности терапии. У пациентов с ХОБЛ и АГ количество принимаемых лекарственных препаратов может достигать 6–8 наименований [61, 62], при этом увеличивается риск межлекарственных взаимодействий. Современная фармакотерапия АГ и ХОБЛ основана на применении фиксированных комбинаций — базисной терапии бронхолитиками (двойная бронходилатация — β2-агонист / М-холинолитик) и АГП (блокатор РААС / БКК), что существенно повышает приверженность терапии и позволяет воздействовать на различные стороны патогенеза обоих заболеваний.
При лечении АГ в сочетании с ХОБЛ показано назначение препаратов / комбинаций, не только эффективно контролирующих АД, но и отвечающих ряду требований:
обеспечение 24-часового контроля АД при приеме 1–2 р./сут;
адекватный контроль АД в ночные и ранние утренние часы;
совместимость препаратов с базисными средствами лечения ХОБЛ;
отсутствие эффектов, ухудшающих бронхиальную проходимость, усугубляющих гипоксию;
положительное влияние на гемодинамику малого круга кровообращения;
выраженные кардио- и вазопротективные эффекты;
отсутствие влияния гипоксии на фармакодинамику АГП [10].
Этим требованиям отвечает активно используемая специалистами фиксированная комбинация Экватор (лизиноприл + амлодипин). Гибкая дозировочная линейка позволяет грамотно подбирать индивидуальную дозу.
В многочисленных клинических исследованиях показана высокая эффективность Экватора:
достижение целевого уровня АД на фоне перехода на эту фиксированную комбинацию 77–100% пациентов;
уменьшение вариабельности АД в течение суток, коррекция суточного профиля АД;
хорошая переносимость терапии, низкий процент развития кашля, повышение качества жизни;
повышение приверженности терапии;
органопротективные эффекты (снижение уровня альбуминурии, уменьшение гипертрофии ЛЖ, снижение скорости распространения пульсовой волны) [63–70].
Клиническое наблюдение
Больной К., 65 лет, наблюдается в клинике с диагнозом: Гипертоническая болезнь 3 стадии, АГ 2 степени, очень высокий риск сердечно-сосудистых осложнений — 4. Дислипидемия IIА. ХОБЛ: эмфизематозный фенотип, тяжелые функциональные нарушения (GOLD 3), выраженные клинические симптомы (CAT 21), редкие обострения (0–1 раз в год).
Обратился в клинику с жалобами на: повышение АД до 170/100 мм рт. ст. (адаптирован к АД 130/90 мм рт. ст.); общую слабость, быструю утомляемость, снижение работоспособности. Анамнез: страдает гипертонической болезнью более 15 лет, ХОБЛ в течение 10 лет. Курение: индекс пачка-лет — 40. Получает комбинированную базисную терапию: тиотропия бромид 5 мкг + олодатерол 5 мкг 1 р./сут; Мертенил (розувастатин) 20 мг/сут; эналаприл 10 мг + гидрохлортиазид 25 мг 1 р./сут в виде свободной комбинации.
На фоне подобранной базисной терапии отмечается отсутствие прогрессирования заболевания, редкие обострения. Достигнут целевой уровень ХС ЛПНП (менее 1,8 ммоль/л). Отсутствие целевого уровня АД подтверждено результатами самоконтроля — колебания АД в течение суток составляют от 145/90 до 160/95 мм рт. ст.
ЭКГ покоя: ритм синусовый, частота сердечных сокращений (ЧСС) — 75 уд./мин. Единичные наджелудочковые экстрасистолы.
Холтеровское мониторирование ЭКГ (ХМ ЭКГ). Базовый ритм синусовый. Средняя ЧСС — 64/мин, максимальная ЧСС — 110/мин, минимальная ЧСС — 50/мин. Пауз более 2,5 с не выявлено. Зафиксированы 1123 нежелудочковые экстрасистолы. Динамики сегмента ST не зарегистрировано.
Эхокардиография: дилатации камер сердца, гипертрофии миокарда не выявлено. Глобальная и локальная сократимость не нарушена. Диастолическая дисфункция ЛЖ — по I типу.
Лабораторные данные: в клиническом анализе крови и мочи — без отклонений. Биохимический анализ крови: глюкоза крови натощак — 4,9 ммоль/л, креатинин — 82 мкмоль/л, калий — 3,4 ммоль/л.
Анализ клинического случая:
целевое АД не достигнуто на фоне приема свободной комбинации ИАПФ и тиазидного диуретика;
зафиксирована гипокалиемия на фоне межлекарственных взаимодействий (тиазидный диуретик в сочетании с β2-агонистом);
выявлена суправентрикулярная экстрасистолия по ХМ ЭКГ.
Коррекция антигипертензивной терапии: назначен препарат Экватор 10/20 (амлодипин 10 мг + лизиноприл 20 мг). На фоне коррекции терапии через 10 дней пациент отметил снижение АД. По самоконтролю АД в течение дня — 125/80–135/85 мм рт. ст., улучшение самочувствия. Уровень калия — 4,4 ммоль/л. ХМ ЭКГ через 2 нед. после коррекции терапии: базовый ритм синусовый. Нарушений ритма нет. Динамики сегмента ST не зарегистрировано.
Таким образом, коррекция терапии с отменой тиазидного диуретика привела к коррекции гипокалиемии и нарушений ритма и достижению целевого уровня АД на фоне приема комбинированного препарата Экватор. В дальнейшем, после титрования дозы Экватора, пациента можно будет перевести на фиксированную комбинацию Эквамер (лизиноприл + амлодипин + розувастатин).
Заключение
Кардиореспираторная коморбидность, в частности сочетание ХОБЛ и АГ, приводит к снижению приверженности лечению, использованию неоптимальных терапевтических стратегий из-за опасения мифических побочных эффектов терапии. Когда АД неадекватно контролируется у пациентов с ХОБЛ, использование фиксированных комбинаций — правильный терапевтический подход для увеличения приверженности и контроля терапии.
Благодарность
Авторы и редакция благодарят ООО «Гедеон Рихтер Фарма» за предоставление полных текстов иностранных статей, требовавшихся для подготовки данной публикации.








.gif)



