Впервые СПОН был описан у больных с тяжелой хирургической патологией более 30 лет назад [19, 21, 24]. В настоящее время под СПОН понимают недостаточность функций 2-х и более органов или функциональных систем, которые не способны поддерживать постоянство внутренней среды организма у больных, находящихся в критическом состоянии [20, 22, 23].
В последние годы СПОН придается исключительное значение в связи с тем, что он рассматривается как ведущая причина летальных исходов у подавляющего большинства больных, находящихся в критическом состоянии [9]. Известно, что острая патология органов дыхания встречается у 100% больных с тяжелым инсультом, а развитие пневмонии обусловливает летальный исход у 5% больных, переживших период неврологических осложнений [10]. Патология сердечно-сосудистой системы развивается у 2/3 больных, а острый инфаркт миокарда определяет исход инсульта в 4% случаев [6]. Острые изменения слизистой ЖКТ выявляются в 60% случаев при инфарктах и кровоизлияниях в мозг [5]. Острая почечная недостаточность встречается у 46% пациентов и в 4% случаев определяет летальный исход больных инсультом [2]. Тромбоэмболия легочной артерии встречается в 43% случаев и обусловливает летальный исход у каждого пятого больного [1, 7].
Высокотехнологичное реанимационное оборудование позволяет длительное время поддерживать адекватное функционирование большинства систем больного организма, но задача коррекции работы мозга до настоящего момента не решена, что обусловливает необходимость поиска новых методов эффективной нейропротекции при критических состояниях.
Основным направлением терапии ишемического инсульта (ИИ) является терапевтическая реперфузия [3]. Проведение современной реперфузионной терапии (тромболизис) возможно только после нейровизуализационной оценки характера и патогенетического варианта инсульта при исключении геморрагического компонента повреждения. Тромболизис имеет ряд ограничений, связанных с временным фактором. По сравнению с реперфузией нейропротективная терапия не имеет подобных ограничений. Это позволяет применять нейропротекторы уже в первые минуты инсульта [7].
Одним из нейропротективных средств, широко применяющихся в последние годы в клинической практике, является препарат Кортексин®. Отечественная неврология имеет многолетний опыт применения препарата Кортексин® в качестве низкодозированной нейропротекции при лечении неврологических заболеваний [8, 11, 12]. Отдельное место заняли работы по многоплановой оценке эффективности препарата Кортексин® при острых нарушениях мозгового кровообращения (ОНМК) [11, 13, 14].
Было четко выделено влияние препарата Кортексин® на первичную и вторичную нейропротекцию. Первичная нейропротекция направлена на прерывание ранних процессов ишемического каскада, вторичная – отсроченной гибели нейронов, деблокирования NMDA-рецепторов, удаление свободных радикалов, расширение терапевтического «окна». Также выделен 2-уровневый механизм действия препарата Кортексин® – клеточный (воздействие на метаболизм нейронов) и центральный, регуляторный (воздействие на обмен нейромедиаторов – дофамина, серотонина, g-аминомасляной кислоты) [4].
Указанные исследования позволяют принципиально говорить о возможности включения препарата в комплексную терапию больных с инсультом и предполагать его роль в снижении вероятности развития таких фатальных осложнений инсульта, как СПОН.
Целью настоящего исследования явилось изучение влияния препарата Кортексин® на динамику неврологического дефицита и развитие СПОН в остром и раннем восстановительном периодах ИИ.
Материал и методы
В исследование включены пациенты в возрасте от 30 до 80 лет с установленным диагнозом ИИ в каротидной системе. При повторном инсульте, возникшем менее чем через 6 мес. после первого, критерием включения являлось наличие данных, подтверждающих ишемический характер первого инсульта.
Ишемический характер инсульта устанавливался по данным анамнеза заболевания и подтверждался данными КТ-исследования.
Патогенетический вариант развития инсульта определялся в соответствии с критериями TOAST на основании данных анамнеза, особенностей клинической картины заболевания и данных ультразвуковой доплерографии и дуплексного сканирования магистральных артерий головы. Всем больным проводили исследование соматического и неврологического статуса по общепринятым методикам на 1-е сут заболевания и 28-е сут от начала инсульта. Для объективизации тяжести состояния, выраженности очагового неврологического дефицита и оценки динамики клинических показателей использовалась шкала тяжести инсульта Национальных институтов здоровья США (NIHSS). Степень функционального восстановления определялась по модифицированной шкале Rankin, индексу Barthel, индексу мобильности Rivermead. Причем на момент поступления критерием исключения из исследования были оценка по шкале NIHSS более 25 баллов, по шкале Rankin – более 4 баллов.
СПОН оценивался по количеству вовлеченных функциональных систем организма. Патология органов дыхания выявлялась при частоте дыхательных движений менее 5 или более 40 в мин, гиперкапнии (РаСО2 >32 мм рт. ст.), гипоксемии (РаО2 <50 мм рт. ст.) и необходимости проведения искусственной вентиляции легких в течение 1 сут и более; патология сердечно-сосудистой системы – при развитии острого инфаркта миокарда, среднем АД менее 50 мм рт. ст., ЧСС менее 40 или более 100 уд./мин; патология ЖКТ – при острых изменениях слизистой желудка и кишечника, желудочно-кишечном кровотечении, застое желудочного содержимого и динамической кишечной непроходимости; острая почечная недостаточность – при уровне креатинина больше 150 мкмоль/л или при диурезе меньше 500 мл/сут; острая печеночная недостаточность – при уровне общего билирубина больше 4,4 мг/% и при повышении уровней АЛТ и АСТ в 2 раза выше нормы.
При поступлении у всех больных регистрировалась ЭКГ для исключения острой сердечной патологии.
Из исследования исключались больные в возрасте до 30 лет, с транзиторной ишемической атакой (ТИА), наличием признаков кровоизлияния по данным КТ, ИИ в вертебрально-базиллярном бассейне, при условии прохождения более 24 ч с момента развития квалифицируемого события, при наличии у пациента в анамнезе клинически значимого активного заболевания печени, почек, наличии данных за любое онкологическое заболевание, больные с черепно-мозговой травмой, острым инфарктом миокарда давностью менее 30 дней, наличием неконтролируемой артериальной гипертензии (АГ), а также пациенты, имевшие психические, психологические, поведенческие нарушения.
При госпитализации проводилась оценка контролируемых факторов риска развития инсульта: атеросклероз (классификация Grey-Weale); АГ (ВОЗ/МОАГ, 1999); ишемическая болезнь сердца (ИБС) (ВКНЦ АМН СССР, 1984); курение, употребление алкоголя, гиподинамия, стресс (данные анамнеза); избыточный вес (индекс массы тела >25); гиперхолестеринемия (классификация Фридериксона, 1970); предшествующие ТИА, ИИ (данные анамнеза); сахарный диабет (СД) (ВОЗ, 1999).
Методом простой рандомизации все пациенты были разделены на 2 группы. Пациенты 1-й группы (60 человек, средний возраст 60±5 лет) получали базисную терапию и препарат Кортексин® в/м в дозе 10 мг 2 р./сут (утром и днем) в течение 10 дней, с повторным аналогичным курсом через 10 дней после первого. Пациентам 2-й группы (40 человек, средний возраст 57±6 лет) проводили только базисную терапию.
Все больные получали максимально унифицированную базисную терапию в соответствии с рекомендациями Европейской инициативной группы по проблеме инсульта (EUSI, 2003), направленную на нормализацию гомеостаза, центральной и церебральной гемодинамики.
Исследуемые группы были сопоставимы по возрасту, полу, тяжести состояния на момент включения, фоновым заболеваниям и патогенетическому типу инсульта.
Статистическая обработка полученных данных проводилась с помощью пакета программ StatSoft Statistica 8.0.550 Portable (2007/Eng). При парном сравнении групп пациентов применялся непараметрический критерий Mann–Whitney U-test. Данные представлены в виде среднего арифметического и стандартного отклонения (M±6). Для оценки факторов риска инсульта, их вклада в формирование СПОН использовались пошаговый дискриминантный анализ с включением и каноническая корреляция. Для создания математической модели прогнозирования развития СПОН у больных с инсультом применялся дискриминантный анализ с проведением классификации. За статистически значимые значения принимались различия при p<0,05.
Результаты
Влияние препарата Кортексин® на неврологический дефицит и функциональное состояние больных ИИ
В процессе ретроспективного анализа клинических данных на 28-й день лечения установлено, что в группе больных, лечение которых составляла только базисная терапия без применения препарата Кортексин®, СПОН развился у 15 человек из 40 обследованных (38%).
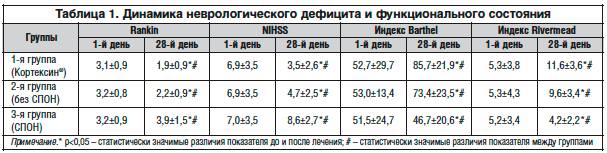
Для оценки неврологического дефицита и его динамики было выделено 3 группы больных: 1-я группа (60 человек) – больные, получавшие базисную терапию и терапию препаратом Кортексин®; 2-я группа (25 человек) – больные, получавшие базисную терапию без применения препарата Кортексин®, течение заболевания которых не осложнилось развитием СПОН; 3-я группа (15 человек) – больные, получавшие базисную терапию без применения препарата Кортексин®, течение заболевания которых осложнилось развитием СПОН (табл. 1).
Степень неврологического дефицита на момент поступления была сопоставимой у всех обследованных, т. к. статистически значимых различий по шкале NIHSS не выявлено (p>0,05). Функциональное состояние на момент поступления по индексу мобильности Rivermead, шкале Rankin и индексу Barthel также не обнаружило статистически значимых различий (p>0,05) между пациентами групп сравнения.
На 28-й день неврологический дефицит и функциональная зависимость были более выраженными по всем шкалам во 2-й и 3-й группах пациентов, не получавших Кортексин® (p<0,05) (табл. 1).
Проведена оценка динамики неврологического дефицита и функциональной зависимости в процессе лечения в 3-х группах больных и установлена отрицательная динамика неврологического дефицита и функционального состояния у больных в группе с развившимся СПОН по всем шкалам (p<0,05).
Выявлена положительная динамика неврологического дефицита и функционального состояния у групп без экстрацеребральных осложнений с максимальным регрессом неврологической симптоматики и функциональной зависимости у больных, получавших базисную терапию в сочетании с препаратом Кортексин® (p<0,05) (табл. 1).
Влияние препарата Кортексин® на формирование СПОН
Проведен анализ факторов риска развития инсульта и их влияния на формирование и развитие СПОН. Для оценки вклада факторов риска в формирование СПОН и определения возможности прогнозирования развития СПОН у больных с инсультом на основании данных факторов риска проведен дискриминантный анализ групп пациентов, получавших только базисную терапию.
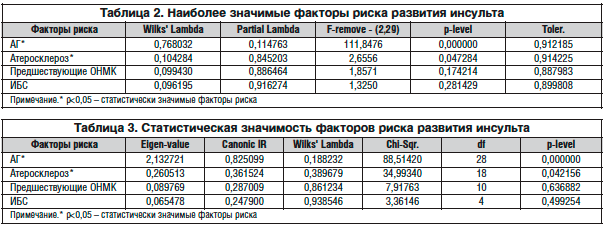
Были отобраны наиболее информативные факторы риска с использованием статистики Уилкса. В результате наиболее значимыми оказались АГ, атеросклероз, предшествующие ТИА и ИИ, ИБС (табл. 2).
При проведении канонического анализа статистически значимыми оказались АГ и атеросклероз (табл. 3).
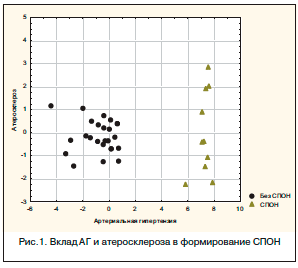
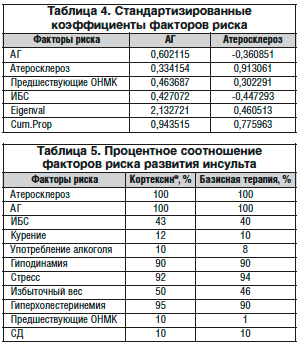
При вычислении стандартизированных переменных для сравнения значимости факторов риска оказалось, что АГ определяет примерно 94% изменчивости, атеросклероз – 78%, что свидетельствует о наибольшем вкладе данных факторов риска в формирование СПОН (табл. 4).
Также видна выраженная дискриминация по оси «Артериальная гипертензия» между группой больных без экстрацеребральных осложнений и группой больных, течение заболевания которых осложнилось развитием СПОН, что говорит об определяющей роли АГ в формировании экстрацеребральных осложнений (рис. 1).
В группе больных, получавших базисную терапию и терапию препаратом Кортексин®, выявлены те же факторы риска развития инсульта, что и у больных, течение заболевания которых осложнилось развитием СПОН (табл. 5). Таким образом, выявлена ассоциация между назначением препарата Кортексин® и отсутствием СПОН.
С целью проверки данной гипотезы проведен дискриминантный анализ с классификацией и расчетом вероятности развития СПОН у больных, получавших Кортексин®.
На первом этапе создания математической модели рассчитаны функции классификации, которые могут непосредственно применяться для распределения объектов исследования на совокупности. В соответствии с полученными результатами группа больных, получавших только базисную терапию, разделена на 3 подгруппы: пациенты, у которых СПОН не развился (25 чел.), пациенты с 2-компонентным (13 чел.) и 3-компонентным (2 чел.) СПОН. Функции классификации вычислены для каждой группы больных. Пациенты отнесены в ту группу, для которой вычислен наибольший классификационный вес (табл. 6).
На втором этапе исследования вычислено расстояние Махаланобиса, которое позволяет определить, является ли данное наблюдение нетипичным по отношению к остальным значениям независимых переменных. Неправильно распределенные пациенты, отмеченные программой, исключены из дальнейшего исследования.
Составлена классификация наблюдений пациентов, получавших только базисную терапию, на основании факторов риска развития инсульта, после чего в программу введены показатели больных, которым проводилась терапия препаратом Кортексин®. При этом 29 из 60 чел. группы больных, получавших Кортексин®, отнесены программой в группу пациентов с 2-компонентным СПОН.
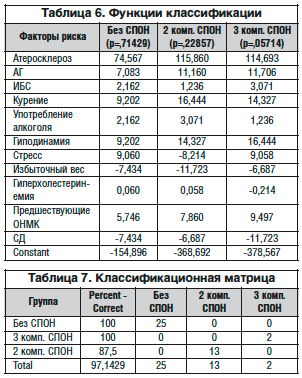
Следовательно, получены данные, свидетельствующие о том, что в группе пациентов, получавших Кортексин®, СПОН должен был развиться у 29 человек, что составляет 48% больных 1-й группы, но данный синдром не развился ни у одного пациента 1-й группы! Опираясь на полученные данные, можно сделать вывод о том, что применение препарата Кортексин® уменьшает вероятность развития СПОН.
На основании классификационной матрицы был определен процент пациентов, верно отнесенных в ту или иную группу, и, следовательно, была установлена точность прогноза развития СПОН у больных ИИ. В целом точность прогноза оказалась равной 97% (табл. 7).
Обсуждение полученных результатов
Данное исследование показало, что курсовая терапия препаратом Кортексин® в дозе 10 мг 2 р./сут (утром и днем) в течение 10 дней, с повторным аналогичным курсом через 10 дней после первого, в остром и восстановительном периоде ИИ приводит к уменьшению выраженности неврологического дефицита и улучшению функционального состояния пациентов с ИИ. Положительная динамика неврологического дефицита и функционального состояния у больных, принимавших Кортексин®, была более выраженной, чем у пациентов, получавших только базисную терапию. Полученные данные соответствуют результатам многоцентрового рандомизированного проспективного двойного слепого плацебо-контролируемого исследования безопасности и эффективности препарата Кортексин® «Эскорт» на момент 2-го визита (21–28 день), которое показало, что применение препарата Кортексин® двумя курсами по 10 дней каждый уже на 28-й день лечения способствует как восстановлению повседневной активности, так и более полному восстановлению когнитивных функций пациента, что подтверждает высокий реабилитационный потенциал препарата [15].
По результатам дискриминантного анализа в группе больных, получавших Кортексин®, имелась вероятность развития СПОН у 48% пациентов, но этого не произошло. Следовательно, применение препарата Кортексин® снижает риск формирования СПОН при ИИ и таким образом, улучшает прогноз заболевания у данной группы пациентов.
Данное утверждение требует продолжения детального изучения механизмов влияния препарата Кортексин® на состояние нервной системы и микроциркуляторного русла у больных ИИ, осложнившимся СПОН. Это научное направление следует считать перспективным, т. к., по данным литературы, Кортексин® повышает эффективность энергетического метаболизма нейронов, улучшает внутриклеточный синтез белков, регулирует процессы метаболизма нейромедиаторов и перекисного окисления липидов в коре головного мозга, зрительном нерве и нейронах сетчатки, стабилизирует мозговой кровоток, препятствует образованию избыточного количества свободных радикалов и ослабляет нейротоксическое действие возбуждающих аминокислот [17, 18].
В ходе исследования препарат Кортексин® подтвердил высокую безопасность применения: за весь период наблюдения у больных, получавших препарат, не зафиксировано его непереносимости, побочных явлений, нежелательных взаимодействий с препаратами базисной терапии, ухудшения лабораторных и электрофизиологических показателей. Следует отметить тот факт, что на фоне выраженного антиастенического действия препарата Кортексин® не отмечено побочных эффектов от его применения в виде усиления раздражительности, эпизодов психомоторного возбуждения, нарушений сна. Комплаентность к проводимой терапии у вошедших в исследование пациентов составила 100%.
Выводы
1. Экстрацеребральные осложнения в виде СПОН определяют исходы тяжелых инсультов, как правило, после 4–10 сут от их начала, профилактике которых следует придавать особое значение.
2. В раннем восстановительном периоде выявлена отрицательная динамика неврологического дефицита и функционального состояния у больных с развившимся СПОН.
3. Положительная динамика неврологического дефицита и улучшение функционального состояния у пациентов, получавших низкодозированную нейропротекцию препаратом Кортексин®, достоверно были более выраженными, чем у пациентов, которым проводилась только базисная терапия, снизился риск формирования СПОН.
4. Полученные результаты позволяют рекомендовать низкодозированную нейропротекцию препаратом Кортексин® в составе комплексной терапии пациентов с ИИ, в т. ч. для профилактики развития СПОН.








.gif)



