
–Т–≤–µ–і–µ–љ–Є–µ
–¶–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –±–Њ–ї–µ–Ј–љ–Є (–¶–Т–С) –Ј–∞–љ–Є–Љ–∞—О—В –≤–∞–ґ–љ–Њ–µ –Љ–µ—Б—В–Њ —Б—А–µ–і–Є –њ—А–Є—З–Є–љ —Б–Љ–µ—А—В–Є, —Б–Њ–Ї—А–∞—Й–µ–љ–Є—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –Є —Б—В–Њ–є–Ї–Њ–є —Г—В—А–∞—В—Л —В—А—Г–і–Њ—Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В–Є. –Т 2016 –≥. –≤ –†–§ —З–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е —Б –≤–њ–µ—А–≤—Л–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ –¶–Т–С –њ—А–Є–±–ї–Є–Ј–Є–ї–Њ—Б—М –Ї 9,5вА∞, —З—В–Њ –љ–∞ 29% –±–Њ–ї—М—И–µ, —З–µ–Љ –≤ 2010 –≥. [1]. –†–Њ—Б—В —Ж–µ—А–µ–±—А–Њ–≤–∞—Б–Ї—Г–ї—П—А–љ–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≤ –Њ–±—Й–µ–є —Б—В—А—Г–Ї—В—Г—А–µ –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В–Є —Б–≤—П–Ј–∞–љ —Б —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ —Б—А–µ–і–љ–µ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –ґ–Є–Ј–љ–Є –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Є–љ—Б—Г–ї—М—В [2]. –Я—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є, —Б–≤—П–Ј–∞–љ–љ—Л—Е —Б –∞—А—В–µ—А–Є–∞–ї—М–љ—Л–Љ —В—А–Њ–Љ–±–Њ–Ј–Њ–Љ, —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ–є –Є–Ј –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ—Л—Е –њ—А–Њ–±–ї–µ–Љ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ—Л. –Ш—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ —Б —Н—В–Њ–є —Ж–µ–ї—М—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–≤ (–Ґ–Р) вАФ –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ –Є –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ–µ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–µ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Њ–є —Б—В—А–∞—В–µ–≥–Є–Є –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є [3вАУ6]. –Ф–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –ї–µ—З–µ–љ–Є—П –¶–Т–С –і–µ–є—Б—В–≤—Г—О—Й–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –і–Њ–њ—Г—Б–Ї–∞—О—В –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –∞—Ж–µ—В–Є–ї—Б–∞–ї–Є—Ж–Є–ї–Њ–≤–Њ–є –Ї–Є—Б–ї–Њ—В—Л (–Р–°–Ъ), –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї–∞, –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї–∞ (–Ъ) –Є —Ж–Є–ї–Њ—Б—В–∞–Ј–Њ–ї–∞ [3, 7вАУ10]. ¬Ђ–Ч–Њ–ї–Њ—В—Л–Љ —Б—В–∞–љ–і–∞—А—В–Њ–Љ¬ї –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–Њ–є —В–µ—А–∞–њ–Є–Є (–Р–Ґ–Ґ) –±—Л–ї–∞ –Є –Њ—Б—В–∞–µ—В—Б—П –Р–°–Ъ, –Њ–њ—Л—В –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Ї–Њ—В–Њ—А–Њ–є –њ—А–µ–≤—Л—И–∞–µ—В 100 –ї–µ—В.
¬Ђ–Ъ–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ¬ї (–∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–µ) –і–Њ–Ј—Л –Р–°–Ъ (75вАУ150 –Љ–≥/—Б—Г—В) –і–Њ—Б—В–∞—В–Њ—З–љ—Л –і–ї—П –њ–Њ–і–∞–≤–ї–µ–љ–Є—П —Б–Є–љ—В–µ–Ј–∞ —В—А–Њ–Љ–±–Њ–Ї—Б–∞–љ–∞ –Р2 (–Є–љ–і—Г–Ї—В–Њ—А–∞ –∞–≥—А–µ–≥–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤) –Є –≤ –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–є —Б—В–µ–њ–µ–љ–Є –Є–љ–≥–Є–±–Є—А—Г—О—В –Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ –њ—А–Њ—Б—В–∞–≥–ї–∞–љ–і–Є–љ–∞ –Х2 вАФ —Ж–Є—В–Њ–њ—А–Њ—В–µ–Ї—В–Њ—А–∞ —Б–ї–Є–Ј–Є—Б—В–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Є –ґ–µ–ї—Г–і–Њ—З–љ–Њ-–Ї–Є—И–µ—З–љ–Њ–≥–Њ —В—А–∞–Ї—В–∞. –Ю–њ—В–Є–Љ–∞–ї—М–љ–∞—П –і–Њ–Ј–∞ –Р–°–Ъ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –±–∞–ї–∞–љ—Б —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є, —З—В–Њ –≤–∞–ґ–љ–Њ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –ї–µ–Ї–∞—А—Б—В–≤–∞ —Б –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є–Љ–Є —Ж–µ–ї—П–Љ–Є. –С–Є–Њ–і–Њ—Б—В—Г–њ–љ–Њ—Б—В—М –≤—Л—И–µ –і–ї—П –ґ–µ–ї—Г–і–Њ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е —Д–Њ—А–Љ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–°–Ъ, –љ–Є–ґ–µ вАФ –і–ї—П –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л—Е. –Р–°–Ъ, –љ–µ –њ–Њ–Ї—А—Л—В–∞—П —А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є, –±—Л—Б—В—А–Њ –≤—Б–∞—Б—Л–≤–∞–µ—В—Б—П –≤ –ґ–µ–ї—Г–і–Ї–µ –Є —В–Њ–љ–Ї–Њ–Љ –Ї–Є—И–µ—З–љ–Є–Ї–µ, –і–Њ—Б—В–Є–≥–∞—П –њ–Є–Ї–Њ–≤–Њ–є –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є–Є –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є —Г–ґ–µ —З–µ—А–µ–Ј 30вАУ40 –Љ–Є–љ. –Ъ–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ —Д–Њ—А–Љ—Л (—Н–љ—В–µ—А–Є–Ї–Є) –≤—Б–∞—Б—Л–≤–∞—О—В—Б—П –Љ–µ–і–ї–µ–љ–љ–µ–µ, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–∞—П –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—П –Р–°–Ъ –≤ –њ–ї–∞–Ј–Љ–µ –Ї—А–Њ–≤–Є –љ–∞—Б—В—Г–њ–∞–µ—В —З–µ—А–µ–Ј 3вАУ4 —З –Є –Љ–Њ–ґ–µ—В –±—Л—В—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ –Ј–∞–Љ–µ–і–ї–µ–љ–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є —Д—Г–љ–Ї—Ж–Є–Є –Ї–Є—И–µ—З–љ–Є–Ї–∞ (—Е—А–Њ–љ–Є—З–µ—Б–Ї–Є–µ –≤–Њ—Б–њ–∞–ї–Є—В–µ–ї—М–љ—Л–µ –њ—А–Њ—Ж–µ—Б—Б—Л, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В –Є –і—А.) [11]. –≠—В–Є –≤–∞–ґ–љ—Л–µ –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–∞ –Њ–њ—А–µ–і–µ–ї—П—О—В –≤—Л–±–Њ—А –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –њ–Њ—Б—В–∞–≤–ї–µ–љ–љ—Л—Е —Ж–µ–ї–µ–є: –≤–Њ –≤—Б–µ—Е –љ–µ–Њ—В–ї–Њ–ґ–љ—Л—Е —Б–Є—В—Г–∞—Ж–Є—П—Е –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ –ґ–µ–ї—Г–і–Њ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ —Д–Њ—А–Љ—Л, –≤ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Є—Е —Ж–µ–ї—П—Е вАФ –ї—О–±—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Р–°–Ъ –≤ –і–Њ–Ј–µ –Є –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–Њ–є —Д–Њ—А–Љ–µ, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –Њ–њ—В–Є–Љ–∞–ї—М–љ—Г—О –Ї–Њ–љ—Ж–µ–љ—В—А–∞—Ж–Є—О –і–µ–є—Б—В–≤—Г—О—Й–µ–≥–Њ –≤–µ—Й–µ—Б—В–≤–∞ –≤ –Ї—А–Њ–≤–Є.
–Т –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ—А–Є–љ—Ж–Є–њ—Л –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Є –ї–µ—З–µ–љ–Є—П —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –Љ–µ–љ—П—О—В—Б—П –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б –і–≤—Г–Љ—П —А–∞–Ј–љ–Њ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–Љ–Є —В–µ–љ–і–µ–љ—Ж–Є—П–Љ–Є: –∞–≥—А–µ—Б—Б–Є–≤–љ—Л–Љ –ї–µ—З–µ–љ–Є–µ–Љ –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ —А–Є—Б–Ї–Њ–Љ –Є –Ї—А–∞–є–љ–µ –Њ—Б—В–Њ—А–Њ–ґ–љ—Л–Љ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–Њ–Љ –≤ –њ—А–Њ—Ж–µ—Б—Б—Л —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є –њ—А–Є –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ–Њ–Љ —В–µ—З–µ–љ–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –≤–≤–Є–і—Г –Њ–њ–∞—Б–љ–Њ—Б—В–Є –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ—Л—Е –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є (–Т–І–Ъ) —Г –±–Њ–ї—М–љ—Л—Е —Б —Е—А–Њ–љ–Є—З–µ—Б–Ї–Њ–є –¶–Т–С. –Я–µ—А–µ—Б–Љ–∞—В—А–Є–≤–∞—О—В—Б—П –њ–Њ–і—Е–Њ–і—Л –Ї –≤–µ–і–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е —Б —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–Љ–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–Љ–Є –∞—В–∞–Ї–∞–Љ–Є (–Ґ–Ш–Р) –Є –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ (–Ш–Ш). –Т —Ж–µ–ї–Њ–Љ –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–∞—П —Б—В—А–∞—В–µ–≥–Є—П –≤—Б–µ –і–∞–ї—М—И–µ —Г—Е–Њ–і–Є—В –Њ—В –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –њ–Њ–і—Е–Њ–і–∞ ¬Ђ–Р–°–Ъ –≤—Б–µ–Љ –і–ї—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є¬ї –≤ —Б—В–Њ—А–Њ–љ—Г –њ–µ—А—Б–Њ–љ–Є—Д–Є–Ї–∞—Ж–Є–Є —А–µ—И–µ–љ–Є–є –≤ —И–Є—А–Њ–Ї–Њ–Љ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В ¬Ђ–ї—Г—З—И–µ —Б–Њ–≤—Б–µ–Љ –љ–µ –ї–µ—З–Є—В—М¬ї –і–Њ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Ґ–Р, –і–µ–є—Б—В–≤—Г—О—Й–Є—Е –љ–∞ —А–∞–Ј–љ—Л–µ —А–µ—Ж–µ–њ—В–Њ—А—Л —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є –∞–љ—В–Є–Ї–Њ–∞–≥—Г–ї—П–љ—В–Њ–≤. –Я—А–Є–љ—Ж–Є–њ–Є–∞–ї—М–љ–Њ —А–∞–Ј–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –Ї –≤–µ–і–µ–љ–Є—О –±–Њ–ї—М–љ—Л—Е –Њ—Б–Њ–±–µ–љ–љ–Њ –і–µ–Љ–Њ–љ—Б—В—А–∞—В–Є–≤–љ—Л –≤ —А–∞–Љ–Ї–∞—Е –њ–µ—А–≤–Є—З–љ–Њ–є, –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є–љ—Б—Г–ї—М—В–∞.
–Р–°–Ъ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є–љ—Б—Г–ї—М—В–∞
–Я—А–Є–љ—П—В–Њ–µ –≤ —А–Њ—Б—Б–Є–є—Б–Ї–Є—Е —А—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞—Е –њ–Њ–љ—П—В–Є–µ –њ–µ—А–≤–Є—З–љ–Њ–є –Є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Є–љ—Б—Г–ї—М—В–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В Primary Prevention –Є Secondary Prevention –≤ –Ј–∞—А—Г–±–µ–ґ–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е [3вАУ6]. –Ю–і–љ–∞–Ї–Њ –∞–љ–∞–ї–Є–Ј —Н—В–Є—Е –і–µ—Д–Є–љ–Є—Ж–Є–є –≤ –Ї–Њ–љ—В–µ–Ї—Б—В–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е –њ—Г–±–ї–Є–Ї–∞—Ж–Є–є –њ–Њ–Ї–∞–Ј—Л–≤–∞–µ—В, —З—В–Њ Primary Prevention –њ–Њ —Б–Љ—Л—Б–ї—Г –±–ї–Є–ґ–µ –Ї –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—О –њ–µ—А–≤–Њ–≥–Њ —Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —Б–Њ–±—Л—В–Є—П (–°–°, vascular events), –∞ Secondary Prevention вАФ –Ї –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—О –њ–Њ–≤—В–Њ—А–љ—Л—Е –°–° [12, 13]. –Ю–±–Њ–±—Й–µ–љ–Є–µ –°–° (–Є–љ—Б—Г–ї—М—В, –Ґ–Ш–Р, –Є–љ—Д–∞—А–Ї—В –Љ–Є–Њ–Ї–∞—А–і–∞, –Њ—Б—В—А—Л–є –Ї–Њ—А–Њ–љ–∞—А–љ—Л–є —Б–Є–љ–і—А–Њ–Љ, —В—А–Њ–Љ–±–Њ–Ј—Л –Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–Є –ї—О–±–Њ–є –і—А—Г–≥–Њ–є –ї–Њ–Ї–∞–ї–Є–Ј–∞—Ж–Є–Є, —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є—П –Љ–Є–Њ–Ї–∞—А–і–∞, –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –Є –і—А.) –Њ—В—А–∞–ґ–∞–µ—В –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ —Б—В—А–µ–Љ–ї–µ–љ–Є–µ –≤—А–∞—З–µ–є –≤–Є–і–µ—В—М –≤—Б–µ –њ—А–Њ–±–ї–µ–Љ—Л —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є –њ–∞—В–Њ–ї–Њ–≥–Є–Є –≤ –Ї–Њ–Љ–њ–ї–µ–Ї—Б–µ –Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –≤—Б–µ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –ї–µ—З–µ–±–љ—Л–µ —Б—В—А–∞—В–µ–≥–Є–Є –і–ї—П –Є—Е —А–µ—И–µ–љ–Є—П.
–Э–∞ –њ–µ—А–≤—Л–є –≤–Ј–≥–ї—П–і —Н—В–Є –ї–Є–љ–≥–≤–Є—Б—В–Є—З–µ—Б–Ї–Є–µ —В–Њ–љ–Ї–Њ—Б—В–Є –љ–µ –Є–Љ–µ—О—В –Њ—В–љ–Њ—И–µ–љ–Є—П –Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ. –Ю–і–љ–∞–Ї–Њ –љ–µ–Ї–Њ—В–Њ—А—Л–µ —Г—В–Њ—З–љ–µ–љ–Є—П –Љ–Њ–≥—Г—В –Њ–Ї–∞–Ј–∞—В—М —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–µ—И–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –њ—А–Є–љ–Є–Љ–∞–µ—В –≤—А–∞—З. Primary Prevention вАФ —Н—В–Њ –љ–µ —Б–Њ–≤—Б–µ–Љ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ (–Ї–∞–Ї –Ї–Њ–Љ–њ–ї–µ–Ї—Б –Љ–µ—А —Б–Њ—Ж–Є–∞–ї—М–љ–Њ–≥–Њ, —Н–Ї–Њ–љ–Њ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л—Е –љ–∞ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П), –∞ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –Њ–±—А–∞–Ј–∞ –ґ–Є–Ј–љ–Є –Є –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і—Г–њ—А–µ–і–Є—В—М –њ–µ—А–≤–Њ–µ –°–° —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П–Љ–Є —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–є —Б–Є—Б—В–µ–Љ—Л. Secondary Prevention вАФ —Б–Њ–≤¬≠—Б–µ–Љ –љ–µ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞, –∞ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–∞—П –њ—А–Њ–≥—А–∞–Љ–Љ–∞ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Њ–є –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М—О –њ–Њ–≤—В–Њ—А–љ—Л—Е —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є.
–Ш—Б–њ–Њ–ї—М–Ј—Г—П —Б–ї–Њ–ґ–Є–≤—И–Є–µ—Б—П –њ–Њ–љ—П—В–Є—П –Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–Є—П, –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ —Г—В–Њ—З–љ–Є—В—М –Љ–µ—Б—В–Њ –Р–°–Ъ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є–љ—Б—Г–ї—М—В–∞. –Ш–Љ–µ–љ–љ–Њ –Ј–і–µ—Б—М –Љ–∞—П—В–љ–Є–Ї –њ–Њ–Ї–∞–Ј–∞–љ–Є–є –Ї–∞—З–љ—Г–ї—Б—П –Њ—В –њ—А–∞–Ї—В–Є–Ї–Є —И–Є—А–Њ–Ї–Њ–≥–Њ –±–µ–Ј—А–µ—Ж–µ–њ—В—Г—А–љ–Њ–≥–Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–°–Ъ ¬Ђ–њ–Њ –≤–Њ–Ј—А–∞—Б—В—Г¬ї –і–Њ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ—Л—Е –Є –љ–µ –≤—Б–µ–≥–і–∞ –Њ–њ—А–∞–≤–і–∞–љ–љ—Л—Е –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є –Р–Ґ–Ґ –і–∞–ґ–µ —В–Њ–≥–і–∞, –Ї–Њ–≥–і–∞ —В–∞–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ. –Р–°–Ъ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –±–Њ–ї–µ–µ 30 –ї–µ—В, –Є –њ–µ—А–≤—Л–µ –Ї—А—Г–њ–љ—Л–µ —А–∞–љ–і–Њ–Љ–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (–†–Ъ–Ш) –і–µ–Љ–Њ–љ—Б—В—А–Є—А–Њ–≤–∞–ї–Є —Е–Њ—А–Њ—И–Є–є –њ—А–µ–≤–µ–љ—В–Є–≤–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –≤ –≤–Є–і–µ —Б–љ–Є–ґ–µ–љ–Є—П –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ (–Ю–†) –°–° –і–Њ 27% (—В–∞–±–ї. 1).
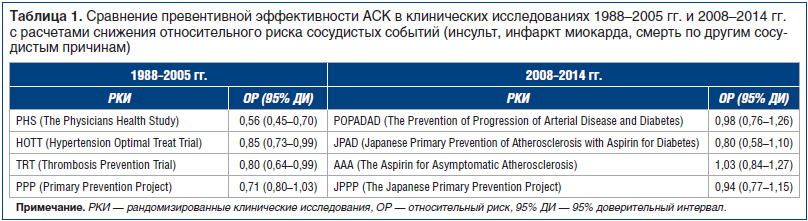
–Ю–і–љ–∞–Ї–Њ —З–µ—А–µ–Ј 20 –ї–µ—В —Б—Е–Њ–і–љ—Л–µ –њ–Њ –і–Є–Ј–∞–є–љ—Г –†–Ъ–Ш (The Japanese Primary Prevention Project вАФ JPPP, The Aspirinfor Asymptomatic Atherosclerosistrial вАФ –Р–Р–Р –Є –і—А.) –њ–Њ–Ї–∞–Ј–∞–ї–Є –љ–µ —В–∞–Ї–Є–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л: —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–°–Ъ –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Њ–є (—Б–љ–Є–ґ–µ–љ–Є–µ –Ю–† –љ–∞ 6% –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є JPPP –Є –њ–Њ–ї–љ–Њ–µ –Њ—В—Б—Г—В—Б—В–≤–Є–µ —А–∞–Ј–ї–Є—З–Є–є –≤ –≥—А—Г–њ–њ–∞—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Р–°–Ъ, –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –Р–Р–Р) [12вАУ15]. –Т —Б—А–µ–і–љ–µ–Љ –≤ 4 –†–Ъ–Ш (POPADAD, JPAD, AAA, JPPP) —Б–љ–Є–ґ–µ–љ–Є–µ –Ю–† –і–Њ—Б—В–Є–≥–∞–ї–Њ –≤—Б–µ–≥–Њ 7%. –°—Г–±–∞–љ–∞–ї–Є–Ј —Б—В–∞—А—И–µ–є –≤–Њ–Ј—А–∞—Б—В–љ–Њ–є –≥—А—Г–њ–њ—Л (—Б—В–∞—А—И–µ 70 –ї–µ—В) –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є JPPP –Њ–±–љ–∞—А—Г–ґ–Є–ї –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ –≤–µ—А–Њ—П—В–љ–Њ—Б—В–Є –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ—Л—Е –Є –≥–∞—Б—В—А–Њ–Є–љ—В–µ—Б—В–Є–љ–∞–ї—М–љ—Л—Е –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Р–°–Ъ [14]. –Я–Њ—Б–ї–µ–і–љ–Є–µ –†–Ъ–Ш, —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–Њ—В–Њ—А—Л—Е –±—Л–ї–Є –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ—Л –≤ 2018 –≥. (ARRIVE, ASCEND), –њ–Њ–і—В–≤–µ—А–і–Є–ї–Є —В–µ–љ–і–µ–љ—Ж–Є—О –Ї —Б–љ–Є–ґ–µ–љ–Є—О —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–°–Ъ –≤ –њ—А–Њ–≥—А–∞–Љ–Љ–∞—Е –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–≤–Њ–≥–Њ –°–° [16, 17]. –Я–Њ—В—А–µ–±–Њ–≤–∞–ї—Б—П –љ–Њ–≤—Л–є –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј (13 –†–Ъ–Ш, n=164 225, —Б—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В вАФ 62 –≥–Њ–і–∞), –Ї–Њ—В–Њ—А—Л–є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–Є–ї –њ–Њ—И–∞—В–љ—Г–≤—И—Г—О—Б—П —А–µ–њ—Г—В–∞—Ж–Є—О –Р–°–Ъ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ (57,1 –°–° –≤ –≥—А—Г–њ–њ–µ –Р–°–Ъ –њ—А–Њ—В–Є–≤ 61,4 –љ–∞ 10 000 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –≥—А—Г–њ–њ–µ –њ–ї–∞—Ж–µ–±–Њ) —Б –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–Љ–Є –Њ–≥–Њ–≤–Њ—А–Ї–∞–Љ–Є –њ–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є (–≤–Њ–Ј—А–∞—Б—В, —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В –Є –і—А.) [18]. –≠—В–Њ—В –∞–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞–ї, —З—В–Њ –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Њ–і–љ–Њ–≥–Њ –њ–µ—А–≤–Њ–≥–Њ –°–° –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –њ—А–Њ–≤–µ—Б—В–Є –ї–µ—З–µ–љ–Є–µ 265 –±–Њ–ї—М–љ—Л—Е, –∞ –і–Њ —А–∞–Ј–≤–Є—В–Є—П –Њ–і–љ–Њ–≥–Њ –±–Њ–ї—М—И–Њ–≥–Њ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П вАФ 210. –Т —Н—В–Њ–Љ –≤—Б—П —Б—Г—Й–љ–Њ—Б—В—М –њ—А–Њ–±–ї–µ–Љ—Л –≤ –µ–µ –љ–Њ–≤–Њ–є –Є–љ—В–µ—А–њ—А–µ—В–∞—Ж–Є–Є: –Р–°–Ъ –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–Њ –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є —А–∞–±–Њ—В–∞–µ—В, –љ–Њ –≤ –њ—А–Њ—Ж–µ—Б—Б–µ –ї–µ—З–µ–љ–Є—П –і–Њ—Б—В–Є—З—М –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П –Љ–Њ–ґ–љ–Њ –±—Л—Б—В—А–µ–µ, —З–µ–Љ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –Є–љ—Б—Г–ї—М—В–∞ –Є–ї–Є –Є–љ—Д–∞—А–Ї—В–∞. –≠—В–Њ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л—Е –і–Њ–Ј –Р–°–Ъ, –Ї–Њ—В–Њ—А—Л–µ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞—О—В –і–Њ—Б—В–∞—В–Њ—З–љ—Л–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–є —Н—Д—Д–µ–Ї—В –Є –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Є –Є—Б–Ї–ї—О—З–∞—О—В –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П. –Т –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ —Н—В–Њ 50вАУ75 –Љ–≥. –Э–∞–Ј–љ–∞—З–Є—В—М 50 –Є–ї–Є 75 –Љ–≥ вАФ —А–µ—И–µ–љ–Є–µ –≤—А–∞—З–∞, –Ї–Њ—В–Њ—А–Њ–µ –Ј–∞–≤–Є—Б–Є—В –Њ—В –Љ–∞—Б—Б—Л —В–µ–ї–∞ –њ–∞—Ж–Є–µ–љ—В–∞ –Є –Њ—Ж–µ–љ–Ї–Є —Д–∞–Ї—В–Њ—А–Њ–≤ —А–Є—Б–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Т—Л–±–Њ—А –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Д–Њ—А–Љ —Б —В–∞–Ї–Њ–є –і–Њ–Ј–Є—А–Њ–≤–Ї–Њ–є –Њ–≥—А–∞–љ–Є—З–µ–љ. –Э–∞–Є–±–Њ–ї–µ–µ –і–Њ—Б—В—Г–њ–µ–љ –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л–є –°–∞–љ–Њ–≤–∞—Б–Ї (–і–Њ–Ј–Є—А–Њ–≤–Ї–Є 50, 75, 100 –Љ–≥) вАФ –њ—А–µ–њ–∞—А–∞—В –Р–°–Ъ, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ї—А—Л—В–∞ –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–Њ–є –Њ–±–Њ–ї–Њ—З–Ї–Њ–є.
–°–љ–Є–ґ–µ–љ–Є–µ –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–≥–Њ –њ–Њ—В–µ–љ—Ж–Є–∞–ї–∞ –Р–°–Ъ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –њ–∞—А–∞–і–Њ–Ї—Б–∞–ї—М–љ—Л–Љ –љ–∞ —Д–Њ–љ–µ —И–Є—А–Њ–Ї–Њ–≥–Њ –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –њ—А–µ–њ–∞—А–∞—В–∞ —Б –љ–µ–Є–Ј–Љ–µ–љ–љ–Њ–є —Е–Є–Љ–Є—З–µ—Б–Ї–Њ–є —Б—В—А—Г–Ї—В—Г—А–Њ–є –њ—А–Њ—Б—В–Њ–є –Љ–Њ–ї–µ–Ї—Г–ї—Л –Р–°–Ъ. –Я–∞—А–∞–і–Њ–Ї—Б –Њ–±—К—П—Б–љ—П–µ—В—Б—П –њ—А–Њ—Б—В–Њ: –≤ ¬Ђ–њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ—Д–Њ–љ–Є–Є¬ї –Р–°–Ъ —Г—В—А–∞—В–Є–ї–∞ –њ–∞—А—В–Є—О –њ–µ—А–≤–Њ–є —Б–Ї—А–Є–њ–Ї–Є. –Ф—А—Г–≥–Є–µ –Є–љ—Б—В—А—Г–Љ–µ–љ—В—Л (—Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ –∞–љ—В–Є–≥–Є–њ–µ—А—В–µ–љ–Ј–Є–≤–љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –Є —Б—В–∞—В–Є–љ—Л) –Ј–∞–љ—П–ї–Є —Б–≤–Њ–Є –Љ–µ—Б—В–∞ –≤ –∞–љ—Б–∞–Љ–±–ї–µ –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Б—А–µ–і—Б—В–≤. –Я—А–µ–≤–µ–љ—В–Є–≤–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Р–°–Ъ –Њ—Б—В–∞–µ—В—Б—П –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є–Љ, –љ–Њ –Љ–Њ–ґ–µ—В –±—Л—В—М —А–µ–∞–ї–Є–Ј–Њ–≤–∞–љ —В–Њ–ї—М–Ї–Њ –≤ —Г—Б–ї–Њ–≤–Є—П—Е —Б—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є–Є –Є –њ–µ—А—Б–Њ–љ–Є—Д–Є–Ї–∞—Ж–Є–Є —А–Є—Б–Ї–∞.
–Т –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –і–ї—П —Н—В–Њ–є —Ж–µ–ї–Є –њ—А–Є–љ—П—В–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –§—А–∞–Љ–Є–љ–≥–µ–Љ—Б–Ї—Г—О —И–Ї–∞–ї—Г (Framingham Risk Score), EURO SCORE –Є–ї–Є —И–Ї–∞–ї—Г –†–µ–є–љ–Њ–ї—М–і—Б–∞ (Reynolds Risk Score). –≠—В–Є —И–Ї–∞–ї—Л –њ–Њ—Б—В—А–Њ–µ–љ—Л –љ–∞ —Д–∞–Ї—В–Њ—А–∞—Е —А–Є—Б–Ї–∞, –≤–Ї–ї–∞–і –Ї–Њ—В–Њ—А—Л—Е –≤ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Г—О –Ј–∞–±–Њ–ї–µ–≤–∞–µ–Љ–Њ—Б—В—М –љ–∞–Є–±–Њ–ї–µ–µ –Ј–љ–∞—З–Є–Љ: –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–µ –і–∞–≤–ї–µ–љ–Є–µ (–Р–Ф), —Г—А–Њ–≤–µ–љ—М —Е–Њ–ї–µ—Б—В–µ—А–Є–љ–∞, –њ–Њ–ї, –Ї—Г—А–µ–љ–Є–µ –Є –≤–Њ–Ј—А–∞—Б—В –Є –і—А. [13, 19, 20]. –Т—Л—Б–Њ–Ї–Є–є 10-–ї–µ—В–љ–Є–є —А–Є—Б–Ї (7,5вАУ10%) —Б–Љ–µ—А—В–Є –Њ—В —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –њ—А–Є—З–Є–љ (EURO SCORE) —Б—З–Є—В–∞–µ—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ—Л–Љ –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Ґ–Р. –Ю—Б–љ–Њ–≤–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ–Ї –њ–Њ–і–Њ–±–љ–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –Ј–∞–Ї–ї—О—З–∞–µ—В—Б—П –≤ —В–Њ–Љ, —З—В–Њ –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л–µ —А–Є—Б–Ї–Є, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –њ—А–Є –љ–∞–±–ї—О–і–µ–љ–Є–Є –Ј–∞ –ґ–Є—В–µ–ї—П–Љ–Є –∞–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–Њ–≥–Њ –≥–Њ—А–Њ–і–Ї–∞ –§—А–∞–Љ–Є–љ–≥–µ–Љ –≤ —Б–µ—А–µ–і–Є–љ–µ –њ—А–Њ—И–ї–Њ–≥–Њ –≤–µ–Ї–∞, –љ–µ –Љ–Њ–≥—Г—В –≤ –њ–Њ–ї–љ–Њ–є –Љ–µ—А–µ –±—Л—В—М –њ–µ—А–µ–љ–µ—Б–µ–љ—Л –љ–∞ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–≥–Њ –ґ–Є—В–µ–ї—П –Ь–Њ—Б–Ї–≤—Л (–Є–ї–Є –і—А—Г–≥–Њ–≥–Њ —А–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –≥–Њ—А–Њ–і–∞). –Ь–љ–Њ–ґ–µ—Б—В–≤–Њ –≥–µ–љ–µ—В–Є—З–µ—Б–Ї–Є—Е, —Б–Њ—Ж–Є–∞–ї—М–љ—Л—Е, –Ї—Г–ї—М—В—Г—А–љ—Л—Е –Є –і—А—Г–≥–Є—Е –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В–µ–є –Њ–Ї–∞–Ј—Л–≤–∞—О—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–µ –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–µ–∞–ї–Є–Ј–∞—Ж–Є—О —А–Є—Б–Ї–∞. –Э–Є–Ј–Ї–Є–є —А–Є—Б–Ї –љ–µ –≥–∞—А–∞–љ—В–Є—А—Г–µ—В –Ј–і–Њ—А–Њ–≤—М—П, –∞ –≤—Л—Б–Њ–Ї–Є–є –љ–µ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ –њ—А–Є–≤–Њ–і–Є—В –Ї –Є–љ—Б—Г–ї—М—В—Г. –Ю–Ї–Њ–ї–Њ 20% –Є–љ—Б—Г–ї—М—В–Њ–≤ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П —Г –±–µ—Б—Б–Є–Љ–њ—В–Њ–Љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ, –∞ 1/3 –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ –Є –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Є–Љ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В—Л–Љ —А–Є—Б–Ї–Њ–Љ –≤ —В–µ—З–µ–љ–Є–µ –ґ–Є–Ј–љ–Є –љ–µ –њ–µ—А–µ–љ–Њ—Б–Є—В –љ–Є–Ї–∞–Ї–Є—Е –°–° [13]. –°–≤—П–Ј—М –°–° —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ —В–Њ–ґ–µ –љ–µ —В–∞–Ї –Њ—З–µ–≤–Є–і–љ–∞ –Є —Б–Њ–≤–µ—А—И–µ–љ–љ–Њ —В–Њ—З–љ–Њ –љ–µ —П–≤–ї—П–µ—В—Б—П –ї–Є–љ–µ–є–љ–Њ–є. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –њ–µ—А–≤–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —Б–Љ–µ—Й–∞–µ—В—Б—П –±–ї–Є–ґ–µ –Ї 50 –≥–Њ–і–∞–Љ, –∞ –њ–Њ—Б–ї–µ 70 –ї–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Є–љ—Б—Г–ї—М—В–∞ –Є –і—А—Г–≥–Є—Е –°–° –њ–Њ—Б—В–µ–њ–µ–љ–љ–Њ —Б–љ–Є–ґ–∞–µ—В—Б—П –Є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –Њ—З–µ–љ—М –љ–Є–Ј–Ї–Њ–є —Г –Њ—З–µ–љ—М –њ–Њ–ґ–Є–ї—Л—Е (–њ–Њ—Б–ї–µ 80 –ї–µ—В) –њ—А–Є –Њ—З–µ–≤–Є–і–љ–Њ–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–Є —А–Є—Б–Ї–∞ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є [12, 13, 18]. –Т –Є—В–Њ–≥–µ –Њ—Ж–µ–љ–Ї–∞ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ –њ–Њ—Б—А–µ–і—Б—В–≤–Њ–Љ –Њ–±—Й–µ–њ—А–Є–љ—П—В—Л—Е –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л—Е —И–Ї–∞–ї –≤—Б–µ–≥–і–∞ –±—Г–і–µ—В —Г—Б–ї–Њ–≤–љ–Њ–є, –Њ—А–Є–µ–љ—В–Є—А–Њ–≤–Њ—З–љ–Њ–є, –љ–µ –Є–Љ–µ—О—Й–µ–є –љ–Є—З–µ–≥–Њ –Њ–±—Й–µ–≥–Њ —Б –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ—Л–Љ –њ—А–Њ–≥–љ–Њ–Ј–Њ–Љ. –Х—Б–ї–Є –Њ—Б–љ–Њ–≤–љ–Њ–є —Ж–µ–ї—М—О –љ–∞–Ј–љ–∞—З–µ–љ–Є—П –Р–°–Ъ —П–≤–ї—П–µ—В—Б—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞, —В–Њ —Б–Њ—Б—В–Њ—П–љ–Є–µ –Ї—А—Г–њ–љ—Л—Е –∞—А—В–µ—А–Є–є вАФ —Н—В–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞—П –Є–љ—Д–Њ—А–Љ–∞—Ж–Є—П, –Ї–Њ—В–Њ—А–∞—П –Њ–њ—А–µ–і–µ–ї—П–µ—В –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –љ–∞–Ј–љ–∞—З–µ–љ–Є—О –Р–°–Ъ.
–£–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–є —Б–Ї—А–Є–љ–Є–љ–≥ (–£–Ч–Ш), –љ–∞–њ—А–∞–≤–ї–µ–љ–љ—Л–є –љ–∞ –≤—Л—П–≤–ї–µ–љ–Є–µ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е —Б—В–µ–љ–Њ–Ј–Њ–≤ —Б–Њ–љ–љ—Л—Е –∞—А—В–µ—А–Є–є, –љ–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ –≤ —А—Г—В–Є–љ–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є –њ—А–∞–Ї—В–Є–Ї–µ [7, 8, 13]. –≠—В–Њ —Б–≤—П–Ј–∞–љ–Њ —Б –љ–Є–Ј–Ї–Њ–є —З–∞—Б—В–Њ—В–Њ–є –≤—Л—П–≤–ї–µ–љ–Є—П –Ї—А–Є—В–Є—З–µ—Б–Ї–Є—Е —Б—В–µ–љ–Њ–Ј–Њ–≤, —В—А–µ–±—Г—О—Й–Є—Е –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤–∞. –Э–Њ –µ—Б–ї–Є –њ–Њ—Б–Љ–Њ—В—А–µ—В—М –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б –і—А—Г–≥–Њ–є —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П, —В–Њ —Ж–µ–љ–љ–Њ—Б—В—М –£–Ч–Ш –≤ –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–є –Љ–µ–і–Є—Ж–Є–љ–µ —В—А—Г–і–љ–Њ –њ–µ—А–µ¬≠–Њ—Ж–µ–љ–Є—В—М. ¬Ђ–Ф–Њ–Ї–∞–Ј–∞–љ–љ—Л–є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј¬ї –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Б—В–µ–њ–µ–љ–Є —Б—В–µ–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –∞—А—В–µ—А–Є–Є –Ї—А–∞—В–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ–Ј–∞ [15, 20]. –Э–µ —В–Њ–ї—М–Ї–Њ —Б—В–µ–њ–µ–љ—М —Б—Г–ґ–µ–љ–Є—П –∞—А—В–µ—А–Є–Є, –љ–Њ –Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–Є –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –±–ї—П—И–µ–Ї (–Р–С) вАФ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ, —Д–Њ—А–Љ–∞, —Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ–Ї—А—Л—И–Ї–Є –Њ–Ї–∞–Ј—Л–≤–∞—О—В –≤–ї–Є—П–љ–Є–µ –љ–∞ —А–µ—И–µ–љ–Є–µ –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Ґ–Р. –Я—А–Њ—Б—В–Њ—В–∞, –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М, –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ–Њ—Б—В—М –Є –≤—Л—Б–Њ–Ї–∞—П —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М –і–µ–ї–∞—О—В –£–Ч–Ш –љ–µ–Ј–∞–Љ–µ–љ–Є–Љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ —Б–Ї—А–Є–љ–Є–љ–≥–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є. –¶–µ–љ–љ–Њ—Б—В—М –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —Б –њ–Њ–Љ–Њ—Й—М—О —Н—В–Њ–≥–Њ –Љ–µ—В–Њ–і–∞, –љ–∞–Љ–љ–Њ–≥–Њ –њ—А–µ–≤—Л—И–∞–µ—В –Ј–∞—В—А–∞—В—Л, –∞ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є—П –≤—Л–≥–ї—П–і—П—В –≤—Б–µ –±–Њ–ї–µ–µ –∞—А—Е–∞–Є—З–љ–Њ –≤ —Г—Б–ї–Њ–≤–Є—П—Е —Б—В—А–µ–Љ–Є—В–µ–ї—М–љ–Њ–≥–Њ —А–∞–Ј–≤–Є—В–Є—П –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Є—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є. –£–ґ–µ —Б–µ–≥–Њ–і–љ—П –Њ—З–µ–≤–Є–і–љ–Њ, —З—В–Њ —З–µ—А–µ–Ј –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –ї–µ—В –њ–∞—Ж–Є–µ–љ—В—Л —Б–Љ–Њ–≥—Г—В –њ–Њ–Ї–∞–Ј—Л–≤–∞—В—М –≤—А–∞—З—Г –Є–Ј–Њ–±—А–∞–ґ–µ–љ–Є—П —Б–≤–Њ–Є—Е —Б–Њ—Б—Г–і–Њ–≤, –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ —Б –њ–Њ–Љ–Њ—Й—М—О —Б–Љ–∞—А—В—Д–Њ–љ–∞, –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –±—Г–і—Г—В –Њ–ґ–Є–і–∞—В—М –Њ—З–µ—А–µ–і–љ–Њ–≥–Њ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞ –†–Ъ–Ш.
–Ю—Ж–µ–љ–Ї–∞ –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–≥–Њ —А–Є—Б–Ї–∞ –∞—А—В–µ—А–Є–∞–ї—М–љ–Њ–≥–Њ —В—А–Њ–Љ–±–Њ–Ј–∞ —В—А–µ–±—Г–µ—В –Є –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ —Б–Ї—А–Є–љ–Є–љ–≥–∞. –Ш–љ—В–µ–≥—А–∞–ї—М–љ—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –≥–µ–Љ–Њ–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є (–≤—А–µ–Љ—П —Б–≤–µ—А—В—Л–≤–∞–љ–Є—П –Ї—А–Њ–≤–Є, –∞–Ї—В–Є–≤–Є—А–Њ–≤–∞–љ–љ–Њ–µ —З–∞—Б—В–Є—З–љ–Њ–µ —В—А–Њ–Љ–±–Њ–њ–ї–∞—Б—В–Є–љ–Њ–≤–Њ–µ –≤—А–µ–Љ—П, –Љ–µ–ґ–і—Г–љ–∞—А–Њ–і–љ–Њ–µ –љ–Њ—А–Љ–∞–ї–Є–Ј–Њ–≤–∞–љ–љ–Њ–µ –Њ—В–љ–Њ—И–µ–љ–Є–µ), –≥–Њ–Љ–Њ—Ж–Є—Б—В–µ–Є–љ, –°-—А–µ–∞–Ї—В–Є–≤–љ—Л–є –±–µ–ї–Њ–Ї вАФ –і–Њ—Б—В—Г–њ–љ—Л–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л–µ —В–µ—Б—В—Л, –Ї–Њ—В–Њ—А—Л–µ –њ–Њ–Љ–Њ–≥—Г—В –≤—А–∞—З—Г –њ—А–Є–љ—П—В—М –Њ–±–Њ—Б–љ–Њ–≤–∞–љ–љ–Њ–µ —А–µ—И–µ–љ–Є–µ –Њ –љ–∞–Ј–љ–∞—З–µ–љ–Є–Є –Ґ–Р –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–≤–Њ–≥–Њ –°–°. –Я–µ—А—Б–Њ–љ–Є—Д–Є–Ї–∞—Ж–Є—П, –Њ—Б–љ–Њ–≤–∞–љ–љ–∞—П –љ–∞ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е, –Є—Б–Ї–ї—О—З–∞–µ—В –њ–Њ–њ—Г–ї—П—Ж–Є–Њ–љ–љ—Л–є –њ–Њ–і—Е–Њ–і –Ї –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О, –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ґ–Р –Ї–∞—В–µ–≥–Њ—А–Є—П–Љ –±–Њ–ї—М–љ—Л—Е, —Г –Ї–Њ—В–Њ—А—Л—Е —А–Є—Б–Ї —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ —П–≤–љ–Њ –њ—А–µ–≤—Л—И–∞–µ—В —А–Є—Б–Ї –Ї—А–Њ–≤–Њ¬≠—В–µ—З–µ–љ–Є–є.
–Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –љ–Њ–≤—Л–µ –і–∞–љ–љ—Л–µ –Њ –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–°–Ъ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є–љ—Б—Г–ї—М—В–∞, –њ–Њ–Ї–∞–Ј–∞–љ–Є—П –Ї –њ—А–Є–Љ–µ–љ–µ–љ–Є—О –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–°–Ъ –Њ—Б—В–∞—О—В—Б—П –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —И–Є—А–Њ–Ї–Є–Љ–Є. –Ъ—А–Њ–Љ–µ –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –њ–Њ —И–Ї–∞–ї–µ EURO SCORE –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї—Г—О —В–µ—А–∞–њ–Є—О –і–Њ–ї–ґ–љ—Л –њ–Њ–ї—Г—З–∞—В—М –≤—Б–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ, –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В —Б—В–µ–њ–µ–љ–Є —Б—В–µ–љ–Њ–Ј–Є—А–Њ–≤–∞–љ–Є—П –∞—А—В–µ—А–Є–є, –µ—Б–ї–Є –Њ–±—Й–∞—П –њ–ї–Њ—Й–∞–і—М –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ—В–Є—З–µ—Б–Ї–Є—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Ј–љ–∞—З–Є—В–µ–ї—М–љ–∞, –∞ —Б—В—А—Г–Ї—В—Г—А–∞ –Р–С –≥–µ—В–µ—А–Њ–≥–µ–љ–љ–∞ –Є –љ–µ—Б—В–∞–±–Є–ї—М–љ–∞ [15]. –Э–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ –Њ—В –љ–∞–ї–Є—З–Є—П –Є–ї–Є –Њ—В—Б—Г—В—Б—В–≤–Є—П —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤ —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Њ—З–µ—В–∞–љ–Є–µ –і–Њ–Ї–∞–Ј–∞–љ–љ–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞ –Є –≥–Є–њ–µ—А–Ї–Њ–∞–≥—Г–ї—П—Ж–Є–Є, –њ—А–Є—Б—Г—В—Б—В–≤–Є–µ –ї–∞–±–Њ—А–∞—В–Њ—А–љ—Л—Е –Љ–∞—А–Ї–µ—А–Њ–≤ –≤–Њ—Б–њ–∞–ї–µ–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ –≤—Л—Б–Њ–Ї–Њ–Љ —А–Є—Б–Ї–µ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –Є –Њ–њ—А–∞–≤–і—Л–≤–∞—О—В –љ–∞–Ј–љ–∞—З–µ–љ–Є–µ –Ґ–Р. –Я—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –њ–µ—А–≤–Њ–≥–Њ CC вАФ –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–∞—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є—З–µ—Б–Ї–∞—П —Б—В—А–∞—В–µ–≥–Є—П, –њ–Њ—В–µ–љ—Ж–Є–∞–ї –Ї–Њ—В–Њ—А–Њ–є –љ–µ –Є—Б—З–µ—А–њ–∞–љ –і–∞–ґ–µ –љ–∞–њ–Њ–ї–Њ–≤–Є–љ—Г. –Т –Љ–Є—А–Њ–≤–Њ–Љ –Љ–∞—Б—И—В–∞–±–µ —Ж–µ–ї–µ–љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–µ –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–µ –ї–µ—З–µ–љ–Є–µ —Б–њ–Њ—Б–Њ–±–љ–Њ –њ—А–µ–і–Њ—В–≤—А–∞—В–Є—В—М –Њ–Ї–Њ–ї–Њ 1 –Љ–ї–љ —Б–Њ—Б—Г–і–Є—Б—В—Л—Е –Ї–∞—В–∞—Б—В—А–Њ—Д –≤ –≥–Њ–і [21].
–Ш–љ—Б—Г–ї—М—В –Є —В—А–∞–љ–Ј–Є—В–Њ—А–љ—Л–µ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є–µ –∞—В–∞–Ї–Є
–Т –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ш–Ш —В–Њ–ї—М–Ї–Њ –і–≤–∞ –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –њ—А–Є–љ–Њ—Б—П—В –Њ—З–µ–≤–Є–і–љ—Г—О –њ–Њ–ї—М–Ј—Г –±–Њ–ї—М–љ—Л–Љ –Є –Є–Љ–µ—О—В –і–Њ—Б—В–∞—В–Њ—З–љ—Г—О –і–Њ–Ї–∞–Ј–∞—В–µ–ї—М–љ—Г—О –±–∞–Ј—Г вАФ –≤–љ—Г—В—А–Є–≤–µ–љ–љ–∞—П —В—А–Њ–Љ–±–Њ–ї–Є—В–Є—З–µ—Б–Ї–∞—П —В–µ—А–∞–њ–Є—П (–Ґ–Ы–Ґ) —А–µ–Ї–Њ–Љ–±–Є–љ–∞–љ—В–љ—Л–Љ–Є —В–Ї–∞–љ–µ–≤—Л–Љ–Є –∞–Ї—В–Є–≤–∞—В–Њ—А–∞–Љ–Є –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ –Є –Р–°–Ъ (–Ї–ї–∞—Б—Б I, —Г—А–Њ–≤–µ–љ—М –Р). –Ґ–Ы–Ґ –≤ –њ—А–µ–і–µ–ї–∞—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–Ї–љ–∞ (–Љ–µ–љ–µ–µ 4,5 —З –Њ—В –њ–Њ—П–≤–ї–µ–љ–Є—П –њ–µ—А–≤—Л—Е —Б–Є–Љ–њ—В–Њ–Љ–Њ–≤) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —З–Є—Б–ї–Њ –±–Њ–ї—М–љ—Л—Е —Б —Е–Њ—А–Њ—И–Є–Љ –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є–µ–Љ —Д—Г–љ–Ї—Ж–Є–є. –Ю–і–љ–∞–Ї–Њ —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В —А–Є—Б–Ї –≤–љ—Г—В—А–Є—З–µ—А–µ–њ–љ—Л—Е –Ї—А–Њ–≤–Њ–Є–Ј–ї–Є—П–љ–Є–є –Є —Б–Њ–њ—А–Њ–≤–Њ–ґ–і–∞–µ—В—Б—П –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ —Г–≤–µ–ї–Є—З–µ–љ–Є–µ–Љ –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є –≤ –±–ї–Є–ґ–∞–є—И–Є–µ –і–љ–Є –њ–Њ—Б–ї–µ –≤–≤–µ–і–µ–љ–Є—П –∞–Ї—В–Є–≤–∞—В–Њ—А–∞ –њ–ї–∞–Ј–Љ–Є–љ–Њ–≥–µ–љ–∞ [3, 10, 15]. –Р–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ–∞—П —В–µ—А–∞–њ–Є—П –Р–°–Ъ –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ш–Ш –њ—А–Є–≤–Њ–і–Є—В –Ї —Г–Љ–µ–љ—М—И–µ–љ–Є—О –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ш–Ш –љ–∞ 13% –Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ–Љ—Г —Б–љ–Є–ґ–µ–љ–Є—О –ї–µ—В–∞–ї—М–љ–Њ—Б—В–Є [5, 6, 15, 22, 23]. –Т—Л–≤–Њ–і—Л –Њ–± —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Р–Ґ–Ґ –Њ—Б–љ–Њ–≤–∞–љ—Л –љ–∞ –†–Ъ–Ш, –≤ –Ї–Њ—В–Њ—А—Л—Е –±–Њ–ї—М–љ—Л–µ –њ–Њ–ї—Г—З–∞–ї–Є –ї–µ—З–µ–љ–Є–µ –і–∞–ї–µ–Ї–Њ –Ј–∞ –њ—А–µ–і–µ–ї–∞–Љ–Є —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–Ї–љ–∞ вАФ 48 —З [5, 6]. –Р–°–Ъ –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–Њ –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є –±–Њ–ї—М–љ—Л–Љ –Ш–Ш –љ–∞ –і–Њ–≥–Њ—Б–њ–Є—В–∞–ї—М–љ–Њ–Љ —Н—В–∞–њ–µ –Є –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л —А–∞–Ј–≤–Є—В–Є—П –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–є —Б–Є–Љ–њ—В–Њ–Љ–∞—В–Є–Ї–Є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –љ–µ —Г–њ–Њ–Љ–Є–љ–∞–µ—В—Б—П: –Ґ–Ы–Ґ –њ—А–Є–Ј–љ–∞–љ–∞ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л–Љ –Љ–µ—В–Њ–і–Њ–Љ –ї–µ—З–µ–љ–Є—П –Ш–Ш, –∞ —А–Њ–ї—М –Р–°–Ъ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В—Б—П —А–∞–љ–љ–µ–є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Њ–є –°–° [3, 24]. –Ф–µ–є—Б—В–≤—Г—О—Й–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ—А–µ–і–ї–∞–≥–∞—О—В –љ–∞—З–Є–љ–∞—В—М –ї–µ—З–µ–љ–Є–µ –Р–°–Ъ —З–µ—А–µ–Ј 24 —З –њ–Њ—Б–ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ґ–Ы–Ґ [3, 10, 24]. –Т –љ–µ–Ї–Њ—В–Њ—А–Њ–є —Б—В–µ–њ–µ–љ–Є –Њ—В–Ї–∞–Ј –Њ—В –Р–°–Ъ –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –±–Њ–ї–µ–Ј–љ–Є –±—Л–ї —Б–≤—П–Ј–∞–љ —Б –љ–∞–і–µ–ґ–і–∞–Љ–Є –љ–∞ –±—Л—Б—В—А–Њ–µ —А–µ—И–µ–љ–Є–µ –њ—А–Њ–±–ї–µ–Љ—Л –ї–µ—З–µ–љ–Є—П –Є–љ—Б—Г–ї—М—В–∞ –њ—Г—В–µ–Љ —А–∞—Б—И–Є—А–µ–љ–Є—П –њ—А–∞–Ї—В–Є–Ї–Є –Ґ–Ы–Ґ. –Ю–і–љ–∞–Ї–Њ —Н—В–Њ–≥–Њ –љ–µ —Б–ї—Г—З–Є–ї–Њ—Б—М, –Є –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б –і–Њ—Б—В—Г–њ–µ–љ –њ—А–Є–Љ–µ—А–љ–Њ 5% –±–Њ–ї—М–љ—Л—Е, –њ–Њ—Б—В—А–∞–і–∞–≤—И–Є—Е –Њ—В –Є–љ—Б—Г–ї—М—В–∞. –≠—В–Њ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ –Ј–∞—Б—В–∞–≤–ї—П–µ—В –≤–љ–Њ–≤—М –≤–Њ–Ј–≤—А–∞—Й–∞—В—М—Б—П –Ї –њ–Њ–Є—Б–Ї—Г –∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л—Е –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П, —Б—А–µ–і–Є –Ї–Њ—В–Њ—А—Л—Е –Р–Ґ–Ґ –њ—А–µ–і—Б—В–∞–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–Њ–є.
–°–≤–µ–і–µ–љ–Є—П –Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Р–°–Ъ –≤ –њ–µ—А–≤—Л–µ —З–∞—Б—Л –Є–љ—Б—Г–ї—М—В–∞ –Ї—А–∞–є–љ–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л, –љ–Њ –Њ–і–љ–Њ –Є–Ј –њ–Њ—Б–ї–µ–і–љ–Є—Е –њ—А—П–Љ—Л—Е —Б—А–∞–≤–љ–µ–љ–Є–є –Ґ–Ы–Ґ –Є –Р–°–Ъ –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ш–Ш —Б –љ–µ–≥—А—Г–±—Л–Љ –љ–µ–≤—А–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–Љ –і–µ—Д–Є—Ж–Є—В–Њ–Љ (—Б—А–µ–і–љ–µ–µ –≤—А–µ–Љ—П –љ–∞—З–∞–ї–∞ –ї–µ—З–µ–љ–Є—П 2,7 —З, —В—П–ґ–µ—Б—В—М –њ–Њ —И–Ї–∞–ї–µ NIHSS-2 (National Institutes of Health Stroke Scale вАФ –®–Ї–∞–ї–∞ —В—П–ґ–µ—Б—В–Є –Є–љ—Б—Г–ї—М—В–∞ –Э–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –Є–љ—Б—В–Є—В—Г—В–Њ–≤ –Ј–і–Њ—А–Њ–≤—М—П C–®–Р) –њ–Њ–Ї–∞–Ј–∞–ї–Њ –њ—А–µ–Є–Љ—Г—Й–µ—Б—В–≤–∞ –Р–°–Ъ –њ–Њ –Є—Б—Е–Њ–і–∞–Љ –Є –≤–Њ—Б—Б—В–∞–љ–Њ–≤–ї–µ–љ–Є—О —Д—Г–љ–Ї—Ж–Є–є –њ—А–Є –ї—Г—З—И–µ–Љ –њ—А–Њ—Д–Є–ї–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є [25]. –≠—В–Њ –≤—Б–µ–ї—П–µ—В –љ–∞–і–µ–ґ–і—Г –љ–∞ –ї—Г—З—И–Є–µ –Є—Б—Е–Њ–і—Л –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –Њ—Б—В–∞–≤—И–Є—Е—Б—П –Ј–∞ –њ—А–µ–і–µ–ї–∞–Љ–Є –≤—Л—Б–Њ–Ї–Є—Е —В–µ—Е–љ–Њ–ї–Њ–≥–Є–є 95% –±–Њ–ї—М–љ—Л—Е –Є —Б—В–∞–≤–Є—В —Б–ї–µ–і—Г—О—Й–Є–є –≤–Њ–њ—А–Њ—Б: –љ–µ –Њ–Ї–∞–ґ–µ—В –ї–Є –њ—А–µ–і–≤–∞—А–Є—В–µ–ї—М–љ—Л–є –њ—А–Є–µ–Љ –∞–љ—В–Є–∞–≥—А–µ–≥–∞–љ—В–Њ–≤ –љ–µ–≥–∞—В–Є–≤–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ –Ґ–Ы–Ґ (–µ—Б–ї–Є —Н—В–Њ—В –Љ–µ—В–Њ–і –ї–µ—З–µ–љ–Є—П –±—Г–і–µ—В –і–Њ—Б—В—Г–њ–µ–љ –±–Њ–ї—М–љ–Њ–Љ—Г)? –†–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є AHA/ASA (AHA вАФ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –њ–Њ –њ—А–Њ–±–ї–µ–Љ–∞–Љ —Б–µ—А–і—Ж–∞, ASA вАФ –Р–Љ–µ—А–Є–Ї–∞–љ—Б–Ї–∞—П –∞—Б—Б–Њ—Ж–Є–∞—Ж–Є—П –Є–љ—Б—Г–ї—М—В–∞) 2018 –≥. –њ–Њ–Ј–≤–Њ–ї—П—О—В –Є–≥–љ–Њ—А–Є—А–Њ–≤–∞—В—М —Н—В–Њ –Њ–±—Б—В–Њ—П—В–µ–ї—М—Б—В–≤–Њ –Ї–∞–Ї –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞—О—Й–µ–µ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б–∞ [24]. –≠—В–Њ –Њ–±—К—П—Б–љ–Є–Љ–Њ —Б —В–Њ—З–Ї–Є –Ј—А–µ–љ–Є—П –њ–∞—В–Њ—Д–Є–Ј–Є–Њ–ї–Њ–≥–Є–Є: –∞–Ї—В–Є–≤–љ–Њ—Б—В—М —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –љ–µ –≤–ї–Є—П–µ—В –љ–∞ —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј, –љ–Њ –њ—А–Њ–і—Г–Ї—В—Л —Д–Є–±—А–Є–љ–Њ–ї–Є–Ј–∞ –њ–Њ–і–∞–≤–ї—П—О—В –∞–≥—А–µ–≥–∞—Ж–Є—О —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤, –Є –Р–Ґ–Ґ –ї–Є—И—М —Г—Б–Є–ї–Є–≤–∞–µ—В —Н—В–Њ—В –њ—А–Њ—Ж–µ—Б—Б, –Њ—Б—В–∞–љ–∞–≤–ї–Є–≤–∞—П –і–∞–ї—М–љ–µ–є—И–µ–µ —В—А–Њ–Љ–±–Њ–Њ–±—А–∞–Ј–Њ–≤–∞–љ–Є–µ. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е —Б–ї—Г—З–∞—П—Е –±–Њ–ї—М–љ—Л–µ, –њ–Њ–ї—Г—З–∞—О—Й–Є–µ –і–≤–Њ–є–љ—Г—О –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Г—О —В–µ—А–∞–њ–Є—О (–Ф–Р–Ґ) –Р–°–Ъ + –Ъ –њ–Њ—Б–ї–µ –Њ—Б—В—А–Њ–≥–Њ –Ї–Њ—А–Њ–љ–∞—А–љ–Њ–≥–Њ —Б–Є–љ–і—А–Њ–Љ–∞ (–Ю–Ъ–°), –њ–µ—А–µ–љ–Њ—Б—П—В –Є–љ—Б—Г–ї—М—В –Є –њ–Њ–і–≤–µ—А–≥–∞—О—В—Б—П –Ґ–Ы–Ґ –њ–Њ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П–Љ. G. Tsivgoulis et al. (2018) –њ—А–Є–≤–Њ–і—П—В —А–µ–Ј—Г–ї—М—В–∞—В—Л –љ–∞–±–ї—О–і–µ–љ–Є—П 1043 –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –Ї–Њ—В–Њ—А—Л–Љ –Ґ–Ы–Ґ –≤—Л–њ–Њ–ї–љ–µ–љ–∞ –љ–∞ —Д–Њ–љ–µ –Ф–Р–Ґ. –Ф–Њ—Б—В–Њ–≤–µ—А–љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –ї–µ—З–µ–љ–Є—П –Љ–µ–ґ–і—Г –≥—А—Г–њ–њ–∞–Љ–Є –±–Њ–ї—М–љ—Л—Е, –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Є –љ–µ –њ–Њ–ї—Г—З–∞–≤—И–Є—Е –Ф–Р–Ґ, –љ–µ –Њ–±–љ–∞—А—Г–ґ–µ–љ–Њ [26]. –Ф—А—Г–≥–Њ–µ –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–µ –і–ї—П –Р–°–Ъ —Б–≤—П–Ј–∞–љ–Њ —Б –Њ–њ–∞—Б–µ–љ–Є–µ–Љ —Б–Њ–≤–µ—А—И–Є—В—М –Њ—И–Є–±–Ї—Г –Є –љ–∞–Ј–љ–∞—З–Є—В—М –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–є –њ—А–µ–њ–∞—А–∞—В –±–Њ–ї—М–љ–Њ–Љ—Г —Б –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–Љ –Є–љ—Б—Г–ї—М—В–Њ–Љ (–њ—А–Є –љ–µ–≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є–Є –Љ–Њ–Ј–≥–∞). –°–њ–µ—Ж–Є–∞–ї—М–љ—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є –≤ —Н—В–Њ–Љ –љ–∞–њ—А–∞–≤–ї–µ–љ–Є–Є –љ–µ –±—Л–ї–Њ, –∞ –≤ –Ї—А—Г–њ–љ—Л—Е –†–Ъ–Ш —В–∞–Ї–Є–µ –њ–Њ–і–≥—А—Г–њ–њ—Л –±—Л–ї–Є –Њ–≥—А–∞–љ–Є—З–µ–љ–љ—Л–Љ–Є [5, 6]. –Ю—В–і–µ–ї—М–љ—Л–µ –њ—Г–±–ї–Є–Ї–∞—Ж–Є–Є –њ–Њ–Ј–≤–Њ–ї—П—О—В –њ—А–µ–і–њ–Њ–ї–Њ–ґ–Є—В—М, —З—В–Њ –њ—А–Є–µ–Љ –Р–°–Ъ –љ–µ –њ—А–Є–≤–Њ–і–Є—В –Ї —В—П–ґ–µ–ї—Л–Љ –њ–Њ—Б–ї–µ–і—Б—В–≤–Є—П–Љ –і–ї—П –±–Њ–ї—М–љ—Л—Е, –µ—Б–ї–Є –Є–љ—Б—Г–ї—М—В –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є. –Р. Berkowitz et al. (2014) –њ—А–Є–≤–Њ–і—П—В —Б–≤–µ–і–µ–љ–Є—П –Њ —А–µ–Ј—Г–ї—М—В–∞—В–∞—Е –ї–µ—З–µ–љ–Є—П –Р–°–Ъ 3000 –±–Њ–ї—М–љ—Л—Е, 34% –Є–Ј –Ї–Њ—В–Њ—А—Л—Е –њ–µ—А–µ–љ–µ—Б–ї–Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В. –У–Њ—Б–њ–Є—В–∞–ї—М–љ–∞—П –ї–µ—В–∞–ї—М–љ–Њ—Б—В—М –≤ –≥—А—Г–њ–њ–µ —Б –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Є–Љ–Є –Є–љ—Б—Г–ї—М—В–∞–Љ–Є –Њ–Ї–∞–Ј–∞–ї–∞—Б—М –љ–Є–ґ–µ, –Ї–∞–Ї –Є —З–Є—Б–ї–Њ –≤—Б–µ—Е –°–° [27]. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ –†–Ъ–Ш –і–Њ–Ј–∞ –Р–°–Ъ, –Ї–Њ—В–Њ—А—Г—О –њ–Њ–ї—Г—З–∞–ї–Є –±–Њ–ї—М–љ—Л–µ –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Є–љ—Б—Г–ї—М—В–∞, –±—Л–ї–∞ –љ–µ –Љ–µ–љ—М—И–µ 100 –Љ–≥/—Б—Г—В –Є –љ–µ –±–Њ–ї—М—И–µ 325 –Љ–≥/—Б—Г—В. –Ф–∞–ї—М–љ–µ–є—И–µ–µ –њ–Њ–≤—Л—И–µ–љ–Є–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–°–Ъ –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ –ї–Є–±–Њ –Ј–∞ —Б—З–µ—В –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П (—В–∞–Ї–Є—Е –і–Њ—Б—В—Г–њ–љ—Л—Е —Д–Њ—А–Љ –љ–µ—В), –ї–Є–±–Њ –њ—Г—В–µ–Љ –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є —Б –і—А—Г–≥–Є–Љ–Є –Ґ–Р, –і–µ–є—Б—В–≤—Г—О—Й–Є–Љ–Є –љ–∞ –і—А—Г–≥–Є–µ —А–µ—Ж–µ–њ—В–Њ—А—Л —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤. –Ъ–Њ–Љ–±–Є–љ–∞—Ж–Є—П –Р–°–Ъ + –Є–љ–≥–Є–±–Є—В–Њ—А P2Y12 —Е–Њ—А–Њ—И–Њ –Ј–∞—А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–ї–∞ —Б–µ–±—П –≤ –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–є –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є, –Ї–Њ–≥–і–∞ –≤ –Ї–∞—З–µ—Б—В–≤–µ –≤—В–Њ—А–Њ–≥–Њ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–∞ –Р–Ґ–Ґ –њ—А–Є –Ю–Ъ–° –Є—Б–њ–Њ–ї—М–Ј—Г—О—В—Б—П —В–Є–Ї–∞–≥—А–µ–ї–Њ—А, –њ—А–∞—Б—Г–≥—А–µ–ї –Є–ї–Є –Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї. –Ф–µ–є—Б—В–≤—Г—О—Й–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–Є –њ–Њ –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –і–Њ–њ—Г—Б–Ї–∞—О—В —В–Њ–ї—М–Ї–Њ –Њ–і–Є–љ –≤–∞—А–Є–∞–љ—В –Ф–Р–Ґ: –Р–°–Ъ + –Ъ. –Ф–µ–є—Б—В–≤–Є–µ –Р–°–Ъ –љ–∞—Б—В—Г–њ–∞–µ—В –±—Л—Б—В—А–Њ, –≤ —В–µ—З–µ–љ–Є–µ 1 —З (–µ—Б–ї–Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П –љ–µ –Ї–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ–∞—П –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ–∞—П —Д–Њ—А–Љ–∞ –њ—А–µ–њ–∞—А–∞—В–∞). –Р–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л–є —Н—Д—Д–µ–Ї—В –Ъ —А–∞–Ј–≤–Є–≤–∞–µ—В—Б—П –Љ–µ–і–ї–µ–љ–љ–Њ (–і–Њ 7 –і–љ–µ–є), –≤ –љ–µ–Њ—В–ї–Њ–ґ–љ—Л—Е —Б–Є—В—Г–∞—Ж–Є—П—Е –љ—Г–ґ–љ—Л –љ–∞–≥—А—Г–Ј–Њ—З–љ—Л–µ –і–Њ–Ј—Л (300вАУ600 –Љ–≥). –Ф–Р–Ґ –Њ–±–µ—Б–њ–µ—З–Є–≤–∞–µ—В –љ–∞–і–µ–ґ–љ–Њ–µ –њ–Њ–і–∞–≤–ї–µ–љ–Є–µ –∞–≥—А–µ–≥–∞—Ж–Є–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤ –Є —Б–љ–Є–ґ–∞–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ґ–Ш–Р –Є –Ш–Ш –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –Р–°–Ъ [4вАУ6, 28, 29]. –Т–І–Ъ вАФ –≥–ї–∞–≤–љ–Њ–µ –њ—А–µ–њ—П—В—Б—В–≤–Є–µ –і–ї—П –±–Њ–ї–µ–µ —А–µ—И–Є—В–µ–ї—М–љ–Њ–є –Р–Ґ–Ґ –≤ –њ–µ—А–≤—Л–µ –і–љ–Є –Ш–Ш. –Т–µ—А–Њ—П—В–љ–Њ—Б—В—М –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–є —В—А–∞–љ—Б—Д–Њ—А–Љ–∞—Ж–Є–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ—З–∞–≥–∞ –Є–ї–Є –Т–І–Ъ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В—Б—П –њ—А–Є –Њ–±—И–Є—А–љ—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П—Е –Љ–Њ–Ј–≥–∞, —Г –њ–Њ–ґ–Є–ї—Л—Е –±–Њ–ї—М–љ—Л—Е —Б –љ–µ–Ї–Њ–љ—В—А–Њ–ї–Є—А—Г–µ–Љ—Л–Љ –Р–Ф, —Г –±–Њ–ї—М–љ—Л—Е —Б –∞–Љ–Є–ї–Њ–Є–і–љ—Л–Љ–Є, –Љ–µ—В–∞–±–Њ–ї–Є—З–µ—Б–Ї–Є–Љ–Є –Є –љ–∞—Б–ї–µ–і—Б—В–≤–µ–љ–љ—Л–Љ–Є –∞–љ–≥–Є–Њ–њ–∞—В–Є—П–Љ–Є, —Б–∞—Е–∞—А–љ—Л–Љ –і–Є–∞–±–µ—В–Њ–Љ. –Ґ–∞–Ї–Є–µ –њ–∞—Ж–Є–µ–љ—В—Л —Б–Њ—Б—В–∞–≤–ї—П—О—В –љ–µ –Љ–µ–љ–µ–µ –њ–Њ–ї–Њ–≤–Є–љ—Л –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –Ш–Ш –Є —В—А–µ–±—Г—О—В –і–µ—В–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Є —А–Є—Б–Ї–∞.
–Ґ–Ш–Р –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є вАФ —Н–Ї–≤–Є–≤–∞–ї–µ–љ—В—Л –Ю–Ъ–° –±–µ–Ј –њ–Њ–і—К–µ–Љ–∞ ST –≤ –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є–Є вАФ –Ї—А–∞—В–Ї–Њ–≤—А–µ–Љ–µ–љ–љ—Л–µ —Н–њ–Є–Ј–Њ–і—Л –љ–∞—А—Г—И–µ–љ–Є—П —Д—Г–љ–Ї—Ж–Є–є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ –±–µ–Ј –њ—А–Є–Ј–љ–∞–Ї–Њ–≤ –Њ—З–∞–≥–Њ–≤—Л—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є. –Ґ–Ш–Р –Є –Ю–Ъ–° —Б–±–ї–Є–ґ–∞–µ—В –љ–µ —В–Њ–ї—М–Ї–Њ –њ–∞—В–Њ–≥–µ–љ–µ–Ј, –љ–Њ –Є —В–∞–Ї—В–Є–Ї–∞ –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П, –љ–∞–њ—А–∞–≤–ї–µ–љ–љ–Њ–≥–Њ –љ–∞ –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –Ш–Ш, –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Ї–Њ—В–Њ—А–Њ–≥–Њ –≤ –±–ї–Є–ґ–∞–є—И–Є–µ –љ–µ–і–µ–ї–Є –Њ—З–µ–љ—М –≤–µ–ї–Є–Ї–∞. –Ф–Р–Ґ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —Б–љ–Є–ґ–∞–µ—В –≤–µ—А–Њ—П—В–љ–Њ—Б—В—М –Ш–Ш –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є–µ–є –Р–°–Ъ –Є –љ–µ–Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —Г–≤–µ–ї–Є—З–Є–≤–∞–µ—В –±–Њ–ї—М—И–Є–µ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є—П, –њ–Њ–і—В–≤–µ—А–ґ–і–∞—П, —З—В–Њ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М –Р–Ґ–Ґ –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –≤ –њ–µ—А–≤—Г—О –Њ—З–µ—А–µ–і—М —Б–≤—П–Ј–∞–љ–∞ —Б –Њ–±—К–µ–Љ–Њ–Љ –Є —Е–∞—А–∞–Ї—В–µ—А–Њ–Љ –Є—И–µ–Љ–Є—З–µ—Б–Ї–Є—Е –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є–є –Љ–Њ–Ј–≥–∞ [26, 27].
–Р–°–Ъ вАФ –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–є –±–µ–Ј–∞–ї—М—В–µ—А–љ–∞—В–Є–≤–љ—Л–є –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –њ—А–µ–њ–∞—А–∞—В, –Ї–Њ—В–Њ—А—Л–є –њ–Њ–Ї–∞–Ј–∞–љ –≤—Б–µ–Љ –±–Њ–ї—М–љ—Л–Љ —Б –Њ—Б—В—А—Л–Љ–Є –љ–∞—А—Г—И–µ–љ–Є—П–Љ–Є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П. –Т –Њ—Б—В—А—Л—Е —Б–Є—В—Г–∞—Ж–Є—П—Е –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ –љ–∞–Ј–љ–∞—З–∞—В—М –ґ–µ–ї—Г–і–Њ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ —Д–Њ—А–Љ—Л –Р–°–Ъ –≤ –і–Њ–Ј–Є—А–Њ–≤–Ї–µ –љ–µ –Љ–µ–љ–µ–µ 150 –Љ–≥. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–°–Ъ –≤ —А–∞–Љ–Ї–∞—Е —В–µ—А–∞–њ–µ–≤—В–Є—З–µ—Б–Ї–Њ–≥–Њ –Њ–Ї–љ–∞ —В—А–µ–±—Г–µ—В –і–∞–ї—М–љ–µ–є—И–µ–≥–Њ –Є–Ј—Г—З–µ–љ–Є—П, –Ї–∞–Ї –Є —Ж–µ–ї–µ—Б–Њ–Њ–±—А–∞–Ј–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —А–∞–Ј–љ—Л—Е –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е —Д–Њ—А–Љ, –≤ —В. —З. –і–ї—П –≤–љ—Г—В—А–Є–≤–µ–љ–љ–Њ–≥–Њ –≤–≤–µ–і–µ–љ–Є—П.
–Я—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є–љ—Б—Г–ї—М—В–Њ–≤
–Т —В–µ—З–µ–љ–Є–µ –≤—Б–µ–≥–Њ –Њ—Б—В—А–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ (–њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ 2 –љ–µ–і.) –Ш–Ш –±–Њ–ї—М–љ—Л–Љ –њ–Њ–Ї–∞–Ј–∞–љ–∞ –Р–°–Ъ —Б —Ж–µ–ї—М—О –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–Њ–≤¬≠—В–Њ—А–љ—Л—Е –Њ—Б—В—А—Л—Е –љ–∞—А—Г—И–µ–љ–Є–є –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П, —В—А–Њ–Љ–±–Њ–Ј–Њ–≤ –Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є–є [3, 5, 6, 10, 24]. –Р–ї—М—В–µ—А–љ–∞—В–Є–≤—Л –њ—А–µ–њ–∞—А–∞—В–∞–Љ –Р–°–Ъ –≤ –њ–µ—А–≤—Л–µ –і–љ–Є –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞ –љ–µ—В. –Ъ–Є—И–µ—З–љ–Њ—А–∞—Б—В–≤–Њ—А–Є–Љ—Л–µ —Д–Њ—А–Љ—Л –Є–Љ–µ—О—В –ї—Г—З—И–Є–є –њ—А–Њ—Д–Є–ї—М –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Є –Љ–Њ–≥—Г—В –±—Л—В—М –љ–∞–Ј–љ–∞—З–µ–љ—Л –і–ї—П —А–∞–љ–љ–µ–є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ –Є –і—А—Г–≥–Є—Е —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є (–°–∞–љ–Њ–≤–∞—Б–Ї 75вАУ100 –Љ–≥ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Љ–∞—Б—Б—Л —В–µ–ї–∞ –±–Њ–ї—М–љ–Њ–≥–Њ). –Я–Њ –Њ–Ї–Њ–љ—З–∞–љ–Є–Є –Њ—Б—В—А–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –≤—Л–±–Њ—А –Р–Ґ–Ґ –Ј–∞–≤–Є—Б–Є—В –Њ—В —Б—В–µ–њ–µ–љ–Є —А–Є—Б–Ї–∞ –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞, –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В–Є –ї–µ—З–µ–љ–Є—П –Є –≤—А–µ–Љ–µ–љ–Є, –Ї–Њ—В–Њ—А–Њ–µ –њ—А–Њ—И–ї–Њ –њ–Њ—Б–ї–µ –Є–љ—Б—Г–ї—М—В–∞. –Т–µ—А–Њ—П—В–љ–Њ—Б—В—М –њ–Њ–≤—В–Њ—А–љ–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ —А–∞—Б–њ—А–µ–і–µ–ї—П–µ—В—Б—П –≤–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ—А–∞–≤–љ–Њ–Љ–µ—А–љ–Њ: –±–Њ–ї–µ–µ –њ–Њ–ї–Њ–≤–Є–љ—Л –≤—Б–µ—Е —Б–ї—Г—З–∞–µ–≤ –њ—А–Є—Е–Њ–і–Є—В—Б—П –љ–∞ –њ–µ—А–≤—Л–є –≥–Њ–і, –∞ –љ–∞–Є–±–Њ–ї–µ–µ –Њ–њ–∞—Б–љ—Л–є –њ–µ—А–Є–Њ–і вАФ –њ–µ—А–≤—Л–µ 3 –Љ–µ—Б. [28]. –Р –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–Њ–≤—В–Њ—А–љ—Л—Е –Є–љ—Б—Г–ї—М—В–Њ–≤ –Р–°–Ъ —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–µ–µ, —З–µ–Љ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ, вАФ —Б–љ–Є–ґ–µ–љ–Є–µ –Ю–† –Ш–Ш –і–Њ—Б—В–Є–≥–∞–µ—В 18вАУ25% –њ—А–Є –і–Њ–ї–≥–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є [4вАУ6, 8]. –Т —А–∞–љ–љ–µ–є –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –њ—А–µ–≤–µ–љ—В–Є–≤–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–°–Ъ –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї (—В–∞–±–ї. 2).
![–Ґ–∞–±–ї–Є—Ж–∞ 2. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–°–Ъ (100вАУ300 –Љ–≥/—Б—Г—В) –≤ —В–µ—З–µ–љ–Є–µ 6 –љ–µ–і. –њ–Њ—Б–ї–µ —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –∞—В–∞–Ї–Є –Є–ї–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ [23] –Ґ–∞–±–ї–Є—Ж–∞ 2. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Р–°–Ъ (100вАУ300 –Љ–≥/—Б—Г—В) –≤ —В–µ—З–µ–љ–Є–µ 6 –љ–µ–і. –њ–Њ—Б–ї–µ —В—А–∞–љ–Ј–Є—В–Њ—А–љ–Њ–є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–є –∞—В–∞–Ї–Є –Є–ї–Є –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ—Б—Г–ї—М—В–∞ [23]](/upload/medialibrary/6cf/22-2.png)
–Ш–Ј–≤–µ—Б—В–љ–Њ, —З—В–Њ –њ—А–Є–Љ–µ—А–љ–Њ —З–µ—А–µ–Ј 6 –љ–µ–і. –њ—А–µ–≤–µ–љ—В–Є–≤–љ—Л–є –њ–Њ—В–µ–љ—Ж–Є–∞–ї –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Р–°–Ъ –њ–Њ –Њ—В–љ–Њ—И–µ–љ–Є—О –Ї –њ–Њ–≤—В–Њ—А–љ–Њ–Љ—Г –Ш–Ш —Б–љ–Є–ґ–∞–µ—В—Б—П –±–Њ–ї–µ–µ —З–µ–Љ –≤ 3 —А–∞–Ј–∞. –Я—А–Є —Н—В–Њ–Љ —Б–њ–Њ—Б–Њ–±–љ–Њ—Б—В—М –Р–°–Ъ –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—В—М –≤—Б–µ —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–µ —Б–Њ–±—Л—В–Є—П,
–≤ —В. —З. —В—А–Њ–Љ–±–Њ–Ј –≥–ї—Г–±–Њ–Ї–Є—Е –≤–µ–љ –љ–Є–ґ–љ–Є—Е –Ї–Њ–љ–µ—З–љ–Њ—Б—В–µ–є, –Њ—Б—В–∞–µ—В—Б—П –≤—Л—Б–Њ–Ї–Њ–є [23]. –Ь–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –Ъ –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –њ–Њ—З—В–Є –љ–µ –Њ—В–ї–Є—З–∞–µ—В—Б—П –Њ—В –Р–°–Ъ (—Б–љ–Є–ґ–µ–љ–Є–µ –Ю–† –≤ —Б—А–∞–≤–љ–µ–љ–Є–Є —Б –Р–°–Ъ –љ–∞ 8,7%), –љ–Њ –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М –Ъ –њ—А–Є –і–ї–Є—В–µ–ї—М–љ–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –ї—Г—З—И–µ [29]. –Ю—Б–љ–Њ–≤–љ–Њ–є –љ–µ–і–Њ—Б—В–∞—В–Њ–Ї –Ъ вАФ –≤—Л—Б–Њ–Ї–∞—П —З–∞—Б—В–Њ—В–∞ —А–µ–Ј–Є—Б—В–µ–љ—В–љ—Л—Е –±–Њ–ї—М–љ—Л—Е (–Њ–Ї–Њ–ї–Њ 20%), —З—В–Њ –і–µ–ї–∞–µ—В –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –љ–µ–љ–∞–і–µ–ґ–љ–Њ–є –Є–ї–Є —В—А–µ–±—Г–µ—В –ї–∞–±–Њ—А–∞—В–Њ—А–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—П (–Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ–Њ–є –∞–Ї—В–Є–≤–љ–Њ—Б—В–Є —В—А–Њ–Љ–±–Њ—Ж–Є—В–Њ–≤). –Ф–Р–Ґ (–Р–°–Ъ + –Ъ) –Ј–∞ –њ—А–µ–і–µ–ї–∞–Љ–Є –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л—Е —Б—А–Њ–Ї–Њ–≤ (30 –і–љ–µ–є) –≤–Њ–Ј–Љ–Њ–ґ–љ–∞ –њ—А–Є –Њ—З–µ–љ—М –≤—Л—Б–Њ–Ї–Њ–Љ —А–Є—Б–Ї–µ –њ–Њ–≤—В–Њ—А–љ—Л—Е –Ґ–Ш–Р. –Р–≥—А–µ—Б—Б–Є–≤–љ—Г—О –Р–Ґ–Ґ –Љ–Њ–ґ–љ–Њ —А–∞—Б—Б–Љ–∞—В—А–Є–≤–∞—В—М –і–ї—П –±–Њ–ї—М–љ—Л—Е –Њ—В–љ–Њ—Б–Є—В–µ–ї—М–љ–Њ –Љ–Њ–ї–Њ–і–Њ–≥–Њ –≤–Њ–Ј—А–∞—Б—В–∞, —Б –љ–Є–Ј–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є –≥—А—Г–±—Л–Љ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–Њ–Љ –∞—А—В–µ—А–Є–є –≥–Њ–ї–Њ–≤–љ–Њ–≥–Њ –Љ–Њ–Ј–≥–∞ [15, 30, 31]. –Э–µ–є—А–Њ–≤–Є–Ј—Г–∞–ї–Є–Ј–∞—Ж–Є—П –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞, –µ—Б–ї–Є –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ—В—Б—П –і–ї–Є—В–µ–ї—М–љ–∞—П –Ф–Р–Ґ. –Я—А–Є–Ј–љ–∞–Ї–Є –≤—Л—А–∞–ґ–µ–љ–љ–Њ–є –∞—В—А–Њ—Д–Є–Є –Љ–Њ–Ј–≥–∞, –ї–µ–є–Ї–Њ—Н–љ—Ж–µ—Д–∞–ї–Њ–њ–∞—В–Є—П, –Љ–љ–Њ–≥–Њ—З–Є—Б–ї–µ–љ–љ—Л–µ –Њ—З–∞–≥–Є –њ–Њ–≤—А–µ–ґ–і–µ–љ–Є—П –Є—И–µ–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –Є –≥–µ–Љ–Њ—А—А–∞–≥–Є—З–µ—Б–Ї–Њ–≥–Њ —Е–∞—А–∞–Ї—В–µ—А–∞, —А–∞—Б—И–Є—А–µ–љ–љ—Л–µ –њ–µ—А–Є–≤–∞—Б–Ї—Г–ї—П—А–љ—Л–µ –њ—А–Њ—Б—В—А–∞–љ—Б—В–≤–∞ —З–∞—Б—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —Ж–µ—А–µ–±—А–∞–ї—М–љ–Њ–є –∞–љ–≥–Є–Њ¬≠–њ–∞—В–Є–Є –Є –њ—А–µ–і—Г–њ—А–µ–ґ–і–∞—О—В –Њ –≤—Л—Б–Њ–Ї–Њ–Љ —А–Є—Б–Ї–µ –Т–І–Ъ. –Т –љ–µ–Ї–Њ—В–Њ—А—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —Б–Є—В—Г–∞—Ж–Є—П—Е (—Б–Њ—Б—В–Њ—П–љ–Є–µ –њ–Њ—Б–ї–µ —А–µ–≤–∞—Б–Ї—Г–ї—П—А–Є–Ј–∞—Ж–Є–Є –Љ–Є–Њ–Ї–∞—А–і–∞ –Є–ї–Є –Ю–Ъ–° —Г –±–Њ–ї—М–љ–Њ–≥–Њ, –њ–µ—А–µ–љ–µ—Б—И–µ–≥–Њ –Ш–Ш) –Ф–Р–Ґ (–Р–°–Ъ + –Ъ) –љ–µ–Њ–±—Е–Њ–і–Є–Љ–∞, –љ–µ—Б–Љ–Њ—В—А—П –љ–∞ –≤—Л—Б–Њ–Ї–Є–є —А–Є—Б–Ї –Т–І–Ъ.
–Т—В–Њ—А—Л–Љ –Ї–Њ–Љ–њ–Њ–љ–µ–љ—В–Њ–Љ –Ф–Р–Ґ –Љ–Њ–ґ–µ—В –±—Л—В—М –Є —В–Є–Ї–∞–≥—А–µ–ї–Њ—А, –µ—Б–ї–Є —Н—В–Њ–≥–Њ —В—А–µ–±—Г—О—В –Ї–∞—А–і–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞–љ–Є—П. –≠—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В—М –Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В—М —В–Є–Ї–∞–≥—А–µ–ї–Њ—А–∞ –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –Є–Ј—Г—З–µ–љ—Л –Љ–∞–ї–Њ. –Э–∞–Є–±–Њ–ї–µ–µ –њ–Њ–ї–љ—Л–µ –і–∞–љ–љ—Л–µ –њ–Њ–ї—Г—З–µ–љ—Л –≤ –†–Ъ–Ш SOCRATES (The Acute Stroke or Transient Ischaemic Attack Treated with Aspirin or Ticagrelor and Patient Outcomes) [32]. –†–µ–Ј—Г–ї—М—В–∞—В—Л —Н—В–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –њ–Њ–Ї–∞–Ј–∞–ї–Є, —З—В–Њ –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ш–Ш —В–Є–Ї–∞–≥—А–µ–ї–Њ—А –±–µ–Ј–Њ–њ–∞—Б–µ–љ –Є —Н—Д—Д–µ–Ї—В–Є–≤–µ–љ. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ –њ—А–Њ—В–Њ–Ї–Њ–ї –†–Ъ–Ш SOCRATES –Є—Б–Ї–ї—О—З–∞–ї –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є. –Ь–Њ–љ–Њ—В–µ—А–∞–њ–Є—П –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї–Њ–Љ –і–ї—П –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є –Ш–Ш –љ–µ –Є—Б–њ–Њ–ї—М–Ј—Г–µ—В—Б—П. –Ъ–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–∞—П —В–µ—А–∞–њ–Є—П –Р–°–Ъ + –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї –љ–µ –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –њ–Њ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Љ–Њ–љ–Њ—В–µ—А–∞–њ–Є—О –Ъ, –љ–Њ –Є–Љ–µ–µ—В —А—П–і –Њ–≥—А–∞–љ–Є—З–µ–љ–Є–є, –Ї –Ї–Њ—В–Њ—А—Л–Љ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї–Њ—А–Њ–љ–∞—А–љ–∞—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ—Б—В—М. –Ъ—А–Њ–Љ–µ —В–Њ–≥–Њ, —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л–µ –і–Њ–Ј—Л –і–Є–њ–Є—А–Є–і–∞–Љ–Њ–ї–∞ (400 –Љ–≥/—Б—Г—В) –і–Њ–≤–Њ–ї—М–љ–Њ —З–∞—Б—В–Њ –≤—Л–Ј—Л–≤–∞—О—В –≥–Њ–ї–Њ–≤–љ—Г—О –±–Њ–ї—М –Є —В–Њ—И–љ–Њ—В—Г, —З—В–Њ –Њ–≥—А–∞–љ–Є—З–Є–≤–∞–µ—В –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В–Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –С–Њ–ї–µ–µ —Г–і–Њ–±–љ—Л–є –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є —Ж–Є–ї–Њ—Б—В–∞–Ј–Њ–ї, –њ–Њ –і–∞–љ–љ—Л–Љ –Љ–µ—В–∞–∞–љ–∞–ї–Є–Ј–∞, –њ—А–µ–≤–Њ—Б—Е–Њ–і–Є—В –≤ –Њ—В–љ–Њ—И–µ–љ–Є–Є –±–µ–Ј–Њ–њ–∞—Б–љ–Њ—Б—В–Є –Ф–Р–Ґ (–Р–°–Ъ + –Ъ) [33]. –¶–Є–ї–Њ—Б—В–∞–Ј–Њ–ї –њ—А–µ–і–њ–Њ—З—В–Є—В–µ–ї—М–љ–µ–µ –і–ї—П –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –ї–∞–Ї—Г–љ–∞—А–љ—Л–є –Ш–Ш –Є–ї–Є –∞—В–µ—А–Њ—В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є–є –Є–љ—Б—Г–ї—М—В –љ–∞ —Д–Њ–љ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–љ–Њ–≥–Њ –∞—В–µ—А–Њ—Б–Ї–ї–µ—А–Њ–Ј–∞.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Р–Ґ–Ґ –≤ —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –њ—А–Є–Љ–µ–љ—П–µ—В—Б—П –і–ї—П –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–≤–Њ–≥–Њ –°–°, –≤ –Њ—Б—В—А–Њ–Љ –њ–µ—А–Є–Њ–і–µ –Ш–Ш –Є –≤ —А–∞–Љ–Ї–∞—Е –≤—В–Њ—А–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–Є. –Ю–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л–µ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –і–∞–љ–љ—Л–µ –Њ –љ–Є–Ј–Ї–Њ–є —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ—Б—В–Є –Р–°–Ъ –≤ –њ–µ—А–≤–Є—З–љ–Њ–є –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–µ –Є–љ—Б—Г–ї—М—В–∞ –љ–µ –Њ—В–Љ–µ–љ—П—О—В –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –Р–Ґ–Ґ —Г –±–Њ–ї—М–љ—Л—Е —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ. –Я—А–µ–њ–∞—А–∞—В—Л –Р–°–Ъ –љ–∞–Є–±–Њ–ї–µ–µ –і–Њ—Б—В—Г–њ–љ—Л –і–ї—П –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–µ–Љ–∞ –≤ —А–∞–Љ–Ї–∞—Е –њ—А–µ–≤–µ–љ—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Ю–љ–Є –і–Њ—Б—В—Г–њ–љ—Л –њ–Њ —Ж–µ–љ–µ, –≤—Л–њ—Г—Б–Ї–∞—О—В—Б—П –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ–Њ–є –њ—А–Њ–Љ—Л—И–ї–µ–љ–љ–Њ—Б—В—М—О –Є –Є–Љ–µ—О—В –і–Њ—Б—В–∞—В–Њ—З–љ–Њ —А–∞–Ј–љ–Њ–Њ–±—А–∞–Ј–љ—Л–µ –і–Њ–Ј–Є—А–Њ–≤–Ї–Є (–њ—А–µ–њ–∞—А–∞—В –°–∞–љ–Њ–≤–∞—Б–Ї 50, 75, 100 –Љ–≥). –°—В—А–∞—В–Є—Д–Є–Ї–∞—Ж–Є—П —Б–µ—А–і–µ—З–љ–Њ-—Б–Њ—Б—Г–і–Є—Б—В–Њ–≥–Њ —А–Є—Б–Ї–∞ вАФ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ–µ —Г—Б–ї–Њ–≤–Є–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ–≥–Њ –Є –Њ–њ—А–∞–≤–і–∞–љ–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –∞–љ—В–Є—В—А–Њ–Љ–±–Њ—Ж–Є—В–∞—А–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤ —Б —Ж–µ–ї—М—О –њ—А–µ–і—Г–њ—А–µ–ґ–і–µ–љ–Є—П –њ–µ—А–≤–Њ–≥–Њ –°–°. –Ф–Р–Ґ (–Р–°–Ъ + –Ъ) —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ —Г–Љ–µ–љ—М—И–∞–µ—В —А–Є—Б–Ї –Ш–Ш —Г –±–Њ–ї—М–љ—Л—Е, –њ–µ—А–µ–љ–µ—Б—И–Є—Е –Ґ–Ш–Р, –Њ–і–љ–∞–Ї–Њ –Њ–њ—В–Є–Љ–∞–ї—М–љ–∞—П –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –∞–≥—А–µ—Б—Б–Є–≤–љ–Њ–є –Р–Ґ–Ґ –≤ –љ–µ–≤—А–Њ–ї–Њ–≥–Є–Є –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В 30 –і–љ–µ–є. –Р–°–Ъ –Ї–∞–Ї —Б—А–µ–і—Б—В–≤–Њ –љ–µ–Њ—В–ї–Њ–ґ–љ–Њ–є –њ–Њ–Љ–Њ—Й–Є –њ—А–Є –Њ—Б—В—А—Л—Е –љ–∞—А—Г—И–µ–љ–Є—П—Е –Љ–Њ–Ј–≥–Њ–≤–Њ–≥–Њ –Ї—А–Њ–≤–Њ–Њ–±—А–∞—Й–µ–љ–Є—П –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ—Л—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є—П—Е –љ–µ —Г–њ–Њ–Љ–Є–љ–∞–µ—В—Б—П, –љ–Њ –µ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Г–ї—Г—З—И–∞–µ—В –Є—Б—Е–Њ–і—Л –Ш–Ш –Є –љ–µ –Њ–Ї–∞–Ј—Л–≤–∞–µ—В —Б—Г—Й–µ—Б—В–≤–µ–љ–љ–Њ–≥–Њ –≤–ї–Є—П–љ–Є—П –љ–∞ —А–µ–Ј—Г–ї—М—В–∞—В—Л —В—А–Њ–Љ–±–Њ–ї–Є–Ј–Є—Б–∞. –†–∞–љ–љ—П—П –≤—В–Њ—А–Є—З–љ–∞—П –њ—А–Њ—Д–Є–ї–∞–Ї—В–Є–Ї–∞ –Є–љ—Б—Г–ї—М—В–∞, —В—А–Њ–Љ–±–Њ—В–Є—З–µ—Б–Ї–Є—Е –Є —В—А–Њ–Љ–±–Њ—Н–Љ–±–Њ–ї–Є—З–µ—Б–Ї–Є—Е –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є–є –њ—А–Њ–≤–Њ–і–Є—В—Б—П –њ—А–µ–њ–∞—А–∞—В–∞–Љ–Є –Р–°–Ъ (–љ–∞–њ—А–Є–Љ–µ—А, –њ—А–µ–њ–∞—А–∞—В–Њ–Љ –°–∞–љ–Њ–≤–∞—Б–Ї). –Т –Њ–њ—А–µ–і–µ–ї–µ–љ–љ—Л—Е —Б–ї—Г—З–∞—П—Е, –љ–∞–њ—А–Є–Љ–µ—А, –њ—А–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –і–ї–Є—В–µ–ї—М–љ–Њ–≥–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —Г –Ї–Њ–Љ–Њ—А–±–Є–і–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤—Л—Б–Њ–Ї–Є–Љ —А–Є—Б–Ї–Њ–Љ –Ї—А–Њ–≤–Њ—В–µ—З–µ–љ–Є–є –Є–ї–Є –њ–ї–Њ—Е–Њ–є –њ–µ—А–µ–љ–Њ—Б–Є–Љ–Њ—Б—В—М—О –Р–°–Ъ, –њ–∞—Ж–Є–µ–љ—В–∞–Љ –Љ–Њ–≥—Г—В –±—Л—В—М –љ–∞–Ј–љ–∞—З–µ–љ—Л –і—А—Г–≥–Є–µ –Ґ–Р (–Ї–ї–Њ–њ–Є–і–Њ–≥—А–µ–ї, —Ж–Є–ї–Њ—Б—В–∞–Ј–Њ–ї, —В–Є–Ї–∞–≥—А–µ–ї–Њ—А).
–Т–µ–і—Г—Й–∞—П –њ–∞—А—В–Є—П –Р–°–Ъ –≤ —Б–Њ–≤—А–µ–Љ–µ–љ–љ–Њ–є —Б–Њ—Б—Г–і–Є—Б—В–Њ–є –љ–µ–≤¬≠—А–Њ–ї–Њ–≥–Є–Є –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л –њ—А–Є–Њ–±—А–µ—В–∞–µ—В –љ–Њ–≤–Њ–µ –Ј–≤—Г—З–∞–љ–Є–µ. –Ь–Њ–љ–Њ—В–Њ–љ–љ—Л–є —А–Є—В–Љ –Љ–∞–ї—Л—Е –і–Њ–Ј —Б–Љ–µ–љ—П–µ—В—Б—П –∞–Ї—Ж–µ–љ—В–∞–Љ–Є, —Б–Є–љ–Ї–Њ–њ–∞–Љ–Є –Є –њ–∞—Г–Ј–∞–Љ–Є, –Ї–Њ—В–Њ—А—Л–µ –Њ–њ—А–µ–і–µ–ї—П—О—В—Б—П –Є–љ–і–Є–≤–Є–і—Г–∞–ї—М–љ–Њ–є –Њ—Ж–µ–љ–Ї–Њ–є —А–Є—Б–Ї–∞ –Є –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–є –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–є —Б–Є—В—Г–∞—Ж–Є–µ–є.












