–Я—А–Њ–і–≤–Є–љ—Г—В—Л–µ —Б—В–∞–і–Є–Є –њ–µ—А–≤–Є—З–љ–Њ–є –Њ—В–Ї—А—Л—В–Њ—Г–≥–Њ–ї—М–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л (–Я–Ю–£–У) –≤—Б–µ –µ—Й–µ –њ—А–µ–≤–∞–ї–Є—А—Г—О—В –Є –њ–Њ-–њ—А–µ–ґ–љ–µ–Љ—Г –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г—О—В—Б—П –≤ 40вАУ80% —Б–ї—Г—З–∞–µ–≤ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≤–њ–µ—А–≤—Л–µ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –і–Є–∞–≥–љ–Њ–Ј–Њ–Љ [1вАУ10]. –Я–Њ –і–∞–љ–љ—Л–Љ –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Ї–ї–Є–љ–Є–Ї–Њ-—Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –Ј–∞ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л, –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –≥–ї–∞—Г–Ї–Њ–Љ–∞ –≤–њ–µ—А–≤—Л–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ—В—Б—П –љ–∞ —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –љ–∞—Е–Њ–і–Є—В—Б—П –≤ –Є–љ—В–µ—А–≤–∞–ї–µ –Њ—В 58 –і–Њ 65 –ї–µ—В, –∞ –Є—Б—Е–Њ–і–љ—Л–є —Г—А–Њ–≤–µ–љ—М –≤–љ—Г—В—А–Є–≥–ї–∞–Ј–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П (–Т–У–Ф) вАУ –≤ ¬Ђ–Ї–Њ—А–Є–і–Њ—А–µ¬ї –Њ—В 25 –і–Њ 30 –Љ–Љ —А—В. —Б—В. [1вАУ10]. –Т—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–µ —А–∞–љ–µ–µ –Љ–Њ–і–µ–ї–Є—А–Њ–≤–∞–љ–Є–µ –њ–Њ–Ј–≤–Њ–ї–Є–ї–Њ —Г—Б—В–∞–љ–Њ–≤–Є—В—М, —З—В–Њ –њ—А–µ–і–њ–Њ–ї–∞–≥–∞–µ–Љ—Л–є –≤–Њ–Ј—А–∞—Б—В –Є —Б—А–Њ–Ї –љ–∞—Б—В—Г–њ–ї–µ–љ–Є—П —Б–ї–µ–њ–Њ—В—Л (–њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б—А–µ–і–љ–µ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П –њ–Њ –і–∞–љ–љ—Л–Љ —Б—В–∞—В–Є—З–µ—Б–Ї–Њ–є –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –њ–µ—А–Є–Љ–µ—В—А–Є–Є >20 –і–С) –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є –љ–∞ –Љ–Њ–Љ–µ–љ—В –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П II —Б—В–∞–і–Є–µ–є –±–Њ–ї–µ–Ј–љ–Є (–Ьe (Q25%; Q75%)) –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П —Б–Њ—Б—В–∞–≤–ї—П—О—В 71 (68,2; 77,5) –≥–Њ–і –Є 3,7 (2,6; 8,6) –≥–Њ–і–∞ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ. –Я—А–Є–љ—П—В–Њ —Б—З–Є—В–∞—В—М, —З—В–Њ –љ–∞—А—Г—И–µ–љ–Є–µ —Д—Г–љ–Ї—Ж–Є–Є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Њ—В–љ–Њ—Б–Є—В—Б—П –Ї –њ—А–µ–і—А–∞—Б–њ–Њ–ї–∞–≥–∞—О—Й–Є–Љ —Д–∞–Ї—В–Њ—А–∞–Љ —А–Є—Б–Ї–∞, –Њ—В–≤–µ—З–∞—О—Й–Є–Љ –Ј–∞ —А–∞–Ј–≤–Є—В–Є–µ –Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л [11, 12]. –Т –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ —Б–ї—Г—З–∞–µ–≤ –њ–Њ–љ–Є–ґ–µ–љ–Є–µ —Г—А–Њ–≤–љ—П –Т–У–Ф —П–≤–ї—П–µ—В—Б—П –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ –љ–µ–Њ—Б–њ–Њ—А–Є–Љ–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–Љ —Б–њ–Њ—Б–Њ–±–Њ–Љ –Ј–∞–Љ–µ–і–ї–µ–љ–Є—П –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [13, 14]. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –Є —А—П–і –њ—А–Њ—В–Є–≤–Њ—А–µ—З–Є–є, –Ї–∞—Б–∞—О—Й–Є—Е—Б—П –∞–±—Б–Њ–ї—О—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є —Г—А–Њ–≤–љ–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞. –Ґ–∞–Ї, –Є–Ј—Г—З–∞—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Т–У–Ф –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є —В–µ—З–µ–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л, –њ—А–Њ—Д. –Р.–Ь. –Т–Њ–і–Њ–≤–Њ–Ј–Њ–≤ (1991) –љ–∞—И–µ–ї, —З—В–Њ –≤–µ–ї–Є—З–Є–љ–∞ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ–≥–Њ –і–∞–≤–ї–µ–љ–Є—П —Е–Њ—В—П –Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –≤—Л—И–µ —Г –ї–Є—Ж —Б –∞–љ–∞–Љ–љ–µ–Ј–Њ–Љ –≥–ї–∞—Г–Ї–Њ–Љ—Л 0вАУ4 –≥–Њ–і–∞, –љ–Њ –љ–µ –њ—А–µ–≤—Л—И–∞–µ—В –Ј–љ–∞—З–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –±–Њ–ї–µ—О—Й–Є—Е –Њ—В 15 –і–Њ 19 –ї–µ—В (19,7 –Є 18,0 –Љ–Љ —А—В. —Б—В., t=1,17; p>0,05) [15]. –Э–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —Г–љ–Є—Д–Є–Ї–∞—Ж–Є–Є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–∞–љ–µ–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –њ—А–Є–≤–µ–ї–∞ –Ї —Б–Њ–Ј–і–∞–љ–Є—О –≥—А–∞–і–∞—Ж–Є–Є –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –і–ї—П —А–∞–Ј–љ—Л—Е —Б—В–∞–і–Є–є –≥–ї–∞—Г–Ї–Њ–Љ—Л [16]. –Ф–ї—П –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л —В–∞–Ї–Њ–є —Б—А–µ–і–љ–Є–є –і–Є–∞–њ–∞–Ј–Њ–љ –≤–µ—А—Е–љ–Є—Е –Ј–љ–∞—З–µ–љ–Є–є —Б–Њ—Б—В–∞–≤–ї—П–µ—В 19вАУ21 –Љ–Љ —А—В. —Б—В. (Pt), —З—В–Њ —В–∞–Ї–ґ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤—Г–µ—В –Ј–Њ–љ–µ ¬Ђ—Б—А–µ–і–љ–µ–є –љ–Њ—А–Љ—Л¬ї (–Њ—В 19 –і–Њ 22 –Љ–Љ —А—В. —Б—В.), —Е–∞—А–∞–Ї—В–µ—А–љ–Њ–є –і–ї—П 72,2% –Ј–і–Њ—А–Њ–≤—Л—Е –ї–Є—Ж –Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–Њ–є —А–∞–љ–µ–µ –≤ –Њ—В–і–µ–ї—М–љ—Л—Е —Н–њ–Є–і–µ–Љ–Є–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П—Е [17, 18]. –Ю–±–љ–∞—А—Г–ґ–µ–љ–љ–∞—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П –Њ—Б–Њ–±–µ–љ–љ–Њ—Б—В—М –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ —В–Њ–Љ, —З—В–Њ –Ј–і–Њ—А–Њ–≤—Л–µ –ї–Є—Ж–∞ –Є –њ–∞—Ж–Є–µ–љ—В—Л —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, –Њ–±–ї–∞–і–∞—О—В —А–∞–Ј–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О –Ї –њ–Њ–≤—Л—И–µ–љ–љ–Њ–Љ—Г —Г—А–Њ–≤–љ—О –Т–У–Ф, –∞ —В–∞–Ї–ґ–µ –Њ —Б—Г—Й–µ—Б—В–≤–Њ–≤–∞–љ–Є–Є –Є–љ—Л—Е —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Є –њ—А–µ–≤–∞–ї–Є—А–Њ–≤–∞–љ–Є–Є –≤ –Њ—В–і–µ–ї—М–љ—Л—Е —Б–ї—Г—З–∞—П—Е —А—П–і–∞ –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –≤–ї–Є—П—О—Й–Є—Е –љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –±–Њ–ї–µ–Ј–љ–Є [19вАУ21]. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, —Г—З–Є—В—Л–≤–∞—О—Й–Є—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г—А–Њ–≤–љ–µ–є –Т–У–Ф –Є —Б–Њ—Б—В–Њ—П–љ–Є–µ —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є, –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ–≥–Њ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П –Љ–Њ–≥—Г—В —Б—В–∞—В—М –Њ—Б–љ–Њ–≤–∞–љ–Є–µ–Љ –і–ї—П –њ–µ—А–µ—Б–Љ–Њ—В—А–∞ –≥—А–∞–љ–Є—Ж –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞.
–¶–µ–ї—М—О –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞–ї–Њ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–µ –±–µ–Ј–Њ–њ–∞—Б–љ–Њ–≥–Њ –і–Є–∞–њ–∞–Ј–Њ–љ–∞ —Г—А–Њ–≤–љ–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –Я–Ю–£–У –љ–∞ —Д–Њ–љ–µ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П.
–Ь–∞—В–µ—А–Є–∞–ї –Є –Љ–µ—В–Њ–і—Л
–Ь–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤–Њ–µ –љ–∞—Г—З–љ–Њ-–Ї–ї–Є–љ–Є—З–µ—Б–Ї–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М 31 –≤—А–∞—З–Њ–Љ –≤ –њ–µ—А–Є–Њ–і —Б —П–љ–≤–∞—А—П –њ–Њ –Љ–∞–є 2015 –≥. –љ–∞ 26 –±–∞–Ј–∞—Е –≤ 4 —Б—В—А–∞–љ–∞—Е –°–Э–У (–С–µ–ї–∞—А—Г—Б—М, –Ъ–∞–Ј–∞—Е—Б—В–∞–љ, –†–Њ—Б—Б–Є—П, –£–Ј–±–µ–Ї–Є—Б—В–∞–љ). –Я—А–µ–і–Љ–µ—В–Њ–Љ –Є–Ј—Г—З–µ–љ–Є—П –≤—Л–±–Њ—А–Њ—З–љ–Њ–≥–Њ –љ–∞–±–ї—О–і–∞—В–µ–ї—М–љ–Њ–≥–Њ –Ї–Њ–Љ–±–Є–љ–Є—А–Њ–≤–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞–ї–Є 78 –њ–∞—Ж–Є–µ–љ—В–Њ–≤ (86 –≥–ї–∞–Ј) —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –Я–Ю–£–У. –£—З–∞—Б—В–Є–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Њ –Є—Е –њ–Є—Б—М–Љ–µ–љ–љ—Л–Љ —Б–Њ–≥–ї–∞—Б–Є–µ–Љ.
–Э–∞ –њ–µ—А–≤–Њ–Љ —Н—В–∞–њ–µ –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ —А–µ—В—А–Њ—Б–њ–µ–Ї—В–Є–≤–љ—Л–є –∞–љ–∞–ї–Є–Ј –і–∞–љ–љ—Л—Е –∞–љ–∞–Љ–љ–µ–Ј–∞ –±–Њ–ї–µ–Ј–љ–Є –Є —А–µ–ґ–Є–Љ–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Э–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–≤–Њ–і–Є–ї–Њ—Б—М –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ–µ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–Є–µ —Б—В–∞–і–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–Љ –Є–Ј–Љ–µ—А–µ–љ–Є–µ–Љ —Г—А–Њ–≤–љ—П –Т–У–Ф (—Б –Ї–Њ—А—А–µ–Ї—Ж–Є–µ–є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Б —Г—З–µ—В–Њ–Љ –і–∞–љ–љ—Л—Е —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –Ј–Њ–љ–µ (–¶–Ґ–†)) –Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ–Љ –њ–Њ–ї—П –Ј—А–µ–љ–Є—П. –Ш—В–Њ–≥–Њ–≤—Л–є –њ—А–Њ—В–Њ–Ї–Њ–ї –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б–Њ–і–µ—А–ґ–∞–ї –і–∞–љ–љ—Л–µ –љ–∞–±–ї—О–і–µ–љ–Є–є 3 –≤—А–µ–Љ–µ–љ–љ—Л—Е –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–Њ–≤: –љ–∞ –Љ–Њ–Љ–µ–љ—В, –Ї–Њ–≥–і–∞ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–µ –±—Л–ї–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Њ –≤–њ–µ—А–≤—Л–µ, –∞ —В–∞–Ї–ґ–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л –Є–Ј–Љ–µ—А–µ–љ–Є–є, –њ—А–Њ–≤–µ–і–µ–љ–љ—Л—Е –≤ —П–љ–≤–∞—А–µ 2010 –≥. –Є —П–љ–≤–∞—А–µ вАУ –Љ–∞–µ 2015 –≥. –Т—А–µ–Љ–µ–љ–љ–Њ–є –њ—А–Њ–Љ–µ–ґ—Г—В–Њ–Ї –≤ 5 –ї–µ—В (2010вАУ2015 –≥–≥.) –±—Л–ї –Є–Ј–±—А–∞–љ –≤ –Ї–∞—З–µ—Б—В–≤–µ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–≥–Њ –њ–µ—А–Є–Њ–і–∞ –љ–∞–±–ї—О–і–µ–љ–Є—П –њ–Њ –њ—А–Є—З–Є–љ–µ –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е —А–∞–љ–µ–µ –Љ–љ–µ–љ–Є–є, —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–Њ—В–Њ—А—Л–Љ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л –љ–∞—З–Є–љ–∞–µ—В—Б—П —З–µ—А–µ–Ј 3,5вАУ6 –ї–µ—В –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П [22вАУ26], –∞ —В–∞–Ї–ґ–µ –≤ —Б–≤—П–Ј–Є —Б –њ–Њ—П–≤–Є–≤—И–µ–є—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М—О –њ—А–Њ—Б–ї–µ–і–Є—В—М —А–µ–Ј—Г–ї—М—В–∞—В—Л –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Б—В–∞—В–Є—З–µ—Б–Ї–Њ–є –∞–≤—В–Њ–Љ–∞—В–Є—З–µ—Б–Ї–Њ–є –њ–µ—А–Є–Љ–µ—В—А–Є–Є (–°–Р–Я), –њ–Њ–ї—Г—З–Є–≤—И–µ–є –±–Њ–ї–µ–µ —И–Є—А–Њ–Ї–Њ–µ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–µ –Є–Љ–µ–љ–љ–Њ –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ –≥–Њ–і—Л. –°—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–∞—П —Д–Њ—А–Љ–∞ –≥–ї–∞—Г–Ї–Њ–Љ—Л –±—Л–ї–∞ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–∞ –љ–∞ 50 –≥–ї–∞–Ј–∞—Е (1-—П –≥—А—Г–њ–њ–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤), –љ–µ—Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–∞—П вАУ –љ–∞ 36 –≥–ї–∞–Ј–∞—Е (2-—П –≥—А—Г–њ–њ–∞ –±–Њ–ї—М–љ—Л—Е). –°—А–µ–і–Є –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–љ—Л—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –±—Л–ї–Њ 47 –ґ–µ–љ—Й–Є–љ (60,3%) –Є 31 –Љ—Г–ґ—З–Є–љ–∞ (39,7%). –Я—А–∞–≤—Л–µ –≥–ї–∞–Ј–∞ –±—Л–ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ 51,2% —Б–ї—Г—З–∞–µ–≤, –ї–µ–≤—Л–µ вАУ –≤ 48,8%. –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Љ–Њ–Љ–µ–љ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л —Б–Њ—Б—В–∞–≤–Є–ї 64,86¬±0,75 –≥–Њ–і–∞, 64,20 (59,80; 69,80) –≥–Њ–і–∞; —Г –Љ—Г–ґ—З–Є–љ вАУ 65,13¬±1,17 –≥–Њ–і–∞, 65,00 (60,10; 69,80) –ї–µ—В; —Г –ґ–µ–љ—Й–Є–љ вАУ 64,68¬±0,99 –≥–Њ–і–∞, 64,10 (59,10; 69,80) –≥–Њ–і–∞ (p=0,798; U=0,255). –Р–љ–∞–Љ–љ–µ–Ј –≥–ї–∞—Г–Ї–Њ–Љ—Л –і–ї—П –ї–Є—Ж –Њ–±–Њ–µ–≥–Њ –њ–Њ–ї–∞ –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –љ–∞ —П–љ–≤–∞—А—М 2010 –≥. —Б–Њ—Б—В–∞–≤–Є–ї 3,62¬±0,44 –≥–Њ–і–∞, 2,20 (0,40; 5,70) –≥–Њ–і–∞ –Є –љ–µ –Є–Љ–µ–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –Ј–љ–∞—З–Є–Љ—Л—Е —А–∞–Ј–ї–Є—З–Є–є —Г –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ (p=0,939; U=0,077). –°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї 73,48¬±0,77 –≥–Њ–і–∞, 72,80 (67,20; 78,10) –≥–Њ–і–∞; —Г –Љ—Г–ґ—З–Є–љ вАУ 73,60¬±1,26 –≥–Њ–і–∞, 73,20 (66,80; 78,60) –≥–Њ–і–∞; —Г –ґ–µ–љ—Й–Є–љ вАУ 73,40¬±0,98 –≥–Њ–і–∞, 72,10 (68,20; 77,10) –≥–Њ–і–∞ (p=0,798; U=0,255). –Р–љ–∞–Љ–љ–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –љ–∞ —Н—В–Њ—В –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А—Г–µ–Љ–Њ —Г–≤–µ–ї–Є—З–Є–ї—Б—П, —Б–Њ—Б—В–∞–≤–Є–≤ 8,62¬±0,44 –≥–Њ–і–∞, 7,20 (5,40; 10,70) –≥–Њ–і–∞.
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П –Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П
–Ъ—А–Є—В–µ—А–Є–Є –≤–Ї–ї—О—З–µ–љ–Є—П: –µ–≤—А–Њ–њ–µ–Њ–Є–і–љ–∞—П —А–∞—Б–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤; —А–µ–≥–Є–Њ–љ –њ—А–Њ–ґ–Є–≤–∞–љ–Є—П вАУ —Б—В—А–∞–љ—Л –°–Э–У (–С–µ–ї–∞—А—Г—Б—М, –Ъ–∞–Ј–∞—Е—Б—В–∞–љ, –†–Њ—Б—Б–Є—П, –£–Ј–±–µ–Ї–Є—Б—В–∞–љ); —А–∞–Ј–≤–Є—В–∞—П —Б—В–∞–і–Є—П –Я–Ю–£–У (—Б –њ—Б–µ–≤–і–Њ—Н–Ї—Б—Д–Њ–ї–Є–∞—В–Є–≤–љ—Л–Љ —Б–Є–љ–і—А–Њ–Љ–Њ–Љ –Є–ї–Є –±–µ–Ј; —Б —И–Є—А–Њ–Ї–Є–Љ, —Б—А–µ–і–љ–Є–Љ –Є–ї–Є —Г–Ј–Ї–Є–Љ —Г–≥–ї–∞–Љ–Є), –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ–∞—П –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –љ–∞ 1.01.2010 –≥., –≤–Њ–Ј—А–∞—Б—В вАУ –Њ—В 60 –і–Њ 89 –ї–µ—В (–њ–Њ–ґ–Є–ї–Њ–є –Є —Б—В–∞—А—З–µ—Б–Ї–Є–є –≤–Њ–Ј—А–∞—Б—В, –њ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –Т—Б–µ–Љ–Є—А–љ–Њ–є –Њ—А–≥–∞–љ–Є–Ј–∞—Ж–Є–Є –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є—П –Њ—В 2012 –≥., www.who.int/ru); –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —А–µ—Д—А–∞–Ї—Ж–Є—П –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ ¬±3,0 –і–њ—В—А –Є –∞—Б—В–Є–≥–Љ–∞—В–Є–Ј–Љ ¬±1,5 –і–њ—В—А; –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –¶–Ґ–† вАУ 520вАУ580 –Љ–Ї–Љ; —А–µ–ґ–Є–Љ –Љ–µ—Б—В–љ–Њ–є –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є —В–µ—А–∞–њ–Є–Є вАУ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –њ–∞—Ж–Є–µ–љ—В—Л –Љ–Њ–≥–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞—В—М –ї—О–±–Њ–є —А–µ–ґ–Є–Љ –Є–љ—Б—В–Є–ї–ї—П—Ж–Є–є (–ї—О–±—Л–µ –≥—А—Г–њ–њ—Л –Є —З–∞—Б—В–Њ—В–∞ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П); –≤ —Б–ї—Г—З–∞–µ –µ—Б–ї–Є —А–µ–ґ–Є–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–є –і–ї—П –њ–∞—А–љ—Л—Е –≥–ї–∞–Ј –±—Л–ї –Њ–і–Є–љ–∞–Ї–Њ–≤—Л–Љ –≤ —В–µ—З–µ–љ–Є–µ 5 –ї–µ—В, —В–Њ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –≤–Ї–ї—О—З–∞–ї–Є—Б—М –і–∞–љ–љ—Л–µ —В–Њ–ї—М–Ї–Њ –њ–Њ 1 –≥–ї–∞–Ј—Г –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞.
–Ъ—А–Є—В–µ—А–Є–Є –Є—Б–Ї–ї—О—З–µ–љ–Є—П: –ї—О–±–∞—П –і—А—Г–≥–∞—П —Д–Њ—А–Љ–∞ –њ–µ—А–≤–Є—З–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л, –Ї—А–Њ–Љ–µ —Г–Ї–∞–Ј–∞–љ–љ–Њ–є –≤—Л—И–µ; –≤—Л—А–∞–ґ–µ–љ–љ—Л–µ –њ–Њ–Љ—Г—В–љ–µ–љ–Є—П –Њ–њ—В–Є—З–µ—Б–Ї–Є—Е —Б—А–µ–і, –њ—А–µ–њ—П—В—Б—В–≤—Г—О—Й–Є–µ –≤—Л–њ–Њ–ї–љ–µ–љ–Є—О –њ–µ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є —Б –њ–Њ–Љ–Њ—Й—М—О –°–Р–Я; –і—А—Г–≥–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–µ—В—З–∞—В–Ї–Є (–≤–Њ–Ј—А–∞—Б—В–љ–∞—П –Љ–∞–Ї—Г–ї–Њ–і–Є—Б—В—А–Њ—Д–Є—П вАУ –ї—О–±–∞—П —Д–Њ—А–Љ–∞, —Б–Њ—Б—В–Њ—П–љ–Є—П –њ–Њ—Б–ї–µ –Њ–Ї–Ї–ї—О–Ј–Є–є, –і–Є–∞–±–µ—В–Є—З–µ—Б–Ї–∞—П —А–µ—В–Є–љ–Њ–њ–∞—В–Є—П –Є –µ–µ –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П –Є –і—А., –Ї–∞–Ї —Н—В–Њ –њ—А–Є–љ—П—В–Њ —Б–Њ–≥–ї–∞—Б–љ–Њ –Љ–µ—В–Њ–і–Є–Ї–µ –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є (https://clinicaltrials.gov)); –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–µ –Њ—Д—В–∞–ї—М–Љ–Њ–ї–Њ–≥–Є—З–µ—Б–Ї–Њ–µ –ї–µ—З–µ–љ–Є–µ –≤ –∞–љ–∞–Љ–љ–µ–Ј–µ, –њ—А–Њ–≤–µ–і–µ–љ–љ–Њ–µ –Љ–µ–љ–µ–µ —З–µ–Љ –Ј–∞ 6 –Љ–µ—Б. –і–Њ –Љ–Њ–Љ–µ–љ—В–∞ –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–∞ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –Є –њ—А–Њ—И–µ–і—И–µ–µ —Б –Њ—Б–ї–Њ–ґ–љ–µ–љ–Є—П–Љ–Є (–љ–∞–њ—А–Є–Љ–µ—А, —А–∞–Ј—А—Л–≤ –Ј–∞–і–љ–µ–є –Ї–∞–њ—Б—Г–ї—Л —Е—А—Г—Б—В–∞–ї–Є–Ї–∞ –Є –њ–Њ–≥—А–∞–љ–Є—З–љ–Њ–є –Љ–µ–Љ–±—А–∞–љ—Л —Б –њ–Њ—В–µ—А–µ–є —Б—В–µ–Ї–ї–Њ–≤–Є–і–љ–Њ–≥–Њ —В–µ–ї–∞); –њ–Њ—Б–ї–µ–Њ–њ–µ—А–∞—Ж–Є–Њ–љ–љ—Л–µ —Б–Њ—Б—В–Њ—П–љ–Є—П, —В—А–∞–≤–Љ—Л –Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –Њ—А–≥–∞–љ–∞ –Ј—А–µ–љ–Є—П, –Ј–∞—В—А—Г–і–љ—П—О—Й–Є–µ –њ—А–Њ–≤–µ–і–µ–љ–Є–µ —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є –њ–Њ –Ь–∞–Ї–ї–∞–Ї–Њ–≤—Г; —Б–∞—Е–∞—А–љ—Л–є –і–Є–∞–±–µ—В, –∞ —В–∞–Ї–ґ–µ –і—А—Г–≥–Є–µ –Њ–±—Й–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, —В—А–µ–±—Г—О—Й–Є–µ –≥–Њ—А–Љ–Њ–љ–∞–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є.
–Т–µ—А–Є—Д–Є–Ї–∞—Ж–Є—П –і–Є–∞–≥–љ–Њ–Ј–Њ–≤ –Є –Љ–µ—В–Њ–і—Л
–Т–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е –і–Є–∞–≥–љ–Њ–Ј –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–Є —Б —Б–Є—Б—В–µ–Љ–Њ–є –і–Є—Д—Д–µ—А–µ–љ—Ж–Є–∞–ї—М–љ–Њ–є –і–Є–∞–≥–љ–Њ—Б—В–Є–Ї–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є–є –Є –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ —Б–њ–µ—Ж–Є–∞–ї—М–љ—Л–Љ–Є –Љ–µ—В–Њ–і–∞–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –°—В–∞–і–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л –љ–∞ –Љ–Њ–Љ–µ–љ—В –њ–µ—А–≤–Є—З–љ–Њ–≥–Њ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г—Б—В–∞–љ–∞–≤–ї–Є–≤–∞–ї–∞—Б—М –њ–Њ –і–∞–љ–љ—Л–Љ –Љ–µ–і–Є—Ж–Є–љ—Б–Ї–Њ–є –і–Њ–Ї—Г–Љ–µ–љ—В–∞—Ж–Є–Є (–љ–∞ –Њ—Б–љ–Њ–≤–∞–љ–Є–Є –і–∞–љ–љ—Л—Е —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є, –Њ—Д—В–∞–ї—М–Љ–Њ—Б–Ї–Њ–њ–Є–Є –Є —А–∞–Ј–љ—Л—Е –≤–Є–і–Њ–≤ –њ–µ—А–Є–Љ–µ—В—А–Є–Є). –°—В–∞–і–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–∞ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–∞ –і–∞–љ–љ—Л–Љ–Є –Њ—Д—В–∞–ї—М–Љ–Њ—Б–Ї–Њ–њ–Є–Є –Є/–Є–ї–Є —Д—Г–љ–і—Г—Б-—Д–Њ—В–Њ–≥—А–∞—Д–Є—А–Њ–≤–∞–љ–Є—П –Є/–Є–ї–Є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –Ї–Њ–≥–µ—А–µ–љ—В–љ–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є –Є/–Є–ї–Є –У–µ–є–і–µ–ї—М–±–µ—А–≥—Б–Ї–Њ–є —В–Њ–Љ–Њ–≥—А–∞—Д–Є–Є –Є –°–Р–Я, –≤—Л–њ–Њ–ї–љ–µ–љ–љ–Њ–є –љ–∞ –њ—А–Є–±–Њ—А–∞—Е Humphrey 745i/750i (Carl Zeiss Meditec Inc., –°–®–Р) —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ—Л –њ–Њ—А–Њ–≥–Њ–≤–Њ–є –њ–µ—А–Є–Љ–µ—В—А–Є–Є SITA Threshold 24-2. –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –°–Р–Я –Њ–њ—А–µ–і–µ–ї—П–ї–Є —Б—А–µ–і–љ—О—О —Б–≤–µ—В–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М —Б–µ—В—З–∞—В–Ї–Є (MD) –Є –µ–µ —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ (PSD). –Ш—Б—Б–ї–µ–і–Њ–≤–∞–ї–∞—Б—М –Њ—Б—В—А–Њ—В–∞ –Ј—А–µ–љ–Є—П, –Њ–њ—А–µ–і–µ–ї—П–ї–∞—Б—М –Ї–ї–Є–љ–Є—З–µ—Б–Ї–∞—П —А–µ—Д—А–∞–Ї—Ж–Є—П, –Є–Ј–Љ–µ—А—П–ї—Б—П —В–Њ–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф (—В–Њ–љ–Њ–Љ–µ—В—А–Є—П –њ–Њ –Ь–∞–Ї–ї–∞–Ї–Њ–≤—Г –≥—А—Г–Ј–Њ–Љ 10 –≥ –Є –њ–љ–µ–≤–Љ–Њ—В–Њ–љ–Њ–Љ–µ—В—А–Є—П). –Я–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –±—Л–ї–Є –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ—Л –љ–∞ –Љ–Њ–Љ–µ–љ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л, –≤ –њ–µ—А–Є–Њ–і —Б 2010 –њ–Њ 2015 –≥. (–њ—А–Є –Є–Ј–Љ–µ—А–µ–љ–Є–Є –љ–µ –Љ–µ–љ–µ–µ 1 —А–∞–Ј–∞ –≤ –≥–Њ–і) –Є –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ вАУ –≤—Б–µ–≥–Њ –љ–µ –Љ–µ–љ–µ–µ 6 —В–Њ–љ–Њ–Љ–µ—В—А–Є–є –і–ї—П –Ї–∞–ґ–і–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞. –Т—Б–µ —Г—З—В–µ–љ–љ—Л–µ –Є–Ј–Љ–µ—А–µ–љ–Є—П –љ–∞ –Љ–Њ–Љ–µ–љ—В –≤–Ї–ї—О—З–µ–љ–Є—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –≤ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Є—Б—М –≤ –Є–љ—В–µ—А–≤–∞–ї–µ –Њ—В 10:00 –і–Њ 12:00, –њ—А–Є —Н—В–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –≤—Л–њ–Њ–ї–љ—П–ї–Њ—Б—М —Б –Є–љ—В–µ—А–≤–∞–ї–Њ–Љ –љ–µ –±–Њ–ї–µ–µ 5 –Љ–Є–љ –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ: —Б–љ–∞—З–∞–ї–∞ –њ–љ–µ–≤–Љ–Њ—В–Њ–љ–Њ–Љ–µ—В—А–Є—П, –Ј–∞—В–µ–Љ —В–Њ–љ–Њ–Љ–µ—В—А–Є—П –њ–Њ –Ь–∞–Ї–ї–∞–Ї–Њ–≤—Г. –Т –Ї–∞–ґ–і–Њ–Љ —Б–ї—Г—З–∞–µ –љ–∞–±–ї—О–і–µ–љ–Є–є –Ј–∞ 5 –ї–µ—В —А–∞—Б—Б—З–Є—В—Л–≤–∞–ї–Є—Б—М —Б–ї–µ–і—Г—О—Й–Є–µ –Ј–љ–∞—З–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Т–У–Ф: –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ, –Љ–µ–і–Є–∞–љ–∞, –Ї–≤–∞—А—В–Є–ї–Є, —А–∞–Ј–Љ–∞—Е –Ј–љ–∞—З–µ–љ–Є–є –Љ–µ–ґ–і—Г –Љ–Є–љ–Є–Љ–∞–ї—М–љ—Л–Љ–Є –Є –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є, –Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–є —А–∞–Ј–Љ–∞—Е (–Њ–Ј–љ–∞—З–∞–µ—В –Є–љ—В–µ—А–≤–∞–ї, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –љ–∞—Е–Њ–і–Є–ї–Њ—Б—М 50% –Ј–љ–∞—З–µ–љ–Є–є). –Ъ–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П –Є —Б—Г–±–Ї–Њ–Љ–њ–µ–љ—Б–∞—Ж–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —Б–Њ–њ–Њ—Б—В–∞–≤–ї—П–ї–Є—Б—М —Б –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л–Љ–Є —Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞–Љ–Є –≤–µ—А—Е–љ–Є—Е –≥—А–∞–љ–Є—Ж –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —Г –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л –Є –±—Л–ї–Є –Њ—Б–љ–Њ–≤–∞–љ—Л –љ–∞ –і–∞–љ–љ—Л—Е –Ї–ї–Є–љ–Є—З–µ—Б–Ї–Є—Е —А–µ–Ї–Њ–Љ–µ–љ–і–∞—Ж–Є–є –†–Њ—Б—Б–Є–є—Б–Ї–Њ–≥–Њ –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–≥–Њ –Њ–±—Й–µ—Б—В–≤–∞ –Њ—В 2015 –≥. –Ф–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П —А–∞—Б—З–µ—В–Њ–≤ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –Є—Е —Б—А–µ–і–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –љ–∞ —Д–Њ–љ–µ –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –Љ–µ—Б—В–љ–Њ–є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ–Њ–є –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ч–∞ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –±—Л–ї–Є –њ—А–Є–љ—П—В—Л –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –°–Р–Я —Б–Њ–≥–ї–∞—Б–љ–Њ –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є, –њ—А–µ–і–ї–Њ–ґ–µ–љ–љ–Њ–є –Т.–Т. –Т–Њ–ї–Ї–Њ–≤—Л–Љ (2005) [27]. –Ш–Ј–Љ–µ—А—П–ї–∞—Б—М —В–Њ–ї—Й–Є–љ–∞ —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ –µ–µ –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –Ј–Њ–љ–µ (–¶–Ґ–†) —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ —Г–ї—М—В—А–∞–Ј–≤—Г–Ї–Њ–≤–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ (–£–Ч–Ш).
–Ь–µ—В–Њ–і—Л —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞
–Ю–±—А–∞–±–Њ—В–Ї–∞ –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –њ—А–Њ–≤–Њ–і–Є–ї–∞—Б—М 1 –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї–µ–Љ —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –њ—А–Њ–≥—А–∞–Љ–Љ—Л Statistica (–≤–µ—А—Б–Є–Є 8,0, StatSoft, –°–®–Р) —Б –њ–Њ—Б–ї–µ–і—Г—О—Й–µ–є –≤—Л–±–Њ—А–Њ—З–љ–Њ–є –њ—А–Њ–≤–µ—А–Ї–Њ–є –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ–Љ 2 –і—А—Г–≥–Є–Љ–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –≤ –љ–µ–Ј–∞–≤–Є—Б–Є–Љ–Њ–Љ —А–µ–ґ–Є–Љ–µ. –Я—А–Є–≤–Њ–і–Є–Љ—Л–µ –њ–∞—А–∞–Љ–µ—В—А—Л, –Є–Љ–µ—О—Й–Є–µ –љ–Њ—А–Љ–∞–ї—М–љ–Њ–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —Д–Њ—А–Љ–∞—В–µ –Ь¬±ѕГ, –≥–і–µ –Ь вАУ —Б—А–µ–і–љ–µ–µ –Ј–љ–∞—З–µ–љ–Є–µ, ѕГ вАУ —Б—В–∞–љ–і–∞—А—В–љ–Њ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ —Б—А–µ–і–љ–µ–≥–Њ –Ј–љ–∞—З–µ–љ–Є—П. –†–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ–љ–љ—Л—Е –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –њ—А–Є–≤–µ–і–µ–љ–Њ –≤ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Є–µ —Б WвАУ–Ї—А–Є—В–µ—А–Є–µ–Љ –®–∞–њ–Є—А–Њ вАУ –£–Є–ї–Ї–∞. –Я–∞—А–∞–Љ–µ—В—А—Л, –Є–Љ–µ—О—Й–Є–µ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–µ, –Њ—В–ї–Є—З–љ–Њ–µ –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —Д–Њ—А–Љ–∞—В–µ –Ьe (Q25%; Q75%), –≥–і–µ –Ьe вАУ –Љ–µ–і–Є–∞–љ–∞, Q25% –Є Q75% вАУ –Ї–≤–∞—А—В–Є–ї–Є. –Я—А–Є –љ–Њ—А–Љ–∞–ї—М–љ–Њ–Љ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є–Є –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –і–ї—П —Б—А–∞–≤–љ–µ–љ–Є—П 2 –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≥—А—Г–њ–њ –Є–ї–Є –њ–Њ–≤—В–Њ—А–љ—Л—Е –≤–љ—Г—В—А–Є–≥—А—Г–њ–њ–Њ–≤—Л—Е –Є–Ј–Љ–µ–љ–µ–љ–Є–є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П t-–Ї—А–Є—В–µ—А–Є–є –°—В—М—О–і–µ–љ—В–∞. –Я—А–Є –Њ—В–ї–Є—З–љ–Њ–Љ –Њ—В –љ–Њ—А–Љ–∞–ї—М–љ–Њ–≥–Њ —А–∞—Б–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ–∞—А–∞–Љ–µ—В—А–Њ–≤ –њ—А–Є —Б—А–∞–≤–љ–µ–љ–Є–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≤—Л–±–Њ—А–Њ–Ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї—Б—П –∞–љ–∞–ї–Є–Ј –і–ї—П –њ–Њ–њ–∞—А–љ–Њ–≥–Њ —Б—А–∞–≤–љ–µ–љ–Є—П –і–≤—Г—Е –љ–µ–Ј–∞–≤–Є—Б–Є–Љ—Л—Е –≤—Л–±–Њ—А–Њ–Ї вАУ Z-–∞–њ–њ—А–Њ–Ї—Б–Є–Љ–∞—Ж–Є—П U-–Ї—А–Є—В–µ—А–Є—П –Ь–∞–љ–љ–∞ вАУ –£–Є—В–љ–Є, –і–ї—П –њ–Њ–≤—В–Њ—А–љ—Л—Е –≤–љ—Г—В—А–Є–≥—А—Г–њ–њ–Њ–≤—Л—Е —Б—А–∞–≤–љ–µ–љ–Є–є –њ—А–Є–Љ–µ–љ—П–ї–∞—Б—М Z-–∞–њ–њ—А–Њ–Ї—Б–Є–Љ–∞—Ж–Є—П T-–Ї—А–Є—В–µ—А–Є—П –Т–Є–ї–Ї–Њ–Ї—Б–Њ–љ–∞. –Ф–ї—П –њ—А–Њ–≤–µ—А–Ї–Є —А–∞–≤–µ–љ—Б—В–≤–∞ –Љ–µ–і–Є–∞–љ –љ–µ—Б–Ї–Њ–ї—М–Ї–Є—Е –≤—Л–±–Њ—А–Њ–Ї –њ—А–Є–Љ–µ–љ—П–ї–Є H-–Ї—А–Є—В–µ—А–Є–є –Ъ—А–∞—Б–Ї–µ–ї–∞ вАУ –£–Њ–ї–ї–µ—Б–∞. –° —Ж–µ–ї—М—О –∞–љ–∞–ї–Є–Ј–∞ –≤–Ј–∞–Є–Љ–Њ—Б–≤—П–Ј–Є –Љ–µ–ґ–і—Г –њ—А–Є–Ј–љ–∞–Ї–∞–Љ–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –љ–µ–њ–∞—А–∞–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–є —А–∞–љ–≥–Њ–≤—Л–є r-–Ї–Њ—Н—Д—Д–Є—Ж–Є–µ–љ—В –Ї–Њ—А—А–µ–ї—П—Ж–Є–Є –°–њ–Є—А–Љ–µ–љ–∞, –∞ –Ї—А–Є—В–Є—З–µ—Б–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Ј–љ–∞—З–Є–Љ–Њ—Б—В–Є –њ—А–Є –њ—А–Њ–≤–µ—А–Ї–µ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –≥–Є–њ–Њ—В–µ–Ј –њ—А–Є–љ–Є–Љ–∞–ї—Б—П —А–∞–≤–љ—Л–Љ <0,05. –Ф–ї—П –њ—А–Њ–≤–µ–і–µ–љ–Є—П –Љ–љ–Њ–≥–Њ–Љ–µ—А–љ–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є –і–∞–љ–љ—Л—Е –Є –і–µ–ї–µ–љ–Є—П —Б–Њ–≤–Њ–Ї—Г–њ–љ–Њ—Б—В–Є –Њ–±—К–µ–Ї—В–Њ–≤ –љ–∞ –Њ–і–љ–Њ—А–Њ–і–љ—Л–µ –≥—А—Г–њ–њ—Л –±—Л–ї –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ –Ї–ї–∞—Б—В–µ—А–љ—Л–є –∞–љ–∞–ї–Є–Ј —Б –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ–Љ –Љ–µ—В–Њ–і–∞ k-—Б—А–µ–і–љ–Є—Е.

–†–µ–Ј—Г–ї—М—В–∞—В—Л –Є –Њ–±—Б—Г–ґ–і–µ–љ–Є–µ
–Т —В–∞–±–ї–Є—Ж–µ 1 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –і–µ—В–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л–µ —А–µ–Ј—Г–ї—М—В–∞—В—Л, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–µ –≤–Њ–Ј—А–∞—Б—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –љ–∞ –Љ–Њ–Љ–µ–љ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –∞ —В–∞–Ї–ґ–µ –≤–Њ–Ј—А–∞—Б—В –Є –∞–љ–∞–Љ–љ–µ–Ј –±–Њ–ї–µ–Ј–љ–Є –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –љ–∞ 2010 –Є 2015 –≥–≥. –Я–µ—А–≤–Є—З–љ—Л–є –њ–Њ–і—Б—З–µ—В —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –њ—А–Њ–≤–Њ–і–Є–ї—Б—П –Є—Б—Е–Њ–і—П –Є–Ј —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є—Е –і–∞–љ–љ—Л—Е, –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е –Є–Ј –∞–Љ–±—Г–ї–∞—В–Њ—А–љ—Л—Е –Ї–∞—А—В –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–°—А–µ–і–љ–Є–є –≤–Њ–Ј—А–∞—Б—В –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ –≤ —А–∞–Ј–ї–Є—З–љ—Л–µ –≤—А–µ–Љ–µ–љ–љ—Л–µ —В–Њ—З–Ї–Є (–Љ–Њ–Љ–µ–љ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤ 2010 –≥. –Є –љ–∞ –Љ–Њ–Љ–µ–љ—В —Д–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї—Б—П (p>0,05). –Т 2010 –≥. –∞–љ–∞–Љ–љ–µ–Ј –≥–ї–∞—Г–Ї–Њ–Љ—Л –≤ 50% —Б–ї—Г—З–∞–µ–≤ –љ–∞—Е–Њ–і–Є–ї—Б—П –≤ –Є–љ—В–µ—А–≤–∞–ї–µ –Њ—В 0,4 –і–Њ 5,7 –≥–Њ–і–∞ (—Б—А–µ–і–љ–Є–є —Б—А–Њ–Ї вАУ 3,62¬±0,44 –≥–Њ–і–∞). –Э–∞ –Љ–Њ–Љ–µ–љ—В —Д–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Ї–Њ–љ—В—А–Њ–ї—М–љ–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞ –∞–љ–∞–Љ–љ–µ–Ј –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –њ—А–Њ–≥–љ–Њ–Ј–Є—А—Г–µ–Љ–Њ —Г–≤–µ–ї–Є—З–Є–ї—Б—П –Є —Б–Њ—Б—В–∞–≤–Є–ї –Њ—В 5,4 –і–Њ 10,7 –≥–Њ–і–∞ (—Б—А–µ–і–љ–Є–є —Б—А–Њ–Ї вАУ 8,62¬±0,44 –≥–Њ–і–∞). –Т–Њ–Ј—А–∞—Б—В –љ–∞ –Љ–Њ–Љ–µ–љ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л (Q25%; Q75%) –љ–∞—Е–Њ–і–Є–ї—Б—П –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Њ—В 59,8 –і–Њ 69,8 –≥–Њ–і–∞, –∞ –≤ 2015 –≥. вАУ –Њ—В 67,2 –і–Њ 78,1 –≥–Њ–і–∞. –Т 13 —Б–ї—Г—З–∞—П—Е –≥–ї–∞—Г–Ї–Њ–Љ–∞ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ —А–Њ–≤–љ–Њ 5 –ї–µ—В –љ–∞–Ј–∞–і, –µ—Й–µ –≤ 6 —Б–ї—Г—З–∞—П—Е –∞–љ–∞–Љ–љ–µ–Ј –≥–ї–∞—Г–Ї–Њ–Љ—Л –±—Л–ї –Њ–≥—А–∞–љ–Є—З–µ–љ —Б—А–Њ–Ї–∞–Љ–Є –Њ—В 1 –і–Њ 3 –Љ–µ—Б.
–Т –і–∞–љ–љ–Њ–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–µ –±—Л–ї–Є –≤–Ї–ї—О—З–µ–љ—Л —В–Њ–ї—М–Ї–Њ –њ–∞—Ж–Є–µ–љ—В—Л —Б–Њ —Б—А–µ–і–љ–µ–є —В–Њ–ї—Й–Є–љ–Њ–є —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –Ј–Њ–љ–µ, —З—В–Њ –±—Л–ї–Њ —Б–і–µ–ї–∞–љ–Њ –і–ї—П –Є—Б–Ї–ї—О—З–µ–љ–Є—П –Њ—И–Є–±–Ї–Є –њ—А–Є –Њ—Ж–µ–љ–Ї–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ —В–Њ–љ–Њ–Љ–µ—В—А–Є–Є. –≠—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≤ —В–∞–±–ї–Є—Ж–µ 2.
–Я–Њ–Ї–∞–Ј–∞—В–µ–ї—М —В–Њ–ї—Й–Є–љ—Л —А–Њ–≥–Њ–≤–Є—Ж—Л –≤ —Ж–µ–љ—В—А–∞–ї—М–љ–Њ–є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –Ј–Њ–љ–µ (–±–µ–Ј —Г—З–µ—В–∞ –і—А—Г–≥–Є—Е —Д–∞–Ї—В–Њ—А–Њ–≤) –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї—Б—П —Г –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ (p=0,437; U=0,778). –С–Њ–ї–µ–µ 50% –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є–Љ–µ–ї–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –¶–Ґ–† –Њ—В 525 –і–Њ 558 –Љ–Ї–Љ, –∞ –≤–µ—Б—М –Љ–∞—Б—Б–Є–≤ –і–∞–љ–љ—Л—Е –љ–∞—Е–Њ–і–Є–ї—Б—П –≤ –Є–љ—В–µ—А–≤–∞–ї–µ –Њ—В 520 –і–Њ 579 –Љ–Ї–Љ. –°—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –¶–Ґ–† —Б–Њ—Б—В–∞–≤–Є–ї–Є 542,65¬±1,97 –Љ–Ї–Љ, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Њ —Б—В–∞–љ–і–∞—А—В–љ—Л–Љ —Б—А–µ–і–љ–Є–Љ –Ј–љ–∞—З–µ–љ–Є—П–Љ –њ–Њ –Њ–±—Й–µ–њ—А–Є–љ—П—В–Њ–є –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є–Є [28]. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –¶–Ґ–† –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї –љ–Є —Б –Њ–і–љ–Њ–є –Є–Ј –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е –≤ –±–∞–Ј–µ –і–∞–љ–љ—Л—Е, —В. –µ. –љ–Є –≤–Њ–Ј—А–∞—Б—В, –љ–Є –∞–љ–∞–Љ–љ–µ–Ј –≥–ї–∞—Г–Ї–Њ–Љ—Л –≤ —Ж–µ–ї–Њ–Љ, –љ–Є —Г—А–Њ–≤–µ–љ—М –і–∞–≤–ї–µ–љ–Є—П –љ–∞ –Љ–Њ–Љ–µ–љ—В —Д–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –љ–µ –Ј–∞–≤–Є—Б–µ–ї–Є –Њ—В –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –¶–Ґ–†.
–Ф–∞–ї–µ–µ –±—Л–ї –њ—А–Њ–≤–µ–і–µ–љ –∞–љ–∞–ї–Є–Ј –Є–Ј–Љ–µ—А–µ–љ–Є–є —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –≤ —А–∞–Ј–љ—Л–µ –≤—А–µ–Љ–µ–љ–љ—Л–µ –њ—А–Њ–Љ–µ–ґ—Г—В–Ї–Є (—В–∞–±–ї. 3).
–Э–∞ —Д–Њ–љ–µ –ї–µ—З–µ–љ–Є—П –Ј–∞ –≤–µ—Б—М –њ–µ—А–Є–Њ–і –љ–∞–±–ї—О–і–µ–љ–Є—П —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –±—Л–ї –њ–Њ–љ–Є–ґ–µ–љ —Б 28 (25,00; 31,00) –і–Њ 20 (17,00; 22,00) –Љ–Љ —А—В. —Б—В. (p<0,001; W=7,727). –£—А–Њ–≤–µ–љ—М –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ 5 –ї–µ—В –љ–∞–Ј–∞–і –±—Л–ї —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ, —З–µ–Љ –љ–∞ –Љ–Њ–Љ–µ–љ—В —Д–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П (—В–∞–±–ї. 4). –Ы–Њ–≥–Є—З–љ—Л–Љ –Њ–±—К—П—Б–љ–µ–љ–Є–µ–Љ —Н—В–Њ–≥–Њ, –њ–Њ–Љ–Є–Љ–Њ, –≤–Њ–Ј–Љ–Њ–ґ–љ–Њ, –≤—Л–±–Њ—А–∞ –±–Њ–ї–µ–µ —Н—Д—Д–µ–Ї—В–Є–≤–љ—Л—Е —Б—Е–µ–Љ –ї–µ—З–µ–љ–Є—П –Љ–Њ–ґ–µ—В –±—Л—В—М —В–∞–Ї–Њ–µ –Њ–±—К—П—Б–љ–µ–љ–Є–µ: –≥–ї–∞—Г–Ї–Њ–Љ–∞ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ —Г 13 —З–µ–ї–Њ–≤–µ–Ї –≤–њ–µ—А–≤—Л–µ —А–Њ–≤–љ–Њ 5 –ї–µ—В –љ–∞–Ј–∞–і, –Њ–љ–Є –µ—Й–µ –љ–µ –љ–∞—З–∞–ї–Є –ї–µ—З–µ–љ–Є–µ –љ–∞ —В–Њ—В –Љ–Њ–Љ–µ–љ—В, –Є –Є—Е —Г—А–Њ–≤–µ–љ—М –Т–У–Ф —Г–Ї–∞–Ј–∞–љ –Є—Б—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—П–Љ–Є –±–µ–Ј –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤. –†–∞–Ј–љ–Є—Ж–∞ –≤ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П—Е –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –≤ —В–µ—З–µ–љ–Є–µ 5-–ї–µ—В–љ–µ–≥–Њ –њ–µ—А–Є–Њ–і–∞ —Б–Њ—Б—В–∞–≤–Є–ї–∞ 0,5 –Љ–Љ —А—В. —Б—В. (p=0,008; W=2,645). –Я—А–Є –њ–Њ—Б–ї–µ–і–Њ–≤–∞—В–µ–ї—М–љ–Њ–Љ —Б—А–∞–≤–љ–µ–љ–Є–Є –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —В–Њ–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –±—Л–ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –≤—Л—И–µ –њ–љ–µ–≤–Љ–Њ—В–Њ–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –љ–∞ 4 –Љ–Љ —А—В. —Б—В. (p<0,001; W=7,072).
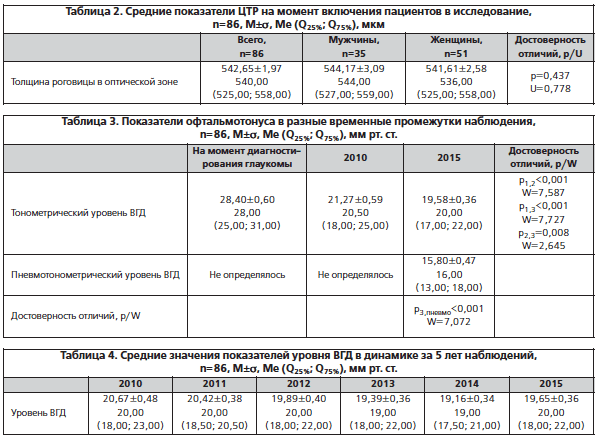
–Ь–Є–љ–Є–Љ–∞–ї—М–љ—Л–µ —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –≤ 2014 –≥., –Љ–∞–Ї—Б–Є–Љ–∞–ї—М–љ—Л–µ вАУ –≤ 2010 –≥., –Є –≤ —Н—В–Њ –ґ–µ –≤—А–µ–Љ—П –±—Л–ї —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ –љ–∞–Є–±–Њ–ї—М—И–Є–є –Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–є —А–∞–Ј–Љ–∞—Е, —Б–Њ—Б—В–∞–≤–Є–≤—И–Є–є 5 –Љ–Љ —А—В. —Б—В.
–Э–∞ —А–Є—Б—Г–љ–Ї–µ 1 –≥—А–∞—Д–Є—З–µ—Б–Ї–Є –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–∞ —А–∞–Ј–љ–Є—Ж–∞ –Њ—В–і–µ–ї—М–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Ј–∞ 5 –ї–µ—В —Г –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ (–Љ–Є–љ–Є–Љ—Г–Љ, –Љ–∞–Ї—Б–Є–Љ—Г–Љ, –Љ–µ–і–Є–∞–љ–∞, –Ї–≤–∞—А—В–Є–ї–Є, —А–∞–Ј–Љ–∞—Е –Є –Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–є —А–∞–Ј–Љ–∞—Е).
–Э–∞ —А–Є—Б—Г–љ–Ї–µ 1 –≤–Є–і–љ–Њ, —З—В–Њ –і–Њ–≤–µ—А–Є—В–µ–ї—М–љ—Л–µ –Є–љ—В–µ—А–≤–∞–ї—Л —Г –Љ—Г–ґ—З–Є–љ –±—Л–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї—М—И–µ, —З–µ–Љ —Г –ґ–µ–љ—Й–Є–љ –і–ї—П –Ї–∞–ґ–і–Њ–є –Є–Ј –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е. –≠—В–Њ –≥–Њ–≤–Њ—А–Є—В –Њ–± –Є—Е –љ–µ–Њ–і–љ–Њ—А–Њ–і–љ–Њ—Б—В–Є, –∞ —В–∞–Ї–ґ–µ –Њ –±–Њ–ї—М—И–Є—Е —А–∞–Ј–ї–Є—З–Є—П—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –і–∞–≤–ї–µ–љ–Є—П —Б—А–µ–і–Є –Љ—Г–ґ—З–Є–љ, —З–µ–Љ –Љ–µ–ґ–і—Г –ґ–µ–љ—Й–Є–љ–∞–Љ–Є. –Ґ–∞–Ї–ґ–µ –Ј–∞–Љ–µ—В–љ–Њ, —З—В–Њ –Є —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є —Г—А–Њ–≤–љ—П –Т–У–Ф —Г –Љ—Г–ґ—З–Є–љ –±—Л–ї–Є –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ –±–Њ–ї—М—И–µ, —З–µ–Љ —Г –ґ–µ–љ—Й–Є–љ. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –≤—Б–µ –њ–Њ–ї—Г—З–µ–љ–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л (p>0,05). –Э–∞ —А–Є—Б—Г–љ–Ї–µ 2 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б—А–∞–≤–љ–µ–љ–Є–є —Г—А–Њ–≤–љ–µ–є –Т–У–Ф –Љ–µ–ґ–і—Г –њ–∞—А–љ—Л–Љ–Є –≥–ї–∞–Ј–∞–Љ–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤.
–С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Б—А–µ–і–љ–Є–µ —Г—А–Њ–≤–љ–Є –Т–У–Ф –Є —Д–ї—Г–Ї—В—Г–∞—Ж–Є–Є –≤ –њ—А–∞–≤–Њ–Љ –Є –ї–µ–≤–Њ–Љ –≥–ї–∞–Ј—Г –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М (p>0,05). –Я—А–Є –њ—А–Њ–≤–µ–і–µ–љ–Є–Є –Ї–Њ—А—А–µ–ї—П—Ж–Є–Њ–љ–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Ј–љ–∞—З–µ–љ–Є—П –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Т–У–Ф, –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П –Љ–µ–і–Є–∞–љ—Л –Є –љ–Є–ґ–љ–µ–≥–Њ –Ї–≤–∞—А—В–Є–ї—П —Б–ї–∞–±–Њ –Є —Г–Љ–µ—А–µ–љ–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Є —Б –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –≤ –Ї–Њ—В–Њ—А–Њ–Љ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –≥–ї–∞—Г–Ї–Њ–Љ–∞, –≤–Њ–Ј—А–∞—Б—В–Њ–Љ 5 –ї–µ—В –љ–∞–Ј–∞–і –Є –≤–Њ–Ј—А–∞—Б—В–Њ–Љ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ –Љ–Њ–Љ–µ–љ—В —Д–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, —З–µ–Љ —А–∞–љ—М—И–µ –±—Л–ї–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–∞ –≥–ї–∞—Г–Ї–Њ–Љ–∞, —В–µ–Љ —Б –Љ–µ–љ—М—И–Є–Љ —Г—А–Њ–≤–љ–µ–Љ –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –њ—А–Є—Е–Њ–і–Є–ї –њ–∞—Ж–Є–µ–љ—В –љ–∞ –њ—А–Є–µ–Љ. –° –і—А—Г–≥–Њ–є —Б—В–Њ—А–Њ–љ—Л, –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –љ–∞ –Љ–Њ–Љ–µ–љ—В —Д–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ—Б–Љ–Њ—В—А–∞ —Г–Љ–µ—А–µ–љ–љ–Њ –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї —Б–Њ —Б—А–µ–і–љ–Є–Љ —Г—А–Њ–≤–љ–µ–Љ —Н—В–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П, –і–Є–∞–≥–љ–Њ—Б—В–Є—А—Г–µ–Љ–Њ–≥–Њ –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є 5 –ї–µ—В.
–Я—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤, –±–Њ–ї–µ—О—Й–Є—Е –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є, –Њ–њ—А–µ–і–µ–ї—П–µ—В—Б—П –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ —Б—В—А—Г–Ї—В—Г—А–љ–Њ-—Д—Г–љ–Ї—Ж–Є–Њ–љ–∞–ї—М–љ—Л—Е —Б–Њ—Б—В–∞–≤–ї—П—О—Й–Є—Е –Ј—А–Є—В–µ–ї—М–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞—В–Њ—А–∞. –Т —Н—В–Њ–є —Б–≤—П–Ј–Є –љ–∞ —Д–Њ–љ–µ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г—А–Њ–≤–љ—П –Т–У–Ф –±—Л–ї–Є –і–Њ–Ї—Г–Љ–µ–љ—В–Є—А–Њ–≤–∞–љ—Л –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П (—В–∞–±–ї. 5).
–С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П MD —Г –Љ—Г–ґ—З–Є–љ –Є –ґ–µ–љ—Й–Є–љ –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –≤ —А–∞–Ј–љ—Л—Е –≤—А–µ–Љ–µ–љ–љ—Л—Е —В–Њ—З–Ї–∞—Е (p>0,05). –°—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П MD 5 –ї–µ—В –љ–∞–Ј–∞–і —Б–Њ—Б—В–∞–≤–Є–ї–Є -6,25 (-9,16; -6,06) –і–С, –∞ –≤ 2015 –≥. –Є–Ј–Љ–µ–љ–Є–ї–Є—Б—М –і–Њ -11,53 (-15,59; -9,23) –і–С. –Т —Б—А–µ–і–љ–µ–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М MD —Г–≤–µ–ї–Є—З–Є–ї—Б—П –љ–∞ -3,71 (-5,35; -2,28) –і–С, –Є–ї–Є –±–Њ–ї–µ–µ 0,65 –і–С/–≥–Њ–і, —З—В–Њ —Е–∞—А–∞–Ї—В–µ—А–љ–Њ –і–ї—П –Љ–µ–і–ї–µ–љ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є —Д–Њ—А–Љ—Л –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Я–Њ–ї—Г—З–µ–љ–љ–Њ–µ –Ј–љ–∞—З–µ–љ–Є–µ —А–∞–Ј–љ–Є—Ж—Л MD –љ–µ –Ї–Њ—А—А–µ–ї–Є—А–Њ–≤–∞–ї–Њ –љ–Є —Б –Њ–і–љ–Њ–є –Є–Ј –љ–µ–њ—А–µ—А—Л–≤–љ—Л—Е –њ–µ—А–µ–Љ–µ–љ–љ—Л—Е (—Г—А–Њ–≤–µ–љ—М –Т–У–Ф, –≤–Њ–Ј—А–∞—Б—В, –∞–љ–∞–Љ–љ–µ–Ј), –Ј–∞ –Є—Б–Ї–ї—О—З–µ–љ–Є–µ–Љ —Б–Њ–±—Б—В–≤–µ–љ–љ–Њ —Н—В–Њ–≥–Њ –њ–µ—А–Є–Љ–µ—В—А–Є—З–µ—Б–Ї–Њ–≥–Њ –Є–љ–і–µ–Ї—Б–∞, –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –љ–∞ 2015 –≥., —В. –µ. —З–µ–Љ –±–Њ–ї—М—И–µ –±—Л–ї —Б–∞–Љ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М –≤ —Д–Є–љ–∞–ї–µ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П, —В–µ–Љ –±–Њ–ї—М—И–µ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–∞ –≥–ї–∞—Г–Ї–Њ–Љ–∞.
–Ф–µ—В–∞–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–µ—А–Є–Љ–µ—В—А–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї –≤—Л–і–µ–ї–Є—В—М –Є–Ј –њ–Њ–ї—Г—З–µ–љ–љ—Л—Е —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –і–∞–љ–љ—Л–µ 2 –≥—А—Г–њ–њ –±–Њ–ї—М–љ—Л—Е. –Т 1-–є –≥—А—Г–њ–њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П MD –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ, –≤–Њ 2-–є вАУ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–ї—П –Ј—А–µ–љ–Є—П –±—Л–ї–Є –≤—Л—А–∞–ґ–µ–љ—Л. –Т —В–∞–±–ї–Є—Ж–µ 6 –њ—А–Є–≤–µ–і–µ–љ—Л –і–∞–љ–љ—Л–µ —В–Њ–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є—Е –Ј–љ–∞—З–µ–љ–Є–є –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л—Е –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П.
–Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј —В–∞–±–ї–Є—Ж—Л 6, —Г—А–Њ–≤–љ–Є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —Г –ї–Є—Ж —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –Є —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М (p=0,372; U=-0,892). –Я—А–Є —Н—В–Њ–Љ —Б–ї–µ–і—Г–µ—В –Њ—В–Љ–µ—В–Є—В—М, —З—В–Њ —Б—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П (–Љ–µ–і–Є–∞–љ–∞) –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –Є–Ј–Љ–µ–љ–Є–≤—И–Є–Љ–Є—Б—П –њ–Њ–ї—П–Љ–Є –Ј—А–µ–љ–Є—П –±—Л–ї–Є –љ–Є–ґ–µ –љ–∞ 1 –Љ–Љ —А—В. —Б—В., –∞ –Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–є —А–∞–Ј–Љ–∞—Е, –љ–∞–Њ–±–Њ—А–Њ—В, –±—Л–ї –і–∞–ґ–µ –±–Њ–ї—М—И–µ –љ–∞ 0,75 –Љ–Љ —А—В. —Б—В.

–Я–Њ–Ї–∞–Ј–∞—В–µ–ї—М —Б–≤–µ—В–Њ—З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є, —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г—О—Й–Є–є —Б—А–µ–і–љ–µ–µ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є–µ (MD), —В. –µ. –Њ–±—Й—Г—О —А–∞–Ј–љ–Є—Ж—Г –Љ–µ–ґ–і—Г –љ–Њ—А–Љ–∞–ї—М–љ–Њ–є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В—М—О, —Б —Г—З–µ—В–Њ–Љ –≤–Њ–Ј—А–∞—Б—В–∞ –Є —З—Г–≤—Б—В–≤–Є—В–µ–ї—М–љ–Њ—Б—В–Є —Б–µ—В—З–∞—В–Ї–Є —Г –Ї–Њ–љ–Ї—А–µ—В–љ–Њ–≥–Њ –њ–∞—Ж–Є–µ–љ—В–∞, —П–≤–ї—П–µ—В—Б—П –љ–∞–Є–±–Њ–ї–µ–µ –Є–љ—Д–Њ—А–Љ–∞—В–Є–≤–љ—Л–Љ –≤ –Њ–њ—А–µ–і–µ–ї–µ–љ–Є–Є –і–Є–љ–∞–Љ–Є–Ї–Є –Є–Ј–Љ–µ–љ–µ–љ–Є–є. –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –њ–µ—А—Б–њ–µ–Ї—В–Є–≤–љ–∞—П –Ї–ї–∞—Б—Б–Є—Д–Є–Ї–∞—Ж–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л –≤–Ї–ї—О—З–∞–µ—В –љ–µ—Б–Ї–Њ–ї—М–Ї–Њ —Б—В–µ–њ–µ–љ–µ–є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –±–Њ–ї–µ–Ј–љ–Є [27]. –Т –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –љ–µ —Б—Г—Й–µ—Б—В–≤—Г–µ—В –µ–і–Є–љ–Њ–≥–Њ –Љ–љ–µ–љ–Є—П –Њ —Б—В–µ–њ–µ–љ–Є (—Е–∞—А–∞–Ї—В–µ—А–Є—Б—В–Є–Ї–∞—Е) –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –њ–Њ –і–∞–љ–љ—Л–Љ –°–Р–Я. –Ь—Л –њ–Њ—Б—З–Є—В–∞–ї–Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ —А–∞–Ј–і–µ–ї–Є—В—М –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Њ–Ї–∞–Ј–∞–љ–љ—Л–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –±–Њ–ї–µ–Ј–љ–Є (n=36) –љ–∞ 2 –њ–Њ–і–≥—А—Г–њ–њ—Л: —В–µ—Е, —Г –Ї–Њ–≥–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—М MD –Є–Ј–Љ–µ–љ–Є–ї—Б—П –Ј–∞ 5 –ї–µ—В –Љ–µ–љ–µ–µ —З–µ–Љ –љ–∞ 5 –Ф–±, —В. –µ. –±–Њ–ї—М—И–µ, —З–µ–Љ –љ–∞ 1 –і–С/–≥–Њ–і (n=26), –Є —В–µ—Е (n=10), —Г –Ї–Њ–≥–Њ –±—Л–ї–Є —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ—Л –±–Њ–ї–µ–µ –Ј–љ–∞—З–Є—В–µ–ї—М–љ—Л–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–ї—П –Ј—А–µ–љ–Є—П —Б —В–µ–Љ, —З—В–Њ–±—Л —Г—В–Њ—З–љ–Є—В—М —В–Њ–љ–Њ–Љ–µ—В—А–Є—З–µ—Б–Ї–Є–µ –і–∞–љ–љ—Л–µ (—В–∞–±–ї. 7).
–Ь–µ–і–Є–∞–љ–∞ —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —Г –Ї–Њ—В–Њ—А—Л—Е –≥–ї–∞—Г–Ї–Њ–Љ–∞ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–ї–∞ –Љ–µ–љ–µ–µ —З–µ–Љ –љ–∞ 1 –і–С/–≥–Њ–і, —Б–Њ—Б—В–∞–≤–Є–ї–∞ 20,00 (17,50; 21,00) –Љ–Љ —А—В. —Б—В., –∞ —Г –±–Њ–ї—М–љ—Л—Е —Б –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –±–Њ–ї–µ–µ 1 –і–С/–≥–Њ–і вАУ 20,50 (19,00; 21,00) –Љ–Љ —А—В. —Б—В. –Э–∞–є–і–µ–љ–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л (p=0,354; U=0,927). –Я–∞—Ж–Є–µ–љ—В—Л —Б –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –њ–Њ–ї—П –Ј—А–µ–љ–Є—П –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 5 –і–С –Ј–∞ –њ—А–Њ—И–µ–і—И–Є–µ 5 –ї–µ—В —В–∞–Ї–ґ–µ –Є–Љ–µ–ї–Є –±–Њ–ї—М—И–Є–є –Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–є —А–∞–Ј–Љ–∞—Е –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞, —З–µ–Љ –±–Њ–ї—М–љ—Л–µ —Б –Љ–µ–љ–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ (2,75 –Є 2,25 –Љ–Љ —А—В. —Б—В. —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–µ–љ–љ–Њ). –Ъ–∞–Ї –≤–Є–і–љ–Њ –Є–Ј –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –≤ —В–∞–±–ї–Є—Ж–µ 7 –і–∞–љ–љ—Л—Е, –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е —Б—А–∞–≤–љ–µ–љ–Є—П –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –±—Л–ї–Є –љ–Є–ґ–µ –љ–∞ 0,2вАУ1,0 –Љ–Љ —А—В. —Б—В. –≤ –≥—А—Г–њ–њ–µ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л–Љ –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ–Љ –Љ–µ–љ–µ–µ 1 –і–С/–≥–Њ–і (p>0,05).
–Ю–і–љ–Є–Љ –Є–Ј –Ї–ї—О—З–µ–≤—Л—Е –Ї—А–Є—В–µ—А–Є–µ–≤ —Н—Д—Д–µ–Ї—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л –Є —Б—В–∞–±–Є–ї–Є–Ј–∞—Ж–Є–Є –≥–ї–∞—Г–Ї–Њ–Љ–љ–Њ–є –Њ–њ—В–Є—З–µ—Б–Ї–Њ–є –љ–µ–є—А–Њ–њ–∞—В–Є–Є (–У–Ю–Э) –і–ї—П –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б —А–∞–Ј–љ—Л–Љ–Є —Б—В–∞–і–Є—П–Љ–Є –±–Њ–ї–µ–Ј–љ–Є —П–≤–ї—П–µ—В—Б—П —Б–Њ–±–ї—О–і–µ–љ–Є–µ —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞. –Ф–ї—П –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —В–∞–Ї–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є –љ–µ –і–Њ–ї–ґ–љ—Л –њ—А–µ–≤—Л—И–∞—В—М 19вАУ21 –Љ–Љ —А—В. —Б—В. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –і–Њ –љ–∞—Б—В–Њ—П—Й–µ–≥–Њ –≤—А–µ–Љ–µ–љ–Є –љ–µ—В –Њ–њ—Г–±–ї–Є–Ї–Њ–≤–∞–љ–љ—Л—Е –Њ—В–µ—З–µ—Б—В–≤–µ–љ–љ—Л—Е –Љ–љ–Њ–≥–Њ—Ж–µ–љ—В—А–Њ–≤—Л—Е –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–є, –Ї–Њ—В–Њ—А—Л–µ –±—Л —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤–Њ–≤–∞–ї–Є –Њ –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е –≥—А–∞–љ–Є—Ж–∞—Е –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Є –њ—А–Є —Н—В–Њ–Љ —Г—З–Є—В—Л–≤–∞–ї–Є –Ї–Њ–љ–Ї—А–µ—В–љ—Л–µ –∞–±—Б–Њ–ї—О—В–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Т–У–Ф. –Ь—Л –њ–Њ—Б—З–Є—В–∞–ї–Є –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ —Б–Њ–њ–Њ—Б—В–∞–≤–Є—В—М –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г—А–Њ–≤–љ–µ–є –Т–У–Ф –Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П –њ–Њ–ї—П –Ј—А–µ–љ–Є—П (–њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П) —Г –±–Њ–ї—М–љ—Л—Е, —З—М–Є –і–∞–љ–љ—Л–µ –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —А–∞—Б–њ–Њ–ї–∞–≥–∞–ї–Є—Б—М –≤–Њ–Ї—А—Г–≥ –Њ—В–і–µ–ї—М–љ—Л—Е –∞–±—Б–Њ–ї—О—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є: 19, 20 –Є 21 –Љ–Љ —А—В. —Б—В. (—В–∞–±–ї. 8вАУ10).
–Я—А–Є –∞–љ–∞–ї–Є–Ј–µ –і–∞–љ–љ—Л—Е, –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л—Е –≤ —В–∞–±–ї–Є—Ж–∞—Е 8вАУ10, —Б–ї–µ–і—Г–µ—В –Њ–±—А–∞—В–Є—В—М –≤–љ–Є–Љ–∞–љ–Є–µ –љ–∞ —В–Њ, —З—В–Њ –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е —Г –ї–Є—Ж, —З—М–Є –Љ–µ–і–Є–∞–љ—Л –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є —Г—А–Њ–≤–љ–µ–є –Т–У–Ф –њ—А–µ–≤—Л—И–∞–ї–Є –Ј–∞–і–∞–љ–љ—Л–µ –Ј–љ–∞—З–µ–љ–Є—П, –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є–µ –≥–ї–∞—Г–Ї–Њ–Љ—Л –њ—А–Њ–Є—Б—Е–Њ–і–Є–ї–Њ –±—Л—Б—В—А–µ–µ, –Њ–і–љ–∞–Ї–Њ —Н—В–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –≤—Б–µ 3 –Ј–љ–∞—З–µ–љ–Є—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞, –њ—А–Є–љ—П—В—Л–µ –Ј–∞ ¬Ђ–Ї–Њ—А–Є–і–Њ—А¬ї –±–µ–Ј–Њ–њ–∞—Б–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –і–ї—П –ї–Є—Ж —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л, –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –≤ —В–µ–Ї—Г—Й–Є—Е –∞–ї–≥–Њ—А–Є—В–Љ–∞—Е –ї–µ—З–µ–љ–Є—П. –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ –љ–µ–±–Њ–ї—М—И–Њ–µ –Ї–Њ–ї–Є—З–µ—Б—В–≤–Њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤, —З—М–Є —А–µ–Ј—Г–ї—М—В–∞—В—Л –±—Л–ї–Є –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л –∞–љ–∞–ї–Є–Ј—Г, –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В –њ—А–Њ–і–Њ–ї–ґ–µ–љ–Є–µ —Н—В–Њ–є —З–∞—Б—В–Є –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П.

–Ф–Њ—Б—В–Є–ґ–µ–љ–Є–µ –±–µ–Ј–Њ–њ–∞—Б–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —П–≤–ї—П–µ—В—Б—П –њ—А–Є–Њ—А–Є—В–µ—В–Њ–Љ –ї–µ—З–µ–љ–Є—П –±–Њ–ї—М–љ—Л—Е —Б –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є –Є —Б—В–∞–љ–Њ–≤–Є—В—Б—П –≤–Њ–Ј–Љ–Њ–ґ–љ—Л–Љ –Ї–∞–Ї –њ—А–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–Є –≥–Є–њ–Њ—В–µ–љ–Ј–Є–≤–љ—Л—Е –∞–љ—В–Є–≥–ї–∞—Г–Ї–Њ–Љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, —В–∞–Ї –Є –њ—А–Є –≤—Л–њ–Њ–ї–љ–µ–љ–Є–Є –ї–∞–Ј–µ—А–љ—Л—Е –Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л—Е –Њ–њ–µ—А–∞—Ж–Є–є –љ–∞ —Д–Њ–љ–µ —А–µ–≥—Г–ї—П—А–љ–Њ–≥–Њ –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П, —З—В–Њ –Є –Њ–њ—А–µ–і–µ–ї—П–µ—В —А–∞—Ж–Є–Њ–љ–∞–ї—М–љ—Г—О —В–∞–Ї—В–Є–Ї—Г –ї–µ—З–µ–љ–Є—П. –Р–Ї—В—Г–∞–ї—М–љ–Њ–µ –Є–Ј–і–∞–љ–Є–µ ¬Ђ–†—Г–Ї–Њ–≤–Њ–і—Б—В–≤–∞ –њ–Њ –≥–ї–∞—Г–Ї–Њ–Љ–µ –і–ї—П –њ—А–∞–Ї—В–Є–Ї—Г—О—Й–Є—Е –≤—А–∞—З–µ–є¬ї (2015) —Г—В–Њ—З–љ—П–µ—В, —З—В–Њ –ї–µ—З–µ–љ–Є–µ –Њ—Б—Г—Й–µ—Б—В–≤–ї—П–µ—В—Б—П –љ–∞ –њ—А–Њ—В—П–ґ–µ–љ–Є–Є –≤—Б–µ–є –ґ–Є–Ј–љ–Є –њ–∞—Ж–Є–µ–љ—В–∞, –∞ —Н—В–Њ –Ј–љ–∞—З–Є—В, —З—В–Њ –њ—А–Є–Љ–µ–љ—П–µ–Љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л (—А–µ–ґ–Є–Љ—Л) –±—Г–і—Г—В –Њ–ґ–Є–і–∞–µ–Љ–Њ —З–µ—А–µ–і–Њ–≤–∞—В—М—Б—П, —З—В–Њ —Б–≤—П–Ј–∞–љ–Њ –Ї–∞–Ї —Б –µ—Б—В–µ—Б—В–≤–µ–љ–љ—Л–Љ —В–µ—З–µ–љ–Є–µ–Љ –±–Њ–ї–µ–Ј–љ–Є, —В–∞–Ї –Є —Б –Є–Ј–Љ–µ–љ–µ–љ–Є–µ–Љ —В–Њ–ї–µ—А–∞–љ—В–љ–Њ—Б—В–Є –Ї –љ–∞–Ј–љ–∞—З–µ–љ–љ—Л–Љ –њ—А–µ–њ–∞—А–∞—В–∞–Љ.
–Т—В–Њ—А—Л–Љ —Н—В–∞–њ–Њ–Љ –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б—В–∞–ї–Њ –Є–Ј—Г—З–µ–љ–Є–µ —А–µ–ґ–Є–Љ–Њ–≤ –љ–∞–Ј–љ–∞—З–µ–љ–Є–є. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ 78 –њ–∞—Ж–Є–µ–љ—В–∞–Љ (86 –≥–ї–∞–Ј) —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї 201 —А–µ–ґ–Є–Љ –љ–∞–Ј–љ–∞—З–µ–љ–Є–є (5 –≥—А—Г–њ–њ –њ—А–µ–њ–∞—А–∞—В–Њ–≤ –Є –Є—Е –Ї–Њ–Љ–±–Є–љ–∞—Ж–Є–Є, –ї–∞–Ј–µ—А–љ–∞—П —Е–Є—А—Г—А–≥–Є—П, –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–Є–µ –Є –њ—А–Њ–љ–Є–Ї–∞—О—Й–Є–µ —В–Є–њ—Л –Њ–њ–µ—А–∞—В–Є–≤–љ—Л—Е –≤–Љ–µ—И–∞—В–µ–ї—М—Б—В–≤), —З—В–Њ –≤ —Б—А–µ–і–љ–µ–Љ —Б–Њ—Б—В–∞–≤–Є–ї–Њ 2,34 –Є–Ј–Љ–µ–љ–µ–љ–Є—П —А–µ–ґ–Є–Љ–∞ –љ–∞ 1 –њ–∞—Ж–Є–µ–љ—В–∞ –Ј–∞ 5 –ї–µ—В. –Я—А–Є –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–Љ –∞–љ–∞–ї–Є–Ј–µ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤ 13 —Б–ї—Г—З–∞—П—Е —А–µ–ґ–Є–Љ –Ј–∞ 5 –ї–µ—В –љ–µ –Љ–µ–љ—П–ї—Б—П, —В. –µ. –±—Л–ї –µ–і–Є–љ—Б—В–≤–µ–љ–љ—Л–Љ; –≤ 42 —Б–ї—Г—З–∞—П—Е —А–µ–ґ–Є–Љ –±—Л–ї 1, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Њ 1 –Є–Ј–Љ–µ–љ–µ–љ–Є—О; –≤ 21 —Б–ї—Г—З–∞–µ —А–µ–ґ–Є–Љ–Њ–≤ –±—Л–ї–Њ 3 (2 –Є–Ј–Љ–µ–љ–µ–љ–Є—П); –≤ 9 —Б–ї—Г—З–∞—П—Е –Є—Е –±—Л–ї–Њ 4 (3 –Є–Ј–Љ–µ–љ–µ–љ–Є—П); –Є –≤ 1 —Б–ї—Г—З–∞–µ –Є—Е –±—Л–ї–Њ 5 (4 –Є–Ј–Љ–µ–љ–µ–љ–Є—П). –Т —Б–≤–Њ–µ–Љ –±–Њ–ї—М—И–Є–љ—Б—В–≤–µ (48,8%) –Є–Ј–Љ–µ–љ–µ–љ–Є–µ —А–µ–ґ–Є–Љ–∞ –±—Л–ї–Њ –њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Њ —В–Њ–ї—М–Ї–Њ 1 —А–∞–Ј, –Є –µ—Й–µ –≤ 24,4% вАУ 2 —А–∞–Ј–∞ –Ј–∞ 5 –ї–µ—В –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–≥–Њ –љ–∞–±–ї—О–і–µ–љ–Є—П.
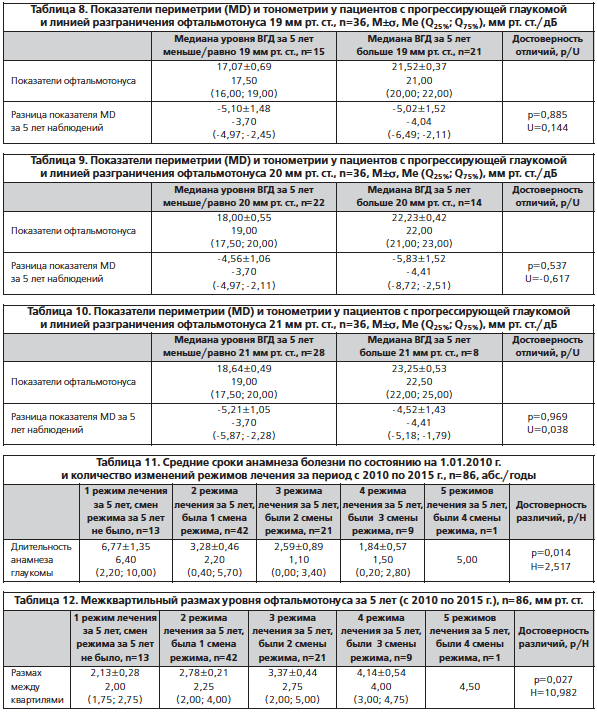
–Т —В–∞–±–ї–Є—Ж–µ 11 –њ—А–Є–≤–µ–і–µ–љ—Л –і–∞–љ–љ—Л–µ –Њ —Б—А–Њ–Ї–µ –∞–љ–∞–Љ–љ–µ–Ј–∞ –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –љ–∞ 1.01.2010 –≥. –Є –Ї–Њ–ї–Є—З–µ—Б—В–≤–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–є —А–µ–ґ–Є–Љ–Њ–≤ –Ј–∞ 5 –ї–µ—В (2010вАУ2015 –≥–≥.).
–Я—А–Є–Љ–µ–љ–µ–љ–љ—Л–є –Ї—А–Є—В–µ—А–Є–є –∞–љ–∞–ї–Є–Ј–∞ (–Ъ—А–∞—Б–Ї–µ–ї–∞ вАУ –£–Њ–ї–ї–Є—Б–∞, –Э=2,517) —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ —В–Њ, —З—В–Њ –≤—Л–±–Њ—А–Ї–∞, —Б–Њ—Б—В–Њ—П—Й–∞—П –Є–Ј 5 –њ–Њ–і–≥—А—Г–њ–њ, –љ–µ —П–≤–ї—П–µ—В—Б—П –Њ–і–љ–Њ—А–Њ–і–љ–Њ–є. –£ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–±–Њ–ї—М—И–Є–Љ –∞–љ–∞–Љ–љ–µ–Ј–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Љ–µ–љ—Л —А–µ–ґ–Є–Љ–Њ–≤ –њ—А–Њ–≤–Њ–і–Є–ї–Є—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ, —З—В–Њ –Ї–Њ—Б–≤–µ–љ–љ–Њ —Г–Ї–∞–Ј—Л–≤–∞–µ—В –љ–∞ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–є –Є—Б—Е–Њ–і–љ—Л–є —Г—А–Њ–≤–µ–љ—М –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —Г —Н—В–Є—Е –≥—А—Г–њ–њ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –Є –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В—М —В—Й–∞—В–µ–ї—М–љ–Њ–≥–Њ –њ–Њ–і–±–Њ—А–∞ –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П. –Э–Є–ґ–µ –њ—А–Є–≤–µ–і–µ–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–љ—Л—Е —Г—А–Њ–≤–љ–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ (–Љ–µ–ґ–Ї–≤–∞—А—В–Є–ї—М–љ—Л–є —А–∞–Ј–Љ–∞—Е), –Ї–Њ—В–Њ—А—Л–µ —В–∞–Ї–ґ–µ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г—О—В –Њ —В–Њ–Љ, —З—В–Њ —Г –ї–Є—Ж —Б –Љ–µ–љ–µ–µ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ –∞–љ–∞–Љ–љ–µ–Ј–Њ–Љ –±—Л–ї–Є –Њ—В–Љ–µ—З–µ–љ—Л –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–µ –Ї–Њ–ї–µ–±–∞–љ–Є—П —Г—А–Њ–≤–љ—П –Т–У–Ф (—В–∞–±–ї. 12).
–Э–∞–Ї–Њ–љ–µ—Ж, –љ–∞ —В—А–µ—В—М–µ–Љ —Н—В–∞–њ–µ —А–∞–±–Њ—В—Л –±—Л–ї–∞ –Є–Ј—Г—З–µ–љ–∞ –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П —А–∞–Ј–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤, –∞ —В–∞–Ї–ґ–µ –≤—Л–і–µ–ї–µ–љ—Л –Њ–і–љ–Њ—А–Њ–і–љ—Л–µ –≥—А—Г–њ–њ—Л, –і–ї—П —З–µ–≥–Њ –±—Л–ї –њ—А–Є–Љ–µ–љ–µ–љ –Ї–ї–∞—Б—В–µ—А–љ—Л–є –∞–љ–∞–ї–Є–Ј –Љ–µ—В–Њ–і–Њ–Љ k-—Б—А–µ–і–љ–Є—Е. –Т —В–∞–±–ї–Є—Ж–µ 13 –њ—А–Є–≤–µ–і–µ–љ—Л –і–∞–љ–љ—Л–µ –Њ —Б—А–µ–і–љ–µ–є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј—Г–µ–Љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤.
–Я—А–µ–і—Б—В–∞–≤–ї–µ–љ–љ—Л–µ –≤ —В–∞–±–ї–Є—Ж–µ 13 –і–∞–љ–љ—Л–µ —Г–Ї–∞–Ј—Л–≤–∞—О—В –љ–∞ –∞–Ї—В–Є–≤–љ–Њ–µ –≤–Ї–ї—О—З–µ–љ–Є–µ –≤ —Б—Е–µ–Љ—Л –ї–µ—З–µ–љ–Є—П –С–С (80 –≥–ї–∞–Ј, 93%), –Я–У (69 –≥–ї–∞–Ј, 80,2%) –Є –Ш–Ъ–Р (44 –≥–ї–∞–Ј–∞, 51,2%). –°—А–µ–і–Є –Љ–µ—В–Њ–і–Њ–≤ –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П –њ—А–µ–Њ–±–ї–∞–і–∞–ї–Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–µ —Б–Є–љ—Г—Б—В—А–∞–±–µ–Ї—Г–ї—Н–Ї—В–Њ–Љ–Є–Є (–°–Ґ–≠) (24 –≥–ї–∞–Ј–∞, 27,9%), –∞ –≤ –Є—В–Њ–≥–µ 30 –≥–ї–∞–Ј –Є–Ј –Њ–±—Й–µ–≥–Њ —З–Є—Б–ї–∞ –±—Л–ї–Є –њ–Њ–і–≤–µ—А–≥–љ—Г—В—Л –Њ–њ–µ—А–∞—В–Є–≤–љ–Њ–Љ—Г –ї–µ—З–µ–љ–Є—О (34,9%). –Я—А–Є –∞–љ–∞–ї–Є–Ј–µ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –≥—А—Г–њ–њ–Є—А–Њ–≤–Ї–Є –Љ–µ—В–Њ–і–Њ–≤ –ї–µ—З–µ–љ–Є—П —Б –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є–µ–Љ –Ї–ї–∞—Б—В–µ—А–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ –±—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ –≤ –њ–µ—А–≤–Њ–Љ –Ї–ї–∞—Б—В–µ—А–µ –±–Њ–ї—М—И–µ –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –С–С, –Ш–Ъ–Р –Є –љ–µ–њ—А–Њ–љ–Є–Ї–∞—О—Й–∞—П –≥–ї—Г–±–Њ–Ї–∞—П —Б–Ї–ї–µ—А—Н–Ї—В–Њ–Љ–Є—П (–Э–У–°–≠), –∞ –≤–Њ –≤—В–Њ—А–Њ–Љ вАУ –Я–У –Є –°–Ґ–≠ (—В–∞–±–ї. 14). –Я—А–Є —Н—В–Њ–Љ –Њ–±–∞ –Ї–ї–∞—Б—В–µ—А–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –Ь-—Е–Њ–ї., –Р–Ь –Є –∞—А–≥–Њ–љ-–ї–∞–Ј–µ—А–љ–Њ–є —В—А–∞–±–µ–Ї—Г–ї–Њ–њ–ї–∞—Б—В–Є–Ї–Є (–Р–Ы–Ґ). –Т —Ж–µ–ї–Њ–Љ —Н—В–Є –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ.

–Э–∞ —А–Є—Б—Г–љ–Ї–µ 3 –њ—А–µ–і—Б—В–∞–≤–ї–µ–љ—Л –≥—А–∞—Д–Є–Ї–Є 2 –Ї–ї–∞—Б—В–µ—А–Њ–≤ –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П —А–∞–Ј–ї–Є—З–љ—Л—Е —А–µ–ґ–Є–Љ–Њ–≤ –Ј–∞ –њ–µ—А–Є–Њ–і 2010вАУ2015 –≥–≥.
–Т–Њ–Ј–Љ–Њ–ґ–љ–Њ—Б—В—М –≤–Њ—Б–њ—А–Њ–Є–Ј–≤–µ–і–µ–љ–Є—П –Љ–Њ–і–µ–ї–Є, –Ї–Њ—В–Њ—А–∞—П –њ–Њ–Ј–≤–Њ–ї–Є—В –њ—А–Њ–≥–љ–Њ–Ј–Є—А–Њ–≤–∞—В—М —В–µ—З–µ–љ–Є–µ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П, –≤—Б–µ –µ—Й–µ –Њ—Б—В–∞–µ—В—Б—П –љ–µ–і–Њ—Б—В–∞—В–Њ—З–љ–Њ –Є–Ј—Г—З–µ–љ–љ–Њ–є –≤ –њ—А–∞–Ї—В–Є—З–µ—Б–Ї–Њ–Љ –Ј–і—А–∞–≤–Њ–Њ—Е—А–∞–љ–µ–љ–Є–Є. –Ъ–Њ–љ–µ—З–љ–Њ, —В–∞–Ї–∞—П –Љ–Њ–і–µ–ї—М –і–Њ–ї–ґ–љ–∞ —Г—З–Є—В—Л–≤–∞—В—М –Љ–љ–Њ–ґ–µ—Б—В–≤–Њ —А–∞–Ј–ї–Є—З–љ—Л—Е —Д–∞–Ї—В–Њ—А–Њ–≤, –Ї —З–Є—Б–ї—Г –Ї–Њ—В–Њ—А—Л—Е —Б–ї–µ–і—Г–µ—В –Њ—В–љ–µ—Б—В–Є –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В—М –∞–љ–∞–Љ–љ–µ–Ј–∞ –±–Њ–ї–µ–Ј–љ–Є. –Т—Л–±–Њ—А –љ–Њ–≤–Њ–≥–Њ –Љ–µ—В–Њ–і–∞ –ї–µ—З–µ–љ–Є—П –Њ—Б–љ–Њ–≤–∞–љ –≤ —В–Њ–Љ —З–Є—Б–ї–µ –Є –љ–∞ —В–Њ–Љ, –Ї–∞–Ї –і–Њ–ї–≥–Њ –Є –Ї–∞–Ї–Є–µ –њ—А–µ–њ–∞—А–∞—В—Л (—Б—Е–µ–Љ—Л) –њ–∞—Ж–Є–µ–љ—В –њ–Њ–ї—Г—З–∞–ї –і–Њ —Н—В–Њ–≥–Њ. –Т —В–∞–±–ї–Є—Ж–µ 15 —Б—Г–Љ–Љ–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л –Ї–ї–∞—Б—В–µ—А–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞, —Г—З–Є—В—Л–≤–∞—О—Й–µ–≥–Њ —Б—А–Њ–Ї –њ—А–µ–і—Л–і—Г—Й–µ–≥–Њ 5-–ї–µ—В–љ–µ–≥–Њ –∞–љ–∞–Љ–љ–µ–Ј–∞ (F=11,90977; p=0,000876).
–°–Њ–≥–ї–∞—Б–љ–Њ —Н—В–Є—Е –і–∞–љ–љ—Л–Љ, –њ–∞—Ж–Є–µ–љ—В—Л, —З–µ–є –і–Њ–Ї—Г–Љ–µ–љ—В–∞–ї—М–љ–Њ –њ–Њ–і—В–≤–µ—А–ґ–і–µ–љ–љ—Л–є –∞–љ–∞–Љ–љ–µ–Ј –≥–ї–∞—Г–Ї–Њ–Љ—Л 5 –ї–µ—В –љ–∞–Ј–∞–і –±—Л–ї –≤ —Б—А–µ–і–љ–µ–Љ –Њ–Ї–Њ–ї–Њ 2,5 –≥–Њ–і–∞, –Ј–∞ –њ–µ—А–Є–Њ–і —Б 2010 –њ–Њ 2015 –≥. –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ —З–∞—Й–µ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є –С–С, –Р–Ы–Ґ –Є –Э–У–°–≠. –Р –≤–Њ—В —Г –±–Њ–ї—М–љ—Л—Е, —З–µ–є –∞–љ–∞–Љ–љ–µ–Ј –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –љ–∞ —П–љ–≤–∞—А—М 2010 –≥. –±—Л–ї –≤—Б–µ–≥–Њ 1,5 –≥–Њ–і–∞, –љ–∞–Є–±–Њ–ї–µ–µ —З–∞—Б—В–Њ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –Я–У. –Ю–±—К—П—Б–љ–µ–љ–Є–µ —Н—В–Њ–є –њ—А–Є—З–Є–љ—Л –Ї—А–Њ–µ—В—Б—П –≤ —Г–Љ–µ—А–µ–љ–љ–Њ–Љ —А–∞—Б–њ—А–Њ—Б—В—А–∞–љ–µ–љ–Є–Є –Я–У –≤ –њ–Њ—Б–ї–µ–і–љ–Є–µ 5 –ї–µ—В, –∞ —В–∞–Ї–ґ–µ –Њ—А–Є–µ–љ—В–∞—Ж–Є–Є –љ–∞ —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–µ –њ—А–µ–њ–∞—А–∞—В—Л –њ–µ—А–≤–Њ–є –ї–Є–љ–Є–Є —В–µ—А–∞–њ–Є–Є.

–°—В—А–∞—В–µ–≥–Є—П –ї–µ—З–µ–љ–Є—П –≥–ї–∞—Г–Ї–Њ–Љ—Л –њ–Њ–і—А–∞–Ј—Г–Љ–µ–≤–∞–µ—В –і–Є—Д—Д–µ—А–µ–љ—Ж–Є—А–Њ–≤–∞–љ–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ—Л—Е –Є—Б—Е–Њ–і–љ–Њ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞. –Э–∞ —Н—В–Њ–Љ —Н—В–∞–њ–µ –Љ—Л —А–∞–Ј–і–µ–ї–Є–ї–Є –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ 2 –≥—А—Г–њ–њ—Л –њ–Њ —Б–Њ—Б—В–Њ—П–љ–Є—О –Љ–µ–і–Є–∞–љ—Л —Г—А–Њ–≤–љ—П –Т–У–Ф –Ј–∞ –њ–µ—А–Є–Њ–і —Б 2010 –њ–Њ 2015 –≥. (—А–Є—Б. 5).
–Ь–µ–і–Є–∞–љ–∞ —Г—А–Њ–≤–љ—П –Т–У–Ф –і–ї—П –Ї–ї–∞—Б—В–µ—А–∞ 1 —Б–Њ—Б—В–∞–≤–Є–ї–∞ 18,25¬±0,32; 19,00 (17,00; 20,00) –Љ–Љ —А—В. —Б—В., –і–ї—П –Ї–ї–∞—Б—В–µ—А–∞ 2 вАУ 21,77¬±0,39; 22,00 (20,00;24,00) –Љ–Љ —А—В. —Б—В. (p<0,001; U=5,728). –Ґ–∞–Ї–Њ–µ –і–µ–ї–µ–љ–Є–µ —Б—В–∞–ї–Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ—Л–Љ –і–ї—П –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –њ—А–µ–і–њ–Њ—З—В–µ–љ–Є–є –≤ –≤—Л–±–Њ—А–µ —А–µ–ґ–Є–Љ–∞. –Т —В–∞–±–ї–Є—Ж–µ 16 –њ—А–Є–≤–µ–і–µ–љ—Л –і–∞–љ–љ—Л–µ –Ї–ї–∞—Б—В–µ—А–љ–Њ–≥–Њ –∞–љ–∞–ї–Є–Ј–∞ —З–∞—Б—В–Њ—В—Л –≤—Л–±–Њ—А–∞ —Б—Е–µ–Љ –ї–µ—З–µ–љ–Є—П –Є –њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Е –њ—А–Є–Љ–µ–љ–µ–љ–Є—П –≤ –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –Њ—В –Є—Б—Е–Њ–і–љ–Њ–≥–Њ —Г—А–Њ–≤–љ—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞.

–Ш–Ј —В–∞–±–ї–Є—Ж—Л 16 –≤–Є–і–љ–Њ, —З—В–Њ –њ–∞—Ж–Є–µ–љ—В—Л —Б –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Ј–∞ 5 –ї–µ—В –±–Њ–ї—М—И–µ –њ–Њ–ї—Г—З–∞–ї–Є –С–С, –∞ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є вАУ –Њ—Б—В–∞–ї—М–љ—Л–µ –≥—А—Г–њ–њ—Л –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є –Є–Љ —З–∞—Й–µ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –Њ–њ–µ—А–∞—Ж–Є–Є (–ї–∞–Ј–µ—А–љ—Л–µ –Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ). –Т–Љ–µ—Б—В–µ —Б —В–µ–Љ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–∞—П –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ—Б—В—М —А–∞–Ј–ї–Є—З–Є–є –±—Л–ї–∞ –Њ–±–љ–∞—А—Г–ґ–µ–љ–∞ –ї–Є—И—М –≤ –і–ї–Є—В–µ–ї—М–љ–Њ—Б—В–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—П –Љ–µ—Б—В–љ—Л—Е –Ш–Ъ–Р (p=0,034), —З—В–Њ, –њ–Њ-–≤–Є–і–Є–Љ–Њ–Љ—Г, —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Є—Е –≤ –Ї–∞—З–µ—Б—В–≤–µ –і–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ–Њ–є —В–µ—А–∞–њ–Є–Є. –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –і–ї—П –Њ–±–Њ–Є—Е –Ї–ї–∞—Б—В–µ—А–Њ–≤ –≤—Б–µ –ї–µ—З–µ–±–љ—Л–µ –њ–Њ–і—Е–Њ–і—Л –±—Л–ї–Є –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –њ—А–Є–±–ї–Є–Ј–Є—В–µ–ї—М–љ–Њ —Б –Њ–і–Є–љ–∞–Ї–Њ–≤–Њ–є —З–∞—Б—В–Њ—В–Њ–є –њ—А–Є–Љ–µ–љ–µ–љ–Є—П.
–Ч–∞–Ї–ї—О—З–µ–љ–Є–µ
–Т –і–∞–љ–љ–Њ–Љ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є–Є –±—Л–ї–Є –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ—Л —А–µ–Ј—Г–ї—М—В–∞—В—Л —Б–Њ—Б—В–Њ—П–љ–Є—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Є –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–љ–Њ–є –љ–∞ –љ–∞—З–∞–ї–Њ 2010 –≥. —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л, –Ї–Њ—В–Њ—А—Л–µ –≤ –Њ–±—П–Ј–∞—В–µ–ї—М–љ–Њ–Љ –њ–Њ—А—П–і–Ї–µ –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –њ–Њ–і –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Є–Љ –љ–∞–±–ї—О–і–µ–љ–Є–µ–Љ –љ–µ –Љ–µ–љ–µ–µ 5 –ї–µ—В. –°—А–µ–і–љ–Є–µ –Ј–љ–∞—З–µ–љ–Є—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Њ—В –Љ–Њ–Љ–µ–љ—В–∞ –і–Є–∞–≥–љ–Њ—Б—В–Є—А–Њ–≤–∞–љ–Є—П –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П –і–Њ —Д–Є–љ–∞–ї—М–љ–Њ–≥–Њ –Њ–±—Б–ї–µ–і–Њ–≤–∞–љ–Є—П –±—Л–ї–Є —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –њ–Њ–љ–Є–ґ–µ–љ—Л (p<0,001; W=7,727). –Ґ–∞–Ї–ґ–µ –±—Л–ї–Є –њ—А–Њ—Б–ї–µ–ґ–µ–љ—Л —Б—А–µ–і–љ–µ–≥–Њ–і–Њ–≤—Л–µ –Ј–љ–∞—З–µ–љ–Є—П —Г—А–Њ–≤–љ—П –Т–У–Ф –≤ —В–µ—З–µ–љ–Є–µ 2010вАУ2015 –≥–≥., –Љ–µ–і–Є–∞–љ—Л –Ј–љ–∞—З–µ–љ–Є–є –Ї–Њ—В–Њ—А—Л—Е –љ–∞—Е–Њ–і–Є–ї–Є—Б—М –≤ –і–Є–∞–њ–∞–Ј–Њ–љ–µ 19вАУ20 –Љ–Љ —А—В. —Б—В., —В. –µ. –њ–Њ–ї–љ–Њ—Б—В—М—О —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Є —В–∞–Ї –љ–∞–Ј—Л–≤–∞–µ–Љ—Л–Љ ¬Ђ–±–µ–Ј–Њ–њ–∞—Б–љ—Л–Љ¬ї —Г—А–Њ–≤–љ—П–Љ, —А–µ–Ї–Њ–Љ–µ–љ–і–Њ–≤–∞–љ–љ—Л–Љ –≤ –љ–∞—Б—В–Њ—П—Й–µ–µ –≤—А–µ–Љ—П –і–ї—П –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л —Б —Г—З–µ—В–Њ–Љ –њ—А–Њ–≤–Њ–і–Є–Љ–Њ–≥–Њ –ї–µ—З–µ–љ–Є—П. –Ґ–µ–Љ –љ–µ –Љ–µ–љ–µ–µ –і–∞–ґ–µ —В–∞–Ї–Є–µ —Г—Б—В–Њ–є—З–Є–≤—Л–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–Є —Г—А–Њ–≤–љ—П –Т–У–Ф –њ—А–Є–≤–µ–ї–Є –Ї –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П. –°—А–µ–і–љ–Є–є –і–µ—Д–µ–Ї—В —Г–≤–µ–ї–Є—З–Є–ї—Б—П –љ–∞ -3,71 (-5,35; -2,28) –і–С, —З—В–Њ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Њ –Є–Ј–Љ–µ–љ–µ–љ–Є—О –±–Њ–ї–µ–µ —З–µ–Љ –љ–∞ 0,65 –і–С/–≥–Њ–і –Є —Е–∞—А–∞–Ї—В–µ—А–Є–Ј—Г–µ—В –Љ–µ–і–ї–µ–љ–љ–Њ –њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й—Г—О —Д–Њ—А–Љ—Г –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –њ–Њ–Ї–∞–Ј–∞—В–µ–ї–µ–є –њ–µ—А–Є–Љ–µ—В—А–Є–Є –њ–Њ–Ј–≤–Њ–ї–Є–ї —А–∞–Ј–і–µ–ї–Є—В—М –≤—Б–µ—Е –њ–∞—Ж–Є–µ–љ—В–Њ–≤ –љ–∞ 2 –≥—А—Г–њ–њ—Л. –Т 1-–є –≥—А—Г–њ–њ–µ –Є–Ј–Љ–µ–љ–µ–љ–Є–µ –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—П —Б—А–µ–і–љ–µ–≥–Њ –Њ—В–Ї–ї–Њ–љ–µ–љ–Є—П (MD) –±—Л–ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –љ–µ–і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ –њ—А–Є —Б—А–µ–і–љ–µ–Љ —Г—А–Њ–≤–љ–µ –Т–У–Ф, —А–∞–≤–љ–Њ–Љ 19,00 (18,00; 21,00) –Љ–Љ —А—В. —Б—В., –≤ —В–Њ –≤—А–µ–Љ—П –Ї–∞–Ї –≤–Њ 2-–є –≥—А—Г–њ–њ–µ —В–∞–Ї–Є–µ –Є–Ј–Љ–µ–љ–µ–љ–Є—П –±—Л–ї–Є –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є (—Б—А–µ–і–љ–Є–є —Г—А–Њ–≤–µ–љ—М –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —Б–Њ—Б—В–∞–≤–Є–ї 20,00 (18,75; 21,00) –Љ–Љ —А—В. —Б—В.)). –Т —Б–≤–Њ—О –Њ—З–µ—А–µ–і—М –≥—А—Г–њ–њ–∞ –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є –њ–Њ–ї–µ–є –Ј—А–µ–љ–Є—П –±—Л–ї–∞ —А–∞–Ј–і–µ–ї–µ–љ–∞ –љ–∞ 2 –њ–Њ–і–≥—А—Г–њ–њ—Л вАУ —Б –Љ–µ–љ–µ–µ –Є –±–Њ–ї–µ–µ –≤—Л—А–∞–ґ–µ–љ–љ—Л–Љ–Є –Є–Ј–Љ–µ–љ–µ–љ–Є—П–Љ–Є. –С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Н—В–Є—Е –њ–Њ–і–≥—А—Г–њ–њ —Г—А–Њ–≤–µ–љ—М –Т–У–Ф –љ–µ –Њ—В–ї–Є—З–∞–ї—Б—П –Љ–µ–ґ–і—Г —Б–Њ–±–Њ–є (20,00 (17,50; 21,00) –Љ–Љ —А—В. —Б—В. –Є 20,50 (19,00; 21,00) –Љ–Љ —А—В. —Б—В., p=0,354; U=0,927). –Ґ–∞–Ї–Є–Љ –Њ–±—А–∞–Ј–Њ–Љ, –Ј–љ–∞—З–µ–љ–Є—П —А–∞–Ј–ї–Є—З–Є–є —Б—А–µ–і–љ–Є—Е –Ј–љ–∞—З–µ–љ–Є–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ —Г –ї–Є—Ж —Б–Њ —Б—В–∞–±–Є–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ–Њ–є –Є –±—Л—Б—В—А–Њ–њ—А–Њ–≥—А–µ—Б—Б–Є—А—Г—О—Й–µ–є –≥–ї–∞—Г–Ї–Њ–Љ–Њ–є —Б–Њ—Б—В–∞–≤–Є–ї–Є 1,5 –Љ–Љ —А—В. —Б—В. –Ф–Њ–њ–Њ–ї–љ–Є—В–µ–ї—М–љ—Л–є –∞–љ–∞–ї–Є–Ј –Ј–∞–≤–Є—Б–Є–Љ–Њ—Б—В–Є –њ—А–Њ–≥—А–µ—Б—Б–Є—А–Њ–≤–∞–љ–Є—П –Њ—В –Њ—В–і–µ–ї—М–љ—Л—Е –∞–±—Б–Њ–ї—О—В–љ—Л—Е –Ј–љ–∞—З–µ–љ–Є–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ (19, 20 –Є–ї–Є 21 –Љ–Љ —А—В. —Б—В.) –љ–µ –≤—Л—П–≤–Є–ї —А–∞–Ј–ї–Є—З–Є–є –≤–Њ –≤—Б–µ—Е —Б–ї—Г—З–∞—П—Е (p>0,05). –≠—В–Њ –Ј–љ–∞—З–Є—В, —З—В–Њ –≤—Б–µ 3 –Ј–љ–∞—З–µ–љ–Є—П –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –≤ —Г–Ї–∞–Ј–∞–љ–љ–Њ–Љ –≤—Л—И–µ –і–Є–∞–њ–∞–Ј–Њ–љ–µ –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л –≤ —В–µ–Ї—Г—Й–Є—Е –∞–ї–≥–Њ—А–Є—В–Љ–∞—Е –ї–µ—З–µ–љ–Є—П, –љ–Њ –њ—А–Є–Њ—А–Є—В–µ—В—Л –і–Њ–ї–ґ–љ—Л –±—Л—В—М –Њ—В–і–∞–љ—Л –Є—Е –Љ–Є–љ–Є–Љ–∞–ї—М–љ–Њ–Љ—Г –њ–Њ–Ї–∞–Ј–∞—В–µ–ї—О.

–С—Л–ї–Њ —Г—Б—В–∞–љ–Њ–≤–ї–µ–љ–Њ, —З—В–Њ —Г –њ–∞—Ж–Є–µ–љ—В–Њ–≤ —Б –љ–µ–њ—А–Њ–і–Њ–ї–ґ–Є—В–µ–ї—М–љ—Л–Љ –∞–љ–∞–Љ–љ–µ–Ј–Њ–Љ –Ј–∞–±–Њ–ї–µ–≤–∞–љ–Є—П —Б–Љ–µ–љ—Л —А–µ–ґ–Є–Љ–Њ–≤ –њ—А–Њ–Є–Ј–≤–Њ–і–Є–ї–Є—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —З–∞—Й–µ, —З—В–Њ —В–∞–Ї–ґ–µ —Б–Њ–Њ—В–≤–µ—В—Б—В–≤–Њ–≤–∞–ї–Њ –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Њ–Љ—Г —А–∞–Ј–Љ–∞—Е—Г –Ј–љ–∞—З–µ–љ–Є–є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Љ–µ–ґ–і—Г –Ї–≤–∞—А—В–Є–ї—П–Љ–Є. –Т —Ж–µ–ї–Њ–Љ —Н—В–Њ —Б–≤–Є–і–µ—В–µ–ї—М—Б—В–≤—Г–µ—В –Њ –љ–µ–Њ–±—Е–Њ–і–Є–Љ–Њ—Б—В–Є –±–Њ–ї–µ–µ —З–∞—Б—В–Њ–є —Б–Љ–µ–љ—Л —В–µ—А–∞–њ–Є–Є. –Ъ–ї–∞—Б—В–µ—А–љ–∞—П –≥—А—Г–њ–њ–Є—А–Њ–≤–Ї–∞ —А–µ–Ј—Г–ї—М—В–∞—В–Њ–≤ –Њ–њ—А–µ–і–µ–ї–Є–ї–∞, —З—В–Њ –≤ –Ї–ї–∞—Б—В–µ—А–µ 1 –±–Њ–ї—М—И–µ –≤—А–µ–Љ–µ–љ–Є –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –С–С, –Ш–Ъ–Р –Є –Э–У–°–≠, –∞ –≤ –Ї–ї–∞—Б—В–µ—А–µ 2 –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–ї–Є—Б—М –Я–У –Є –°–Ґ–≠. –Я—А–Є —Н—В–Њ–Љ –Њ–±–∞ –Ї–ї–∞—Б—В–µ—А–∞ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ–Њ –љ–µ –Њ—В–ї–Є—З–∞–ї–Є—Б—М –њ–Њ –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ–Є—О –Ь.-—Е–Њ–ї., –Р–Ь –Є –ї–∞–Ј–µ—А–љ–Њ–є —Е–Є—А—Г—А–≥–Є–Є, –Є, –≤–Њ–Њ–±—Й–µ, —Н—В–Є –Љ–µ—В–Њ–і—Л –ї–µ—З–µ–љ–Є—П —В–∞–Ї–ґ–µ –њ—А–Є–Љ–µ–љ—П–ї–Є—Б—М –Ј–љ–∞—З–Є—В–µ–ї—М–љ–Њ —А–µ–ґ–µ. –Я–∞—Ж–Є–µ–љ—В—Л —Б –±–Њ–ї–µ–µ –љ–Є–Ј–Ї–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞ –Ј–∞ 5 –ї–µ—В —З–∞—Й–µ –њ–Њ–ї—Г—З–∞–ї–Є –С–С, –∞ –ї–Є—Ж–∞ —Б –±–Њ–ї–µ–µ –≤—Л—Б–Њ–Ї–Є–Љ–Є –Ј–љ–∞—З–µ–љ–Є—П–Љ–Є вАУ –Њ—Б—В–∞–ї—М–љ—Л–µ –≥—А—Г–њ–њ—Л –ї–µ–Ї–∞—А—Б—В–≤–µ–љ–љ—Л—Е –њ—А–µ–њ–∞—А–∞—В–Њ–≤, –Є –Є–Љ —З–∞—Й–µ –≤—Л–њ–Њ–ї–љ—П–ї–Є—Б—М –Њ–њ–µ—А–∞—Ж–Є–Є (–ї–∞–Ј–µ—А–љ—Л–µ –Є —В—А–∞–і–Є—Ж–Є–Њ–љ–љ—Л–µ), –Њ–і–љ–∞–Ї–Њ —Б—В–∞—В–Є—Б—В–Є—З–µ—Б–Ї–Є –і–Њ—Б—В–Њ–≤–µ—А–љ—Л–µ —А–∞–Ј–ї–Є—З–Є—П –±—Л–ї–Є –њ–Њ–ї—Г—З–µ–љ—Л –ї–Є—И—М –њ—А–Є –њ—А–Є–Љ–µ–љ–µ–љ–Є–Є –Љ–µ—Б—В–љ—Л—Е –Ш–Ъ–Р.
–†–µ–Ј—Г–ї—М—В–∞—В—Л –і–∞–љ–љ–Њ–≥–Њ –Є—Б—Б–ї–µ–і–Њ–≤–∞–љ–Є—П —Б —Г—З–µ—В–Њ–Љ –љ–µ–±–Њ–ї—М—И–Њ–≥–Њ –Ї–Њ–ї–Є—З–µ—Б—В–≤–∞ –њ—А–Њ–∞–љ–∞–ї–Є–Ј–Є—А–Њ–≤–∞–љ–љ—Л—Е –і–∞–љ–љ—Л—Е –і–Њ–ї–ґ–љ—Л –±—Л—В—М –њ—А–Њ–і–Њ–ї–ґ–µ–љ—Л –Є –Љ–Њ–≥—Г—В –±—Л—В—М –Є—Б–њ–Њ–ї—М–Ј–Њ–≤–∞–љ—Л —Б —Ж–µ–ї—М—О –Њ–њ—А–µ–і–µ–ї–µ–љ–Є—П –Њ–њ—В–Є–Љ–∞–ї—М–љ—Л—Е –≥—А–∞–љ–Є—Ж –Њ—Д—В–∞–ї—М–Љ–Њ—В–Њ–љ—Г—Б–∞, –∞ —В–∞–Ї–ґ–µ –њ—А–Є –≤—Л–±–Њ—А–µ –Њ–њ—В–Є–Љ–∞–ї—М–љ–Њ–≥–Њ –њ—А–µ–њ–∞—А–∞—В–∞ (–Њ–≤) –љ–∞ —Б—В–∞—А—В–µ –ї–µ—З–µ–љ–Є—П –Є –њ—А–Є –і–Є–љ–∞–Љ–Є—З–µ—Б–Ї–Њ–Љ –љ–∞–±–ї—О–і–µ–љ–Є–Є –±–Њ–ї—М–љ—Л—Е —Б —А–∞–Ј–≤–Є—В–Њ–є —Б—В–∞–і–Є–µ–є –≥–ї–∞—Г–Ї–Њ–Љ—Л.












