В России топотекан (Гикамтин) зарегистрирован для лечения рецидивирующего рака яичников в качестве монотерапии, в виде 30–минутной инфузии по 1,5 мг/м2/сут., с 1–го по 5–й дни каждые 3 недели. В III фазе исследования по сравнительной оценке топотекана и паклитаксела в качестве химиотерапии II–й линии у 226 как резистентных, так и чувствительных к препаратам платины пациенток, топотекан превзошел паклитаксел по непосредственной эффективности (общий ответ на терапию топотеканом составил 20,5% по сравнению с 14% при лечении паклитакселом) при сравнимой медиане выживаемости (63 недели в группе топотекана и 53 недели в группе паклитаксела, р=0,2) [2]. Основным видом токсичности в группе больных, получавших топотекан, была гематологическая тоскичность с высокой частотой нейтропений III–IV степени (79% против 23% р<0,01), которая была некумулятивной и управляемой, в отличие от часто встречающейся периферической полинейропатии при использовании паклитаксела, которая наблюдалась у 31% пациенток и нередко приводила к вынужденному прекращению лечения. Нейтропения на фоне топотекана продолжается в среднем 7 дней и не столь часто является поводом для отмены терапии. Подобный профиль гематологической токсичности, как правило, позволяет проводить терапию топотеканом в течение длительного времени.
В сравнительном исследовании пегилированного липосомального доксорубицина (ПЛД) и топотекана у 474 пациенток с рецидивами рака яичников частота общего ответа, времени до прогрессирования были сравнимы при достоверно лучшей медиане выживаемости для группы ПЛД (86,1 недель по сравнению с 63,3 недель, p=0,01), однако качество жизни пациенток в группе, получавших топотекан оказалось достоверно лучше [3]. Вероятно, этот факт объясняется значительно менее выраженной негематологической токсичностью топотекана. В группе больных, получавших топотекан, частота стоматита составила 15%, мукозитов – 3% и ладонно–подошвенного синдрома – в 1% случаев, по сравнению с 40%, 14% и 49% соответственно в группе ПЛД. Именно негематологическая токсичность ПЛД лимитирует его длительное применение у пациенток с РЯ.
В сравнительном исследовании топотекана и гемцитабина у 112 больных с платинорезистентными рецидивами РЯ, как по непосредственным, так и отдаленным результатам, топотекан достоверно превзошел гемцитабин: клиническое улучшение наблюдалось у 56% на фоне топотекана и у 23,2% на фоне гемцитабина, а средняя выживаемость составила 16,8 месяцев и 8,2 месяца соответственно [4]. Частота нейтропении IV ст. при этом была сравнима в обеих группах. Согласно результатам вышеизложенных основных исследований III фазы, топотекан оказался либо сравнимым, либо показал преимущества по сравнению с препаратами сравнения (паклитаксел, гемцитабин, ПЛД) при низко выраженной негематологической токсичности. [2,3,4,5]
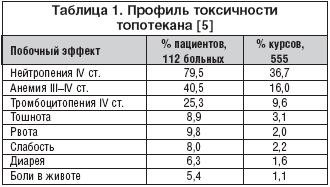
И все же рекомендуемый стандартный режим сопровождается высоким уровнем миелосупрессии: по данным Bookman, нейтропения IV ст. отмечалась у 79,5% больных, у 6% – фебрильная нейтропения [5]. Профиль токсичности стандартного режима топотекана представлен в таблице 1.
Гематологическая токсичность в ряде случаев требует отсрочки терапии, редукции дозы препарата и применения гранулоцитарного колониестимулирующего фактора.
С целью снижения токсичности при сохранении эффективности с 2000 года ведется поиск альтернативных доз и режимов введения различных химиотерапевтических препаратов. В частности, еженедельное введение паклитаксела продемонстрировало высокую эффективность и при этом низкий уровень негематологической токсичности у пациенток с раком яичников [7].
Разработка еженедельного режима топотекана (Гикамтина) основана на данных экспериментальных исследований. В преклинических исследованиях на ксенографтных моделях опухоли толстой кишки фармакокинетика еженедельного введения топотекана и его введения в режиме несколько раз в неделю была схожей, причем эффективность топотекана зависела от дозы введенного препарата [7]. На опухолевых клеточных линиях ученые отметили изменения внутриклеточной топоизомеразы I под воздействием топотекана, и при этом снижалась чувствительность опухоли к последующему введению цитостатика. К исходному уровню топоизомераза I возвращалась только через 7 дней [8]. Эти преклинические данные послужили предпосылкой к изучению еженедельного введения препарата.
Homesley et al. [10] определили максимально переносимую дозу болюсного 30–минутного введения топотекана – 4 мг/м2, с дозолимитирующей токсичностью II степени в виде анемии и диареи. При назначении препарата в данном дозовом режиме не требовалось применение поддерживающей терапии Г–КСФ. Таким образом, активную дозу топотекана для еженедельного введения, при минимальной токсичности, стали искать в дозовом диапазоне между 2 мг/м2 и 4 мг/м2.
Bhoola S.M. et al. [11] провели ретроспективное исследование еженедельного введения топотекана у пациенток, получивших более 2 линий химиотерапии по поводу рецидива рака яичников, причем все 50 пациенток получали комбинацию паклитаксела и карбоплатина, 31 больная – липосомальный доксорубицин, 4 – гемцитабин, 6 пациенток ранее получали топотекан в стандартном режиме и 37 пациенток – другие цитостатики. Двадцать четыре (24) пациентки получили по две линии химиотерапии, 10 пациенток – по 3, 16 пациенток – по 4 и более. Было оценено 50 больных, которые получили 2444 недельных курса химиотерапии топотеканом в виде болюсов – 3,7 мг/м2, в дни 1, 8, 15. Гематологическая токсичность была невыраженной: нейтропения III–IV ст. отмечалась у 18% пациенток, анемия III–IV ст. – у 24%, тромбоцитопения III–IV ст. наблюдалась в 10% случаев. Из–за гематологической токсичности было отложено 9% циклов химиотерапии, и у 6% больных использовался Г–КСФ. У 62% пациентов в связи с анемией II–III ст. применяли эритропоэтин. Только у одной пациентки развилась фебрильная нейтропения, которая была транзиторной и краткосрочной. Данный режим сопровождался низким уровнем негематологической токсичности, отмечалась слабость III ст. в 4% случаев и I–II ст. – у 14% больных. Авторы высказывают мнение, что слабость при использовании топотекана, вероятнее всего, носит вторичный по отношению к анемии характер, и при активном использовании эритропоэтина от этого вида токсичности, которая и обусловливает основные жалобы больных, удается избавиться. Частота объективного ответа составила 31%, с продолжительностью эффекта 3 месяца, стабилизация заболевания отмечалась в 43% случаев с продолжительностью 3,5 месяца. Из 50 пациенток по маркеру СА–125 было оценено только 7, у 29% из них отмечалась частичная регрессия опухоли и у 29% – стабилизация процесса, причем у одной пациентки длительность стабилизации составила 14 месяцев. У 23 оцененных пациенток с платиночувствительным вторым рецидивом в 39% случаев отмечался частичный эффект и у 43% отмечалась стабилизация заболевания. Из 19 больных с платинорезистентным или рефрактерным заболеванием у 21% был частичный эффект и у 37% – стабилизация. Было неожиданным, что из 6 больных, которые ранее получали стандартный режим топотекана и затем прогрессировали, отмечалась частичная ремиссия у 2 пациенток и у 1 – стабилизация заболевания. Исходя из результатов исследования, авторы делают вывод о весьма высокой эффективности данного режима, причем это касается даже неоднократно леченных пациенток, при гораздо менее выраженной токсичности по сравнению со стандартным режимом назначения топотекана.
В 2005 году были опубликованы очень интересные данные Morris R. et al. [12] II фазы исследования еженедельного болюсного введения топотекана в дозе 4 мг/м2 у 41 пациентки с платиночувствительным рецидивом рака яичников. В данном протоколе перерыва в терапии не предусматривалось, и в среднем было проведено по 10 еженедельных (от 1 до 45) введений топотекана. Частота объективного эффекта отмечалась у 28% больных и стабилизация заболевания – у 33%, при медиане времени до прогрессирования 30 недель. Нейтропения III и IV степени наблюдались у 19% пациенток, что привело к отсрочке химиотерапии в 2% курсов. Анемия III–IV ст. была отмечена в 9,7% случаев, а тромбоцитопения III–IV ст. – в 7,3%. Из негематологической токсичности отмечались тошнота III–IV ст. у 7,3% пациентов, рвота III–IV ст. и диарея III–IV ст. в 4,8% и 2,4% случаев соответственно. Слабость III–IV ст. наблюдалась у 25% больных.
В 2004 году Rodriguez M. et al. [13] опубликовали предварительные данные II фазы исследования еженедельного введения топотекана в дозе 4 мг/м2 в дни 1, 8, 15, 28–дневного цикла химиотерапии, с последующим повышением дозы до 5 мг/м2 при хорошей переносимости цитостатика. Оценено было 15 пациенток с платиночувствительным рецидивом; в среднем проведено 2 (от 1 до 8) курса химиотерапии. Общий эффект составил 20% и у 40% пациенток отмечалась стабилизация болезни при медиане времени до прогрессирования 26,4 недели. Нейтропения IV ст. наблюдалась у 13,3% больных, случаев фебрильной нейтропении не отмечалось, анемия IV ст. наблюдалась у 6,7% пациенток. Негематологической токсичности не отмечалось. Окончательные результаты лечения топотеканом в дозе 5 мг/м2 будут опубликованы позже.
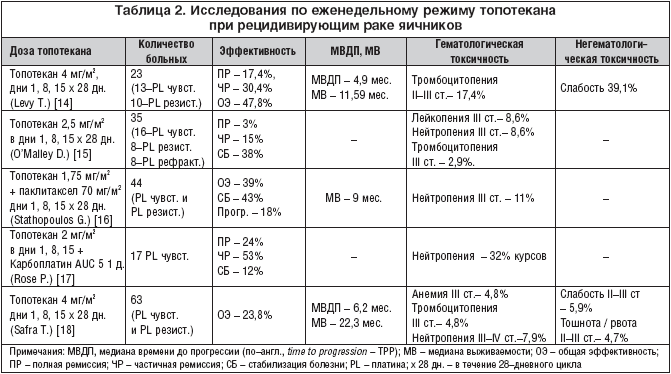
В таблице 2 представлены исследования топотекана в режиме еженедельного введения, как в монотерапии, так и в комбинациях с другими цитостатиками.
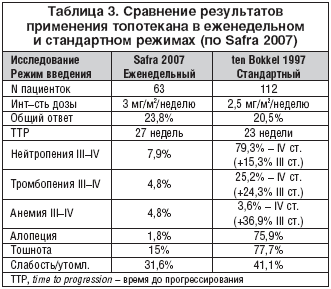
В 2007 году Safra T. et al. опубликовали результаты недавно проведенного исследования еженедельного приема топотекана у 63 пациенток. Топотекан назначался в дозе 4 мг/м2 в дни 1, 8 и 15, в течение 28–дневного цикла. Авторы, помимо обсуждения полученных результатов, говорящих об эффективности и хорошей переносимости предложенной терапии, приводят сравнение различных режимов введения препарата, исследование которых проводилось в разные годы. В частности, сравнение результатов, полученных в данном исследовании – Safra 2007 (еженедельный режим) и в исследовании III фазы ten Bokkel 1997 (стандартный режим), приведено в таблице 3.
Появление в последнее время «таргетных» препаратов открыло возможность их исследования в комбинации с топотеканом. При раке яичников повышенная экспрессия рецептора эпидермального фактора роста (EGFR) обнаруживается в 35–70% случаев и коррелирует с неблагоприятным прогнозом. В связи с этим Slomovitz B. et al. [19] использовали гефитиниб (Иресса) – ингибитор EGFR – в дозе 250 мг/сутки, ежедневно в сочетании с топотеканом в возрастающей дозе: 2,0 мг/м2 в дни 1, 8, 15 (цикл 28 дней) до 4 мг/м2, в те же дни при платинорезистентных рецидивах рака яичников. 13 больным было проведено 45 циклов лечения топотеканом, у 12 пациенток проведена оценка токсичности, у 11 – оценка эффективности протокола. Топотекан в трех различных дозировках – 2, 3 и 4 мг/м2 – получили 3, 3 и 7 пациенток соответственно. Из 11 оцененных пациенток, у которых в анамнезе было от 2 до 4 линий химиотерапии, стабилизация заболевания отмечена у 4 больных. Токсичность III–IV ст. была представлена только тромбоцитопенией у одной пациентки (!). Исследование продолжается, и, по мнению авторов, его результаты могут оказаться весьма многообещающими.
Таким образом, в настоящее время продолжается активная работа по изучению еженедельных режимов введения топотекана как в виде монотерапии, так и в комбинации с другими препаратами. Использование данного режима введения, по мнению многих авторов, позволяет существенно снизить токсичность химиотерапии при сохранении ее эффективности.
Литература
1. Давыдов М.И. Аксель Д. Статистика злокачественных новообразований в России в 2004 году
2. Ten Bokkel Huinink W, et al. Topotecan versus paclitaxel for the treatment of recurrent epithelian ovarian cancer. J.Clin. Oncol. 1997;15:2183–2193
3. Gordon A.N, et al. Recurrent epithelial ovarian carcinoma: a randomized phase III study of pegylated liposomal doxorubicin versus topotecan. J Clin. Oncol 2001;19:3312–22.
4. Prasad M., et al. Cost of treatment and outcomes associated with second–line therapy and greater for relapsed ovarian cancer. Gynecologic Oncology 2004 (93): 223–228.
5. Bookman M.N., et al. Topotecan for the treatment of advanced epithelial ovarian cancer: an open–label phase II study in patients treated after prior chemotherapy that contained cisplatin or carboplatin and paclitaxel. J Clin Oncol 1998;16: 3345–52.
6. McCabe F., et al. Comparative activity of oral and parenteral topotecan in murine tumor models: efficacy of oral topotecan. Cancer Invest 1994;12:308–13
7. Markman M., et al. Phase II trial of weekly single–agent paclitaxel in platinum/paclitaxel–refractory ovarian cancer. J Clin Oncol 2002;20:2365–9
8. Bence A., et al. Evaluation of topotecan cytotoxicity and topoisomerase I levels in non–small cell lung cancer cells. Proc Am Assoc Cancer Res 2002;43:247; abst 1227.
9. Rose P.G., et al. A phase II and pharmacokinetic study of weekly 72–h topotecan infusion in patients with platinum–resistant and paclitaxel–resistant ovarian carcinoma. Gynecol Oncol 2000;78:228–34.
10. Homesley H.D, et al. A dose–escalating study of weekly bolus topotecan in previously treated ovarian cancer patients. Gynecol Oncol 2001;83:394–9.
11. Bhoola S.M., et al. Retrospective analysis of weekly topotecan as salvage therapy in relapsed ovarian cancer. Gynecol Oncol 2004;95:564–569.
12. Morris R., et al. Phase II study of weekly topotecan in patients with relapsed platinum–sensitive ovarian or peritoneal cancer. ASCO 2005: 5058 abst.
13. Rodriguez M., et al. A preliminary report of a phase II study of weekly topotecan in platinum–sensitive recurrent ovarian and peritoneal carcinoma. ASCO 2004 abst.5063.
14. Levy T., et al. Phase study of weekly topotecan in patients with recurrent or persistent epithelial ovarian cancer. Gynecol Oncol 2003: 88(2) 136–40.
15. O’Malley D., et al. Weekly topotecan in heavily pretreated patients with recurrent epithelial ovarian carcinoma. Gynecol Oncol 2005:98;242–8.
16. Stathopoulos G., Malamos N. Weekly administration of topotecan–paclitaxel as second–line treatment in ovarian cancar. Cancar Chemother Pharmacol 2006.
17. Rose P., et al. A phase I / II trial of weekly topotecan and carboplatin in potentially–sensitive relapsed ovarian and peritoneal carcinoma. Gynecol Oncol 2005: 99:714–9.
18. Safra T., et al. Efficacy and toxicity of weekly topotecan in recurrent epithelial ovarian and primary peritoneal cancer. Gynecol Oncol 2007, doi:10.1016/j.ygyno.2006.11.017
19. Slomovitz B.M., et al. Phase 1 study of weekly topotecan and gefitinib in patients with platinum–resistant ovarian, peritoneal, or fallopian tube cancer. ASCO 2006, abst.5090.












