– Уважаемый Борис Сергеевич, какова актуальность данной проблемы?
– Инфекции верхних дыхательных путей принадлежат к числу заболеваний, часто встречающихся в амбулаторной практике. При этом наиболее значимым бактериальным возбудителем является β-гемолитический стрептококк группы А (БГСА). Хорошо известно, что при БГСА-инфекциях глотки возможно развитие ранних гнойных (абсцессы, флегмоны) и поздних иммуноопосредованных (острая ревматическая лихорадка (ОРЛ), постстрептококковый гломерулонефрит) осложнений, которые могут быть успешно предупреждены своевременным назначением адекватной антибактериальной терапии (АБТ).
С учетом чрезвычайной актуальности данной проблемы вполне объяснимо пристальное внимание к ней со стороны национальных и международных научных медицинских ассоциаций. Так, в течение 5-ти предыдущих лет увидели свет обновленные варианты рекомендаций, подготовленных группами экспертов Американской кардиологической ассоциации (American Heart Association (AHA)) и Американской академии педиатрии (American Academy of Pediatrics (AAP)) [1], а также Американского общества инфекционных болезней (Infectious Disease Society of America (IDSA)) [2].
– Имеются ли проблемы терминологии?
– Да, конечно. Обращают на себя внимание явные различия в отечественной и зарубежной нозологической терминологии.
Острый тонзиллит (ангина) – это воспаление одного или нескольких лимфоидных образований глоточного кольца, чаще небных миндалин, имеющее большей частью стрептококковую, реже – вирусную этиологию. Под острым фарингитом понимают воспаление слизистой оболочки глотки преимущественно вирусного генеза. В соответствии с Международной классификацией болезней X пересмотра выделяют стрептококковый фарингит (J02.0) и стрептококковый тонзиллит (J03.0). Однако в зарубежной литературе широко используются взаимозаменяемые термины «тонзиллофарингит» и «фарингит». На наш взгляд, подобное смешение понятий, которое в последние годы стало встречаться, к сожалению, и в отечественной медицинской литературе, представляется не совсем корректным с учетом различий этиопатогенеза и патоморфологии, а также практических подходов к терапии. В определенной степени можно согласиться с термином «тонзиллофарингит» с учетом возможного сочетания симптоматики тонзиллита и фарингита, особенно в педиатрической практике. В то же время вести речь о поражении миндалин (нередко гнойном), протекающем в рамках состояния, которое диагностируется как «фарингит» (?), представляется абсурдным с точки зрения русскоязычной терминологии. Более того, широкое применение термина «фарингит» (который, как указывалось выше, ассоциируется преимущественно с вирусной инфекцией) может повлечь за собой необоснованный отказ от назначения антибиотиков в тех клинических ситуациях, в которых эти препараты необходимы. Поэтому в отечественных практических рекомендациях указанные термины разделены (тонзиллит/фарингит) [3].
– Каковы эпидемиологические данные по БГСА-инфекциям глотки?
– Точные данные официальной статистики по БГСА-инфекциям отсутствуют. Однако, согласно результатам американских исследователей, практически каждый ребенок, достигший 5-летнего возраста, имеет в анамнезе перенесенную БГСА-инфекцию глотки, а 13-летний – до 3 эпизодов заболевания [4]. Стоимость прямых и косвенных расходов, связанных с каждым случаем БГСА-тонзиллита/фарингита, составляет 205 долларов, а при экстраполяции на все население США – от 224 млн до 539 млн долларов ежегодно [5].
Имеющиеся на сегодняшний день данные свидетельствуют о том, что, по крайней мере, в пределах нескольких следующих 10-летий человечество не сможет быть избавлено от стрептококка этой группы. Таким образом, сохраняется возможность вспышек ОРЛ в различных регионах мира, особенно среди детей в возрасте 7–15 лет. Более того, проведенный В.Д. Беляковым анализ эпидемиологического процесса показал, что в конце ХХ века появилась БГСА-инфекция, являющаяся аналогом таковой прошлых времен, угроза ее распространения нарастает. И в ближайшем будущем предстоит решающее сражение с высоковирулентной агрессивной БГСА-инфекцией, которая в соответствии с ее биологическими характеристиками способна проявить такую же мощь, как и в начале ХХ века [6]. Подтверждением изложенному служат недавние вспышки ОРЛ в США, Италии и Израиле [7–9], а также чрезвычайно высокие показатели заболеваемости данной нозологической формой в Австралии и Океании [10].
– Какие клинические признаки характерны для БГСА-инфекций глотки?
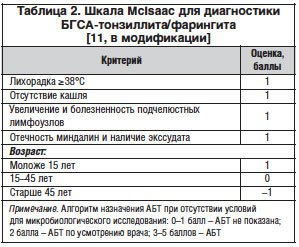
– Выделяют эпидемиологические и клинические признаки, в большей степени присущие БГСА-инфекции глотки или вирусному фарингиту (табл. 1). Однако наибольшее значение в разграничении БГСА-тонзиллита с другими нозологиями имеют лихорадка ≥38°С, отсутствие кашля, отечность миндалин и наличие в них экссудата, увеличение и болезненность подчелюстных лимфоузлов. Эти симптомы составляют основу предложенного R. Centor и модифицированного W. McIsaak клинического алгоритма, который был апробирован на большой группе пациентов (табл. 2). Данный алгоритм позволяет при первом осмотре больного предположить наличие БГСА-инфекции глотки и, соответственно, решить вопрос о назначении эмпирической антимикробной терапии при невозможности дальнейшей этиологической верификации диагноза.
– Как верифицировать БГСА-инфекцию глотки?
– Диагноз БГСА-тонзиллита/фарингита следует подтверждать микробиологическим исследованием мазка с поверхности миндалин и/или задней стенки глотки. Однако у культурального метода имеется ряд недостатков: а) он не позволяет дифференцировать активную инфекцию от БГСА-носительства; б) для выполнения данного исследования требуется 2–3 суток; в) необходимы наличие сертифицированной микробиологической лаборатории и решение ряда организационных вопросов (доставка образцов, наличие персонала, обеспечение транспортом и другое); г) высокая стоимость исследования.
В последние годы все большее распространение получают тестовые системы, основанные на иммунохроматографическом методе. Они позволяют определять БГСА-антиген в течение 5–7 минут и обладают высокой специфичностью и чувствительностью. В России подобный экспресс-тест (Стрептатест) зарегистрирован в 2010 г. Результаты маркетинговых исследований свидетельствуют о необходимости внедрения этого теста в широкую клиническую практику.
Определение титров противострептококковых антител, в частности антистрептолизина-О (АСЛО), при обследовании больного с БГСА-инфекцией глотки является малоинформативным. Повышение титров АСЛО начинается к концу 2-й недели и достигает максимума к 4–5-й неделе от начала болезни, то есть в период, когда клиническая симптоматика БГСА-тонзиллита/фарингита практически полностью регрессирует. Также следует заметить, что нормальные значения вышеуказанного показателя варьируют в зависимости от возраста больного, географического положения местности и сезона. Поэтому, в соответствии с рекомендациями ВОЗ, верхняя граница нормы для противострептококковых антител не должна превышать 20-процентный уровень над популяционными данными, полученными от здоровых лиц определенной возрастной группы, проживающих в конкретном регионе, с учетом времени года. Необходимо, чтобы для каждой серии новых исследований в качестве контроля использовали стандартизованные сыворотки с известным титром противострептококковых антител.

С другой стороны, динамическое повышение титров АСЛО в достаточной степени подтверждает перенесенную А-стрептококковую инфекцию глотки, что является важным компонентом диагностики ОРЛ. При отсутствии ответа на стрептококковый антиген в сочетании с негативными данными микробиологического исследования диагноз ОРЛ представляется маловероятным. Однако уровень стрептококковых антител может быть нормальным, если между началом ОРЛ и проведением исследования прошло более 2 месяцев. Чаще всего это наблюдают у больных ревматической хореей. Подобную закономерность встречают и у пациентов с поздним ревматическим кардитом.
– Каковы современные подходы к антимикробной терапии БГСА-инфекции глотки?
– Выбор антибиотика для лечения БГСА-инфекции глотки основан на следующих принципах: эффективность, безопасность, антимикробный спектр (узкий или широкий), режим дозирования, комплаентность (соблюдение предписанной схемы терапии) и стоимость.
С учетом вышеизложенного пенициллин V (феноксиметилпенициллин) или амоксициллин рассматриваются как средства выбора у больных с хорошей переносимостью этих лекарственных препаратов. Однако оптимальным представляется выбор препарата из группы оральных пенициллинов – амоксициллина. Он по противострептококковой активности аналогичен ампициллину и феноксиметилпенициллину, но существенно превосходит их по своим фармакокинетическим характеристикам, отличаясь большей биодоступностью (95, 40 и 50% соответственно) и меньшей степенью связывания с сывороточными белками (17, 22 и 80% соответственно).
В вышеуказанных рекомендациях предложена новая схема применения амоксициллина, заключающаяся в однократном приеме суточной дозы, составляющей 50 мг/кг, максимум 1 г, в течение 10 дней. Основанием для внедрения указанной схемы послужили результаты 4 сравнительных исследований, в ходе которых было показано, что клиническая и бактериологическая активность амоксициллина, назначавшегося 1 раз в сутки больным с БГСА-инфекцией глотки, была сопоставима с таковой в группах сравнения [12–15]. В то же время эти работы различались как по суточным дозам амоксициллина в исследуемых группах, так и по схемам лечения в контроле. Более того, подобные схемы восприняты отнюдь не однозначно, в частности европейскими авторами, и в настоящее время не одобрены контролирующими органами (Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA), Европейским агентством по лекарственным средствам (EMA)) для первичной профилактики ОРЛ [16, 17].
Назначение ампициллина в пероральной форме для лечения БГСА-тонзиллита, а также инфекций дыхательных путей иной локализации в настоящее время большинством авторов признано нецелесообразным по причине неудовлетворительных фармакокинетических характеристик препарата (в первую очередь – низкой биодоступности).
Применение феноксиметилпенициллина представляется оправданным только у младшего контингента больных, учитывая наличие лекарственной формы в виде суспензии, а также несколько большую комплаентность благодаря контролю со стороны родителей, чего нельзя сказать о подростках. Кроме того, хотелось бы напомнить о специфическом феномене аминопенициллин-ассоциированной кожной сыпи у больных инфекционным мононуклеозом, частота развития которой в современных условиях составляет 29,5% [18]. Поэтому феноксиметилпенициллин рассматривается как препарат выбора в ситуациях, когда у пациента с острым тонзиллитом невозможно быстро исключить диагноз инфекционного мононуклеоза по имеющимся клиническим и лабораторным признакам, а также провести микробиологическое исследование или экспресс-тест на БГСА.
Назначение однократной инъекции бензатин пенициллина целесообразно в следующих случаях, таких как:
- низкая комплаентность больных;
- ОРЛ и/или хроническая ревматическая болезнь сердца (ХРБС) в анамнезе у ближайших родственников;
- неблагоприятные социально-бытовые условия (фактор скученности);
- вспышки БГСА-инфекции в организованных коллективах;
- невозможность перорального приема.
Наряду с пенициллинами заслуживает внимания представитель оральных цефалоспоринов первого поколения цефадроксил, высокая эффективность которого в терапии А-стрептококковых тонзиллитов, а также хорошая переносимость подтверждены в многочисленных клинических исследованиях. Следует помнить, что среди пациентов с непереносимостью пенициллина перекрестные аллергические реакции на цефалоспорины встречаются в 10–15% случаев.

При непереносимости β-лактамных антибиотиков целесообразно назначение макролидов, противострептококковая активность которых сопоставима с таковой для пенициллина. Эти препараты также обладают способностью создавать высокую тканевую концентрацию в очаге инфекции и хорошей переносимостью. Применение эритромицина – первого представителя антибиотиков данного класса в настоящее время существенно уменьшилось, особенно в терапевтической практике, поскольку он наиболее часто по сравнению с другими макролидами вызывает нежелательные эффекты со стороны желудочно-кишечного тракта, обусловленные его стимулирующим действием на моторику желудка и кишечника.
Длительность лечения БГСА-инфекции глотки макролидами составляет 10 дней, азитромицином – 5 дней. Следует отметить, что ранее одобренная Фармкомитетом РФ схема (10 мг/кг/сут в 1 прием в течение 3-х дней, курсовая доза – 30 мг/кг) значительно уступает по бактериологической эффективности как 5-дневной схеме (12 мг/кг/сут в 1 прием в течение 5 дней, курсовая доза – 60 мг/кг), так и препаратам сравнения [19, 20].
Антибиотики линкозамиды (линкомицин, клиндамицин) также обладают высокой противострептококковой активностью, но их назначают при БГСА-тонзиллите только при непереносимости β-лактамов и макролидов.
Схемы антимикробной терапии острого и хронического рецидивирующего А-стрептококкового тонзиллита, принятые в РФ, представлены в таблицах 3 и 4.
– Насколько значимы феномены интернализации и формирования биопленок при БГСА-инфекциях глотки? Как это отражается на схемах лечения?
– В рамках рассматриваемой проблемы вышеназванные микробиологические феномены в последнее время приобретают все большую популярность (иногда искусственно гипертрофированную). Следует отметить, что при сдержанной оценке клинической значимости полученных данных со стороны микробиологов рядом авторов (к сожалению, недостаточно обоснованно и, что крайне важно, без оценки последствий!) предлагается пересмотреть ныне существующие схемы антимикробной терапии и назначать макролиды как препараты первого ряда при хронических формах БГСА-тонзиллитов/фарингитов.
Феномен интернализации заключается в том, что БГСА, являющиеся по сути внеклеточными патогенами, могут проникать внутрь эпителиальных клеток слизистой оболочки дыхательных путей и таким образом быть защищенными от действия β-лактамных антибиотиков. Однако, по данным эксперта ВОЗ по проблемам стрептококковых инфекций проф. Э. Каплана, указанный феномен аналогичен таковому, наблюдаемому у носителей БГСА в верхних дыхательных путях. Подходы к терапии таких пациентов будут рассмотрены далее.
В то же время, как подчеркивает Э. Каплан, феномен интернализации «не следует интерпретировать как указание на то, что макролиды или азалиды являются более эффективными в эрадикации БГСА из верхних дыхательных путей. Врачам следует иметь в виду, что локальные показатели устойчивости БГСА к макролидам остаются достаточно значимыми во многих регионах, особенно за пределами США» [21].
Относительно микробных биопленок можно сказать следующее. В начале этого года был опубликован обзор германских исследователей, в котором подчеркивается, что в силу нарастающей устойчивости БГСА к макролидам последние не являются решением проблемы устранения А–стрептококковых биопленок [22]. Гораздо более перспективным направлением исследований в этой области представляется совместное применение общепринятых терапевтических схем (пенициллины) и кодируемых бактериофагами специфических ферментов – пептидогликангидролаз (эндолизинов), способных разрушать как экзополимерный матрикс биопленки, так и клеточную стенку БГСА [23]. К тому же до настоящего времени сравнительные рандомизированные контролируемые исследования, демонстрирующие клиническую и бактериологическую эффективность макролидов и азалидов при хронических рецидивирующих БГСА-тонзиллитах/фарингитах, ассоциированных с формированием биопленок, не проводились. Следовательно, дозы и схемы применения этих препаратов для подобных больных не разработаны. Поэтому необходимы дальнейшие исследования в данном направлении, которые позволят оценить эффективность подобной тактики и потенциальные риски ее применения как для отдельного пациента (безопасность и переносимость), так и для общества в целом (развитие антибиотикорезистентности) [24].

Необходимо отметить, что на рубеже XX–XXI веков приобретенная устойчивость БГСА к эритромицину была распространена достаточно широко и в ряде стран Европы превышала 20%. Исследования, выполненные в Финляндии, Испании, Италии, Германии, Бельгии, подтвердили, что эта устойчивость, как правило, ассоциируется с потреблением макролидов и является управляемым процессом. Ограничение применения макролидов привело к 2–4-кратному снижению уровня резистентности БГСА к этим препаратам.
По данным многоцентрового проспективного исследования ПеГАС III, в России за период с 2006 по 2009 год резистентность БГСА к макролидам была следующей: эритромицин – 0,8%, кларитромицин – 3,3%, азитромицин – 10%, спирамицин – 1,4%, джозамицин – 1,7%, мидекамицин – 4,1% [25]. Однако эти данные отнюдь не являются поводом для применения макролидов в качестве препаратов выбора для лечения БГСА-инфекций глотки.
Как указывалось выше, препаратами первого ряда в терапии БГСА-тонзиллитов/фарингитов являются β-лактамные антибиотики (в первую очередь пенициллины). В условиях нарастающей резистентности БГСА к макролидам последние необходимо рассматривать лишь как альтернативные средства для лечения А-стрептококкового тонзиллита и назначать их только больным с аллергией на β-лактамы. Несоблюдение данного требования, то есть широкое применение макролидов в качестве стартовой эмпирической терапии БГСА-инфекции глотки может повлечь за собой весьма серьезные последствия вплоть до развития ОРЛ [26]. Поэтому, перефразируя известного политика, не следует создавать самим себе трудности, чтобы потом их героически преодолевать.
Таким образом, феномены интернализации и формирования биопленок не являются основанием для позиционирования макролидов в качестве препаратов первого ряда в терапии хронических БГСА-инфекций глотки.
– Что такое БГСА-носительство и надо ли его лечить?
– В условиях умеренного климата в зимне-весенний период около 20% детей школьного возраста могут быть бессимптомными носителями глоточной БГСА-инфекции. При этом на фоне БГСА-колонизации, которая может длиться 6 и более месяцев, возможно развитие интеркуррентного вирусного фарингита. При обследовании таких больных выявляются доказательства присутствия БГСА в зеве (культуральный метод или экспресс-тест), что в совокупности с клиническими данными может привести к ошибочной диагностике А-стрептококкового тонзиллита/фарингита. Необходимо подчеркнуть, что при длительном наблюдении за БГСА-носителями признаки активного иммунного ответа макроорганизма в виде повышения титров АСЛО или антиДНК-азы B не выявляются. Полагают, что риск развития гнойных, инвазивных и негнойных осложнений (в частности, ОРЛ) у БГСА-носителей очень низкий или отсутствует.
В дифференцировке носительства и хронического рецидивирующего БГСА-тонзиллита/фарингита большое значение придается тщательной оценке имеющегося симптомокомплекса, клиническому ответу на АБТ, наличию или отсутствию БГСА в мазке из зева в межсимптомном периоде.
В большинстве случаев БГСА-носительства АБТ не показана. Однако существуют особые ситуации, при которых назначение антибиотиков оправданно: 1) в период вспышки ОРЛ, постстрептококкового гломерулонефрита или инвазивных БГСА-инфекций в данном регионе; 2) во время вспышки БГСА-тонзиллита/фарингита в закрытых и полузакрытых коллективах (воинские части, интернаты и так далее); 3) при наличии ОРЛ в анамнезе у пациента или ближайших родственников; 4) в семье, члены которой излишне обеспокоены в отношении БГСА-инфекции; 5) при определении показаний к тонзиллэктомии по причине БГСА-носительства. В указанных случаях целесообразны 10-дневные курсы лечения амоксициллином/клавуланатом или клиндамицином.
– Какова роль бактериофагов в современной терапии БГСА-инфекции глотки?
– Терапия фагами в целом представляется, несомненно, перспективной – в первую очередь из-за нарастания устойчивости возбудителей ряда инфекций к антибиотикам. Однако широкое применение этих препаратов и, в частности, стрептококкового фага в настоящее время ограничено в силу следующих обстоятельств.
1. Важным условием эффективной фаготерапии является предварительное определение фагочувствительности возбудителя (выделение от больных штаммов стрептококков, чувствительных к стрептококковому бактериофагу). Отсюда следует необходимость наличия сертифицированной микробиологической лаборатории, способной быстро (!) выполнить настоящее исследование.
2. Стрептококковый бактериофаг выпускается в жидкой лекарственной форме. В связи с этим при пероральном приеме происходит частичная инактивация препарата кислой средой желудка. При местном применении в виде ватных тампонов, смоченных раствором фага и накладываемых на область миндалин, помимо неудобств для больного, возможно тампонирование дыхательных путей (особенно у детей) с развитием асфиксии. Применение препарата в виде ингаляций или орошений как единственного метода лечения ангины представляется малоэффективным, поскольку лекарство быстро смывается слюной при глотании.
3. Не разработаны схемы (с указанием доз и длительности) лечения стрептококковыми фагами. Какие-либо методические рекомендации по этому поводу отсутствуют, вероятно, в силу того, что сравнительные контролируемые исследования не проводились. В инструкции по применению препарата вся информация по этому поводу ограничивается сроком лечения 7–20 дней.
Таким образом, применение стрептококкового фага при БГСА-инфекциях глотки не возбраняется, но обязательно вместе с системной АБТ (но не вместо последней!).
– Каковы современные подходы к вторичной профилактике ревматической лихорадки?
– Всем пациентам, перенесшим документально подтвержденную ОРЛ или страдающим ХРБС в виде поствоспалительного краевого фиброза створок сердечных клапанов либо сформированного порока сердца, назначается вторичная профилактика рецидивов заболевания. Она начинается еще в стационаре и заключается в круглогодичном введении бензатин пенициллина в следующих дозах: детям – 600 тыс. ЕД (масса тела до 27 кг включительно) или 1,2 млн ЕД (масса тела более 27 кг), взрослым – 2,4 млн ЕД внутримышечно каждые 3 недели. Рекомендуемый экспертами АHА и ААP в качестве альтернативы ежедневный пероральный прием пенициллина V или сульфадиазина представляется малоприемлемым. Показана более высокая частота повторных атак ОРЛ у пациентов, принимавших в качестве профилактики пенициллин V (даже при тщательном соблюдении предписанной схемы), по сравнению с таковыми, получавшими бензатин пенициллин [27].
Длительность вторичной профилактики ОРЛ устанавливают индивидуально. Учитывают следующие факторы:
- – возраст больного;
- – наличие ХРБС;
- – время, прошедшее с момента первой атаки болезни;
- – количество предыдущих атак;
- – фактор скученности в семье;
- – семейный анамнез, отягощенный по ОРЛ/ХРБС;
- – социально-экономический и образовательный статус больного;
- – риск стрептококковой инфекции в регионе;
- – профессию и место работы больного (учителя, врачи, лица, работающие в условиях скученности).
Как правило, длительность вторичной профилактики такова:
- – для лиц, перенесших ОРЛ без кардита (артрит, хорея), – не менее 5 лет после последней атаки или до 21-летнего возраста (по принципу «что дольше»);
- – для лиц, перенесших кардит без формирования порока сердца, – не менее 10 лет после последней атаки или до 21-летнего возраста (по принципу «что дольше»);
- – для больных с пороком сердца (в том числе после оперативного лечения) – не менее 10 лет после последней атаки или до 40-летнего возраста (по принципу «что дольше»), в ряде случаев – пожизненно.
Широко практиковавшееся ранее ежедневное применение эритромицина у больных с ОРЛ в анамнезе и непереносимостью β-лактамных антибиотиков в настоящее время нецелесообразно из-за повсеместного нарастания резистентности А-стрептококка к макролидам. В качестве альтернативы у данной категории пациентов может рассматриваться своевременное курсовое лечение макролидами каждого случая верифицированного А–стрептококкового тонзиллита/фарингита.
– Каковы направления будущих исследований по данной проблеме?
– Будущие исследования, по мнению экспертов IDSA, должны быть направлены на: а) совершенствование методов диагностики БГСА-тонзиллита/фарингита с дифференцировкой остропротекающей инфекции и хронического носительства; б) разработку более простых и коротких (но не в ущерб эффективности!) схем лечения упомянутых инфекций; в) разработку доступной, эффективной и безопасной БГСА-вакцины, эффективной в отношении большинства А-стрептококковых штаммов.
Следует отметить, что в настоящее время имеются данные первой фазы клинических испытаний 26-валентной вакцины, содержащей эпитопы М-протеинов так называемых «ревматогенных» штаммов БГСА, которые не вступали в перекрестную реакцию с тканевыми антигенами человеческого организма. Результаты исследований с участием 30 здоровых добровольцев показали, что созданная рекомбинантная вакцина против А-стрептококка стимулирует иммунный ответ без каких-либо признаков токсичности. По мнению создателей, она способна обеспечивать защиту против большинства А-стрептококковых штаммов, в том числе вызывающих острый тонзиллит, синдром стрептококкового токсического шока и некротический фасциит [28].
Упомянутые результаты вселяют определенный оптимизм, но при этом возникает как минимум один вопрос: не приведет ли вызванная вакциной активация иммунной системы пациента к первичной или повторной атаке ОРЛ? Ответ, по всей вероятности, должен быть получен в дальнейших крупномасштабных проспективных исследованиях.
– Спасибо Вам за интервью!








.gif)



