Первое описание – 1958 г., типичный возраст дебюта заболевания – 30–50 лет. Описаны случаи у нескольких членов одной семьи, однако подавляющее большинство – спорадические заболевания, в 70% случаев выявление альвеолярного протеиноза происходит у курильщиков [1,4–7]. Мужчины болеют в 3 раза чаще, чем женщины.
Этиология заболевания не установлена, обсуждается роль генетической мутации генов сурфактантных белков, чаще встречающихся при врожденном альвеолярном протеинозе, и роль мутации ГМ–КСФ. Также для врожденного варианта альвеолярного протеиноза характерна рецессивная мутация рецепторов ГМ–КСФ и нарушение синтеза фосфолипидов [3,5].
Описана мутация замены лизина на глутаминовую кислоту в сурфактантном протеине–С у ребенка с альвеолярным протеинозом, ассоциированным с неспецифической интерстициальной пневмонией [3].
Выявляются ассоциации альвеолярного протеиноза с микобактериальной, грибковой (Nocardia, Cryptococcus) и пневмоцистной инфекцией. Более того, в некоторых случаях таких ассоциированных заболеваний наблюдался регресс альвеолярного протеиноза при лечении сочетанием рифампицина, изониазида, стрептомицина и этамбутола, ассоциированного с туберкулезом легких [1,6,7].
Сочетание альвеолярного протеиноза с ВИЧ–инфекцией быстро приводит к развитию прогрессирующей дыхательной недостаточности.
Обнаружена связь развития альвеолярного протеиноза после контакта с кремниевой пылью [J.M. Xippell, 1977], аллюминиевой пылью [R.R. Miller, 1984], титановой и другими видами, что было воспроизведено в эксперименте – «пылевой» альвеолярный протеиноз на мышах [A.G. Heppleston, 1974], и в эксперименте также подтвержден регресс заболевания после прекращения контакта и проведения бронхоальвеолярного лаважа.
Описаны случаи альвеолярного протеиноза в сочетании с острым и хроническим миелолейкозом, острым лимфобластным лейкозом, миелофиброзом, множественной миеломой. Однако не до конца ясна ассоциация этих заболеваний с альвеолярным протеинозом; вероятнее всего, это следует расценивать, как паранеопластическое проявление. Встречаются редкие описания сочетания альвеолярного протеиноза с солидными опухолями [1,5–7].
При альвеолярном протеинозе обнаружено снижение IgA и повышение ЛДГ, что, по некоторым данным, предлагают рассматривать как отражение активности альвеолярного протеиноза.
Классификация альвеолярного протеиноза разрабатывается [1]. В России используется классификация, принятая НИИ пульмонологии: разделение заболеваний на первичные и вторичные (псевдопротеиноз).
Первичный альвеолярный протеиноз, который, в свою очередь, подразделяется на врожденный и идиопатический:
– врожденный альвеолярный протеиноз – смертность в раннем детском возрасте наступает от быстро прогрессирующей дыхательной недостаточности;
– идиопатический альвеолярный протеиноз – дебют заболевания развивается чаще в возрасте 30–50 лет в результате присоединения вторичной бронхолегочной инфекции;
Вторичный (псевдопротеиноз), связанный с вирусными инфекциями, пневмоцистной пневмонией у лиц с иммуносупрессией, гемобластозами, воздействием неорганической (асбестовой) пыли, токсических паров (особенно при производстве пластмасс), озона, NO2. Этиологию вторичного альвеолярного протеиноза, по различным данным, связывают с курением, контактом с цементной пылью, воспалительными заболеваниями, вызванными инфекционными агентами (Pneumocystis carinii, cryptococcus neoformans и др.), иммунодефицитными состояниями (СПИД, лечение цитотоксическими препаратами), паранеопластическими проявлениями (лейкозы, лимфомы, редко – солидными опухолями)
Анализ уровня онкомаркеров в плазме у пациентов с альвеолярным протеинозом не дал практического результата, ведутся исследования уровня канцер–эмбрионального антигена, СА19–9 и др. в лаважной жидкости, так как часто обнаруживается их повышение при бронхо–альвеалярном лаваже, не связанное с наличием какого–либо онкологического заболевания [6,7].
Интересным представляется распределение частоты встречаемости клинических проявлений при альвеолярном протеинозе [6]:
• Одышка 64%
• Кашель 41%
• Хрипы 28%
• Кровохарканье 21%
• Снижение массы тела 18%
• Лихорадка 16%
• Утолщение концевых фаланг по типу «барабанные палочки» 15%
• Боль в грудной клетке 14%
• Цианоз 14%
Протеиноз врозлых и детей можно верифицировать морфологически. При первичном врожденном альвеолярном протеинозе обращает на себя внимание более гомогенная структура ШИК–положительного эозинофильного вещества (за счет более частого наличия дефекта не только сурфактантных протеинов, но и дефекта синтеза фосфолипидной мембараны) и слабо выраженный фиброз интерстиции.
В препаратах при первичном идиопатическом альвеолярном протеинозе морфологически обнаружены более выраженные фиброзные изменения (за счет частого присоединения бронхолегочной инфекции) и наличие инфильтрации интерстиция лимфоцитами [2,3].
К патогенетическим механизмам развития альвеолярного протеиноза на клеточном уровне и дальнейшему дефекту местной иммунной защиты легочной ткани относят взаимодействие гранулоцитарно–моноцитарного колониестимулирующего фактора (ГМ–КСФ), рецепторов ГМ–КСФ, В–клеток и цитокинов (ИЛ–10, ИЛ–12 и ИЛ–18) [5].
В норме ГМ–КСФ стимулирует дифференцировку моноцитов и катаболизм протеинов сурфактанта (альвеолярными) зрелыми макрофагами.
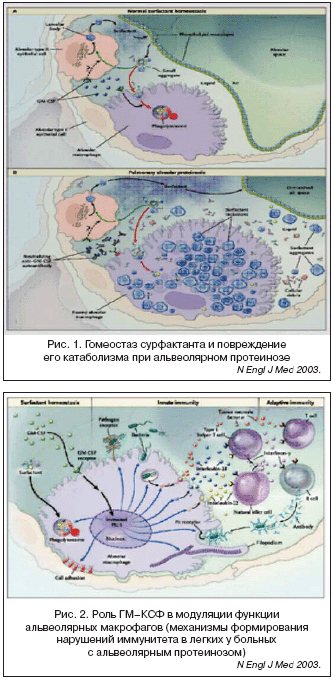
При альвеолярном протеинозе ИЛ–10, который обнаруживается в высоком титре, инактивирует синтез ГМ–КСФ и стимулирует выработку В–лимфоцитами антител к ГМ–КСФ, тем самым, нарушается катаболизм сурфактанта и начинается его накопление [5]. На рисунке 1 схематично изображены механизмы гомеостаза сурфактанта и нарушения его катаболизма, обнаруживаемые при альвеолярном протеинозе. Монослой фосфолипидов полярными головками ориентирован к жидкости, ацидными концами к воздуху. Образование сурфактанта происходит в системе аппарата Гольджи альвеоцитов II типа [5].
Альвеолярные макрофаги, захватывая и катаболизируя основные сурфактантные пулы, зависят от гранулоцитарно–макрофагального КСФ.
Хотя в ряде работ показано, что ГМ–КСФ стимулирует легочный рост и гиперплазию альвеоцитов II типа, потенциальное влияние ГМ–КСФ на преобразование сурфактанта в этих клетках до конца не известно.
При повреждении стимуляции ГМ–КСФ (мутация самого гена ГМ–КСФ, мутация рецепторов, антител) нарастает количество сурфактанта во внеклеточном пространстве за счет нарушения катаболизма, что со временем приводит к проявлению клинической картины.
Важную роль ГМ–КСФ играет также и в модуляции функции альвеолярных макрофагов, нарушение которой приводит к формированию дефектов иммунитета в легких у больных с альвеолярным протеинозом (рис. 2) [5,6].
В норме ГМ–КСФ стумулирует фактор транскрипции PU1 в альвеолярных макрофагах. Поэтому при дефекте стимула ГМ–КСФ появляется множество функциональных нарушений, которые реализуются в макрофагах этим фактором транскрипции. Речь идет о клеточной адгезии, катаболизме сурфактанта, экспрессии рецепторов представления бактерий, наблюдается дефект FC–рецепторов фагоцитоза, нарушается выработка цитокинов ИЛ–12 и ИЛ–18, стимулирующих выработку интерферонов Т–клетками в ответ на попадание инфекции в дыхательные пути. Все это приводит к снижению иммунной защиты в легких.
До настоящего времени диагностика альвеолярного протеиноза базируется на совокупности клинико–анамнестических, компьютерная томография высокого разрешения (КТВР) или мультиспиральная компьютерная томография (МСКТ) легких и морфологических данных. Выявление гистологической картины легочной ткани и цитологии БАЛ, характерной для альвеолярного протеиноза – наличие в альвеолах эозинофильного гранулярного ШИК–положительного вещества вакуолизированных, пенистых макрофагов и гиперплазии альвеоцитов II типа [3].
В лечении альвеолярного протеиноза бронхоальвеолярный лаваж под наркозом остается единственным основным симптоматическим методом для всех форм заболевания при прогрессирующей дыхательной недостаточности. Данный метод лечения дает длительную ремиссию (от полугода до нескольких лет), так как обычно заболевание медленно прогрессирует.
Для лечения первичных форм альвеолярнго протеиноза применяются такие методы, как трансплантация легких (при врожденной форме альвеолярного протеиноза); плазмаферез, что является патогенетическим методом лечения – эрадикация антител к ГМ–КСФ и введение ГМ–КСФ (ингаляционные формы или подкожно) [8].
Во всех исследовательских работах рекомендуется категорический отказ от курения, так как это значительно ухудшает течение альвеолярного протеиноза и дальнейший прогноз [1,4–7]. Обязательно проведение профилактики бронхолегочных инфекций (противовирусной и антибактериальной), учитывая нарастающий дефект иммунной защиты сурфактанта и снижение иммунитета легких.
Клинический случай. Больной Б., 34 лет, поступил в клинику с жалобами на приступообразный кашель с выделением большого количества слизисто–гнойной мокроты, особенно по утрам, на дистанционные хрипы, появляющиеся в горизонтальном положении, на появление одышки при подъеме на 5–й этаж.
Из анамнеза заболевания Появление кашля по утрам отмечает около 10 лет (связывает с длительным курением). Настоящее ухудшение с конца апреля 2007 г,, когда после переохлаждения отметил подъем температуры тела до 38°С, однако переносил ее хорошо и продолжал ходить на работу. 01.05.2007 г. температура тела поднялась до 39,8°С, держалась постоянно, появилось незначительное кровохарканье на фоне кашля, отмечал нарастание слабости. Бригадой СМП больной был доставлен в ГКБ № 79, где в приемном отделении на рентгенографии легких диагностирована двусторонняя нижнедолевая пневмония. Однако пациент отказался от госпитализации, дежурным врачом была назначена пероральная терапия левофлоксацином 500 мг/сут. и амброксолом 30 мг 3 раз/сут., которую пациент принимал амбулаторно в течение 7 дней. На фоне антибактериальной терапии пациент почувствовал значительное улучшение состояния: на 2–е сутки температура тела нормализовалась, кровохарканье не возобновлялось, уменьшились кашель и одышка. В дальнейшем пациент наблюдался по месту жительства, где, учитывая наличие у больного эпизода кровохарканья, двусторонней нижнедолевой пневмонии, быстрого снижения температуры тела на фоне терапии левофлоксацином, заподозрили наличие туберкулеза и направили пациента в противотуберкулезный диспансер. Данных за туберкулез получено не было, однако при проведении контрольной рентгенографии легких – рентгенологическая картина сохранялась без динамики. Была продолжена антибактериальная терапия. Рентгенологическая картина сохранялась. Необходимо отметить, что несколькими годами ранее при обращении в поликлинику по месту жительства при диспансеризации была проведена флюорография легких. Рентгенологом, со слов пациента, выявлены изменения легочного рисунка, было рекомендовано обращение к терапевту, однако ввиду хорошего самочувствия пациент этого делать не стал.
Для проведения диагностической фибробронхоскопии пациент был направлен в Центр борьбы с туберкулезом, где после проведении фибробронхоскопии и исследования лаважной жидкости был заподозрен альвеолярный протеиноз – при цитологическом исследовании БАЛ выявлены глыбки неклеточного вещества, большое количество альвеолярных макрофагов (54%), лимфоциты (37%), нейтрофилы (9%), макрофаги с глыбками фагоцитированного материала, аналогичного неклеточному материалу.
Для продолжения обследования больной направлен в пульмонологическое отделение Госпитальной терапевтической клиники ММА имени И.М. Сеченова.
Анамнез жизни: Родился в 1973 г., г. Москва. В детстве рос и развивался соответственно возрасту. Образование средне–специальное (машинист автомобильного крана). Работал по специальности на автомобильном кране с 18 до 22 лет, частые переохлаждения. С 23 лет работал на грузовом транспорте водителем. С 2000 по 2004 г. – постоянный контакт со строительной пылью в большой экспозиции (водитель КАМАЗа на стройках, вывозил в больших объемах цементный мусор). При этом отмечал усиление легочных симптомов – усиление кашля, появление одышки. С 2004 г. автослесарь на автосервисе. В армии не служил. Курит с 14 лет до 2 пачек в день (индекс курильщика 30 пачек/лет). С 5 лет аллергический ринит, удаление полипов носа, аллергический конъюктивит, проводилась специфическая иммунотерапия аллергенами с хорошим эффектом. В детстве перенес гепатит А, детские инфекции. Травма грудной клетки, правого голеностопного сустава в возрасте 30 лет. Наследственность не отягощена.
При поступлении общее состояние относительно удовлетворительное. Гиперстенического телосложения. Кожные покровы обычной окраски и влажности, чистые. Дыхание через нос свободное. ЧДД 17 в мин. Перкуторный звук легочный с коробочным оттенком. Аускультативно дыхание жесткое, на выдохе умеренное количество сухих хрипов в нижнелатеральных отделах с обеих сторон (крепитации нет). Тоны сердца ясные, ритм правильный. ЧСС=Ps=78 уд. в мин. АД 120/70 мм рт.ст. Живот пальпаторно мягкий, чувствительный в эпигастрии и правом подреберье. Нижний край печени у реберной дуги, чувствителен при пальпации. Дизурии нет. Поколачивание по поясничной области безболезненно с обеих сторон. Очаговой симптоматики нет.
Общий анализ крови: эритроциты 4,866 млн., гемоглобин 147,4 г/л, цветовой показатель 0,9 , лейкоциты 9,56 тыс, нейтрофилы 58,4%, лимфоциты 33,1%, СОЭ 5 мм/ч, моноциты 5,9%, эозинофилы 1,2%, тромбоциты 330,1 тыс.
Коагулограмма: АЧТВ 1,15 (норма 0,75–1,25), ПИ 109% (норма 86–110%), фибриноген 2,81 г/л (норма 1,8–4 г/л).
Биохимический анализ крови: АСТ 30 ед/л (норма 0–40 ед/л), АЛТ 29 ед/л (норма 0–40 ед/л), Г–ГТ 34 ед/л (норма 0–55 ед/л), ЩФ 107 ед/л (норма 0–115 ед/л), K+ 4,6 мэкв/л (норма 3,5–5 мэкв/л), Na+ 141 мэкв/л (норма 135–145 мэкв/л), глюкоза 84 мг/дл (норма 60–100 мг/дл), креатинин 1,2 мг/дл (норма 0,7–1,4 мг/дл), мочевая кислота 6,6 мг/дл (норма 2,5–7 мг/дл), общий билирубин 0,8 мг/дл (норма 0,2–1 мг/дл), общий холестерин 178 мг/дл (норма 150–250 мг/дл), ХС ЛПОНП 65,4 мг/дл (норма 10–30 мг/дл), триглицериды 327 мг/дл (норма 50–150 мг/дл), общий белок 7,7 г/дл (норма 6–8 г/дл), альбумин 4,7 г/дл (норма 3,5–5 г/дл), белковые фракции альбумина 66,7% (норма 54,7–68,7%), альфа–1 3,2% (норма 3,7–7,8%) альфа–2 8,3% (норма 5,2–10,7%), бета 11,4% (норма 8,6–13,7%), гамма 10,4% (норма 10,7–19,3%).
Иммунологические показатели крови: IgA 225 мг/дл (норма 50–300 мг/дл), IgM 164 мг/дл (норма 40–200 мг/дл), IgG 1300 мг/дл (норма 600–2000 мг/дл), РФ (качест.) отр., СРБ 0,4 мг/дл (норма 0–0,8 мг/дл), а/т к ВИЧ не выявлены, РПР отр., ИФА отр., HCV Ab отр., HBs Ag отр.
Общий анализ мокроты: лейкоциты 5 – 10 – 30 в п/зр в скоплениях до 50, эритроциты 1–2 в препарате, местами скопление до 20, макрофаги – умеренное количество, эпителий плоский – значительное количество, цилиндрический – немного, спирали Куршмана не найдены, кристаллы Шарко–Лейдена не найдены, атипичные клетки не найдены. Значительная примесь отделяемого носоглотки.
Обращает внимание наличие эритроцитов 1–2 в п.зр в скоплении до 20, лейкоцитоз, что, вероятнее всего, обусловлено наличием хронического бронхита (у пациента большой стаж курения).
ЭКГ: ритм синусовый, правильный с ЧСС 74 в мин. Нормальное положение ЭОС.
Функция внешнего дыхания: незначительные вентиляционные нарушения по смешанному типу. При анализе кривой поток–объем – умеренное снижение скоростных показателей выдоха, характеризующих дистальную бронхиальную проходимость. Общее бронхиальное сопротивление в норме (ФЖЕЛ 4,57л (89%), ОФВ1 3,52 л (83%), индекс Тиффно 77%, МОС25% 384 л/мин. (76%), МОС50% 206 л/мин. (63%), МОС75% 72 л/мин. (49%)). По данным бодиплетизмографии – начальные признаки рестрикции (незначительное снижение общей емкости легких TLC 6,34 л (87%) с редукцией оcтаточного объема легких RV 1,35 л (72%), VC 4,99 л 93%)).
Фибробронхоскопия: гортань, голосовая щель, трахея и карина без особенностей. Бронхиальное дерево осмотрено до сегментарного уровня. Слизистая умеренно гиперемирована, слегка отечна. Секрет в умеренном количестве. Аспирация. Шпора и устья сегментарных бронхов не расширены, проходимы. Заключение: катаральный эндобронхит.
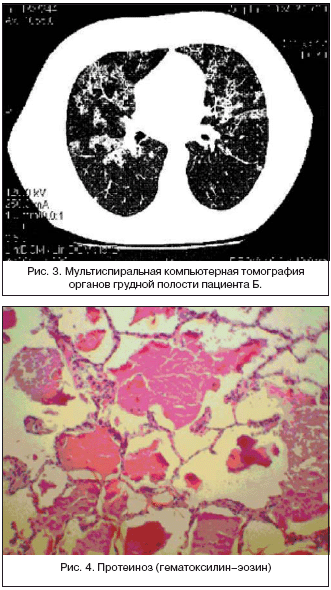
МСКТ органов грудной полости: при исследовании органов грудной клетки в обоих легких определяются множественные участки повышенной плотности легочной паренхимы по типу «матового стекла» неправильной формы. На этом фоне отмечается выраженное утолщение легочного интерстиция, преимущественно внутридолькового. Жидкости в плевральной полости нет. Трахея и крупные бронхи свободно проходимы, не деформированы. Лимфатические узлы средостения не увеличены. Аорта, легочный ствол и их ветви не расширены. Заключение: КТ–картина, вероятнее всего, соответствует альвеолярному протеинозу легких (рис. 3).
Выявленные изменения при МСКТ, скорее всего, соответствуют альвеолярному протеинозу, что потребовало морфологического подтверждения.
Больному для уточнения диагноза проведена видеоторакоскопия с атипичной краевой резекцией. При ревизии: в плевральной полости незначительное количество прозрачного выпота. Париетальная плевра не изменена. Легочная ткань ригидная. На фоне спавшегося легкого во всех долях легкого (больше в верхней и средней) определяются участки размерами от 1х1 до 2,5х1,5 см розовато–желтого цвета, выступающие над поверхностью легкого, при инструментальной пальпации не спадаются. Макропрепарат – резецированные фрагменты верхней доли легкого, размерами 2х1,5х2 см и 2х2,5х1,5 см – мягкоэластической консистенции, включающие плотные участки розовато–желтого цвета, что соответствует частому типичному описанию вида легких при альвеолярном протеинозе (розовато–желтого цвета, выступающие над поверхностью легкого небольшие образования).
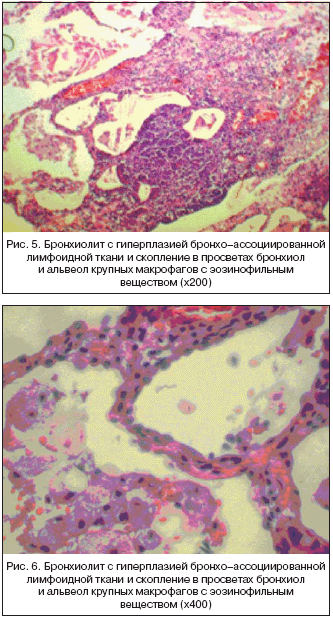
Данные морфологического исследования – в ткани легкого картина легочного протеиноза с интрестициальным фиброзом, лимфоидной инфильтрацией в виде очагов, а также кровоизлияний. Заключение – легочный протеиноз. На рисунках 4, 5, 6, и 7 приведены фотографии микропрепарата биопсийного материала легочной ткани пациента.
Таким образом, данные анамнеза и клинического обследования, характерная картина МСКТ и результаты морфологического исследования, позволили нам поставить диагноз: идиопатический альвеолярный протеиноз. Хронический бронхит (курильщика). Аллергический ринит.

Литература
1. Респираторная медицина. Руководство. Под ред. Академика РАМН А.Г. Чучалина. Том 2.–М. 2007.– с.311–317.
2. А.Л. Черняев, М.В. Самсонова. Патологическая анатомия легких. Атлас. – М.2004 – с. 90–91.
3. Pathology of the Lung. Edited by W. Timens and H.H. Popper. ERS. Monograph 39, 2007.– p.24–25.
4. H.R.W. Wirtz, M. Schmidt. Acute influence of cigarette smoke on secretion of pulmonary surfactant in rat alveolar type II cells in culture. Eur Respir J, 1996, 9, 24–32
5. Bruce C. Trapnell, M.D., Jeffrey A. Whitsett, M.D., and Koh Nakata, M.D., Ph.D. Мechanisms of disease: Pulmonary Alveolar Proteinosis. N Engl J Med 2003; 349: 2527–39.
6. Jason S. Vourlekis, Kelly E. Greene. Pulmonary alveolar proteinosis. Interstitial Lung Desease. – 2006.– p.865 – 876.
7. O.C. Ioachimescu, M.S. Kavuru. Pulmonary alveolar proteinosis. Chronic Respiratory Disease 2006; 3: 149–159.
8. M. E. Wylam, R. Ten, U. B. S. Prakash, H. F. Nadrous, M. L. Clawson, P. M. Anderson. Aerosol granulocyte–macrophage colony–stimulating factor for pulmonary alveolar proteinosis. Eur Respir J 2006; 27: 585–593.











