Введение
Сахарный диабет (СД) является важнейшей и до настоящего времени не решенной проблемой современной медицины. Связано это со многими факторами – прежде всего с увеличивающейся распространенностью заболевания и постоянно нарастающей численностью заболевших СД. По данным Международной федерации диабета (IDF), сегодня в мире насчитывается 415 млн пациентов с установленным диагнозом СД [1]. Ожидается, что к 2040 г. численность пациентов с СД составит 642 млн человек, однако эта цифра может оказаться значительно выше. Основную долю среди больных СД составляют пациенты с СД 2-го типа (СД2) – 90–95%. По оценке экспертов Всемирной организации здравоохранения, СД приобрел в XXI в. масштабы неинфекционной эпидемии. Наибольшая его распространенность наблюдается в странах Азии, Африки, Китае, Индии, что связывают с быстрым развитием и внедрением в этих странах научно-технического прогресса, увеличением продолжительности жизни, а также изменением стиля жизни, ассоциированным с изобилием готовой и легкоусвояемой пищи, алкоголем, курением, значительным уменьшением физической активности, иными словами, поворотом к «западному» образу жизни. Все это, несомненно, приводит к развитию ожирения, метаболического синдрома и, в конечном итоге, к развитию СД и сердечно-сосудистых заболеваний (ССЗ). Неслучайно IDF проводит проспективные исследования применительно не только к СД, но и к метаболическому синдрому. Ожидается, что к 2025 г. численность пациентов с метаболическим синдромом увеличится до 500 млн человек, из них 15% ежегодно заболевает СД2. В Российской Федерации СД страдает более 10 млн человек, причем примерно 50% из них не знают о том, что больны диабетом. Аналогичная ситуация складывается и с распространенностью СД среди пациентов как с избыточной массой тела, так и с ожирением.Следует также отметить, что значительно возросла и летальность пациентов с СД. По данным IDF, каждые 6 секунд умирает 1 пациент с СД. За 2015 г. летальность от СД составила 5 млн, превысив суммарную летальность от таких заболеваний, как малярия, туберкулез, СПИД.
Сахарный диабет и сердечно-сосудистые заболевания
Острота проблемы заключается не только в распространенности СД и увеличении численности пациентов, но и в развитии тяжелейших осложнений СД. Прежде всего это относится к развитию ССЗ. Среди основных заболеваний следует отметить в первую очередь инфаркт миокарда (ИМ), инсульт, сердечную недостаточность [2]. Фатальные и нефатальные сердечно-сосудистые осложнения у больных СД2 встречаются не менее чем в 70–80% случаев [3, 4]. Риск ССЗ при постановке диагноза СД2 возрастает в 2–4 раза по сравнению с лицами без СД [5, 6].Обширная доказательная научная база позволила Американской кардиологической ассоциации причислить СД к ССЗ. В рамках исследования OASIS Study (Organization to Asses Strategies for Ischemic Syndromes) было доказано, что риск смерти вследствие любых сердечно-сосудистых причин абсолютно одинаков как у пациентов с СД без ишемической болезни сердца (ИБС) в анамнезе, так и у пациентов с ИБС, но без указания в анамнезе на СД [7]. ИБС развивается у 70–80% пациентов с СД2 и у 40% пациентов с СД 1-го типа. В последние годы усилия ученых и клиницистов направлены не только на достижение контроля процессов метаболизма, улучшение качества жизни, но и на увеличение продолжительности жизни, которая у большинства пациентов с СД2 сокращается в связи с ранним развитием ССЗ.
СД2 ассоциируется с повышенным риском развития всех форм ИБС, включая стенокардию, безболевую ишемию миокарда, ИМ, а также внезапную сердечную смерть. В соответствии с результатами Фрамингемского исследования [8], абсолютный риск ССЗ и смертности зависит от многих факторов, в частности таких, как артериальная гипертензия, дислипидемия, ожирение, питание, курение, алкоголь, причем увеличение риска всегда более выражено у лиц женского пола. Между тем причинами высокой заболеваемости и смертности пациентов с СД2 от ССЗ являются факторы риска, специфичные только для этого заболевания (помимо общих для всей популяции факторов риска ИБС) (табл. 1) [9].

Доминирующую позицию в структуре факторов риска ССЗ у пациентов с СД занимают нарушения липидного спектра (табл. 2).

В условиях инсулинорезистентности и недостаточной секреции инсулина у пациентов с СД2 наблюдается повышение базального и постпрандиального уровня триглицеридов (ТГ), холестерина липопротеидов низкой плотности (ХС ЛПНП), холестерина липопротеидов очень низкой плотности (ХС ЛПОНП) в плазме крови. При этом вторично снижается концентрация холестерина липопротеидов высокой плотности (ХС ЛПВП), что связано с повышенным переносом эфиров ХС из ХС ЛПВП в липопротеиды очень низкой плотности и хиломикроны в обмен на ТГ. Основой гипертриглицеридемии при СД2 служит низкая чувствительность висцеральной жировой ткани к антилиполитическому действию инсулина, что ведет к повышенному липолизу, поступлению большого количества СЖК в портальный кровоток и, в сочетании с гиперинсулинемией, повышению синтеза ТГ и ЛПОНП печенью. Кроме этого, у больных СД2 при гипергликемии снижена активность эндотелиальной липопротеинлипазы, ответственной за катаболизм ТГ и ХС ЛПОНП. Базальная триглицеридемия обусловлена концентрацией ХС ЛПОНП и продуктами их обмена – ремнантами. По данным метаанализа 17 проспективных популяционных исследований установлено, что с увеличением базального уровня ТГ риск нарастания ССЗ увеличивается у мужчин на 30%, а у женщин – на 70%. Существенную роль в патогенезе дислипидемии при СД2 играет постпрандиальная гипертриглицеридемия, обусловленная уровнем хиломикронов и их ремнант, также обогащенных ТГ [10]. Нарушение обратного транспорта липидов на фоне постпрандиальной дислипидемии способствует усиленной мобилизации эфиров ХС и формированию атерогенных пенистых клеток. Постпрандиальная дислипидемия принимает активное участие в формировании ранних проявлений атеросклероза, о чем неуклонно свидетельствует утолщение комплекса интима – медиа сонной артерии, отражающей степень выраженности доклинического атеросклероза [11].
Для пациентов с СД2 характерным является изменение не только количественного, но и качественного состава липидов. Отмечается повышенное содержание мелких плотных частиц ЛПНП, плохо связывающихся с печеночными рецепторами, а потому длительно циркулирующих в крови, они подвергаются в значительной степени окислению, далее неконтролируемо захватываются моноцитами, дифференцировавшимися из макрофагов, и впоследствии во многом определяют судьбу атеросклеротической бляшки [12]. А как известно, для пациентов с СД2 характерным является формирование так называемой нестабильной атеросклеротической бляшки, которая состоит из большого количества липидного содержимого под тонкой фиброзной покрышкой, способной в любую минуту разорваться при высокой нагрузке. Такие бляшки получили название «бляшки-убийцы» [13].
Если рассматривать существующие факторы риска развития ССЗ при СД, то, согласно проспективному британскому исследованию по изучению СД (UKPDS), первую позицию среди различных факторов риска занимают ХС ЛПНП (табл. 3).

Самыми ранними предвестниками атеросклеротических бляшек в сосудах служат отложения жира, называемые жировыми пятнами. Жировые пятна в аорте появляются уже в детстве, а в коронарных артериях – в подростковом возрасте. Настоящие атеросклеротические бляшки начинают формироваться в период 13–19 лет. Из этого следует, что профилактику атеросклероза надо начинать проводить уже в детском возрасте.
Развитие атеросклеротического поражения сосудистой стенки у пациентов с СД2 – сложный многостадийный процесс, основу которого составляют гипергликемия, дислипидемия, инсулинорезистентность, запускающие каскад механизмов, приводящих к атеросклеротическому поражению сосудов (рис. 1).
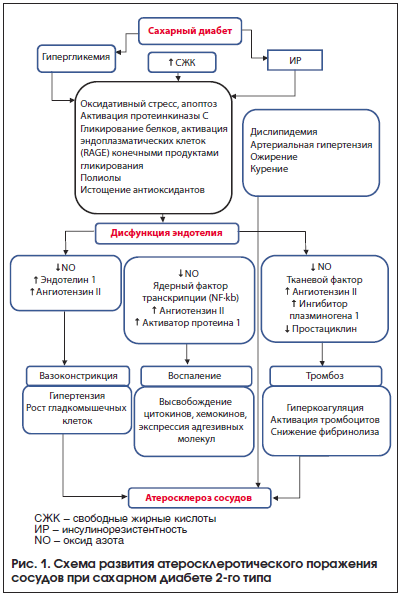
В настоящее время акцент в терапии СД2 делается на его долгосрочное управление, которое предполагает достижение не только целевого гликемического контроля и артериального давления, но и целевых параметров липидов. Совсем недавно реальная клиническая практика свидетельствовала о том, что целевых параметров липидов достигают всего лишь 22% пациентов с СД2, и это вновь было подчеркнуто в рамках докладов Американской ассоциации сердца и Европейской ассоциации кардиологов [14, 15]. Хочется надеяться, что картина изменится к лучшему. Сегодня наши пациенты с СД первоначально посещают врача-терапевта или врача общей практики, которые в последующем либо направляют пациента к эндокринологу, либо сами его наблюдают и корректируют терапию, включающую в том числе препараты, направленные на улучшение липидного обмена. Если же говорить о первичной профилактике атеросклероза в целом, то, помня о том, что заболевание развивается не в одночасье, а в течение довольно продолжительного периода времени, можно сказать, с первых лет жизни человека, то необходимо периодически проводить диспансерные осмотры с целью своевременного выявления патологических изменений. До 50% сердечно-сосудистых осложнений можно предотвратить благодаря своевременной первичной профилактике. Как известно, к препаратам первой линии, способствующим нормализации липидного спектра и реально снижающим смертность от ССЗ у пациентов с СД2, относятся статины (ингибиторы гидрокси-метил-коэнзим А-редуктазы) [16].
Статины
Статины внедрены в клиническую практику в 1990-х гг. и нашли широкое применение при различных заболеваниях. Ранее считали, что основное действие этих препаратов направлено на снижение продукции ХС печенью и активации рецепторов обратного захвата ЛПНП печенью. В последующем, по мере изучения статинов, в дополнение к их положительному влиянию на показатели липидного спектра было установлено, что статины обладают уникальными плейотропными эффектами (противовоспалительным, антиаритмическим, антитромботическим, мягким гипотензивным, антиоксидантным и иммуностимулирующим, способностью увеличивать биодоступность оксида азота (NO), стабилизацию нестабильной атеросклеротической бляшки, повышать эластичность артерий и улучшать функцию эндотелия), т. е. они способны воздействовать на основные звенья патогенеза ССЗ [17, 18]. Следует подчеркнуть, что плейотропные эффекты статинов могут проявляться либо очень быстро, либо в более отдаленный период времени. Например, плейотропное действие статинов при остром коронарном синдроме (ОКС) развивается уже в первые дни после их назначения, в то время как для стабилизации нестабильной бляшки, нередко формирующейся у пациентов с СД2, требуется не менее 4–6 мес., а для частичного регресса атеросклеротической бляшки, подтвержденного ангиографически, требуется 2–3 года непрерывного лечения статинами [19–21]. Для того чтобы правильно назначить лечение и определиться с необходимой дозой статина, следует учитывать, к какой группе сердечно-сосудистого риска (ССР) относится конкретный пациент и каких целевых параметров липидного спектра необходимо достичь.СД2 относится к группе высокого ССР, а в сочетании с ССЗ или заболеваниями почек либо при их отсутствии, но при наличии одного или более факторов риска, либо при поражении органов-мишеней – к группе очень высокого ССР. Целевые параметры липидов для пациентов с СД2 представлены в таблице 4 [22].

Как подчеркивается в рекомендациях Европейского общества кардиологов (ESC), в качестве основных препаратов для снижения уровня ХС ЛПНС на 50% и более могут применяться аторвастатин в дозе 40–80 мг и розувастатин в дозе 20–40 мг [23].
Статины назначают при уровне ХС ЛПНП, превышающем целевые значения, а у пациентов с СД2 и диагностированной ИБС – независимо от их исходного уровня. Неоднократно подчеркивалось, что статины являются краеугольным камнем в первичной и вторичной профилактике сердечно-сосудистых событий у пациентов с высоким уровнем ХС ЛПНП и сниженным уровнем ХС ЛПВП.
Однако залогом успеха профилактики ССЗ при СД2 является и высокая приверженность пациентов выполнению назначений врача. Взаимопонимание и хороший длительный контакт с врачом способны повысить комплаентность пациентов и обеспечить эффективность терапии статинами, добиться достижения целевых результатов гликемического уровня, нормализации АД и модификации образа жизни.
Доказательная база применения статинов
В последние годы сформировалась достаточно большая доказательная база, основанная на результатах, полученных при проведении крупных международных многоцентровых рандомизированных плацебо-контролируемых исследований, данных метаанализов, убедительно доказывающих эффективность статинов в снижении сердечно-сосудистой заболеваемости и смертности у больных СД при первичной и вторичной профилактике: HPS, ASCOT-LLA, CARE, 4S, LIPID, ALLHAT-LLT. Так, в исследовании Heart Protection Study (HPS) изучалось высокое содержание в крови пациентов с СД ХС ЛПНП, которое не отличалось от такового в общей популяции, при этом данной категории лиц не проводилась никакая гиполипидемическая терапия. Подобная практика, к сожалению, встречается и сегодня. В исследовании приняли участие 5963 пациента с СД и 14 753 – с периферическим атеросклерозом без СД. У 51% пациентов с СД имелись признаки ИБС. Назначение симвастатина в дозе 40 мг на протяжении 5 лет позволило статистически достоверно снизить коронарную смертность на 20%, частоту развития первого нефатального ИМ – на 37% по сравнению с плацебо. Риск сосудистых осложнений снизился на 33% у пациентов с СД без признаков атеросклероза и на 27% среди 2426 пациентов с СД, у которых исходный уровень ХС ЛПНП был ниже 3 ммоль/л [24]. Одним из ключевых исследований применения статинов при СД, включавшим только пациентов с диабетом, является исследование CARDS (Collaborative Atorvastatin Diabetes Study), в котором сравнивали результаты лечения аторвастатином в дозе 10 мг/сут и плацебо у больных СД2 с относительно низким уровнем ХС ЛПНП (максимальный предел включения – 4,14 ммоль/л) [25, 26]. У пациентов отсутствовали заболевания коронарных, мозговых или периферических сосудов, но имелся один из следующих признаков высокого риска: гипертония, ретинопатия, альбуминурия, курение. Применение аторвастатина сопровождалось высокодостоверным уменьшением частоты возникновения первичной конечной точки на 37%, причем оно было одинаковым в подгруппах больных с исходным ХС ЛПНП выше и ниже среднего уровня 3,06 ммоль/л. Результаты в группе аторвастатина оказались достоверно лучше в отношении таких компонентов первичной конечной точки, как острые коронарные события – уменьшение риска на 36%, инсульты – на 48%, реваскуляризации миокарда – на 31%. Исследование CARDS было прекращено почти за 2 года до намеченного срока в связи с очевидными преимуществами аторвастатина. В ряде исследований изучались возможные нефропротекторные свойства статинов. С целью сравнения нефропротективных эффектов розувастатина и аторвастатина было проведено два рандомизированных проспективных исследования PLANET I и PLANET II у пациентов с исходной умеренной протеинурией и гиперхолестеринемией [27, 28]. Протоколы исследований были идентичны. Различия заключались в том, что в PLANET I включили 325 пациентов с СД 1-го и 2–го типа, а в PLANET II – 220 пациентов без СД. Уровень ХС ЛПНП при включении в исследования должен был превышать 2,35 ммоль/л, критерием протеинурии было отношение белок мочи / креатинин мочи 500–5000 мг/г. Больные были рандомизированы в группы аторвастатина (целевая доза 80 мг/сут) и розувастатина (целевая доза 40 мг/сут). Первые 4 нед. пациенты получали половину целевой дозы каждого препарата, затем переходили к лечению целевыми дозами. Продолжительность наблюдения составила 52 нед. Эффективность лечения оценивали по динамике отношения белок мочи / креатинин мочи. У лиц с СД (PLANET I) аторвастатин достоверно уменьшил протеинурию на 15%, розувастатин не оказал на нее существенного влияния. У лиц без СД (PLANET II) действие статинов на функцию почек было аналогичным: аторвастатин уменьшал протеинурию и альбуминурию в среднем более чем на 20%. Различное влияние оказывали изучаемые препараты и на скорость клубочковой фильтрации (СКФ). В группе, получавшей аторвастатин в дозе 80 мг/сут, отмечалось статистически незначимое уменьшение СКФ на 2 мл/мин/1,73 м2, в группе, получавшей розувастатин в дозе 40 мг/сут, СКФ снизилась на 8 мл/мин/1,73 м2, у лиц без СД уменьшение СКФ было статистически достоверным (p<0,05). Значимых различий по частоте развития почечных осложнений между группами в исследовании PLANET II выявлено не было [29–31]. Однако в PLANET I (больные с СД) частота развития почечных осложнений была значительно выше в группе розувастатина 40 мг/сут. Острая почечная недостаточность в группе розувастатина наблюдалась в 4,1% случаев, в группе аторвастатина – в 0,9% (p <0,05). Удвоение сывороточного креатинина в группе аторвастатина не наблюдалось, в группе розувастатина отмечалось у 4,9% пациентов (p <0,01). Таким образом, авторы данной публикации пришли к заключению, что аторвастатин обладает более выраженным нефропротективным действием для популяции больных с ХБП [27]. Кроме того, данные крупного мета-анализа, опубликованного в 2013 г., в котором сравнивались высокие дозы розувастатина и аторвастатина у больных высокого ССР и ХБП, показывают, что эффект снижения СКФ был менее выражен при применении аторвастатина 80 мг/сут. Применение розувастатина было ассоциировано со значительным увеличением числа новых случаев протеинурии по сравнению с таковым при применении аторвастатина [50]. Этот эффект был обусловлен включением в исследование высоких терапевтических доз розувастатина (40 мг/сут). Новое руководство ESC 2016 г. по лечению дислипидемии рекомендует именно высокие дозы статинов для пациентов высокого и очень высокого ССР, к которым относятся больные ХБП. Авторы данного мета-анализа пришли к заключению, что у пациентов высокого риска с ХБП на фоне приема аторвастатина отмечается улучшение функции почек [50].В исследовании TNT СHD – DM: TNT in Patients With Coronary Heart Disease and Diabetes оценивали эффективность терапии аторвастатином в суточной дозе 80 мг в снижении риска развития основных сердечно-сосудистых осложнений у больных ИБС и СД2 [32, 33]. Пациенты (1501 человек) с СД2 и ИБС были рандомизированы в 2 группы, в одной из которых назначали дозу 10 мг, в другой – 80 мг аторвастатина. Интенсивная гиполипидемическая терапия 80 мг аторвастатина в сутки у больных ИБС и СД2 достоверно снижала риск развития основных сердечно-сосудистых событий на 25% по сравнению с терапией аторвастатином в суточной дозе 10 мг.
Исследование PROVE IT-TIMI 22 (Pravastatin or Atorvastatin Evaluation and Infection Therapy Thrombolysis in Myocardial Infarction 22 Investigators) включало 4162 пациента с ОКС, которые были рандомизированы в группы аторвастатина 80 мг/сут и правастатина 40 мг/сут в течение 10 дней после манифестации ОКС. При анализе исследования выявлено, что частота наступления первичной конечной точки (смерть от любой причины, ИМ, реваскуляризация коронарных артерий и инсульт) в группе аторвастатина была на 16% меньше, чем в группе правастатина. За время наблюдения в группе правастатина средний уровень ХС ЛПНП составил 2,46 ммоль/л, в группе аторвастатина – 1,6 ммоль/л (p<0,001). В заключение подчеркивается, что оригинальный аторвастатин является более эффективным гиполипидемическим препаратом, способствующим уменьшению риска повторных ишемических событий у пациентов с ОКС [34].
Безопасность приема статинов
При назначении любых препаратов всегда остро стоит вопрос не только об их эффективности, но и о безопасности. Следует отметить, что статины считаются одними из наиболее безопасных препаратов в кардиологии. Обычно лечение статинами хорошо переносится и характеризуется сравнительно низкой частотой побочных эффектов.Одним из нежелательных явлений (НЯ) при приеме статинов является повышение уровня печеночных ферментов: аспартатаминотрансферазы и аланинаминотрансферазы (АСТ, АЛТ), которое встречается в 0,5–2% случаев. Превышение уровня перечисленных ферментов при двух последовательных измерениях более чем в 3 раза по сравнению с верхними пределами нормальных значений служит показанием для отмены приема статинов. В случаях более умеренного повышения уровня ферментов достаточно ограничиться снижением дозы препарата. Обычно в течение короткого времени после отмены препаратов уровни АЛТ и АСТ возвращаются к референсным значениям, и в последующем терапию тем же статином можно возобновить в меньшей дозе [35]. Наибольшее клиническое значение имеет вопрос о связи терапии статинами с нарушением функции печени или печеночной недостаточностью. Результаты статистического анализа причин, приведших пациентов к трансплантации печени в США за период 1990–2002 гг., свидетельствуют о том, что лишь 1 из когорты пациентов, включавшей 51 741 человека, лечился статинами [36, 37]. Случаи развития печеночной недостаточности на фоне терапии статинами единичны – 1–1,14 случая на 1 млн человеко-лет.
Еще реже (0,1–0,5% случаев) при приеме статинов наблюдаются миопатия и миалгия, которые проявляются болью и слабостью в мышцах, сопровождаются повышением уровня креатинфосфокиназы (КФК) более чем в 5 раз, что требует отмены препарата.
В ряде случаев прием препаратов класса статинов представляет собой так называемый «эффект ноцебо», что убедительно было продемонстрировано в исследовании ASCOT, ASCOT-LLA (Anglo-Scandinavian Cardiac Outcomes Trial—Lipid-Lowering Arm), в котором изучили воздействие раскрытия данных о лечении на восприятие связанных со статинами НЯ. Во время слепой фазы исследования ASCOT 5,8% пациентов в группе аторвастатина и 5,6% пациентов в группе плацебо сообщили о связанных с мышцами НЯ (отношение рисков [ОР] 1,03; 95% доверительный интервал [ДИ] 0,88–1,21). Слепая фаза исследования ASCOT-LLA была прекращена досрочно из-за преимуществ аторвастатина, и всем пациентам была предложена открытая терапия статином: 6409 пациентов выбрали ее, а 3490 пациентов отказались. Во время открытой фазы терапии частота связанных с мышцами НЯ была на 41% выше среди пациентов, получавших статины, по сравнению с пациентами, не получавшими статины (95% ДИ 1,10–1,79, р=0,006). Авторы исследования подтвердили хорошую переносимость пациентами препарата аторвастатин и указали на то, что у многих пациентов зарегистрированные НЯ связаны с информацией о приеме препарата, что не является истинным НЯ [38].
Пожалуй, самым опасным НЯ при лечении статинами является рабдомиолиз (распад мышечной ткани) с возможным повреждением почечных канальцев. Однако частота его развития крайне мала и составляет всего ~0,1% [39]. Факторами, предрасполагающими к развитию рабдомиолиза, могут служить инфекционные заболевания, выраженные метаболические, эндокринные, электролитные нарушения, тяжелые заболевания печени и почек, алкоголизм, пожилой возраст.
На основании подробного анализа многочисленных клинических исследований, данных метаанализов в отношении безопасности статинов FDA (Федеральное управление по контролю за качеством пищевых продуктов и лекарственных препаратов США) в феврале 2012 г. внесло определенные поправки в аннотацию по использованию этой группы препаратов. Это касалось ограничения доз препаратов симвастатина и ловастатина, особенно в сочетании с другими препаратами, поскольку это может повысить риск возможного развития изменений со стороны мышечной системы, выявляемых по повышению фермента КФК до уровня выше 5 верхних границ нормы. Далее FDA считает, что перед назначением статинов необходимо исследование уровня трансаминаз печени (АЛТ, АСТ), однако в последующем мониторинг этих показателей не столь рационален в связи с очень редким неблагоприятным воздействием на печень. Терапию статинами следует прекратить, как указано в рекомендации, в случае явных клинических признаков поражения печени либо при выявлении гипербилирубинемии или желтухи.
Наименее изученным остается вопрос о влиянии статинов на нервную ткань. Существуют отдельные сообщения, свидетельствующие о том, что назначение статинов может приводить к некоторому снижению когнитивной функции, особенно у пожилых пациентов. Однако в РКИ подтверждено отсутствие взаимосвязи между приемом статинов и развитием деменции, включая болезнь Альцгеймера [40]. По результатам метаанализов статины снижают частоту развития негеморрагического инсульта на 17–21%, несмотря на отсутствие прямой взаимосвязи между этим показателем и повышенным уровнем ХС, что потенциально способствует сохранению ментальной функции [41, 42]. Использование статинов у больных с диагностированной деменцией, включая болезнь Альцгеймера, может уменьшать скорость прогрессирования когнитивной функции.
Статинотерапия и риск развития сахарного диабета
FDA указывает на возможный риск ухудшения гликемического контроля у пациентов с СД2, а также на риск выявления новых случаев СД2 на фоне терапии статинами. Что касается ухудшения гликемического контроля у пациентов с СД2 (исследование PROVE-IT TIMI 22), то, как известно, эндокринологам на протяжении всей жизни пациентов приходится заниматься коррекцией углеводного обмена, и поэтому возможное некоторое его ухудшение на фоне применения статинов не представляется чем-то удручающим, при наличии значительного положительного эффекта, способствующего предотвращению фатальных сердечно-сосудистых событий. В метаанализе 13 РКИ статинов изучали вероятность развития диабета среди 91 140 участников. Терапия статинами ассоциировалась с повышением риска развития СД на 9%, другими словами, развитием 1 впервые выявленного случая СД2 на 255 пациентов, получавших лечение статинами в течение наблюдательного 4-летнего периода. Однако абсолютный риск был низким – 1 случай на 1000 пациенто-лет лечения [43]. Что касается новых случаев развития СД, то FDA опирается на исследование JUPITER (The Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin), в котором использование розувастатина в качестве средства первичной профилактики по сравнению с плацебо выявило увеличение относительного риска развития новых случаев СД2 на 27% [44–47]. За последние 25 лет в многочисленных исследованиях по изучению статинов и их влияния на конечные кардиоваскулярные точки не установлено однозначной взаимосвязи между терапией статинами и развитием СД2. Представляется необходимым более активно выявлять пациентов, имеющих факторы риска нарушения углеводного обмена, и направлять усилия на предотвращение манифестации СД2. Заботясь о безопасности применения препаратов этого класса, безусловно, необходимо соблюдать все меры предосторожности, но и помнить о том, что отказ от их назначения может стоить пациенту жизни.Выбор статина и интенсивность гиполипидемической терапии
Совет экспертов Всероссийского научного общества кардиологов (ВНОК), Национального общества по изучению атеросклероза (НОА), Российского общества кардиосоматической реабилитации и вторичной профилактики (РосОКР), Национальной ассоциации по борьбе с инсультами (НАБИ) в 2011 г. вынес свое решение о применении статинов при лечении больных высокого и очень высокого ССР на примере оригинального препарата аторвастатин (Липримар®) как одного из наиболее хорошо изученных и широко назначаемых статинов [48].Управление липидным контролем начинается уже при установлении диагноза СД2 и стартует с общепринятой модификации стиля жизни, направленной на снижение массы тела, увеличение физической активности, правильное питание. Все эти требования должны выполняться пациентами на протяжении всей жизни, и, безусловно, можно добиться улучшения всех индивидуально подобранных целевых параметров обменных процессов. Но, как известно, выполнять эти требования, соблюдать их в течение всей жизни – задача для наших пациентов трудновыполнимая. Довольно часто при установлении диагноза СД2 врачи фиксируют в биохимическом анализе крови повышенный уровень ХС, ХС ЛПНП, ТГ и снижение ХС ЛПВП, но не принимают никаких мер, направленных на нормализацию липидного спектра. Далее, по прошествии какого-то периода времени, при повторном исследовании липидов вновь фиксируют эти же показатели, но продолжают бороться главным образом с гипергликемией. Между тем мы должны четко осознавать, что СД2 относится к категории факторов высокого ССР, и поэтому не забывать по показаниям назначать гиполипидемическую терапию, в частности, статины (табл. 5, 6) [49].


Заключение
В заключение хотелось бы подчеркнуть, что на современном этапе в своей практической работе мы руководствуемся клиническими рекомендациями, основанными на мощной доказательной базе. Это касается в равной степени достижения как целевого гликемического контроля, так и параметров целевого уровня липидов, контроля АД.С учетом того, что у пациентов с СД2 выявляются нарушения практически всех процессов метаболизма, в значительной степени повышающих риск развития ССЗ, только посредством многофакторного управления всеми этими процессами с еще более активным использованием статинов будет возможно действительно добиться долгосрочного контроля СД, снижения летальности, а следовательно, улучшения качества и продолжительности жизни наших пациентов.












