Введение
Число больных сахарным диабетом (СД) в мире за последнее десятилетие увеличилось более чем в 2 раза и к концу 2021 г. превысило 537 млн человек. Согласно прогнозам Международной диабетической федерации к 2030 г. СД будут страдать 643 млн человек, а к 2045 г. — 784 млн [1].
Согласно данным Федерального регистра СД на 01.01.2022 в Российской Федерации на диспансерном учете состояло 4 871 863 пациента с диагнозом СД, т. е. 3,34% населения. Среди них СД 1 типа диагностирован у 5,6%, СД 2 типа — у 92,3%, а 2,1% приходится на другие формы диабета, в том числе гестационный СД [2].
Исследования, проведенные в последние годы, подтверждают мультифакторную природу СД. Большое значение в развитии заболевания принадлежит внешним средовым факторам, прежде всего способствующим развитию дисбаланса в системе антиоксиданты/прооксиданты с активацией неконтролируемых процессов свободнорадикального окисления и перекисного окисления структурных и функциональных биомолекул организма [3].
Малоновый диальдегид (МДА) — продукт перекисного окисления липидов (ПОЛ), содержание которого в плазме крови коррелирует с активностью процессов пероксидации на тканевом и клеточном уровнях. Степень повреждения клеток, обусловленного воздействием свободных радикалов, можно определить по уровню МДА [4].
Супероксиддисмутаза (СОД) — основной фактор антиоксидантной защиты (АОЗ). Этот фермент регулирует окислительный стресс, липидный обмен, уровень воспаления; предотвращает ПОЛ, окисление липопротеинов низкой плотности в макрофагах, образование липидных капель и адгезию воспалительных клеток в эндотелии [5].
Важный компонент системы АОЗ — каталаза (КАТ), обеспечивающая контроль накопления перекисей, в том числе и образующихся за счет функционирования СОД. Существует корреляция между уровнем КАТ и метаболическими нарушениями при различных заболеваниях. Исследования показали, что содержание каталазоспецифической мРНК, белков и ферментативная активность КАТ напрямую коррелировали с повреждением тканей, что согласуется с более низкой экспрессией КАТ в нелеченых диабетических группах [6].
Глутатион S-трансфераза (Г-S-Т) катализирует реакции детоксикации различных окисленных метаболитов, в частности катехоламинов, и является составной частью системы АОЗ, препятствуя дегенеративным клеточным процессам. Фермент Г-S-Т и его кофермент глутатион — важные антиоксидантные факторы в системе клеточной защиты против активных форм кислорода. В эксперименте было показано, что перепроизводство свободных радикалов в мозге крыс с СД приводит к окислительному повреждению мембранных липидов, белка и в конечном итоге к снижению содержания Г-S-Т [7].
Течение СД у каждого пациента индивидуально и зависит от выраженности изменений метаболизма на фоне гипергликемии, включая нарушения оксидативных процессов, приводящих к развитию различных осложнений СД [8]. Дистальная нейропатия (ДН) и синдром диабетической стопы (СДС) значительно осложняют течение СД. Эти состояния являются наиболее частой причиной госпитализации, ухудшения качества жизни и инвалидизации больных СД. Именно поэтому изучение механизмов развития и особенностей течения ДН и СДС столь актуально.
Цель исследования: изучить особенности изменений в системе антиоксиданты/прооксиданты у пациентов с СД 1 и 2 типа, осложненным ДН и СДС.
Материал и методы
Обследовано 149 пациентов с СД 1 и 2 типа в стадии декомпенсации, сопровождающимся ДН и СДС. Пациентов распределили в 4 группы. В 1-ю группу вошли пациенты с СД 1 типа и ДН (n=23, 45±5 лет, 11 мужчин). Во 2-ю группу включили больных СД 2 типа и ДН (n=58, 55±5 лет, 23 мужчины). В 3-ю группу вошли пациенты с СД 1 типа, сопровождающимся ДН и СДС (n=12, 47±7 лет, 7 мужчин). В 4-ю группу включили пациентов с СД 2 типа, также сопровождающимся ДН и СДС (n=56, 59±9 лет, 30 мужчин). Контрольную группу составили 19 практически здоровых лиц (50±5 лет, 9 мужчин).
Критерии включения в исследование: пациенты 40–70 лет с СД 2 типа, осложненным ДН, принимающие пероральные сахароснижающие препараты или получающие инсулинотерапию; пациенты 40–70 лет с СД 2 типа, сопровождающимся СДС, получающие инсулинотерапию; пациенты старше 18 лет с СД 1 типа, осложненным ДН или СДС, получающие инсулинотерапию.
Критерии невключения: пациенты с тяжелыми сопутствующими заболеваниями, в том числе онкологическими, неалкогольной жировой болезнью печени на стадии цирроза или фиброза; с острым коронарным синдромом; бронхообструктивными заболеваниями легких (хроническая обструктивная болезнь легких, бронхиальная астма, обструктивный бронхит и др.); с тяжелыми неврологическими расстройствами; пациенты, не давшие добровольного согласия на исследование; беременные женщины.
Диагноз СД у всех пациентов подтвержден клинико-лабораторными исследованиями. В работе использованы рекомендации федеральной целевой программы «Сахарный диабет» [9]. Все обследованные пациенты дали информированное добровольное согласие на исследование.
Проведено лабораторно-биохимическое исследование с целью оценки показателей системы антиоксиданты/прооксиданты в плазме крови. Для лабораторных исследований использовали ламинарные шкафы 2-го класса защиты, ПЦР-бокс, морозильную камеру с температурой -20 °С, криоморозильную камеру с температурой -70 °С, спектрофотометр «Пикодроп» с персональным компьютером, весы аналитические электрические, pH-метр, термостат твердотельный TDB 2400, термостат-инкубатор, центрифугу «Вортекс», центрифугу MiniSpin, мешалки электромагнитные.
Из образцов периферической венозной крови получали гемолизат эритроцитов по стандартной методике [10]. Полученный прозрачный гемолизат помещали в стоящую на льду пробирку и использовали для определения активности КАТ, Г-S-Т, СОД и уровня МДА.
Для расчета Г-S-Т и СОД определяли количество гемоглобина (Hb) в гемолизате [10]. Активность КАТ определяли и рассчитывали с помощью методики, основанной на способности перекиси водорода (H2O2) образовывать стойкий окрашенный комплекс с солями молибдена. Активность КАТ описывали отношением H2О2 (нМоль) / Hb (мг) [11]. Активность Г-S-Т исследовали по методике, основанной на определении скорости конъюгации восстановленного глутатиона и 1-хлор-2,4-динитробензола и выражали в мМоль/мин/мг [12]. Уровень МДА в гемолизате определяли по реакции с тиобарбитуровой кислотой [13]. Активность СОД в гемолизате оценивали по методике, основанной на скорости ингибирования окисления адреналина [14], и выражали в условных единицах (у. е.).
Для сравнения выборок применяли однофакторный дисперсионный анализ (ANOVA), одним из условий которого является нормальное распределение признака в статистических совокупностях, из которых извлечены выборки, проверенные с помощью критерия согласия Пирсона (χ2). Множественные попарные сравнения выполнены с помощью критерия Тьюки. Статистически значимыми признаны показатели при p<0,05. Данные представлены в виде среднего арифметического со стандартной ошибкой.
Результаты и обсуждение
При анализе и статистической обработке полученных данных установлено, что у больных СД, по сравнению с контрольной группой, активируется ПОЛ, что сопровождается накоплением его первичных и конечных продуктов, прежде всего МДА (см. таблицу). Так, при оценке степени прооксидантной нагрузки на основании данных о содержании продуктов ПОЛ у пациентов всех исследуемых групп значения МДА отличались от показателей контрольной группы. Средний показатель МДА в контрольной группе составил 5,40±0,58 мкМоль/л. У пациентов 1-й группы уровень МДА практически в 2 раза превышал значения в контрольной группе. У пациентов 2-й группы концентрация МДА оказалась на 30,4% выше, чем в контрольной группе. Среди пациентов с СД, осложненным ДН и СДС, отличие значений МДА от значений в контрольной группе оказалось еще более выраженным. У пациентов 3-й группы концентрация МДА в 3,8 раза превышала значения в контрольной группе, а у пациентов 4-й группы — в 4,4 раза.
Установлено статистически значимое повышение уровня МДА у пациентов 1-й группы по сравнению с пациентами 2-й группы (p<0,01). В то же время уровень МДА у пациентов 2-й группы статистически значимо превышал показатели МДА пациентов контрольной группы (p<0,001). Анализ полученных данных показал, что у пациентов с СД 1 и 2 типа с ДН активируются избыточная пероксидация липидов и накопление ее продуктов по сравнению с контрольной группой.
У пациентов всех исследуемых групп значительно повышена активность ПОЛ по сравнению с контрольной группой, что свидетельствует о значительном окислительном стрессе, который наиболее выражен у пациентов с СД 1 и 2 типа, осложненным ДН и СДС. Данный факт может свидетельствовать о глубоких нарушениях метаболических процессов при СД, прежде всего у пациентов с осложнениями сосудистого характера, что, вероятно, связано с повреждением клеток свободными радикалами. Ранее было показано, что уровень МДА повышен у пациентов с СД, особенно сопровождающимся СДС [15].
Известно, что дефицит инсулина и гипергликемия активируют липопероксидацию у больных СД. Инсулин ингибирует ПОЛ, влияет на подвижность липидов мембран и утилизацию перекисей. Усиление процессов пероксидации приводит к дислипидемии и повреждению эндотелия. Накопление продуктов пероксидации при СД может влиять на биологические эффекты инсулина, его продукцию и функционирование. У пациентов с СД 1 типа недостаток инсулина абсолютный, что и лежит в основе патогенеза этого заболевания [3].
При изучении системы АОЗ установлены различные отклонения средних изучаемых показателей в группах пациентов с СД по сравнению с группой контроля (см. таблицу), однако эти изменения носили статистически незначимый характер. Тем не менее установлено, что показатель активности СОД оказался статистически значимо ниже у пациентов с СД 1 типа, осложненным ДН и СДС (3-я группа), по сравнению с группой пациентов с СД 2 типа, осложненным ДН и СДС (4-я группа) (p<0,01). Ранее было показано, что у пациентов с СД, осложненным СДС, отмечались изменения таких показателей АОЗ, как СОД, Г-S-Т и КАТ [15].
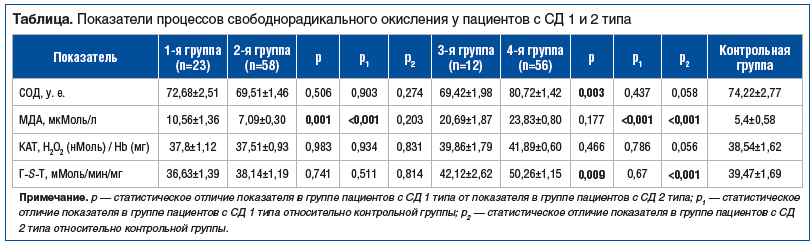
Анализ показателей СОД позволяет сделать вывод о том, что у пациентов с СД 1 типа с ДН и СДС уровень АОЗ ниже по сравнению с пациентами с СД 2 типа, осложненным ДН и СДС. Следовательно, у пациентов с СД 1 типа, осложненным ДН и СДС, выше окислительный стресс, в большей степени выражены ПОЛ, адгезия липидных клеток в эндотелии и другие нарушения липидного обмена.
На фоне снижения активности СОД у больных СД 1 типа с ДН и СДС показатели Г-S-Т оказались статистически значимо ниже по сравнению со значениями в группе больных СД 2 типа с ДН и СДС (p<0,01). Эти изменения могут привести к менее эффективному обезвреживанию продуктов свободнорадикального окисления.
Среди пациентов с СД 2 типа, осложненным ДН и СДС, Г-S-Т оказался статистически значимо выше (на 27%), чем в контрольной группе (p<0,001). Анализ активности Г-S-Т позволяет сделать вывод о том, что у пациентов с СД 1 типа, осложненным ДН и СДС, напряжение в системе АОЗ более выражено по сравнению с больными СД 2 типа, осложненным ДН и СДС. Кроме того, у этих пациентов также нарушена функция системы биотрансформации ксенобиотиков, что может быть причиной более активных дегенеративных процессов. В связи с этим можно предположить снижение эффективности фармакотерапии СД 2 типа, осложненного ДН и СДС, поскольку повышенная активность фермента 2-й фазы биотрансформации ксенобиотиков (в том числе и лекарственных веществ) может индуцировать их более быструю инактивацию и выведение.
Показатели активности фермента второй линии системы АОЗ — КАТ незначительно отличались от показателей в группе контроля. Несущественное, статистически незначимое повышение (на 8,8%) активности фермента отмечено у пациентов с СД 1 типа, осложненным ДН и СДС.
Заключение
Незначительные изменения в функционировании ферментов системы АОЗ на фоне значительной активации процессов ПОЛ могут служить отражением дисбаланса в системе антиоксиданты/прооксиданты и выраженного окислительного стресса у пациентов с СД. Окислительный стресс у больных СД способствует развитию таких осложнений, как ДН и СДС, о чем свидетельствует повышенный уровень продуктов липопероксидации, а именно МДА, у обследованных пациентов, а также снижение показателей АОЗ, таких как СОД. Эти осложнения являются следствием истощения компенсаторных механизмов организма на фоне оксидативного стресса. Вместе с тем повышенный показатель Г-S-Т у пациентов с СД 2 типа, осложненным ДН и СДС, свидетельствует о повышении активности системы АОЗ и изменениях в работе системы биотрансформации ксенобиотиков.
Таким образом, выявленные изменения в системе антиоксиданты/прооксиданты влияют на развитие и течение ДН и СДС у пациентов с СД 1 и 2 типа.
Исследование выполнено за счет средств гранта «Участник молодежного научно-инновационного конкурса» федерального государственного бюджетного учреждения «Фонд содействия развитию малых форм предприятий в научно-технической сфере».












