Введение
Согласно определению Американской ассоциации гастроэнтерологов, пищевод Барретта (ПБ) — это состояние, при котором многослойный плоский неороговевающий эпителий дистального отдела пищевода замещается на специализированный цилиндрический эпителий с бокаловидными клетками [1]. Следовательно, для установления диагноза ПБ требуется проведение комплексного эндоскопического исследования с прицельной биопсией и обязательным гистологическим подтверждением наличия фокусов кишечной метаплазии.
По оценкам экспертов, ПБ выявляется у каждого сотого пациента, предъявляющего жалобы на хроническую изжогу. В связи с отсутствием в широкой клинической практике высокотехнологичных методов эндоскопического исследования и необходимостью гистологического подтверждения с взятием биоптата для установления диагноза истинная распространенность заболевания неизвестна.
Растущее внимание к проблеме ПБ вызвано прежде всего высокой частотой развития на его фоне аденокарциномы пищевода (АКП) [2]. По данным отчета о состоянии онкологической помощи населению за 2012 г., распространенность рака пищевода в России за последние 10 лет резко увеличилась и составила 8,2 на 100 тыс. населения [3]. В среднем АКП развивается у 10–13% больных с ПБ [4, 5], а пятилетняя выживаемость данной категории пациентов не превышает 11–15% [3, 5, 6].
Главной целью терапии больных с ПБ является купирование симптомов и, как следствие, улучшение качества жизни пациентов, но что еще важнее — снижение повреждающего действия гастроэзофагеального и/или дуоденогастроэзофагеального рефлюктата на метаплазированный эпителий слизистой оболочки пищевода и предотвращение прогрессирования этих изменений вплоть до развития дисплазии и АКП [7].
Антисекреторная терапия
При анализе клинических проявлений выявлено, что основными жалобами пациентов с ПБ являются изжога и/или отрыжка кислым, при этом частота и выраженность указанных симптомов намного выше, чем у больных с эрозивным эзофагитом или пептической стриктурой пищевода [8–10]. Поэтому в качестве терапии первой линии при ПБ рассматривается длительное назначение антисекреторных препаратов из группы ингибиторов протонной помпы (ИПП) [11–15]. Установлено, что многолетний прием ИПП приводит к возникновению участков реэпителизации многослойным плоским неороговевающим эпителием в пределах очагов метаплазии, а также к снижению риска развития и прогрессирования дисплазии [16]. Согласно данным С.С. Кардашевой и соавт. (2008), терапия ИПП сопровождается повышением индекса апоптоза при одновременном снижении индекса пролиферации в участках кишечной метаплазии эпителия пищевода, что свидетельствует о положительном влиянии препаратов этой группы на предотвращение дальнейшего прогрессирования патологического процесса [17]. Важно отметить, что подобные изменения характерны только при приеме антисекреторных лекарственных средств из группы ИПП, тогда как Н2-гистаминоблокаторы, напротив, приводят к увеличению клеточной пролиферации метаплазированного эпителия, поэтому не должны применяться у больных с ПБ [18, 19].
Имеются также рекомендации об увеличении кратности приема препарата до 2 р./сут в тех случаях, когда при однократном приеме ИПП в стандартной дозе не происходит купирования симптомов и стабилизации морфологической картины пищевода [20]. Более эффективным считается разделение дозы препарата на 2 приема (перед завтраком и перед ужином), нежели прием полной суточной дозы однократно утром [21].
Несмотря на все вышесказанное, в ряде клинических исследований было показано, что нормализация внутрипищеводного рН не может быть достигнута у некоторого числа пациентов с ПБ даже при приеме высоких доз ИПП [12–15, 22–25]. Сравнительный анализ клинических исследований по применению высоких доз ИПП у пациентов с ПБ представлен в таблице 1.
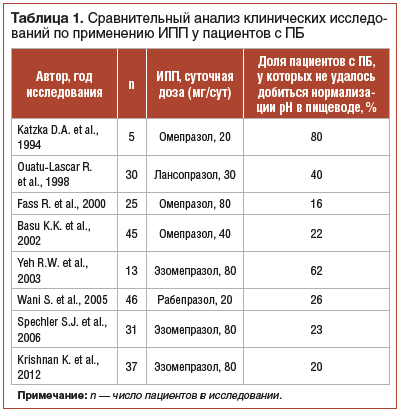
Причиной неэффективности ингибиторов секреции соляной кислоты может быть преобладание в рефлюктате дуоденального содержимого с преимущественно щелочной средой, когда изжога и другие симптомы гастроэзофагеальной рефлюксной болезни (ГЭРБ) возникают в результате действия на слизистую оболочку пищевода компонентов желчи (желчных кислот, лизолецитина) и панкреатических ферментов [26]. Установлено, что только у 50% пациентов с ГЭРБ рефлюктат имеет кислотный характер, у 10% — желчный, тогда как в 39,7% случаев имеет место смешанный состав рефлюктата, который является ключевым фактором риска развития ПБ [27]. В случае наличия у пациента с ПБ подтвержденного дуоденогастроэзофагеального рефлюкса к стандартной терапии ИПП следует добавлять антациды, прокинетики, урсодезоксихолевую кислоту [28].
Хирургическое лечение
Широко применявшееся ранее антирефлюксное хирургическое лечение больных с ПБ не подтвердило своих преимуществ перед консервативными. Так, проспективный анализ показал, что после хирургических антирефлюксных операций риск развития АКП составил 3,8 на 1000 пациентов с ПБ в год, а у получавших медикаментозную терапию — 5,3 на 1000 пациентов в год, однако различия оказались статистически незначимыми (р=0,29) [29]. Операция фундопликации не уменьшает протяженность сегмента ПБ и рекомендуется только при доказанной с помощью рентгенологического и манометрического исследования недостаточности функции нижнего пищеводного сфинктера или при наличии грыжи пищеводного отверстия диафрагмы [20].
С учетом того факта, что ни стандартная медикаментозная терапия, ни антирефлюксная хирургия не приводят к регрессии кишечной метаплазии, в настоящее время большее внимание уделяется эндоскопическим методам абляции патологически измененной слизистой пищевода, таким как аргон-плазменная коагуляция, электрокоагуляция, криоабляция, а также фотодинамическая и лазерная терапия [30]. В комбинации с терапией ИПП эти методики обеспечивают реэпителизацию пищевода нормальным многослойным плоским эпителием, тем не менее остается до конца нерешенным вопрос о полноте такой реверсии и возможности рецидива кишечной метаплазии [20].
Важной задачей выполнения эндоскопического лечения больных с ПБ, помимо элиминации самого метаплазированного эпителия пищевода, является разрушающее воздействие на стволовые клетки-предшественники, уже приобретшие черты кишечной дифференцировки [20]. Данные клетки расположены на базальной мембране, и их удаление возможно только при адекватной глубине абляции [4, 26].
Фотодинамическая терапия
В 1990–2000 гг. наиболее часто используемым методом абляции для лечения ПБ была фотодинамическая терапия (ФТД) [31–33]. Суть метода заключается в том, что после накопления препарата (фотосенсибилизатора) в ткани-мишени она подвергается лазерному излучению, под действием которого образуются свободные радикалы кислорода, запускающие апоптоз клеток через 12–24 ч после процедуры [31]. В качестве фотосенсибилизаторов для ФТД в США используется порфимер натрия, в Европе — 5-аминолевулиновая кислота (5-АЛК) [32]. Регрессия метаплазии эпителия пищевода после ФТД наблюдается примерно в 50% случаев, однако частота рецидива в последующие 2 года составляет от 10 до 75% [33, 34]. При этом факторами риска рецидива являются пожилой возраст и курение. Ограничением к широкому применению ФТД являются ее осложнения, возникающие, как правило, в течение первых 2 нед. после процедуры [35]:
фоточувствительность кожи (в основном при использовании порфимера натрия), что требует ограничения пребывания на солнце в последующем;
боль за грудиной и дисфагия;
стеноз пищевода (примерно у одной трети пациентов, получавших порфимер натрия, реже — 5-АЛК).
Недавно опубликованное исследование, где сравнивали применение 5-АЛК и порфимера натрия, подтвердило относительно низкую скорость достижения полной ремиссии дисплазии эпителия высокой степени при их использовании, а также лучший профиль безопасности для 5-AЛК [36]. Таким образом, в настоящее время ФТД рекомендуется только как метод локального лечения больных с дисплазией высокой степени и рака in situ при ПБ, а также у пациентов с достаточно протяженным сегментом ПБ (более 3–4 см) и проводится только в специализированных онкологических стационарах [37].
Аргон-плазменная коагуляция
Наиболее эффективным методом лечения ПБ без очагов тяжелой дисплазии считается аргон-плазменная коагуляция (АПК) [38]. Устройство для проведения данного вида абляции состоит из источника газа аргона, источника высокочастотного электрического тока и специального катетера, который подводит газ и ток непосредственно к патологически измененной ткани [30]. Принцип основан на том, что при выходе из катетера газ ионизируется электродом и обеспечивает подачу тока высокой частоты к метаплазированному эпителию пищевода [30, 38]. Глубина коагуляции, как правило, составляет 1–3 мм, однако глубина повреждения зависит от мощности генератора (30–90 Вт), скорости потока газа аргона (1–2 л/мин), расстояния от катетера до ткани (2–5 мм) и времени воздействия на саму ткань [39]. Благодаря возможности регулировки формы, размера и энергии плазменной дуги АПК обеспечивает абляцию даже небольших участков метаплазированного эпителия в пищеводе без значительного повреждающего действия на окружающие ткани [26]. Последовательную АПК с перекрывающими полями возможно применять и при достаточно протяженных сегментах метаплазии [38, 39]. В работе С.С. Пирогова показано, что при ПБ с длиной сегмента 3–4 см АПК оказывается эффективной у 80–90% больных [39]. Осложнения (одинофагия, стеноз, перфорация) после АПК возникают статистически значимо реже, чем при ФДТ [40, 41]. Результаты длительных проспективных наблюдений за пациентами, которым была проведена АПК, показали, что эффективность данного метода оказывается выше при применении электрического тока более высокого напряжения или при комбинации АПК с приемом ИПП в больших дозах [38–41]. Сравнительный анализ проспективных клинических исследований по наблюдению за пациентами с ПБ без очагов дисплазии, у которых применялась АПК, представлен в таблице 2.

Поиск новых методов лечения ПБ
В настоящее время исследуются возможности применения гибридной АПК для лечения больных с неосложненным ПБ с предварительным введением физиологического раствора в подслизистый слой стенки пищевода. По мнению ряда авторов, данный метод не лишен такого недостатка, как уменьшение глубины абляции [26, 36]. Это может привести к тому, что после вмешательства в глубоких отделах слизистой оболочки могут остаться так называемые «скрытые» железы, выстланные метаплазированным эпителием [41].
Недавно появились сведения о возможности применения еще одного метода лечения ПБ, основанного на использовании жидкого азота в качестве криогенного вещества (при температуре -196 °C), под воздействием которого происходит разрушение метаплазированного эпителия [42, 43]. Пока в литературе имеются лишь единичные исследования, касающиеся данного метода эндоскопической абляции, тем не менее первые полученные результаты позволяют надеяться на возможный успех в лечении ПБ, поскольку было продемонстрировано устранение дисплазии эпителия более чем в 95% случаев, кишечной метаплазии — в 57% и 84% в течение относительно короткого периода наблюдения (10 и 24 мес. соответственно) [44]. Эффективность криотерапии при ПБ активно изучается в настоящее время.
Необходимо отметить, что, несмотря на значительные успехи, достигнутые при применении эндоскопических методов абляции ПБ, на сегодняшний день не представляется возможным отменить поддерживающую терапию ИПП данной категории пациентов после проведенного вмешательства.
Длительное время при развитии дисплазии высокой степени при ПБ или ранней аденокарциномы (рака in situ) предпочтение отдавалось радикальной эзофагэктомии с пластикой желудочным стеблем и регионарной лимфодиссекцией [37]. Однако с учетом развития большого количества осложнений и высокой летальности в послеоперационном периоде применение традиционных хирургических вмешательств стало весьма ограниченным, и в настоящее время на первый план вышел органосохраняющий метод внутрипросветного эндоскопического лечения — резекция слизистой оболочки пищевода, в т. ч. с диссекцией в подслизистом слое [20, 37].
Заключение
Таким образом, всем больным с ПБ показана пожизненная терапия ИПП в поддерживающих дозировках, при необходимости — в комбинации с симптоматическими лекарственными препаратами (антациды, прокинетики). Антирефлюксные хирургические вмешательства не обеспечивают статистически значимого снижения риска развития аденокарциномы пищевода. В настоящее время «золотым стандартом» терапии ПБ считается комбинирование эндоскопических методов абляции с назначением ИПП, только в этом случае возможно приостановить прогрессирование метапластических изменений эпителия пищевода. Среди эндоскопических методов лечения ПБ наиболее эффективным признана аргон-плазменная коагуляция. При выявлении дисплазии эпителия умеренной или высокой степени на фоне ПБ пациенту назначаются ИПП в двойной дозе, он в срочном порядке направляется в специализированное онкологическое учреждение для решения вопроса о возможности проведения эндоскопического или хирургического лечения с целью предупреждения развития АКП.












