

8‒10 ноября 2017 г. в Москве прошел XVII конгресс Российского общества урологов с международным участием. Мероприятие было посвящено заболеваниям мочеполовой системы, новым направлениям в их терапии и профилактике. В рамках мероприятия выступил с докладом профессор Грегори Роберт ‒ уролог отделения урологии и трансплантации почек Университетской больницы г. Бордо, Франция.
Доброкачественная гиперплазия предстательной железы (ДГПЖ) ‒ наиболее распространенное урологическое заболевание, предикторами которого являются возраст, уровень простатического специфического антигена (ПСА), максимальная скорость потока мочи (Qmax), объем простаты. Однако данных показателей недостаточно для точного прогнозирования риска развития заболевания.
Патогенез ДГПЖ включает несколько механизмов: андроген/эстрогенный сигнальный путь, гипоксию, стромально-эпителиальные взаимодействия, хроническое воспаление. При хроническом воспалении создается порочный круг (рис. 1): воспалительные клетки стимулируют рост собственных клеток простаты посредством секреции цитокинов; простатические клетки также секретируют цитокины, а значит, и рост простатических клеток, что приводит в конечном итоге к увеличению объема органа.

Влиянию воспалительного процесса на развитие ДГПЖ посвящен ряд современных исследований. Приведем результаты наиболее интересных из них.
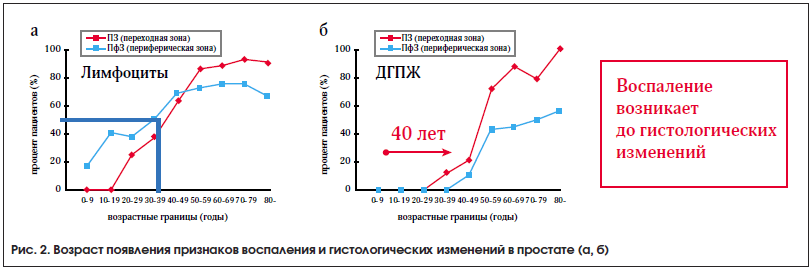
Fujikawa et al. (2005) [1] провели исследование 962 кадаверных простат. Было выявлено, что лимфоциты впервые появляются в структуре предстательной железы уже
в раннем возрасте (в 10 лет). А к 40 годам формируются гистологические изменения, характерные для ДГПЖ (рис. 2).
Zlotta et al. (2014) [2] изучали распространенность воспалительных и гиперпластических изменений в простатах европеоидов и монголоидов в возрасте 22‒98 лет, полученных при аутопсии в России (n=220, европеоиды) и Японии (n=100, монголоиды). Размеры предстательной железы составляли от 10 до 150 см3. Была выявлена положительная корреляционная связь между наличием и степенью выраженности острого или хронического воспаления и формированием ДГПЖ. Так, хроническое воспаление было выявлено более чем у 70% мужчин обеих групп (p>0,05), 40% мужчин имели высокую степень выраженности воспаления, что было ассоциировано с более частым развитием ДГПЖ (p<0,001).
Di Silverio et al. (2003) [3] было проведено ретроспективное исследование, в которое было включено 3942 пациента, прооперированных по поводу синдрома нижних мочевыводящих путей (СНМП)/ДГПЖ за 20-летний период. Отмечена связь между наличием хронического воспаления в предстательной железе и ее объемом (рис. 3). Причем признаки хронического воспаления были выявлены у 43% мужчин данной выборки.
![Рис. 3. Связь между наличием хронического воспаления в предстательной железе и ее объемом [3] Рис. 3. Связь между наличием хронического воспаления в предстательной железе и ее объемом [3]](/upload/medialibrary/1c6/2003-4.png)
Интерес представляют результаты биопсии предстательной железы, взятой у пациентов, принимавших антиандрогенные препараты. Так, в исследовании Reduce биопсия простаты была выполнена 8224 мужчинам с СНМП, найденные гистологические изменения классифицировали в зависимости от типа воспаления и степени его выраженности на 4 вида (рис. 4) [4]. Результаты показали, что хроническое воспаление простаты встречалось в 77,6% случаев, причем отмечена слабая, но статистически значимая связь между интенсивностью воспаления и тяжестью по Международной шкале оценки простатических симптомов (IPSS).
![Рис. 4. Оценка воспаления по данным гистологии [4] Рис. 4. Оценка воспаления по данным гистологии [4]](/upload/medialibrary/1b4/2003-5.png)
Исследование MTOPS [5], основанное на биопсийном материале 1197 пациентов, показало наличие хронического воспаления в 45% случаев, которое было ассоциировано с увеличением объема простаты (41 против 36 см3), более высоким значением ПСА (3,3 против 2,5 нг/мл), прогрессированием клинической симптоматики (21 против 13%; p=0,083), риском острой задержки мочи (5,6 против 0%; p=0,003) и хирургическим вмешательством (7,3 против 3,9%; p=ns).
Материалы биопсии 273 пациентов (Robert et al., 2009) [6] оценивались гистологически с помощью методов окраски гематоксилин-эозином и иммуногистохимии (с применением CD3, CD4, CD8, CD20 и CD163-антител). Значительное воспаление предстательной железы отмечено в 73% случаев у пациентов, прооперированных по поводу ДГПЖ, и в 20% случаев ‒ в контрольной группе. В результате исследования отмечена взаимосвязь между высокой степенью воспаления и объемом простаты (104 против 90 г; p=0,01) и высокими показателями по шкале IPSS (21,2 против 12,8; p=0,016).
Медикаментозное лечение ДГПЖ
Основой лечения ДГПЖ должен быть индивидуальный подход к каждому пациенту. Задачей врача является не только выяснение подробного анамнеза и назначение терапии, но и разъяснение пациенту важных аспектов его заболевания, возможных последствий невыполнения рекомендаций. На основании анамнеза и данных обследования формируется индивидуальная схема лечения (моно- или комбинированная). Целью медикаментозной терапии является улучшение качества жизни пациентов, которого можно достичь, остановив прогрессирование заболевания, воздействуя на хронический воспалительный процесс в простате. В арсенале врача имеются различные группы лекарственных средств (альфа-1-адреноблокаторы, ингибиторы 5-альфа-редуктазы и пр.), которые по-разному влияют на СНМП. Учитывая большой вклад воспаления в развитие ДГПЖ, рассмотрим, какие же из существующих препаратов воздействуют на данный процесс.Особой группой препаратов, воздействующих на воспаление, являются ингибиторы циклооксигеназы 2 (ЦОГ-2). Исследование Di Silverio et al. (2005) [7] включало 46 пациентов, которые были рандомизированы на две группы. Первая группа получала финастерид, вторая – финастерид+ингибиторы ЦОГ-2. Через 12 нед. была выявлена статистически значимая разница между группами по степени улучшения СМНП и Qmax, однако через 24 нед. терапии различие перестало быть статистически значимым.
Falaharkar et al. (2008) [8] провели исследование
по оценке влияния целекоксиба (100 мг) на никтурию
в сравнении с плацебо, в результате отмечена статистически значимая разница между группами на фоне 1-го месяца терапии.
В метаанализе [9], включившем данные трех рандомизированных контролируемых исследований (23‒40 пациентов в каждой группе), сравнивалось действие ингибиторов ЦОГ-2 (целекоксиб, рофекоксиб) и других НПВС (теноксикам). Терапия противовоспалительными препаратами показала хорошие результаты по шкале IPSS и по Qmax, однако при длительном применении с высокой частотой развивались неблагоприятные явления со стороны желудочно-кишечного тракта (желудочное кровотечение), что не позволяет назначать данные препараты для длительного лечения ДГПЖ.
Альтернативой являются лекарственные средства, получаемые из растительного сырья. Один из представителей этой группы ‒ препарат Пермиксон («Пьер Фабр Медикамент Продакшн», Франция), содержащий гексановый экстракт Serenoa repens.
Пермиксон обладает комплексным действием, оказывая антиандрогенный, противовоспалительный, противоотечный и антипролиферативный эффекты, избирательно проявляющиеся на уровне предстательной железы. При этом препарат не оказывает влияния на уровень половых гормонов и ПСА в крови, не вызывает ухудшения половых функций, либидо, потенции в отличие от других групп препаратов, после применения которых высок риск возникновения ретроградной эякуляции и расстройства половой функции. Местное противовоспалительное действие обусловлено влиянием липидостеролового экстракта Serenoa repens на основные медиаторы воспаления – он подавляет активность фосфолипазы А2, ЦОГ и липооксигеназы.
Противовоспалительный эффект Пермиксона изучается долгое время. Friedlander (2015) и Vela Navarrete (2003) показали, что при применении Пермиксона снижается число воспалительных клеток (макрофагов, Т- и В-лимфоцитов) в простате [10]. Рандомизированные исследования: Ragab (1987) и Pauber-Braquet (1997) выявили, что применение препарата снижает продукцию медиаторов воспаления, в частности продуктов каскада реакций арахидоновой кислоты, а также цитокинов (Sirab (2011); Latil (2009, 2010); Latil (2012); Bernichtein (2015)), привлекающих воспалительные клетки и вызывающих мультипликацию клеток простаты [11‒12].
Было проведено международное рандомизированное двойное слепое контролируемое исследование PERMIN [13] в параллельных группах c участием 4-х стран (Франция, Италия, Испания, Португалия) и 42 клинических центров. 206 мужчин с СНМП, связанными с ДГПЖ, ежедневно получали Пермиксон 320 мг перорально или тамсулозин 0,4 мг в течение 3-х месяцев. В данном исследовании проводилось количественное определение мРНК для 29 наиболее значимых маркеров воспаления при ДГПЖ и измерение содержания белка в моче. мРНК выделялась из эпителиальных клеток предстательной железы, десквамированных в просвет желез и в семенную жидкость после пальцевого ректального исследования, в первой порции мочи в день 1-й и день 90-й .
На 90-й день было отмечено снижение средней экспрессии генов для 65,4% маркеров воспаления в группе Пермиксона по сравнению с 46,2% в группе тамсулозина. Для 15 наиболее часто экспрессируемых генов эта разница была больше (80 против 33% соответственно).
В целом благоприятный эффект при лечении Пермиксоном выявлен в отношении 73% генов против 27% в группе тамсулозина (рис. 5). По шкале IPSS статистически значимой разницы между группами не отмечено. Эти результаты впервые показали противовоспалительные свойства Пермиксона в клинической практике у пациентов
с ДГПЖ и СНМП.

Важно отметить, что за 30 лет применения препарата Пермиксон во Франции не было зарегистрировано серьезных побочных эффектов, требующих отмены препарата. Препарат хорошо переносится пациентами.
Таким образом, хроническое воспаление предстательной железы является ключевым компонентом патогенеза, симптомов и прогрессирования ДГПЖ. Стратегия лечения должна основываться на индивидуальном подходе. Для пациентов с наличием или риском развития воспаления необходим подбор безопасных противовоспалительных препаратов. Пермиксон – единственный препарат для СНМП/ДГПЖ, который показал значительную противовоспалительную активность (in vitro, in vivo и в клинических исследованиях) и может назначаться в качестве первой линии терапии данной нозологии.












